Allgemeine Informationen
Definition
- Die multiple Sklerose, auch Encephalomyelitis disseminata, ist eine chronische, entzündliche, demyelinisierende und neurodegenerative Erkrankung des ZNS.
- Klinisch ist die Erkrankung durch Episoden mit entzündlicher Aktivität (Schübe) im Bereich des N. opticus, im Rückenmark und Gehirn sowie anschließende symptomarme Phasen (schubförmig remittierende MS) gekennzeichnet.
- Diagnostische Kriterien
- Dank standardisierter diagnostischer Kriterien (siehe Abschnitt Diagnostik) kann die Erkrankung frühzeitig erkannt und behandelt werden.
- Der Schwerpunkt liegt auf dem objektiven Nachweis von Läsionen, die sowohl zeitlich als auch im Hinblick auf ihre Lokalisation im ZNS (ZNS) disseminiert sind.
Klassifikation
- Die diagnostischen Kriterien ermöglichen es, in den meisten Fällen eindeutig zu entscheiden, ob eine MS vorliegt oder nicht.
- Unter die Kategorie der möglichen multiplen Sklerose fallen:
- Patient*innen, deren klinisches Bild für die Erkrankung spricht, bei denen die Diagnostik jedoch noch nicht abgeschlossen ist.
- Patient*innen, die einige, aber nicht alle diagnostischen Kriterien erfüllen.
- Verlaufsformen1
- klinisch isoliertes Syndrom (KIS)
- schubförmig remittierende MS (RRMS)
- sekundär progrediente MS (SPMS)
- mit aufgesetzten Schüben
- ohne aufgesetzte Schübe
- primär progrediente MS (PPMS)
Häufigkeit
- Prävalenz
- Die Prävalenz variiert mit geografischer Herkunft und ethnischer Abstammung. Am höchsten ist sie bei Personen europäischer Abstammung in Regionen mit gemäßigtem Klima.2-3
- In Deutschland liegt die Prävalenz bei 175–289/100.000.4-5
- In bestimmten ethnischen Gruppen, etwa den skandinavischen Samen und den nordamerikanischen Ureinwohner*innen, ist die Prävalenz besonders gering.
- Inzidenz
- Die jährliche Inzidenz der multiplen Sklerose beträgt in Deutschland 8/100.000 Einw.5
- Alter
- Meist setzen die ersten Symptome im Alter zwischen 20 und 45 Jahren ein (in etwa 70 % der Fälle).6
- Geschlecht
- Frauen sind etwa doppelt so häufig betroffen wie Männer.
Ätiologie und Pathogenese
- Die Ursachen der Erkrankung sind nicht bekannt.
- Die meisten Forscher*innen vertreten die Auffassung, dass die multiple Sklerose auf dem Zusammenspiel von genetischer Prädisposition und Umweltfaktoren beruht.7 Möglicherweise spielt dabei die Interaktion des Immunsystems mit Infektionserregern eine Schlüsselrolle.8 Es kommt dabei zu einem entzündlichen Prozess, der zur Zerstörung von Myelinscheiden und im weiteren Verlauf auch von Axonen führt.
- Als die konsistentesten Risikofaktoren in Bezug auf die Entwicklung von MS haben sich eine durchgemachte Infektion mit dem Epstein-Barr-Virus, dem Erreger der Mononukleose (Pfeiffer-Drüsenfieber), und das Rauchen erwiesen.3,9-10
- Erbliche Faktoren
- Etwa 15 % der Patient*innen haben Verwandte mit MS.
- Veränderungen des Chromosoms 6 sind mit einem erhöhten Risiko assoziiert: Der Haplotyp DRB1*1501 führt zu einem um das Dreifache erhöhten MS-Risiko.11
- Ein Teil der Genloki, die bei MS-Patient*innen gehäuft Auffälligkeiten zeigten, sind maßgeblich an immunologischen Funktionen beteiligt, etwa an der Differenzierung von T-Helferzellen.12
- Es gibt Hinweise darauf, dass Sonnenlicht und Vitamin D das MS-Risiko senken können, möglicherweise vermittelt über Effekte auf die Expression immunologisch relevanter Gene.
- In einem großen europäischen Genscreening wurden mehrere MS-relevante Gene identifiziert, u. a. zwei Gene (CYP27B1, CYP24A1), die am Vitamin-D-Stoffwechsel beteiligt sind.12
- Die Erkrankung hat eine immunologische Grundlage, ein Autoantigen konnte jedoch nicht identifiziert werden.
- Virusinfektion
- Virusinfektionen werden als möglicher ätiologischer Faktor diskutiert, entsprechende Nachweise wurden jedoch nie erbracht.
- Es scheint ein Zusammenhang zwischen dem Epstein-Barr-Virus (Mononukleose) und der MS zu bestehen.9,13
- Vitamin D
- In einer australischen Untersuchung wurde eine inverse Assoziation zwischen dem Grad der mütterlichen Sonnenexposition im 1. Trimenon der Schwangerschaft und dem Risiko der Entwicklung von MS beim Kind festgestellt.14
- Daten einer randomisierten klinischen Studie deuten auf eine Assoziation zwischen einem hohen Vitamin-D-Spiegel (> 50 nmol/l) und einer verringerten MS-Aktivität und einer langsameren Progression der Erkrankung bei Patient*innen mit neu diagnostizierter MS hin.15
- Die Ergebnisse einer finnischen Kohortenstudie zeigen, dass ein Zusammenhang zwischen niedrigen Vitamin-D-Spiegeln und einem erhöhten Risiko für MS besteht.16
- Die Autor*innen einer Metaanalyse kommen jedoch zu dem Schluss, dass eine Assoziation zwischen MS und Vitamin D nicht ausreichend belegt ist.9
- Untergruppen
- Stress und Exazerbation
- Exazerbationen der MS treten nach belastenden Lebensereignissen gehäuft auf.18
Entstehung von Plaques19
- Die Demyelinisierungsherde bei der MS fallen histologisch durch eine Sklerosierung auf. Ihr disseminiertes Auftreten führte zur Namensgebung: multiple Sklerose. Man bezeichnet diese Herde als Plaques.
- Diese Läsionen entstehen typischerweise in der weißen Substanz, wo sie primär die Myelinscheide und die myelinisierende Zelle, den Oligodendrozyten, angreifen. Sie können aber auch in der grauen Substanz auftreten.20-21
- Eine gestörte Blut-Hirn-Schranke scheint bei Personen mit genetischer Prädisposition für MS zur Plaques-Entstehung beizutragen.
- Eine Hypothese besagt, dass eine systemische Infektion zu einer verstärkten Expression von Adhäsionsmolekülen auf dem Endothel von hirn- oder rückenmarkversorgenden Gefäßen führt, wodurch Leukozyten – über die gestörte Blut-Hirnschranke – in das ZNS eindringen können.
- Lymphozyten, die in der Lage sind, Myelinantigene zu erkennen, können eine Immunantwort anstoßen, die zur Bildung einer akuten, entzündlichen, demyelinisierenden Läsion führt.
- Einer anderen Hypothese zufolge ist das Absterben des Oligodendrozyten der primäre Auslöser der Plaquesentstehung. Molekulare Veränderungen der Myelinscheide induzieren immunologisch-entzündliche Prozesse wie die Aktivierung von Makrophagen.
- Dass man im Gehirn von MS-Patient*innen Plaques in unterschiedlichen Entwicklungsstadien und wechselnden Lokalisationen findet, scheint die große Variabilität der Erkrankung und der davon betroffenen Nervenbahnen zu erklären.22
Prädisponierende Faktoren
- Genetische Faktoren
- Genetische Faktoren spielen eine Rolle, auch wenn familiäre Häufungen relativ selten sind.
- Die Assoziation zwischen der MS und der HLA-Region des Genoms wurde bereits im Jahr 1972 erkannt.23 In einer großen genetischen Studie wurden auch andere relevante Allele nachgewiesen; deren Bedeutung für ein erhöhtes MS-Risiko ist jedoch deutlich geringer als die des HLA-Systems.
- Klima
-
- Es besteht eine Assoziation zwischen dem Geburtsmonat und dem MS-Risiko, was die Vermutung stützt, dass klimatische Einflüsse in der Schwangerschaft oder unmittelbar nach der Geburt eine Rolle spielen könnten.24
- Infektionen
- Trauma
- Stress
- Geburt
- Nach einer Entbindung besteht bei der Mutter ein erhöhtes Risiko für Exazerbationen.25
ICPC-2
- N86 Multiple Sklerose (MS)
ICD-10
Nach ICD-10-GM Version 2021:26
- G35.- Multiple Sklerose [Encephalomyelitis disseminata]
- G35.0 Erstmanifestation einer multiplen Sklerose
- G35.1- Multiple Sklerose mit vorherrschend schubförmigem Verlauf
- G35.2- Multiple Sklerose mit primär-chronischem Verlauf
- G35.3- Multiple Sklerose mit sekundär-chronischem Verlauf
- G35.9 Multiple Sklerose, nicht näher bezeichnet
- Die folgenden fünften Stellen sind bei den Subkategorien G35.1-G35.3 zu benutzen:
- 0 ohne Angabe einer akuten Exazerbation oder Progression
- 1 mit Angabe einer akuten Exazerbation oder Progression
Diagnostik
Diagnostische Kriterien
McDonald-Kriterien 201727
- Siehe Tabelle Diagnostische Kriterien bei multipler Sklerose (McDonald-Kriterien 2017)
- Die Diagnose kann auf Grundlage der Anamnese und der Befunde der klinisch-neurologischen Untersuchung gestellt werden, sofern andere Ursachen der Symptome ausgeschlossen werden können. Voraussetzung für die Diagnose MS sind:
- neurologische Ausfälle in mindestens 2 zeitlich getrennten Phasen sowie klinische Befunde aus mindestens 2 räumlich getrennten Läsionen im ZNS
- evtl. eine progrediente Entwicklung, ausgehend von unterschiedlichen Teilen des ZNS über einen Zeitraum von mindestens 1 Jahr.
- In den meisten Fällen stützt sich die Diagnose auf eine Zusammenschau von klinischem Befund, Bildgebung (MRT) und Liquordiagnostik. Die Diagnose kann heute auch bei Erkrankten gestellt werden, bei denen lediglich ein klinischer Schub aufgetreten ist, sofern Hinweise auf mehrere Läsionen vorliegen und diese entweder nicht gleichzeitig aufgetreten sind, oder ein pathologischer Liquorbefund (oligoklonale Banden) vorliegt.
- Weitere Laboruntersuchungen zur differenzialdiagnostischen Abgrenzung sind nur bei konkretem klinischen Verdacht erfoderlich.28
Differenzialdiagnosen
- Stoffwechselerkrankungen
- funnikuläre Myelose (Subacute Combined Degeneration of the Spinal Cord, SACD), durch Vitamin-B12-Mangel verursacht
- Autoimmunerkrankungen
- Sjögren-Syndrom
- systemischer Lupus erythematodes
- Morbus Behçet
- Sarkoidose
- chronisch inflammatorische demyelinisierende Polyradikuloneuropathie mit zentralnervöser Demyelinisierung
- Antiphospholipid-Syndrom
- akute disseminierte Enzephalomyelitis (ADEM)
- Polyarteriitis nodosa
- Infektionskrankheiten
- HIV-assoziierte Myelopathie
- HTLV-I-assoziierte Myelopathie (humanes T-lymphotropes Virus 1)
- Lyme-Borreliose
- meningovaskuläre Syphilis
- progressive multifokale Leukenzephalopathie (PML), JC-Virus-assoziiert
- Zoster (HZV)
- Hepatitis C (HCV)
- Vaskuläre Erkrankungen
- zentralnervöse Vaskulitis
- retino-cochleo-zerebrale Vaskulitis
- familiäre kavernöse Hämangiome
- spinale durale arteriovenöse Fisteln
- Morbus Eales (Periphlebitis retinae mit Glaskörperblutungen und zentralnervösen Manifestationen)
- isolierte Angiitis des ZNS (IACNS)
- zerebrale autosomal-dominante Arteriopathie mit subkortikalen Infarkten und Leukenzephalopathie (CADASIL)
- Genetische Syndrome
- hereditäre Ataxien
- hereditäre Paraplegien
- Leber-Optikusatrophie
- andere mitochondriale Zytopathien
- lysosomale Krankheiten
- Leukodystrophien
- Erkrankungen der hinteren Schädelgrube und des Rückenmarks (insbesondere für die Differenzialdiagnostik bei progredienter Myelopathie und primär progredienter multipler Sklerose von Bedeutung)
- Arnold-Chiari-Syndrom
- nichthereditäre Ataxien
- zervikale Spondylose
- andere Myelopathien
- Psychische Erkrankungen
- Neoplastische Erkrankungen
- primäre Hirntumoren
- spinale Tumoren
- Lymphome des ZNS
- paraneoplastische Erkrankungen
- multiple Metastasen im ZNS
- Klinisch isolierte Syndrome
- Optikusneuritis anderer Ursache
- isolierte Hirnstammsyndrome
- Querschnittsmyelitis (viele dieser Patient*innen entwickeln eine klinisch sichere MS oder einen Verlauf, der sich nur schwer davon unterscheiden lässt)
Anamnese
- Beginn
- Die Symptome können sich innerhalb von Minuten, Stunden oder Tagen, aber auch innerhalb von Wochen oder Monaten entwickeln.
- Eine subakute Symptomentwicklung innerhalb einer knappen Woche ist der häufigste Fall.
- In seltenen Fällen kann die Erkrankung auch in Form akuter neurologischer Ausfälle einsetzen und mitunter einem Schlaganfall ähneln (apoplektischer Beginn).
- Frühsymptome
- Je nachdem, welche Bereiche des ZNS betroffen sind, können die Symptome sehr unterschiedlich sein.
- Häufige initiale Symptome sind Doppelbilder, Sehstörungen auf einem Auge, Parese der Extremitäten, Störungen der Bewegungskoordination, Sensibilitätsstörungen und imperativer Harndrang.
- Häufig treten als Frühsymptom nur leichte zentrale Paresen auf, die sich eher in einer Minderung der Geschwindigkeit als der Kraft äußern und evtl. mit einer eingeschränkten Ausdauer einhergehen.
- Die ersten Symptome können leicht sein und schnell wieder verschwinden. Symptome, die weniger als 24 Stunden andauern, stehen jedoch in der Regel nicht mit MS in Zusammenhang.
- In der sorgfältigen Anamnese findet man rückblickend häufig Hinweise darauf, dass sich die MS bereits zu einem früheren Zeitpunkt durch Frühsymptome angekündigt hat.
- Fatigue ist das häufigste, wenn auch unspezifische Symptom in frühen MS-Stadien.28
- Bei ausgebildeter Krankheit
- zentrale Paresen mit schmerzhaften Spasmen
- Sensibilitätsstörungen der Extremitäten
- Sehstörungen
- Ataxie mit Unsicherheit beim Gehen oder dem Greifen von Gegenständen
- Dysarthrie
- Blasen- und Mastdarmfunktionsstörungen
- psychische Symptome wie Angststörungen und Depression
- seltener: neuropathische Schmerzsyndrome wie die Trigeminusneuralgie
- Fatigue
Klinische Untersuchung
- Es sollte eine systematische neurologische Untersuchung durchgeführt werden. Dabei können folgende Krankheitszeichen auffallen:
- zentrale Paresen mit Kraftminderung, erhöhtem Muskeltonus und verlangsamten Bewegungen
- Koordinationsstörungen der Arme und Beine
- Sensibilitätsstörungen in umschriebenen Nervenversorgungsgebieten
- gesteigerte Muskeleigenreflexe, z. B. Patellarsehnen- und Achillessehnenreflex
- abgeschwächte oder fehlende Fremdreflexe, z. B. Bauchhaut- oder Analsphinkterreflex
- Augenhintergrund
- nach Optikusneuritis: Blässe der Papille im temporalen Bereich
- bei Papillitis: Schwellung der Papille (Stauungspapille)
- Positives Lhermitte-Zeichen: Die passive Flexion des Nackens ruft ein oft als elektrisierend beschriebenes Gefühl entlang der Wirbelsäule und in den Extremitäten hervor.
- Bei Läsionen im Hirnstamm und Kleinhirn
- Nystagmus
- Dysarthrie
- Ataxie
- Gleichgewichtsstörungen
Ergänzende Untersuchungen in der Hausarztpraxis
- Es gibt keine ergänzenden Untersuchungen, die in der Hausarztpraxis einen spezifischen diagnostischen Nutzen hätten.
- Es sollte ein Screening im Hinblick auf etwaige systemische Erkrankungen erfolgen.
- CRP, Hb, Schilddrüsenwerte (TSH), Glukose und antinukleäre Antikörper
- Vgl. relevante Differenzialdiagnosen.
Diagnostik bei Spezialist*innen
- Die Diagnostik bei multipler Sklerose stützt sich primär auf die Anamnese und die Befunde der klinisch-neurologischen Untersuchung.
- Eine MRT, eine Liquordiagnostik und visuell evozierte Potenziale können wertvolle Informationen liefern und von großer Bedeutung sein, wenn das klinische Bild allein keine sichere Grundlage für die Diagnosestellung ist. Zudem helfen sie beim Ausschluss relevanter Differenzialdiagnosen.
Magnetresonanztomografie
- Befunde
- In der MRT-Untersuchung des Gehirns und des Rückenmarks sind in typischen Fällen mehrere hyperintense Areale in der weißen Substanz zu beobachten.
- Nutzen
- wertvolle Zusatzinformationen für die MS-Erkennung
- Hinweise auf Alter, Lokalisation und Streuung der Erkrankungsherde
- Präzision
- Die MRT ist in der MS-Diagnostik die sensitivste bildgebende Methode, auch wenn sie keine optimale Sensitivität und Spezifität bietet, sodass ein gewisses Risiko falsch positiver und falsch negativer Ergebnisse besteht.29
- In Ausnahmefällen kann die MRT auch bei klinisch diagnostizierter multipler Sklerose negativ ausfallen.
- Die in der MRT erkennbaren Veränderungen und das Ausmaß der neurologischen Ausfälle stehen nicht immer miteinander im Einklang.
MRT-Kriterien bei schubförmiger MS27
- Räumliche Dissemination (Dissemination in Space, DIS)
- je mindestens eine hyperintensive Läsion in der T2-gewichteten MRT-Untersuchung in mindestens 2 der folgenden 4 Bereiche des ZNS:
- periventrikulär
- kortikal oder juxtakortikal (im Marklager ohne Kontakt zum Kortex)
- infratentoriell
- spinal.
- je mindestens eine hyperintensive Läsion in der T2-gewichteten MRT-Untersuchung in mindestens 2 der folgenden 4 Bereiche des ZNS:
- Zeitliche Dissemination (Dissemination in Time, DIT)
- 1 der folgenden Kriterien:
- gleichzeitiger Nachweis von mindestens einer Kontrastmittel(KM)-aufnehmenden und einer nicht KM-aufnehmenden Läsion
- neue T2-hyperintense Läsion in einer Folge-MRT-Untersuchung.
- 1 der folgenden Kriterien:
Liquordiagnostik28
- In der Liquoruntersuchung kann der immunologische und inflammatorische Charakter der MS abgebildet werden. Sie stützt die Diagnose, wenn die MRT-Kriterien keine ausreichende Spezifität haben oder wenn das klinische Bild atypisch ist.
- Als pathologische Veränderungen des Liquors, die für eine multiple Sklerose sprechen können, gelten das Vorliegen von oligoklonalen IgG-Banden, die sich eindeutig von den entsprechenden Banden im Serum unterscheiden, oder ein erhöhter IgG-Index.
- Zur Analyse wird die Methode der isoelektrischen Fokussierung empfohlen.
- Die lymphozytäre Pleozytose im Liquor übersteigt 50 Zellen/mm3 in der Regel nicht, und der Gesamtproteinspiegel liegt meist unter 1 g/l.
Visuell evozierte Potenziale
- Visuell evozierte Potenziale können in bestimmten Situationen, in denen in der MRT nur wenige oder wenig spezifische Läsionen nachweisbar sind, zusätzliche Informationen liefern.
- Die gewonnenen Informationen können auch ergänzend zur klinischen Untersuchung genutzt werden, um objektive Hinweise auf eine zweite Läsion zu erhalten, sofern die erste klinisch aktive Läsion nicht die Sehbahnen befallen hat.
- Typisch für eine durchgemachte Optikusneuritis ist eine erhöhte Latenzzeit nach visueller Stimulation, aber eine normale Wellenform.
Spezielle Labordiagnostik28
- Anamnese, klinische Untersuchung, MRT und Liquordiagnostik reichen aus, um die Diagnose einer MS zu stellen. Weitere Laboruntersuchungen sind nur bei konkretem Verdacht auf eine andere Erkrankung erforderlich.
- Ggf. infrage kommen dabei:
- CRP
- großes Blutbild
- Serumchemie (z. B. Nieren-, Leberwerte, Elektrolyte: Harnstoff, Kreatinin, GGT, AP, GOT, GPT, K, Na, Ca)
- Blutzucker
- Vitamin B12
- Rheumafaktor
- ANA
- Anti-Phospholipid-Antikörper
- Anti-ds-DNS-Antikörper
- Lupus-Antikoagulans
- ACE
- Borrelien-Serologie
- Urinstatus.
- Weitere spezielle Untersuchungen:
- c-ANCA/p-ANCA
- ENA-Profil
- Autoantikörper gegen Aquaporin-4 (ggf. zur Abgrenzung Neuromyelitis optica)
- HIV-Serologie
- HTLV-1-Serologie
- TPHA
- langkettige Fettsäuren
- Mykoplasmen-Serologie
- Methylmalonyl-Ausscheidung im Urin.
Weitere Diagnostik
- Schädel-CT
- Die Schädel-CT ist in der Regel ohne Befund, große Läsionen können jedoch als leicht hypointense Areale erkennbar sein. Sie kann in der Differenzialdiagnostik zum Ausschluss raumfordernder intrakranieller Prozesse eine wichtige Rolle spielen.
- Harnwege
- Liegen Harnwegssymptome vor, können auch eine urodynamische Untersuchung, eine Zystoskopie und eine Sonografie der Nieren und der Harnblase angezeigt sein.
- Zudem können Miktionsprotokolle hilfreich sein, um die Flüssigkeitsaufnahme und -ausscheidung zu beurteilen.
Indikationen zur Überweisung
- Neurologie
- bei klinischem Verdacht auf die Erkrankung
- zur Verlaufskontrolle, in der Regel vierteljährlich
- Zur kontinuierlichen Versorgung von MS-Betroffenen und zur Durchführung der Therapie an der Schnittstelle Allgemeinmedizin/Neurologie gibt es bislang keine dezidierten Empfehlungen, etwa aus einer interdiziplinären Leitlinie.
- Die Anordnung und Durchführung der DMT- und Schubtherapie sollte durch Behandelnde erfolgen, die in der MS-Therapie erfahren sind.
- Das kann z. B. eine neurologische MS-Schwerpunktpraxis sein oder ein medizinisches Versorgungszentrum an einer neurologischen Klinik.
- Die Deutsche Multiple Sklerose Gesellschaft verleiht nach leitlinienorientierten Qualitätskriterien die Zertifikate „MS-Schwerpunktzentrum“, „MS-Zentrum“ und „MS-Rehabilitationszentrum“ und bildet MS-spezialisierte Pflegekräfte aus, sog. MS-Nurses.30
- Urologie
- Therapie neurogener Blasenfunktionsstörungen in enger Absprache mit den neurologisch Behandelnden
- Urologie/Andrologie/Gynäkologie
- Nephrologie
- Bei Proteinurie oder Hämaturie unter der Therapie, etwa mit Alemtuzumab (siehe dort)
Checkliste zur Überweisung
Multiple Sklerose
- Zweck der Überweisung
- Bestätigende Diagnostik? Therapie? Sonstiges?
- Anamnese
- Wann wurde die Diagnose gestellt? Entwicklung und Verlauf: rasche Progression? Komplikationen?
- Symptome: Paresen, Sehstörungen, Sonstiges? Bei fortgeschrittener Erkrankung: Spasmen, Ataxie, Dysarthrie, Schmerzen?
- Sonstige relevante Krankheiten? Regelmäßig eingenommene Arzneimittel?
- Probetherapie: womit und welche Wirkung?
- Folgen: Funktionsverlust? Arbeitsunfähigkeit? Aktivitätsniveau?
- Klinische Untersuchung
- Allgemeinzustand? Neurologischer Status? Psychosozialer Status?
- Ergänzende Untersuchungen
- Weitere Diagnostik
- Etwaiges Ergebnis neuerer Untersuchungen wie MRT, CT, Sonstiges?
Therapie
Therapieziele
- Die Lebensqualität verbessern oder erhalten.
- Die Dauer und Häufigkeit von Krankheitsschüben verringern und damit potenziell eine progrediente Funktionseinschränkung verhindern.
Allgemeines zur Therapie
- Es gibt keine kausale Therapie.
- Dank neuer Kriterien kann die Diagnose heute frühzeitiger gestellt werden. Es gibt viele Hinweise auf den Nutzen einer frühzeitigen therapeutischen Intervention. Dafür steht mittlerweile eine ganze Reihe entzündungshemmender und immunmodulierender krankheitsmodifizierender Therapien (DMT) zur Verfügung.
- Therapieprinzipien
- Die Therapie ist auf die Bekämpfung der akuten Schübe, die Verhinderung von Rezidiven und der Progression, die Linderung der Symptome und die Rehabilitation ausgerichtet.
- Eine begleitende symptomatische Therapie von Schwindel, Blasenfunktionsstörungen, Obstipation, neurogenen Schmerzen und Spastizität ist häufig notwendig.
- Die Erkrankung bringt häufig schwere psychosoziale Probleme mit sich und führt bei vielen Patient*innen zu einer Depression.
Orientierung an der Krankheitsaktivität
Schubtherapie28
- Methylprednisolon-Puls, bevorzugt i. v. , evtl. auch oral
Verlaufsmodifizierende Therapie (DMT)1,28
Leitlinie: Immuntherapeutika nach Wirksamkeitskategorien28
- Nach den Effekten auf die Reduktion der Schubrate sollen die Immuntherapeutika in 3 Kategorien eingeteilt werden:
- Wirksamkeitskategorie I (relative Reduktion der Schubrate im Vergleich zu Placebo von 30–50 %)
- Beta-Interferone einschließlich Peg-Interferon
- Dimethylfumarat
- Glatirameroide
- Teriflunomid (teratogenes Potenzial beachten – nicht bei Frauen im reproduktionsfähigen Alter!)
- Azathioprin nur in Ausnahmefällen
- Zugelassen, wenn Interferon-beta nicht möglich ist oder unter Azathioprin-Therapie ein stabiler Verlauf erreicht wird.
- geringe Wirksamkeit, schlechte Datenlage
- nur in Ausnahmefällen, z. B. bei Zweiterkrankung wie M. Crohn oder Myasthenia gravis, die mit Azathioprin gut behandelbar sind.
- Wirksamkeitskategorie II (relative Reduktion der Schubrate im Vergleich zu Placebo von 50–60 %)
- Cladribin
- Fingolimod
- Ozanimod
- Wirksamkeitskategorie III (Reduktion der Schubrate um > 60 % im Vergleich zu Placebo oder > 40 % im Vergleich zu Substanzen der Kategorie 1)
- Alemtuzumab
- CD20-Antikörper:
- Ocrelizumab
- Rituximab (off label)
- Natalizumab
- Je nach Verlaufsform kommen unterschiedliche Medikamente zum Einsatz. Falls nicht ausdrücklich anders bezeichnet, ist die vorgenommene Reihenfolge alphabetisch und sagt nichts über eine mögliche Priorisierung einzelner Substanzen aus.
- KIS
- Wirksamkeitskategorie I
-
- Wirksamkeitskategorie II–III
- RRMS, milder bis moderater Verlauf
- Wirksamkeitskategorie I
- Immunglobuline nur postpartal im Einzelfall
- SPMS, aktiv
- Ggf. in Erwägung ziehen:
- Siponimod
- Interferon-beta-1a
- Interferon-beta-1b
- Cladribin
- CD20-Antikörper: Ocrelizumab oder Rituximab (off label).
- Ggf. in Erwägung ziehen:
- PPMS
- CD20-Antikörper
- Ocrelizumab
- Rituximab (off label)
- CD20-Antikörper
Empfehlungen für Patient*innen
- Bei leichten bis mittelgradigen funktionellen Beeinträchtigungen kann körperliche Aktivität zu einer Verbesserung der Kondition, der Beweglichkeit und der Lebensqualität beitragen. Durch Training können bei MS-Patient*innen die Gehdistanz, die Geschwindigkeit und die Ausdauer verbessert werden.31
- Eines der häufigsten Symptome der MS ist die Fatigue, eine ausgeprägte Erschöpfung. Die Patient*innen ermüden dann schnell, was berufliche Leistungsfähigkeit und private Aktivitäten stark einschränken kann. Entscheidend sind dann eine sorgfältige Planung und eine Anpassung des persönlichen Aktivitätsniveaus.
- Bei vielen Patient*innen verstärken sich die Beschwerden bei Hitze, weshalb sie z. B. Aufenthalte in der Sauna oder Sonnenbäder meiden sollten.
- Eine gesunde und vielseitige Ernährung gilt als wichtig: Der Verzehr von Vollkornprodukten, von Fisch 2- bis 3-mal pro Woche sowie von weißem Fleisch wird empfohlen. Gesättigte tierische Fette wie in fettreichen Milch- oder Fleischprodukten und insbesondere rotes Fleisch sollten nur in Maßen verzehrt werden. Es sollte viel Obst und Gemüse gegessen werden (5 Einheiten pro Tag).
Immunmodulierende Therapie
Interferon-beta-1a und -1b1,28
- Durch eine Interferontherapie kann die Krankheitsprogression bei ausgewählten Erkrankten verlangsamt werden.
- Durch eine frühzeitige Behandlung mit Interferon-beta nach dem ersten Schub (klinisch isolierte Syndrome) scheinen die Häufigkeit der Entwicklung einer klinisch gesicherten MS reduziert und der zunehmende Verlust von Hirngewebe bei Patient*innen mit klinisch isolierten Syndromen verringert werden zu können.
- Infrage kommen:
- Betroffene mit klinischem isoliertem Syndrom (KIS)
- Betroffene mit aktiver schubförmig verlaufender MS mit mindestens 2 Schüben innerhalb der vergangenen 2–3 Jahre und erhaltener Gehfähigkeit.
- Wirksamkeit
- Die Häufigkeit der Schübe wird um etwa 30 % gesenkt.
- Der Schweregrad der Symptome im Rahmen der Schübe wird reduziert.
- In der MRT sind weniger neue und aktive Läsionen nachweisbar.
- Nicht alle sprechen auf die Therapie an, und bei einigen nimmt die initiale Wirkung nach und nach ab.
- Die Bildung neutralisierender Antikörper (NAk) gegen Beta-Interferon scheint die Wirkung des Medikaments einzuschränken. Bei entsprechendem Verdacht kann die Bestimmung neutralisierender Antikörper gegen Beta-Interferon (IFNb-NAk) sinnvoll sein.
- Diagnostische und therapeutische Voraussetzungen
- Die Krankheit ist aktiv und führt zu klinischen Schüben (s. o.).
- Die Diagnose ist durch eine MRT-Untersuchung (neue, wachsende oder Kontrastmittel aufnehmende Läsionen) und eine Liquordiagnostik (intrathekale IgG-Synthese) gesichert.
- Die Therapie wird durch Fachärzt*innen für Neurologie eingeleitet.
- Es ist nicht geklärt, wann die Therapie idealerweise begonnen werden sollte, wie lange sie dauern sollte, wie bei Therapieversagen vorzugehen ist, wie ggf. das Absetzen erfolgen sollte und welche langfristige Wirkung die Therapie hat.
- Einer umfassenden Aufklärung der Patient*innen und einer sorgfältigen Planung von Kontrolluntersuchungen kommen große Bedeutung zu.
- Diagnostik bei Therapiebeginn
- klinisch-neurologische Untersuchung mit Beurteilung der funktionellen Defizite anhand der EDSS-Skala (Expanded Disability Status Scale) und Blutbild
- Differenzialblutbild der Leukozyten, GOT, GPT, AP, Gamma-GT, Bilirubin, T4 und TSH, Elektrolyte und Kreatinin
- klinisch-neurologische Untersuchung mit Beurteilung der funktionellen Defizite anhand der EDSS-Skala (Expanded Disability Status Scale) und Blutbild
- Applikationsform
- Die verschiedenen Präparate werden entweder subkutan oder intramuskulär verabreicht.
- Kontraindikationen
- Schwangerschaft, Anwendung einer sicheren Methode der Empfängnisverhütung erforderlich
- Stillzeit
- unbehandelte schwere Depression
- unbehandelte oder schwer kontrollierbare Epilepsie
- Sekundär progrediente multiple Sklerose
- Die Therapieergebnisse sind nicht konsistent. Überzeugende Belege für die Wirksamkeit der Therapie liegen nicht vor.
- Interferon-beta-1b wurde von der Europäischen Arzneimittel-Agentur EMA für die Indikation der sekundär progredienten MS zugelassen. Bei Patient*innen mit schubförmiger, aktiver Krankheit scheint die Therapie die beste Wirksamkeit zu zeigen.
- Primär progrediente multiple Sklerose
- Es gibt keine Präparate, die für die Therapie der primär progredienten MS zugelassen sind.
Glatirameracetat1,28
- Indikation
- Durchführung
- 1 x tgl. 20 mg subkutan
- Einleitung und Durchführung der Therapie durch Neurolog*in
- Wirksamkeit
- Die Wirksamkeit ist mit der von Interferon-beta-1a und -1b vergleichbar.
- Die vorliegenden Wirksamkeitsnachweise zu Interferon-beta-1a und -1b und Glatirameracetat beziehen sich nur auf Patient*innen in der Altersgruppe zwischen 18 und 45 Jahren mit einem EDSS-Grad bis 5,0.
- Eine Studie deutet darauf hin, dass durch eine frühzeitige Therapie die Zeit vom Auftreten des ersten Symptoms bis zur klinisch gesicherten Erkrankung verlängert werden kann. Die Zeit, innerhalb der 1 von 4 Patient*innen eine gesicherte MS entwickelt hatte, wurde um 115 % von 336 Tagen auf 722 Tage verlängert.32
Teriflunomid1,28,33
- Das Medikament ist zur Behandlung der schubförmig remittierenden MS zugelassen.
- Wirkmechanismus
- Teriflunomid ist der aktive Metabolit von Leflunomid, einem Isoxazol-Derivat, das als Basistherapeutikum bei rheumatischen Erkrankungen eingesetzt wird.
- Teriflunomid hemmt die Dihydroorotat-Dehydrogenase (DHODH), die den 4. Schritt der De-novo-Pyrimidinsynthese in den Mitochondrien katalysiert. Dies hemmt die Proliferation aktivierter Lymphozyten, nicht jedoch andere Lymphozyten, die pyrimidinunabhängig von der DHODH rezirkulieren können. Dadurch hat Teriflunomid eine zytostatische Wirkung auf Lymphozyten und eine immunmodulierende Wirkung bei MS.
- Wirksamkeit
- In Registerstudien mit Teriflunomid (14 mg) wurde verglichen mit Placebo eine Verringerung der Schubhäufigkeit bei schubförmig verlaufender MS (RRMS) um 31–36 % und eine Verringerung der Krankheitsprogression um 26–29 % festgestellt.
- Teriflunomid (14 mg) reduzierte verglichen mit Placebo die Anzahl der Gadolinium aufnehmenden T1-Läsionen in der MRT pro Untersuchung um 80 % und führte zu einer relativen Verringerung der Zunahme des T2-Läsionsvolumens um 77 %.
- In einer randomisierten Studie mit verblindeter Auswertung wurde zudem festgestellt, dass Teriflunomid (14 mg) eine mit Interferon-beta-1a vergleichbare Wirksamkeit hinsichtlich der jährlichen Schubhäufigkeit hat.
- Teriflunomid (14 mg) führte bei Patient*innen mit klinisch isoliertem Schub (KIS) zu einer signifikanten Verringerung des Anteils derer, bei denen ein erneuter klinischer Schub auftrat oder bei denen in der MRT eine erneute Krankheitsaktivität nachgewiesen wurde.
- Die Wirksamkeit ist mit der von hochdosiertem Interferon vergleichbar.
- Indikationen
- schubförmige MS (RRMS) mit mildem bis moderatem Verlauf
- Kontraindikationen
- Teriflunomid darf nicht bei Patient*innen mit stark eingeschränkter Leber- oder Nierenfunktion, schweren Immundefekten, schweren chronischen aktiven Infektionen oder schwerer Myelosuppression angewendet werden.
- Teratogenes Risiko!
- Nicht während der Schwangerschaft und Stillzeit anwenden.
- Bei Patientinnen im reproduktionsfähigen Alter sind die ebenso wirksamen und weniger risikobehafteten Alternativen der Wirksamkeitskategorie I zu bevorzugen.
- Dosierung
- Teriflunomid wird 1 x tgl. in Form von Tabletten (14 mg) verabreicht.
- Die Therapie sollte von Neurolog*innen eingeleitet und überwacht werden, die Erfahrung bei der Diagnostik und Therapie von MS haben. Die behandelnden Ärzt*innen benötigen spezifische Kenntnisse, um angemessen über das Arzneimittel informieren zu können. Sie sollten mit den geltenden Leitlinien zur Behandlung von MS-Patient*innen vertraut sein.28
- Vor Therapiebeginn
- sorgfältige Beurteilung der Indikation
- Umfassende mündliche und schriftliche Aufklärung der Patient*innen über die zu erwartende Wirksamkeit und mögliche Nebenwirkungen sowie darüber, dass die Therapie eine engmaschige Verlaufskontrolle mit Blutuntersuchungen erfordert.
- Beurteilung der Schubhäufigkeit (vergangenes Jahr) und der Veränderung der funktionellen Defizite im vergangenen Jahr mittels EDSS-Skala (Expanded Disability Status Scale), evtl. auch Symbol Digit Modalities Test (SDMT) und/oder Multiple Sclerosis Functional Composite (MSFC)
- Berücksichtigung früherer medikamentöser Therapien und Einschätzung, ob eine Auswaschphase nötig ist.
- MRT-Untersuchung vor/bei Therapiebeginn
- Blutuntersuchungen mit hämatologischem Status, einschl. Differenzialblutbild, CRP, Kreatinin und Leberwerte (GPT)
- Blutdruckmessung
- Tuberkulose-Screening bei Risikopatient*innen
- Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung bei Frauen
- Während der Therapie
- nach 1 Monat: Kontrolle im Hinblick auf etwaige Nebenwirkungen
- nach 3 und 6 Monaten, danach halbjährlich: klinische Kontrolle durch Neurolog*in
- nach 3 und 6 Monaten, danach halbjährlich: Blutuntersuchungen mit hämatologischem Status, Differenzialblutbild und CRP
- in den ersten 6 Monaten alle 2 Wochen, danach alle 2 Monate: Blutproben für die GPT-Analyse
- nach 1, 3 und 6 Monaten, danach etwa halbjährlich: Blutdruckmessung
- halbjährlich: Beurteilung der Krankheitsaktivität (Schubhäufigkeit und Funktionsbeurteilung mithilfe der EDSS-Skala (Expanded Disability Status Scale) sowie evtl. SDMT und MSFC
- 1 x jährlich MRT-Untersuchung
- bei Absetzen der Therapie evtl. beschleunigte Elimination mit Colestyramin (3 x 8 g über 11 Tage) oder Aktivkohle (2 x 50 g über 11 Tage); bei Übergang zu einer anderen Therapie Auswaschphase empfohlen
- Wechselwirkungen
- Bei der Anwendung von Teriflunomid kann es zu Wechselwirkungen mit Induktoren von P450 (CYP) und Arzneistoff-Transportern sowie HMG-CoA-Reduktasehemmern (Statine) kommen.
- Mit Colestyramin oder Aktivkohle kann eine schnelle und signifikante Verringerung der Teriflunomidkonzentration im Plasma erreicht werden.
- Nebenwirkungen
- Teriflunomid unterliegt der besonderen Überwachung. Damit auf neue sicherheitsrelevante Informationen so schnell wie möglich reagiert werden kann, ist jeder Verdacht auf Nebenwirkungen unter Teriflunomid im Rahmen des nationalen Meldesystems unverzüglich an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Abteilung Pharmakovigilanz, zu melden.
- Die Teriflunomid-Therapie wird in der Regel gut vertragen und geht meist nur mit relativ leichten, vorübergehenden Nebenwirkungen einher.34 Registerstudien zufolge sind die häufigsten Nebenwirkungen Infektionen der oberen Atemwege, Harnwegsinfektionen, Parästhesien, Diarrhö, Übelkeit, erhöhte GPT-Werte und Haarausfall.
Dimethylfumarat1,28,35-36
- Wirkmechanismus
- Dimethylfumarat ist ein peroral verabreichtes Medikament mit immunmodulierender Wirkung.
- Das Medikament wirkt entzündungshemmend, indem es die Konzentrationen proinflammatorischer Zytokine senkt und die antiinflammatorischer Zytokine erhöht.
- Zudem wirkt es über den Transkriptionsfaktor Nrf2 (Nuclear Factor [Erythroid-Derived 2]-Related Factor 2) auf endogene zelluläre antioxidative Systeme. In-vitro-Studien deuten darauf hin, dass Dimethylfumarat neben seinen antiinflammatorischen Eigenschaften auch Gliazellen vor oxidativem Stress schützt.
- Gemeinsam scheinen diese Wirkungen zu einer Verringerung der Krankheitsaktivität bei MS beizutragen.
- Wirksamkeit
- Es gibt Belege mäßiger Qualität dafür, dass das Medikament die Rezidivhäufigkeit senkt.36 Auch die Wirksamkeit des Medikaments auf das Fortschreiten von Behinderungen und auf die mittels MRT darstellbaren Läsionen kann auf Basis der bisherigen Studien nicht abschließend beurteilt werden.
- Indikation
- schubförmig remittierende MS
- Kontraindikationen
- Dimethylfumarat darf nicht bei Patient*innen mit schweren Immundefekten, schweren chronischen aktiven Infektionen oder schwerer Myelosuppression angewendet werden.
- Dimethylfumarat ist laut eines Rote-Hand-Briefs von 2020 bei vermuteter oder bestätigter progressiver multifokaler Leukenzephalopathie (PML) kontraindiziert und darf auch bei schwerer Lymphopenie
(Lymphozytenwerte < 0,5 × 109 /l) nicht eingeleitet werden.
- Dosierung
- in der 1. Woche 2 x tgl. 120 mg; danach 2 x tgl. 240 mg
- Vor Therapiebeginn
- Die Therapie sollte von Neurolog*innen eingeleitet und überwacht werden, die Erfahrung mit der Diagnostik und Therapie von MS haben. Die behandelnden Ärzt*innen benötigen spezifische Kenntnisse, um angemessen über das Arzneimittel informieren zu können. Sie sollten mit den geltenden Leitlinien zur Behandlung von MS-Patient*innen vertraut sein.28
- sorgfältige Beurteilung der Indikationsstellung
- umfassende Aufklärung der Betroffenen über die zu erwartende Wirkung, mögliche Nebenwirkungen und die im Rahmen der Therapie erforderliche Verlaufskontrolle
- Beurteilung von Schubhäufigkeit und funktionellen Defiziten im vergangenen Jahr mittels der EDSS-Skala (Expanded Disability Status Scale) sowie evtl. SDMT und MSFC
- Berücksichtigung früherer medikamentöser Therapien und Einschätzung, ob eine Auswaschphase nötig ist.
- MRT-Untersuchung vor/bei Therapiebeginn
- Blutuntersuchungen mit hämatologischem Status, einschl. Differenzialblutbild, CRP, Kreatinin und Leberwerten (GPT)
- bei Frauen im gebärfähigen Alter: Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung
- Während der Therapie: Beurteilung und Vorgehen
- nach 1 Monat: Kontrolle im Hinblick auf etwaige Nebenwirkungen
- nach 3 und 6 Monaten, danach halbjährlich: klinische Kontrolle durch Neurolog*in
- nach 3 und 6 Monaten, danach halbjährlich: Blutuntersuchungen mit hämatologischem Status, einschl. Differenzialblutbild, CRP, Kreatinin und GPT
- halbjährlich: Beurteilung der Krankheitsaktivität (Schubhäufigkeit und Funktionsbeurteilung mithilfe der EDSS-Skala [Expanded Disability Status Scale] sowie evtl. SDMT und MSFC)
- 1 x jährlich MRT-Untersuchung
- Wechselwirkungen
- keine bekannt
- Nebenwirkungen
- Die Dimethylfumarat-Therapie wird in der Regel gut vertragen.
- Registerstudien zufolge sind die häufigsten Nebenwirkungen starke Rötungen (Flush; etwa 35 %) und gastrointestinale Symptome wie Übelkeit, Schmerzen und Diarrhö (etwa 25 %). Diese Nebenwirkungen verschwanden in der Regel innerhalb eines Monats wieder.
- Die Therapie führt meist zu einer leichten Erniedrigung der Leukozyten- und Lymphozytenwerte, diese fallen jedoch nur selten unter den unteren Referenzwert.
- Dimethylfumarat kann – meist innerhalb der ersten 6 Monate – zu einer Erhöhung der Leberenzyme (GPT und GOT) führen.
- Die AKdÄ informiert über Fälle einer progressiven multifokalen Leukenzephalopathie (PML) im Zusammenhang mit der Anwendung von Dimethylfumarat auch bei leichter Lymphopenie (bisher galt nur eine mäßige bis schwere Lymphopenie als Kontraindikation). Falls die Lymphozytenzahl unterhalb der Norm liegt, sollte vor Einleitung einer Therapie mit Dimethylfumarat eine umfassende Abklärung möglicher Ursachen durchgeführt werden. Dimethylfumarat sollte bei Patient*innen, bei denen eine schwere Lymphopenie (Lymphozytenwerte < 0,5 x 109 /l) auftritt, die mehr als 6 Monate andauert, abgesetzt werden. Der Hersteller informierte im November 2020 in einem Rote-Hand-Brief über die erforderlichen Maßnahmen zur Senkung des Risikos einer PML.37
Natalizumab1,28
- Indikationen
- Monotherapie bei schubförmig verlaufender MS, die trotz einer Therapie mit Erstlinienpräparaten (Beta-Interferon und Glatirameracetat) hochaktiv ist.
- Patient*innen mit schnell progredienter, schwerer schubförmiger MS
- Natalizumab ist ein rekombinanter, monoklonaler Antikörper gegen Alpha4-Integrine, der die Adhäsion aktivierter Immunzellen und deren Migration über die Blut-Hirn-Schranke hemmt (Alpha4-Integrin-Antagonist).
- Wirksamkeit
- Natalizumab verringert das jährliche Rezidivrisiko um rund 70 % und die Zahl neuer oder vergrößerter Hirnläsionen in der MRT um über 80 %.
- Zudem kann die Therapie zu einer Remission des klinischen Krankheitsbilds und der radiologischen Krankheitsaktivität führen.
- Es wird im Abstand von 4 Wochen in Form intravenöser Infusionen (300 mg) verabreicht.
- Insgesamt wurde unter 99.571 MS-Patienten, die mit Natalizumab behandelt wurden, von 212 Fällen der progressiven multifokalen Leukenzephalopathie (PML) berichtet.38
- Daraus ergibt sich eine Häufigkeit von 2,1 Fällen je 1.000 Patient*innen.
- In etwa 23 % der PML-Fälle verlief diese tödlich.
- Das PML-Risiko steigt mit zunehmender Zahl der verabreichten Dosen, und es ist bei Personen mit einer früheren JC-Virus(humanes Polyomavirus 2)-Infektion und bei Personen, die zuvor mit Immunsuppressiva behandelt wurden, erhöht.
- Bei PML, aktuell oder in der Vorgeschichte, ist Natalizumab kontraindiziert.
- Natalizumab ist seit 2006 als Zweitlinientherapie nach Beta-Interferonen und Glatirameracetat zugelassen.
- Die Behörden kamen zu dem Schluss, dass der Nutzen von Natalizumab die Risiken übersteigt, dass die Patient*innen jedoch umfassend über mögliche Nebenwirkungen aufgeklärt werden müssen.
- Natalizumab erfordert eine engmaschige Kontrolle von Nebenwirkungen und unterliegt der besonderen Überwachung. Damit auf neue sicherheitsrelevante Informationen so schnell wie möglich reagiert werden kann, ist jeder Verdacht auf Nebenwirkungen unter Natalizumab im Rahmen des nationalen Meldesystems unverzüglich an das Bundesamt für Arzneimittel und Medizinprodukte (BfArM), Abteilung Pharmakovigilanz, zu melden.
- Die Therapie ist bei Anzeichen einer PML umgehend abzubrechen.
- Informieren Sie die Patient*innen sowohl mündlich als auch schriftlich über Risiken und mögliche Nebenwirkungen der Behandlung.
- Unter der Behandlung können sich neutralisierende Antikörper gegen Natalizumab bilden. 6 und 12 Monate nach Behandlungsbeginn wird eine Kontrolle im Hinblick auf neutralisierende Antikörper empfohlen.
Sphingosin-1-Phosphat (S1P)-Rezeptor-Modulatoren1,28
Fingolimod
- Indikationen
- Seit 2011 als Zweitlinientherapie zugelassen: Monotherapie bei schubförmig verlaufender MS, die trotz einer Therapie mit Erstlinienpräparaten (Beta-Interferon oder Glatirameracetat) hochaktiv ist.
- Patient*innen der Altergruppe 10–17 mit hoch aktiver RRMS (siehe Abschnitt Im Kindesalter)
- Soll wegen unzureichender Wirksamkeit nicht bei PPMS eingesetzt werden.
- An SPMS Erkrankte sollen nicht auf Fingolimod eingestellt werden.
- Fingolimod (0,5 mg) wird 1 x tgl. peroral verabreicht.
- Fingolimod (Sphingosin-1-phosphat-Rezeptor-Modulator) hält Lymphozyten in den peripheren Lymphknoten zurück, was zu einer Umverteilung autoreaktiver T-Lymphozyten und einer Verringerung der Entzündungsaktivität im ZNS führt.
- Wirksamkeit bei RRMS (Wirksamkeitskategorie 2)
- Fingolimod 0,5 mg führte im Vergleich zu Placebo zu einer relativen Verringerung der Schubhäufigkeit um 55 %.
- Die nach 6 Monaten nachgewiesene Krankheitsprogression war nach 2 Jahren um 34 % reduziert worden.
- MRT-Analysen zeigten, dass die Gesamtzahl neuer oder vergrößerter T2-Läsionen um 75 % und der Anzahl der Gadolinium aufnehmenden T1-Läsionen um 81 % zurückgeht.
- Die Wirksamkeit ist Placebo signifikant überlegen und auch Beta-Interferon signifikant überlegen.
- Nebenwirkungen
- Im Rahmen der Fingolimod-Therapie kam es den Registerstudien zufolge zu 2 Todesfällen (eine Herpes-Enzephalitis und eine Varizella-zoster-Enzephalitis).
- Da zu Therapiebeginn die Gefahr von Herzrhythmusstörungen besteht, ist bei Verabreichung der ersten Dosis eine verstärkte Herz-Kreislauf-Überwachung erforderlich.
- Fingolimod unterliegt der besonderen Überwachung. Damit auf neue sicherheitsrelevante Informationen so schnell wie möglich reagiert werden kann, ist jeder Verdacht auf Nebenwirkungen unter Fingolimod im Rahmen des nationalen Meldesystems unverzüglich an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Abteilung Pharmakovigilanz, zu melden.
- In den USA ist die Therapie bei Herzinfarkten, Schlaganfällen oder TIA innerhalb der vergangenen 6 Monate oder bei Anwendung von Antiarrhythmika der Klasse Ia oder III kontraindiziert.
- Weitere beschriebene Nebenwirkungen sind Hypertonie, Makulaödeme und eine Erhöhung der Transaminasen.
- Insbesondere nach Umstellung von Natalizumab wurde in den ersten Monaten der Fingolimo-Behandlung einzelne Fälle von PML beobachtet (Carry-over-PML).
- Die Behörden kamen zu dem Schluss, dass der Nutzen von Fingolimod die Risiken übersteigt, dass die Patient*innen jedoch umfassend über mögliche Nebenwirkungen aufgeklärt werden müssen.
- Bei gleichzeitigem Vorliegen eines Diabetes mellitus oder bei durchgemachter Uveitis sollten vor Therapiebeginn evtl. Kardiolog*innen konsultiert werden, und die Patient*innen sollen augenärztlich untersucht werden. Die augenärztliche Untersuchung sollte eine optische Kohärenztomografie (OCT) umfassen.
- Bei Patient*innen, die nicht bereits immun sind, ist vor Therapiebeginn eine Impfung gegen Windpocken (Varizella zoster) erforderlich.
- Laut Rote Hand-Brief vom September 2019 ist Fingulimod bei Schwangerschaft und bei Frauen im gebährfähigen Alter, die keine wirksame Verhütungsmethode anwenden, kontraindiziert.
- Laut Rote Hand-Brief vom November 2020 soll bei der Anwendung von Fingulimod die Leberfunktion überwacht werden, alle 3 Monate Leberfunktionstests einschließlich Serum-Bilirubin. Bei Anstieg der Transaminasen um mehr als das Dreifache des oberen Referenzwertes sollte eine häufigere Überwachung erfolgen, bei Anstieg auf mehr als das Fünffache soll die Behandlung unterbrochen werden.
- Die AkdÄ teilte im November 2020 mit, dass unter Fingolimod ein Fall von VZV-Meningoenzephalitis aufgetreten ist. Vor der Behandlung mit Fingolimod sollte daher ein Antikörpertest auf VZV durchgeführt werden. Bei negativem Test sollte vor Therapiebeginn eine Impfung erfolgen. Hochdosierte Kortikoide können den Verlauf verschlimmern. Deshalb sollte bei einer Veschlechterung oder Neuauftreten neurologischer Symptome unter Fingulimod nicht nur ein MS-Schub, sondern auch eine VZV-Enzephalitis in Betracht gezogen werden.
Siponimod
- Indikation
- seit Januar 2020 zugelassen für die Behandlung Erwachsener mit aktiver SPMS
- Wirksamkeitskategorie II
- Nebenwirkungen
- keine wesentlichen Unterschiede zu Fingolimod
- In der Schwangerschaft streng kontraindiziert
- Sollte in der Stillzeit nicht angewendet werden.
Ozanimod
- Seit Mai 2020 zur Behandlung der aktiven RRMS zugelassen
- Wirksamkeitskategorie II
- Verträglichkeits- und Sicherheitsprofil ähnlich wie bei Fingolimod
- Lymphopenien, AV-Blockierungen und pathologische Leberenzyme scheinen aber seltener aufzutreten.
- In der Schwangerschaft streng kontraindiziert
- Sollte in der Stillzeit nicht angewendet werden.
Alemtuzumab1,28
- Das Medikament ist seit 2015 zugelassen.
- Wirkmechanismus39
- Alemtuzumab ist ein humanisierter monoklonaler Antikörper, der an CD52-Moleküle auf der Zelloberfläche von T- und B-Lymphozyten bindet und den antikörper- und komplementvermittelten Zelltod induziert.
- Dies führt zu einer langfristigen Depletion (niedrigen Werten) von B-Zellen (bis zu 6 Monaten) und T-Zellen (mehr als 1 Jahr) und einer anschließenden Repopulation von Lymphozyten mit einer veränderten Untergruppenverteilung. Es ist insbesondere eine Häufung regulatorischer T-Zellen und von T-Gedächtniszellen zu beobachten.
- Es wird angenommen, dass durch die Therapie „ungünstige“ Lymphozyten-Populationen entfernt werden und anschließend eine Repopulation von Lymphozyten mit einem bei MS günstigeren Profil erfolgt. Dies führt zu einer geringeren Krankheitsaktivität; Schubhäufigkeit und Progression permanenter Funktionseinschränkungen gehen zurück.
- Wirksamkeit
- Den Registerstudien zufolge führt Alemtuzumab verglichen mit Interferon-beta-1a zu einer relativen Verringerung der Schubhäufigkeit um 50–54 % und zu einer Verringerung der Krankheitsprogression um 27–35 %.
- Zudem führte Alemtuzumab verglichen mit Interferon-beta-1a bei der Untersuchung nach 2 Jahren zu einer Verringerung der Anzahl der Gadolinium aufnehmenden T1-Läsionen in der MRT um 61–63 %.40
- Indikation bis auf Weiteres eingeschränkt
- Die ursprüngliche Zulassung des Medikaments erstreckte sich auf die Behandlung von Erwachsenen mit hochaktiver (klinisch oder MR-tomografisch belegter), schubförmiger MS (RRMS).
- Im November 2019 hat die europäische Arzneimittelzulassungsbehörde EMA die Indikation wegen Sicherheitsbedenken dahingehend eingeschränkt, dass Alemtuzumab nur noch angewendet werden soll bei Erwachsenen mit hochaktiver RRMS trotz angemessener Behandlung mit mindestens einer anderen krankheitsmodifizierenden Therapie sowie bei Patient*innen mit rasch progredienter schubförmiger MS. Die Behandlung sollte in einem Krankenhaus mit raschem Zugang zu intensivmedizinischer Betreuung und Spezialist*innen im Umgang mit schwerwiegenden Nebenwirkungen erfolgen.41
- Kontraindikationen
- Alemtuzumab darf nicht bei Patient*innen mit HIV-Infektion oder anderen schweren chronischen Infektionen oder bei einer Allergie gegen den Wirkstoff angewendet werden.
- Alemtuzumab darf außerdem nicht während der Schwangerschaft und Stillzeit angewendet werden.
- Alemtuzumab soll nicht mehr angewendet werden bei Personen mit bestimmten Herz-, Kreislauf- und Blutungsstörungen.41
- Dosierung
- Alemtuzumab wird zu Therapiebeginn an 5 aufeinanderfolgenden Tagen als intravenöse Infusion mit einer Dosis von 12 mg und 1 Jahr nach der ersten Verabreichung (Folgetherapie) an 3 aufeinanderfolgenden Tagen mit einer Dosis von 12 mg verabreicht.
- Bei erneuter Krankheitsaktivität kann im Abstand von jeweils 1 Jahr eine Folgetherapie erfolgen.
- An den ersten 3 Tagen vor Alemtuzumab-Gabe sollten jeweils 1.000 mg Methylprednisolon intravenös infundiert werden.
- Eine ergänzende Therapie mit Antihistaminika und/oder Antipyretika vor der Verabreichung von Alemtuzumab ist in Betracht zu ziehen. Zudem sollten die Patient*innen während der Infusionstherapie sowie in den nachfolgenden 4 Wochen peroral 2 x 200 mg Aciclovir einnehmen.
- Vor Therapiebeginn
- Die Therapie sollte von Neurolog*innen eingeleitet und überwacht werden, die Erfahrung mit der Diagnostik und Therapie von MS haben. Die behandelnden Ärzt*innen benötigen spezifische Kenntnisse, um angemessen über das Arzneimittel informieren zu können. Sie sollten mit den geltenden Leitlinien zur Behandlung von MS-Patient*innen vertraut sein.28
- sorgfältige Beurteilung der Indikationsstellung
- Umfassende mündliche und schriftliche Aufklärung der Patient*innen über die zu erwartende Wirksamkeit und mögliche Nebenwirkungen sowie darüber, dass während der Therapie und für mindestens 48 Monate nach der letzten Dosis monatliche Blut- und Urinkontrollen durchgeführt werden müssen.
- Beurteilung der Schubhäufigkeit (vergangenes Jahr) und der Veränderung der funktionellen Defizite im vergangenen Jahr mithilfe der EDSS-Skala (Expanded Disability Status Scale) sowie evtl. SDMT und MSFC
- Berücksichtigung früherer medikamentöser Therapien und Einschätzung, ob eine Auswaschphase nötig ist.
- MRT-Untersuchung vor/bei Therapiebeginn
- Infektionsscreening (Tuberkulose, Hepatitis B und Hepatitis C, evtl. HIV) bei Risikopatient*innen
- Blutuntersuchungen mit hämatologischem Status, einschl. Differenzialblutbild, CRP, Kreatinin und Leberwerten (GPT) sowie Schilddrüsenfunktion (TSH)
- Urinuntersuchungen: Teststreifen beim Screening ausreichend
- ggf. Durchführung etwaiger geplanter Impfungen mindestens 6 Wochen vor Therapiebeginn
- Screening auf das Varizella-zoster-Virus (VZV) und Impfung VZV-negativer Patient*innen vor Therapiebeginn
- evtl. Screening auf das humane Papillomvirus (HPV) bei Frauen
- bei Frauen im gebärfähigen Alter: Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung
- ergänzende Therapie mit Methylprednisolon, Antihistaminika und/oder Antipyretika vor der Infusion sowie mit Aciclovir während/nach der Infusion wie oben unter Dosierung angegeben
- Während der Therapie – Vorgaben zur Überwachung seit April 2019
- Überwachung der Vitalparameter einschließlich Blutdruck vor und während der Infusion
- Bei klinisch relevanten Veränderungen der Vitalfunktionen: Infusion beenden und zusätzliche Überwachung einschließlich EKG in Betracht ziehen.
- Überwachung der Leberfunktionsparameter vor und während der Behandlung
- Bei Symptomen einer Leberschädigung oder anderen schwerwiegenden immunvermittelten Reaktionen soll die Behandlung nur nach sorgfältiger Nutzen-Risiko-Abwägung weitergeführt werden.
- Patient*innen sollten darüber informiert werden, umgehend ärztliche Hilfe in Anspruch zu nehmen, wenn einige Tage nach der Infusion allgemeine Symptome auftreten oder Symptome von Leberschäden.
- Überwachung der Vitalparameter einschließlich Blutdruck vor und während der Infusion
- Weitere Kontrolluntersuchungen während der Therapie
- nach 3 und 6 Monaten, danach halbjährlich: klinische Kontrolle durch Neurolog*in
- während der Therapie und für 48 Monate nach der letzten Dosis Alemtuzumab: monatliche Blutuntersuchungen mit hämatologischem Status, einschl. Differenzialblutbild, CRP sowie ergänzend Kreatinin und TSH (alle 3 Monate)
- Während der Therapie und für 48 Monate nach der letzten Dosis Alemtuzumab: monatliche Urinuntersuchungen mit Teststreifen; bei Nachweis einer Proteinurie und einer Hämaturie oder bei Verdacht auf eine Nierenerkrankung anderer Ursache ist die Überweisung zur Nephrologie erforderlich.
- halbjährlich: Beurteilung der Krankheitsaktivität (Schubhäufigkeit und Funktionsbeurteilung mithilfe der EDSS-Skala (Expanded Disability Status Scale, EDSS) sowie evtl. SDMT und MSFC
- 1 x jährlich: MRT-Untersuchung
- jährlich: Screening auf das humane Papillomvirus (HPV) bei Frauen
- bei Frauen im gebärfähigen Alter: Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung
- Wechselwirkungen
- keine bekannt
- Nebenwirkungen
- Nach dem Auftreten folgender schwerwiegender Nebenwirkungen einschließlich damit assoziierter Todesfälle hat die EMA im April 2019 eine Überprüfung von Alemtuzumab eingeleitet und die Indikation bis auf Weiteres eingeschränkt (s. o.).
- Autoimmunhepatitis und Leberschädigung
- kardiovaskuläre Ereignisse wie Myokardinfarkt, Schlaganfall, Dissektionen hirnzuführender Arterien
- hämophagozytische Lymphohistiozytose (HLH)
- Alemtuzumab unterliegt seit seiner Zulassung der besonderen Überwachung. Damit auf neue sicherheitsrelevante Informationen so schnell wie möglich reagiert werden kann, ist jeder Verdacht auf Nebenwirkungen unter Alemtuzumab im Rahmen des nationalen Meldesystems unverzüglich an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Abteilung Pharmakovigilanz, zu melden.
- Während der Infusion oder innerhalb des darauffolgenden Tages können Reaktionen auf die Infusion auftreten. Dies hängt vermutlich mit der Ausschüttung von Zytokinen während der Infusion zusammen und kann zu Symptomen wie Kopfschmerzen, Hautausschlag (Urtikaria), Juckreiz, Übelkeit, Fieber und Schüttelfrost, Flush, Dyspnoe, Tachykardie, Schwindel und Schmerzen führen. Die Infusion von Methylprednisolon vor der Gabe von Alemtuzumab sowie ergänzende Antihistaminika und Antipyretika scheinen solche unerwünschten Reaktionen zu mildern.
- Zudem kann die Therapie Autoimmunreaktionen wie Thyreoditis (36 %), eine Immunthrombozytopenie (ITP; 1 %) und Nephropathien wie die Anti-GBM-Krankheit (GBM: glomeruläre Basalmembran) (0,3 %) hervorrufen.
- Auch Verdachtsfälle von Autoimmunzytopenien wie Neutropenie, hämolytische Anämie und Panzytopenie sind beschrieben.
- Außerdem besteht bei Patient*innen, die mit Alemtuzumab behandelt wurden, ein erhöhtes Infektionsrisiko (71 % verglichen mit 53 % bei der Beta-Interferon-Therapie). Schwere Infektionen mit dem Varizella-Zoster-Virus (VZV), etwa Varizella-Primärinfektionen und Reaktivierungen des VZV, sind möglich (0,3 % verglichen mit 0 % bei der Beta-Interferon-Therapie).
- Auch von Infektionen des Gebärmutterhalses mit dem humanen Papillomavirus (HPV), u. a. auch von Dysplasien des Gebärmutterhalses, wurde bei mit Alemtuzumab behandelten Patientinnen berichtet (2 %). Bei Frauen wird deshalb ein jährliches HPV-Screening empfohlen.
- Bei bis zu 0,3 % der mit Alemtuzumab behandelten Patient*innen wird von einer Tuberkulose berichtet. Vor Therapiebeginn sollte ein Tuberkulose-Screening in Betracht gezogen werden.
- Patient*innen, die mit Alemtuzumab behandelt wurden, sind häufiger von oberflächlichen Pilzinfektionen von Haut und Schleimhäuten, insbesondere von oraler und vaginaler Kandidose, betroffen (12 % verglichen mit 3 % bei der Beta-Interferon-Therapie).
- Nach dem Auftreten folgender schwerwiegender Nebenwirkungen einschließlich damit assoziierter Todesfälle hat die EMA im April 2019 eine Überprüfung von Alemtuzumab eingeleitet und die Indikation bis auf Weiteres eingeschränkt (s. o.).
- Neutralisierende Antikörper
- Es wurden neutralisierende Antikörper (NAk) nachgewiesen.
- Eine entsprechende Untersuchung und etwaige Maßnahmen scheinen insbesondere dann indiziert zu sein, wenn aufgrund einer anhaltend hohen Krankheitsaktivität ein 3., 4. oder 5. Therapiezyklus notwendig ist.
Cladribin1,28,42
- Zytostatisch und immunsuppressiv wirkendes Purinanalogon, das auch zur Behandlung der Haarzellleukämie eingesetzt wird.
- Zulassungsstatus
- seit 2017 in der EU zur Behandlung hochaktiver schubförmiger MS
- seit März 2019 in den USA zur Behandlung der sekundär progredienten MS
- Indikationen
- Cladribin kann nach Berücksichtigung der vorliegenden Zulassungsstudien bei folgenden Patientengruppen eingesetzt werden:
- Patient*innen, die unter der Therapie mit einem verlaufsmodifizierenden Medikament eine hohe Krankheitsaktivität aufweisen.
- Patient*innen mit 2 oder mehr Schüben im vorausgegangenen Jahr, unabhängig davon, ob sie mit einer DMT behandelt wurden oder nicht.
- Cladribin kann nach Berücksichtigung der vorliegenden Zulassungsstudien bei folgenden Patientengruppen eingesetzt werden:
- Kontraindikationen
- Hypersensitivität gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile des Arzneimittels
- Schwangerschaft und Stillzeit
- Infektionen
- Immundefizienz
- mittelschwere oder schwere Nierenerkrankungen (Kreatinin-Clearance < 60 ml/min)
- mittelschwere oder schwere Lebererkrankungen
- Impfung mit einem Lebendimpfstoff in den vorangegangenen 4–6 Wochen, z. B. gegen Varizella-Zoster-Virus (VZV), Typhus oder Gelbfieber
- aktive maligne Erkrankung
- relative Kontraindikationen
- signifikante Infektionsneigung, z. B. Dekubitus, Aspirationsneigung, rezidivierende Harnwegsinfekte, Atemwegsinfekte
- maligne Vorerkrankungen
- Fruktoseintoleranz (Cladribin-Tabletten sind sorbitolhaltig)
- Kinder und Jugendliche: fehlende Daten zu Sicherheit und Wirksamkeit
- Therapieregime
- orale Applikation von insgesamt 3,5 mg/kg KG in 4 Therapiezyklen
- Ein Therapiezyklus umfasst 1–2 Tabletten pro Tag über 4–5 Tage
- Dosisanpassung nach Gewicht
- Vor Therapiebeginn
- sorgfältige Anamnese und klinische Untersuchung zum Ausschluss von Kontraindikationen (s. o.)
- Bei aktiver Infektion: Behandlungszyklus bis zum vollständigen Abklingen der Infektion verschieben.
- Basislabor
- vor Beginn der Therapie und ggf. vor deren Fortsetzung im 2. Behandlungsjahr
- Bei Vorbehandlung mit einer anderen DMT sind die substanzspezifischen Sicherheitsabstände und Auswaschzeiten zu beachten.
- bei Patientinnen im reproduktionsfähigen Alter: Schwangerschaftstest und Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung
- Weil eine Beeinträchtigung der Wirksamkeit oraler Kontrazeptiva durch Cladribin nicht ausgeschlossen werden kann, ist die zusätzliche Anwendung einer Barrieremethode während der Behandlung und für mindestens 4 Wochen nach der letzten Dosis notwendig.
- ggf. anstehende Auffrischung von Impfungen; Therapiebeginn mit Cladribin frühestens 4–6 Wochen nach Anwendung eines Lebensimpfstoffs
- ggf. Röntgenthorax
- Ausgangs-MRT des Schädels mit KM
- Dokumentierte Aufklärung der betroffenen Person über Therapie und Risiken
- Die Entscheidung für Cladribin ist nach Beginn der Behandlung für mindestens 6 Monate nicht mehr rückgängig zu machen.
- Während der Therapie
- Impfungen mit attenuierten Lebendimpfstoffen möglichst nicht unter der Therapie. Wenn möglich, Normalisierung der Leukozyten (Lymphozyten) im therapiefreien Intervall abwarten.
- vierteljährliche klinisch-neurologische Kontrolluntersuchungen durch MS-erfahrene Behandelnde
- vor jedem Therapiezyklus und danach alle 2–3 Monate
- Anamnese und klinische Untersuchung hinsichtlich möglicher Kontraindikationen (s. o.)
- Basislabor (s. o.)
- ggf. Lymphozytentypisierung (CD4+-T-Zellen, CD8+-T-Zellen, B-Zellen, NK-Zellen)
- zuverlässige Empfängnisverhütung (s. o.) und vor jedem Therapiezyklus Wiederholung des Schwangerschaftstests
- Schädel-MRT einmal jährlich
- reguläre Krebsvorsorgeuntersuchungen
- Nach Therapieende
- Regelmäßige Blutbildkontrollen über mindestens 5 Jahre fortführen.
- reguläre Krebsvorsorgeuntersuchungen
- Wechselwirkungen
- Das Präparat enthält Hydroxypropylbetadex, das möglicherweise zu einer erhöhten Bioverfügbarkeit anderer oraler Arzneimittel führen kann: empfohlener Sicherheitsabstand von 3 Stunden.
- wegen möglicher additiver Effekte kontraindizierte Kombinationen mit:
- anderen Immunsuppressiva einschließlich Kortikosteroiden
- anderen DMT
- anderen potenziell hämatotoxischen Medikamenten, z. B. Carbamazepin.
- Impfstoffe (s. o.)
- BCRP-Inhibitoren wie Eltrombopag (Thrombopoetinagonist)
- potenzielle pharmakokinetische Interaktionen
- mit starken BCRP- und P-gp-Induktoren, z. B. Rifampicin, Johanniskraut
- mit starken ENT1- und CNT1-Inhibitoren, z. B. Kalziumantagonisten
- Orale Kontrazeptiva (s. o.)?
- Nebenwirkungen
- Lymphopenie
- Grad 3 (< 500–200 Lymphozyten/μl) bei bis zu 25 % der exponierten Patienten
- Grad 4 (< 200 Lymphozyten/μl) bei bis 0,7 % der exponierten Patient*innen
- erhöhte Infektionsneigung43
- Schwerwiegende Infektionen traten in der zulassungsrelevanten Studie CLARITY bei 2,3 % der Cladribin-exponierten Personen auf.
- Die Rate der VZV-Infektionen, meist oraler Herpes oder Zoster der Haut, war in den klinischen Studien unter Cladribin höher als unter Placebo. Die adjustierte Inzidenz pro 100 Patientenjahre betrug 0,83 unter Cladribin und 0,20 unter Placebo.
- Malignomrisiko?43
- In einer Metaanalyse klinischer Studien mit insgesamt 923 Patient*innen und einer Cladribin-Gesamtexpositionszeit von 3.433 Jahren betrug das relative Risiko für Malignomerkrankungen unter Cladribin gegenüber Placebo 1,97 (95 % KI: 0,54–7,17).
- Im Vergleich zu einer gematchten Referenzpopulation zeigte sich kein bedeutsamer Unterschied hinsichtlich des Malignomrisikos.
- progressive multifokale Leukenzephalopathie (PML)
- Diese bei parentaler Gabe von Cladribin zur Behandlung der Haarzellleukämie in einigen Fällen aufgetretene potenziell lebensbedrohliche Nebenwirkung wurde unter Cladribin-Tabletten bislang nicht beobachtet (Stand Mai 2019).44
- Lymphopenie
Ocrelizumab1,28
- Anti-CD20-Antikörper, dessen Wirkung maßgeblich über eine Depletion von B-Zellen vermittelt wird.
- Zulassungsstatus
- Kontraindikationen
- Hypersensitivität gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile des Arzneimittels
- aktive schwerwiegende Infektionen
- relative Kontraindikationen
- chronische Infektionen z. B. mit HIV oder Hepatitis
- signifikante Infektionsneigung, z. B. Dekubitus, Aspirationsneigung, rezidivierende Harnwegsinfekte, Atemwegsinfekte
- Immundefizienz
- maligne Vorerkrankungen
- Schwangerschaft und Stillzeit
- Kinder und Jugendliche: fehlende Daten zu Sicherheit und Wirksamkeit
- Patient*innen mit progressiver MS und Krankheitsdauer über 15 Jahren und/oder EDSS > 6,5: fehlende Daten zu Sicherheit und Wirksamkeit
- Therapieregime
- intravenöse Applikation
- 1. Zyklus: 2 Einzeldosen á 300 mg im Abstand von 14 Tagen
- ab dem 2. Zyklus 600 mg alle 6 Monate
- Vor Therapiebeginn
- sorgfältige Anamnese und klinische Untersuchung zum Ausschluss von Kontraindikationen (s. o.)
- Bei aktiver Infektion: Behandlungszyklus bis zum vollständigen Abklingen der Infektion verschieben.
- Basislabor
- bei Patientinnen im reproduktionsfähigen Alter: Schwangerschaftstest und Aufklärung über die Notwendigkeit einer sicheren Methode der Empfängnisverhütung
- Impfstatus überprüfen.
- ggf. anstehende Auffrischung von Impfungen mindestens 6 Wochen vor Behandlung
- VZV-Serologie – bei negativem Ergebnis: Impfung mit Lebendimpfstoff vor Therapiebeginn. Die Therapie mit Ocrelizumab sollte erst bei ausreichendem Antikörpertiter begonnen werden.
- Ausgangs-MRT des Schädels mit KM
- dokumentierte Aufklärung der betroffenen Person über Therapie und Risiken
- Während der Therapie
- vor, während und nach der Infusion
- zur Vermeidung von Infusionsreaktionen: Vortherapie mit 100 mg Methylprednisolon i. v. und einem Antihistaminikum wie Dimetinden
- Überwachung der Vitalparameter während und bis mindestens 1 Stunde nach der Infusion
- vierteljährliche klinisch-neurologische Kontrolluntersuchungen durch MS-erfahrene Behandelnde
- alle 3 Monate Blutbild und Differenzialblutbild, möglichst inkl. Bestimmung von CD19+- und/oder CD20+-B-Zellen
- alle 6 Monate: Immunglobuline im Serum: IgG und möglichst auch IgM und IgA
- Schädel-MRT einmal jährlich
- reguläre Krebsvorsorgeuntersuchungen
- vor, während und nach der Infusion
- Wechselwirkungen
- Es sind keine pharmakokinetischen Wechselwirkungen zu erwarten.
- Wegen möglicher additiver Effekte wird die gleichzeitige Gabe anderer Immunsuppressiva, mit Ausnahme von Kortikosteroiden zur Schubbehandlung, nicht empfohlen.
- Nebenwirkungen
- häufige infusionsassoziierte Nebenwirkungen bis hin zu schwerwiegenden infusionsbedingten Reaktionen (IRR)
- Zytokinbedingte Reaktionen können dabei noch bis zu 24 Stunden nach Infusion auftreten.
- Berichtet wurden u. a. Hautreaktionen, oropharyngeale Reizung, Dyspnoe, Flush, Blutdruckabfälle, Pyrexie, Schwindel und Tachykardie.
- Die Fahrtauglichkeit kann vorübergehend beeinträchtigt sein.
- Infektionen, z. B. Atemwegsinfekte, Influenza, Herpes simplex und VZV
- vereinzelt Carry-over-Fälle von PML
- Vereinzelte Fälle von Malignomen in den klinischen Studien. Ob diese im Zusammenhang mit der Ocrelizumab-Behandlung standen, ist noch unklar.
- häufige infusionsassoziierte Nebenwirkungen bis hin zu schwerwiegenden infusionsbedingten Reaktionen (IRR)
Weitere Medikamente1,28
- Mitoxantron
- Mitoxantron ist zugelassen für die Behandlung Erwachsener mit hochaktiver schubförmiger multipler Sklerose verbunden mit sich rasch entwickelnder Behinderung, für die keine alternativen Therapieoptionen bestehen.
- Mitoxantron reduzierte in klinischen Studien die Progression und Schubrate sowie die Zahl der aktiven im MRT darstellbaren Läsionen statistisch signifikant, jedoch überwiegend mit nur moderater Effektstärke. Da das längerfristige Risikoprofil jedoch nicht geklärt ist, sollte es vorzugsweise als Reservemedikament bei schnell fortschreitender MS mit häufigen Schüben betrachtet werden. Es gibt insgesamt nur spärliche Belege für die Wirksamkeit45, und die Nebenwirkungen sind ein wesentliches Argument, das gegen die Anwendung als Standardmedikament spricht.
- Mitoxantron wirkt kardiotoxisch. Bei bis zu 12 % der damit Behandelten trat eine systolische Dysfunktion auf.45
- Mitoxantron wird im Abstand einiger Wochen intravenös verabreicht und häufig mit Methylprednisolon kombiniert.
- Rituximab
- Rituximab ist ein monoklonaler Antikörper, der wie Ocrelizumab gegen das CD20-Antigen auf B-Lymphozyten gerichtet ist.
- MS ist keine zugelassene Indikation des Medikaments; bei schubförmiger MS und bei primär progredienter MS wird es jedoch mitunter im Rahmen des Off-Label-Use angewendet, wenn es bei Patient*innen unter 50 Jahren und bei MR-tomografischem Nachweis Kontrastmittel aufnehmender Läsionen im ZNS zum Therapieversagen kommt.
- Bei Patient*innen mit rheumatoider Arthritis, die mit Rituximab behandelt wurden, sind tödliche infusionsbedingte Reaktionen berichtet worden. Um das Risiko für solche Ereignisse zu reduzieren, sollte vor einer Infusion mit Rituximab eine Prämedikation mit 100 mg Methylprednisolon, einem Analgetikum/Antipyretikum (z. B. Paracetamol) und einem Antihistaminikum (z. B. Diphenhydramin) erfolgen. Patient*innen mit vorbestehenden Herzerkrankungen und Personen, bei denen in der Vorgeschichte kardiopulmonale Nebenwirkungen aufgetreten sind, sollten engmaschig überwacht werden. Wenn eine Anaphylaxie oder andere schwerwiegende Überempfindlichkeitsreaktionen/infusionsbedingte Reaktionen auftreten, sollte die Verabreichung von Rituximab sofort gestoppt werden und mit einer angemessenen medizinischen Behandlung begonnen werden.46
- In Verbindung mit Rituximab in der Therapie von onkologischen und rheumatologischen Erkrankungen traten Fälle einer Hepatitis-B-Reaktivierung auf. Diese Fälle schließen Berichte von fulminanter Hepatitis ein, manche mit tödlichem Ausgang. Patient*innen mit aktiver Hepatitis-B-Erkrankung dürfen nicht mit Rituximab behandelt werden. Bei allen Patient*innen ist vor Behandlungsbeginn mit Rituximab ein HBV-Screening erforderlich.47
- Auch einzelne Fälle von PML unter Rituximab wurden berichtet.
- Intravenöse Immunglobuline (IVIG)
- für die MS-Therapie nicht zugelassen
- Die Beweislage zur Wirksamkeit ist nicht zufriedenstellend.
- Sollen nicht mehr zur verlaufmodifizierenden Therapie der MS eingesetzt werden.
- Evtl. in der Schwangerschaft als Alternative zu anderen Immuntherapeutika. Die Datenlage ist hier jedoch ebenfalls inkonsistent.
Autologe hämatopoetische Stammzelltransplantation (HSZT)28,48
- Die HSZT wurde bei Patient*innen mit schubförmig verlaufender MS evaluiert, bei denen die Zweitlinientherapie keine hinreichende Wirksamkeit gezeigt hat.
- Solide Wirksamkeitsnachweise aus bislang zwei randomisiert kontrollierten Studien (RCT) (Stand Juni 2021).49-50
- In der größeren der beiden RCT mit einem Beobachtungszeitraum von 2 Jahren war die MS bei 3 von 52 HSZT-Behandelten progredient, gegenüber 34 von 51, die mit einem Immuntherapeutikum behandelt worden waren.50
- Die therapiebedingte Mortalität hat abgenommen und liegt mittlerweile unter 1 %.51
- Eine internationale Kohortenstudie mit 281 Erkrankten aus 13 Ländern zeigte ein progressionsfreies 5-Jahres-Überleben von 48 %. Die Mortalität innerhalb der ersten 100 Tage nach erfolgter HSZT lag bei 2,8 %.52
- Eine größere schwedische Studie mit einer längeren Beobachtungszeit scheint die Langzeitwirksamkeit der HSZT zu bestätigen.53
- Weitere Studien, insbesondere zum Vergleich der HSZT mit Medikamenten der Wirksamkeitskategorie 3, stehen noch aus. Die HSZT hat laut Leitlinien der Deutschen Gesellschaft für Neurologie das Potenzial, sich zu einer Therapieoption bei schubförmiger MS zu entwickeln. Sie solle aber bis auf Weiteres nur im Rahmen von Studien durchgeführt werden.28
MS-Schübe
- Bei ausgeprägter Funktionsstörung ist eine Behandlung indiziert.
- In der Regel wird für einige Tage die hochdosierte intravenöse Verabreichung von Methylprednisolon empfohlen.
Kortikosteroide
- Kortikosteroide können die einzelnen Schübe verkürzen und abschwächen.
- Intravenöse und perorale Therapie im Vergleich
- Aus einem Cochrane-Review geht hervor, dass die perorale Therapie der intravenösen nicht unterlegen ist.
- Perorale Kortikosteroidbehandlungen (Dexamethason in sinkenden Dosen, beginnend mit 16 mg tgl.) können auch ohne eine vorausgegangene intravenöse Gabe von hochdosiertem Methylprednisolon durchgeführt werden.
- Intravenös
- Die Therapie erfolgt über 3–5 Tage mit 0,5–1 g Methylprednisolon pro Tag in 500 ml Glukoselösung, infundiert über 30–60 min.
Primär progrediente multiple Sklerose
- Es liegen keine Studien vor, die bei dieser Indikation die Wirksamkeit einer Therapie mit Interferon-beta-1a oder -1b oder Glatirameracetat belegen.
Sekundär progrediente multiple Sklerose
- Es liegen Belege dafür vor, dass Beta-Interferon die Schubhäufigkeit und die Krankheitsaktivität in der MRT senkt.
- Eine günstige Wirkung auf die Geschwindigkeit des Fortschreitens bei sekundär progredienter MS ist nur unzureichend belegt.
- Eine Therapie kann bei Patient*innen mit sekundär progredienter MS in Betracht gezogen werden, wenn die Krankheit in Form von Schüben klinisch aktiv ist.
- Die Dosierung ist die gleiche wie bei der schubförmig verlaufenden MS.
- Simvastatin
- In einer Studie stellten Forschende fest, dass Simvastatin die Progression der Hirnatrophie verglichen mit Placebo reduzierte und gut vertragen wurde.54
- Es sind jedoch weitere Studien erforderlich, bevor darüber nachgedacht werden kann, Simvastatin routinemäßig zur Behandlung der sekundär progredienten MS einzusetzen.
- Evtl. ist anschließend auch eine perorale Gabe über weitere 2–3 Wochen sinnvoll.54
Im Kindesalter
Leitlinie: Therapie der MS bei Kindern und Jugendlichen28
- Die Therapie eines akuten Schubs bei Kindern soll wie bei Erwachsenen erfolgen. Methylprednisolon soll dabei gewichtsadaptiert in einer Dosis von 20 mg/kg KG/d (Maximaldosis 1.000 mg/d) gegeben werden.
- Bei Kindern und Jugendlichen mit der Diagnose einer RRMS und leichten oder mittelschweren Verlaufsformen soll zunächst eine Therapie mit einem der Beta-Interferon-Präparate oder einem Glatirameroid begonnen werden.
- Bei Kindern und Jugendlichen ab einem Alter von 10 Jahren mit der Diagnose einer RRMS und Hinweisen auf einen aktiven Krankheitsverlauf (Schub oder wiederholte MRT-Aktivität) unter einer Immuntherapie sollte ein Therapiewechsel auf Fingolimod erfolgen.
- Bei Kindern und Jugendlichen ab einem Alter von 10 Jahren mit einer rasch fortschreitenden RRMS mit 2 oder mehr Schüben mit Behinderungsprogression in 1 Jahr und mit einer oder mehr Gadolinium anreichernden Läsionen im MRT des Gehirns oder mit einer signifikanten Erhöhung der T2-Läsionen im Vergleich zu einer kürzlich durchgeführten MRT kann eine Therapie primär mit Fingolimod erfolgen.
- Mangel an aussagekräftigen Studien28
- Zur medikamentösen Therapie der MS im Kindesalter liegt bislang nur eine einzige randomisiert-kontrollierte Studie vor (Stand Juni 2021).
- 215 RRMS-Patient*innen im Alter von 10–17 Jahren nahmen an der Studie teil. Fingolimod erwies sich im Vergleich zu Interferon-beta-1a als überlegen hinsichtlich der Schubrate und der Akkumulation von MRT-Läsionen in einem 2-jährigen Beobachtungszeitraum. Die Autor*innen der Studie erklärten, es seien längere Studien erforderlich, um die längerfristige Wirksamkeit und Sicherheit von Fingolimod bei kindlicher MS zu beurteilen.55
- Seit November 2018 ist Fingolimod zur Behandlung von Patient*innen im Alter von 10–17 Jahren mit hochaktiver RRMS zugelassen.56
- Die Therapie der MS erfolgt weitgehend in Anlehnung an die Empfehlungen zur MS im Erwachsenenalter, wobei bei Kindern und Jugendlichen verschiedene Besonderheiten zu beachten sind.57
- Zur medikamentösen Therapie der MS im Kindesalter liegt bislang nur eine einzige randomisiert-kontrollierte Studie vor (Stand Juni 2021).
- MS-Schübe
- Ein MS-Schub sollte möglichst bald, d. h. innerhalb von 2–5 Tagen nach Beginn der klinischen Symptomatik behandelt werden.57
- Es werden intravenös einmal täglich 20 mg/kg KG Methylprednisolon (Maximaldosis 1 g/d) unter Magenschutz für 3–5 Tage gegeben.
- 7–14 Tage nach Beendigung des Steroidpulses sollte eine Reevaluation erfolgen. Bei nur geringer Besserung oder bei Zunahme der klinischen Symptomatik wird die Steroidtherapie wiederholt.
- Sind die klinischen Symptome gravierend, z. B. Hemiparese, Tetraparese oder Erblindung, und bessern sich diese nicht deutlich durch die Steroidpulsbehandlungen, werden möglichst zeitnah 5 Zyklen einer Plasmapherese oder Immunadsorption durchgeführt.
- Immunmodulatorische Therapie 57
- Ein möglichst früher Beginn und eine konsequente Durchführung der Therapie sind anzustreben, da so die Prognose verbessert werden kann.
- Die Indikation zu einer immunmodulatorischen Therapie besteht daher, sobald die Diagnose MS gestellt wurde.
- Meist ist dies aufgrund der neuen Diagnosekriterien schon beim 1. Schub möglich. Wenn dies nicht der Fall ist, sollte eine 2. MRT-Untersuchung nach 3 Monaten erfolgen, um möglicherweise die Diagnose zu sichern und die Therapie einzuleiten.
- Die Auswahl der Substanzen und des anzuwendenden Therapieschemas orientiert sich u. a. an der Verlaufsform der MS und sollte an einem spezialisierten Zentrum erfolgen.
Symptomatische medikamentöse Therapie
Spastik58
- Zur Behandlung der Spastik (Spastizität) bei MS stehen folgende Muskelrelaxanzien zur Verfügung:
- Baclofen-Tabletten 10 mg/25 mg
- Initial werden 3 x tgl. 5 mg verabreicht und die Dosis anschließend schrittweise bis auf maximal 80–90 mg tgl. erhöht.
- Tizanidin
- Gabapentin 1.200–2.700 mg/d, vor allem zur Behandlung der tonischen Spastik und den damit verbundenen Schmerzen. Gabapentin ist für diese Indikation nicht zugelassen, wird aber in aller Regel gut vertragen.28
- Für Dantrolen existiert kein konsistenter Wirksamkeitsnachweis. Vor allem wegen möglicher lebertoxischer Effekte sollte es nicht routinemäßig eingesetzt werden.
- Benzodiazepine (z. B. Diazepam) sind wegen ihrer unzureichend belegten spastikreduzierenden Wirksamkeit, wegen Nebenwirkungen wie Sedierung und Muskelschwäche sowie wegen ihres ausgeprägten Suchtpotenzials nur in Ausnahmefällen vertretbar.28
- Eine intrathekale Baclofentherapie kann bei stark ausgeprägter Spastizität oder bei schweren systemischen Nebenwirkungen anderer Mukelrelaxanzien erfolgen.
- Eine weitere Alternative sind intramuskuläre Injektionen von Botulinumtoxin A. Die bisherigen Studien erlauben noch keine abschließenden Aussagen zur Wirksamkeit. Vor allem Patient*innen mit ausgeprägter lokaler Spastik scheinen davon zu profitieren, besonders wenn die betroffene Muskulatur direkt nach der Injektion physiotherapeutisch nachbehandelt wird.59 Die Behandlung ist nur für Spastik infolge anderer neurologischer Erkrankungen zugelassen. Um die Kostenübernahme durch die Krankenversicherungen u. a. auch bei MS-Patient*innen zu unterstützen, hat der Arbeitskreis Botulinumtoxin der Deutschen Gesellschaft für Neurologie eine Stellungnahme zum Off-Label-Use von Botulinumtoxin verfasst.60
- Baclofen-Tabletten 10 mg/25 mg
- Cannabinoide
- Wirkstoffe aus Cannabis sativa (Hanf)
- Δ9-Tetrahydrocannabinol (THC)
- Cannabidiol (CBD)
- In einer 2018 von Allan et al. publizierten Metaanalyse waren 4 systematische Reviews zu Cannabinoiden in der Behandlung von Spastik berücksichtigt. Die meisten zugrunde liegenden randomisiert kontrollierten Studien (RCT) waren an Patient*innen mit MS durchgeführt worden.61
- Laut 2 von 3 Metaanalysen, in denen eine numerische Skala zur Messung der Spastik eingesetzt wurde, ging die Spastizität unter Cannabinoiden signifikant stärker zurück als unter Placebo.
- Eine Reanalyse des größten systematischen Reviews ergab, dass ca. 35 % der mit Cannabinoiden behandelten Patient*innen und 25 % der Placebogruppe eine Reduktion der Spastizität um mindestens 30 % erreichten (Risk Ratio 1,37; 95 % KI: 1,07−1,76).
- Die Responder-Metaanalyse aller 4 Reviews zeigte, dass etwa die Hälfte aller Patient*innen unter Cannabinoiden und 35 % unter Placebo eine subjektive Besserung ihrer Beschwerden erfuhren (Risk ratio 1,45; 95 % KI 1,08−1,95).
- zur schmerzlindernden Wirksamkeit s. u.
- Nebenwirkungen
- verminderte Muskelkraft, u. U. mit einer erhöhten Sturzneigung
- Müdigkeit
- Benommenheit
- Gedächtnis- und Konzentrationsstörungen
- evtl. eingeschränkte Verkehrs- und Arbeitssicherheit
- Depressivität
- Verwirrtheits- und Unruhezustände
- psychotische Zustände
- Es gibt Hinweise darauf, dass CBD unerwünschte Effekte von THC neutralisiert, wie:
- Sedierung
- Angst
- psychotische Symptome
- Tachykardie
- verminderte Standsicherheit.
- Wirkstoffe aus Cannabis sativa (Hanf)
- Als erstes Cannabinoid-Fertigarzneimittel zur Behandlung von Spastik bei Patient*innen mit multipler Sklerose wurde 2010 ein Mundspray mit Nabiximols, einem ethanolischen Extrakt aus Cannabis (THC/CBD ca. 1/1) zugelassen.
- In der Neufassung 2020 des von der BKK Mobil Oil unterstützten, an der Universität Bremen erarbeiteten Cannabis-Reports62 werden Spasmen bei MS wie bereits in der Vorversion von 2018 unter die denkbaren Indikationen für den Einsatz von Cannabinoiden gezählt.
- Einschränkend wird dort jedoch auf die umfassende Synthese klinischer Daten hingewiesen, aufgrund derer die im November 2019 publizierte britischen NICE-Leitlinie „NG144Cannabinoide“63 dazu rät, Cannabinoide in dieser Indikation zunächst nur im Rahmen eines 4-wöchigen Therapieversuchs unter fachärztlicher Aufsicht einzusetzen. Wenn die Spastik unter der Behandlung nicht um mindestens 20 % auf einer Zehnpunkteskala zurückgeht, sollte der Therapieversuch beendet werden.
- Näheres siehe Artikel Cannabinoid-haltige Arzneimittel.
Schmerzen
- Grundlegendes zum Thema Schmerz, u. a. zur Unterscheidung zwischen neuropathischen, nozizeptiven und somatoformen sowie zwischen akuten und chronischen Schmerzen siehe den Artikel Schmerzbehandlung, Grundsätze.
- 10–15 % der Patient*innen haben akute Schmerzen.
- häufig: schmerzhafte tonische Spastik
- seltener: neuropathische Schmerzen
- Trigeminusneuralgie
- Lhermitte-Zeichen (neuropathische, „elektrisierende“ Schmerzen in Rumpf und Extremitäten bei Nackenbeugung)
- Tic-artige dysästhetische Schmerzen in den Extremitäten
- radikuläre Schmerzen
- Antikonvulsiva wie Carbamazepin, Pregabalin oder Gabapentin sind bei attackenartig einschießenden neuropathischen Schmerzen die 1. Wahl.
- Mehr als 30 % aller von MS Betroffenen haben chronische Schmerzen.
- meist brennende Schmerzen in den Extremitäten, evtl. schmerzhafte Wadenkrämpfe oder schmerzhafte Spastik
- Bei chronischen Schmerzen ist eine multimodale Schmerztherapie angezeigt, einschl. Physiotherapie, Bewegungstherapie, Entspannungsverfahren und ggf. Schmerzpsychotherapie.
- medikamentöse Therapiekomponente bei Muskelschmerzen infolge der Spastik
- medikamentöse Therapiekomponente bei chronischen neuropathischen Schmerzen
- bei Dauerschmerzen: trizyklische Antidepressiva (z. B. Amitriptylin)
- bei attackenartig einschießenden Schmerzen: Antikonvulsiva (z. B. Pregabalin oder Gabapentin)
- Cannabinoide
- Hinweise auf eine mäßige zentral analgetische und schlaffördernde Wirkung bei MS64-65
- Welchen Stellenwert Cannabinoide in der Behandlung neuropathischer Schmerzen haben, ist kontrovers.
- Die Deutsche Gesellschaft für Neurologie kam in der zuletzt 2019 aktualisierten Version ihrer S2k-Leitlinie zur nichtinterventionellen Therapie neuropathischer Schmerzen zu folgenden Schlussfolgerungen:1
- „Cannabinoide können zur Therapie neuropathischer
Schmerzen jeglicher Ursache nicht empfohlen werden, da ihr Effekt eher gering ausgeprägt ist und die Nebenwirkungsrate hoch ist." - „Nur in Einzelfällen kann bei Versagen anderer Schmerztherapien der Einsatz von Cannabinoiden als Off-Label-Therapie im Rahmen eines multimodalen Schmerztherapiekonzepts erwogen werden.“
- „Cannabinoide können zur Therapie neuropathischer
- In der im Abschnitt Spastik beschriebenen Metaanalyse (Allan 2018) konnte eine schmerzlindernde Wirksamkeit von Cannabinoiden nicht zweifelsfrei bewiesen werden. Es wurde aber bestätigt, dass neuropathische Schmerzen möglicherweise besser auf die Behandlung ansprechen als andere Schmerzformen.61
- Näheres siehe Artikel Cannabinoid-haltige Arzneimittel.
Urologische Symptome
- Bei Blasendysfunktion, imperativem Harndrang und Inkontinenz mitunter Besserung durch Anticholinergika
- Tolterodin-L-Tartrat, Solifenacinsuccinat, Darifenacin, Fesoterodin und Mirabegron kommen infrage. Es ist jedoch Vorsicht im Hinblick auf einen möglichen Harnverhalt und andere anticholinerge Nebenwirkungen geboten.
- Oxybutynin als Depotpflaster kann ebenfalls wirksam sein und ist mit weniger anticholinergen Nebenwirkungen verbunden.
- In Ausnahmefällen kann Desmopressin indiziert sein.
- Cannabispräparate scheinen bei Urgeinkontinenz oder häufigem Harndrang infolge von MS eine gewisse Wirksamkeit zu haben, die bisherigen Studien zu dieser Indikation waren jedoch von kurzer Dauer und eingeschränkter Qualität.66
- Erektile Dysfunktion
- intrakavernös oder transurethral appliziertes Prostaglandin
- evtl. Sildenafil oder andere perorale Mittel wie Tadalafil oder Vardenafil
- Näheres zur Behandlung finden Sie im Artikel Erektile Dysfunktion.
- Therapieplanung in enger Absprache zwischen neurologischen und urologischen Behandelnden28
Depression
- Grundlegendes zur Diagnostik und Therapie siehe Artikel Depression.
- Zur medikamentösen Behandlung der Depression bei MS-Patient*innen gibt es nur wenige Studien.
- SSRI werden aufgrund ihrer aktivierenden Eigenschaften bevorzugt. Substanz- und klassenspezifische Nebenwirkungen können aber ihren Nutzen einschränken. Zu den häufigsten Nebenwirkungen bei SSRI zählen sexuelle Dysfunktionen (bei Frauen, bei Männern). In dem Fall kann der Wechsel auf einen Serotonin-Noradrenalin-Wiederaufnahme-Hemmer (SNRI, z. B. Venlafaxin) angezeigt sein. Bei Patient*innen mit neuropathischen Dauerschmerzen kommt eher ein trizyklisches Antidepressivum zur Behandlung von Depression und Schmerz infrage.
Fatigue
- Nichtmedikamentöse Maßnahmen stehen bei der Fatigue an 1. Stelle.28
- Für Amantadin gibt es Hinweise, wenn auch keine zweifelsfreien Beweise zur Wirksamkeit bei MS-Fatigue. Die empfohlene Dosierung liegt bei mindestens 2 x tgl. 100 mg Amantadin. Das Medikament kann zu Hautausschlag, Ödemen und anticholinergen Nebenwirkungen führen. In der Regel wird es aber gut vertragen. Für die Indikation Fatigue ist das Mittel nicht mehr zugelassen. Die Behandlung kann also nur im Rahmen des Off-Label-Use erfolgen.28
- Modafinil ist laut Metaanalysen nicht wirksamer als Placebo.28,67
- Pemolin, L-Carnitin, Prokarin, 4-Aminopyridin (Fampridin) und Ginkgo biloba hatten in bisherigen Studien keine oder inkonsistente Effekte.28
Gehfähigkeit
- 4-Aminopyridin (Fampridin) führte in einer randomisiert kontrollierten Doppelblindstudie bei etwa 1/3 der MS-Patient*innen zu einer Besserung der eingeschränkten Gehfähigkeit.68
- Die gemessene Besserung korrelierte mit der subjektiv von den Patient*innen angegebenen Besserung und wird von den Autor*innen der Studie als klinisch relevant eingestuft.
- 2 x 10 mg Fampridin sind zur Besserung der Gehfähigkeit bei erwachsenen Patient*innen mit multipler Sklerose und Schwierigkeiten beim Gehen (EDSS 4–7) zugelassen.
- Die Therapie sollte von Ärzt*innen mit Erfahrung bei der Therapie von MS-Betroffenen eingeleitet werden.
- Die klinischen Erfahrungen ergeben ein gemischtes Bild. Es wird eine individuelle Erprobung über etwa 2–4 Wochen mit Gehtest („Timed 25-Foot Walk“) vor Therapiebeginn und bei der Beurteilung nach 2–4 Wochen empfohlen. Bei unzureichendem Ansprechen ist die Therapie zu beenden.
- Mögliche Nebenwirkungen sind u. a. Krampfanfälle, Schwindel, Schlaflosigkeit, Verstärkung einer bestehenden Trigeminusneuralgie, Angst und Gleichgewichtsstörungen.
- Fampridin unterliegt der besonderen Überwachung. Damit auf neue sicherheitsrelevante Informationen so schnell wie möglich reagiert werden kann, ist jeder Verdacht auf Nebenwirkungen unter Fampridin im Rahmen des nationalen Meldesystems unverzüglich an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Abteilung Pharmakovigilanz, zu melden.
Weitere Therapien
Allgemeines
- Das psychische Wohlbefinden, also Linderung oder Vorbeugung von Angstsymptomen, Depression oder Stress, kann durch Interventionen verbessert werden, die auf dem Prinzip der Achtsamkeit basieren.69
Spastik
- Näheres dazu im Artikel Spastisches Syndrom.
- Eine Physiotherapie ist generell wichtig, um die richtige Art und die richtige Menge an Bewegung für die Betroffenen zu finden. Ein Wechsel von Bewegung und Erholung ist ratsam.
- Nicht veröffentlichte Studien mit nur wenigen Patient*innen und kurzer Dauer deuten darauf hin, dass eine hochintensive Bewegungstherapie mit großer Belastung verglichen mit einer herkömmlichen physiotherapeutischen Bewegungstherapie zu einer größeren Verbesserung der körperlichen Kondition gemessen an der maximalen Sauerstoffaufnahme führt.
- Orthesen, die die Dorsalflexion des Knöchels unterstützen, können zur Stützung des Knies und zu Verbesserung von Koordination und Gleichgewicht beim Gehen beitragen.70
Urologische Symptome
- Häufig ist ein intermittierender Katheterismus notwendig, um einen unwillkürlichen Urinabgang und einen Harnverhalt zu verhindern. Dieser kann allein oder ergänzend zu einer medikamentösen Therapie zur Anwendung kommen. Nach entsprechender Anleitung und ausreichend erhaltener motorischer Geschicklichkeit kann die komplikationsarme Variante des aseptischen intermittierenden Katheterismus auch von den Patienten selbst durchgeführt werden.
- Ein Eingriff zur Blasenvergrößerung kann indiziert sein.
- Eine mögliche Alternative ist ein Urostoma mit Beutel.
- Ein Verweilkatheter und absorbierende Binden kommen nur infrage, wenn alle anderen Maßnahmen nicht zu ausreichendem Erfolg führen.
Obstipation oder Stuhlinkontinenz
- Umstellung der Ernährung, d. h. faserreiche Kost
- Aufnahme von ausreichend Flüssigkeit, 1,5–2 Liter pro Tag
- Bewegung
- Evtl. Abführmittel
Kognitive Beeinträchtigungen
- Kognitives Training u. a. mit Aufmerksamkeitsübungen
Fatigue
- Fatigue ist eines der häufigsten Symptome der MS.
- Zu große körperliche Anstrengung sollte vermieden werden.
- Viele Patient*innen sind empfindlich gegenüber hohen Temperaturen. Es wurden verschiedene Arten von Kältetherapien ausprobiert, Belege zur Wirksamkeit liegen jedoch nicht vor.
- Durch eine bessere Planung des Alltags und eine individuelle Anpassung des Aktivitätsniveaus können die Beschwerden gelindert werden.
- Umgebungsveränderungen und evtl. eine Physiotherapie können die subjektive Erschöpfung möglicherweise verbessern.
- Ein gruppenbasiertes Programm (FACETS) mit 6 Sitzungen, die eine kognitive Therapie und die Vermittlung von Methoden zur Energieoptimierung umfassen, führte im Vergleich zur „herkömmlichen Therapie“ zu einer signifikanten Verringerung der Erschöpfung und einer besseren Bewältigung der Krankheit.71
- Körperliches Training kann ebenfalls der Fatigue entgegenwirken und scheint bei MS-Patient*innen sicher zu sein, das heißt, es führt nicht zu mehr Schüben als ohne Training.72
Depression
- Diese kann organische, psychische und soziale Ursachen haben.
- Sie wird in Übereinstimmung mit den einschlägigen Leitlinien bei Depression therapiert. Grundlegendes zur Diagnostik, Psycho- und Pharmakotherapie siehe Artikel Depression.
- Sowohl zur psychotherapeutischen als auch zur medikamentösen Behandlung der Depression bei MS-Patient*innen gibt es nur wenige Studien.
- Es gibt Hinweise darauf, dass Psychotherapie depressive Symptome reduzieren und die Betroffenen bei der Krankheitsbewältigung unterstützen kann. Verfahren der kognitiven Verhaltenstherapie sind dabei am besten untersucht.73
Prävention
- Primärprävention
- Möglicherweise kann die MS-Inzidenz durch Vitamin D in Form von erhöhter Sonnenexposition oder Nahrungsergänzungsmitteln gesenkt werden. Beweise dafür gibt es noch nicht.
- Sekundärprävention
- Physiotherapeutische und ergotherapeutische Maßnahmen können dazu beitragen, einer Spastizität und anderen Komplikationen vorzubeugen.
- Der Nutzen eines Ausdauertrainings mit geringer bis mäßiger Intensität ist gut belegt.74
- Krafttraining verbessert wahrscheinlich alltagsrelevante Funktionen wie Aufstehen, Gehen oder Treppensteigen.75
- Es scheint, dass Stillen protektiv gegen einen Rückfall nach einer Schwangerschaft wirken kann, besonders bei vollem Stillen bis zu 6 Monate nach der Geburt.76
Verlauf, Komplikationen und Prognose
Verlauf
- Die Erkrankung setzt meist im jungen Erwachsenenalter ein. Das durchschnittliche Alter bei Krankheitsbeginn beträgt 30 Jahre.
- Der Verlauf kann sehr unterschiedlich sein.77-78
- schubförmig – remittierend oder progredient
- bei etwa 80–85 % der Patient*innen wiederholte Exazerbationen (Schübe) mit kompletter oder inkompletter Remission der neurologischen Defizite im schubfreien Intervall
- Meist nehmen die neurologischen Funktionseinschränkungen mit jedem Schub zu (schubförmig progredient).
- Varianten mit mildem Verlauf, wenigen Schüben und keinen oder nur geringen funktionellen Beeinträchtigungen
- Im Durchschnitt treten bei MS-Patient*innen 0,8 Schübe jährlich auf.
- primär progredient
- Bei ca. 15 % der Patient*innen verläuft die Erkrankung von Anfang an chronisch progredient, ohne klar abgrenzbare Schübe.
- sekundär progredient
- nach schubförmig remittierendem Beginn: Übergang in einen chronisch progredienten Verlauf
- nach 11–15 Jahren 58 % der Patient*innen mit schubförmig remittierendem Verlauf
- nach mehr als 25 Jahren 89 % der Patient*innen mit schubförmig remittierendem Verlauf77
- schubförmig – remittierend oder progredient
- Neurologische Ausfälle
- Die Erkrankung kann von Beginn an alle Arten neurologischer Ausfälle in unterschiedlichen Kombinationen hervorrufen.
- Bei fortgeschrittener Krankheit sind die Patient*innen funktionell stark eingeschränkt, und das klinische Bild ist homogener.
- Schwangerschaft
- Eine Schwangerschaft hat keinen prognostischen Einfluss auf das Krankheitsbild.
- Während der Schwangerschaft treten jedoch weniger Schübe auf, in den 3–6 Monaten nach der Geburt ist das Schubrisiko erhöht.25
Komplikationen
- Eingeschränkte kognitive Funktionen, meist Gedächtnisstörungen und Veränderungen des Orientierungssinns und der räumlichen Wahrnehmung; Sprachvermögen meist kaum eingeschränkt.
- Unterschiedlich schwere Ausprägung der Komplikationen; bei etwa 50 % der Patient*innen im Verlauf der Krankheit Nachlassen der kognitiven Funktionen
- Entwicklung einer Demenz
- Harnwegsinfektionen
- sowohl Infektionen der unteren als auch der oberen Harnwege, Gefahr von Nierenschädigungen
- Dekubitalgeschwüre
- Depression
- depressive Episoden bei 30–50 % der Patient*innen
- Infektionen der Lunge
- Septikämie
Prognose
- Schubförmiger Verlauf
- Bei 80–85 % der Patient*innen ist die Erkrankung im frühen Stadium durch einen schubförmigen Verlauf gekennzeichnet.
- Bei etwa 4 von 5 Betroffenen mit zunächst schubförmiger MS nimmt die Erkrankung – für gewöhnlich innerhalb von 20 Jahren nach Krankheitsbeginn – einen sekundär progredienten Charakter an.
- Bei 1 von 5 Patient*innen ist ein milder Verlauf mit nahezu normaler Lebenserwartung und keinen oder nur geringen funktionellen Einschränkungen zu beobachten.
- Primär progredienter Verlauf
- Bei etwa 15 % der Patient*innen hat die Erkrankung bereits von Beginn an einen progredienten Charakter und wird in diesem Fall als primär progrediente MS bezeichnet.
- Nach 20 Krankheitsjahren
- Haben 20 % der Patient*innen nur leichte Beschwerden, eine nahezu normale Lebenserwartung und keine oder nur geringe körperliche Funktionseinschränkungen.
- Sind 20 % der Betroffenen verstorben.
- Liegen bei 60 % der Patient*innen Funktionseinschränkungen in schwankendem Ausmaß vor.
- Aus einer norwegischen Follow-up-Studie79 geht hervor, dass nach 15 Jahren die Wahrscheinlichkeit,
- nicht auf einen Rollstuhl angewiesen zu sein, bei etwa 75 % liegt.
- ohne Hilfsmittel gehen zu können, bei etwa 60 % liegt.
- berufsunfähig zu sein, bei etwa 54 % liegt.
- Am besten ist die Prognose bei Menschen mit schubförmig remittierendem Verlauf.
- Weitere Faktoren, die sich prognostisch günstig auswirken, sind junges Alter, sensorische und visuelle Symptome und lange Intervalle zwischen den akuten Exazerbationen innerhalb der ersten Jahre nach der Diagnose.
- Es kann zu jedem beliebigen Zeitpunkt zu einem Stillstand der Krankheitsprogression kommen.
- In einer amerikanischen Studie hatten MS-Patient*innen eine um 7,5 Jahre kürzere Lebenserwartung als entsprechende Personen in der Kontrollgruppe.80
Verlaufskontrolle
- Regelmäßige, in der Regel vierteljährliche, neurologische Kontrolluntersuchungen sollten durch MS-erfahrene Behandelnde erfolgen.28
- Frühsymptome eines neuen Schubs?
- Anzeichen für Komplikationen (Dekubitus, psychische Beschwerden, Harnwegssymptome)?
- Evtl. MRT zur ergänzenden Messung des Therapieerfolgs; der Nutzen ist unzureichend belegt.
- Hinweise auf Therapieversagen?
- Bei Nachlassen der therapeutischen Wirkung: neutralisierende Antikörper gegen Interferon-beta-1a und -1b (IFNb-NAk)? Test routinemäßig nach 12 und 24 Monaten oder bei klinischem Verdacht auf Therapieversagen
Unter der Therapie mit Interferon-beta-1a/-1b oder Glatirameracetat
- Die Therapie mit Interferon-beta-1a/-1b oder Glatirameracetat wird von Neurolog*innen eingeleitet.
- Nach 1, 3 und 6 Monaten: Kontrolle von Injektionstechnik und Nebenwirkungen
- Durchführung der Kontrollen im Wechsel mit einer auf MS spezialisierten Pflegekraft
- Ärztliche Untersuchungen
- zu Beginn alle 7 Monate und danach bei stabilem Verlauf 1 x jährlich
- bei stabilem Krankheitsverlauf: halbjährliche Kontrollen im Wechsel zwischen Hausärzt*in und Neurolog*in
- Blutproben bei jeder Kontrolle
- Differenzialblutbild der Leukozyten
- GOT, GPT, AP, Gamma-GT, Bilirubin
- T4 und TSH
- Elektrolyte und Kreatinin
- Schübe unter der Interferontherapie nach den geltenden Verfahrensweisen behandeln.
- Einmal jährlich: funktionelle Defizite mittels EDSS oder MSFC bestimmen.
Unter der Therapie mit Natalizumab
- Bei Patient*innen, die mit Natalizumab behandelt werden, erfolgt die Verlaufskontrolle in Form eines Gesprächs und einer neurologischen Untersuchung, wenn die Betroffenen zu ihren monatlichen Infusionen erscheinen.
- Auf MS spezialisierte Pflegekräfte und Neurolog*innen überwachen die Therapie und sollten dabei besonders auf das Auftreten von Symptomen achten, die für eine PML sprechen könnten.
- Bei Infektionen oder Zeichen eines Immundefekts: unverzügliche Rücküberweisung an das behandelnde neurologische Zentrum
- Wenn die Einleitung einer weiteren Therapie indiziert ist, auf potenzielle Wechselwirkungen achten.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Alle relevanten diagnostischen Möglichkeiten in Betracht ziehen.
- Nicht voreilig von einer MS sprechen, wenn die Diagnose noch nicht gesichert ist.
- Möglichst unaufgeregt über die Erkrankung und die Prognose aufklären.
- Betonen Sie, dass viele MS-Patient*innen eine normale Lebenserwartung und keine oder nur geringe körperliche Funktionseinschränkungen haben.
- Sowohl durch die Erkrankung als auch durch manche Medikamente kann die Fahrtüchtigkeit eingeschränkt sein.81 Näheres siehe Artikel Beurteilung der Fahreignung
Patienteninformationen in Deximed
Patientenverbände
- Deutsche Multiple Sklerose Gesellschaft: Was ist Multiple Sklerose?
- Kompetenznetz Multiple Sklerose: Multiple Sklerose erforschen, verstehen und therapieren
Weitere Informationen
- Siehe Artikel Beurteilung der Fahreignung.
Illustrationen

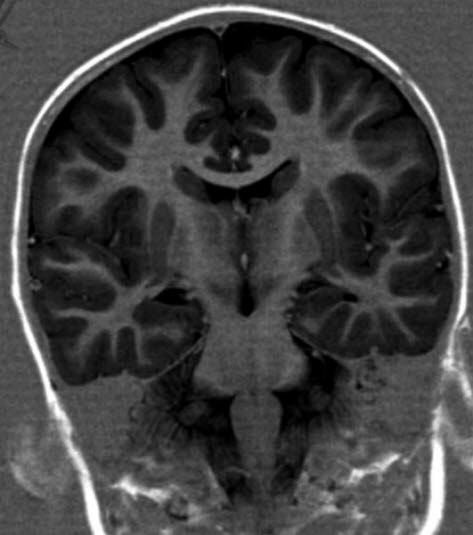
MS-Veränderungen (MRT-Koronarschnitt)

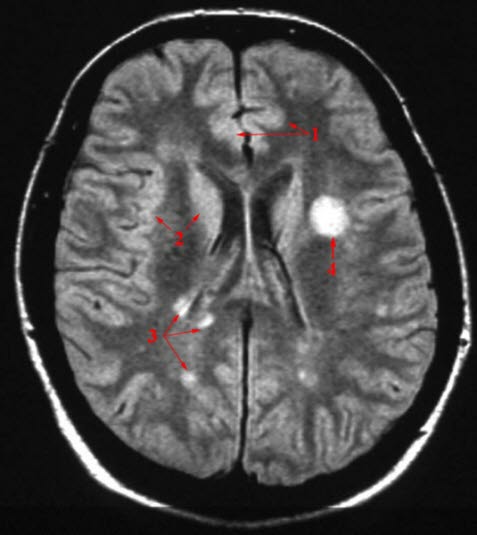
MS-Veränderungen, Demyelinisierung
CME-Punkte
Quellen
Leitlinien
- Deutsche Gesellschaft für Neurologie. Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis Optica Spektrum und MOG-IgG-assoziierte Erkrankungen – Living Guideline. AWMF-Leitlinie Nr. 030-050LG. S2k, Stand 2021. www.awmf.org
- Gesellschaft für Neuropädiatrie. Pädiatrische Multiple Sklerose. AWMF-Leitlinie Nr. 022-014. S1, Stand 2016 (abgelaufen). www.awmf.org
- Bundesanstalt für Straßenwesen. Begutachtungsleitlinien zur Kraftfahreignung. Bergisch Gladbach, Stand 2019. www.bast.de
Literatur
- Krankheitsbezogenes Kompetenznetz Multiple Sklerose (Hrsg.): Qualitätshandbuch MS/NMOSD. Empfehlungen zur Therapie der Multiplen Sklerose / Neuromyelitis-optica-Spektrum-Erkrankungen für Ärzte. München 2018 (Download am 01.05.2019) www.kompetenznetz-multiplesklerose.de
- Compston A. Genetic epidemiology of multiple sclerosis. J Neurol Neurosurg Psychiatry 1997; 62: 553-61. PubMed
- Aschiero A, Munger KL. Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors. Ann Neurol 2007; 61: 504-13. PubMed
- Petersen G, Wittmann R, Arndt V, Göpffarth D. Epidemiologie der Multiplen Sklerose in Deutschland Regionale Unterschiede und Versorgungsstruktur in Abrechnungsdaten der gesetzlichen Krankenversicherung. Nervenarzt 2014; 85: 990-8. www.ncbi.nlm.nih.gov
- Kip M, Zimmermann A, Bleß HH. Weißbuch Multiple Sklerose : Versorgungssituation in Deutschland. Berlin: Springer, 2016. www.iges.com
- Calabresi PA. Diagnosis and management of multiple sclerosis. Am Fam Physician 2004; 70: 1935-44. PubMed
- Ebers GC. Environmenrtal factors and multiple sclerosis. Lancet Neurology 2008; 7: 268-77. PubMed
- Ascherio A, Munger KL. Environmental risk factors for multiple sclerosis. Part I: the role of infection. Ann Neurol 2007; 61: 288-99. PubMed
- Belbasis L, Bellou V, Evangelou E, et al. Environmental risk factors and multiple sclerosis: an umbrella review of systematic reviews and meta-analyses. Lancet Neurol. 2015; 14: 263-73. doi: 10.1016/S1474-4422(14)70267-4 DOI
- DeLorenze GN, Munger KL, Lennette ET, Orentreich N, Vogelman JH, Ascherio A. Epstein-Barr Virus and Multiple Sclerosis. Evidence of Association From a Prospective Study With Long-term Follow-up. Arch Neurol 2006; 63. www.ncbi.nlm.nih.gov
- Ramogapalan SV, Maugeri NJ, Handunnetthi L, et al. Expression of the Multiple Sclerosis-associated MHC class II allele HLA-DRB1*1501 is regulated by vitamin D. PLoS Genet 2009; 5: e1000369. www.ncbi.nlm.nih.gov
- The International Multiple Sclerosis Genetics Consortium & the Wellcome Trust Case Control Consortium. Genetic risk and primary role for cell-mediated immune mechanisms in multiple sclerosis. Nature 2011: 476: 214-219. www.ncbi.nlm.nih.gov
- Levin LI, Munger KL, Rubertone MV, et al. Multiple sclerosis and Epstein-Barr virus. JAMA 2003; 289: 1533-6. PubMed
- Staples J, Ponsonby A-L, Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis. BMJ 2010; 340: c1640. www.bmj.com
- Ascherio A, Munger KL, White R, et al. Vitamin D as an early predictor of Multiple sclerosis activity and progression. JAMA Neurol 2014. doi:10.1001/jamaneurol.2013.5993 DOI
- Munger KL, Hongell K, Åivo J, et al. 25-Hydroxyvitamin D deficiency and risk of MS among women in the Finnish Maternity Cohort. Neurology 2017 Oct 10; 89(15): 1578-1583. pmid:28904091 PubMed
- Lucchinetti CF, Bruck W, Rodriguez M, Lassmann H. Distinct patterns of multiple sclerosis pathology indicates heterogeneity in pathogenesis. Brain Pathol 1996; 6: 259-74. PubMed
- Mohr DC, Hart SL, Julian L, Cox D, Pelletier D. Association between stressful life events and exacerbation in multiple sclerosis: a meta-analysis. BMJ 2004; 328: 731. PubMed
- Frohman EM, Racke MK, Raine CS. Multiple sclerosis - the plaque and its pathogenesis. N Engl J Med 2006; 354: 942-55. PubMed
- Bø L, Vedeler CA, Nyland HI et al. Intracortical multiple sclerosis lesions are not associated with increased lymphocyte infiltration. Mult Scler 2003;9: 323-31. PubMed
- Bø L, Vedeler CA, Nyland HI et al. Subpial demyelination in the cerebral cortex of multiple sclerosis patients. J Neuropathol Exp Neurol 2003; 62: 723-32. PubMed
- Barnett MH, Henderson AP, Prineas JW. The macrophage in MS: just a scavenger after all? Pathology and pathogenesis of the acute MS Lesion. Mult Scler 2006; 12: 121-32. www.ncbi.nlm.nih.gov
- Jersild C, Svejgaard A, Fog T. HL-A antigens and multiple sclerosis. Lancet 1972; 1: 1240-1. www.ncbi.nlm.nih.gov
- Willer CJ, Dyment DA, Sadovnick AD, Rothwell PM, Murray TJ, Ebers GC for the Canadian Collaborative Study Group. Timing of birth and risk of multiple sclerosis: population based study. BMJ 2005; 330: 120-4. pubmed.ncbi.nlm.nih.gov
- Confavreux C, Hutchinson M, Hours MM, Cortinovis-Tourniare P, Moreau T, and the Pregnancy in MS Group. Rate of pregnancy-related relapse in multiple sclerosis. N Engl J Med 1998; 339: 285-91. New England Journal of Medicine
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2021. G35.- www.dimdi.de
- Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162-73. PMID: 29275977 PubMed
- Deutsche Gesellschaft für Neurologie. Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis Optica Spektrum und MOG-IgG-assoziierte Erkrankungen - Living Guideline. AWMF-Leitlinie Nr. 030-050LG. S2k, Stand 2021. www.awmf.org
- Whiting P, Harbord R, Main C, et al. Accuracy of magnetic resonance imaging for the diagnosis of multiple sclerosis: systematic review. BMJ 2006; 15: 875-84. www.ncbi.nlm.nih.gov
- Deutsche Multiple Sklerose Gesellschaft Bundesverband e. V.. MS-Schwester/MS-Therapiemanagement: DMSG Fachfortbildung für 'MS-Schwestern'. Hannover 2017 (Download 29.05.2019). www.dmsg.de
- Pearson M, Dieberg G, Smart N. Exercise as a Therapy for Improvement of Walking Ability in Adults With Multiple Sclerosis: A Meta-Analysis. Arch Phys Med Rehabil. 2015; 96: 1339-48. doi:10.1016/j.apmr.2015.02.011 DOI
- Comi G, Martinelli M, Rodegher M, et al. Eff ect of glatiramer acetate on conversion to clinically defi nite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial. Lancet 2009; 374: 1503-11. PubMed
- Papadopoulou A, Kappos L, Sprenger T. Teriflunomide for oral therapy in multiple sclerosis. Expert Rev Clin Pharmacol. 2012; 5): 617-28. PubMed PMID: 23234322 PubMed
- Sartori A, Carle D, Freedman MS. Teriflunomide: a novel oral treatment for relapsing multiple sclerosis. Expert Opin Pharmacother. 2014;15(7):1019-27. PMID: 24742277. PubMed
- Linker RA, Gold R. Dimethyl fumarate for treatment of multiple sclerosis: mechanism of action, effectiveness, and side effects. Curr Neurol Neurosci Rep. 2013 Nov;13(11):394 PubMed
- Xu Z, Zhang F, Sun F, Gu K, Dong S, He D. Dimethyl fumarate for multiple sclerosis. Cochrane Database of Systematic Reviews 2015, Issue 4. Art. No.: CD011076. DOI: 10.1002/14651858.CD011076.pub2. DOI
- Biogen GmbH. Tecfidera® (Dimethylfumarat): Aktualisierte Empfehlungen im Zusammenhang mit Fällen von progressiver multifokaler Leukenzephalopathie (PML) bei leichter Lymphopenie. Rote Hand-Brief vom 09.11.2020. www.akdae.de
- Bloomgren G, Richman S, Hotermans C, et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy. N Engl J Med 2012; 366: 1870-80. New England Journal of Medicine
- Brown JW, Coles AJ. Alemtuzumab: evidence for its potential in relapsing-remitting multiple sclerosis. Drug Des Devel Ther. 2013;7:131-8. doi: 10.2147/DDDT.S32687 DOI
- Cohen JA, Coles AJ, Arnold DL, et al; CARE-MS I investigators. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet. 2012; 380:1819-28. doi: 10.1016/S0140-6736(12)61769-3. DOI
- Information des Paul-Ehrlich-Insituts zu Alemtuzumab (Lemtrada) vom 01.11.2019. Lemtrada (Alemtuzumab) – PRAC empfiehlt Maßnahmen zur Minimierung schwerwiegender Nebenwirkungen. www.pei.de
- Müller C. USA: Zulassung von Mavenclad bei Multipler Sklerose. Cladribin bei sekundär progredienter MS. DAZ.online; Stuttgart, 02.04.2019. www.deutsche-apotheker-zeitung.de
- Cook S, Leist T, Comi G et al. Safety of cladribine tablets in the treatment of patients with multiple sclerosis: An integrated analysis. Mult Scler Relat Disord 2019; 29: 157-167. PMID: 30885374 PubMed
- EMD Serono. MAVENCLAD is the first and only short-course oral therapy for relapsing forms of MS. Rockland, MA, USA. April 2019. www.mavenclad.com
- Martinelli Boneschi F, Vacchi L, Rovaris M, Capra R, Comi G. Mitoxantrone for multiple sclerosis. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD002127. DOI: 10.1002/14651858.CD002127.pub3. DOI
- Roche Pharma GmbH. Rote-Hand-Brief über tödliche infusionsbedingte Reaktionen im Zusammenhang mit der Anwendung von MabThera (Rituximab) bei Patienten mit rheumatoider Arthritis. Rote Hand-Brief 05.11.2011. www.akdae.de
- Roche Pharma AG. MabThera® (Rituximab): Hepatitis-B-Virus-(HBV)-Screening vor Behandlungsbeginn. Rote Hand-Brief 11.11.2013. www.akdae.de
- Cohen JA, Baldassari LE, Atkins HL, et al. Autologous Hematopoietic Cell Transplantation for Treatment-Refractory Relapsing Multiple Sclerosis: Position Statement from the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant 2019; 25(5): 845-54. PMID: 30794930 PubMed
- Cohen JA, Barkhof F, Comi G, et al. Oral fingolimode or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402-415. pmid: 20089954 PubMed
- Burt RK, Balabanov R, Burman J, et al. Effect of Nonmyeloablative Hematopoietic Stem Cell Transplantation vs Continued Disease-Modifying Therapy on Disease Progression in Patients With Relapsing-Remitting Multiple Sclerosis: A Randomized Clinical Trial. JAMA 2019; 321:165-74. PMID: 30644983 PubMed
- Muraro PA, Pasquini M, Atkins HL, et al. Long-term Outcomes After Autologous Hematopoietic Stem Cell Transplantation for Multiple Sclerosis. JAMA Neurol 2017; 74: 459-69. PMID: 28241268 PubMed
- Muraro PA, Pasquini M, Atkins HL et al. Long-term Outcomes After Autologous Hematopoietic Stem Cell Transplantation for Multiple Sclerosis. JAMA Neurol Published online February 20, 2017. doi:10.1001/jamaneurol.2016.5867 DOI
- Burman J, Iacobaeus E, Svenningsson A, Lycke J, Gunnarsson M et al. Autologous haematopoietic stem cell transplantation for aggressive multiple sclerosis: the Swedish experience. J Neurol Neurosurg Psychiatry 2014; 85: 1116-21. pmid:24554104 PubMed
- Chataway J, Schuerer N, Alsanousi A, Chan D, MacManus D et al. Effect of high-dose simvastatin on brain atrophy and disability in secondary progressive multiple sclerosis (MS-STAT): a randomised, placebo-controlled, phase 2 trial. Lancet 2014; 383: 2213-21. pmid:24655729 PubMed
- Chitnis T, Arnold DL, Banwell B et al. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis. N Engl J Med 2018; 379: 1017-1027. PMID: 30207920 PubMed
- Müller C. Fingolimod bei Kindern und Jugendlichen. Gilenya erhält Zulassung für schubförmige MS bei Kindern. DAZ.online; Stuttgart 4.12.2018. Download 25.6.2019 www.deutsche-apotheker-zeitung.de
- Gesellschaft für Neuropädiatrie. Pädiatrische Multiple Sklerose. AWMF-Leitlinie Nr. 022-014. S1, Stand 2016 (abgelaufen). www.awmf.org
- Shakespeare D, Boggild M, Young CA. Anti-spasticity agents for multiple sclerosis. Cochrane Database of Systematic Reviews 2003, Issue 4. Art. No.: CD001332. DOI: 10.1002/14651858.CD001332. DOI
- Giovannelli M, Borriello G, Castri P et al. Early physiotherapy after injection of botulinum toxin increases the beneficial effects on spasticity in patients with multiple sclerosis. Clin Rehabil 2007; 21: 331–7. www.ncbi.nlm.nih.gov
- Arbeitskreis Botulinumtoxin e. V. der Deutschen Gesellschaft für Neurologie. Stellungnahme zur Kostenerstattung von Botulinumtoxin bei „Off-Label-Indikationen“ durch die gesetzlichen Krankenkassen. Fassung vom 04.05.2006 www.botulinumtoxin.de
- Allan GM, Finley CR, Ton J et al. Systematic review of systematic reviews for medical cannabinoids. Pain, nausea and vomiting, spasticity, and harms. Canadian Family Physician 2018, 64 (2): e78-e94. www.cfp.ca
- Glaeske G, Muth L (Hrsg.): Cannabis-Report 2020. Bremen 2021. www.socium.uni-bremen.de
- National Institute for Health and Care Excellence. Cannabis-based medicinal products. NICE guideline. 11 November 2019. www.nice.org.uk
- Koppel, BS, Brust JC, Fife T et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2014; 82:1556–1563. PMID: 24778283 PubMed
- Whiting PF, Wolff RF, Deshpande S et al. Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA 2015; 313(24):2456-73. PMID: 26103030 PubMed
- Freeman RM, Adekanmi O, Waterfield MR, Waterfield AE, Wright D, Zajicek J. The effect of cannabis on urge incontinence in patients with multiple sclerosis: a multicentre, randomised placebo-controlled trial (CAMS-LUTS). Int Urogynecol J Pelvic Floor Dysfunct 2006; 17:636-41. pmid:16552618 PubMed
- Stankoff B, Waubant E, Confavreux C, Edan G, Debouverie M, Rumbach L et al. Modafinil for fatigue in MS. Neurology 2005; 64: 1139-43. www.ncbi.nlm.nih.gov
- Goodman AD, Brown TR, Krupp LB, et al. Sustained-release oral fampridine in multiple sclerosis: a randomised, double-blind, controlled trial. Lancet 2009; 373: 732-38. PubMed
- Simpson R, Simpson S, Ramparsad N, et al. Mindfulness-based interventions for mental well-being among people with multiple sclerosis: a systematic review and meta-analysis of randomised controlled trials. J Neurol Neurosurg Psychiatry. 2019. PMID: 31196913. www.ncbi.nlm.nih.gov
- McLoughlin JV, Lord SR, Barr CJ, et al. Dorsiflexion assist orthosis reduces the physiological cost and mitigates deterioration in strength and balance associated with walking in people with multiple sclerosis.. Arch Phys Med Rehabil 2015; 96: 226-32. doi:10.1016/j.apmr.2014.09.005 DOI
- Thomas S, Thomas PW, Kersten P, et al. A pragmatic parallel arm multi-centre randomised controlled trial to assess the effectiveness and cost-effectiveness of a group-based fatigue management programme (FACETS) for people with multiple sclerosis. J Neurol Neurosurg Psychiatry 2013. pmid:23695501 PubMed
- Heine M, van de Port I, Rietberg MB, et al. Exercise therapy for fatigue in multiple sclerosis. Cochrane Database Syst Rev 2015; 9: CD009956. doi:10.1002/14651858.CD009956.pub2 DOI
- Thomas PW, Thomas S, Hillier C, Galvin K, Baker R. Psychological interventions for multiple sclerosis. Cochrane Database Syst Rev 2006 25; (1):CD004431. onlinelibrary.wiley.com
- Dalgas U, Stenager E. Multipel sklerose og fysisk træning. Ugeskr Læger 2005; 167: 1495-9. PubMed
- Khan F, Turner-Stokes L, Ng L, Kilpatrick T. Multidisciplinary rehabilitation for adults with multiple sclerosis. Cochrane Database Syst Rev. 2007; (2): CD006036. onlinelibrary.wiley.com
- Krysko KM, Rutatangwa A, Graves J et al. Association Between Breastfeeding and Postpartum Multiple Sclerosis Relapses A Systematic Review and Meta-analysis. JAMA Neurol 2019. epub 4173. pmid:31816024. www.ncbi.nlm.nih.gov
- Weinshenker BG, Bass B, Rice GPA, et al. The natural history of multiple sclerosis: a geographically based study. 1. Clinical course and disability. Brain 1980; 112: 133-46. PubMed
- Tremlett H, Zhao Y, Devonshire V, UBC Neurologists. Natural history comparisons of primary and secondary progressive multiple sclerosis reveals differences and similarities. J Neurol 2009; 256: 374-81. PMID: 19308306 PubMed
- Myhr KM, Riise T, Vedeler C, Nortvedt MW, Grønning M, Midgard R et al. Disability and prognosis in multiple sclerosis: demographic and clinical variables important for the ability to walk and awarding of disability pension. Multiple Sclerosis 2001; 7: 59-65. PubMed
- Marrie RA, Elliott L, Marriott J, et al. Effect of comorbidity on mortality in multiple sclerosis. Neurology 2015. pmid:26019190 PubMed
- Bundesanstalt für Straßenwesen. Begutachtungsleitlinien zur Kraftfahreignung. Bergisch Gladbach, Stand 2019. www.bast.de
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).