Allgemeine Informationen
- Sofern nicht anders gekennzeichnet, basiert der Artikel auf diesen Referenzen.1-5
Definition
- HIV-Infektion
- chronische Infektion verursacht durch das humane Immundefizienz-Virus (HIV, Human Immunodeficiency Virus)
- AIDS
- Aquired Immunodeficiency Syndrome (erworbenes Immundefizienzsyndrom)
- klinische Symptome einer schweren zellulären Immunschwäche, verursacht durch eine HIV-Infektion
- In den USA und einzelnen anderen Ländern umfasst die AIDS-Definition auch HIV-Infizierte mit einer CD4-Zellzahl (CD4-positive T-Helferzellen) < 200/µl ohne klinische Manifestation einer zellulären Immunschwäche.
- AIDS-definierende Erkrankungen
- opportunistische Infektionen
- bestimmte maligne Erkrankungen
andereAndere schwere klinische Manifestationen, die wahrscheinlich auf eine weit fortgeschrittene HIV-Infektion zurückgeführt werden, deren Pathogenese aber unsicher ist.
- Paradigmenwechsel
- In Ländern mit hohem Durchschnittseinkommen kam es nach Einführung der hochaktiven antiretroviralen Therapie (HAART, kurz ART) 1996 zu einer erheblichen Reduktion der durch HIV-Infektion verursachten Erkrankungen und Todesfälle.
1-2 - Die Erkrankung wird heute als eine chronische Infektion betrachtet.
- Die Lebenserwartung ist bei Patient*innen, die eine adäquate Behandlung erhalten, nahezu normal.
3
- Die Lebenserwartung ist bei Patient*innen, die eine adäquate Behandlung erhalten, nahezu normal.
- Das Vorkommen pulmonaler, kardialer, gastrointestinaler und renaler Erkrankungen, die nicht direkt mit der zugrunde liegenden HIV-Infektion verbunden sind
4-7, ist angestiegen.8-11
- In Ländern mit hohem Durchschnittseinkommen kam es nach Einführung der hochaktiven antiretroviralen Therapie (HAART, kurz ART) 1996 zu einer erheblichen Reduktion der durch HIV-Infektion verursachten Erkrankungen und Todesfälle.
Häufigkeit
Deutschland46-78
- Laut Modellrechnungen lebten im Jahr 2019 in Deutschland rund 90.700 Menschen mit HIV oder AIDS (95-%-KI: 84.900–97.200). Daraus errechnet sich ein Zuwachs von 7 % gegenüber 2015.
- davon noch nicht diagnostiziert: ca. 10.800
- unter antiretroviraler Therapie: ca. 96 % der Menschen mit diagnostizierter HIV-Infektion (80 % im Jahr 2006)
- Infektionswege
- Sex zwischen Männern: ca. 73 %
- heterosexuelle Kontakte: Frauen ca. 10 %, Männer ca. 5 %
- i. v. Drogengebrauch: ca. 11 %
- Bluttransfusionen oder Blutprodukte (überwiegend in den 1980er Jahren): 0,6 %
- prä-, peri- oder postnatale Transmission: 1 %
- Jährlich versterben etwa 500 HIV-Infizierte an den Folgen der Infektion.
- Gesamtzahl der AIDS-Toten seit Beginn der Epidemie: in Deutschland ca. 29.000
- Es kam in 2019 geschätzt zu 2.600 Neuinfektionen, in 2018 waren es 2.500.
- In Deutschland starben in 2019 geschätzt 380 Menschen an AIDS.
International122
- AIDS/HIV-Infektion wurde 1981 entdeckt.
- Weltweit ist HIV/AIDS die Krankheit, die die meisten jungen Erwachsenen tötet.
- Die Epidemie ist in Ländern mit hohem Durchschnittseinkommen stagniert, wächst aber weiterhin in den meisten Entwicklungsländern.
- Prävalenz
139- Laut UNAIDS (gemeinsames Programm der Vereinten Nationen zu HIV/AIDS) hatten 2019 etwa 38 Mio. Menschen eine HIV-Infektion.
- Darunter waren ca. 1,8 Mio. Kinder unter 15 Jahren.
- Ungefähr 70 % der HIV-Infizierten leben in einem Land südlich der Sahara. Dort sind fast 60 % aller Betroffenen weiblich.
- Laut UNAIDS (gemeinsames Programm der Vereinten Nationen zu HIV/AIDS) hatten 2019 etwa 38 Mio. Menschen eine HIV-Infektion.
- Inzidenz
- Jedes Jahr stecken sich mehr als 2 Mio. Personen an.
- Übertragung von HIV von der Mutter auf ihr Kind
- Das Risiko variiert von 15–35 %, wenn keine antivirale Behandlung erfolgt.
14 - ART (antiretrovirale Therapie) während der Schwangerschaft reduziert das Übertragungsrisiko für das Kind auf ca. 1 %.
15 - Falls während der Schwangerschaft keine Behandlung erfolgte, verringern ART bei der Mutter (nach der Geburt) und/oder eine vorbeugende Behandlung des Neugeborenen das Erkrankungsrisiko deutlich.
16
- Das Risiko variiert von 15–35 %, wenn keine antivirale Behandlung erfolgt.
- Sterblichkeit
- 2019 lag die geschätzte Zahl der Todesfälle aufgrund von AIDS weltweit bei 690.000.
Ursache und Krankheitsentwicklung
- Infektion mit HIV, dem humanen Immundefizienz-Virus
- HIV ist ein Retrovirus.
- Es gibt 2 Haupttypen: HIV-1 und -2.
- Fast alle HIV-Infektionen in Deutschland werden durch HIV-1 verursacht.
- HIV-2 ist überwiegend in Westafrika verbreitet.
- In Deutschland machen HIV-2-Infektionen nur ca. 0,5 % aller Neudiagnosen aus.
61 - Ein Großteil aller verfügbaren Leitlinien und Studien zur HIV-Infektion betreffen HIV-1 und sind nicht ohne Weiteres auf HIV-2-Infektionen übertragbar.
17
- Subtypen
61- Beim Menschen werden mittlerweile 9 Subtypen von HIV-1 in der Gruppe M und mindestens 15 breiter zirkulierende rekombinante Formen (CRF) unterschieden.
- Darüber hinaus gibt es von HIV-1 noch eine Gruppe O (Outlier), weitgehend beschränkt auf Westafrika (Kamerun).
- Zuletzt wurden die sehr selten vorkommenden Gruppen N- und P-Viren beschrieben.
- CD4
- CD4-Antigene auf der Oberfläche der T-Lymphozyten fungieren als Rezeptoren, an denen das HI-Virus andockt.
- Virustranskription
- Erfolgt in den T-Lymphozyten.
- Das Genmaterial des Virus wird vom Genmaterial der Zellen inkorporiert, wo es lange Zeit inaktiv verbleiben kann.
- In immunologisch inaktiven Zellen kann eine kontinuierliche Reproduktion des Virus stattfinden.
- Von dort wird das Virus freigesetzt und infiziert neue Zellen.
- Akute HIV-Infektion
- meist nach 4–6 Wochen
- massenhafte Freisetzung von Viruskopien
- kurzfristige, vorübergehende Verminderung der CD4-Zellzahl
- erstmalig messbare spezifische Immunantwort gegen HIV (Serokonversion)
- Die Latenzzeit von der Ansteckung bis zur Entwicklung von Symptomen aufgrund einer geschwächten Immunabwehr kann weniger als 1–2 Jahre betragen. Der Durchschnitt liegt aber bei 7–12 Jahren.
- Selten können HIV-Infektionen dauerhaft asymptomatisch verlaufen.
- Nach einer Serokonversion bleiben HIV-Antikörper bis zum Lebensende nachweisbar.
- Progression: nachlassende Immunität durch kontinuierliche Reduktion von T-Helferzellen
- Da die T-Helferzellen eine Schlüsselfunktion bei der Aktivierung anderer Immunzellen haben, kommt es zu einer Beeinträchtigung der gesamten Immunfunktion.
- Klinisch führt dies zu einer erhöhten Infektionsneigung.
- Bei einer fortgeschrittenen Immunschwäche (AIDS) entwickeln sich lebensbedrohliche opportunistische Infektionen, und es erhöht sich das Risiko, an Krebs zu erkranken.
Übertragung von HIV
Übertragungswege
- Sexueller Kontakt
- Infiziertes Blut oder Blutprodukte, die in den Blutkreislauf gelangen.
- Gewebs- und Organtransplantationen
- perinatale Übertragung von der Mutter auf ihr Kind
Alle Körperflüssigkeiten
- In Blut, Samenflüssigkeit, Vaginalsekret und auf der Oberfläche der Darmschleimhaut finden sich in der Regel die höchsten Viruskonzentrationen bei HIV-Infizierten.
- In anderen Körperflüssigkeiten ist HIV in deutlich niedrigeren Konzentrationen vorhanden, sodass Übertragungen zwar theoretisch denkbar, bisher aber nicht beschrieben sind.
- Akzidentelle, berufsbedingte HIV-Übertragungen sind bisher nur durch Kontakt mit Blut oder Viruskulturflüssigkeit dokumentiert.
- HIV wird nicht durch Tröpfcheninfektion übertragen.
Ansteckungsrisiko
- Ist während der ersten 3 Monate nach der Ansteckung und während der AIDS-Phase am größten.
- Korreliert mit der Viruslast und der Dauer der Exposition.
- Das Ansteckungsrisiko bei ungeschütztem Geschlechtsverkehr mit HIV-infizierten Partner*innen kann nicht im Einzelfall bestimmt werden. Das Risiko ist aber grundsätzlich niedrig.
- Das Risiko ist höher, wenn HIV-Infizierte eine hohe Viruslast haben, wenn die Partner*innen eine venerische Erkrankung haben und wenn die nichtinfizierte Person die empfangende ist.
- Wenn die infizierten Partner*innen nicht medikamentös behandelt werden, ist das Ansteckungsrisiko pro ungeschütztem Geschlechtsverkehr wahrscheinlich nicht größer als 0,1 % oder geringer (weniger als 1 pro 1.000).
-
- Wenn die infizierte Person behandelt wird, ist das Risiko noch geringer.
- Bei stabiler Senkung der Viruslast unter 50 Kopien/ml ist eine HIV-Übertragung unwahrscheinlich.
183
- Das Ansteckungsrisiko ist erheblich höher bei Schleimhautläsionen und bei einer begleitenden sexuell übertragbaren Krankheit.
- Die Transmissionsrate ist bei empfangendem analem Geschlechtsverkehr größer als bei insertivem Analsex.
- Siehe Tabelle Ansteckungsrisiko unbehandelter HIV-positiver Personen.
- Es wird angenommen, dass bei vaginalem Geschlechtsverkehr das Ansteckungsrisiko vom Mann auf die Frau größer ist als von der Frau auf den Mann.
- Das Verwenden derselben Injektionsnadel zum i. v. Gebrauch illegaler Drogen geht mit einem sehr hohen Risiko für eine HIV-Übertragung einher.
- Stichverletzung unbeteiligter Personen durch herumliegendes, gebrauchtes Injektionsbesteck
- Das HIV-Übertragungsrisiko ist dabei vermutlich gering, weil an den Kanülen nach dem Gebrauch nur geringe Blutmengen anhaften, die zudem meistens getrocknet sind.
- Trotz zahlreicher Expositionen, vor allem von Kleinkindern, die sich an Kanülen im Sandkasten verletzen oder mit Klinikabfall, gibt es bislang noch keinen einzigen dokumentierten Fall einer HIV-Transmission.
Mutter-Kind-Übertragung
- Das Übertragungsrisiko korreliert mit der Viruslast im Blut der Mutter, dem Krankheitsstadium und dem Geburtsmodus.
19-22 - Die Übertragung von der infizierten Mutter auf ihr Kind geschieht in den meisten Fällen kurz vor oder bei der Geburt oder über die Muttermilch.
23 - Die Behandlung mit einer antiretroviralen Therapie verringert die Ansteckungsgefahr.
24 - Wenn die Viruslast bei der Mutter auf < 50 Viruskopien pro ml Plasma gesenkt wurde, liegt das Risiko bei einer vaginalen Geburt unter 1 %.
25 - Bei höherer Viruslast führt die elektive Sectio zu weniger vertikalen Übertragungen als die vaginale Geburt
(Ib).26 - Das Stillen ist nachweislich ein Risikofaktor für die HIV-Übertragung
27, der aber durch die antiretrovirale Behandlung verringert werden kann.15,2810
Bluttransfusion
- HIV-Übertragungsrisiko bei infizierter Transfusion: 90–100 %
- Nach Einführung des direkten Genomnachweises für HIV im Jahr 2004 sind nur noch 2 HIV-Übertragungen (2007 und 2010) bekannt geworden, bei mehr als 4 Mio. Transfusionen/Jahr.
2911
Medizinisches Personal und HIV
- Der Stich mit einer infizierten Nadel hat ein Übertragungsrisiko von 0,3 %. In den meisten Fällen ist das Risiko sogar geringer.
30 - Serokonversionen nach Schleimhaut- oder Hautkontakt mit HIV-positivem Blut sind beschrieben, jedoch insgesamt bei intakter Haut sehr unwahrscheinlich.
3112- Für die Übertragung scheinen dabei die Blutmenge, der lang andauernde Blutkontakt sowie die nichtintakte Hautbarriere entscheidend gewesen zu sein.
- Die Behandlung mit antiretroviralen Mitteln unmittelbar nach der Exposition kann das Übertragungsrisiko um wahrscheinlich über 80 % reduzieren.
ICPC-2
- B90 HIV-Infektion/AIDS
ICD-10
- Der gesamte Abschnitt basiert auf dieser Referenz.
3213 - B20 Infektiöse und parasitäre Krankheiten infolge HIV-Krankheit [Humane Immundefizienz-Viruskrankheit]
- B21 Bösartige Neubildungen infolge HIV-Krankheit [Humane Immundefizienz-Viruskrankheit]
- B22 Sonstige näher bezeichnete Krankheiten infolge HIV-Krankheit [Humane Immundefizienz-Viruskrankheit];
inclinkl.:- Demenz
- Enzephalopathie
- Interstitielle lymphoide Pneumonie
- Kachexie-Syndrom
- Slim disease
- Wasting-Syndrom
- B23 Sonstige Krankheitszustände infolge HIV-Krankheit [Humane Immundefizienz-Viruskrankheit]
- B23.0 Akutes HIV-Infektionssyndrom
- B23.8 Sonstige näher bezeichnete Krankheitszustände infolge HIV-Krankheit; (Persistierende) generalisierte Lymphadenopathie
- B24 Nicht näher bezeichnete HIV-Krankheit [Humane Immundefizienz-Viruskrankheit]; incl.:
- AIDS-related complex [ARC] o.n.A.
- Erworbenes Immundefektsyndrom [AIDS] o.n.A.
- Z21 Asymptomatische HIV-Infektion [Humane Immundefizienz-Virusinfektion]; incl. HIV-positiv o.n.A.
- O98.7 HIV-Krankheit [Humane Immundefizienz-Viruskrankheit], die Schwangerschaft, Geburt und Wochenbett kompliziert
- Z20.6 Kontakt mit und Exposition gegenüber HIV [Humanes Immundefizienz-Virus]
- R75 Laborhinweis auf Humanes Immundefizienz-Virus [HIV]; incl.: Nicht eindeutiger Befund des HIV-Tests beim Kleinkind
Diagnostik
Diagnostik der HIV-Infektion
- Der gesamte Abschnitt basiert auf diesen Referenzen.
61,3314 - Die Diagnostik der HIV-Infektion stützt sich auf den Nachweis spezifischer Antikörper in Kombination mit dem Nachweis von Virusantigen oder viralen Nukleinsäuren (Zweistufendiagnostik mit Such- und Bestätigungstest).
- Spezifische Antikörper sind im Durchschnitt nach 22 Tagen bei einer infizierten Person nachweisbar und Virusantigen bereits nach 16–18 Tagen.
- Schnelltests sind weniger empfindlich als moderne Labortests, sie reagieren 1–2 Wochen später.
3415 - Virale Nukleinsäuren können im Durchschnitt schon nach 11 Tagen diagnostiziert werden.
- Ein sicherer Ausschluss erfordert jedoch deutlich längere Zeiträume als die genannten Mittelwerte.
- Bei Verwendung einer Zweistufendiagnostik, die im Suchtest allein auf dem Nachweis von HIV-Antikörpern beruht (ELISA 3. Generation), ist daher noch immer ein 12-Wochen-Zeitfenster festgelegt, um eine HIV-Infektion sicher zu diagnostizieren oder auszuschließen.
- Werden moderne Suchtests der 4. Generation verwendet, die neben Antikörpern auch HIV-Antigene nachweisen, ist ein sicherer Nachweis in der Regel schon nach max. 6 Wochen möglich.
- Damit gilt auch, dass 6 Wochen nach möglicher Exposition durch ein negatives Ergebnis im HIV-Antikörper-/Antigen-Suchtest der 4. Generation eine Infektion mit großer Sicherheit ausgeschlossen werden kann (keine spezifischen Antikörper oder p24-Antigen nachweisbar).
HIV-Test als Kassenleistung?3516
- Bei konkretem Verdacht auf eine HIV-Exposition (Näheres siehe Abschnitt Therapie nach HIV-Exposition – Sofortmaßnahmen) oder -Infektion, z. B.:
- geplatztes Kondom
- Verletzung mit einer potenziell infizierten Kanüle
- risikoreiches Sexualverhalten
- Patient*innen gehören einer Risikogruppe an.
- potenzielle Frühsymptome einer HIV-Infektion, z. B. Hautveränderungen.
- Im Rahmen der Schwangerschaftsvorsorge
- Ein breites HIV-Screening der Bevölkerung auf Kassenkosten ist derzeit nicht möglich (Stand November 2020).
- Zugunsten der Früherkennung von HIV-Infektionen werden aber Grenzfälle in der Regel großzügig gehandhabt und ein Regress ist nicht zu befürchten.
- Patientenaufklärung
- Wenn der Test über die Krankenversicherung abgerechnet wird, werden personenbezogene Daten an die Versicherung weitergegeben.
- Wünschen die Patient*innen eine anonyme Testung, dann tragen sie die dabei anfallenden Kosten (ca. 20–30 €) in der Regel selbst.
- Für Menschen, die die Kosten für einen anonymen HIV-Test nicht selbst aufbringen können, bieten die AIDS-Hilfe und viele Gesundheitsämter kostenlose Tests an.
- Selbsttests
3617- Seit 2018 bieten Apotheken und manchen Drogerien frei verkäufliche Selbsttests an. Die Sensitivität der empfohlenen Tests ist nahe 100 % und ähnlich hoch wie bei laborgestützten ELISA-Tests.
- Vorteil: Anonymität schafft Niederschwelligkeit und erhöht damit möglicherweise die Erkennungsrate.
- Nachteil: Es fehlt die fachliche und menschliche Begleitung, einschließlich einer kompetenten ärztlichen Beratung vor dem Test, bei der Vermittlung eines – evtl. auch falsch – positiven Testergebnisses und bei der Aufklärung über das weitere Vorgehen.
- Cave: Qualitätsmängel bei manchen Tests! Von der Deutschen AIDS-Hilfe empfohlene Selbsttest-Kits (Stand November 2020):
- Autotest-VIH, Hersteller: AAZ/Ratiopharm
- INSTI HIV Self Test, Hersteller: biolytica
- Exacto, Hersteller: BioSynex.
Zweistufendiagnostik
- 1. Schritt: hochsensitiver Antikörper-Suchtest
- z. B. ELISA, auf Antikörper gegen virale Antigene (HIV-1 und -2) und/oder virales p24-Antigen
- 2. Schritt: hochspezifischer Bestätigungstest
- In seltenen Fällen kann es im Suchtest zu unspezifischen Reaktionen kommen. Daher wird mit einem zweiten, hochspezifischen Test, dem Immunoblot, die Spezifität der Bindung der Antikörper an die viralen Proteine (Antigene) geprüft.
- Zur Bestätigung eines reaktiven ELISA durch den Immunoblot genügt nicht der Nachweis eines einzigen viralen Proteins, sondern es ist immer ein definiertes Reaktionsmuster erforderlich, anhand dessen erst die Diagnose einer HIV-Infektion gestellt werden kann.
- In seltenen Fällen kann es im Suchtest zu unspezifischen Reaktionen kommen. Daher wird mit einem zweiten, hochspezifischen Test, dem Immunoblot, die Spezifität der Bindung der Antikörper an die viralen Proteine (Antigene) geprüft.
HIV-Nukleinsäureamplifikationstest (NAT)
- Nachweis viraler Nukleinsäuren, z. B. via PCR
- Alternative zur Bestätigung eines positiven Suchtestes im Immunoblot
- Voraussetzung: Viruslast ≥ 1.000 Kopien/ml
- 2. Probe zum Ausschluss einer Probenverwechslung empfohlen
- Auch wenn das Ergebnis im Immunoblot nicht eindeutig ist, kann zur weiteren Abklärung ein NAT durchgeführt werden.
Zweite Blutprobe
- Generell sollte zum Ausschluss einer Probenverwechslung immer eine 2. Blutprobe getestet werden.
- Zur endgültigen Abklärung der Diagnose, wenn durch den NAT eine Infektion nicht zu bestätigen ist.
- Blutabnahme nach 1–3 Wochen
- Frische Infektion: Ein noch unvollständig ausgebildetes Bandenmuster im Immunoblot zeigt bei Wiederholung der Untersuchung 1 bis mehrere Wochen später ein eindeutiges Bandenmuster und damit eine abgeschlossene Serokonversion.
- Bei begründetem Verdacht auf eine kürzlich erworbene HIV-Infektion mit noch negativem oder unklarem Ergebnis im ELISA der 4. Generation, aber mit positivem NAT-Ergebnis (in der Regel > 100.000 Kopien/ml) sollte vor Beginn einer ART das positive NAT-Ergebnis in einer 2. Blutentnahme bestätigt werden.
-
HIV-Diagnose bei einem Neugeborenen
- Der Antikörpertest ist wegen mütterlicher Antikörper nicht aussagekräftig.
-
vor Therapiebeginn: Bestätigung eines positiven NAT-Ergebnisses anhand einer 2. Blutentnahme bei Neugeborenen
Differenzierung HIV-1 und -2
- Typspezifische Immunoblots
- Kreuzreaktivitäten können die Differenzialdiagnose erschweren.
- evtl. typspezifische PCR zur weiteren Abklärung
Negativer Test oder niedriges Signal
- Die verfügbaren kommerziellen NAT haben nicht dieselbe Sensitivität für alle bekannten HIV-1-Gruppen und -Subtypen. Dies kann zu erniedrigten oder falsch-negativen Testergebnissen führen.
- Bei niedriger oder nicht nachweisbarer Viruslast im reaktivem Suchtest:
- HIV-2?
- Andere, noch seltenere Virusvarianten?
- Bislang ist noch kein kommerzieller NAT-Test für HIV-2 verfügbar.
- Negative NAT-Ergebnisse: Absicherung durch serologische Untersuchungen
-
Falls serologisch der Verdacht auf eine HIV-2-Infektion besteht, kann in
virolovirologischen Speziallaboren eine HIV-2-NAT zur Diagnose einer HIV-2-Infektion zusätzlich zur serologischen Untersuchung herangezogen werden.
-
Diagnostik von AIDS
- Die AIDS-Diagnose wird in den meisten Ländern außerhalb Nordamerikas klinisch aufgrund des Auftretens opportunistischer Infektionen, bestimmter Malignomtypen oder anderer klinischer Manifestationen bei fortgeschrittener HIV-Infektion gestellt.
Diagnostik opportunistischer Infektionen
- Evtl. seltene Keimspezies
- Oft Reaktivierung latenter Infektionen
- Antikörperuntersuchungen sind wenig aussagekräftig, weil die Patient*innen Antikörper einer früheren Infektion tragen könnten und die Fähigkeit, neue Antikörper zu bilden, vermindert ist.
- Zur Diagnosestellung muss der Erreger in einer Biopsie oder anderen Materialien direkt nachgewiesen werden, evtl. mithilfe von Spezialfärbung oder PCR-Technik.
Klinische Stadien einer HIV-Infektion
- Der gesamte Abschnitt basiert auf diesen Referenzen.
37-383,18 DieErdembezieht sich auf die 1993 von der US-amerikanischenGesundheitsministerium unterstellte BehGesundheitsbehördeCDC(Centers for Disease Control and Prevention (CDC)definiertevorgestellte1993 die klinischen Stadien einer HIV-Infektion. Diese Klassifikation ist international anerkannt und wird u. a. auch in den deutschsprachigen Leitlinien18als Grundlage für die Indikationsstellung zur ART verwendetStadieneinteilung.
Klinisches Stadium CDC-A
- Asymptomatische Infektion
- Umfasst sowohl Patient*innen, die eine symptomatische Primärinfektion hatten, als auch Erkrankte, bei denen die Infektion zu Beginn subklinisch ist.
- Kann 10–20 Jahre andauern, gelegentlich sogar länger.
- Persistierende, generalisierte Lymphadenopathie
- Besteht bei Lymphknoten > 1 cm Durchmesser an 2 oder mehreren extrainguinalen Stellen, für einen Zeitraum von mindestens 3 Monaten.
- Kann bei ca. 30 % der Betroffenen festgestellt werden.
- Hat keine Bedeutung für die Prognose.
- Akute HIV-Infektion
34,39-4015- Symptome treten 2–6 Wochen nach der Übertragung auf und dauern meist 1–2 Wochen an.
- Die Infektion ist bei ca. 50 % symptomatisch.
- 80–90 % dieser Patient*innen haben Fieber, meist 2–4 Wochen nach der Übertragung.
- Bei ca. 40 % tritt ein unspezifisches makulopapulöses Hauterythem auf.
- häufig Halsschmerzen mit zervikaler Lymphadenopathie
- evtl. Ulzera der Mundschleimhaut
- Krankheitsgefühl und Abgeschlagenheit
- Gelenk- und Muskelschmerzen
- Appetit- und Gewichtsverlust
- Das Krankheitsbild ähnelt klinisch einer schwachen Mononukleose.
Klinisches Stadium CDC-B
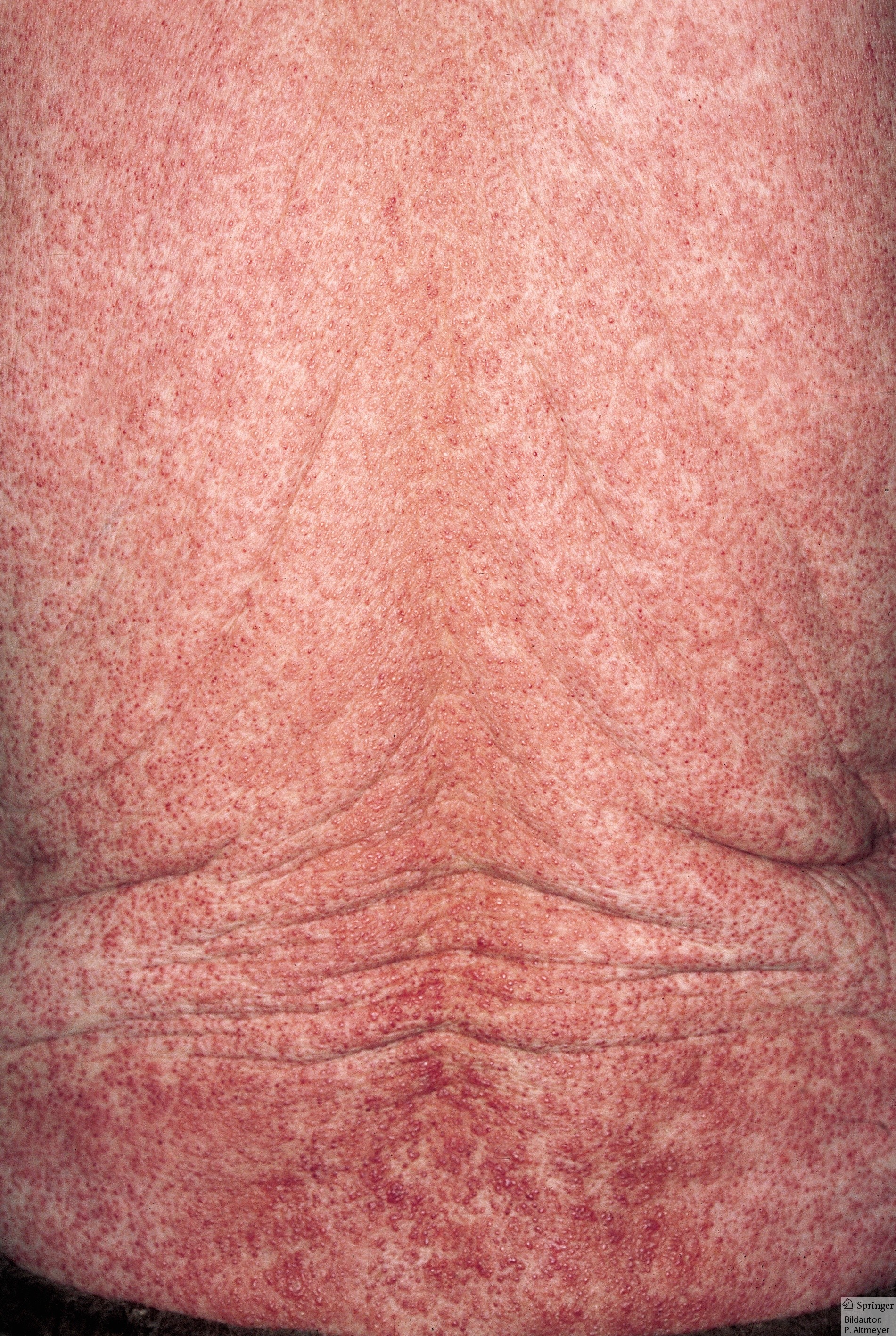
Bazilläre Angiomatose (Quelle: P. Altmeyer)
- Krankheitssymptome oder Erkrankungen, die nicht in die AIDS-definierende Kategorie C fallen, dennoch aber der HIV-Infektion ursächlich zuzuordnen sind oder auf eine Störung der zellulären Immunabwehr hinweisen.
- bazilläre Angiomatose (Bartonellen)
- oropharyngeale Kandida-Infektion
- vulvovaginale Kandida-Infektionen, die entweder chronisch (länger als 1 Monat) oder nur schlecht therapierbar sind.
- Zervixdysplasien oder Carcinoma in situ
- konstitutionelle Symptome, z. B.:
- orale Haarleukoplakie (weiße, streifige Plaques, vor allem am Zungenrand)
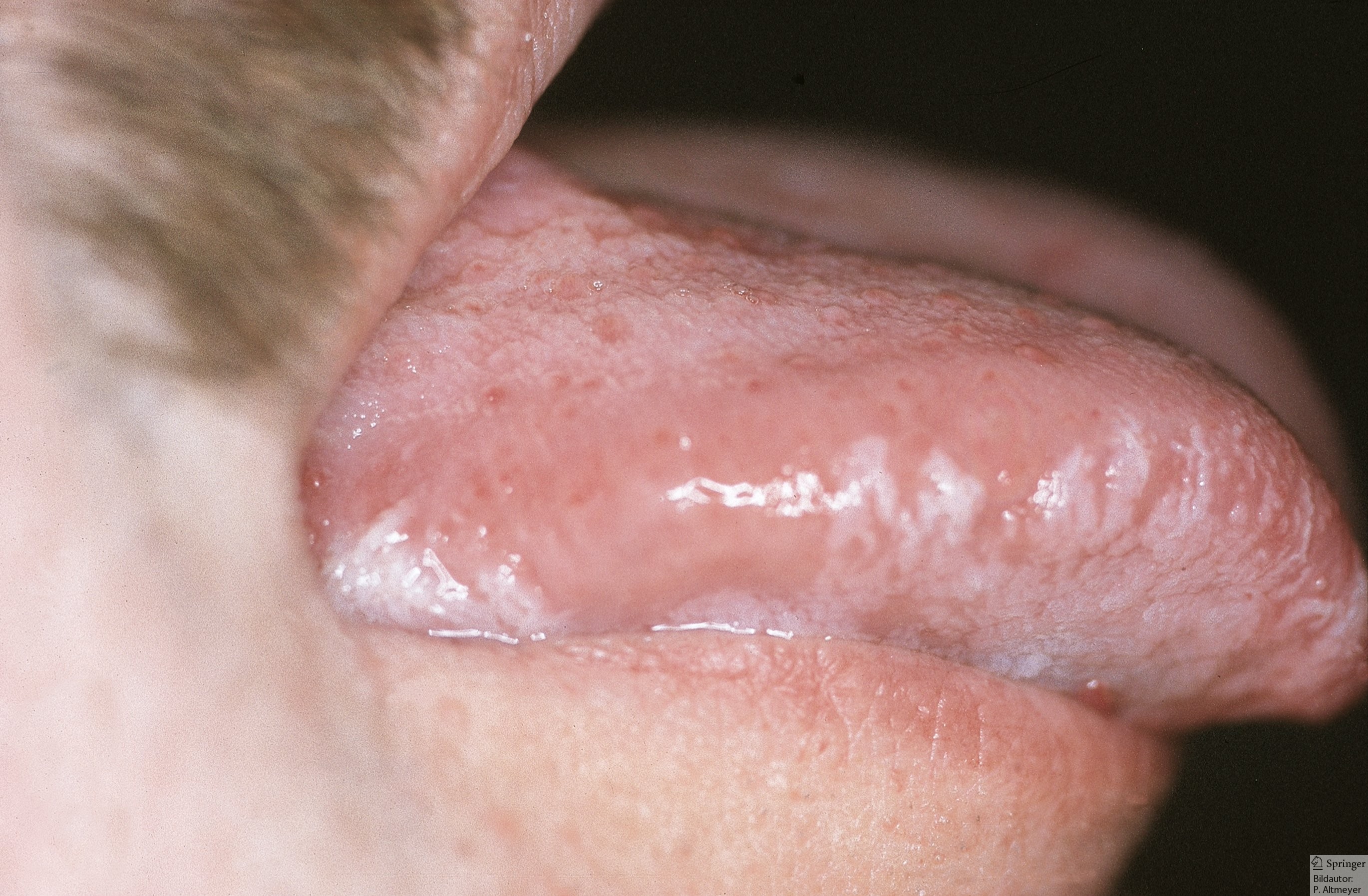 Orale Haarleukoplakie (Quelle: P. Altmeyer)
Orale Haarleukoplakie (Quelle: P. Altmeyer) - Zoster (≥ 2 Episoden oder ≥ 2 Dermatome)
- primäre Immunthrombozytopenie (früher: idiopathische thrombozytopenische Purpura)
- Listeriose
- Entzündungen weiblicher Unterleibsorgane (z. B. Adnexitis), besonders bei Komplikationen eines Tuben- oder Ovarialabszesses
- periphere Neuropathie
Klinisches Stadium CDC-C (AIDS-definierende Erkrankungen)
- Pneumocystis-jirovecii-Pneumonie
- Toxoplasma-Enzephalitis
- Ösophageale Kandida-Infektion oder Befall von Bronchien, Trachea oder Lunge
- Chronische Herpes-simplex-Ulzera oder Herpes-Bronchitis, -Pneumonie oder -Ösophagitis
- CMV-Retinitis
- Generalisierte CMV-Infektion (nicht von Leber oder Milz)
- Rezidivierende Salmonellen-Septikämien
- Rezidivierende Pneumonien innerhalb eines Jahres
- Extrapulmonale Kryptokokken-Infektionen
- Chronische intestinale Kryptosporidien-Infektion
- Chronische intestinale Infektion mit Isospora belli (Isosporose)
- Disseminierte oder extrapulmonale Histoplasmose
- Tuberkulose
- Infektionen mit Mykobakterium avium complex oder M. kansasii, disseminiert oder extrapulmonal
- Kaposi-Sarkom
- Malignom der Haut
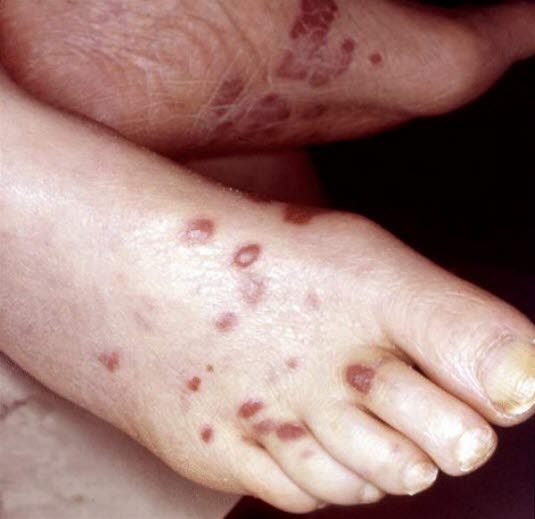 Kaposi-Sarkom
Kaposi-Sarkom - aus Spindelzellen, vaskulärem Gewebe und Plasmazellen
- Wird auf eine Infektion mit dem humanen Herpesvirus 8 zurückgeführt.
- Malignom der Haut
- Maligne Lymphome (Burkitt's, immunoblastisches oder primär zerebrales Lymphom)
- Invasives Zervixkarzinom
- HIV-Enzephalopathie
- Progressiv multifokale Leukenzephalopathie
- Wasting-Syndrom
- ungewollte Gewichtsabnahme von mindestens 10 %
- persistierende Diarrhöen oder Fieber
Laborstadien einer HIV-Infektion
- Nach CDC-Klassifikation von 1993
Fieber18- CDC-1: CD4-Lymphozyten ≥500/µl
- CDC-2: CD4-Lymphozyten 200–499/µl
- CDC-3: CD4-Lymphozyten <200/µl
Differenzialdiagnosen
- Tonsillitis, Pharyngitis und Mononukleose bei akuter Infektion
- Andere Ursachen einer Immunschwäche
- Tuberkulose
Anamnese
- Fieber?
- Halsschmerzen?
- Aphthen der Mundschleimhaut?
- Zervikale Lymphadenitis?
- Evtl. makulopapulöses Exanthem?
- Persistierende Lymphknotenschwellung?
- Krankheitsgefühl und Abgeschlagenheit?
- Kopfschmerzen?
- Gelenk- und Muskelschmerzen?
- Appetit- und Gewichtsverlust?
- Im weiteren Verlauf: Allgemeinsymptome und Symptome aus verschiedenen Organsystemen als Folge der Immunschwäche
- Ungeschützter Sex?
- Partner*innen mit unbekanntem HIV-Status?
- Häufig wechselnde Partner*innen?
- Fernreisen?
- Risikoverhalten unter Drogeneinfluss?
- Partner*in HIV-positiv: ART? Virämie? CD4-Zellzahl?
- Medizinischer Beruf: Potenzielle Exposition in der Vergangenheit?
- Nadelstichverletzung?
- Kontakt der Schleimhaut oder einer Hautläsion mit potenziell infiziertem Material?
- Transfusion von Blut oder Blutprodukten?
- Vor 2004?
- Chirurgische Eingriffe unter unzureichenden hygienischen Bedingungen?
- Zeitlicher Abstand zu möglicher Exposition?
- Letzter HIV-Test: Bei Patient*innen und Partner*innen?
Klinische Untersuchung
Akute HIV-Infektion
- Symptome der akuten Infektion treten in der Regel 2–4 Wochen nach der Übertragung auf.
- Fieber?
- Halsentzündung und zervikale Lymphadenopathie?
- Läsionen der Mundschleimhaut?
- Hautveränderungen?
- Hinweise auf Drogenkonsum?
Latenzphase
- Kann sich über 10–30 Jahre oder länger erstrecken.
- In der ganzen Zeit besteht eine aktive Virusreplikation mit schrittweiser Reduktion von CD4-Zellen (T-Helfer-Zellen).
- Persistierende Lymphknotenschwellung?
- Häufige Zufallsbefunde: Neutropenie, Thrombozytopenie, Hypergammaglobulinämie (bes. IgG und IgA) und erhöhte BSG oder CRP
- Hautveränderungen wie bei einer seborrhoischen Dermatitis, Psoriasis und Follikulitis?
- Die Latenzphase kann auch ganz ohne klinische Symptomatik oder auffällige Laborbefunde verlaufen.
Entwicklung der Immunschwäche
- Orale Candidiasis
- Rezidivierende vaginale Candidiasis, Nachweis einer Zervixdysplasie oder eines Zervixkarzinoms
- Fieber, Gewichtsverlust, Diarrhö, neu aufgetretene Malabsorption
- Anhaltender Husten, Bronchitis, Dyspnoe, Pneumonien
- Enzephalitis/Enzephalopathie
- Krampfanfälle?
- Kognitive Defizite?
- Neuropathie
- Schmerzen?
- Sensible Ausfälle?
- Schluckbeschwerden
- Rezidivierende anhaltende symptomatische Episoden einer Herpes-simplex-Infektion (Herpes labialis oder Herpes genitalis)
- Rezidivierender Zoster
- Kaposi-Sarkom
- Lymphknotenschwellung
- Lymphom, Tuberkulose oder atypische Mykobakterien
- Retinitis: Sehstörungen?
Orale Manifestationen
- Symptome einer HIV-Infektion treten häufig in der Mundhöhle auf.
- Aphthen
- Gingivitis
- Stomatitis
- nekrotisierende Parodontitis
- Haarleukoplakie (EBV-assoziiert)
- orale Candidiasis
- Orale Symptome können frühe Zeichen einer HIV-Infektion, aber auch einer Verschlechterung der HIV-Infektion sein.
Nicht AIDS-definierende Erkrankungen
- Bei HIV-Positiven mit einer CD4-Zahl über 350/µl besteht eine erhöhte Krankheitsanfälligkeit gegenüber nicht-AIDS-definierenden Erkrankungen.
41 - Es wird angenommen, dass die hohe Frequenz der Virusreplikationen die lokale Immunität schwächt und die Erkrankungswahrscheinlichkeit erhöht. Dies gilt für:
- verschiedene Malignomarten
- Bronchialkarzinom
- Analkarzinom
- Hodgkin-Lymphom
- Malignome im HNO-Bereich
- Nephropathie
- kardiovaskuläre Erkrankungen.
- verschiedene Malignomarten
- Es wird empfohlen, das Risiko für diese Krankheiten bei der Indikationsstellung zur antiviralen Behandlung zu berücksichtigen.
4119
Ergänzende Untersuchungen in der Hausarztpraxis
- HIV-Test anbieten bei:
- sexuellem Risikoverhalten
- i. v. Drogenkonsum
- anderen sexuell übertragbaren Krankheiten
- HIV-positiven Partner*innen
- Herkunft aus Ländern mit hoher HIV-Prävalenz
- Auch den Partner*innen HIV-Tests anbieten.
- besonders nach chirurgischen Eingriffen unter unzureichender Asepsis
- Schwangerschaft
- Mutter, die bei der Geburt HIV-positiv ist.
- Ein HIV-Test erfordert immer eine vorherige Aufklärung und Einverständniserklärung der Patient*innen.
- Ablauf der HIV-Testung siehe Abschnitt Blutprobennahme nach HIV-Exposition
- Lymphozytenuntersuchung mit Zählung der T-Lymphozyten (CD4-Zellen)
- HIV-RNA quantitativ
- Ggf. Untersuchung von Genitale und Rektum
- Entzündung?
- Kandidose?
- Herpes?
- Kondylome?
- Drogenscreening?
- Gewicht
- Körpergröße
- Blutdruck
Diagnostik bei Spezialist*innen
- Der Nachweis von opportunistischen Mikroorganismen kann häufig direkt aus der Biopsie oder aus anderem Material erfolgen.
- Häufig bedarf es Spezialuntersuchungen, die nur von wenigen Labors durchgeführt werden.
Probennahme
- Bestätigungstest und Resistenz
- CD4-Zellen und HIV-RNA
- Hb
- Differenzialblutbild
- Bilirubin, GPT, AP, CK
- Ca
- Kreatinin, GFR
- Glukose und HbA1C
- Gesamtcholesterin, LDL, HDL und Triglyzeride
- Serologie
- Tuberkulose
- Tuberkulin-Hauttest (THT) oder Interferon-Gamma Release Assay (IGRA)
- Urinstatus
- Evtl. Drogenscreening
Weitere Tests
- Genital- und Anal-Abstriche
61- Chlamydien (Frauen/Männer) und Gonokokken
- evtl. HPV
- Zervixzytologie
- hohes Risiko für eine HPV-Infektion und damit erhöhtes Vorkommen einer zervikalen Neoplasie
- Bei Frauen und Männern, die Sex mit Männern haben:
-
- Vorsorgeuntersuchung auf rektale Dysplasien (siehe Artikel Analkarzinom)
- Tuberkulose-Abklärung
61
- IGRA ist spezifischer als THT.
- HIV-Infektion erschwert die TB-Erkennung.
- Eine HIV-Infektion kann die Sensitivität und Spezifität beider Tests beeinträchtigen, besonders bei geringer CD4-Zellzahl (Anergie). Ein negatives Testergebnis schließt daher eine tuberkulöse Infektion nicht sicher aus.
- häufig extrapulmonale Formen der TB, besonders bei niedrigen CD4-Zellzahlen
- Auch bei pulmonaler TB sind Symptombild und radiologische Befunde oft untypisch oder sogar unauffällig.
- positives Testergebnis
- Nach Ausschluss einer aktiven Organtuberkulose sollte eine präventive medikamentöse Therapie, in der Regel mit Isoniazid (INH) angeboten werden.
- aktive TB
- antituberkulöse Kombinationstherapie in Abhängigkeit von der Medikamentensensibilität der Erreger
- Nach Initiierung einer ART kann es bei gleichzeitiger Erkrankung an TB zu einem Immune Reconstitution Inflammatory Syndrome (IRIS) und damit zu einer klinischen Verschlechterung der TB kommen.
- EKG
- Eine Basisuntersuchung ist wünschenswert, weil mit der antiretroviralen Behandlung kardiovaskuläre Risiken verbunden sind.
- Atazanavir kann das PR-Intervall verlängern.
- Rö
ntgenthoraxntgen-Thorax- Ist wünschenswert aufgrund des Risikos für zahlreiche HIV-bedingte Komplikationen, die sich als Lungenerkrankung manifestieren können.
Indikationen zur Überweisung/Klinikeinweisung
- Personen mit einem positiven HIV-Test sollten schnellstmöglich an eine infektionsmedizinische Abteilung überwiesen werden, die Erfahrung mit der Diagnostik und Behandlung von HIV-Patient*innen hat.
Therapie
- Die folgenden Empfehlungen beziehen sich ausschließlich auf die Behandlung von Infektionen mit HIV-1. Einige Medikamente sind bei HIV-2-Infektionen weniger wirksam. Eine HIV-2-Infektion sollte immer an einem spezialisierten Zentrum behandelt werden.
183
Therapieziele
- Das primäre Ziel ist, das krankheitsfreie Überleben zu erhöhen bei maximaler Hemmung der Virusreplikation und Bewahrung der immunologischen Funktion.
- Das biochemische Ziel der Behandlung ist, den Virus-RNA-Spiegel unter die Nachweisgrenze (ca. 20 Viruskopien/ml) zu bringen.
- Der Entwicklung von komplizierenden opportunistischen Infektionen vorbeugen.
- Komplizierende Erkrankungen behandeln.
- Ansteckung anderer Personen vermeiden.
Allgemeines zur Therapie
- Die Behandlung ist anspruchsvoll und sollte von entsprechend spezialisierten Ärzt*innen durchgeführt werden.
- Zusätzlich zur antiviralen Therapie umfasst die Behandlung auch psychische Begleitung und soziale Unterstützung sowie die Behandlung komorbider Erkrankungen.
Empfehlungen zu Behandlungsindikationen und Zeitpunkt für den Beginn der antiviralen Therapie (ART)Aufgrund neuerer Studien setzt sich auch in den Leitlinien immer mehr die Empfehlung durch, die antiretrovirale Therapie allen Patient*innen anzubieten, sobald die Diagnose gestellt ist. Die CD4-Zellzahl bestimmt dabei nur die Dringlichkeit eines baldigen Therapiebeginns.18,42Eine Beobachtungsstudie von amerikanischem Militärpersonal mit bekanntem Zeitpunkt der Serokonversion zeigt, dass der Beginn der ART weniger als 12 Monate nach der Serokonversion die Wahrscheinlichkeit für eine Normalisierung der CD4-Zellzahl erhöht.43Eine frühe Therapie im Rahmen der akuten HIV-Infektion führt zur Limitierung der HIV-Reservoire.44-45Die klinische Relevanz dieser Ergebnisse ist bislang jedoch noch nicht geklärt.
Die START-Studie ergab trotz geringer Zahl an klinischen Ereignissen einen signifikanten Vorteil hinsichtlich schwerer AIDS- und Non-AIDS-Ereignisse bei einem Behandlungsbeginn über 500 CD4-Zellen/µl.46Nur in der kleinen Subgruppe von Patient*innen mit einer Plasmavirämie < 5.000 Kopien/ml oder CD4-Zellen über 800/µl erreichte dieser Effekt keine statistische Signifikanz.
Die TEMPRANO(ANRS-1236)-Studie zeigte ebenfalls bei Behandlungsbeginn in der Subgruppe von Patient*innen mit > 500 CD4-Zellen/µl eine bessere Prognose als bei späterem Behandlungsbeginn.47
- Es ist eine kontinuierliche Kombinationsbehandlung mit mindestens 3 wirksamen Medikamenten notwendig.
- HAART (Highly Active Antiretroviral Treatment)
- Ein gutes Behandlungsergebnis erfordert Motivation und ein hohes Maß an Therapietreue.
- Das Virus liegt weiterhin latent als DNS in den Zellkernen der infizierten T-Lymphozyten und wird wieder anfangen, sich zu replizieren, wenn die Behandlung aussetzt.
Leitlinie: Indikationen fürIndikation einezur antiretroviraleantiretroviralen Therapie (ART)183
Symptomatische Patient*innen- Indikation
Die symptomatischeEine HIV-1-Infektioninsolldengrundsätzlichklinischen Stadien B und C stellt– unabhängig vonden bei asymptomatischen Patient*innen genannten Kriterien, z. B. CD4-Zellzahl, eine Indikation zur Behandlung dar. Eine ART soll erfolgen.Eine HIV-NephropathieImmunstatus undeinPlasmaviruslastsymptomatisches–HIV-assoziiertesdauerhaft antiretroviralneurologischesbehandeltDefizit (HAND) sind als symptomatische HIV-Infektion zu wertenwerden.
AsymptomatischeTherapieeinleitungPatient*innenso rasch wie möglich (binnen weniger Tage bis Wochen) bei:DiesymptomatischerIndikationsstellungHIV-Infektion- Beeinträchtigung
zurderTherapieT-Zell-Immunität (Labor-Kategorien CDC-2 und CDC-3) - asymptomatisch Infizierten mit erhöhten Risiken, insbesondere bei:
sollHIV-assoziierter Nephropathie- HIV-assoziiertem neurokognitiven Defizit
- Hepatitis-B-Koinfektion
- chronische Hepatitis-C-Koinfektion
- Lebensalter > 50 Jahre
- systemische Immunsuppression oder zytostatische Chemotherapie oder Bestrahlung im
DialogRahmenzwischenvonspezialisiertenonkologischenÄrzt*innenoderund informiertenautoimmunenPatient*innenErkrankungengestelltoderwerden.nach Transplantation sollteSchwangerschaftbegonnen(vertikalewerden, wenn die Erkrankten bereit sind.Transmissionsprophylaxe)folgtGründeallgemeinenfürGesichtspunkteneineundhorizontaleeinerTransmissionsprophylaxeindividuellen(„TreatmentRisikoabschätzung.asDiese orientiert sich vorrangig an der absoluten CD4-Zellzahl, berücksichtigt darüber hinaus aber weitere Kriterien.Prevention/TasP“)
CD4-ZellzahlDie Therapieeinleitung soll verzögert werden bei opportunistischen Infektionen:CD4-Zellzahlzerebrale< 500/μlBei allen Patient*innen mit unter 500 CD4-Zellen/µl soll eine Therapie erfolgen.KryptokokkoseDieeinzelneHöheKrankheitskonstellationenderbeiCD4-Zellzahleinerbestimmt dabei nur die zeitliche Dringlichkeit des Therapiebeginns, nicht aber die prinzipielle IndikationTuberkulose.
CD4-ZellzahlDie<Therapieeinleitung200/μlIstkannmit einer auch unter Therapie weiterbestehend erhverzöhten Morbidität und Mortalität verbunden, sodass ein dauerhaftes Unterschreiten dieses Werts vermiedengert werdensollte.Die Therapie soll dringlich erfolgen.
CD4-Zellzahl < 350/μllaut Kohortenstudien deutlich reduziertes ProgressionsrisikobeiTherapiebeginn unterhalb von 350/μlDie Therapie soll rasch eingeleitet werden.
CD4-Zellzahl 350–500/μllaut Therapieunterbrechungsstudien weniger klinische Ereignisse bei kontinuierlicher TherapieDies betraf auch Todesfälle aus anderen Gründen wie nicht-AIDS-definierende Krebserkrankungen, Herz-Kreislauf-Erkrankungen, Leber- und Nierenerkrankungen sowie schwere bakterielle Infektionen; bei einer vergleichbaren Rate ernsthafter Medikamentennebenwirkungen und gleicher Lebensqualität.In der HOPS-Kohorte wurden Nebenwirkungen durch Nukleosidanaloga bei Therapiebeginn oberhalb von 350 CD4-Zellen/µl seltener beobachtet.Kohortenanalysen legen weiterhin nahe, dass ein erhöhtes Progressionsrisiko auch bei 350–499 CD4-Zellen gegenüber noch höheren Werten besteht und das Progressionsrisiko bei Behandlungsbeginn unterhalb von 350 CD4-Zellen höher ist als bei Behandlungsbeginn zwischen 351 und 450 CD4-Zellen.Die Therapie soll eingeleitet werden.
CD4-Zellzahl > 500/μlEine Therapie sollte erfolgen.
ZusatzkriterienZusätzlich für einen frühen Therapiebeginn sprechen:Schwangerschaft (Näheres s. u.)Alter > 50 JahrechronischeHepatitis CtherapiebedürftigeHepatitis Brasches Absinken der CD4-ZellzahlImmunsuppression im Rahmen einer systemischen Chemotherapie, Radiotherapie oder von Autoimmunerkrankungen bzw. im Rahmen von Transplantationen
Akuteasymptomatischer HIV-Infektion(Serokonversion)- ohne beeinträchtigten Immunstatus
AnzahlElitederControllernSymptome=sowie Schwere und Dauer der Serokonversionssymptomatik sindPersonen mitder Prognose assoziiert, sodass bei ausgeprägter oder langandauernder Symptomatik bei Serokonversion eine ART eingeleitet werden soll.
Die ART sollte beiasymptomatischeroder gering symptomatischer Primärinfektion erfolgen und außerhalb von Studien nicht unterbrochen werden.
Die antiretrovirale Therapie reduziert das Risiko einer HIV-Transmission. Bei stabiler Senkung der Viruslast unter 50 Kopien/ml ist eine HIV-Übertragung unwahrscheinlich.Kohortendaten sprechen gegen eine HIV-Übertragung innerhalb HIV-diskordanter Paare bei unter 50 Kopien/ml supprimierter Plasmavirämie.Die Bedeutung der Viruslast hinsichtlich des Transmissionsrisikos sollte mit allen Patient*innen thematisiert werden.Ein frei ohne Druck zustande gekommener Patientenwunsch nach einer ART zum Schutz der Partner*innen stellt ein Zusatzkriterium fürInfektion, dieEinleitungübereinervieleTherapieJahredar.DiekeinenEmpfehlungCD4-T-Zell-Verlustzur Berücksichtigung klassischer Präventionsmaßnahmen, wie Kondome und Safer Sex, bleibt davon unbenommen. Sie gilt insbesondere, wenn die aktuelle HI-Viruslast nachweisbar oder unbekannt ist oder die Therapie zuvor unterbrochen wurde, und wenn es zusätzlich um den Schutz vor anderen Geschlechtserkrankungen gehterleiden.
Medikamentöse Therapie
Chronische HIV-InfektionPrimärtherapie
- Die Behandlung besteht aus einer Kombination von mindestens 3 Medikamenten, deren Dosierung sich nach den Ergebnissen der Resistenzbestimmung sowie nach der Bewertung der Nebenwirkungen, Komorbidität und Interaktionen richtet.
- Nach heutigem Wissensstand ist es in aller Regel notwendig, eine ART lebenslang ohne Unterbrechungen einzunehmen.
183Ausnahmen können für Patient*innen gelten, bei denen die Therapie sehr früh begonnen wurde.Körperliche und psychische Belastung durch dauerhafte Medikamenteneinnahme und die Kosten der ART sind dann gegenüber der Prognoseverbesserung abzuwägen.
- Vorteile eines früheren Therapiebeginns
183- weniger klinische Komplikationen (z. B. HIV-assoziierte Lymphome)
- weniger Nebenwirkungen
- Immunkontrolle zusätzlich erworbener und prävalenter Infektionen mit hohem Reaktivierungsrisiko (z. B. Tuberkulose) wird verbessert.
- niedriges Risiko für ein Immune Reconstitution Inflammatory Syndrome (IRIS)
Antivirale Wirkstoffklassen
EineIntegrasehemmereffektive(INI)ARTwie:
- BIC
senkt=die Infektiosität und das Übertragungsrisiko.Bictegravir DieDTGVerfügbarkeit=einfach einzunehmender und gut verträglicher Kombinationen, die Einnahmefehler mit dem Risiko der Resistenzentwicklung verringern, ermöglicht heute einen früheren Therapiebeginn.DolutegravirFürEVGdie=InitialbehandlungElvitegravir- RAL
werden=Medikamente aus 4 Klassen ausgewählt:Raltegravir.
- BIC
nukleosidische/nukleotidischeNukleosidische Reverse-Transkriptase-Inhibitoren (NRTI/NtRTI) wie:
- ABC = Abacavir
nonnukleosidischeFTC = Emtricitabin- 3TC = Lamivudin
- TAF = Tenofoviralafenamid
- TDF = Tenofovirdiproxil.
- Nichtnukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI)
Proteaseinhibitor(PI) mit Booster (Ritenavir oder Cobicistat)Integrasehemmer (INI).
PIDORmit=BoosterAlle PI sind in Kombination mit niedrig dosiertem (1–2 x 100 mg/d) Ritonavir oder Cobicistat (150 mg/d) stärker wirksam als ohne BoosterDoravirin.Folgende Kombinationsvarianten haben sich laut Leitlinien der European AIDS Clinical Society (EASC) von Oktober 2020 in der Erstlinientherapie als wirksam, sicher und gut verträglich erwiesen:48empfohlen2NRTI/NtRTI + INI1NRTI/NtRTI + INI
alternativProteaseinhibitoren (PI) wie:
2DRVNRTI/NtRTI +=1 NNRTI2 NRTI/NtRTI + PI mit BoosterDarunavir.
weitereBoostersubstanzenKombinationen
wie:1cINI=+ PI mit Booster.Cobicistat
- r = Ritonavir.
Diese Empfehlungen basieren auf der in 2014 verabschiedeten und seit Mai 2019 abgelaufenen Version der konsensbasierten Leitlinie „Antiretrovirale Therapie der HIV-Infektion“ (zu relevanten Änderungen nach Erscheinen der Leitlinien siehe Fußnoten in diesem Textkasten).Diese Empfehlungen zielen auf die Auswahl der Substanzen für den Therapiebeginn.Zur Sicherung des Behandlungserfolges ist häufig ein Substanzwechsel notwendig.Eintablettenregimezur Verbesserung der individuellen Verträglichkeitzur Anpassung der Therapie an dieINI-basiert:Lebenssituation der Patient*innenBIC/TAF/FTCMedikamentenwechselwirkungenDTG/ABC/3TCBegleitrisiken.DTG/3TC- EVG/c/TAF/FTC
DarausNNRTI-basiert:- DOR/TDF/3TC
- RPV/TAF/FTC
kannODERsich die Notwendigkeit ergeben, die Therapie mit einer hier nicht vorrangig empfohlenen oder sogar einer nicht empfohlenen Kombination fortzuführen.RPV/TDF/FTC
ResistenztestungPI-basiert:Vor Behandlungsbeginn sollte ein genotypischer Resistenztest erfolgen.Liegen Resistenzen vor, so sollte die Therapie mit 3 als sensitiv interpretierten Substanzen begonnen werden.
Zur Förderung der notwendigen hohen Adhärenz werden bevorzugt Fixkombinationen empfohlen.Wo nötig (z. B. Dosisreduktion beiNiereninsuffizienz, Intoleranz), können Einzelsubstanzen verordnet werden.
Empfohlene Kombinationen: Komponente 1 (NRTIDRV/NtRTI)Aufgrund ihrer vergleichbaren Wirksamkeit sowie ihres günstigen Nebenwirkungsprofils sollten Emtricitabin oder Lamivudin Bestandteil jeder Primärkombination sein.Tenofovir-Disoproxilfumaratc/Emtricitabin (TDF/FTC)Wird empfohlen.Ist in Kombination mit einem geboosteten PI, NNRTI oder INI gut wirksam und besser verträglich als Zidovudin/Lamivudin.TDF kann zu einer proximal-tubulären Dysfunktion und zu progredienterNiereninsuffizienzführen.Es geht mit einer stärkeren Minderung der Knochendichte einher als die Kombination von Abacavir und Lamivudin.
Tenofoviralafenamid/Emtricitabin (TAF/FTC)in einer Kombinationstablette mit Elvitegravir/Cobicistat verfügbarTAF weist eine geringere Nieren- und Knochentoxizität als TDF auf und wird in der o. g. Kombination anstelle von TDF empfohlen.1
Abacavir/Lamivudin (ABC/3TC)Ist ebenfalls gut wirksam und im Allgemeinen gut verträglich.Abacavir kann evtl. lebensbedrohliche Hypersensitivitätsreaktionen auslösen. Das Auftreten ist mit dem HLA-B*5701-Antigen assoziiert. Es ist notwendig, dessen Vorhandensein vor Therapie auszuschließen. Trotz HLA-B*5701-Negativität können in Einzelfällen Hypersensitivitätsreaktionen auftreten, sodass die Notwendigkeit zur diesbezüglichen Aufklärung und Überwachung nicht entfällt.Die Einstufung der Kombination als „empfohlen“ erfolgt unter der Voraussetzung des Einsatzes ausschließlich bei HLA-B*5701-negativen Patient*innen.Die Langzeitverträglichkeit der Kombination ist gut, bei niedriger Inzidenz von Lipoatrophie und Fettstoffwechselstörungen.Aufgrund vorläufiger Hinweise auf mögliche Nebenwirkungen von Abacavir auf das kardiovaskuläre Risiko sollte dessen Einsatz bei Patient*innen mit erhöhtem kardiovaskulärem Risiko (Framingham-Score > 20 %/10 Jahre) sorgfältig abgewogen werden.Einsatz mit Vorsicht bei Plasmavirämie > 100.000 Kopien/ml und hohem kardiovaskulärem Risikoalternative KombinationTenofovir-DF/Lamivudin (TDF/3TC)
nicht empfohlenZidovudin/Lamivudin (ZDV/3TC)Didanosin/Lamivudin (DDI/3TC)Didanosin/Emtricitabin (DDI/FTC)Didanosin/Stavudin (DDI/d4T)Didanosin/Tenofovir-DF (DDI/TDF)Stavudin/Lamivudin (d4T/3TC)
Stavudin/Emtricitabin (dT4/FTC)Stavudin/Zidovudin (dT4/AZT)Lamivudin/Emtricitabin (3TC/FTC)Tenofovir-DF/Abacavir (TDF/ABC)Regimes aus 3 oder 4 Nukleosidanaloga
Empfohlene Kombinationen: Komponente 2Mehrtablettenregime- INI
2-basiert:DolutegravirDTG(nicht+beiTAF/FTCSchwangerschaftODERundDTGbei+Frauen mit Schwangerschaftswunsch)49TDF/FTCRaltegravirElvitegravirRAL + ABC/Cobicistat3TC(ODER RAL + TAF/FTC,alternativODER RAL + TDF/FTC)
- NNRTI-basiert:
RilpivirinDOR(Cave:+nichtTDF/FTC ODERbeiDORHIV-RNA+>TAF/FTC ODER100.000DORKopien+ ABC/ml!)alternativ: Efavirenz (nicht bei Schwangerschaft und bei Frauen mit Schwangerschaftswunsch)nicht empfohlen: Nevirapin, Etravirin3TC
- PI
mit pharmakokinetischem Booster-basiert:Darunavir + Booster mit Ritonavir oder CobicistatAtazanavirDRV/r +BoosterABC/3TC ODERmit RitonavirDRV/roder Cobicistatalternativ: Lopinavir+Booster mit Ritonavirnicht empfohlen: Fosamprenavir, Saquinavir, Indinavir oder Ritonavir in therapeutischer DosierungTAF/FTC
- INI
1Kurz nach dem Erscheinen der Leitlinien wurde TAF für weitere Ein-Tabletten-Regime und freie Kombinationen zugelassen.2Juni 2018: Zulassung des Ein-Tabletten-Regimes aus dem INI Bictegravir (BIC) und TAF/FTC.50Dieses Regime wird neben den bereits genannten in den Leitlinien der European AIDS Clinical Society (EASC) zu den empfohlenen Erstlinienbehandlungen gezählt.48,51Die 3 Behandlungsregimes, die aus 2 verschiedenen NRTI und zusätzlich entweder NNRTI, PI oder INI bestehen, werden als gleichwertig eingestuft.Der Grad derNebenwirkungen
und die individuellen Umstände bestimmen die Wahl.Dafür sind besondere Kenntnisse und Erfahrung im Behandlungsteam erforderlich.
Dolutegravir in Vergleichsstudien52-53Der Integrase-Inhibitor Dolutegravir zeigte in Kombination mit TDF/FTC und ABC/3TC im Vergleich zu Efavirenz und Darunavir/Rironavir eine bessere virologische Wirksamkeit und ist Raltegravir nicht unterlegen (Ib).Unter Dolutegravir traten im Vergleich zu Efavirenz und Raltegravir bei Therapieversagen seltener Resistenzmutationen auf.In der FLAMINGO-Studie kam es bei virologischem Versagen weder unter Darunavir/Rironavir noch unter Dolutegravir zu Resistenzmutationen.Kontroverse Bewertung zur Therapie in der SchwangerschaftDolutegravir kann zuNeuralrohrdefektenbeim Ungeborenen führen. Deshalb sollte es nicht bei Schwangeren und bei Frauen im gebärfähigen Alter nur unter sicherer Verhütung angewendet werden. Bei Eintritt einer Schwangerschaft sollte auf eine alternative Behandlung gewechselt werden.49Die WHO hat 2019 die Empfehlung herausgegeben, dass Dolutegravir als bevorzugtes Erst- und Zweitlinienmedikament für alle Patientengruppen inklusive Schwangere verwendet werden soll.54Näheres zu den empfohlenen Therapieregimes siehe AbschnittSchwangerschaft und Stillzeit
Nebenwirkungen- Die Behandlung hat anfangs häufig teilweise erhebliche Nebenwirkungen, selbst wenn das Nebenwirkungsprofil bei den neuesten Medikamenten deutlich verbessert ist.
- Die Nebenwirkungen sind häufig vorübergehend oder nehmen nach 1–12 Wochen ab. In den meisten Fällen ist es möglich, die Medikamentenkombination zu verändern, damit die Patient*innen die Behandlung tolerieren.
- Lipodystrophie, die Entwicklung von Herz-Kreislauf-Erkrankungen sekundär zu den Veränderungen der Blutlipide und andere Nebenwirkungen, die dazu führen können, dass die Patient*innen die Behandlung abbrechen, sind Unsicherheitsfaktoren, die für die Langzeitprognose Bedeutung haben können.
Arzneimittelinteraktionen
183- Vielzahl an Interaktionsmöglichkeiten zwischen antiretroviralen Substanzen und Begleitmedikation, Nahrungsergänzungsmitteln, Komplementär- und Alternativmedizin, legalen und illegalen Drogen
hoheHohe interindividuelle Variabilität, z. B. durch genetische PolymorphismenVorhersage von Interaktionen ist oft kaum möglich; Medikamentenspiegelmessungen (TDM) erwägen.bei Mitbehandlung durch weitere Ärzt*innenAustausch über alle verordneten PharmakaInteraktionsrisiken vor Therapiebeginn abschätzen.Ggf. durch TDM quantifizieren.Dosisanpassung?Umstellung der Medikation?
Die Verordnung von ART und Begleitmedikation erfordert eine genaue Kenntnis von Art und Ausmaß zu erwartender Interaktionen jedes Medikaments.Neue wichtige Interaktionen ergeben sich durch die Einführung einer Reihe neuer Substanzen in die Therapie derHepatitis-C-Koinfektion.Diese sollten vor einem Einsatz sorgfältig analysiert werden, und u. U. sollte die Therapie angepasst werden (z. B.HEP Druginteractions).Die klinische Relevanz von Interaktionen ist vielfältig:Reduktion oder Verstärkung der Wirksamkeit (und der Nebenwirkungen) der ARTReduktion oder Verstärkung der Wirksamkeit (und der Nebenwirkungen) der Begleitmedikation.
- Dabei sind u. a. folgende Wirkstoffgruppen von besonderer Bedeutung:
- Antikonvulsiva
- Antidepressiva
- vasoaktive Substanzen
- Antihistaminika
- Antiarrhythmika
- Antiinfektiva
- Kontrazeptiva
- Statine (erhöhtes Risiko für Rhabdomyolyse bei der Kombination von Proteasehemmern)
- Steroide, topisch oder systemisch.
- Wegen möglicher neuer Erkenntnisse wird dringend empfohlen, konkrete Interaktionspotenziale der verordneten Medikamente zu überprüfen (z. B. auf Interaktionsdatenbanken wie HIV Drug Interaction Checker oder über die Interaktion-Hotline des Instituts für interdisziplinäre Medizin: Tel. 0160-90244100, E-Mail: interaktion@ifi-infektiologie.de).
Unzureichender Therapieeffekt
- Kann auf eine Resistenzentwicklung zurückgeführt werden.
DieUnzureichendeResistenzentwicklungTherapietreuewird in der Regel darauf zurückgeführt, dassfördert dieMedikamenteneinnahmeBildungnichtvonbefolgt wurde.Wenn man sich bei Personen ansteckt, die behandelt werden, kann die Infektion mit einem bereits resistenten Stamm geschehenResistenzen.- Bei Therapieversagen kann die Kombination von mehr als 3 Medikamenten indiziert sein.
- Genotypische Resistenzbestimmungen des Virus gelten als Anhaltspunkt für die Wahl der Behandlung.
Leitlinie: Initialtherapie Primärtherapie der HIV-Infektion183
Leitlinie: Therapiemanagement ART18
Therapiewechsel
Änderungen der Therapie können durch Versagen, Nebenwirkungen, Adhärenzproblemen, eingetretene oder geplante Schwangerschaft, Begleittherapien oder potenzielle Interaktionen notwendig werden.Ein Alternativregime bei Therapieversagen sollte mindestens zwei neue, in der Resistenztestung als aktiv beurteilte Substanzen enthalten, bevorzugt aus Substanzklassen, gegenüber denen das Virus noch nicht exponiert war.Die Auswahl sollte sich nach einer möglichst aktuellen Resistenztestung richten, wobei vorangegangene Resistenztestungen und ART-Regime mitberücksichtigt werden sollten.Entscheidungen über Zweit- und spätere Kombinationstherapien erfordern Spezialkenntnisse und sollten nur von besonders erfahrenen und geschulten Ärzt*innen getroffen werden.
Absetzen einer antiretroviralen Therapie
Bei notwendigen Therapieunterbrechungen sind alle Substanzen gleichzeitig abzusetzen, sofern die Kombination keine NNRTI beinhaltet.Beim Absetzen einer NNRTI-haltigen Kombination sind die langen Halbwertszeiten von Dolutegravir oder der NNRTI zu berücksichtigen: Durch unterschiedliche Halbwertszeiten der ART-Komponenten kann nach gleichzeitigem Absetzen eine funktionelle Monotherapie entstehen, mit dem Risiko einer Resistenzentwicklung.NNRTI: Auf verlängerte Enzyminduktion achten.Bei planbaren Therapieunterbrechungen kann z. B. der NNRTI gegen einen PI mit Ritonavir-Booster ausgetauscht und nach ca. 2 Wochen die gesamte Therapie abgesetzt werden. Nach Absetzen des NNRTI sollten die übrigen Medikamente noch 14 Tage weiter gegeben werden.Bei Absetzen von Tenofovir-DF, Emtricitabin oder Lamivudin bei bestehender HBV-Koinfektion können schweren Exazerbationen derHepatitis Bauftreten.
Management des Therapieversagens
Ziel bei beginnendem Therapieversagen: Senkung der Plasmavirämie auf < 50 Kopien/mlOptionen bei niedriggradiger Virusreplikation, keiner oder beginnender Resistenzentwicklung (gegen eine Substanz)Überprüfung von Adhärenz und evtl. Wechselwirkungen/TDMIntensivierung durch Zugabe einer neuen Substanz und/oder Ritonavir-Boosterung eines ungeboosterten PITherapiewechsel bei virologischem, immunologischem oder klinischem TherapieversagenZiel: Viruslast dauerhaft < 50 Kopien/ml
AdhärenzproblemeEine Vereinfachung der Therapie kann erwogen werden.Die Umstellung auf einen Ritonavir-geboosterten PI kann sinnvoll sein, um dem Risiko der Resistenzentwicklung durch mangelnde Adhärenz bei NNRTI, raltegravirhaltigen Kombinationen oder der Kombination Tenofovir-DF/Emtricitabin/Elvitegravir/Cobicistat vorzubeugen.
Besteht keine Möglichkeit, auf ein vollständig suppressives Regime zu wechseln, so ist die Fortführung einer laufenden, inkomplett virologisch wirksamen, aber immunologisch teilweise wirksamen Therapie eine Option.Allerdings besteht dabei das Risiko der weiteren Akkumulation von Resistenzmutationen mit dem Verlust von Therapieoptionen. Daher ist eine Therapieoptimierung immer vorzuziehen.
Therapiepausen
Je häufiger eine Therapie unterbrochen wird, desto größer ist das Risiko einer Resistenzentwicklung, insbesondere bei bestehenden Resistenzen und Kombination von Medikamenten mit unterschiedlicher Halbwertszeit.Im akuten retroviralen Syndrom können Therapiepausen bzw. Absetzen der ART zu einer raschen immunologischen Verschlechterung oder zu neurologischen Komplikationen führen.Pausen bei Patient*innen mit Therapiebeginn während der akuten HIV-Infektion ergaben zwar Hinweise auf eine verbesserte Immunkontrolle nach vorübergehender Therapie, deren Dauer jedoch unklar ist.Therapiepausen aus strategischen Überlegungen haben keinen erwiesenen Nutzen und sind daher abzulehnen. Dazu zählen u. a.:Einsparung von ToxizitätReversion oder Reduktion von Resistenzmutationen bei intensiv vorbehandelten Patient*innenimmunologische Überlegungen.Therapieunterbrechungen können evtl. notwendig werden bei:unerwünschten Arzneimittelwirkungenunzureichender Adhärenzdringendem Patientenwunsch.
Während der Therapiepausen sollten Viruslast und Immunstatus engmaschig kontrolliert werden.
Schwangerschaft und Stillzeit
- Der gesamte Abschnitt basiert auf dieser Referenz.
5520
HIV-Test
- Jeder Schwangeren soll entsprechend den geltenden Mutterschaftsrichtlinien ein HIV-Antikörpertest empfohlen werden.
55- Dieser sollte möglichst früh in der Schwangerschaft erfolgen und kann bei erhöhtem Risiko (z. B. HIV-
positiverpositive Partner*innen) auch im Verlauf der Schwangerschaft wiederholt werden. - Die Durchführung des HIV-Tests sollte von einem Beratungsangebot und einer Aufklärung über Behandlungsmöglichkeiten begleitet sein.
- Im Rahmen der Beratung sollen u. a. die positiven Auswirkungen einer gegen HIV gerichteten Therapie auf die Gesundheit und Lebenserwartung von infizierten Menschen und auf das Übertragungsrisiko von der Mutter auf ein Kind sowie auf die Sexualpartner*innen hervorgehoben werden.
- Bei Bedarf sind der Schwangeren Adressen und Telefonnummern weiterer Beratungsangebote zur Verfügung zu stellen.
- Sofern die werdende Mutter einem Test nicht widerspricht, wird im Rahmen der Schwangerschaftsvorsorge routinemäßig ein Such- und ggf. ein Bestätigungstest zum Ausschluss einer HIV-Infektion durchgeführt.
- Die Schwangere soll in verständlicher Form über das Testergebnis informiert werden – auch wenn keine Infektion nachweisbar ist – damit sie auf Nachfrage auskunftsfähig ist.
- Die erfolgte Durchführung des Tests ist laut den geltenden Mutterschaftsrichtlinien im Mutterpass zu dokumentieren, das Ergebnis jedoch nicht. Bei positivem Testergebnis sollte die Schwangere an ein auf HIV-spezialisiertes Zentrum zur interdisziplinären Beratung überwiesen werden.
- Dieser sollte möglichst früh in der Schwangerschaft erfolgen und kann bei erhöhtem Risiko (z. B. HIV-
Therapieindikation
- Bei HIV-positiven Schwangeren gelten die gleichen Indikationen für eine antiretrovirale Kombinationstherapie (cART) wie bei nicht
55- Jede HIV-Infektion in der Schwangerschaft stellt eine Behandlungsindikation dar.
- Die Kombinationstherapie oder -prophylaxe mit antiretroviralen Substanzen reduziert das Risiko einer Mutter-Kind-Übertragung (Ia).
56-57 - Bei einer in der Schwangerschaft neu diagnostizierten HIV-Infektion soll eine Behandlung so rasch wie möglich, spätestens aber zu Beginn des 2. Trimenons begonnen werden.
- Eine wirksame ART soll weitergeführt werden. Eine bestehende ART sollte geändert werden, wenn ihre Sicherheit nur unzureichend belegt ist.
- Ziele einer cART in der Schwangerschaft sind eine wirksame Prophylaxe der HIV-Transmission durch maximale Hemmung der Virusreplikation bei der Mutter bei möglichst guter Verträglichkeit für die Schwangere und den Feten.
- Frauen im gebärfähigen Alter sollen möglichst mit einer cART behandelt werden, die im Fall einer Schwangerschaft unverändert beibehalten werden kann.
- Dolutegravir kann zu Neuralrohrdefekten beim Ungeborenen führen. Deshalb sollte es bei Schwangeren nicht und bei Frauen im gebärfähigen Alter nur unter sicherer Verhütung angewendet werden. Bei Eintritt einer Schwangerschaft sollte auf eine alternative Behandlung gewechselt werden.
4921
- Dolutegravir kann zu Neuralrohrdefekten beim Ungeborenen führen. Deshalb sollte es bei Schwangeren nicht und bei Frauen im gebärfähigen Alter nur unter sicherer Verhütung angewendet werden. Bei Eintritt einer Schwangerschaft sollte auf eine alternative Behandlung gewechselt werden.
- Die Entscheidung über ein Absetzen der Therapie nach Geburt soll nur von in der Behandlung HIV-infizierter Patientinnen erfahrenen Ärzt*innen gemeinsam mit den Patientinnen getroffen werden.
Therapieregime
- Prinzipiell stehen für die cART in der Schwangerschaft Medikamente aus allen Substanzklassen zur Verfügung.
- Allerdings sind die meisten antiretroviralen Medikamente für den Einsatz in der Schwangerschaft nicht zugelassen, und die begrenzten klinischen Erfahrungen lassen noch keine abschließende Nutzen-Risiko-Abschätzung zu.
- Hat eine Frau beim Eintritt der Schwangerschaft bereits eine erfolgreiche cART, wird diese weitergeführt.
- Es ist allerdings zu prüfen, ob im Hinblick auf das exponierte Kind eine Therapiemodifikation möglich und sinnvoll ist.
Empfohlene Therapiekomponenten
- Kombinationspartner 1
- NRTI
TenofovirTDF/FTC (Tenofovirdisoproxil/Emtricitabin)- Abacavir/Lamivudin
- alternativ: Zidovudin/Lamivudin
- bei begleitender chronischer Hepatitis
TenofovirTDF/EmtricitabinFTCTenofovirTenofovirdisoproxil/Lamivudin
- NRTI
- Kombinationspartner 2
- NNRTI
- Rilpivirin
- alternativ: Nevirapin
- PI
- Darunavir + Ritonavir-Booster
- alternativ: Atazanavir + Ritonavir
- alternativ: Lopinavir + Ritonavir
- NNRTI
Labormonitoring
- Monatliche Kontrollen des Blutbilds (mögliche
Medikamenten-assoziiertemedikamentenassoziierte Anämien oder Thrombozytopenien) - Resistenztestung
- Vor Beginn einer cART in der Schwangerschaft soll ein Resistenztest erfolgen.
- Medikamentenspiegel
- Die Pharmakokinetik antiretroviraler Substanzen kann durch eine Schwangerschaft verändert werden.
- Medikamentenspiegelmessungen in der Schwangerschaft können deshalb bei Nebenwirkungen oder bei unzureichender Viruslastsenkung sinnvoll sein.
- Wegen eines geringen Plasmaspiegels und eines damit verbundenen erhöhten Risikos für ein Therapieversagen und für eine Mutter-Kind-Übertragung, soll eine Kombination aus Elvitegravir/Cobicistat
5822 oder Darunavir/Cobicistat in der Schwangerschaft nicht verabreicht werden.5923
Entbindungsmodus und Expositionsprophylaxe
- Eine vaginale Entbindung ist unter folgenden Voraussetzungen eine empfehlenswerte Option:
- Die Schwangere nimmt eine antiretrovirale Kombinationstherapie ein.
- Die HIV-RNA-Last liegt am Ende der Schwangerschaft (mindestens 4 Wochen bis zum Entbindungstermin) < 50 Kopien/ml.
- Dann ist keine intrapartale, aber ggf. eine postnatale Expositionsprophylaxe (s. u.) nötig.
- Beurteilung geburtshilflicher Risiken durch erfahrene Geburtshelfer*innen
- Klärung logistischer Probleme (z. B. Entfernung zu geeigneter Geburtsklinik).
- HIV-infizierte Schwangere mit einer HIV-RNA-Last > 50 Kopien/ml in der 36. SSW, sollten eine elektive Sectio frühestens ab der 37. SSW durch ein erfahrenes Team erhalten.
- Es soll dabei eine intra- und postnatale Expositionsprophylaxe mit Zidovudin erfolgen, bei > 1.000 Kopien/ml in der 36. SSW eine intrapartale und eine erweiterte postnatale Expositionsprophylaxe (s. u.).
Risikosituationen
- Erhöhte Viruslast kurz vor der Geburt
- Wenn die Viruslast bis zum Zeitpunkt der Geburt nicht unter 50 Kopien/ml gesenkt werden kann oder wenn es kurz vor der Geburt zu einem Viruslastanstieg kommt:
- Umstellung oder Intensivierung der mütterlichen Medikation durch erfahrene HIV-Behandler*innen
- Ist eine baldige Entbindung erforderlich oder bereits im Gang, dann sollte bei einer Viruslast > 50 Kopien/ml – soweit zeitlich möglich – der Mutter Zidovudin i. v. peripartal gegeben werden. Die zeitnahe Entbindung hat jedoch die höchste Priorität.
- Eine weitere präpartale medikamentöse Eskalation an die Mutter kann im Einzelfall erwogen werden.
- Wenn die Viruslast bis zum Zeitpunkt der Geburt nicht unter 50 Kopien/ml gesenkt werden kann oder wenn es kurz vor der Geburt zu einem Viruslastanstieg kommt:
- Keine antiretrovirale Therapie der Mutter vor der Geburt
- Wenn trotz bekannter HIV-Infektion bis zur Geburt keine Transmissionsprophylaxe durchgeführt wurde, sollte diese spätestens intrapartal und postnatal als eskalierte Prophylaxe durchgeführt werden.
- Auch bei unvollständiger intrapartaler Transmissionsprophylaxe kann mit einem Vorteil gerechnet werden, wenn die postnatale Expositionsprophylaxe bis spätestens 72 Stunden nach Geburt begonnen wird.
- Falls in Abhängigkeit von der Geburtsphase bei klinischer Erstvorstellung ein Kaiserschnitt noch infrage kommt, sollte dieser angestrebt werden.
- Ist eine Entbindung rasch erforderlich oder bereits im Gang, dann sollte – soweit zeitlich möglich – Zidovudin i. v. peripartal gegeben werden. Die zeitnahe Entbindung hat jedoch die höchste Priorität.
- Die antivirale Therapie der Mutter sollte präpartal in der Regel nicht intensiviert werden; im Einzelfall kann das jedoch erwogen werden.
- Wenn trotz bekannter HIV-Infektion bis zur Geburt keine Transmissionsprophylaxe durchgeführt wurde, sollte diese spätestens intrapartal und postnatal als eskalierte Prophylaxe durchgeführt werden.
Nach der Entbindung
- Behandlungsindikation bei der Mutter überprüfen und – je nach Situation – ART fortsetzen oder beenden.
- Bei niedrigem Übertragungsrisiko
- Erfolgreiche ART wurde bereits vor der Schwangerschaft begonnen und HIV-RNA lag während der gesamten Schwangerschaft unter 50 Kopien/ml: Auf eine postnatale Expositionsprophylaxe kann verzichtet werden.
- Bei einer mütterlichen HI-Viruslast < 1.000 Kopien/ml zum Zeitpunkt der Entbindung erfolgt eine postnatale orale Zidovudin-Gabe an das Neugeborene innerhalb 6 Stunden nach Geburt für 4 Wochen.
- Erweitere (eskalierte) postnatale Transmissionsprophylaxe
- Ein hohes Übertragungsrisiko, z. B. bei fehlender mütterlicher Therapie vor Entbindung oder erhöhter Viruslast der Mutter kurz vor Geburt, kann durch die Kombination von 2–3 antiviralen Substanzen u. U. wirksamer gesenkt werden als mit Zidovudin allein.
- Bei präpartal fehlender mütterlicher Therapie wird eine eskalierte postnatale Prophylaxe des Neugeborenen mit einer Kombination aus einer Nevirapin-Kurzprophylaxe (1. Dosis so früh wie möglich postpartal, zumindest innerhalb von 48 Stunden, 2. Dosis 48 Stunden nach der 1. Gabe und 3. Dosis 96 Stunden nach der 2. Gabe) und einer 4- bis 6-wöchigen Zidovudin-Gabe empfohlen.
- Zur Vermeidung von Nevirapinresistenzen kann die Kombination dieses Regimes (3 Gaben Nevirapin + 6 Wochen Zidovudin) mit einer 14-tägigen Lamivudin-Gabe beim Neugeborenen erwogen werden.
- Bei bestehender oder wahrscheinlicher NNRTI-Resistenz, kann auf Raltegravir ausgewichen werden.
- Eine ausführliche kontrazeptive Beratung im Rahmen der gynäkologischen Routineuntersuchung 6–8 Wochen postpartal sollte auf jeden Fall erfolgen.
- Stillen?
- an HIV-RNA-Last orientiert
- > 50 Kopien/ml: Stillverzicht empfehlen.
- < 50 Kopien/ml: partizipative Entscheidungsfindung nach Aufklärung über Vorteile und Risiken des Stillens.
- Die antiretrovirale Behandlung von Mutter und Kind reduziert zwar drastisch das Übertragungsrisiko (Ia)
4119, das Stillen geht jedoch dann – neben dem Restrisiko einer Virusübertragung – mit einer erheblichen Arzneimittelexposition des Säuglings einher. - Voraussetzungen für ein sicheres Stillen
- wirksame ART mit Nachweis einer HIV-RNA-Last < 50 Kopien/ml über mehrere Monate
- zuverlässige ART-Einnahme, belegt u. a. durch eine bislang sehr hohe und kontinuierliche Therapietreue
- Die Patientin ist bereit, während der Stillzeit an einem zusätzlichen HIV-RNA-Monitoring teilzunehmen.
- an HIV-RNA-Last orientiert
Telefon-Hotlines
- Beratung zu Problemen im Zusammenhang mit HIV-Infektionen in der Schwangerschaft
- bei gynäkologischen Fragestellungen: 0178-282 0282
- bei Fragestellungen zur antiretroviralen Therapie in der Schwangerschaft: 069-63017680
- bei neonatologischen/pädiatrischen Fragestellungen: 0178-4121313
- bei Fragen zur Versorgung durch Hebammen: Deutscher Hebammenverband (DHV): 0721-9818927
HIV bei Kindern und Jugendlichen
- Der gesamte Abschnitt basiert auf dieser Referenz.
6024
Leitlinie: Indikation zur ART6024
- Säuglinge sollen unverzüglich eine ART erhalten.
- Kinder > 12–36 Monate sollen eine ART erhalten.
- Kinder 37 Monate bis 12 Jahre
- Asymptomatisch ohne Immundefekt: Sollten eine ART erhalten.
- Symptomatisch und/oder mit Immundefekt: Sollen eine ART erhalten.
- Jugendliche > 12 Jahre sollen wie Erwachsene therapiert werden.
- Die Zahl der Neuinfektionen mit HIV bei Kindern ist durch die Transmissionsprophylaxe deutlich zurückgegangen und liegt mittlerweile in Deutschland bei 10–20/Jahr.
6125- Prävalenz: ca. 300–400
6226-6327
- Prävalenz: ca. 300–400
- Die medizinische Versorgung von Kindern und Jugendlichen mit HIV sollte in enger Zusammenarbeit mit einem pädiatrischen HIV-Schwerpunktzentrum erfolgen.
- Empfohlene Arzneimittelkombinationen für die Initialtherapie:
- 2 NRTI + geboosterter PI – oder –
- 2 NRTI + 1 NNRTI – oder –
- 2 NRTI + 1 INI.
- Näheres zum Thema Kinder mit HIV-Infektion in Kindergarten und anderen öffentlichen Einrichtungen finden Sie im Abschnitt Prävention.
Sexuell übertragbare Krankheiten bei HIV-positiven Patient*innen
- Alle HIV-positiven Personen, die sexuell aktiv sind, sollten jährlich auf Syphilis, Chlamydien (Frauen, Männer) und Gonokokken
61 getestet werden sowie beim Partnerwechsel, bei einer Schwangerschaft oder beim Auftreten von Symptomen.- In Abhängigkeit von den Partnerzahlen können kürzere Kontrollintervalle sinnvoll sein.
- > 5 Partner*innen: halbjährliche Kontrollen auf HCV, Syphilis, rektale Chlamydien- und Gonokokken-Infektionen
- > 10 Partner*innen: vierteljährliche Untersuchungen auf Syphilis, Gonokokken und Chlamydien
- In Abhängigkeit von den Partnerzahlen können kürzere Kontrollintervalle sinnvoll sein.
- Untersuchungen bei Männern
- Erststrahlurin auf Chlamydien und Gonorrhö (Nukleinsäureamplifikation NAAT)
- evtl. Anus: Chlamydien und Gonorrhö-Abstrich (NAAT)
- evtl. Hals: Gonorrhö-Abstrich (NAAT)
- Blut: Syphilis-Serologie (evtl. Hepatitis B/C)
- Nachweis einer Chlamydien-Infektion bei Männern, die Sex mit Männern haben.
- Weitere Subtypisierung, um Lymphogranuloma venereum auslösende Erregervarianten zu erkennen und entsprechend zu behandeln.
61
- Weitere Subtypisierung, um Lymphogranuloma venereum auslösende Erregervarianten zu erkennen und entsprechend zu behandeln.
- Untersuchungen bei Frauen
- Vaginalabstrich für Chlamydien und Gonorrhö (NAAT)
- evtl. Anus: Chlamydien und Gonorrhö-Abstrich (NAAT)
- evtl. Hals: Gonorrhö-Abstrich (NAAT)
- Blut: Syphilis-Serologie (evtl. Hepatitis B/C)
Therapie
- Klärung der Ansteckungsquelle, Information
- Kein Sex während der Behandlung
- Gebrauch von Kondomen, in jedem Fall bis das Ergebnis der Kontrollprobe vorliegt.
- Behandlung der Chlamydien-Infektion
- unkomplizierte urogenitale oder rektale Chlamydien-Infektion: Doxycyclin 200 mg tgl. über 7 Tage
- Kontrolle 5 Wochen nach der Behandlung
- evtl. auch Kontrolle bei Verdacht auf Therapieversagen oder erneuter Ansteckung
- in der Schwangerschaft: Azythromycin 1 g als Einmaldosis
- Kontrolle 5 Wochen nach der Behandlung
- weitere Informationen in den Artikeln Genitale
ChlamydieninfektionChlamydien-Infektion bei Frauen und GenitaleChlamydieninfektionChlamydien-Infektion bei Männern
- unkomplizierte urogenitale oder rektale Chlamydien-Infektion: Doxycyclin 200 mg tgl. über 7 Tage
- Behandlung der Gonorrhö
- Bei positivem NAAT: Kultur anlegen und Behandlung beginnen.
- unkomplizierte urogenitale/anale/Hals Gonorrhö: Einmaldosis 1 g Ceftriaxon (i. m. oder i. v.) und 1,5 g Azithromycin peroral
- Kontroll-NAAT 2 Wochen nach der Behandlung
- Näheres siehe Artikel Gonorrhö.
- Behandlung einer genitalen Herpes-simplex(HSV)-Episode (Näheres in den Artikeln Herpes genitalis bei Männern und Herpes genitalis bei Frauen) bei HIV-positiven Patient*innen
6428- Primärerkrankung
- Aciclovir 5 x tgl. 400 mg über 7–10 Tage
- Valaciclovir 2 x tgl. 500–1.000 mg über 10 Tage
- Famciclovir 3 x tgl. 250–500 mg über 10 Tage
- fulminanter Herpes genitalis
- Aciclovir 5–10 mg/kg KG i. v. alle 8 Stunden über 2–7 Tage
- bei klinischer Besserung Umstellung auf orale Medikation
- Insgesamt über mindestens 10 Tage behandeln.
- Rezidiv
- Die meisten Patient*innen kommen mit einer 5-tägigen Behandlung aus.
- Bei Patient*innen mit ausreichenden CD4-Zahlen (> 500 Zellen/µl) reichen möglicherweise auch kürzere Regimes aus.
- Für HIV-Positive ohne Hinweise auf Immunschwäche scheinen Standarddosierungen (siehe Artikel Herpes genitalis bei Männern und Herpes genitalis bei Frauen) auszureichen (Ib/A).
- Bei Patient*innen mit fortgeschrittenem AIDS kann es erforderlich sein, die Standarddosis zu verdoppeln und länger als 5 Tage zu behandeln (Ib/B).
- Ultrakurzzeittherapien sollten nur mit Vorbehalt eingesetzt werden, denn sie wurden bislang nicht ausreichend in der Behandlung immunkompromittierter Patient*innen erprobt.
- bei Schwangeren
- Suppressionsbehandlung ab 32. SSW bei Patientinnen mit früherem Genitalherpes (und HIV): Aciclovir 3 x tgl. 400 mg
- Näheres zur Behandlung des Herpes genitalis in der Schwangerschaft im Artikel Herpes genitalis bei Frauen
- Primärerkrankung
- Behandlung von Syphilis
- frühe Syphilis, Dauer kürzer als 1 Jahr und ohne Komplikationen: Benzathin-Benzylpenicillin 2,4 Mio. IE i. m. als Einmaldosis
- latente oder späte Infektion, Ansteckung > 1 Jahr und ohne Komplikationen: Benzathin-Benzylpenicillin 2,4 Mio IE i. m. wöchentlich über 3 Wochen
- Kontroll-Serologie nach 3, 6 und 12 Monaten, danach jährlich
- Näheres im Artikel Syphilis
Immunrekonstitutionssyndrom484
- Immune Reconstitution Inflammatory Syndrome (IRIS oder IRD)
- Eine paradoxe Reaktion auf eine latente (evtl. manifeste) opportunistische Infektion, die einige Wochen nach dem Beginn der ART auftreten kann.
- Inzidenz: 5–10 % aller mit ART Behandelten
- Unter ART kommt es zu einer überschießenden Immunantwort und damit zu einer klinischen Verschlechterung opportunistischer Erkrankungen.
61- ansteigende CD4-Zellzahl und Abfall der Viruslast
- Symptome aktiver opportunistischer Infektionen ähneln, z. B.:
- Tuberkulose
- Pneumocystis-jirovecii-Pneumonie
- Kryptokokken-Meningitis
- Zytomegalie (CMV, Näheres dazu siehe auch Artikel Sexuell übertragbare Infektionen bei Männern, die Sex mit Männern haben)
- Differenzialdiagnosen
- Medikamentennebenwirkungen
- Adhärenzprobleme
- neue Infektion
- Therapie
- Behandlung der opportunistischen Infektion nach den üblichen Leitlinien
- bei leichten Symptomen evtl. NSAR
- Kortikosteroide
- Können bei Läsionen im Zentralnervensystem, bei obstruierenden Lymphknoten oder zunehmenden respiratorischen Problemen wirksam sein.
- Haben vor allem bei Tuberkulose-IRIS einen Nutzen gezeigt.
- bei Kryptokokken-IRIS (Erhöhung des intrazerbralen Drucks): Kortikosteroide für mindestens 2–6 Wochen
- ART nur in schwersten Fällen pausieren.
- Die Prognose ist bei einer aktiven Diagnostik und frühzeitiger Behandlung gut.
Therapie nach HIV-Exposition
- Der gesamte Abschnitt basiert auf dieser Referenz.
6529
Sofortmaßnahmen nach beruflicher HIV-Exposition
- Stich- oder Schnittverletzung
- Spontanen Blutfluss nicht sofort unterbinden, da potenziell infektiöses Material dadurch ausgespült wird.
- Mindestens 1 min lang bluten lassen.
- Sonstige Manipulationen an der Wunde nach Möglichkeit vermeiden, insbesondere Quetschen und Ausdrücken direkt im Einstichbereich, um keine Erregerverschleppung in tiefere Gewebsschichten zu begünstigen.
Nachnach der spontanenoderBlutung:induzierten Blutung ggfGgf. Stichkanalbzw. Schnittverletzungspreizen und gründliches Spülunglen mit Wasser/Seife oder Antiseptikum (z. B. Povidon-Iod oder anderesethanolbasiertes Händedesinfektionsmittel oder Hautantiseptikumauf Basis von Ethanol)durchführenanwenden.
- Spontanen Blutfluss nicht sofort unterbinden, da potenziell infektiöses Material dadurch ausgespült wird.
- Kontamination des Auges
- unverzüglich Spülung mit 0,9 % NaCl oder Wasser
- Aufnahme in die Mundhöhle
- Das aufgenommene Material sofort, möglichst vollständig ausspucken.
- Danach die Mundhöhle mehrfach mit 0,9 % NaCl oder Wasser spülen (ca. 4- bis 5-mal)
- Jede Portion nach etwa 15
Sekundensec intensiven Hin- undHer-BewegensHerbewegens in der Mundhöhle ausspucken.
- Jede Portion nach etwa 15
- Kontamination geschädigter oder entzündlich veränderter Haut
- gründliches Waschen mit Wasser und Seife
- Danach, falls verfügbar, Abreiben der Hautoberfläche mit großzügiger Einbeziehung des Umfelds um das kontaminierte Areal mit einem mit Hautantiseptikum satt getränkten Tupfer.
- Im Anschluss an die Sofortmaßnahmen
- Entscheid über systemische, medikamentöse Postexpositionsprophylaxe
- Unfalldokumentation (D-Ärzt*in/ Betriebsärzt*in)
- erster HIV-Antikörper-Test
- Hepatitis-Serologie
Sofortmaßnahmen nach sexueller HIV-Exposition30
- Nach einer Exposition bei eindringendem Geschlechtsverkehr
- Penis unter fließendem Wasser mit Seife waschen.
- Dazu sollte die Vorhaut zurückgezogen und die Eichel sowie die Innenseite der Vorhaut vorsichtig (ohne Druck auf die Schleimhaut auszuüben) gereinigt werden.
Eine Scheiden- oder Darmspülung nach einer Exposition bei rezeptivem Geschlechtsverkehr kann angesichts einer unklaren Datenlage nicht empfohlen werden.
- Penis unter fließendem Wasser mit Seife waschen.
- Nach der Aufnahme von Sperma in den Mund
- Dieses möglichst umgehend und vollständig ausspucken.
- Danach sollte die Mundhöhle 4- bis 5-mal kurz (etwa 15
Sekundensec) mit Wasser gespült werden. - Es ist unklar, ob das Schlucken aufgenommener Samenflüssigkeit ungünstiger ist als das Ausspucken.
- Bei Ejakulation im hinteren Rachenbereich gelingt das Entfernen des Ejakulates aus der Mundhöhle durch Schlucken ggf. effektiver als durch Spucken.
- Wenn Ejakulat ins Auge gelangt, sollte dieses sofort mit Wasser ausgespült werden.
Blutprobennahme nach HIV-Exposition
- Blutproben vom Exponierten
- HIV Ag/Ab-Test (evtl. Schnelltest)
- Anti-HCV
- HBsAg und Anti-HBs
- Syphilis-Serologie
- Differenzialblutbild
- Kreatinin
- Bilirubin, GPT, AP
- Blutzucker, Lipide
- evtl. Schwangerschaftstest
- evtl. Drogenscreening
- Test auf andere sexuell übertragbare Krankheiten nach Ermessen, ggf. Kontrolluntersuchungen nach 2 und 6 Wochen
- Wiederholung des HIV-Antikörpertests und der Hepatitis-Serologie nach 6 Wochen sowie nach 3 und 6 Monaten
- zusätzlich bei Einleitung einer HIV-PEP sowie nach 2 Wochen
- Blutbild
- Transaminasen
- Bilirubin
- Gamma-GT
- Kreatinin
- Urinstatus und -Sediment
- Blutzucker
- Sollte ein akutes, fieberhaftes Krankheitsbild innerhalb von 3 Monaten nach der Exposition oder nach dem Ende der medikamentösen Prophylaxe auftreten, ist die diagnostische Abklärung einer primären HIV-Infektion erforderlich, bei negativem Antikörpernachweis ggf. auch durch Nachweis viraler Nukleinsäuren (NAT, HIV-PCR).
- Besonders verdächtig ist ein akutes Krankheitsbild innerhalb der ersten 4 Wochen nach Exposition oder Ende der PEP.
- Ein positiver PCR-Befund bedarf der Bestätigung mittels einer 2. Probe.
- Der routinemäßige Einsatz eines Nukleinsäureamplifikationsverfahrens bei asymptomatischen HIV-exponierten Personen ist wegen des niedrigen positiven Vorhersagewertes nicht angezeigt.
- Blutprobe von der Indexperson
- HIV-Antikörper-/-Antigen-Kombinationstest (HIV Ag/Ab-Test)
- HIV-RNA
- Anti-HCV und Hepatitis C-RNA
- HBsAg und Anti-HBs
- evtl. Drogenscreening
- Wenn die HIV-Infektion der Indexperson gesichert ist und keine aktuellen Kontrollwerte vorliegen, sollte eine neue Bestimmung der CD4-Zellen/µl und der aktuellen Viruslast angestrebt werden, entweder in der behandelnden Klinik oder in der Hausarztpraxis.
- Sollten HIV-Resistenzanalysen der Indexperson vorliegen, sollten diese in den Entscheidungsprozess zur Empfehlung einer PEP einfließen.
Das Einverständnis zurVor Durchführung des HIV-Testes und der Hepatitis-SerologiemussEinverständnisvorliegen,derbevoruntersuchtendiesePersonUntersuchungen durchgeführt werdeneinholen.- Eine Ablehnung des HIV-Testes durch die Indexperson ist zu respektieren.
- In einigen Bundesländern gibt es weitergehende Regelungen, die unter bestimmten Voraussetzungen eine Testung der Indexperson (z. B. nach Vergewaltigung oder Angriff mit einer gebrauchten Spritze) auch ohne deren Einverständnis erlauben. In der Regel ist dafür eine richterliche Anordnung erforderlich.
Postexpositionsprophylaxe (PEP)6529
Leitlinie: Indikationen für eine PEP6529
Bei beruflicher HIV-Exposition (Indexperson HIV-positiv)
EineHIV-PEPsolltesoll beiKontakten miterhöhtem Infektionsrisikoempfohlen werden.erfolgen:
massive Inokulation (> 1 ml) von Blut oder anderer (Körper-)Flüssigkeit mit (potenziell) hoher Viruskonzentration- (blutende) perkutane Stichverletzung mit Injektionsnadel oder anderer Hohlraumnadel und Viruslast der Indexperson > 50 Kopien/ml oder unbekannt
- Schnittverletzung mit kontaminiertem Skalpell, Messer o. Ä. und Viruslast der Indexperson > 50 Kopien/ml oder unbekannt.
- Eine HIV-PEP kann
angeboten werdenerfolgen bei:- (blutender) perkutaner Stichverletzung mit Injektionsnadel oder anderer Hohlraumnadel und Viruslast der Indexperson < 50 Kopien/ml
- Schnittverletzung mit kontaminiertem Skalpell, Messer o. Ä. und Viruslast der Indexperson < 50 Kopien/ml
- Schleimhautkontakt oder Kontakt nichtintakter Haut (Hautekzem, frischer Wunde etc.) mit Flüssigkeiten potenziell hoher Viruslast bei der Indexperson (> 50 Kopien/ml oder unbekannt)
- sichtbaren, oberflächlichen Verletzungen ohne Blutfluss z. B. mit einer blutig tingierten chirurgischen Nadel und potenziell hoher Viruslast bei der Indexperson (> 50 Kopien/ml oder unbekannt)
- Spritzer von Blut oder anderen Körperflüssigkeiten ins Auge und potenziell hoher Viruslast bei der Indexperson (> 50 Kopien/ml oder unbekannt)
- massiver Inokulation (> 1 ml) von Blut oder anderer (Körper-)Flüssigkeit, z. B. in ein offenes Operationsfeld, und potenziell hohe Viruslast bei der Indexperson (> 50 Kopien/ml oder unbekannt).
- Eine HIV-PEP ist nicht indiziert bei allen fraglichen HIV-Expositionen ohne oder mit geringem Risiko, z. B.:
- Haut- oder Schleimhautkontakt Kontakt zu Flüssigkeiten niedrigen Risikos wie Urin oder Speichel
- Kontakt von infektiösem Material jeden Risikos zu intakter Haut
- Schleimhautkontakt oder Kontakt nichtintakter Haut (Hautekzem, frischer Wunde etc.) mit Körperflüssigkeiten einer Indexperson mit Viruslast < 50 Kopien/ml
- bei sichtbaren, oberflächlichen Verletzungen ohne Blutfluss z. B. mit einer blutig tingierten chirurgischen Nadel und Viruslast der Indexperson < 50 Kopien/ml.
NichtberuflicheBiss- parenteraleund ExpositionSchnittverletzungen
- HIV-PEP soll erfolgen nach:
- tiefen blutigen Bissverletzungen durch eine nicht oder nicht
ausreichend antiretroviral behandelte HIV-positive Person, die zum Zeitpunkt des Bisses selbst blutende Verletzungen im Mund aufweist (z. B. Zungenbiss bei epileptischem Anfall).
- tiefen blutigen Bissverletzungen durch eine nicht oder nicht
- PEP empfehlen bei:
versehentlicherseriellenTransfusionblutendenvonVerletzungen durch das gleiche Instrument, z. B. bei seriellen Verletzungen mit einem Messer und unbekanntem oder nur zeitverzögert ermittelbarem HIV-haltigenStatusBlutkonservenderoderVerletzten.
I. Erhaltv. vonDrogengebrauch mitund hoherVerletzung Wahrscheinlichkeitan HIV-haltigen Blutprodukten oder Organen (Expert*innen hinsichtlich Dauer einer Kanülen
- PEP
hinzuziehen)soll erfolgen nach:
- gemeinsamer Nutzung eines HIV-kontaminierten Injektionsbestecks.
- PEP kann erfolgen nach:
- gemeinsamer Nutzung eines Injektionsbestecks ohne Kenntnis des HIV-Status der anderen Drogen-Konsumierenden.
- PEP soll nicht erfolgen nach:
- Stichverletzungen Unbeteiligter durch
mehrere DrogengebrauchendeherumliegendesgemeinsamDrogen-Injektionsbesteck (Abklären, ob eine HIV-PrEP-Beratung sinnvoll ist und gewKanünscht wirdlen).)
- Stichverletzungen Unbeteiligter durch
SexuelleSex Expositionmit HIV-infizierter Person
- Ungeschützter
insertiver oder rezeptiver vaginaler oder analer Geschlechtsverkehr(z. B. infolge eines geplatzten Kondoms) insertiver oder rezeptiver vaginaler oder analer Geschlechtsverkehr mit einer bekannt HIV-infizierten Person - PEP empfehlen, wenn die Indexperson unbehandelt oder die Viruslast > 1.000 Kopien/ml oder der Behandlungsstatus nicht eruierbar ist.
- PEP anbieten, wenn Viruslast der Indexperson 50–1.000 Kopien/ml.
- Keine PEP-Indikation, wenn Indexperson wirksam behandelt (Viruslast < 50 Kopien/ml) ist.
Ungeschützter Geschlechtsverkehr bei
Bei unbekanntem HIV-Status der PartnerSexpartner*innen
- PEP anbieten
.
keinenachEinigkeitungeschütztembezüglichAnal-PEPoder Vaginalverkehr*, wenn die Wahrscheinlichkeit, dass bei den Sexualpartner*innen eine unbekannte oder nicht behandelte HIV-IndikationInfektion vorliegen könnte, erhöht ist, z. B.:- bei Sex zwischen Männern – oder –
DiebeistatistischeHeterosexuellen,ExpositionswahrscheinlichkeitwennistdiesehrSexualpartner*innengeringaktiv i. v. Drogen konsumieren, aus einer HIV-Hochprävalenzregion (≤ 1:10z.000B. Subsahara-Afrika) kommen oder bisexuell sind.
- Oralverkehr*
- Unabhängig von der Wahrscheinlichkeit, mit der bei den
Sexualpartner*innen eine unbehandelte HIV-Infektion vorliegen könnte und unabhängig von der Art des Oralverkehrs (aktiv, passiv, Sperma aufnehmend).
- Unabhängig von der Wahrscheinlichkeit, mit der bei den
- Küssen
- Kontakt von HIV mit Haut.
Behandlungszeitpunkt6529
Eine medikamentöse HIV-PEPsollte so frunverzüh wie möglich nacheinerFeststellungExpositionderbegonnenIndikationwerden.beginnen!- Die besten Ergebnisse sind bei einem Prophylaxebeginn innerhalb von 24 Stunden, besser noch innerhalb von 2 Stunden zu erwarten.
- Liegen bereits mehr als 72 Stunden zwischen der Exposition und dem möglichen
Prophylaxe-BeginnProphylaxebeginn, so kommt eine Prophylaxe in der Regel nicht mehr infrage.
Therapieschema PEP6529
- Standardkombination mit 2 NRTI und einem PI
AntiviraleDieSubstanzeninfragesindkommendenbislangMedikamentenichthabenzurkeine formelle Zulassung für eine PEPzugelassen (Stand September 2019). DieBehandlungKostenträgererfolgtübernehmendaheraberimdieRahmenBehandlungskosten,deswennOff-Label-Use.Wenneineine sichere oder sehr wahrscheinlichehohes HIV-ExpositionÜbertragungsrisikovorliegtbesteht und diePEPBehandlunggemäßleitlinienkonformden Leitlinien65eingesetzt wird, ist sie nach Ansicht des Gemeinsamen Bundesausschusses (G-BA) eine Form der Frühtherapie zur Verhinderung einer manifesten Infektion. Damit ist der Gebrauch der antiretroviralen Medikamente im Rahmen der Leitlinie zulassungskonform und erstattungsfähig (Stand September 2019)erfolgt.
- Empfohlene Therapieschemata
TenofovirTDF/FTCdisoproxil(Tenofovirdisoproxil/Emtricitabin) 245/200 mg 1 x 1 + RAL (Raltegravir) 400 mg 2 x 1 – oder –ODER RaltegravirRAL 600 mg 1 x 2 – oder –ODERTDF/FTC (wie oben) + DTG (Dolutegravir) 50 mg 1 x 1 (ggf. Schwangerschaftstest vor Behandlungsbeginn; Näheres siehe Abschnitt Schwangerschaft und Stillzeit) – oder –alternativTAFPLUSDarunavir/Ritonavir(Tenofoviralafenamid)800/100+mgFTC1+xBIC1Lopinavir/Ritonavir 200/50 mg 2 x 2
- Die Behandlungszeit beträgt
Längere Behandlungszeiträume können in Erwägung gezogen werden, wenn es zu einer massiven Kontamination gekommen ist oder zwischen Exposition und Prophylaxe-Beginn mehr als 36–48 Stunden verstrichen sind.Die Konsultation von Expert*innen wird dann dringend empfohlen.
Expert*innen konsultieren
Trotz ausführlicher nationaler und internationaler Leitlinien erfordern individuelle Besonderheiten der HIV-Exposition immer wieder den Rat von Expert*innen. Das trifft besonders in folgenden Situationen zu:Zeitraum zwischen möglicher Exposition und Beginn einer Prophylaxe ist länger als 24 Stunden.Ein hohes Infektionsrisiko besteht aufgrund massiver Inokulation von virushaltigem Material.Art und Infektionsgefährdung durch das verursachende Instrument der akzidentellen Verletzung ist weitgehend unklar.Exponierte Person ist (vermutlich) schwanger.Die Index-Person wurde lange antiretroviral vorbehandelt und eine Multiresistenz der Viren ist nachgewiesen oder möglich.Erhebliche unerwünschte Wirkungen des initialen Prophylaxeregimes stellen eine Durchführung dieser Prophylaxe infrage oder machen eine Umstellung erforderlich.
- Die Deutsche Aidshilfe bietet eine Liste der Kliniken, die 24 Stunden am Tag eine Beratung zur HIV-PEP durchführen können.
Sekundärbehandlung
- Der gesamte Abschnitt basiert auf dieser Referenz.
61 - Auf den Bedarf an psychosozialer Unterstützung achten sowohl bei Verdacht auf eine HIV-Infektion als auch bei sicher positivem Test.
- Aus der Diagnose einer HIV-Infektion können sich schwerwiegende psychosoziale Probleme ergeben.
- Für die häufig sehr schwierige Bewältigung dieser Probleme stehen an vielen Orten besondere Einrichtungen zur Verfügung, z. B. Selbsthilfegruppen oder psychosoziale Beratungsstellen.
- Eine enge Zusammenarbeit mit derartigen Einrichtungen anstreben.
- Soweit regional Angebote bestehen, sollten auch die Empfehlungen von Aufklärungs- und Schulungsangeboten erwogen werden, wie sie von der Deutschen Aidshilfe vermittelt werden.
- Psychische Symptome wie Angst und Depression können sowohl als Reaktion auf die befürchtete oder eingetretene Erkrankung auftreten als auch als Nebenwirkung der ART.
- Unter Efavirenz wurde eine erhöhte Inzidenz von Depression und Suizidalität beobachtet.
- Bei der medikamentösen Behandlung psychischer Begleiterkrankungen sind potenzielle Wechselwirkungen von Psychopharmaka mit der ART zu beachten.
- Zur palliativmedizinischen Behandlung bei AIDS siehe auch folgende Artikel:
Prävention
Empfehlungen
- Über die Verbreitungsweise informieren.
- Schutz durch Kondom beim Geschlechtsverkehr
- Bringt mindestens 80 % Reduktion der HIV-Inzidenz beim konsequenten Gebrauch unter Heterosexuellen.
66-67
- Bringt mindestens 80 % Reduktion der HIV-Inzidenz beim konsequenten Gebrauch unter Heterosexuellen.
- Das Teilen von Spritzen vermeiden.
- Die Anzahl der Sexualpartner*innen reduzieren.
- Die Ansteckungsquelle finden.
- Mütter mit HIV-Infektion sollten nicht stillen.
Vorbeugende Behandlung – Medikamente/Impfstoffe
- Schwangere werden mit ART behandelt, um die Übertragung auf das Kind zu vermeiden.
68 - In hochendemischen Gebieten hat sich die Instillation von Tenofovir Gel in die Scheide bei Geschlechtsverkehr als eine Methode erwiesen, die Ansteckungsgefahr um ca. 50 % zu verringern, wenn Frauen das Gel regelmäßig anwendeten (bei mehr als 80 % der
Geschlechtsverkehresexuellen Begegnungen).69 - Primärprophylaxe gegen opportunistische Infektionen mit Trimetoprim/Sulfamethoxazole bei CD4-Zellzahl geringer als 200/µl
- Bei fehlenden HAV- und/oder HBV-Antikörpern ist eine entsprechende Impfung indiziert, die Indikation für eine HPV-Impfung ist zu prüfen.
61 - Die Anwendung von Lebendimpfstoffen, inkl. BCG ist kontraindiziert.
- Eine vorbeugende Behandlung gegen Tuberkulose bei HIV-Infizierten wird empfohlen bei:
- positiver Tuberkulinprobe (Mantoux > 5 mm) und längerem Aufenthalt in einem Land mit hoher Prävalenz für Tuberkulose
- Personen, bei denen die Tuberkulinprobe umgeschlagen ist, unabhängig von Alter und früheren BCG-Impfungen.
- Ausnahme sind früher BCG-Geimpfte, bei denen der Umschlag auf die Verbesserung der zellulären Immunität aufgrund der antiviralen Behandlung zurückgeführt wird.
- enger Kontakt (bei CD4-Zellzahl < 2000/µl) zu Personen mit ansteckender Tuberkulose
Präexpositionsprophylaxe (PrEP)7031
Leitlinie: PrEP7031
Indikation zur oralen PrEP
- Soll als prophylaktische Maßnahme Menschen mit substanziellem HIV-Infektionsrisiko angeboten werden.
- Ein substanzielles HIV-Infektionsrisiko besteht bei einer HIV-Inzidenz von mehr als 3 pro 100 Personenjahren ohne Zugang zur PrEP. Insbesondere gehören hierzu folgende HIV-negative Personen:
- Männer, die Sex mit Männern haben (MSM), oder Transgender-Personen mit der Angabe von analem Sex ohne Kondom innerhalb der letzten 3–6 Monate und/oder voraussichtlich in den nächsten Monaten bzw. einer sexuell übertragbaren Infektion (STI) in den letzten 12 Monaten.
- serodiskordante Konstellationen mit virämischen HIV-positiven Partner*innen ohne ART, einer nicht suppressiven ART oder in der Anfangsphase einer ART (also einer HIV-RNA, die nicht schon 6 Monate bei mindestens < 200 RNA-Kopien/ml liegt)
- Erhalten die HIV-positiven Partner*innen eine nichtsuppressive ART, sollte vor Verschreibung einer PrEP nach Möglichkeit eine Resistenzanalyse erfolgen, um eine Unwirksamkeit von TDF und/oder FTC auszuschließen.
- Darüber hinaus kann individuell ein substanzielles Risiko bestehen, insbesondere bei:
- Menschen mit Sex ohne Kondom mit Personen, bei denen eine undiagnostizierte HIV-Infektion wahrscheinlich ist.
- drogeninjizierenden Personen ohne Gebrauch steriler Injektionsmaterialien.
Empfohlene Medikamente
- Zur PrEP soll das orale Kombinationspräparat Emtricitabin/Tenofovirdisoproxil (TDF/FTC) eingesetzt werden.
- Die PrEP soll als kontinuierliche einmal tägliche Einnahme von TDF/FTC erfolgen.
- Eine intermittierende, anlassbezogene Einnahme der PrEP kann als Gebrauch außerhalb der Zulassung (Off-Label-Use) im individuellen Fall erwogen werden.
Nur zusammen mit anderen Präventionsmaßnahmen
- Die HIV-PrEP soll nur in Kombination mit einer Beratung zu anderen Schutzmaßnahmen vor einer HIV-Infektion, STI einschließlich viraler Hepatitiden verordnet werden.
- Hierbei ist zu betonen, dass die HIV-PrEP das Risiko einer HIV-Transmission, nicht jedoch das Risiko für andere sexuell übertragbare Infektionen reduziert.
Ausschluss von Kontraindikationen
- Neben dem Ausmaß des HIV-Infektionsrisikos sind potenzielle Kontraindikationen sowie mindestens die folgenden Voraussetzungen zu prüfen:
- aktuelle, negative HIV-Serologie (4. Generations-ELISA mit p24-Ag), keinesfalls älter als 14 Tage; Wiederholung 4 Wochen nach Beginn der PrEP
- Ausschluss einer replikativen Hepatitis-B-Infektion mittels Serologie (HBs-Antigen, anti-HBc-Antikörper) oder Prüfung der HBV-Immunität (HBs-Antikörper, ggf. Impfung gegen HBV)
- Ausschluss einer Nierenfunktionsstörung mittels Kreatinin-Bestimmung im Serum (eGFR muss mindestens 60 und sollte > 80 ml/min sein).
- Erfordert regelmäßige Medikamenteneinnahme.
- Die Schutzwirkung setzt ab dem Beginn der PrEP verzögert ein.
7031- In der Kolorektalschleimhaut besteht ab Tag 2 der Einnahme eine ausreichende Medikamentenkonzentration, im weiblichen Genitale ab Tag 7.
- Risikosenkung um 75 % unter Emtricitabin/Tenofovir
- Seit 2016 ist Emtricitabin/Tenofovir für die PrEP zugelassen.
- Seit 1. September 2019 werden die Kosten für eine PrEP bei Menschen mit erhöhtem Ansteckungsrisiko von der GKV übernommen.
7132 - Die monatlichen Therapiekosten für Emtricitabin/Tenofovir (Generikum) liegen bei ca. 40–50 € (Stand September 2019).
- Weiterführende Informationen hierzu finden Sie bei der Deutschen Aidshilfe.
HIV-Expositionsprophylaxe in diskordanten Partnerschaften6529
- Neben der konsequenten Verwendung von Kondomen gibt es 2 Möglichkeiten der medikamentösen Intervention:
- ART der HIV-infizierten Partner*innen
, um das Übertragungsrisiko zu minimieren.DasReduktionErgebnis einer randomisierten Interventionsstudie bei diskordanten Paaren belegt, dass bei erfolgreicher Behandlung der HIV-Infektion dasdes Übertragungsrisikobertragungsrisikos aufnichtinfiziertennichtinfizierte Partner*innen um mehr als 95 %reduziert werden kann.Bei dem einzigen in der Studie beobachteten Übertragungsereignis erfolgte die Übertragung wahrscheinlich vor oder kurze Zeit nach dem Beginn der Therapie zu einem Zeitpunkt, zu dem die Virusvermehrung noch nicht vollständig unterdrückt war.65,72-73
- Chemoprophylaxe bei nichtinfizierten Partner*innen
- anlassbezogene Expositionsprophylaxe
,(z. B. nach einem „Kondomunfall“) - anlassunabhängige Dauerprophylaxe (Präexpositionsprophylaxe).
- anlassbezogene Expositionsprophylaxe
- ART der HIV-infizierten Partner*innen
- Präexpositionsprophylaxe (PrEP) (s. o.)
- HIV-diskordante Paare sollten mit den bestehenden medikamentösen Optionen vertraut gemacht werden, sodass sie eine informierte Entscheidung darüber treffen können, ob sie eine der Möglichkeiten in Anspruch nehmen wollen und damit sie sich entsprechend vorbereiten können.
- Bei Entscheidung zur PrEP: Untersuchungsintervalle vereinbaren.
- Ist für evtl. zukünftige Expositionsnotfälle eine PEP vorgesehen: Vorstellungs- und Konsultationsmodalitäten klären, z. B. Telefonnummer für Rückfragen.
Kinder in öffentlichen Einrichtungen
- Die aktuellen Erkenntnisse geben keine Hinweise darauf, dass Kinder mit HIV-Infektion in der Praxis ein Ansteckungsrisiko für andere Kinder oder Erwachsene in der näheren Umgebung darstellen. HIV-positive Kinder können deshalb ohne Einschränkung Kinderbetreuungseinrichtungen und andere öffentliche Einrichtungen aufsuchen.
- Es besteht keine Informationspflicht gegenüber betroffenen Einrichtungen, wie z. B. der Schule, dem Hort oder dem Kindergarten. Da HIV im Alltagskontakt nicht ansteckend ist, schätzt der Gesetzgeber die Gefahr der Stigmatisierung der betroffenen Personen höher ein als eine Gefährdung Dritter.
7433 - Wenn das HIV-positive Kind besondere Verhaltensprobleme hat, die für andere Kinder zu einem erhöhten Risiko führen, in Kontakt mit infiziertem Blut zu kommen (Beißen/Kratzen), oder besondere Hautprobleme, die zu einem erhöhten Risiko für das Personal werden könnten, ist es ratsam, die Situation vor Aufnahme in Kindergarten und Schule nach medizinischen und pädagogischen Maßstäben zu bewerten. Dies gilt auch für Kinder, bei denen sich AIDS entwickelt hat.
HIV und Arbeit75
- Berufliche HIV-Übertragungen sind bisher nur durch Blut oder Viruskonzentrat (Viruskultur) erfolgt, und zwar bei:
- Stich- und Schnittverletzungen
- Kontakt infektiöser Körperflüssigkeiten mit einer offenen Wunde oder nichtintakter (geschädigter) Haut des Exponierten – oder –
- Schleimhautexposition (inkl. Blutspritzern ins Auge).
- Aus diesem Grund bestehen keine allgemeinen Restriktionen für die Ausübung des Berufs.
- Die Arbeitnehmer*innen sind nicht dazu verpflichtet, ihren Infektionsstatus den Arbeitgeber*innen mitzuteilen.
- Ausnahme:
medizinischesMedizinisches Personal, das Operationen mit erhöhter HIV-Übertragungsgefahr ausführt. - Auch Berufe, bei denen der Betroffene mit Lebensmitteln in Berührung kommt, wie Schlachten, Fischveredelung, Gastronomie, können von einer Person mit HIV-Infektion ohne Einschränkung ausgeübt werden.
- Es keine Hinweise darauf, dass sich das Virus durch Nahrungsmittel überträgt.
- In Berufen, in denen man mit Lebensmitteln zu tun hat, gelten – unabhängig von HIV – allgemeine Regeln, dass Personen mit offenen oder infizierten Wunden, Hautinfektionen, Hautschäden oder Diarrhö nicht mit Lebensmitteln in Kontakt kommen dürfen.
Anerkennung als Berufskrankheit
- Tritt eine HIV-Infektion im Zusammenhang mit der beruflichen Tätigkeit auf, kann diese Erkrankung als Berufskrankheit anerkannt werden.
7634 - Zuständig hierfür sind die gesetzlichen Unfallversicherungsträger.
- Der Verdacht auf eine Berufskrankheit muss dort gemeldet werden (Meldebogen
7735). - Es wird eine ausführliche Arbeits- und Gefährdungsanamnese erhoben und ein Gutachten entscheidet über die Anerkennung als Berufskrankheit.
- Dann können bestimmte Maßnahmen auf Kosten der GUV durchgeführt werden:
- spezielle therapeutische Maßnahmen
- Minderung der Erwerbsfähigkeit bis zur Zahlung einer Rente.
7836
Meldepflicht gemäß IfSG
- Gemäß § 7 Abs. 3 IfSG ist der direkte oder indirekte Nachweis von HIV nichtnamentlich direkt an das Robert Koch-Institut (RKI) zu melden.
61- Primär meldepflichtig ist das diagnostizierende Labor, das den einsendenden Ärzt*innen einen Durchschlag des Meldebogens schickt.
- Die einsendenden Ärzt*innen sind verpflichtet, dem Labor nicht zur Verfügung stehende demografische, anamnestische und klinische Angaben auf dem Meldebogen zu ergänzen und den so ergänzten Meldebogen direkt an das RKI zu senden.
- Meldebögen und Freiumschläge für die Rücksendung an das RKI können im RKI angefordert werden: www.rki.de.
- Um Mehrfachmeldungen ein- und derselben Person zu erkennen, wird eine die Anonymität wahrende fallbezogene Verschlüsselung verwendet (§ 10 Abs. 2 IfSG), die aus Elementen des Vor- und Zunamens generiert wird.
Das AIDS-Fallregister
- Der gesamte Abschnitt basiert auf dieser Referenz.
61 - Seit 1982 werden die freiwilligen und anonymen Fallberichte der behandelnden Ärzt*innen über AIDS-Erkrankungs- und Todesfälle in der Bundesrepublik Deutschland in einem zentralen Fallregister erfasst.
- Grundlage der Meldungen ist die jeweils geltende AIDS-Falldefinition zur epidemiologischen Erfassung. Die europaweit angewendete „AIDS-Falldefinition für die epidemiologische Überwachung“ von 1993 ist deckungsgleich mit dem Stadium „C“ der CDC-Stadieneinteilung von 1993.
- Die freiwilligen und anonymisierten Meldungen an das AIDS-Fallregister erfolgen auf einem gesonderten Meldebogen, der als vertraulicher Arztbericht gekennzeichnet ist und den standesrechtlichen Regelungen unterliegt.
- Berichte über HIV-Neudiagnosen, AIDS-Fallberichte sowie Todesfallmeldungen (von allen HIV-Patient*innen) an:
- Robert Koch-Institut, Abteilung Infektionsepidemiologie/FG 34, Postfach 650261, 13302 Berlin, Tel.: +49 (0)30 - 18754-3424, Fax: +49 (0)30 - 18754-3533, Kontakt: E-Mail
- Unter dieser Adresse sind AIDS-Fallberichtsbögen und -Falldefinitionen sowie HIV-Meldebögen kostenlos zu beziehen.
Verlauf, Komplikationen und Prognose
Verlauf
- HIV-Infektionen verlaufen gewöhnlich langsam mit einer schrittweisen Progression über mehrere Jahre.
- Mit moderner ART, gutem Kontrollprogramm und guter Therapietreue können die meisten Patient*innen ein normales Leben führen, ohne wesentliche Verkürzung der Lebensaussichten.
Komplikationen
- Psychische Störungen und Suizid
- Infektionen mit opportunistischen Mikroorganismen
- Im Nervensystem
- Infektionen
- neurokognitive Störungen
79 - Neuropathien, z. B. Radikulopathien
- Im Herz-Kreislauf-System
- erhöhtes Risiko für Herz-Kreislauf-Erkrankungen
80 - Achtung: Erhöhtes Risiko für Rhabdomyolyse bei der Kombination von Proteasehemmern und Statinen!
- erhöhtes Risiko für Herz-Kreislauf-Erkrankungen
- In den Atmungsorganen
- Pneumocystis-Pneumonie
- andere Lungeninfektionen
- Im Verdauungssystem
- Kandida-Infektionen
- Aphthen
- infektiöse Ösophagitis
- chronische Hepatitis
81 - nicht-alkoholische Fettleber
- Im Urogenitalsystem
- Infektionen
- Nierenerkrankungen
82
- Im Muskel-Skelett-System
- Metabolische und endokrine Komplikationen
- erhöhtes Risiko für Insulinresistenz, Diabetes, Dyslipidämie und Lipodystrophie
82
- erhöhtes Risiko für Insulinresistenz, Diabetes, Dyslipidämie und Lipodystrophie
- Malignomentwicklung
- Seit der Einführung einer hochwirksamen ART treten HIV-bedingte Krebsarten viel seltener auf.
Beobachtung der CD4-Zellzahl
- Manifestationen HIV-bezogener opportunistischer Infektionen können auf allen Niveaus von CD4 vorkommen, aber die Inzidenz von schweren und potenziell lebensbedrohlichen Infektionen erhöht sich dramatisch, wenn die CD4-Zellzahl auf unter 200/µl fällt.
- CD4-Werte bei 200, 100 und 50/µl markieren ein Risiko für Pneumocystis-jiroveci-, Toxoplasma-gondii- und Mycobacterium-avium-Infektionen und sind eine Indikation für antibiotische Prophylaxe.
84
Prognose
- Die HIV-Infektion hat sich von einer fast 100 % tödlichen zu einer chronischen Krankheit mit lebenslanger Notwendigkeit zur Behandlung gewandelt.
- Unbehandelt
- Die durchschnittliche Zeit von der Infektion bis zur Entwicklung von AIDS bei Patient*innen ohne antivirale Behandlung liegt bei 8–10 Jahren.
85 - Die Sterblichkeit bei vollständig entwickeltem AIDS ohne ART beträgt 80 % nach 2 Jahren und 100 % nach 5 Jahren.
- Die durchschnittliche Zeit von der Infektion bis zur Entwicklung von AIDS bei Patient*innen ohne antivirale Behandlung liegt bei 8–10 Jahren.
- Optimale Behandlung
- Bei moderner Kombinationsbehandlung kann die HIV-Infektion lange Zeit unterdrückt werden.
- Bei Patient*innen, die schon AIDS entwickelt haben, verbessert sich unter der Therapie die geschwächte Immunfunktion.
- Bei Patient*innen, die die Behandlung zuverlässig einnehmen und gut vertragen, ist die Lebenserwartung in einem ähnlich moderaten Ausmaß reduziert wie bei anderen chronischen Erkrankungen, z. B. Diabetes.
In norwegischen Studien mit Erkrankten, die vor 1994 diagnostiziert wurden, im Vergleich zu Patient*innen mit einer Diagnose nach 1997 hat sich die 5-Jahres-Mortalitätsrate im Verhältnis zur Normalbevölkerung von 22,6 auf 3,96 reduziert.86Eine multinationale Studie zeigt entsprechend:Die Exzessmortalität, d. h. die Zahl der krankheitsbedingt zusätzlichen Todesfälle im Vergleich zur Normalbevölkerung, betrug bei HIV-positiven Personen vor Einführung der ART 40,8 pro 1.000 Personenjahre. Heute beträgt sie 6,1 Todesfälle pro 1.000 Personenjahre.87
Kinder mit HIV-Infektion61,8837
- Eine HIV-Infektion verläuft bei Kindern deutlich aggressiver als bei Erwachsenen.
- Bei Säuglingen und Kleinkindern stehen Entwicklungsstörungen und schwere bakterielle Infektionen im Vordergrund.
- 1/5 aller unbehandelten Säuglinge stirbt im ersten Lebensjahr oder erleidet neurologische Schäden durch HIV-Enzephalopathien.
- Die ART ist daher bereits in den ersten Lebensmonaten zu beginnen.
Verlaufskontrolle
- Die Koordination der Verlaufskontrolle sollte an einem auf HIV-Patient*innen spezialisierten Zentrum (Schwerpunktpraxis oder Klinik) erfolgen.
- Die Zusammenarbeit und Beteiligung der Hausärzt*innen ist wichtig.
- Im Gespräch bleiben – zu Themen wie Sexualität, Partner*innen, Prävention, Kinderwunsch.
- Regelmäßig
- Exploration der psychosozialen Situation
- jährliche Grippeimpfung
- allgemeine Vorsorgeuntersuchungen
- jährliche Vorsorgeuntersuchungen auf Dysplasien
61- bei Frauen: zervikale und rektale
- Bei Männern, die Sex mit Männern haben: rektale.
- evtl. Untersuchung auf sexuell übertragbare Krankheiten
Labor
- CD4-Zellen und HIV-RNA
- Hb, Leukozyten mit Diff., Thrombozyten, Bilirubin, GPT, AP, Ca, Kreatinin, GFR
- Glukose, Cholesterin gesamt, LDL, HDL und Triglyzeride
- CK, Amylase, Laktat
- Serologiekontrolle bei früher negativem Befund für Hepatitis A/B/C
- Evtl. jährliche Syphilis-Kontrolle
- Urinstatus
- Evtl. Medikamentenspiegel
- Evtl. Drogenscreening
Medikamentenspiegel (Therapeutic Drug Monitoring, TDM)183
Mehrere Studien haben eineKorrelation zwischenderPlasmakonzentration und antiviraler Wirksamkeitvon PI nachgewiesen.Hohe Variabilität der intraindividuellen Plasmaspiegel zu unterschiedlichen Zeitpunkten.MöglicheGründeIndikationen zur Plasmaspiegelbestimmung:-
Nahrungseffekteumfangreiche Komedikation/Verdacht auf pharmakokinetische InteraktionenMedikamenteninteraktionenerheblich unter- oder übergewichtige BehandelteSchwangerschaftMultiresistenzKrankheitsstadiumTherapie von SchwangerenAdhärenzschwankungenTherapie von Kindernklinisch-pharmakologischeintestinaleEigenschaftenResorptionsstörungen- höhergradige Leberfunktionsstörungen
- Wirkverlust der
Substanzklassen.
NRTIWirkenVerdachterstaufnach intrazellulärer Phosphorylierung.keine klare Beziehung zwischen Wirkung und Höhe der PlasmaspiegelEin TDM dieser Substanzen in Plasma oder Serum ist nicht sinnvoll.
PIerhebliche inter- und intraindividuelle VariabilitMedikamententoxizitätder Absorption und MetabolisierungIhr Abbau über das Cytochrom P450-System kann durch andere Pharmaka gehemmt und induziert werden.Dies kann zu komplexen Interaktionen mit Begleitmedikation und Nahrungsmitteln führen.Wechselwirkungen durch Hemmung des Enzyms UGT1A1 können die Wirkspiegel beeinträchtigen (z. B. Atazanavir und Raltegravir).Besonders bei Atazanavir ist die Resorption vom Magen-pH abhängig.Ein TDM kann erforderlich werden.
NNRTIWerden gastrointestinal besser und gleichmäßiger als die PI resorbiert.Die Plasmakonzentrationen mehrerer Substanzen variieren durch physiologische Änderungen des Verteilungsraumes, z. B. des Körpergewichtes in der Schwangerschaft.Ritonavir, Rilpivirin, Cobicistat und Dolutegravir blockieren die aktive Kreatininsekretion in der Niere.Interaktionen mit der Begleitmedikationz. B. Metformin mit DolutegravirJede Änderung der HIV-Medikation und der Begleitmedikation sollte zuvor bezüglich Interaktionen analysiert und entsprechend angepasst werden.
Zeichen für Progression?183
- Steigende HIV-RNA-Zahl
- Fallende CD4-Zellzahl
- in der Regel erst nach dem virologischen Versagen
- Beruht nicht immer auf Therapieversagen und Progression.
- Ein signifikanter Abfall der CD4-Zellzahl ohne virologisches Versagen kann auch auf komplizierende Erkrankungen hindeuten (z. B. Leberzirrhose, Tuberkulose, maligne Lymphome).
- Neu aufgetretene oder verstärkte Symptome:
- anhaltendes Fieber
- Nachtschweiß
- anhaltende Diarrhö
- Husten
- Dyspnoe
- Gewichtsverlust
- Wundheilungsstörungen
- Belag im Rachen
- Hauteffloreszenzen/-tumoren
- Sehstörungen.
- Opportunistische Erkrankungen können auch als Exazerbation subklinischer Infektionen unter antiretroviraler Therapie auftreten (Immunrekonstitutionssyndrom) und sind dann nicht als Therapieversagen zu interpretieren.
Anstieg der Virämie – mögliche Ursachen183
- Die häufigste Ursache eines Anstiegs der Plasmavirämie ist ein Adhärenzproblem.
- Weitere mögliche Ursachen:
- verminderte Absorption oder beschleunigte Metabolisierung antiretroviraler Substanzen
- Medikamenteninteraktionen
- bestehende oder neue virale Resistenzen
- unzureichende Dosierung.
Leitlinie: Verlaufskontrolle unter ART183,8938
Kontrollintervalle
- CD4-Zellzahl und HIV-RNA sollten bei Diagnosestellung und anschließend in
23- bis36-monatigen Abständen bestimmt werden.- Therapieeinleitung und -umstellung erfordern evtl. kurzfristigere Kontrollen.
- Patient*innen, die mit weniger als 200 CD4-Zellen/μl und vor allem mit einer gleichzeitig hohen HI-Viruslast eine ART beginnen, sollten in den ersten Wochen klinisch engmaschig beobachtet werden.
8938 - Nach Reduktion der HIV-RNA durch die Therapie unter 50 Kopien/ml sind Kontrollen alle 2–4 Monate empfohlen
.
Häufig kommt es zu einer nur intermittierend nachweisbaren geringen Plasmavirämie (50–200 Kopien/ml, „Blip“), die zumindest unter einer Kombination mit Proteaseinhibotor und Ritonavir-Booster meistens nicht mit Therapieversagen und Resistenzentwicklung vergesellschaftet ist.Insbesondere unter Therapien mit niedriger genetischer Resistenzbarriere (z. B. Tenofovir-DF/Emtricitabin/Efavirenz) sollten jedoch kurzfristige Kontrollen erfolgen, da eine wiederholte Plasmavirämie über 50 Kopien/ml mit einem Resistenzrisiko assoziiert ist.
Therapieerfolg und -versagen
- Der Therapieerfolg spiegelt sich in einer klinischen Verbesserung und einem Anstieg der CD4-Zellzahl wider und wird von weiteren Faktoren mitbestimmt wie Patientenalter und mögliche Begleiterkrankungen.
- Als Therapieerfolg gilt das nachhaltige Absinken der Plasmavirämie unter 50 HIV-RNA-Kopien pro ml.
Die Virämie sinkt biphasisch: Einem schnellen initialen Abfall in den ersten Wochen folgt eine Phase der langsameren Abnahme.EinBeiWertwiederholtemunterhalbNachweisvoneiner HIV-RNA über 50 Kopien/ml solltenacheinetwavirologisches3–4TherapieversagenMonaten, bei initial sehr hoher Plasmavirämie spätestens nach 6 Monaten erreichtausgeschlossen werden.
ARTEinüberprüfenvirologischesundTherapieversagenevtl. umstellenist bei:Abfalldereiner HIV-RNAumoberhalbwenigervonals 2 log10 nach 4 Wochen – oder –HIV-RNA > 50200 Kopien/mlnach 6 Monaten – oder –bestätigter Anstieg der Plasmavirämie auf > 50 Kopien/ml.
Unter einer Kombination mit Proteaseinhibotor und Ritonavir-Booster kommt es häufiger zu Plasmavirämie-Werten gering über 50 Kopien/ml, die jedoch im Allgemeinen kein erhöhtes Risiko eines Therapieversagens anzeigen.Zur Abklärung sind eine Resistenztestung und/oder eine Plasmaspiegelkontrolle des NNRTI oder PI sinnvoll.
Bei einem ausbleibenden Anstieg oder einem Absinken der CD4-Zellzahl trotz guter Virussuppression ist ein positiver Effekt auf die CD4-Zellzahl durch eine Therapieumstellung nur bei Zidovudin-basierten Therapien oder Therapien mit Tenofovir-DF und Didanosin zu erwarten.Insbesondere bei älteren Patient*innen oder bei schwer geschädigtem Immunsystem ist der immunologische Erfolg trotz guter Virussuppression oft unbefriedigend. Potenziell knochenmarkstoxische antiretrovirale Substanzen sollten vermieden werdenwahrscheinlich.
Resistenztestung bei Therapieversagen
- Bei
virologischemeinerTherapieversagenViruslastsolltevon > 200 Kopien/ml soll einegenotypischeResistenztestungResistenzanalysedurchgeführtaller für die Therapieentscheidung relevanten viralen Genomabschnitte erfolgenwerden.Als Standardverfahren wird die Populationssequenzierung empfohlen.Die klinische Relevanz der Detektion von Minoritäten mittels ultrasensitiver Methoden ist bislang nur bedingt für die NNRTI gezeigt worden.Da es in Therapiepausen zu einer irreführenden Verdrängung durch den Wildtyp kommen kann, sollte die Testung unter laufender Therapie erfolgen.
- Bei einer
PlasmavirbestämietigtenunterViruslast von 50–200–400RNA-Kopien/mlgelingt sie häufig aus technischen Gründen nicht, und das Ergebnis kann evtl. nicht repräsentativ für die gesamte Viruspopulation sein.Ist die Plasmavirämie fürsollte eineResistenzanalyseResistenztestungzu niedrig, kann diese aus peripheren Blutlymphozyten erfolgen, ergibt aber u. U. kein vollständiges Bild der Resistenzsituation und ist in diesem Fall nur zum Nachweis, nicht aber zum sicheren Ausschluss von Resistenzmutationen geeignet.
Genotypische Resistenzbefunde sind diagnostischer Standard und fast immer ausreichend.Sie sollten mithilfe aktueller Interpretationsalgorithmen (z. B.www.hiv-grade.deunter Berücksichtigung der Vortherapie interpretiertangestrebt werden.
Die phänotypische Testung kann beim Einsatz komplexer Salvage-Regime und neuer Substanzen sinnvoll sein.
Medikamentenspiegelbestimmung (Therapeutic Drug Monitoring, TDM)
Eine Spiegelbestimmung von NNRTI bzw. PI kann in folgenden klinischen Situationen sinnvoll sein:Multimedikation (Interaktionen)/komplexe Booster-Therapienerheblich unter- oderübergewichtige Patient*innenNebenwirkungenTherapieversagen (Resistenz?)fehlerhafte Medikamenteneinnahme/ungenügende Therapieadhärenzintestinale ResorptionsstörungenLeberfunktionsstörungenART bei KindernTherapie in der SchwangerschaftOnce-daily-Regime (z. B. Proteaseinhibotor mit Ritonavir-Booster)Einsatz neuer Substanzen (Risiko neuer Interaktionen).
Ein TDM von Raltegravir oder Dolutegravir ist wegen des differenten Metabolismus (UGT1A1) und des geringen Interaktionspotenzials nur in Ausnahmefällen indiziert.Für die Beurteilung der Wirksamkeit ist der Talspiegel der wichtigste Parameter (Ausnahme: Raltegravir), während für die Einschätzung des Toxizitätspotenzials der Gesamtverlauf der Medikamentenspiegel betrachtet werden muss.Entscheidungen über eine Dosismodifikation sollten nicht allein aufgrund des TDM getroffen werden, sondern immer Anamnese, Klinik und Resistenzsituation der Patient*innen miteinbeziehen.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Über das Ansteckungsrisiko und vorbeugende Maßnahmen
- Über die gute Prognose bei zuverlässiger Durchführung der ART
- Therapieunterbrechungen erhöhen das Risiko der Resistenzentwicklung.
- Risiken der medikamentösen Therapie einschl. potenziell lebensbedrohlicher Wechselwirkungen
- Bei Symptomen und Beschwerden, die neu auftreten oder ungewöhnlich lange anhalten: Ärztlichen Rat suchen.
- Regelmäßige Kontrolle der Immunabwehr und die Messung der Viruslast im Blut sind wichtig, um die Behandlung rechtzeitig beginnen oder ggf. umstellen zu können.
- Über Patienten- und Arbeitnehmerrechte
- Vorsorgemaßnahmen, z. B. Impfungen
Patienteninformationen in Deximed
- HIV und AIDS
Was ist HIV?HIV-Übertragung von der Mutter auf das KindHIV-Infektion, DiagnoseHIV – wenn der Test positiv warHIV-Infektion im AlltagHIV-Infektion, BehandlungHIV-Infektion, Symptome und opportunistische Infektionen- Lungenentzündung durch Pneumocystis jiroveci
Patientenorganisationen
Illustrationen

Orale Haarleukoplakie (Quelle: P. Altmeyer, Online Enzyklopaedie Dermatologie, Venerologie und Umweltmedizin)

Bazilläre Angiomatose (Quelle: P. Altmeyer, Online Enzyklopaedie Dermatologie, Venerologie und Umweltmedizin)

Kaposi-Sarkom
Quellen
Leitlinien
- Deutsche AIDS-Gesellschaft (DAIG). Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion. AWMF-Leitlinie Nr. 055-001. S2k, Stand
2014 (abgelaufen)2021. www.awmf.org - Deutsche AIDS-Gesellschaft (DAIG).
LeitlinienMedikamentösezur PostexpositionellenPostexpositionsprophylaxeProphylaxe der(PEP) nach HIV-InfektionExposition. AWMF-Leitlinie Nr. 055-004. S2k, Stand20182021. www.awmf.org - Deutsche AIDS-Gesellschaft (DAIG).
Leitlinien zurHIV-Präexpositionsprophylaxeexpositionsprohphylaxe (PrEP). AWMF-Leitlinie Nr. 055-008. S2k, Stand 2018. www.awmf.org - Deutsche AIDS-Gesellschaft (DAIG). HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen. AWMF-Leitlinie Nr. 055-002. S2k, Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Pädiatrische Infektiologie (DGPI), Deutsche AIDS-Gesellschaft (DAIG). Antiretrovirale Therapie der HIV-Infektion bei Kindern und Jugendlichen. AWMF-Leitlinie Nr. 048-011. S2k, Stand 2019. www.awmf.org
Literatur
PalellaRobertFJKoch-Institut.JrHIV-Infektion/AIDS. RKI-Ratgeber. 16.06.2022 www.rki.de- UNAIDS. AIDSINFO. Letzter Zugriff 10.08.2022 aidsinfo.unaids.org
- Deutsche AIDS-Gesellschaft (DAIG). Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion. AWMF-Leitlinie Nr. 055-001. S2k,
DelaneyStandKM, Moorman AC, et al. Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. N Engl J Med 1998; 338: 853-602021.New England Journal of Medicinewww.awmf.org HuangEuropeanL,AIDSQuartinClinicalA,SocietyJones D, Havlir DV(EACS).IntensiveGuidelinescareVersionof11.0patientsOctoberwith2021. www.eacsociety.org- Achenbach CJ. HIV infection.
NBMJEnglBestJPractice.MedLast2006reviewed: 15 Jul 2022;355last updated:173-81.22 Apr 2022PubMed Hammer SMbestpractice.Management of newly diagnosed HIV infectionbmj.N Engl J Med 2005; 353: 1702-10.PubMedcom- Robert Koch-Institut. Epidemiologisches Bulletin 48/2020. Berlin, 26.11.2020. www.rki.de
- Robert Koch-Institut. HIV/AIDS in Deutschland –Eckdaten der Schätzung. Epidemiologische Kurzinformation des Robert Koch-InstitutsStand: Ende 2019. www.rki.de
- Robert Koch-Institut.
HIV-Infektion/AIDS. RKI-Ratgeber. 22.11.2018. Letzter Zugriff am 30.11.2020www.rki.de Robert Koch-Institut.Epidemiologisches Bulletin 45/2016. Berlin, 14.11.2016. www.rki.deMorris A, Creasman J, Turner J, Luce JM, Wachter RM, Huang L. Intensive care of human immunodeficiency virus-infected patients during the era of highly active antiretroviral therapy. Am J Respir Crit Care Med 2002; 166: 262-7.PubMedVincent B, Timsit JF, Auburtin M, et al. Characteristics and outcomes of HIV-infected patients in the ICU: impact of the highly active antiretroviral treatment era. Intensive Care Med 2004; 30: 859-66.PubMedNarasimhan M, Posner AJ, DePalo VA, Mayo PH, Rosen MJ. Intensive care in patients with HIV infection in the era of highly active antiretroviral therapy. Chest 2004; 125: 1800-4.PubMedCasalino E, Wolff M, Ravaud P, Choquet C, Bruneel F, Regnier B. Impact of HAART advent on admission patterns and survival in HIV-infected patients admitted to an intensive care unit. AIDS 2004; 18: 1429-33.PubMedUNAIDS. AIDSINFO. Download am 16.05.2017aidsinfo.unaids.org- UNAIDS. Global HIV & AIDS statistics — 2020 fact sheet. Stand Juni 2020. www.unaids.org
The Working Group on MTCT of HIV. Rates of mother-to-child transmission of HIV-1 in Africa, America and Europe: results of 13 perinatal studies. J Acquir Immune Defic Syndr 1995; 8: 506-10.pubmed.ncbi.nlm.nih.govShapiro RL, Hughes MD, Ogwu A, et al. Antiretroviral regimens in pregnancy and breast-feeding in Botswana. N Engl J Med 2010; 362: 2282-94.New England Journal of MedicineChasela CS, Hudgens MG, Jamieson DJ, et al. Materanl or infant antiretroviral drugs to reduce HIV-1 transmission. N Engl J Med 2010; 362: 2271-81.New England Journal of MedicineGensthaler BM. HIV-2. Im Schatten des großen Bruders. Pharmazeutische Zeitung online 12/2011. Download am 16.05.2017.www.pharmazeutische-zeitung.deDeutsche AIDS-Gesellschaft (DAIG). Leitlinien zur antiretroviralen Therapie der HIV-Infektion. AWMF-Leitlinie Nr. 055-001, Klasse S2k, Stand 2014 (abgelaufen).www.awmf.orgPublic Health Service Task Force. Recommendations for use of antiretroviral drugs in pregnant HIV-1 infected women for maternal health and interventions to reduce perinatal HIV-1 transmission in the United States. Nov 2, 2007.pubmed.ncbi.nlm.nih.govCooper ER, Charurat M, Mofenson L, Hanson C, Pitt J, Diaz C et al. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and the prevention of perinatal HIV-1 transmission. J Acquir Immune Defic Syndr 2002; 29: 484 - 94.PubMedBritish HIV Association. Guidelines for the management of HIV infection in pregnant women and the prevention of mother-to-child transmission. HIV Medicine 2001; 2: 314-34.www.ncbi.nlm.nih.govSperling RS, Shapiro DE, Coombs RW, Todd JA, Herman SA, McSherry GD et al. Maternal viral load, zidovudine treatment, and the risk of transmission of human immunodeficiency virus type 1 from mother to infant. N Engl J Med 1996; 335: 1621 - 9.New England Journal of MedicineNduati R, John G et al. Effect of Breastfeeding and Formula Feeding on Transmission of HIV-1. JAMA 2000; 283:1167-1174.jamanetwork.comThe International Perinatal HIV Group. N Engl J Med 1999; 340: 977-87New England Journal of MedicineIoannidis JPA, Abrams EJ, Ammann A, Bulterys M, Goedert JJ, Gray L et al. Pernatal Transmission of Human immunodeficiency Virus Type 1 by Pregnant Women with RNA Loads < 1000 Copies/mL. JID 2001;183:539-45.PubMedThe European Mode of Delivery Collaboration: Elective caesarean-section versus vaginal delivery in prevention of vertical HIV-1 transmission: A randomized clinical trial. Lancet 1999, Mar 27;353:1035-9.www.thelancet.comMiotti PG, Taha ET, Newton I, et al. HIV transmission through breatfeeding: a study in Malawi. JAMA 1999; 282: 744-9.PubMed- White AB, Mirjahangir JF, Horvath H, Anglemyer A, Read JS. Antiretroviral interventions for preventing breast milk transmission of HIV. Cochrane Database of Systematic Reviews 2014, Issue 10. Art. No.: CD011323. DOI: 10.1002/14651858.CD011323. DOI
- Robert
-Koch-Institut. Blutsicherheit. Häufig gestellte Fragen. Wie hoch ist geschätzt heutzutage noch das Risiko eines Empfängers, sich durch Spenderblut mit HIV, Hepatitis A,B,C u.ä. zu infizieren? 19.05.2014. www.rki.de Gerberding JL. Occupational exposure to HIV in health care settings. N Engl J Med 2003; 348: 826-33.New England Journal of Medicine- Rabenau
H.F.HF, et al. Prävention der nosokomialen Übertragung von Humanem Immunschwächevirus (HIV) durchHIV-positive Mitarbeiterinnen und Mitarbeiter im Gesundheitswesen. Bundesgesundheitsbl. 2012, 55:937-943. edoc.rki.de - Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2021. Stand 18.09.2020; letzter Zugriff 30.11.2020 www.dimdi.de
- Robert
-Koch-Institut. Humanes Immundefizienz Virus (HIV) Labordiagnostik zur Feststellung des Infektionsstatus. Erste Blutprobe. Download am 16.05.2017. www.rki.de - Deutsche AIDS-Hilfe. Akute HIV-Infektion. HIVreport 1/2014. www.aidshilfe.de
- Berliner AIDS-Hilfe. Mündliche Auskunft von Jens Petersen und Jens Ahrens am 29.05.2017.
- AIDS-Hilfe Köln. FAQ: HIV-Selbsttest. Rechtzeitig testen – Aids verhindern! Abruf am 30.11.2020 www.aidshilfe-koeln.de
- Hartmann M. CDC-Klassifikation (1993). HIV-Leitfaden 21.10.2016.
DownloadLetzteamAktualisierung:1716.0511.2017.2018 www.hivleitfaden.de Centers for Disease Control and Prevention. 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Recomm Rep 1992; 41:1-19. PMID: 1361652PubMedSchacker T, Collier AC, Hughes J et al. Clinical and epidemiologic features of primary HIV infection. Ann Intern Med 1996; 125:257-64. PMID: 8678387PubMedKassutto S, Rosenberg ES. Primary HIV type 1 infection. Clin Infect Dis 2004; 38: 1447-53.PubMed- Hammer SM, Eron JJ, Reiss P, Schooley RT et al. Antiretroviral Treatment of Adult HIV Infection. 2008. Recommendations of the International AIDS Society-USA Panel. JAMA 2008; 300: 555-70. PubMed
Marrazzo JM, del Rio C, Holtgrave DR, et al. HIV prevention in clinical care settings. 2014 recommendations of the international antiviral society - USA panel. JAMA 2014; 312: 390-409. doi:10.1001/jama.2014.7999DOIOkulicz JF, Le TD, Agan BK, et al. Influence of the timing of antiretroviral therapy on the potential for normalization of immune status in human immunodefieciency virus 1-infected individuals . JAMA Intern Med 2014. doi:10.1001/jamainternmed.2014.4010DOIAnanworanich J, Schuetz A, Vandergeeten C et al. Impact of multitargeted antiretroviral treatment on gut T cell depletion and HIV reservoir seeding during acute HIV infection. PLoS ONE 2012;7: e33948. PMID: 22479485PubMedAnanworanich J, Chomont N, Fletcher JL et al. Markers of HIV reservoir size and immune activation after treatment in acute HIV infection with and without raltegravir and maraviroc intensification. J Virus Erad 2015; 1: 116-22.www.ncbi.nlm.nih.govLundgren JD, Babiker AG, Gordin F et al. Initiation of Antiretroviral Therapy in Early Asymptomatic HIV Infection. N Engl J Med 2015; 373: 795-807. DOI: 10.1056/NEJMoa1506816DOIDanel C, Moh R, Gabillard D, Badje A, Le CJ, Ouassa T, et al. A Trial of Early Antiretrovirals and Isoniazid Preventive Therapy in Africa. N Engl J Med 2015 Aug 27;373(9):808-22. PMID: 26193126PubMedEuropean AIDS Clinical Society (EACS). Guidelines Version 10.1 October 2020.www.eacsociety.orgArzneimittelkommission der deutschen Ärzteschaft. Rote-Hand-Brief zu Dolutegravir-haltigen Arzneimitteln: Berichte über Neuralrohrdefekte. 04.06.2018.www.akdae.deWarpakowski A. HIV-Infektion: Komplettregime mit Bictegravir. Dtsch Arztebl 2018; 115(44): A-2014.www.aerzteblatt.deAchenbach CJ. HIV infection. BMJ Best Practice. Last reviewed: 30 Oct 2020; Last updated: 04 Mar 2020.bestpractice.bmj.comWalmsley SL, Antela A, Glumeck N, et al. Dolutegravir plus Abacavir-Lamivudine for the treatment of HIV-1 infection. N Engl J Med 2013; 369: 1807-18. doi:10.1056/NEJMoa1215541DOIClotet B, Feinberg J, van LJ, Khuong-Josses MA, Antinori A, Dumitru I, et al. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet 2014 Mar 31. PMID: 24698485PubMedWHO. Newsroom. WHO recommends dolutegravir as preferred HIV treatment option in all populations.www.who.int- Deutsche AIDS-Gesellschaft (DAIG). HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen. AWMF-Leitlinie Nr. 055-002, Klasse S2k, Stand 2020. www.awmf.org
Siegfried N, vanArzneimittelkommission derMerwedeutschenL, Brocklehurst P, Sint TTÄrzteschaft.AntiretroviralsRote-Hand-BriefforzureducingDolutegravir-haltigentheArzneimitteln:riskBerichteofübermother-to-child transmission of HIV infectionNeuralrohrdefekte.Cochrane Database of Systematic Reviews 2011, Issue 704.Art06.No.: CD003510. DOI: 10.1002/14651858.CD003510.pub32018.DOISturt AS, Dokubo EK, Sint TTwww.Antiretroviral therapy (ART) for treating HIV infection in ART-eligible pregnant womenakdae.Cochrane Database of Systematic Reviews 2010, Issue 3. Art. No.: CD008440. DOI: 10.1002/14651858.CD008440.DOIde- Arzneimittelkommission der deutschen Ärzteschaft: Rote-Hand-Brief zu Elvitegravir/Cobicistat. 26.03.2019. www.akdae.de
- Arzneimittelkommission der deutschen Ärzteschaft: Rote-Hand-Brief zu Darunavir/Cobicistat. 25.06.2018. www.akdae.de
- Deutsche Gesellschaft für Pädiatrische Infektiologie (DGPI), Deutsche AIDS-Gesellschaft (DAIG). Antiretrovirale Therapie der HIV-Infektion bei Kindern und Jugendlichen. AWMF-Leitlinie Nr. 048-011. S2k, Stand 2019. www.awmf.org
- Robert Koch-Institut. Epidemiologisches Bulletin 46/2019. Berlin, 14.11.2019. www.rki.de
- Niehues T, Nadal D. HIV/AIDS bei Kindern. Pädiatrie up2date 2014; 9: 107-125. DOI: 10.1055/s-0034-1365480 DOI
- Marcus U. HIV-Infektion bei Kindern in Deutschland. HIV & more online, Ausgabe 3/2019. www.hivandmore.de
- European guideline for the management of genital herpes. IUSTI/WHO European STD guidelines Editorial Board. 2017. iusti.org
- Deutsche AIDS-Gesellschaft (DAIG).
LeitlinienMedikamentösezurPostexpositionsprophylaxePostexpositionellen(PEP)Prophylaxe dernach HIV-InfektionExposition. AWMF-Leitlinie Nr. 055-004, Klasse. S2k, Stand20182021. www.awmf.org WellerDeutscheSC, Davis-Beaty KAidshilfe.CondomSafer-Sex-Unfalleffectiveness/in reducing heterosexual HIV transmissionPEP.CochraneZugriffDatabase of Systematic Reviews 2002, Issue 115.Art08.No.: CD003255. DOI: 10.1002/14651858.CD003255.2022DOIGoulder PJ, Walker BDwww.HIV-1 superinfection -- a word of cautionaidshilfe.N Engl J Med 2002; 347: 756-8.New England Journal of MedicineSiegfried N, van der Merwe L, Brocklehurst P, Sint TT. Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection. Cochrane Database of Systematic Reviews 2011, Issue 7. Art. No.: CD003510. DOI: 10.1002/14651858.CD003510.pub3.DOIKarim QA, Karim SSA, Frolich JA, et al. Effectiveness and safety of tenofovir gel, an antiretroviral microbicide, for the prevention of HIV infection in women. Science 2010; : DOI:10.1126/science.1193748.DOIde- Deutsche AIDS-Gesellschaft (DAIG). Leitlinien zur HIV-Präexpositionsprophylaxe. AWMF-Leitlinie Nr. 055-008, Klasse S2k, Stand 2018. www.awmf.org
- Bundesministerium für Gesundheit. Gesetzlicher Anspruch für HIV-Präexpositionsprophylaxe (PrEP) kommt. Berlin, 02.09.2019. www.bundesgesundheitsministerium.de
Cohen MS, Chen YQ, McCauley M et al. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med 2011; 365: 493-505. PMID: 21767103PubMedTreating HIV-infected people with antoretrovirals protects partners from infection. NIH News, may 2011.www.niaid.nih.gov- BAG Kinder und Jugendliche im Umfeld von HIV/AIDS. Handreichung für den Kontakt mit HIV/AIDS-betroffenen Familien. Download am 19.05.2017. www.aidshilfe
.de Juristenkreis der Aidshilfe Köln (Hrsg.) JUR-INFO Rechtliche Informationen zu HIV und AIDS. 2/2008. Download am 19.05.2017www.aidshilfe-koeln.de- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). Dortmund. Merkblätter und wissenschaftliche Begründungen zu den Berufskrankheiten der Anlage 1 zur Berufskrankheiten-Verordnung (BKV), zuletzt aktualisiert durch die Dritte Verordnung zur Änderung der Berufskrankheiten-Verordnung vom 22. Dezember 2014. Zugriff 24.1.2017. www.baua.de
- DGVU Formtexte für Ärzte: Ärztliche Anzeige bei Verdacht auf eine Berufskrankheit. www.dguv.de
- Mehrtens
,G. Valentin,H. Schönberger,A. Arbeitsunfall und Berufskrankheit Bhaskaran K, Mussini C, Antinori A, et al.; CASCADE Collaboration. Changes in the incidence and predictors of human immunodeficiency virus-associated dementia in the era of highly active antiretroviral therapy. Ann Neurol 2008; 63: 213-21.PubMedTriant VA, Lee H, Hadigan C, Grinspoon SK. Increased acute myocardial infarction rates and cardiovascular risk factors among patients with human immunodeficiency virus disease. J Clin Endocrinol Metab 2007; 92: 2506-12.PubMedAberg JA, Kaplan JE, Libman H, et al. Primary care guidelines for the management of persons infected with human immunodeficiency virus: 2009 update by the HIV Medicine Association of the Infectious Diseases Society of America. Clin Infect Dis 2009; 49: 651-81.PubMedChu C, Selwyn PA. Complications of HIV infection: a systems-based approach. Am Fam Physician 2011; 83: 395-406.pubmed.ncbi.nlm.nih.govBrown TT, Qaqish RB. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS 2006; 20: 2165-74.PubMedTreating opportunistic infections among HIV-infected adults and adolescents. MMWR Morb Mortal Weekly Rep 2004; 53(RR-15): 1-112.www.ncbi.nlm.nih.govRutherford GW, Lifson AR, Hessol NA et al. Course of HIV-I infection in a cohort of homosexual and bisexual men: an 11 year follow up study. BMJ 1990; 301: 1183-8.www.ncbi.nlm.nih.govOrmaasen V, Sandvik L, Dudman SG et al. HIV related and non-HIV related mortality before and after the introduction of highly active antiretroviral therapy (HAART) in Norway compared to the general population. Scand J Infect Dis 2007; 1: 51-57.dx.doi.orgBhaskaran K, Hamouda O, Sannes M et al. Changes in the Risk of Death After HIV Seroconversion Compared With Mortality in the General Population. JAMA 2008; 300: 51-9.PubMed- Arzbach V. Schwangerschaft und HIV - Gesundes Kind trotz Infektion. Pharmazeutische Zeitung online 16/2013. Download am 19.05.2017 www.pharmazeutische-zeitung.de
- Deutsche AIDS-Gesellschaft (DAIG). Therapie und Prophylaxe opportunistischer Infektionen bei erwachsenen HIV-infizierten Patienten. AWMF-Leitlinie Nr. 055-006, Klasse S2k, Stand 2015 (abgelaufen). daignet.de
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).