Allgemeine Informationen
Definition
- Die Koronare Herzerkrankung (KHK) ist die klinisch relevante Manifestation der Atherosklerose an den Herzkranzarterien.1
- Es handelt sich um eine chronische, in der Regel progrediente Erkrankung, wobei unterschiedlich lange Phasen scheinbarer Stabilität mit instabilen Phasen wechseln können („chronisches Koronarsyndrom").2
- Typische klinische Manifestationen sind Angina pectoris und Dyspnoe unter Belastung.1,3
Zur Terminologie
- Der lange Zeit übliche Begriff „stabile KHK" ist insofern irreführend, als die Patient*innen ein dauerhaft erhöhtes Risiko für kardiovaskuläre Ereignisse und variable klinische Verläufe aufweisen4
- Der neu eingeführte Begriff „chronisches Koronarsyndrom" berücksichtigt die Dynamik der Erkrankung im Verlauf und auch deren Beeinflussbarkeit durch Lebensstiländerungen, pharmakologische Therapie und Revaskularisierung.5
- Der Begriff „chronisches Koronarsyndrom" (CCS) ist dabei auch komplementär zum langjährig eingeführten Begriff des „akuten Koronarsyndroms" (ACS) zu sehen.6
Häufigkeit
- Todesursache
- Die chronische ischämische Herzkrankheit ist mit einem Anteil von 8,0 % bzw. 76.000 Fällen auf Basis der ICD-10-Klassifikation die häufigste Todesursache in Deutschland (Jahr 2018).7
- Die Sterblichkeit nimmt aber laufend ab – seit 1998 hat sie sich in etwa halbiert, wobei Männer doppelt so häufig an einer KHK sterben wie Frauen.8
- Prävalenz
- Die Lebenszeitprävalenz liegt im Alter zwischen 40 und 79 Jahren bei 8,0 %.9
- Geschlechtsverteilung
- Männer zu Frauen ca. 2:19
- Sozialer Status
- Bei einem niedrigen Sozialstatus ist die Prävalenz ca. doppelt so hoch wie bei einem hohen Sozialstatus.9
- Stationäre Behandlung
- Es gibt in Deutschland eine erhebliche Überversorgung mit Koronarangiografien und koronaren Interventionen. Deutschland liegt weltweit an der Spitze mit diesen Eingriffen.10 Im Jahr 2018 wurden 867.137 Koronarangiografien durchgeführt, darunter 366.840 perkutane Interventionen (PCI).
- Praxisprävalenz
- ca. 7–11 % aller Patient*innen in einer hausärztlichen Praxis11
Ätiologie und Pathogenese
- Frühe pathophysiologische Konzepte der Atherosklerose betrachteten diese vor allem als reine Akkumulation und Speicherung von Lipiden und glatten Muskelzellen.12
- Heutzutage geht man von einem komplexen Zusammenspiel verschiedener Faktoren aus, wobei entzündliche Prozesse in allen Stadien der Atherosklerose eine entscheidende Rolle spielen.13-14
- Die Plaquebildung wird durch verschiedene sich auch selbst verstärkende Komponenten begünstigt, u. a. LDL-Oxidation, Endothelaktivierung, Rekrutierung von Entzündungszellen, Produktion von Zytokinen.15
- Im Laufe des atherosklerotischen Prozesses können unterschiedliche Läsionen mit unterschiedlichen klinischen Folgen entstehen:12
- stenosierende Läsionen (kleiner Lipidkern, viel Fibrose und Kalzifikation, dicke fibröse Kappe der Plaque): Diese Läsionen führen zur Perfusionsminderung und Belastungsischämie mit klinisch Angina und/oder Dyspnoe.
- nicht stenosierende Läsionen (großer Lipidkern mit nur dünner fibröser Kappe): Diese Läsionen sind anfällig für Plaqueruptur/Thrombosierung mit Ausbildung eines ACS.
- Die Mehrzahl der Läsionen dehnt sich überwiegend abluminal aus, sodass eine große atherosklerotische Krankheitslast auch ohne signifikante Stenosen bestehen kann bzw. ischämieverursachende Stenosen nur die Spitze des Eisbergs eines insgesamt veränderten Gefäßsystems darstellen.12,16
- Die klinische Manifestation eines CCS (Belastungsischämie mit Angina und/oder Dyspnoe) wird im zeitlichen Verlauf vorwiegend durch Anzahl, Verteilung und Schweregrad der Stenosen bestimmt.
- Es kann allerdings jederzeit auch ein ACS auftreten, abhängig von Ausdehnung und Schweregrad der Atherosklerose und Vulnerabilität der Plaques.4
- Generell hat es einen Paradigmen-Wechsel im Verständnis der stenosierenden KHK gegeben: Das stenotische Gefäß führt bei körperlichen und seelischen Belastungen zu stenokardischen Beschwerden. Und Plaque-Rupturen treten bei Vorhandensein koronarer Stenosen auch häufiger auf. Meist sind aber die stenotischen Gefäße selbst nicht davon betroffen – was auch erklären würde, dass die Dilatation einer Stenose bei stabiler KHK mit PCI keinerlei prognostischen Vorteil hat.
- Neben der makrovaskulären Atherosklerose mit obstruktiver KHK können weitere Veränderungen zu chronisch auftretenden Myokardischämien führen:
- mikrovaskuläre Veränderungen, endotheliale Dysfunktion17-18
- Auch bei der endothelialen Dysfunktion bestehen die klassischen Risikofaktoren (Hyperlipidämie, Rauchen, arterielle Hypertonie, Diabetes mellitus), zudem sind Frauen häufiger betroffen.
- vasospastische Angina
- Myokardhypertrophie mit erhöhtem O2-Bedarf (arterielle Hypertonie, Aortenklappenstenose, hypertrophe Kardiomypathie)17
- extrakardiale Ursachen (Anämie, pulmonal bedingte Hypoxämie)17
- mikrovaskuläre Veränderungen, endotheliale Dysfunktion17-18
Prädisponierende Faktoren
Modifizierbare Risikofaktoren
- Erhöhung des Risikos durch:
- Hyperlipidämie
- Rauchen
- Diabetes mellitus
- arterielle Hypertonie
- abdominelle Adipositas (Taillen-Hüften-Verhältnis)19-22
- psychosoziale Belastung23-24
- Niedrigeres Risiko durch:
- täglichen Konsum von Obst und Gemüse – eine Senkung des kardialen Risikos durch eine entsprechende Nahrungsumstellung ist aber nicht ausreichend belegt.
- körperliche Aktivität25
- möglicherweise moderaten Alkoholkonsum.25
Nicht modifizierbare Risikofaktoren
- Alter
- Das Alter ist auch nach Adjustierung für sonstige, konventionelle Risikofaktoren ein unabhängiger Prädiktor für das kardiovaskuläre Risiko.26
- Das Alter ist Bestandteil diverser Risikorechner zur Berechnung des kardiovaskulären Risikos wie ARRIBA, ESC-SCORE, AGLA-Risikorechner
- Die DEGAM empfiehlt ARRIBA zur Risikoberatung und Therapie-Entscheidungsfindung.27
- Geschlecht
- gewisser hormoneller Schutz von Frauen bis zur Menopause28
- Frauen erleiden einen ersten Herzinfarkt 9 Jahre später als Männer.29
- 80 % der Differenz sind allerdings durch die altersabhängige Verteilung der Risikofaktoren zwischen Männern und Frauen erklärt.29
- Familienanamnese
Differenzialdiagnosen
- Zahlreiche Differenzialdiagnosen (siehe auch die Artikel Brustschmerzen und Dyspnoe bei Erwachsenen), u. a.:31
- Brustwandsyndrom
- Refluxkrankheit
- Gastritis/Ulkuskrankheit
- COPD/Asthma
- Respiratorischer Infekt mit Pleuritis
- Psychogene Störung
- Medikamenteninduziert (z. B. Triptane)
ICPC-2
- K74 Ischämische Herzerkrankung mit Angina pectoris
ICD-10
- I20 Angina pectoris
- I20.1 Angina pectoris mit dokumentiertem Spasmus
- I20.8 Andere spezifische Formen der Angina pectoris
- I20.9 Unspezifische Angina pectoris
Diagnostik
Diagnostische Kriterien
- Verdachtsdiagnose und Beurteilung der Vortestwahrscheinlichkeit auf Basis von:
- klinischer Symptomatik
- Risikoprofil
- Ggf. Bestätigung der Diagnose bei mittlerer Vortestwahrscheinlichkeit durch nichtinvasive und im Einzelfall invasive Untersuchungen
Anamnese
- Bei 8–11 % der Patient*innen mit Brustschmerzen als Anlass für die hausärztliche Konsultation ist eine chronische KHK die Ursache.1,31
- Auf Basis einer sorgfältigen Anamnese kann die Diagnose oft schon mit einer recht hohen Sicherheit vermutet werden, auch wenn körperliche und apparative Untersuchungen für Bestätigung, Ausschluss von Differenzialdiagnosen und Schweregradbeurteilung hilfreich sind.3
- Ergibt sich aus der ersten Beurteilung der V. a. KHK, sind weitere Ziele der Anamnese:1
- Einschätzung der Vortestwahrscheinlichkeit einer KHK, wichtig für die Auswahl der weiteren Diagnostik
- Ermittlung des kardiovaskulären Risikoprofils
- frühzeitige Identifikation abwendbar ungünstiger Verläufe
- Ermittlung der Bereitschaft zur Veränderung des Lebensstils.
- Symptome
- Angina pectoris
- Lokalisation, Ausstrahlung (retrosternal, thorakal, epigastrisch, Schulter(n), Arm(e), Kiefer, Rücken)
- Charakter (Druck, Enge, Schmerz, Brennen)
- Dauer (in der Mehrzahl der Fälle ≤ 10 min)
- ein wenige Sekunden andauernder Brustschmerz wird üblicherweise nicht durch eine KHK ausgelöst.
- Belastungsabhängigkeit (Art und Ausmaß der körperlichen Belastung)
- Auftreten im Tagesverlauf (typisch z. B. auch morgens nach dem Aufwachen)
- sonstige auslösende Faktoren (Kälte, schwere Mahlzeit, emotionaler Stress)
- Rückgang durch körperliche Ruhe, durch Nitratgabe
- Dyspnoe
- Kann das einzige Symptom einer koronaren Herzkrankheit sein!
- Wurde bisher als Symptom einer KHK eher untergewichtet und wird neuerdings aber als eigenständiger Faktor für die Beurteilung berücksichtigt5
- mögliche weitere Symptome
- Übelkeit
- Schwächegefühl
- Angstgefühl
- Palpitationen
- Schwindel.
- Angina pectoris
- Risikofaktoren
- Hyperlipidämie
- arterielle Hypertonie
- Rauchen
- Diabetes mellitus
- familiäre Belastung
- Übergewicht (v. a. abdominelle Adipositas)
- Bewegungsmangel
- psychosoziale Belastung
- Sonstige Begleit- und Vorerkrankungen mit erhöhtem Risiko für KHK, z. B.:
- PAVK, extrakranielle Karotisstenose, zerebrovaskuläre Erkrankung
- chronische Nierenkrankheit
- rheumatologische Grunderkrankungen, z. B. rheumatoide Arthritis
- St. n. Radiotherapie.
- Der Marburger-Herz-Score32 ermöglicht sehr schnell und mit nur einer körperlichen Untersuchung die Kategorisierung des kardialen Risikos und die Entscheidung, ob überhaupt eine weitere Diagnostik sinnvoll ist.
Klassifikation der Angina pectoris
- Nur ca. 10–15 % der Patient*innen weisen eine typische Angina pectoris auf, die Mehrheit berichtet eine atypische Angina oder einen nicht-anginösen Brustschmerz.3
- Typische Angina – alle 3 der folgenden Kriterien sind erfüllt:3
- Engegefühl retrosternal oder im Bereich von Hals, Kiefer, Schulter oder Arm
- ausgelöst durch körperliche Belastung
- Rückgang bei körperlicher Ruhe oder durch Nitrate innerhalb von 5 min.
- Atypische Angina3
- 2 Kriterien sind erfüllt.
- Nichtanginöser Brustschmerz3
- 1 oder keines der Kriterien sind erfüllt.
CCS-Klassifikation des Schweregrades einer Angina pectoris (CCS = Canadian Cardiac Society)
- Grad I: AP nur bei starker körperlicher Belastung
- Grad II: AP bei mäßiger Belastung (z. B. Berg hoch laufen, mehr als 1 Stockwerk Treppe steigen)
- Grad III: AP bei leichter Belastung (um 2 Häuserblocks gehen mit normalem Tempo, 1 Stockwerk steigen)
- Grad IV: AP in Ruhe (keine Belastung notwendig, um AP auszulösen)
Klinische Untersuchung
Messparameter
- Größe, Gewicht
- Die DEGAM rät von einer routinemäßigen Bestimmung von BMI, Taille-Hüft-Verhältnis und Hüftumfang zur Kalkulation des kardiovaskulären Risikos ab.27
- Blutdruck, Puls (Frequenz, Rhythmus)
Inspektion
- Xanthelasmen (Lider, meist innerer Augenwinkel), selten Xanthome (Sehnenscheiden, Ellbogen, Kniegelenke) als möglicher Hinweis auf Hypercholesterinämie
- Halsvenenstauung (bei Herzinsuffizienz als Folge einer KHK)
- Beinödeme (bei Herzinsuffizienz als Folge einer KHK)
Palpation
- Abgeschwächte Pulse bei generalisierter Atherosklerose mit PAVK
Auskultation
- Herz
- häufig keine auskultatorischen Befunde
- evtl. 3. Herzton bei Herzinsuffizienz
- evtl. Systolikum bei Mitralklappeninsuffizienz (siehe auch Artikel Herzgeräusche bei Erwachsenen)
- häufig keine auskultatorischen Befunde
- Lunge
- Rasselgeräusche über der Lunge bei Herzinsuffizienz mit Lungenstauung
- Arterien
- Stenosegeräusche (z. B. bei generalisierter Atherosklerose mit Karotisstenose)
Bestimmung der Vortestwahrscheinlichkeit
- Für die hausärztliche Versorgungsebene empfiehlt die DEGAM die Verwendung des Marburger Herzscores.31
- Einschätzung der Wahrscheinlichkeit einer KHK anhand 5 einfach zu erfassender Kriterien
- In vielen Leitlinien wird die Tabelle von Diamond-Forrester zur Beurteilung der Vortestwahrscheinlichkeit verwendet (Kriterien Alter, Geschlecht, Klassifikation der Angina, neuerdings auch Dyspnoe), die angegebenen Wahrscheinlichkeiten passen aber eher für die kardiologische Versorgungsebene.1,3
Beurteilung der Wahrscheinlichkeit einer stenosierenden KHK: Marburger Herzscore31
Kriterien
- Geschlecht und Alter (Männer ≥ 55 Jahre und Frauen ≥ 65 Jahre): 1 Punkt
- Bekannte vaskuläre Erkrankung: 1 Punkt
- Beschwerden sind belastungsabhängig: 1 Punkt
- Schmerzen sind durch Palpation nicht reproduzierbar: 1 Punkt
- Patient*in vermutet, dass der Schmerz vom Herzen kommt: 1 Punkt
Interpretation
- Score-Wert 0–1: sehr geringe (< 1 %) Wahrscheinlichkeit einer stenosierenden KHK als Ursache des Brustschmerzes – es sollte keine weitere Diagnostik durchgeführt werden.
- Score-Wert 2: geringe (ca. 5 %) Wahrscheinlichkeit einer stenosierenden KHK
- Score-Wert 3: mittlere (ca. 25 %) Wahrscheinlichkeit einer stenosierenden KHK
- Score-Wert 4–5: hohe (ca. 65 %) Wahrscheinlichkeit einer stenosierenden KHK
Ergänzende Untersuchungen in der hausärztlichen Praxis
EKG
- Ein EKG sollte nur bei mindestens mittlerer Wahrscheinlichkeit im Marburger-Herz-Score durchgeführt werden.
- Hinweise auf alten Infarkt (pathologische Q-Zacken), ischämiebedingte Erregungsrückbildungsstörungen, Arrhythmie, siehe auch die Artikel:
- Ein unauffälliges Ruhe-EKG schließt eine KHK nicht aus.
Rö-Thorax
- Bei Herzinsuffizienz: evtl. Stauungszeichen, vergrößerter Herzschatten
- Ausschluss/Nachweis pneumologischer Differenzialdiagnosen
Labor – Blut
- Blutbild (Anämie?)
- Glukose, ggf. bei wiederholt erhöhter Blutglukose
- HbA1c
- Lipidstatus: Gesamtcholesterin, HDL
- eGFR, Kreatinin
- Ggf. TSH
- Troponin nur dann bei V. a. ACS, wenn ein Katheterlabor weit von der Hausarztpraxis entfernt ist.
- NT-proBNP nur dann bei V. a. Herzinsuffizienz, wenn eine kardiologische Praxis, die ein Echo durchführen könnte, zu weit entfernt ist.
Labor – Urin
- Bei V. a. chronische Nierenkrankheit: Teststreifen, bei auffälligem Teststreifen ggf. auch Urinstatus und einmalig Spontanurin
Belastungs-EKG
- Das Belastungs-EKG hat eine nur geringe diagnostische Aussagekraft. Selbst wenn bei einer Vortest-Wahrscheinlichkeit von 30 % durch eine normale Ergometrie die Wahrscheinlichkeit für eine stenosierende KHK halbiert würde, wäre das verbleibende Risiko mit 15 % noch deutlich zu hoch. Die Nationale Versorgungsleitlinie KHK empfiehlt darum die Ergometrie nur noch nachrangig bei einer Vortestwahrscheinlichkeit von 15–35 %. Vorrangig sollte an Myokardszintigrafie und Stress-Echo gedacht werden, Erstere v. a. wenn bei Linksschenkelblock die Endstrecken im EKG nicht beurteilbar sind.31
-
- Nachteile sind fehlende oder unzureichende Aussagekraft u. a. bei:31
- unzureichender körperlicher Belastung
- ST-Senkung > 1 mm im Ruhe-EKG
- Linksherzhypertrophie
- Linksschenkelblock.
- Nachteile sind fehlende oder unzureichende Aussagekraft u. a. bei:31
- Die diagnostische Aussagekraft des Belastungs-EKG ist insgesamt moderat.31
- Die Sensitivität wird im Mittel mit 68 % und die Spezifität mit 77 % angegeben.1
- Bei Frauen ist die Aussagekraft geringer als bei Männern.31
Langzeit-EKG
- Bei V. a. klinisch relevante supraventrikuläre oder ventrikuläre Rhythmusstörungen
Gesamtbeurteilung der klinischen Wahrscheinlichkeit
- Für die Gesamtbeurteilung wird das eher grobe Raster der Vortestwahrscheinlichkeit durch die individuelle ärztliche Einschätzung ergänzt, um so eine Gesamtbeurteilung der Wahrscheinlichkeit einer KHK zu erzielen.5
- Bei hoher Vortest-Wahrscheinlichkeit kann direkt die Diagnose einer KHK, ins DMP KHK eingeschrieben, und es können ASS und Simvastatin verordnet werden. Eine PCI würde die Prognose der Patient*innen nicht verbessern. Mit einer invasiven Diagnostik könnte allenfalls eine Mehrgefäßerkrankung festgestellt werden, bei der eine Bypass-Operation die Sterblichkeit um ca. 3 % senken kann.
- Aktuell ist das koronare CT noch keine Kassenleistung. Sollte der Gemeinsame Bundesauschuss entscheiden, dass es Kassenleistung wird, kann künftig möglicherweise komplett auf eine invasive Diagnostik einer KHK verzichtet werden, weil eine Lokalisationsdiagnostik von Stenosen auch mit koronarem CT möglich wären.
Leitlinie: Diagnostik bei V. a. chronische KHK1
EKG
- Patient*innen, bei denen aufgrund von Anamnese und Befund die Verdachtsdiagnose einer KHK besteht, sollen ein Ruhe-EKG mit 12 Ableitungen erhalten.
Planung weiterer Diagnostik und Therapie in Abhängigkeit von der Vortestwahrscheinlichkeit
- Bei Patient*innen mit einer niedrigen Vortestwahrscheinlichkeit sollte zum Nachweis einer stenosierenden KHK kein Verfahren zur Diagnostik angewendet, sondern eine andere Ursache der Beschwerden in Betracht gezogen werden.
- Bei Patient*innen mit einer mittleren Vortestwahrscheinlichkeit sollten zur weiteren Diagnostik nichtinvasive Verfahren angewendet werden, um den Verdacht auf eine stenosierende KHK weitgehend einzugrenzen.
- Bei Patient*innen mit einer hohen Vortestwahrscheinlichkeit sollte ohne weitere Diagnostik eine stenosierende KHK als Ursache der Beschwerden angenommen und mit der Therapieplanung begonnen werden.
Belastungs-EKG
- Bei einer Vortestwahrscheinlichkeit > 30 % liegt bei einem negativen Belastungs-EKG die Nachtestwahrscheinlichkeit im Durchschnitt noch immer über 15 %, sodass weitere Tests erforderlich bleiben.
Psychosoziale Diagnostik
- Die Wahrscheinlichkeit einer depressiven Störung soll mittels Screening-Fragen im Anamnesegespräch oder standardisierter Fragebögen eingeschätzt werden.
- Die Wahrscheinlichkeit für das Vorliegen einer sonstigen prognostisch relevanten psychischen Störung (Angststörung, posttraumatische Belastungsstörung, Schizophrenie, bipolare Störung) oder einer psychosozialen Risikokonstellation (niedriger sozioökonomischer Status, soziale Isolation, mangelnde soziale Unterstützung, beruflicher oder familiärer Stress) sollte mittels geeigneter Anamnesefragen oder Fragebögen eingeschätzt werden.
Diagnostik bei Spezialist*innen
Echokardiografie
- Bei V. a. KHK sollte eine transthorakale Echokardiografie in Ruhe durchgeführt werden.1
- Beurteilung der globalen linksventrikulären Funktion
- Erfassung regionaler Wandbewegungsstörungen als Hinweis auf KHK
- Ausschluss/Nachweis von Differenzialdiagnosen
Funktionelle Bildgebung (Ischämiediagnostik)
- Vor allem bei mittlerer Vortestwahrscheinlichkeit sollte eine Ischämiediagnostik durch ein funktionelles Bildgebungsverfahren erfolgen.1,3
- Dabei werden Koronarstenosen nicht direkt dargestellt, sondern ihre Auswirkungen auf Perfusion und/oder Myokardkontraktilität unter physikalischer oder pharmakologischer Belastung.
- Zur Verfügung stehen Stress-Echokardiografie, Myokardszintigrafie und Kardio-MRT (Magnetresonanztomografie).
- Die Verfahren sind in ihrer Wertigkeit zur Ischämiediagnostik vergleichbar und sollten daher vor allem nach Verfügbarkeit, lokaler Expertise und Patientenpräferenz gewählt werden.1
- Sensitivität und Spezifität 80–90 %33
Stressechokardiografie
- Das am häufigsten angewandte Verfahren der funktionellen Bildgebung; die Stressechokardiografie kann durch niedergelassene Kardiolog*innen durchgeführt werden.
- Die Belastung wird ergometrisch oder medikamentös (Dobutamin) durchgeführt.
- Der Ischämienachweis erfolgt durch Erfassung von Wandbewegungsstörungen unter Belastung.
- Lokalisation und Ausmaß von Wandbewegungsstörungen werden in einem 16-Segment-Modell des linken Ventrikels erfasst.
Myokardszintigrafie
- Darstellung einer Perfusionsminderung unter Belastung (ergometrisch oder medikamentös) nach Injektion einer radioaktiven Substanz34
- Das Ausmaß der Perfusionsstörung wird durch den sog. SDS (Summed Difference Score = Unterschied der Perfusion in Ruhe und unter Belastung) ausgedrückt.
- je höher der SDS, desto ausgeprägter die Perfusionsstörung
- Ergänzend wird die linksventrikuläre Ejektionsfraktion unter Belastung und in Ruhe erfasst.
Kardio-MRT
- Erfassung von Perfusions- und Kontraktilitätsstörungen unter medikamentöser Belastung (Adenosin oder Dobutamin)35
- Zur Perfusionsbeurteilung Injektion eines gadoliniumhaltigen Kontrastmittels
- Eine Darstellung der Koronargefäße ist theoretisch möglich, bislang aber noch keine ausreichende Bildauflösung für eine klinisch sinnvolle Anwendung.
- Aktuell keine Kostenübernahme durch die GKV für diese Indikation36
Kardio-CT (CT-Koronarangiografie und Kalzium-Score)
- Ein Kardio-CT könnte bei niedriger Vortestwahrscheinlichkeit eine Option sein, um eine KHK als Ursache für Beschwerden auszuschließen (hoher negativer prädiktiver Wert). Die nicht unerhebliche Strahlenbelastung spricht aber gegen den Einsatz des CT im Niedrig-Prävalenz-Bereich.35
- Dagegen kann künftig die Darstellung der Koronargefäße durch CT-Angiografie helfen, eine stenosierende KHK zu lokalisieren, um möglicherweise Koronarangiografien einzusparen. Voraussetzung für eine verbreitete Anwendung wäre eine Kostenübernahme durch die gesetzliche Krankenversicherung.
- Beim Nachweis von Stenosen ist die genaue Beurteilung des Schweregrades häufig schwierig.33
- Erfassung des Gesamtausmaßes koronarer Verkalkungen durch Bestimmung eines Kalzium-Scores (Agatston-Score) mit prognostischer Bedeutung35
Invasive Koronarangiografie
- Im Gegensatz zum Vorgehen beim ACS ist die invasive Koronarangiografie bei V. a. CCS im Allgemeinen nicht Teil der Primärdiagnostik.1
- Eine Koronarangiografie soll im Rahmen der Therapieplanung nur dann angeboten werden, wenn1
- eine Bereitschaft der Patient*innen zu einer Bypass-OP aus prognostischer Indikation besteht.
- Zur Entscheidungsfindung kann die Patienteninformation Verdacht auf koronare Herzerkrankung – brauche ich eine Herzkatheteruntersuchung? verwendet werden.
- Lediglich bei hoher klinischer Wahrscheinlichkeit einer KHK und therapierefraktärer schwerer Symptomatik bei bereits niedriger Belastung kann eine umgehende invasive Strategie erwogen werden.5
Leitlinie: Erweiterte Diagnostik bei V. a. chronische KHK1
Echokardiografie
- Patient*innen, bei denen aufgrund von Anamnese und Befund die Verdachtsdiagnose einer KHK besteht, sollten eine echokardiografische Untersuchung in Ruhe erhalten.
Ischämiediagnostik (Stressechokardiografie, Myokardszintigrafie, Kardio-MRT) bzw. nichtinvasive Koronarbildgebung (Kardio-CT)
- Die Wahl des nichtinvasiven Verfahrens soll abhängig gemacht werden von
- der Vortestwahrscheinlichkeit für eine stenosierende KHK.
- der Eignung der Patient*innen für den entsprechenden Test.
- testbezogenen Risiken.
- den vor Ort verfügbaren Gerätschaften und der lokalen Expertise.
Invasive Diagnostik
- Eine invasive Koronarangiografie soll nicht durchgeführt werden
- bei niedriger Wahrscheinlichkeit für eine stenosierende KHK.
- bei mittlerer Wahrscheinlichkeit für eine stenosierende KHK und fehlendem Ischämie-Nachweis nach nichtinvasiver Diagnostik.
- bei hoher Komorbidität, bei der das Risiko der Koronarangiografie größer ist als der Nutzen durch die Sicherung der Diagnose und hieraus resultierender therapeutischer Maßnahmen.
- bei Patient*innen ohne symptomatische Indikation, die nach der Beratung mit dem Patientenblatt „Verdacht auf koronare Herzkrankheit: Brauche ich eine Herzkatheter-Untersuchung?" zu einer Bypass-OP aus prognostischer Indikation nicht bereit sind.
- Eine invasive Koronarangiografie soll empfohlen werden:
- Patient*innen mit hochgradigem Verdacht auf eine stenosierende KHK nach nichtinvasiver Diagnostik, die nach der Beratung mit der Info „Verdacht auf koronare Herzkrankheit: Brauche ich eine Herzkatheter-Untersuchung?" zu einer Bypass-OP aus prognostischer Indikation bereit sind.
- Patient*innen mit hochgradigem Verdacht auf eine stenosierende KHK nach nichtinvasiver Diagnostik, bei denen die Symptomatik trotz optimaler konservativer Therapie persistiert (symptomatische Indikation).
Indikationen zur Krankenhauseinweisung
- V. a akutes Koronarsyndrom (ACS)
- Brustschmerzen mit V. a. auf andere akut bedrohliche Erkrankung
Checkliste zur Überweisung
Brustschmerz
- Zweck der Einweisung
- Bestätigende Diagnostik? Therapie?
- Anamnese
- Brustschmerz: Beginn, Dauer? Progression? Lokalisation, Ausstrahlung? Auslösende Faktoren? Belastungsabhängigkeit?
- Begleitsymptome: Atemnot? Fieber? Husten? Auswurf? Bauchschmerzen?
- Vor- und Begleiterkrankungen? Bekannte Gefäßerkrankung? Kardiovaskuläre Risikofaktoren? Depression/Somatisierungsstörung?
- Medikation?
- Klinische Untersuchung
- Allgemeinzustand? Bewusstseinsstörung? Kaltschweißigkeit?
- Blutdruck, Puls, Rhythmus
- Halsvenenstauung? Ödeme?
- Herzgeräusche? Lungenstauung?
- Ergänzende Untersuchungen
- EKG
- evtl. Troponinschnelltest
Therapie
Therapieziele
- Wesentliche Ziele der Behandlung des CCS sind:1
- Reduktion der Sterblichkeit
- Reduktion der kardiovaskulären Morbidität (Vermeidung von ACS, Herzinfarkt, chronischer Herzinsuffizienz)
- Erhaltung der Belastbarkeit
- Verbesserung der krankheitsbezogenen Lebensqualität, u. a. durch:
- Verminderung der Angina-pectoris-Häufigkeit
- Verminderung der Intensität weiterer somatischer und psychischer Beschwerden.
Allgemeines zur Therapie
- Die Behandlung beruht auf:
- Lebensstilmodifikation
- körperliche Aktivität
- Ernährung und Gewicht
- Rauchstopp
- medikamentöse Therapie
- Thrombozytenaggregationshemmung
- Statin-Therapie
- antianginöse Medikation
- Revaskularisierung
- Option als symptomatische Therapie bei refraktärer AP unter optimaler medikamentöser Behandlung
- bei Mehrgefäßerkrankung Bypass zur Verbesserung der Prognose
- Behandlung von Komorbiditäten
- Behandlung psychosozialer Faktoren
- weitere Maßnahmen (z. B. Impfung)
- Lebensstilmodifikation
- Siehe hierzu auch die Artikel:
Beratung und gemeinsame Entscheidungsfindung
- Auch bei der aus ärztlicher Sicht eindeutigen Behandlungsindikation sollte die Beratung im Sinne der partizipativen Entscheidungsfindung erfolgen mit folgenden Kernprinzipien:1
- Hinweis auf anstehende Therapieentscheidung und Angebot zur gemeinsamen Entscheidung
- verständliche Aufklärung über Behandlungsmöglichkeiten sowie ihren Nutzen und Schaden
- aktives Erfragen des Verständnisses
- Erfassung von Erwartungen, Zielen und Präferenzen der Patient*innen
- Erzielen einer Übereinstimmung für einen konkreten Behandlungsplan.
- Hilfreich für die Beratung ist dabei auch die Verwendung des ARRIBA-Moduls kardiovaskuläre Prävention.
Lebensstilmodifikation
Körperliche Aktivität
- Regelmäßige körperliche Aktivität wirkt sich günstig auf die kardialen Risikofaktoren aus und hilft den Betroffenen, besser mit ihrer Verunsicherung durch ihre Herzerkrankung umzugehen.39-40,41-42
- Elemente eines Trainingsprogramms im Rahmen der Sekundärprävention der KHK39
- Mindestens 3- bis 4-mal pro Woche sollten aerobe Ausdauerbelastungen (z. B. „Walking", „Nordic-Walking", Radfahren, Schwimmen) mit niedriger bis moderater Intensität durchgeführt werden.39
- Ergänzend sollten 2- bis 3-mal pro Woche dynamische Kraftbelastungen durchgeführt werden.39
- Kraftbelastungen mit hoher isometrischer Komponente sollten vermieden werden.39
- Eine Belastungskontrolle durch die Patient*innen kann z. B. über die Anwendung der Borg-Skala vorgenommen werden.44
- Beispiele von Trainingsintensitäten1
- leichtes Training: Spazieren, leichte Hausarbeit (Borg 10–11)
- moderates Training: schnelles Gehen, langsames Radfahren, Wasserakrobatik (Borg 12–13)
- anstrengendes Training: Jogging, Fahrradfahren > 15 km/h, zügiges Bahnenschwimmen (Borg 14–16)
Ernährung
- Patient*innen mit KHK sollte eine gesunde, ausgewogene Ernährung empfohlen werden (ballaststoffreich, reich an Früchten und Gemüse, wenig gesättigte Fette).1
- Die Ernährung sollte abwechslungsreich sein und sich an den Empfehlungen der mediterranen Kost in den DEGAM-Leitlinien orientieren.27
- Täglich
- Getreide: 1–2 Portionen pro Mahlzeit in Form von Brot, Nudeln, Reis, Couscous etc. vorzugsweise als Vollkornprodukte
- Gemüse: 2 oder mehr Portionen pro Mahlzeit, mindestens eine Portion täglich als Rohkost
- Obst: 1–2 Portionen pro Mahlzeit z. B. als Dessert, abwechslungsreich
- Trinken: möglichst täglich 1,5–2 l Wasser und ungesüßten Kräutertee
- Milchprodukte: 2 Portionen pro Tag, bevorzugt als fettarme Produkte z. B. in Form von Joghurt oder Käse
- Olivenöl: elementarer Bestandteil, als Fettquelle reich an einfach ungesättigten Fettsäuren
- Oliven, Nüsse, Körner/Saat: z. B. als Quelle für Fette, Proteine, Vitamine
- Gewürze, Kräuter, Knoblauch, Zwiebeln: als Gewürze zur Geschmacksvariation und zur Reduktion des Salzkonsums
- Alkohol: moderater Konsum bis 1 Glas Wein täglich (Frauen) bzw. 2 Gläser (Männer) zu den Mahlzeiten
- Wöchentlich
- Fisch/Meeresfrüchte: 2 oder mehr Portionen
- weißes Fleisch: 2 Portionen
- Eier: 2–4 Portionen (inklusive Kochen und Backen)
- rotes Fleisch: weniger als 2 Portionen, möglichst dünn geschnitten, industriell weiterverarbeitet (z. B. Wurst, Fertigkost) weniger als 1 Portion
- Kartoffeln: bis zu 3 Portionen, möglichst frisch zubereitet
- Es liegen keine Daten vor aus kontrollierten Studien zu rein vegetarischer, veganer oder anderweitig selektiver Diät bei Patient*innen mit chronischer KHK vor.1
- Siehe auch Artikel Vollwertige Ernährung, Empfehlungen der DGE.
Gewicht
- Im Gegensatz zur Primärprävention, bei der Übergewicht/Adipositas mit einem erhöhten Risiko für kardiovaskuläre Ereignisse verbunden sind, ist bei KHK-Patient*innen der Nutzen einer Gewichtsreduktion nicht sicher belegt.1
- Einige Studien fanden sogar einen Überlebensvorteil bei adipösen Patient*innen im Vergleich zu Patient*innen mit einem BMI < 25 kg/m² (Adipositas-Paradox).1
- Eine Gewichtsreduktion per se wird daher aktuell nicht empfohlen, eine sich ergebende Gewichtsreduktion durch die empfohlene körperliche Aktivität ist davon aber abzugrenzen.1
Raucherentwöhnung
- Raucherentwöhnung ist für die Prognose mindestens so bedeutsam wie die medikamentöse Behandlung.45
- Bei allen Patient*innen sollte der Nikotinkonsum erfragt und dokumentiert werden.27
- Vollständige Abstinenz sowohl von aktivem als auch passivem Rauchen sollte bei allen Patient*innen angestrebt werden.1
- Raucherentwöhnung ist die kosteneffektivste Präventionsmaßnahme.43
- Verschiedene Therapieformen helfen bei der Raucherentwöhnung, ggf. auch in Kombination:46
- niederschwellige Verfahren (Kurzberatung, Telefonberatung, internet- bzw. smartphonegestützte Verfahren)
- psychotherapeutische Interventionen
- medikamentöse Therapie.
- E-Zigaretten sollten nicht zur Entwöhnung oder Schadensminimierung empfohlen werden.1
Leitlinie: DEGAM-Empfehlungen zur verhaltensorientierten Lebensstilberatung27
- Die Beratung sollte selbstregulative, verhaltensbezogene Techniken beinhalten.
- Diese bestehen aus:
- der Aufforderung zur Beschlussfassung hinsichtlich einer Verhaltensänderung
- der gemeinsamen spezifischen Zielsetzung
- der Überprüfung der zuvor gesetzten Ziele
- der Aufforderung zur Selbstbeobachtung des Verhaltens und
- der Bereitstellung von Feedback hinsichtlich des Verhaltens.
Prognostisch wirksame medikamentöse Therapie
Thrombozytenaggregationshemmer und orale Antikoagulanzien
- In der Langzeitprävention ist ASS das am besten untersuchte Medikament.43
- Es sollte allen Patient*innen mit chronischem Koronarsyndrom (CCS) angeboten werden.3,47
- Bei Patient*innen mit CCS und einer Indikation zur oralen Antikoagulation (z. B. Vorhofflimmern) soll allerdings keine zusätzliche Thrombozytenaggregationshemmung erfolgen.1
- Nach ACS und/oder PCI wird für einen begrenzten Zeitraum eine duale Plättchenhemmung (DAPT = Dual Antiplatelet Therapy) durchgeführt.3,47
- Bei Patient*innen nach Stentimplantation und mit Indikation zur Antikoagulation (z. B. Vorhofflimmern) wird für einen begrenzten Zeitraum eine Triple-Therapie (ASS + Clopidogrel + orales Antikoagulans) durchgeführt.3,47
Thrombozytenaggregationshemmung und orale Antikoagulation nach ACS und/oder Stentimplantation
- Detaillierte Empfehlungen hierzu finden Sie in den Artikeln:
Lipidsenkende Therapie
- Allen Patient*innen mit CCS sollte – unabhängig vom Ausgangswert der Blutfette – ein Statin angeboten werden.1,3
- Allerdings gibt es aktuell keinen breiten Konsens zwischen den Fachgesellschaften über die Art der Statingabe.48
- Strategie der festen Dosis („Fire and Forget"): Gabe eines hochdosierten Statins ohne zwingende Ergebniskontrolle
- Zielwertstrategie: Die Erreichung eines bestimmten LDL-Zielwerts wird angestrebt bzw. Reduktion ≥ 50 % vom Ausgangswert.
- Die DEGAM empfiehlt eine Strategie der festen Dosis („Fire and Forget").1
- Hinsichtlich einer Statin-Hochdosis bestehen ebenfalls Kontroversen. In der kardialen Sekundärprävention senken Hochdosen von Statinen (z. B. Atorvastatin 80 mg) in geringem Maß die Re-Infarktrate. Sie können aber die Sterblichkeit nicht beeinflussen.49 Eine Reihe unerwünschter Wirkungen sind – insbesondere im Alter – mit der Statindosis assoziiert.50-54
- In der Regel ist eine Hochdosisgabe eines Statins sinnvoll.
- Weitere Lipidbestimmungen oder Anpassungen entfallen.
- Andere Lipidsenker nur bei teilweiser oder vollständiger Statinunverträglichkeit zu erwägen.
- In den neuen ESC-Guidelines wird dagegen eine noch intensivere LDL-Senkung als bisher empfohlen (Zielwert < 55 mg/dl, Reduktion ≥ 50 % vom Ausgangswert). Große Register-Daten zeigen allerdings, dass in der Gesamtbevölkerung der Nadir der Sterblichkeit bei einem LDL von 140, bei mit Lipidsenkern behandelten Personen bei 90 mg/dl liegt.55-56
- Da dieser Zielwert mit reiner Statingabe häufig nicht erreicht werden kann, wird von der ESC die zusätzliche Gabe von Ezetimib und der – sehr teuren – PCSK9-Inhibitoren (Evolocumab und Alirocumab)57 empfohlen.
- Die DEGAM hält eine Behandlung mit PCSK9-Inhibitoren zu den derzeitigen Preisen nicht für ausreichend wirksam und nicht kosteneffektiv.1
- Zu berücksichtigen ist auch, dass gemäß Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) PCSK9-Inhibitoren nicht routinemäßig eingesetzt werden sollen (nur zur Vermeidung einer Lipidapherese).1
- PCSK9-Inhibitoren dürfen nicht von Hausärzt*innen verordnet werden.
- Statindosierungen und ihre Wirkung auf den LDL-Spiegel1
- moderate Dosis (LDL-Reduktion 30–49 %)
- Atorvastatin 10–20 mg
- Rosuvastatin 5–10 mg
- Simvastatin 20–40 mg
- Pravastatin 40–80 mg
- Lovastatin 40 mg
- hohe Dosis (LDL-Reduktion ≥ 50 %)
- Atorvastatin 40–80 mg
- Rosuvastatin 20–40 mg
- moderate Dosis (LDL-Reduktion 30–49 %)
- Durchschnittliche Senkung des LDL-Cholesterins durch verschiedene Therapien/Therapiekombinationen58
- moderate Dosierung eines Statins: 30 %
- hochdosiertes Statin: 50 %
- hochdosiertes Statin + Cholesterinresorptionshemmer: 65 %
- PCSK9-Inhibitor: 60 %
- hochdosiertes Statin + PCSK9-Inhibitor: 75 %
- hochdosiertes Statin + Cholesterinresorptionshemmer + PCSK9-Inhibitor: 85 %
DEGAM-Leitlinie: Neue Thrombozytenaggregationshemmer, Einsatz in der Hausarztpraxis47
Chronisches Koronarsyndrom
- Allen Patient*innen mit stabiler KHK soll niedrig dosierte Acetylsalicylsäure (ASS) angeboten werden.
- Clopidogrel soll nicht als Mittel der 1. Wahl eingesetzt werden, kann aber als Alternative bei ASS-Intoleranz angeboten werden.
- Nach kardialer Bypass-Operation reicht eine ASS-Monotherapie aus.
- Nach kardialer Bypass-Operation und Notwendigkeit einer Antikoagulation sollte postoperativ nur noch die orale Antikoagulation fortgeführt werden.
Chronisches Koronarsyndrom nach Stentimplantation
- Unbeschichteter Stent (BMS): ASS 100 mg/d dauerhaft, Clopidogrel 75 mg/d für 4 Wochen
- Beschichteter Stent (DES): ASS 100 mg/d dauerhaft, Clopidogrel 75 mg/d für 3–6 Monate
- Speziell bei mit Zotarolimus oder Everolimus beschichteten Stents kann die Dauer der Clopidogrel-Gabe auf 3 Monate verkürzt werden
Triple-Therapie (Phenprocoumon + ASS + Clopidogrel) nach Stentimplantation bei Patient*innen mit chronischem Koronarsyndrom und Indikation zur Antikoagulation
- So kurz wie möglich
- INR-Ziel nur 2,0–2,5
- Clopidogrel statt Ticagrelor
- OAK + BMS: Triple 4 Wochen, dann nur Phenprocoumon
- OAK + DES: Triple 1–3 Monate (Limus-Stent) bzw. 6 Monate (Paclitaxel-Stent), dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- Bei erhöhtem Blutungsrisiko kann bei antikoagulierten Patient*innen mit stabiler KHK die Clopidogrel-Gabe auf 6, bei sehr hohem Blutungsrisiko auf 1–3 Monate verkürzt werden.
Nationale VersorgungsLeitlinie: Lipidsenkende Therapie1
- Allen Patient*innen mit KHK soll unabhängig vom Ausgangswert der Blutfettwerte zur Reduktion der Morbidität und der Sterblichkeit dauerhaft ein Statin als Mittel der 1. Wahl empfohlen werden.
- Die DEGAM empfiehlt die Strategie der festen Dosis: Allen Patient*innen mit koronarer Herzkrankheit sollte eine feste Hochdosis-Statintherapie empfohlen werden, sofern keine Kontraindikationen bestehen.
- Ezetimib kann Patient*innen mit KHK angeboten werden, wenn keine Hochdosis-Statintherapie toleriert wird (Strategie der festen Dosis). Allerdings konnte kein Nutzen einer Ezetimib-Monotherapie belegt werden (Anmerkung der Redaktion).
- Patient*innen mit KHK können PCSK9-Inhibitoren angeboten werden, wenn keine Hochdosis-Statintherapie toleriert wird (Strategie der festen Dosis).
Symptomatisch wirksame medikamentöse Therapie
- Die antianginöse Behandlung umfasst die Möglichkeit zur raschen Therapie eines Angina-pectoris-Anfalls durch die Patient*innen sowie eine – sofern erforderlich – längerfristig vor AP-Anfällen schützende Behandlung.
Schnellwirksame Nitrate
- Zur Behandlung eines Angina-pectoris-Anfalls sollte ein schnell wirksames Nitrat zur Verfügung stehen.1
- Mit Spray etwas schnellerer Wirkungseintritt als bei sublingualer Gabe3
- Applikation am besten im Sitzen oder Liegen zur Vermeidung einer Synkope3
- Vorteil einer nur bedarfsweisen Anwendung von Nitraten ist auch, dass sich keine Nitrattoleranz entwickelt.1
Längerfristig wirksame antiischämische Medikation
- Eine optimale antiischämische Therapie ist nicht definiert und sollte daher individuell unter Berücksichtigung von Komorbiditäten angepasst werden.3
- Betablocker und Ca-Antagonisten sind am besten untersucht und werden als Erstlinientherapie empfohlen.3
- Nur bei Unverträglichkeit oder Unwirksamkeit von Betablockern oder Ca-Antagonisten sollten weitere Substanzen erwogen werden.
- Ivabradin senkt die Sinusfrequenz und ist eine Option vor allem bei Patient*innen mit erhöhter Sinusfrequenz und Herzinsuffizienz.59
- Die Substanz ist nur zugelassen, wenn Betablocker nicht vertragen werden oder kontraindiziert sind.
- Ranolazin ist eine Option erst bei Versagen der anderen antiischämischen Medikamente.3
- Ranolazin ist nur zugelassen, wenn Betablocker oder Kalziumantagonisten nicht ausreichen oder nicht vertragen werden.
- QT-Verlängerungen und Cytochrom-Interaktionen wurden beschrieben.
- Ivabradin senkt die Sinusfrequenz und ist eine Option vor allem bei Patient*innen mit erhöhter Sinusfrequenz und Herzinsuffizienz.59
Medikamentöse Therapie von kardiovaskulären Komorbiditäten
- Komorbiditäten wie arterielle Hypertonie, Vorhofflimmern und Herzinsuffizienz sollten gemäß der entsprechenden Leitlinien behandelt werden, hier sind insbesondere ACE-Hemmer/AT-Inhibitoren und Betablocker von Bedeutung.
- Hingegen ist eine KHK keine eigenständige Indikation für ACE-Hemmer/AT-Inhibitoren, hierzu gibt es keinen ausreichend belegten Nutzen.1
- Auch die Indikation zur Betablocker-Therapie ergibt sich aus Komorbiditäten oder zur symptomatischen Behandlung einer Angina pectoris, während für die KHK allein ein prognostischer Nutzen einer Langzeittherapie fraglich ist.
- Lediglich im 1. Jahr nach Myokardinfarkt wird in den NVL derzeit eine Betablocker-Therapie empfohlen mit anschließender Evaluation des Absetzens.1
Revaskularisation
- Während der prognostische Nutzen einer Revaskularisation beim ACS gut belegt ist, wurde diese Frage beim CCS lange kontrovers diskutiert.60
- Studien und Metaanalysen in den vergangenen Jahren zeigten, dass in den untersuchten Studienpopulationen eine routinemäßige Revaskularisierung im Vergleich zur rein medikamentösen Behandlung nicht zu einem verbesserten Überleben führte.61-64
- Im ISCHEMIA-Trial wurde dies kürzlich erneut auch für eine Studienpopulation mit mäßiger bis großer Ischämie bestätigt.65
- Dagegen zeigt sich in den meisten Studien ein symptomatischer Nutzen mit Verbesserung der Angina pectoris-Beschwerden.63,66-67
- Der ORBITA-Trial (Randomisierung PCI vs. Schein-PCI) weist auf eine mögliche Placebo-Komponente bei der symptomatischen Verbesserung durch PCI hin.68-69
- Insgesamt ist derzeit eine routinemäßige Revaskularisierung bei der Mehrheit der Patient*innen mit CCS nicht indiziert, sie ist eine Option für folgende Indikationen:1,70
- symptomatische Indikation bei refraktären Beschwerden unter optimaler medikamentöser Therapie
- prognostische Indikation bei Hochrisikogruppen, (die zudem in vielen Studien ausgeschlossen sind)70
- Hauptstammstenose > 50 %
- 2- bis 3-Gefäßerkrankung mit niedriger linksventrikulärer Ejektionsfraktion < 35 %
- nur noch ein verbleibendes offenes Koronargefäß mit Stenose >50 %
- Die Patient*innen sollten insbesondere auch darüber aufgeklärt werden, ob bei ihnen ein Eingriff vor allem wegen eines prognostischen oder vorwiegend wegen eines symptomatischen Nutzens diskutiert wird.71-73
- Zur Beratung und als Entscheidungshilfe stehen Informationsblätter im Rahmen des Programms für Nationale Versorgungsleitlinien (NVL) zur Verfügung:
- Entscheidungshilfe: Stents einsetzen bei einer Herzkatheteruntersuchung?
- Entscheidungshilfe: Stent oder Bypass?
- Der Entscheidung über die Art eines Eingriffs (PCI vs. Bypass) sollte eine Diskussion des individuellen Nutzen-Risiko-Profils im „Herz-Team" aus Kardiolog*innen und Herzchirurg*innen vorausgehen, wichtige Kriterien sind dabei:70
- Komplexität des Koronarbefunds
- Eingriffsrisiko
- kardiale und nichtkardiale Komorbiditäten
- Präferenz der Patient*innen.
- Mehrgefäßerkrankung, komplexer Gefäßbefund und Diabetes mellitus sind dabei Kriterien, die eher für eine Bypass-OP im Vergleich zur PCI sprechen.70,74-76
Nationale Versorgungsleitlinie: Revaskularisation1
- Bei einer konservativ nicht ausreichend behandelbaren Symptomatik (Angina pectoris oder Äquivalente) soll bei geeigneter Morphologie (nach invasiver Diagnostik) eine Revaskularisation angeboten werden.
- Bei einer Mehrgefäßerkrankung oder Hauptstammstenose soll mit dem Informationsblatt „Entscheidungshilfe: Verengte Herzkranzgefäße: Stent oder Bypass?" beraten werden. Diese Beratung soll dokumentiert werden.
- Bei komplexen Koronarbefunden (SYNTAX-Score) soll über den Therapievorschlag im Herzteam entschieden werden.
- Patient*innen mit Diabetes mellitus und koronarer Mehrgefäßerkrankung soll als Revaskularisationsverfahren die Bypass-OP angeboten werden.
- Patient*innen mit proximaler oder medialer Hauptstammstenose und einem SYNTAX- Score ≤ 22 soll PCI oder Bypass-OP gleichermaßen angeboten werden.
- Bei Patient*innen mit Bifurkationsstenose des Hauptstamms oder proximaler/medialer Hauptstammstenose und mäßig ausgeprägter Mehrgefäßerkrankung (SYNTAX-Score von 23 bis 32) sollte primär die Bypass-OP, nachrangig eine PCI angeboten werden.
- Patient*innen mit Hauptstammstenose und Mehrgefäßerkrankung (SYNTAX-Score ≥ 33) soll die Bypass-OP angeboten werden.
Behandlung psychosozialer Faktoren
- Psychosozialer Stress, Depression und Angst sind mit einer schlechteren Prognose verbunden und erschweren die Veränderung des Lebensstils und die allgemeine Therapieadhärenz3,77
- Behandelnde Hausärzt*innen können zur Behandlung psychosozialer Belastungen1
- selbst im Rahmen einer psychosomatischen Grundversorgung tätig werden.
- Krankheitsbewältigung
- Therapie von leicht-mittelgradigen Depressions- und Angstsymptomen
- bei weitergehendem Bedarf Vermittlungshilfe leisten.
- selbst im Rahmen einer psychosomatischen Grundversorgung tätig werden.
Nationale Versorgungsleitlinie: Behandlung psychosozialer Faktoren1
- Patient*innen mit chronischer KHK und psychosozialen Belastungsfaktoren sollen multimodale Verhaltensinterventionen angeboten werden, um ihr psychosoziales Wohlbefinden und die Sekundärprävention der KHK zu verbessern:
- Aufklärung über einen gesundheitsförderlichen Lebensstil
- körperliches Training
- psychologische Interventionen zur Reduktion psychosozialer Risikofaktoren und zur Förderung der Krankheitsverarbeitung.
Weitere Maßnahmen
Impfung
- Patient*innen mit CCS sollte eine jährliche Grippeimpfung empfohlen werden.1
Komplementäre und alternative Therapien
- Komplementäre/alternative Therapien wie Phytotherapie, Vitaminergänzungsmittel oder Omega-3-Fettsäuren-Präparate sollen nicht angewendet werden.1
Verlauf, Komplikationen und Prognose
Komplikationen
- ACS/Herzinfarkt, kardiogener Schock
- Chronische Herzinsuffizienz
- Ventrikuläre Tachykardien, Kammerflimmern
- Supraventrikuläre Tachykardien
- Notwendigkeit zur Herzschrittmachertherapie
Verlauf und Prognose
- Jährlicher Sterblichkeit ca. 1,2–2,4 %78
- Ungünstigerer Verlauf bei Patient*innen mit:78
- reduzierter LV-Funktion und Herzinsuffizienz
- Mehrgefäßerkrankung
- proximalen Koronarstenosen
- ausgeprägter Ischämie
- reduzierter körperliche Belastbarkeit
- Depression.
Hausärztliche Langzeitbetreuung, kardiale Rehabilitation
- Die Langzeitbetreuung erfolgt primär hausärztlich in Kooperation mit Fachärzt*innen, Kliniken und Rehaeinrichtungen.1
- Evtl. strukturierte Betreuung im Rahmen eines DMP (Disease-Management-Programm)79-80
- regelmäßige, individuell festzusetzende Verlaufskontrollen
- Vereinbarung von Therapiezielen
- evidenzbasierte Therapie (Lebensstil, Medikation)
- Schulungen (z. B. Hypertonie, Diabetes, Umgang mit Antikoagulanzien), evtl. Veranlassung einer Psychotherapie
- Anbindung an Herzgruppen, im Einzelfall Veranlassung eines ambulanten oder stationären Heilverfahrens im Rahmen der kardialen Rehabilitation
Nationale Versorgungsleitlinie: Hausärztliche Langzeitbetreuung1
- Patient*innen mit KHK sollten von ihren Hausärzt*innen zu regelmäßigen Konsultationen in die Praxis eingeladen werden (viertel- bis halbjährlich), die unabhängig von Kontakten geplant werden, die z. B. wegen akuter Beschwerden oder Komorbiditäten erforderlich sind.
- Patient*innen mit KHK soll eine Überweisung zur Kardiologie empfohlen werden, wenn auf der hausärztlichen Versorgungsebene keine ausreichende Symptomkontrolle erreicht werden kann oder wenn prognostisch wirksame Maßnahmen nicht ausreichend umgesetzt werden können (z. B. aufgrund von Unverträglichkeiten).
- Patient*innen mit KHK soll eine Vorstellung bei weiteren Gesundheitsprofessionen empfohlen werden, wenn hierdurch eine bessere Symptomkontrolle oder Prognoseverbesserung erreicht werden kann.
- Patient*innen mit KHK, insbesondere nach ACS, nach Koronarintervention oder nach Bypass-Operation, soll die Teilnahme an einer ambulanten Herzgruppe oder anderen Nachsorgeprogrammen zur Förderung eines regelmäßigen körperlichen Trainings und anderer risikoreduzierender Lebensstiländerungen empfohlen werden.
- Eine zeitlich begrenzte Rehabilitationsmaßnahme in spezialisierten Rehabilitationseinrichtungen (Heilverfahren: ambulant oder stationär) sollte in folgenden Fällen empfohlen werden, soweit kein akutmedizinischer Handlungsbedarf besteht:
- bei limitierender Symptomatik trotz Standardtherapie
- bei ausgeprägtem und unzureichend eingestelltem Risikoprofil
- bei ausgeprägter psychosozialer Problematik
- bei drohender Berufs-/Erwerbsunfähigkeit oder Pflegebedürftigkeit.
Patienteninformationen
Patientenblätter und Patientenleitlinie des NVL-Programms
Mögliche Untersuchungen bei KHK-VerdachtGemeinsam entscheidenWichtig: Ernährung und BewegungWarum Rauchstopp hilftEntscheidungshilfe: Langzeitbehandlung mit StatinenBrauche ich eine Herzkatheter-Untersuchung?Entscheidungshilfe: Stents einsetzen bei einer Herzkatheter-Untersuchung?Entscheidungshilfe: Stent oder Bypass?PatientenleitlinieChronische KHK
Patienteninformationen in Deximed
KHK
KoronareChronischeHerzkrankheitKoronarekoronareHerzerkrankungen, UntersuchungenKoronare Herzerkrankheit, Ernährung und Bewegung
Gesundheitsprävention
Herzerkrankungen, Vorbeugung von KomplikationenFettarme LebensmittelWarum sollten Sie das Rauchen aufgeben, und wie gelingt es?Krafttraining – gut für's Herz
Diagnostik
EKG bei Angina pectoris und HerzinfarktPerkutane Koronarintervention (PCI)Bypass-Operation des HerzensHerzerkrankung
Gesundheitsinformation.de
Weitere Informationen
- Siehe Artikel Beurteilung der Fahreignung
Illustrationen
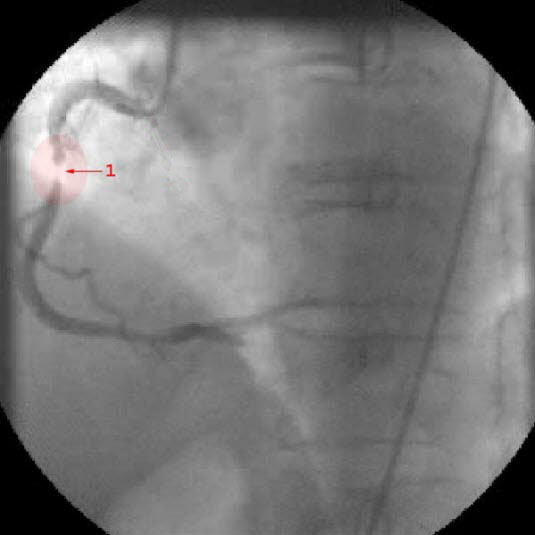
Koronarangiografie: Darstellung einer Stenose in der rechten Koronararterie (1 = hochgradige Stenose)
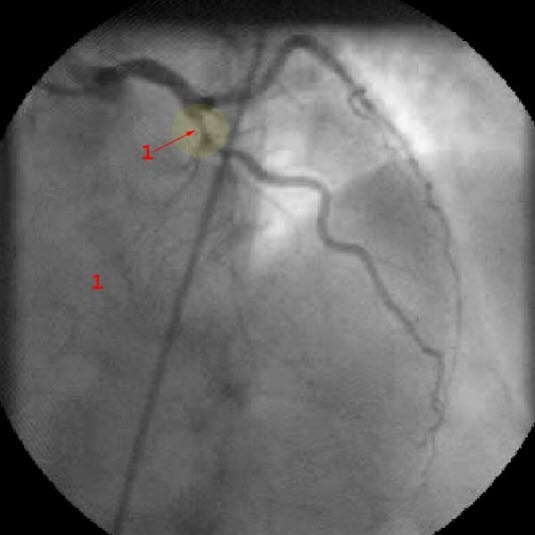
Koronarangiografie: ausgeprägte RIVA-Stenose (1)
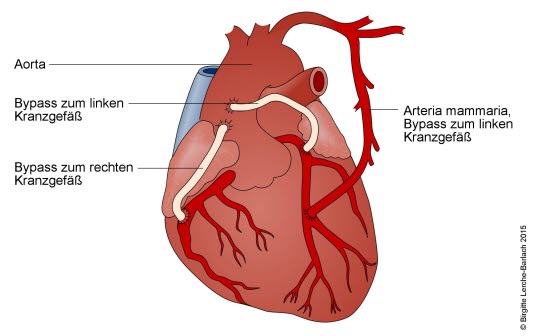
Koronarer Dreifach-Bypass
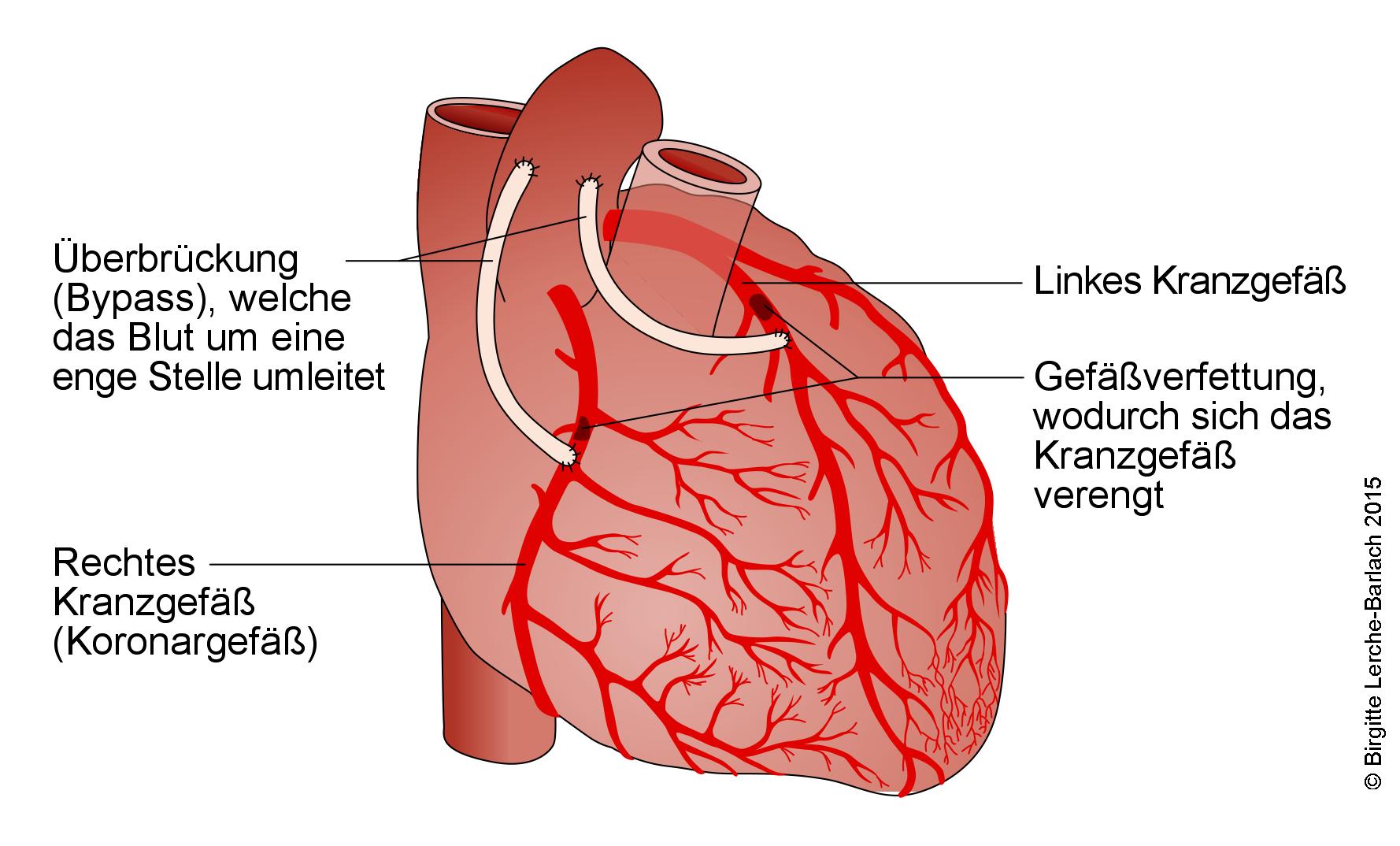
Koronararterien-Bypass
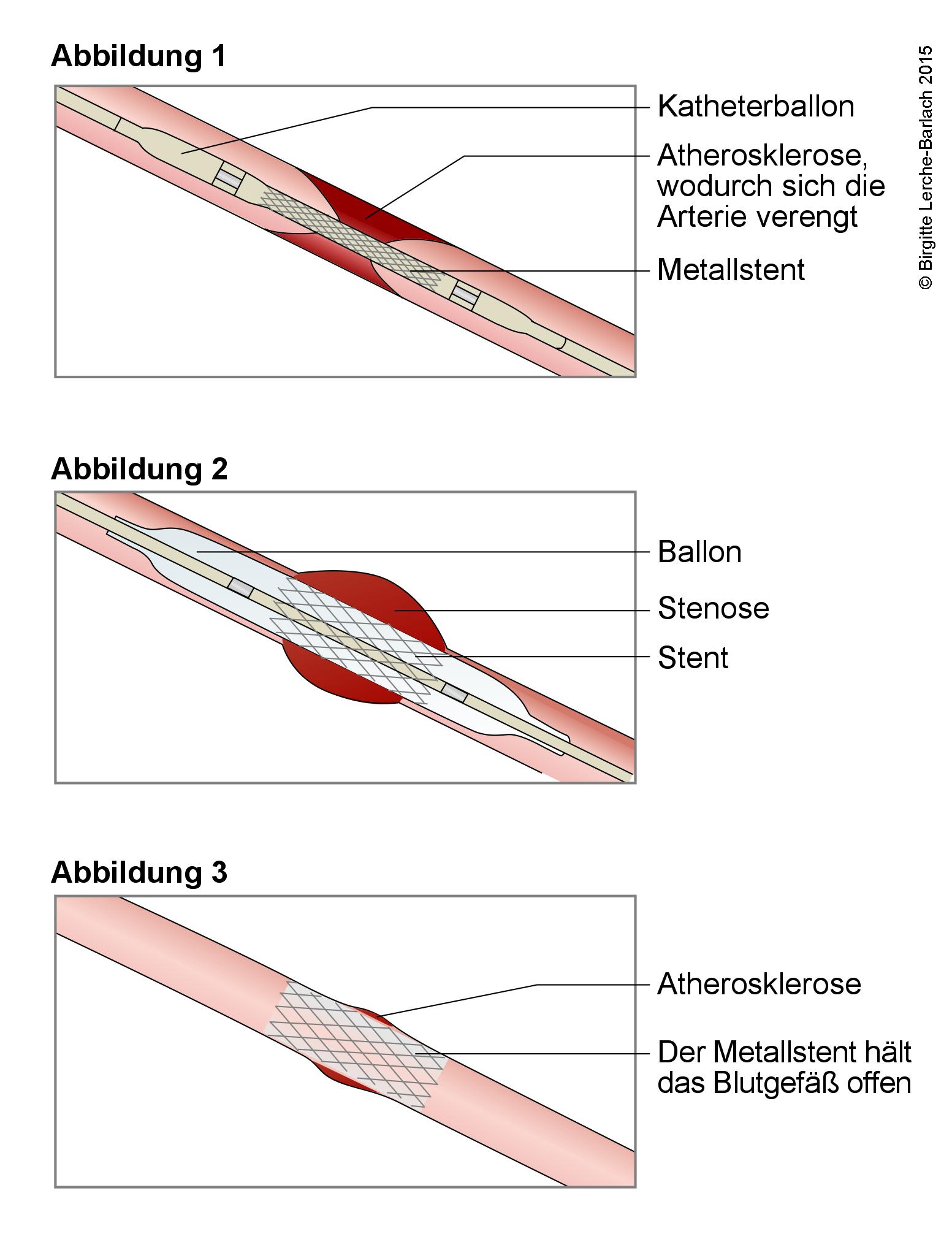
Stentbehandlung eines engen Blutgefäßes
Quellen
Leitlinien
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische KHK – Langfassung, 5. Auflage. AWMF-Leitlinie Nr. nvl-004. S3, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Brustschmerz. AWMF-Leitlinie Nr. 053-023. S3, Stand 2011. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Hausärztliche Risikoberatung zur kardiovaskulären Prävention. AWMF-Leitlinie Nr. 053-024. S3, Stand 2016. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. AWMF-Leitlinie Nr. 053-041. S2e, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauferkrankungen. Leitlinie körperliche Aktivität zur Sekundärprävention und Therapie kardiovaskulärer Erkrankungen. Stand 2009. www.dgpr.de
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauf-Erkrankungen. Leitlinie zur kardiologischen Rehabilitation (LL-KardReha) im deutschsprachigen Raum Europas Deutschland, Österreich, Schweiz (D-A-CH). AWMF-Leitlinie Nr. 133-001. Stand 2020. www.dgpr.de
- Deutsche Gesellschaft für Suchtforschung und Suchttherapie. Rauchen und Tabakabhängigkeit: Screening, Diagnostik und Behandlung. AWMF-Leitlinie Nr. 076-006. S3, Stand 2021. www.awmf.org
- European Society of Cardiology. Guidelines for the diagnosis and management of chronic coronary syndromes. Stand 2019. www.escardio.org
- European Society of Cardiology, European Association for Cardio-Thoracic Surgery. Guidelines on myocardial revascularization. Stand 2018. www.escardio.org
Literatur
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische KHK – Langfassung, 5. Auflage. Version 1. 2019 [cited: 2021-03-03]. DOI: 10.6101/AZQ/000419. www.awmf.org
- Schüpke S. Chronisches und akutes Koronarsyndrom. Cardiovasc 2020; 20: 30-35. doi:10.1007/s15027-020-0416-9 DOI
- Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020; 41: 407-477. doi:10.1093/eurheartj/ehz425 DOI
- Fox K, Metra M, Morais J, et al. The myth of ‘stable’ coronary artery disease. Nat Rev Cardiol 2020; 17: 9-21. doi:10.1038/s41569-019-0233-y DOI
- Jurisch D, Laufs U. Chronisches Koronarsyndrom - Neuklassifikation der stabilen koronaren Herzkrankheit. Internist 2021; 62: 47-57. doi:10.1007/s00108-020-00910-0 DOI
- Dürschmied D, Bode C, von zur Mühlen C. Chronisches Koronarsyndrom: Neudefinition der „stabilen“ koronaren Herzerkrankung. Dtsch Arztebl 2019; 116: 12-16. www.aerzteblatt.de
- Deutsche Herzstiftung. Herzbericht 2019. www.herzstiftung.de
- RKI: Gesundheit in Deutschland (2015). www.rki.de
- Gößwald A, Schienkiewitz A, Nowossadeck E, et al. Prävalenz von Herzinfarkt und koronarer Herzkrankheit bei Erwachsenen im Alter von 40 bis 79 Jahren in Deutschland. Bundesgesundheitsbl 2013; 56: 650-655. doi:10.1007/s00103-013-1666-9 DOI
- Deutsche Herzstiftung. Deutscher Herzbericht 2019. www.herzstiftung.de
- Wiesemann A. Die KHK-Problematik in der Praxis. Der Hausarzt 2012; 4: 45-47. www.klinikum.uni-heidelberg.de
- Libby P, Theroux P. Pathophysiology of Coronary Artery Disease. Circulation 2005; 111: 3481-3488. doi:10.1161/CIRCULATIONAHA.105.537878 DOI
- Weber C, Noels H. Atherosclerosis: current pathogenesis and therapeutic options. Nature Medicine 2011; 17: 1410-1422. doi:10.1038/nm.2538 DOI
- Libby P, Hansson G. From Focal Lipid Storage to Systemic Inflammation. J Am Coll Cardiol 2019; 74: 1594–1607. doi:10.1016/j.jacc.2019.07.061 DOI
- Poston R. Atherosclerosis: integration of its pathogenesis as a self-perpetuating propagating inflammation: a review. Cardiovasc Endocrinol Metab 2019; 8: 51-61. doi:10.1097/XCE.0000000000000172 DOI
- Schoenhagen P, Ziada RM, Kapadia SP, Crowe TD, Nissen SE, Tuzcu EM. Extent and direction of arterial remodeling in stable versus unstable coronary syndromes: an intravascular ultrasound study. Circulation 2000; 101: 598-603. pubmed.ncbi.nlm.nih.gov
- Jacobshagen C, Maier L. Pathophysiologie der chronischen Myokardischämie. Herz 2013; 38: 329-333. doi:10.1007/s00059-013-3790-6 DOI
- Halcox JP, Schenke WH, Zalos G, et al. Prognostic value of coronary vascular endothelial dysfunction. Circulation 2002; 106: 653-8. pubmed.ncbi.nlm.nih.gov
- Yusuf S, Hawken S, Ôunpuu S et al. Obesity and the risk of myocardial infarction in 27 000 participants from 52 countries: a case-control study. Lancet 2005; 366: 1640-9. PubMed
- McGill HC, McMahan A, Herderick EE, Zieske AW, Malcom GT, Tracy RE, Strong JP, for the pathobiological determinants of atherosclerosis in youth (PDAY) research group. Obesity accelerates the progression of coronary atherosclerosis in young men. Circulation 2002; 105: 2712-8. PubMed
- Lakka H-M, Lakka TA, Tuomilehto J, Salonen JT. Abdominal obesity is associated with increased risk of acute coronar events in men. Eur Heart J 2002; 23: 706-13. PubMed
- Bogers RP, Bemelmans WJ, Hoogenveen RT, et al. Association of overweight with increased risk of coronary heart disease partly independent of blood pressure and cholesterol levels: A meta-analysis of 21 cohort studies including more than 300 000 persons. Arch Intern Med 2007; 167: 1720-8. PubMed
- Rosengren A, Hawken S, Ôunpuu S, et al. Association of psychosocial risk factors with risk of acute myocardial infarction in 11 119 cases and 13 648 controls from 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 953-62. PubMed
- Hemingway H, Marmot M. Psychosocial factors in the primary and secondary prevention of coronary heart disease: a systematic review. I: Yusuf S, Cairns JA, Camm AJ, Fallen EL, Gersh BJ, red. Evidence based cardiology. London: BMJ Books, 1998: 269-85.
- Yusuf S, Hawken S, Ounpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937-952. doi:10.1016/S0140-6736(04)17018-9 DOI
- Dhingra R, Vasan R. Age as a Cardiovascular Risk Factor. Med Clin North Am 2012; 96: 87-91. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Risikoberatung zur kardiovaskulären Prävention. AWMF-Nr. 053-024. Stand 2016. www.awmf.org
- Deutsche Herzstiftung. Die koronare Herzkrankheit: Ursachen und Risiken. Zugriff 07.03.21. www.herzstiftung.de
- Anand S, Islam S, Rosengren A, et al. Risk factors for myocardial infarction in women and men: insights from the INTERHEART study. Eur Heart J 2008; 29: 932-940. doi:10.1093/eurheartj/ehn018 DOI
- Roncaglioni M, Santoro L, D'Avanzo B, et al . Role of Family History in Patients With Myocardial Infarction. Circulation 1992; 85: 2065-2072. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Brustschmerz. AWMF-Leitlinie Nr. 053-023, Stand 2011. www.awmf.org
- Institut für Allgemeinmedizin, Universitätsmedizin Rostock. Marburger-Herz-Score. allgemeinmedizin.med.uni-rostock.de
- Stiefelhagen P. Kardiale Bildgebung bei KHK - Ischämiediagnostik oder Stenosendetektion?. CardioVasc 2020; 20: 16-17. doi:10.1007/s15027-020-3430-z DOI
- Lindner O, Rusche H, Schäfers M, et al. Aktuelle Konzepte der Myokardperfusionsszintigraphie. Dtsch Arztebl 2007; 104: A952-958. www.aerzteblatt.de
- Achenbach S, Barkhausen J, Beer M, et al. Konsensusempfehlungen der DRG/DGK/DGPK zum Einsatz der Herzbildgebung mit Computertomographie und Magnetresonanztomographie. Kardiologe 2012; 6: 105-125. doi:10.1007/s12181-012-0417-8 DOI
- Möllmann H, Leistner P, Schulze P, et al. Kommentar zu den Leitlinien (2019) der ESC zum chronischen Koronarsyndrom. Kardiologe 2020; 14: 482-491. doi:10.1007/s12181-020-00408-x DOI
- Arriba Modulbeschreibung "Kardiovaskuläre Prävention". Zugriff 15.03.21. arriba-hausarzt.de
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Arriba. Zugriff 15.03.21. www.degam.de
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauferkrankungen. Leitlinie körperliche Aktivität zur Sekundärprävention und Therapie kardiovaskulärer Erkrankungen. Stand 2009. www.dgpr.de
- Larcombe JH. Review: exercise based cardiac rehabilitation reduces all cause and cardiac mortality in coronary heart disease. Evid Based Med 2004; 9: 175. www.ncbi.nlm.nih.gov
- Hambrecht R, Walther C, Mobius-Winkler S, et al. Percutaneous coronary angioplasty compared with exercise training in patients with stable coronary artery disease: a randomized trial. Circulation 2004; 109: 1371-8. PubMed
- Iestra JA, Kromhout D, van der Schouw YT, Grobbee DE, Boshuizen HC and van Staveren WA. Effect size estimates of lifestyle and dietary changes on all-cause mortality in coronary artery disease patients: a systematic review. Circulation 2005; 112: 924-34. pubmed.ncbi.nlm.nih.gov
- Piepoli M, Hoes A, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2016; 37: 2315-2381. academic.oup.com
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauf-Erkrankungen. Leitlinie zur kardiologischen Rehabilitation (LL-KardReha) im deutschsprachigen Raum Europas Deutschland, Österreich, Schweiz (D-A-CH). AWMF-Nr. 133-001. Stand 2020. www.dgpr.de
- Stead LF, Buitrago D, Preciado N, Sanchez G, Hartmann-Boyce J, Lancaster T. Physician advice for smoking cessation. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD000165. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Suchtforschung und Suchttherapie. Rauchen und Tabakabhängigkeit: Screening, Diagnostik und Behandlung. AWMF-Leitlinie 076-006. Stand 2021. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. AWMF-Leitlinie Nr.053-041. Stand 2019. www.awmf.org
- Parhofer K. LDL: Je niedriger, desto besser. MMW - Fortschritte der Medizin 2019; 19: 43-44. doi:10.1007/s15006-019-1060-0 DOI
- Koskinas et al. Effect of statins and non-statin LDL-lowering medications on cardiovascular outcomes in secondary prevention: a meta-analysis of randomized trials. European Heart Journal (2017) 0, 1–9. boris.unibe.ch
- Hirnblutungen durch zu niedriges LDL? Neurology 2019;92:1-9. www.esanum.de
- Leutner M et al. Diagnosis of osteoporosis in statin-treated patients is dose-dependent. Ann Rheum Dis 2019;78:1706–1711. ard.bmj.com
- Jende et al. Association of Serum Cholesterol Levels With Peripheral Nerve Damage in Patients With Type 2 Diabetes. JAMA Network Open 2019;2(5):e194798. pubmed.ncbi.nlm.nih.gov
- Caughey et al. Association of Statin Exposure With Histologically Confirmed Idiopathic Inflammatory Myositis in an Australian Population. JAMA Intern Med. jamanetwork.com
- Naci H et al. Comparative Tolerability and Harms of Individual Statins. Circulation 2013. www.ahajournals.org
- Mach F, Baigent C, Catapano A, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41: 111-188. doi:10.1093/eurheartj/ehz455 academic.oup.com
- Johannesen C, Langsted A, Mortensen M, Nordestgaard M. Association between low density lipoprotein and all cause and cause specific mortality in Denmark: prospective cohort study. BMJ 2020;371:m4266. www.bmj.com
- Schmidt A, Pearce L, Wilkins J, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database Sys Rev 2017; 4: CD011748.. doi:10.1002/14651858.cd011748.pub2 DOI
- Mühleck F, Laufs U. Primärprävention der koronaren Herzkrankheit. Herz 2020; 45: 39-49. doi:10.1007/s00059-019-04873-3 DOI
- Fox K. et al. Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial. Lancet 2008 Sep 6;372(9641):807-16. pubmed.ncbi.nlm.nih.gov
- Holmes D, Taggart D. Revascularization in stable coronary artery disease: a combined perspective from an interventional cardiologist and a cardiac surgeon. Eur Heart J 2016; 37: 1873–1882. doi:10.1093/eurheartj/ehw044 DOI
- Stergiopoulos K, Boden W, Hartigan P et al. Percutaneous Coronary Intervention Outcomes in Patients With Stable Obstructive Coronary Artery Disease and Myocardial Ischemia A Collaborative Meta-analysis of Contemporary Randomized Clinical Trials JAMA Intern Med. 2014;174(2):232-240. www.ncbi.nlm.nih.gov
- Sedlis SP Hartligan PM, Teo KK et al.: Effect of PCI on long-term survival of patients with stable ischemic heart disease. N Engl J Med. 2015 November; 372:20. 1937-1946. www.ncbi.nlm.nih.gov
- Bangalore S, Maron D, Stone G, et al. Routine Revascularization Versus Initial Medical Therapy for Stable Ischemic Heart Disease - A Systematic Review and Meta-Analysis of Randomized Trials. Circulation 2020; 142: 841-857. doi:10.1161/CIRCULATIONAHA.120.048194 DOI
- Boden W, O'Rourke R, Teo K, et al, for the COURAGE Trial Research Group. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007; 356: 1503-16. PubMed
- Maron D, Hochman J, Reynolds H, et al. Initial Invasive or Conservative Strategy for Stable Coronary Disease. N Engl J Med 2020; 382: 1395-1407. doi:10.1056/NEJMoa1915922 DOI
- Weintraub W, Spertus J, Kolm P, for the COURAGE Trial Research Group. Effect of PCI on quality of life in patients with stable coronary disease. N Engl J Med 2008; 359: 677-687. doi:10.1056/NEJMoa072771 DOI
- Wijeysundera HC, Nallamothu BK, Krumholz HM, et al. Meta-analysis: Effects of percutaneous coronary intervention versus medical therapy on angina relief. Ann Intern Med 2010; 152: 370-9. pubmed.ncbi.nlm.nih.gov
- Al-Lamee R, Thompson D, Dehbi H, et al. Percutaneous coronary intervention in stable angina (ORBITA): a double-blind, randomised controlled trial. Lancet 2018; 391: 31-40. pubmed.ncbi.nlm.nih.gov
- Albuquerque L, Gomes W. ORBITA Trial: Redefining the Role of Intervention in the Treatment of Stable Coronary Disease? Braz J Cardiovasc Surg 2018; 3: 3-5. doi:10.21470/1678-9741-2017-0243 DOI
- Neumann F, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J ; 40: 87-165. doi:10.1093/eurheartj/ehy394 DOI
- Kureshi F, Jones P, Buchanan D,, Abdallah M, Spertus S. Variation in patients’ perceptions of elective percutaneous coronary intervention in stable coronary artery disease: cross sectional studyBMJ 2014;349:g5309. www.bmj.com
- Goff S, Mazor K, Ting H, Kleppel R, Rothberg M. How Cardiologists Present the Benefits of Percutaneous Coronary Interventions to Patients With Stable Angina A Qualitative Analysis JAMA Intern Med. 2014 Oct; 174(10):1614-21. www.ncbi.nlm.nih.gov
- Rothberg M, Scherer L, Kashef M et al. The Effect of Information Presentation on Beliefs About the Benefits of Elective Percutaneous Coronary Intervention JAMA Intern Med 2014 Oct;174(10):1623-9. www.ncbi.nlm.nih.gov
- Weintraub WS, Grau-Sepulveda MV, Weiss JM, et al. Comparative effectiveness of revascularization strategies. N Engl J Med 2012; : doi:10.1056/NEJMoa1110717. DOI
- Hlatky MA, Boothroyd DB, Bravata DM, et al. Coronary artery bypass surgery compared with percutaneous coronary interventions for multivessel disease: a collaborative analysis of individual patient data from ten randomised trials. Lancet 2009; 373: 1190-7. PubMed
- Sipahi I, Akay MH, Dagdelen S, et al. Coronary artery bypass grafting vs percutaneous coronary intervention and long-term mortality and morbidity in multivessel disease. Metaanalysis of randomized clinical trials of the arterial grafting and stenting era. JAMA 2013. doi:10.1001/jamainternmed.2013.12844 DOI
- Whooley MA, de Jonge P, Vittinghoff E et al. Depressive symptoms, health behaviors, and risk of cardiovascular events in patients with coronary heart disease. JAMA 2008; 300: 2379-88. PubMed
- Deutsche Gesellschaft für Kardiologie. ESC Pocket Guidelines. Management der stabilen koronaren Herzkrankheit (KHK), Version 2013. leitlinien.dgk.org
- Der Hausarzt digital. Neues DMP KHK. www.hausarzt.digital
- Gemeinsamer Bundesausschuss. DMP für Patienten mit koronarer Herzkrankheit aktualisiert, 22.11.19. Zugriff 18.03.21. www.g-ba.de
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i.Br.
- Günther Egidi, Dr. med., Facharzt für Allgemeinmedizin, Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).