Allgemeine Informationen
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-5
Definition
- Das Bronchialkarzinom ist der mit Abstand häufigste von der Lunge ausgehende maligne Tumor.
- Durch den Einfluss der internationalen Nomenklatur wird auch in Deutschland der Begriff „Lungenkarzinom“ (engl. Lung Cancer) immer gebräuchlicher.
1-3 - Histologisch unterscheidet man zwischen 4 großen Gruppen:
- Plattenepithelkarzinom (30–40
- Adenokarzinom (25–30
- großzelliges Karzinom (<
- kleinzelliges Karzinom (15–20
4
- Plattenepithelkarzinom (30–40
- Das kleinzellige Bronchialkarzinom ist eine besonders aggressive Art von Lungenkrebs mit Tendenz zu früher Streuung.
5
TNM-Klassifikation
- Der gesamte Abschnitt basiert auf diesen Referenzen.1,
64-75 - T (Tumor)
- Tis: Carcinoma in situ
- T1: größter Durchmesser <
- T1a(mi): minimal invasives Adenokarzinom (Adenokarzinom mit lepidischem Wachstumsmuster <
- T1a: größter Durchmesser <
- T1b: größter Durchmesser >
- T1c: größter Durchmesser >
- T2: größter Durchmesser >
- Infiltration des Hauptbronchus unabhängig vom Abstand von der Carina, aber ohne direkte Invasion der Carina – oder –
- Infiltration der viszeralen Pleura – oder –
- tumorbedingte partielle Atelektase oder obstruktive Pneumonie, die bis in den Hilus reichen, Teile der Lunge oder die gesamte Lunge umfassen
- T2a: größter Durchmesser >
- T2b: größter Durchmesser >
- T3: größter Durchmesser >
- Infiltration von Thoraxwand (inklusive parietale Pleura und Superior Sulcus), N. phrenicus oder parietales Perikard – oder –
- zusätzlicher Tumorknoten im selben Lungenlappen wie der Primärtumor
- T4: größter
DuchmesserDurchmesser >- mit direkter Infiltration von Diaphragma, Mediastinum, Herz, großen Gefäßen, Trachea, N. laryngeus recurrens, Ösophagus, Wirbelkörper oder Carina – oder –
- zusätzlicher Tumorknoten in einem anderen ipsilateralen Lungenlappen
- N (Lymphknoten)
- N0: keine Lymphknotenmetastase(n)
- N1: Metastase(n) in ipsilateralen, peribronchialen und/oder ipsilateralen hilären Lymphknoten und/oder intrapulmonalen Lymphknoten oder direkte Invasion dieser Lymphknoten
- N2: Metastase(n) in ipsilateralen mediastinalen und/oder subkarinalen Lymphknoten
- N3: Metastase(n) in kontralateralen mediastinalen, kontralateralen hilären, ipsi- oder kontralateral tief zervikalen, supraklavikulären Lymphknoten
- M (Metastase)
- M0: keine Fernmetastase(n)
- M1: Fernmetastase(n)
- M1a:
- separate(r) Tumorknoten in einem kontralateralen Lungenlappen – oder –
- Pleura mit knotigem Befall – oder –
- maligner Pleuraerguss – oder –
- maligner Perikarderguss
- M1b: solitäre Fernmetastase(n) in einem solitären extrathorakalen Organ
- M1c: mehrere Fernmetastasen in einem oder mehreren Organen
Stadieneinteilung
- Stadium 0: Tis N0 M0
- Stadium IA1:
- T1a (mi) N0 M0 – oder –
- T1a N0 M0
- Stadium IA2: T1b N0 M0
- Stadium IA3: T1c N0 M0
- Stadium IB: T2a N0 M0
- Stadium IIA: T2b N0 M0
- Stadium IIB:
-
- T1a-c N1 M0 – oder –
- T2a,b N1 M0 – oder –
- T3 N0 M0
- Stadium IIIA:
- T1a-c N2 M0 – oder –
- T2a,b N2 M0 – oder –
- T3 N1 M0 – oder –
- T4 N0 M0 – oder –
- T4 N1 M0
- Stadium IIIB:
- T1a-c N3 M0 – oder –
- T2a,b N3 M0 – oder –
- T3 N2 M0 – oder –
- T4 N2 M0
- Stadium IIIC:
- T3 N3 M0
- T4 N3 M0
- Stadium IVA: jedes T, jedes N, M1a oder M1b
- Stadium IVB: jedes T, jedes N, M1c
Häufigkeit
Der gesamte Abschnitt basiert auf diesen Referenzen.4,8-10- In Deutschland ist das Bronchialkarzinom bei Männern die häufigste und bei Frauen die dritthäufigste Ursache krebsbedingter Todesfälle.
- Die Inzidenz beträgt bei Männern 65 und bei Frauen 21/100.000/Jahr.
- Der
AltergipfelAltersgipfel liegt bei 75–80 Jahren. - Parallel zum Zigarettenkonsum ist die Inzidenz bei Frauen seit einigen Jahrzehnten angestiegen. Bei Männern stagniert sie oder ist leicht rückläufig.
Ätiologie und Pathogenese
- Zigarettenrauchen
- Ist bei Männern und Frauen der wichtigste bekannte Risikofaktor für die Entstehung von Lungenkrebs.
- 80–90
- Zigaretten mit geringerem Teergehalt reduzieren
offenbardas Lungenkrebsrisiko nicht.11
- Andere Formen des Rauchens
Auch siesind mit ebenfalls mit einem erhöhtemhten Risiko für Lungenkrebs und andere Krebsarten verbunden (z.12und Zigarrenrauchen); das Zigarettenrauchen stellt jedoch das höchste Risiko dar.
- Umwelteinflüsse und berufliche Expositionen, die das Risiko erhöhen können:
9,13- Feinstaub, etwa in Dieselmotorabgasen
14 - Eine erhöhte Radonbelastung in Gebäuden kann zu einer lokalen Häufung von Lungenkrebsfällen führen. Laut einer Studie in Großbritannien gingen 3,3
- ionisierende Strahlung
- Asbest
- Schwermetalle wie Chromate, Arsen und Nickel
- polyzyklische Kohlenwasserstoffe, etwa in Ruß und Teer
.
- Feinstaub, etwa in Dieselmotorabgasen
Histologische Einteilung4
- Der histologische Typ ist für die Therapieplanung und Prognose relevant. Dabei werden kleinzellige und nicht-kleinzellige Karzinome unterschieden:
- kleinzelliges Karzinom
- nicht-kleinzelliges Karzinom
- Adenokarzinom
- Plattenepithelkarzinom
- großzelliges Karzinom
.
- Kleinzelliges Bronchialkarzinom
- 15–20
- in der Regel schnell wachsend
- bei Nichtraucher*innen selten
2 - meist in den zentralen Atemwegen (Hauptbronchus und Trachea) lokalisiert mit früher lokoregionärer Ausbreitung ins Mediastinum
- oft frühe extrathorakale Metastasierung
- häufig paraneoplastisches Syndrom
- Auch wenn der Tumor gut auf Chemotherapie anspricht, ist ein kleinzelliges Bronchialkarzinom zum Zeitpunkt der Diagnose oft bereits fortgeschritten und die Prognose ungünstig.
15
- 15–20
- Adenokarzinom
- 25–30
- histologisch heterogen
- meist periphere Lungenanteile betroffen
- frühe Metastasierung
- häufig mit Vorerkrankung der Lunge
16
- 25–30
- Plattenepithelkarzinom
- 30–40
- meist endobronchial in den zentralen Atemwegen lokalisiert
- oft mit Hämoptyse, postobstruktiver Pneumonie oder lobärem Kollaps
- metastasiert meist erst spät im Krankheitsverlauf
17
- 30–40
- Großzelliges Karzinom
- weniger als 10
- schlecht differenziert
- große periphere Tumoren
- frühe Metastasierung
16
- weniger als 10
Prädisponierende Faktoren
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Zigarettenrauchen
18-19- 9 von 10 Frauen und 8 von 10 Männern mit Lungenkrebs waren in der Vergangenheit Zigarettenraucher*innen.
- Etwa 10
- Epidemiologischen Studien zufolge geht auch Passivrauchen mit einem erhöhten Risiko für Lungenkrebs
einherzueinher.20-21
- Berufliche Exposition
- Asbest ist der häufigste berufliche Risikofaktor. Eine asbestexponierte Person hat ein 6-mal so hohes Risiko für Lungenkrebs wie eine nichtexponierte.
2223 - Exposition gegenüber Staub, Gasen, Chemikalien etc. (z.
24
- Asbest ist der häufigste berufliche Risikofaktor. Eine asbestexponierte Person hat ein 6-mal so hohes Risiko für Lungenkrebs wie eine nichtexponierte.
- Radonbelastung in Gebäuden
25 - Feinstaub aus Dieselmotorabgasen geht von allen Luftschadstoffen mit dem höchsten Lungenkrebsrisiko einher.
14 - Chronische obstruktive Lungenerkrankung, idiopathische Lungenfibrose, Tuberkulose
- Infektionen mit bestimmten Viren gehen mit einem erhöhten Lungenkrebsrisiko einher.
- Für das humane Papilloma Virus (HPV) ist dieser Zusammenhang in Asien und Afrika besonders ausgeprägt, scheint aber auch in Europa eine Rolle zu spielen.
26-27 - Infektionen mit dem Eppstein-Barr-Virus (EBV) sind mit einem erhöhten Risiko für großzellige lymphoepitheliale Karzinome assoziiert.
28 - Bei HIV-Infizierten steht das erhöhte Lungenkrebsrisiko vermutlich mit dem besonders hohen Anteil von Raucher*innen in Zusammenhang.
29
- Für das humane Papilloma Virus (HPV) ist dieser Zusammenhang in Asien und Afrika besonders ausgeprägt, scheint aber auch in Europa eine Rolle zu spielen.
- Genetische Faktoren scheinen eine gewisse Rolle zu spielen, sind aber noch unzureichend erforscht. Bei
RauchernRaucher*innen dominieren andere genetische Subtypen von Bronchialkarzinomen als beiNichtrauchernNichtraucher*innen.30
ICPC-2
- R84 Bösartige Neubildung Lunge / Bronchus
ICD-10
- C34 Bösartige Neubildung der Bronchien und der Lunge6
- C34.0 Hauptbronchus
- C34.1 Oberlappen (-Bronchus)
- C34.2 Mittellappen (-Bronchus)
- C34.3 Unterlappen (-Bronchus)
- C34.8 Bronchus und Lunge, mehrere Teilbereiche überlappend
- C34.9 Bronchus oder Lunge, nicht näher bezeichnet
Diagnostik
Leitlinie: Früherkennung des Lungenkarzinoms1
Jährliche CT bei erhöhtem Risiko
BeiDefinitionasymptomatischenRisikoperson- Alter
Risikopersonen50–75 Jahre – und – - ≥15 Zigaretten/d für
einmindestensLungenkarzinom30sollJahreeine Früherkennung mittels Thoraxübersichtsaufnahmen allein– oderin Kombination mit zytologischen Sputumuntersuchungennichterfolgen (Ia/A).– Asymptomatischen≥10RisikopersonenZigaretten/d füreinmindestensLungenkarzinom20im Alter zwischen 55Jahreund 74 Jahren– undeiner–Raucheranamnese≤10-jährige Nikotinkarenz
- Alter
- Asymptomatische Risikopersonen (s. o.) profitieren von
≥einem30 Packungsjahren und weniger als 15 Jahren Nikotinkarenzkanneine jährlichestrukturierten Lungenkarzinom-Früherkennungherkennungsprogramm mittels jährlicher Low-Dose-CTunter den u. g. Rahmenbedingungen angeboten werden (Ia/C). Bei asymptomatischen Risikopersonen für ein Lungenkarzinom im Alter ≥ 50 Jahren und einer Raucheranamnese von ≥ 20 Packungsjahren und einem der folgenden zusätzlichen Risikofaktoren kann eine jährliche Lungenkarzinom-Früherkennung mittels Low-Dose-CT unter den u. g. Rahmenbedingungen angeboten werdenUntersuchungen.Risikofaktoren: ZDie genauen Rahmenbedingungen sind noch durch das Bundesumweltministerium, den Gemeinsamen Bundesausschuss und evtl.nweitere Fachkreise festzulegen. MitLungenkarzinom,derpositivekonkretenFamilienanamneseUmsetzungfeines entsprechenden FrürherkennungsprogrammseinistLungenkarzinom, Zfrühestens im Lauf des Jahres 2024 zu rechnen (Stand April 2023).n. HNO-Malignom oder anderer Rauchen-assoziierter Malignome, Z. n. Lymphom-Erkrankung, Asbestexposition,COPD,LungenfibroseRahmenbedingungen
Nicht Low-Dose-CT: Eineinfrage jährlichekommende Lungenkarzinom-Früherkennung mittels Low-Dose-CT sollte mindestens für 2 Jahre und unter folgenden Rahmenbedingungen erfolgen (Ia/B):Verfahren
multidisziplinäres Behandlungsteam mindestens unter Beteiligung von Fachärzten für Radiologie, Pneumologie, Thoraxchirurgie, Onkologie, und Radiotherapie, idealerweise in einem zertifizierten Lungenkrebszentrum (DKG)begleitendeRaucherentwöhnungfortlaufende Dokumentation und Befundvergleichinnerhalb eines qualitätsgesicherten Früherkennungsprogramms.
- Thoraxübersichtsaufnahmen – und/oder –
- Sputum-Zytologie – und/oder –
- Bronchoskopie – und/oder –
- Biomarkern, z. B.:
- klassische Tumormarker
- Liquid
im Serum.Biopsies - Atemgas-Exhalat-Analysen
Diagnostisches Vorgehen
- Der Röntgenbefund kann einen starken diagnostischen Verdacht begründen.
- Thorakale Raumforderungen werden nicht selten als Zufallsbefund im konventionellen Röntgen oder CT von Thorax oder Abdomen festgestellt.
- Diagnosesicherung und Bestimmung des Karzinomtyps erfolgen in der Histologie, ggf. flankiert von molekularpathologischen Untersuchungen.
- Weitere Untersuchungen sind notwendig, um das Stadium der Krebserkrankung (TNM-Klassifikation) zu ermitteln und evtl. Begleiterkrankungen zu erkennen.
Differenzialdiagnosen
- Tuberkulose
- Sarkoidose
- Pneumonie
- Andere von Lunge oder Pleura ausgehende Tumoren
:
- Karzinoide
- Mesotheliome
- Sarkome
- Blastome
.
- Lungenmetastasen einer anderen Tumorerkrankung
Anamnese
- Vielraucher*in
- Berufliche Belastung mit Asbest, Schwermetallen, polyzyklischen Kohlenwasserstoffen, ionisierender Strahlung, Dieselabgasen (z.
- Wohnung in einer stark radonbelasteten Region?
- Andere prädisponierende Faktoren?
- Frühe Symptome
- Atemwegsymptome über 6 Wochen?
- Husten (65
- Hämoptyse (35
- wiederholte Atemwegsinfektionen mit Bronchitiden
- Oft erst später:
- Thoraxschmerzen (50
- Schweratmigkeit (60
- Heiserkeit
- Pneumonie
- Müdigkeit
.
- Thoraxschmerzen (50
- Gewichtsverlust
31
Klinische Untersuchung
- Klinische Befunde variieren oder können ganz fehlen.
- Zentrale Tumoren können zu Atelektasen und poststenotischer Pneumonie mit Atemnebengeräuschen führen.
- Periphere Tumoren ergeben in der Regel keine klinischen Befunde.
- Invasion in die Pleura führt zum Pleuraerguss.
- Bei ca. 20
- Lymphadenopathie (Hals/Fossa supraclavicularis)
- Hepatomegalie
- obere Einflussstauung mit Stokeskragen
- Trommelschlegelfinger
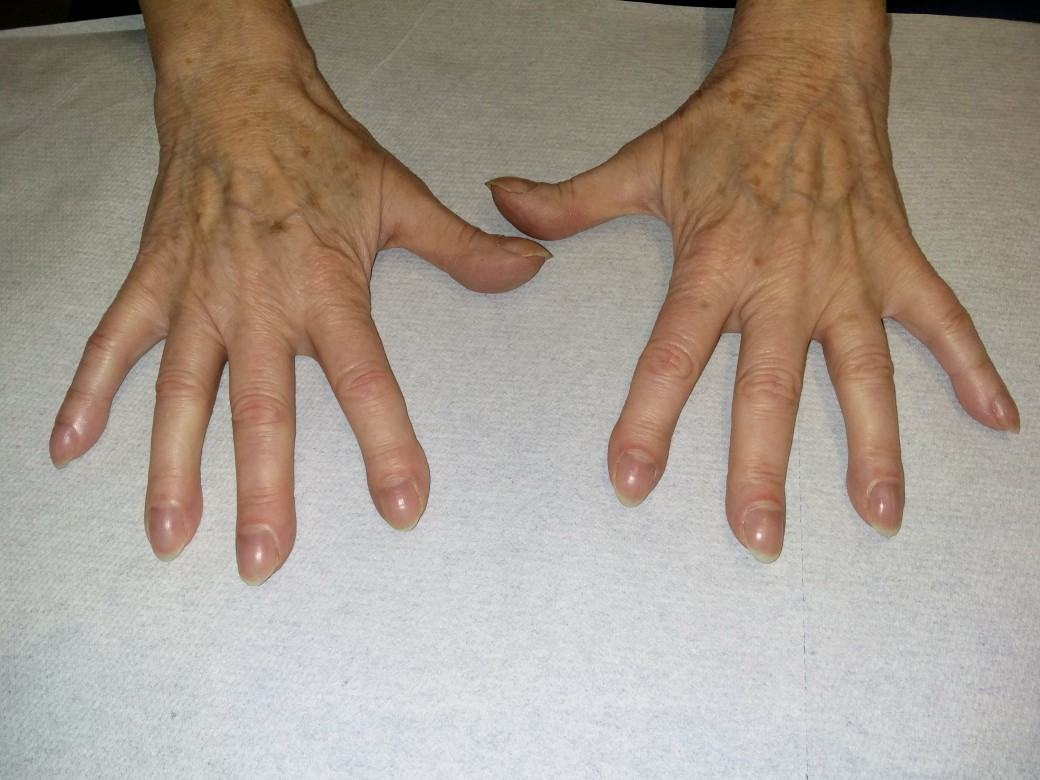 Trommelschlegelfinger
Trommelschlegelfinger
- Hirnmetastasen können erste Manifestation sein und sich durch folgende Symptome äußern:
32-337- Kopfschmerzen
- Übelkeit und Erbrechen
- Hemiparese
- Gesichtsfeldausfälle
- andere fokale neurologische Ausfälle
- epileptische Anfälle
- Verwirrtheit
- Persönlichkeitsveränderungen
- Bewusstseinstrübungen
.
- Selten (<
- Horner-Syndrom infolge eines von der Lungenspitze ausgehenden Pancoast-Tumors
undAtembehinderung infolge einer Parese des N. laryngeus recurrens- Hautmetastasen
Symptome und Anzeichen intrathorakaler Tumorausbreitung
- 40
- Heiserkeit als Folge einer Affektion des Nervus laryngeus recurrens
31 - Lähmung des Zwerchfells aufgrund einer Affektion des Nervus phrenicus
- Atembeschwerden
- Zwerchfellhochstand links (Röntgen-Thorax)
- Lungenspitzen-Karzinom (Pancoast-Tumor) mit Affektion von Sympathikusganglien und Plexus brachialis
- Horner-Syndrom
- neuropathischer Schulter-Arm-Schmerz
- Sensibilitätsstörungen, Paresen und Muskelatrophien an Unterarm und Hand
34
- Anhaltende pleuritische Schmerzen durch Tumorinvasion in die Brustwand
- Pleuraerguss
- behinderte Atmung
- Auskultation: abgeschwächtes Atemgeräusch
- Klopfschall-Dämpfung
35
- Schluckstörungen durch Tumorinvasion oder -kompression der Speiseröhre
- Obstruktion der Vena cava superior
36- venöse Stauung an Hals und Oberkörper einschließlich Schultern und Armen
- Gesichtsschwellung
- Plethora
- Perikardiale Tumorinvasionen sind Autopsien zufolge häufig, treten aber nur selten klinisch in Erscheinung, als Perikarderguss oder -tamponade.
37
Symptome und Anzeichen extrathorakaler Tumorausbreitung
- Fast 1/3 aller Patient*innen mit Lungenkrebs zeigen Symptome und Anzeichen von extrathorakaler Tumorausbreitung.
31 - Typische metastatische Lokalisationen
- Knochen
- Leber
- Nebennieren
- Lymphknoten
- Gehirn
- Rückenmark
- Unspezifische Symptome
- Schwäche/Fatigue
- Gewichtsverlust
- Knochenmetastasen (meist in langen Röhrenknochen oder Rückenwirbeln)
- Schmerzen
- Frakturen
- Palpable Lymphknoten und insbesondere supraklavikuläre Lymphadenopathie deuten auf Metastasen hin.
- Bei 10
337 Folgende Symptome können darauf hindeuten:- Kopfschmerzen
- Übelkeit und Erbrechen
- Hemiparese
- Gesichtsfeldausfälle
- andere fokale neurologische Ausfälle
- epileptische Anfälle
- Verwirrtheit, Persönlichkeitsveränderungen, Bewusstseinstrübungen.
32-337
- Trotz häufiger Leberbeteiligung: Transaminasenanstieg eher selten
Paraneoplastische Syndrome
- Extrapulmonale Dysfunktion von Organen ohne direkten Bezug zu Primärtumor oder Metastasen
- Freisetzung bioaktiver Stoffe oder Autoantikörper, die vom Tumor selbst oder als Reaktion auf den Tumor gebildet werden.
38 - Ca. 10
15 - Erstes Auftreten vor, gleichzeitig mit oder nach dem Zeitpunkt der Diagnose
- Je nach betroffenem Organsystem verschiedene Arten von Syndromen:3
- endokrin
- metabolisch
- autoimmun (z.
- neuromuskulär (z.
- ossär
- kardiovaskulär
- hämatologisch
- kutan (z.
- renal
.
- Die Behandlung dieser assoziierten Syndrome hat häufig einen entscheidenden Einfluss auf das Befinden der Patient*innen.
Ergänzende Untersuchungen in der Hausarztpraxis
- Der gesamte Abschnitt basiert auf diesen Referenzen.2-3
- Blutbild, Differenzialblutbild
- Elektrolyte (Na, K, und ggf. Ca und P)
- Nierenparameter (Kreatinin, Harnstoff)
- Leberparameter (GOT, GPT, Gamma-GT, AP, Bilirubin)
- LDH
- Gerinnung (Quick/INR, PTT)
- Harnsäure
- Evtl. Tumormarker
- Neuronenspezifische Enolase (NSE) kann bei einem kleinzelligen Bronchialkarzinom erhöht sein.
- CEA kann bei einem Adenokarzinom erhöht sein.
Diagnostik bei Spezialist*innen
Röntgen-Thorax
- Konventionelle Röntgenaufnahmen des Thorax sind wenig sensitiv und spezifisch bei der Detektion eines Bronchialkarzinoms.
- Kann im frühen Stadium unauffällig sein – insbesondere bei zentral gelegenen Tumoren.
CT mit Kontrastmittel – Thorax und Oberbauch
beiBei der Erkennung früher Stadien höhere Sensitivität als konventionelles Röntgen
MRT mit Kontrastmittel
:- Bei
nurspeziellen Fragestellungen,wennz. B.CTVerdachtnichtaufdurchführbar3solitäre Lebermetastasen, Hirn- oder Knochenmetastasen (kranielle MRT)
Screening?FrüherkennungsprogrammScreening auf Lungenkrebs bei einer Hochrisikopopulation wird in vielen Ländern diskutiert.- Niedrig dosierte Spiral-CT
BesondersVorteil:die Anwendung der niedrig dosierten Spiral-Computertomografie als Screening-Werkzeug hat vielversprechende Ergebnisse erbracht.Der Vorteil der Methode liegt darin, dass sich auchAuch kleine periphere Tumore können vor der Metastasierungdiagnostizierenerkanntlassenwerden.- Nachteil
ist die: hohe Strahlenbelastungdurch die CT-Untersuchung. Pro 1.000–2.000 CT-Untersuchungen ist mit einem zusätzlichen, strahlungbedingten Lungentumor zu rechnen.39
NiedrigImplementierungdosiertein Deutschland- Nach Einschätzung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) überwiegt der Nutzen des Low-Dose-CT-Screenings
vonbeiHochrisikogegenwärtigen oder ehemaligen starken Raucher*innen den potenziellen strahlenbedingten Schaden.8 - Die Rahmenbedingungen für ein nationales Lungenkarzinom-
GruppenFrüherkennungsprogramm werdenempfohlenderzeit durch den gemeinsamen Bundesausschuss (G-BA) in Absprache mit dem Bundesamt für Strahlenschutz (BfS) und den einschlägigen medizinischen Fachgesellschaften erarbeitet (Stand April 2023).
- Nach Einschätzung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) überwiegt der Nutzen des Low-Dose-CT-Screenings
- Näheres siehe
Leitlinieauch Leitlinienkasten Früherkennung desBronchialkarzinomsLungenkarzinoms).1,40 Cochrane Collaboration41Kam 2013 in einer Metaanalyse zu dem Ergebnis, dass die bisher verfügbaren Forschungsergebnisse nicht ausreichen, um das Screening in Form von konventionellen Röntgenaufnahmen oder Sputumzytologie zu empfehlen.
Untersuchungen im Krankenhaus
- Labor
- Hb
- Differenzialblutbild
- Entzündungsparameter (BSG, CRP)
- LDH
- Kreatinin
- Elektrolyte (Na, K, und ggf. Ca und P)
- Kalzium
- Albumin
- GPT (ALAT)
- Gamma-GT
- AP
- Bilirubin
- NSE
- ProGRP
- bei Bestätigung der
Lungenkrebs-DiagnoseLungenkrebsdiagnose ggf. weitere Tumormarker und spezifische Parameter zur Diagnostik paraneoplastischer Syndrome
- Spirometrie
- Ist obligatorisch für alle Patient*innen, die wegen der Diagnose Bronchialkarzinom operiert werden sollen.
- Klinische Zeichen für paraneoplastische Syndrome, z.
- Syndrom der inadäquaten ADH-Sekretion (SIADH, Schwartz-Bartter-Syndrom)
- erhöhte ACTH-Produktion
- Hyperkalzämie
- verschiedene neurologische Manifestationen
- Hautläsionen
.
- Die Fitness/das Funktionsniveau der Patient*innen ist entscheidend für die Therapieplanung.
Bildgebung
3,42- Röntgen-Thorax mit Schnittbildern (falls verfügbar)
42- häufige Befunde beim Bronchialkarzinom
- periphere Verdichtung oder Rundschatten
- Atelektasen
- vergrößerter Hilus
- verbreitertes Mediastinum
- Pleuraerguss
- bei zentralen Tumoren oft keine Auffälligkeiten
- Bei weiter bestehendem
klinischenklinischem Verdacht sollte auch bei unauffälligem Röntgen-Thorax eine CT von Thorax und oberem Abdomen durchgeführt werden.
- häufige Befunde beim Bronchialkarzinom
- CT mit Kontrastmittel
3– Thorax und oberes Abdomen- Beurteilung von Lungenparenchym, Mediastinum und Pleura
- bei vergrößerten Lymphknoten (kurzer Durchmesser >
- im oberen Abdomen: Beurteilung von Leber und Nebennieren
- notwendig für Staging und Behandlungsplanung
- MRT mit Kontrastmittel – Thorax und Abdomen
3
- Nur wenn CT nicht durchführbar ist, etwa wenn die Patient*innen die Zustimmung verweigern.
- Die MRT des Thorax ist als Routineuntersuchung zur Stadienbestimmung beim Bronchialkarzinom nicht zu empfehlen, hat jedoch einen gewissen Wert bei der topografischen Abgrenzung einer möglichen Affektion des Plexus brachialis oder der Wirbelsäule oder bei Verdacht auf Tumorinvasion in das Mediastinum.
- Schädel-MRT (evtl. CT)
- MRT: Mittel der 1. Wahl zur Diagnostik von Hirnmetastasen
- CT: nur wenn MRT nicht durchführbar
3
- PET-CT (Positronen-Emissions-Tomografie plus CT)
- In der PET signalgebend ist die gesteigerte Glukoseaufnahme der Krebszellen.
- Ist bei kurativem Therapieansatz für die Ausbreitungsdiagnostik vorteilhaft, vorausgesetzt dass es dadurch nicht zu erheblichen Therapieverzögerungen kommt.
- Erlaubt frühe und genaue Diagnosen und damit längeres Überleben.
43 - Ein Nutzwert für die Verlaufsdiagnostik ist nicht belegt.
- Evtl. Skelettszintigrafie
- bei Skelettschmerzen, erhöhtem AP-Wert oder Hyperkalzämie
- Evtl. Oberbauchsonografie
Pathologische Anatomie
- In 40–60 % aller Fälle sichert die Zytologie des Sputums die Diagnose.
- Bei ungefähr der Hälfte der Tumorpatient*innen mit Pleuraexsudat verifiziert die Zytologie des Pleurapunktats die Diagnose.
- Histologische Klassifikation
- Adenokarzinom
- Plattenepithelkarzinom
- großzelliges Karzinom
- adenosquamöses Karzinom
- kleinzelliges Karzinom
- Karzinoidtumor
- Karzinome vom Speicheldrüsentyp
- sarkomatoides Karzinom
- Mesotheliom
- Metastasen einer anderen Entität
- Molekulare Diagnostik
- Mittlerweile sind eine Reihe genetischer Faktoren bekannt, die im Tumorgewebe bestimmt werden können und hinsichtlich der Prognose und des Ansprechens auf molekular zielgerichtete Therapien von großer Bedeutung sind.
- Dazu zählen u. a.:
- EGFR-Mutationen
- BRAF V600-Mutationen
- KRAS-Mutationen
- ALK-Fusionen
- ROS1-Fusionen
- RET-Fusionen
- NTRK1–3-Fusionen
- PDL-1-Expression
Invasive Diagnostik
- Fiberbronchoskopie
- Ermöglicht die Diagnosesicherung bei 60–90 % der zentralen, aber nur bei ca. 10 % der peripheren Tumoren.
- angezeigt bei bildgebendem Verdacht und zugänglichem Tumor
3 - Bei allen Patient*innen mit peripherem Lungeninfiltrat, um
- einen Tumor der Bronchialschleimhaut auszuschließen.
- eine Bronchiallavage und eine Bürstenbiopsie im relevanten Segment vorzunehmen.
- eine Stadieneinteilung mithilfe von transbronchialer Nadelaspirationsbiopsie aus den regionalen Lymphknoten zu ermöglichen.
- Die Untersuchung erfolgt unter örtlicher Betäubung, ggf. ambulant.
- Perkutane Lungenbiopsie
- Die transthorakale Nadelaspirationsbiopsie wird bei peripher liegenden Tumoren unter örtlicher Betäubung und Röntgendurchleuchtung angewendet.
44 - Erlaubt die Diagnosesicherung in 60
-–80 % der Fälle. - 10
- bei unspezifischem
benignenbenignem Befund: Thorakoskopie oder Minithorakotomie - häufige Komplikation (25–30 %): Pneumothorax
45
- Die transthorakale Nadelaspirationsbiopsie wird bei peripher liegenden Tumoren unter örtlicher Betäubung und Röntgendurchleuchtung angewendet.
- Pleurapunktion bei Pleuraerguss
- Das Punktat wird zytologisch untersucht.
- Ein maligner Pleuraerguss tritt meist erst in fortgeschrittenen Krankheitsstadien auf
3und schließt chirurgische Eingriffe und Strahlenbehandlungen mit kurativer Intention in der Regel aus. - Ist die Zytologie nicht eindeutig, können Thorakoskopie oder Pleurabiopsie erforderlich werden.
- Pleurabiopsie
- Erfolgt unter Röntgendurchleuchtung und örtlicher Betäubung.
- Thorakoskopie
- Erfolgt entweder unter Regional- oder Allgemeinanästhesie.
- Die Pleuradrainage kann bei Malignität zur Pleurodese verwendet werden.
- Mediastinoskopie
- zur histologischen N-Klassifikation der Lymphknoten im vorderen Mediastinum
- unter Vollnarkose
- Ultraschallgeführt werden via Ösophagus aus den Lymphknoten im Mediastinum Biopsien entnommen.
- Zugang entweder suprasternal oder links parasternal
- Kann angewendet werden, wenn die vergrößerten Lymphknoten für andere Methoden der Biopsiegewinnung nicht erreichbar sind, weil sie z.
- Andere Methoden zur Biopsiegewinnung
- Können zur Diagnostik von Fernmetastase notwendig werden, z.
- Eine Bildgebung des oberen Abdomens zum Metastasenscreening und Knochenmarkuntersuchungen sind deshalb Standardverfahren bei der Stadieneinteilung von kleinzelligen Karzinomen.
- Können zur Diagnostik von Fernmetastase notwendig werden, z.
Probenahme für eine morphologische Diagnostik
Präoperative Untersuchung der Lungenfunktion
- Bedeutsame postoperative Komplikationen betreffen meist die Atemfunktion.
- Wichtigste präoperative Untersuchung: Spirometrie
- Wenn das forcierte exspiratorische Volumen (FEV1) und die Diffusionskapazität bei über 60 % des zu erwartenden Normalwerts liegen, kann eine Pneumonektomie durchgeführt werden.
- Wenn die Werte unter 60 % liegen, wird eine selektive Lungenfunktionsuntersuchung mit Perfusionsszintigrafie durchgeführt.
- Die Messung der maximalen Sauerstoffaufnahme unter Belastung ist ebenfalls aussagekräftig.
Indikationen zur Überweisung
- Bei Verdacht auf Bronchialkarzinom oder eine andere Tumorerkrankung
Therapie
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-3
Therapieziele
- Palliation
- Heilung bei ca. 10 % der Patient*innen
Allgemeines zur Therapie
- Chirurgische Resektion, Strahlenbehandlung und Chemotherapie – entweder einzeln oder in Kombination – sind mögliche Behandlungen beim Bronchialkarzinom.
- Entscheidend für die Art und Abfolge der Therapien:
- Ausbreitungsgrad der Krankheit (Stadium)
- Tumorbiologie einschließlich histologischer und molekularer Eigenschaften
3 - Allgemeinzustand der Patient*innen
- Komorbidität
.
- Etwa 25 % aller Patient*innen sind operabel.
- Chemotherapie und Strahlentherapie sind meist begrenzt wirksam.
Kleinzelliges Bronchialkarzinom (SCLC)1-2,7
- Ein kleinzelliges Bronchialkarzinom (SCLC) hat zum Diagnosezeitpunkt häufiger bereits metastasiert als andere Bronchialkarzinom-Typen. Zum Diagnosezeitpunkt haben ungefähr 35 % eine auf den initialen Hemithorax begrenzte Erkrankung (Limited Disease) und 65 % eine darüber
hinausgehendehinaus gehende Erkrankung (Extensive Disease). Das SCLC wird immer – unabhängig vom Stadium der Erkrankung bei der Diagnose – als systemische Erkrankung betrachtet. - Strahlenbehandlung und Zytostatika zeigen in der Regel einen Effekt.
- Neben folgenden stadienorientierten Empfehlungen sind weitere Faktoren für die Therapieentscheidung maßgeblich, u. a. Alter, Fitness und Präferenzen der erkrankten Person:
Patient*innenStadiummitI-IIA- Resektion
begrenzterdesErkrankungPrimärtumorswerden(wennmitOP nicht infrage kommt, Vorgehen wie in Stadium IIB–III) - 4 Zyklen Cisplatin/Etoposid
- ggf. gefolgt von einer prophylaktischen Schädelbestrahlung
- Resektion
- Stadium IIB–III
- simultane Radiochemotherapie
- gefolgt von einer prophylaktischen Schädelbestrahlung
- Stadium IV
- Zytostatika + Immuncheckpoint-Inhibition: 4–6 Zyklen
PlatinCarboplatin/Etoposidbehandelt,in der Regelin Kombination miteinereinemBestrahlungPD-L1-Antikörpervon(AtezolizumabLungeoderundDurvalumab) - Danach
Mediastinum.Erhaltungstherapie mit PD-L1-Antikörper - Bei
ausgedehnterHirnmetastasenErkrankung wird primärggf. nur Chemotherapiedurchgeführt, während Strahlenbehandlung gegen symptomatische Manifestationen später im Verlauf erwogen werden kann.z. B. lokal in Thorax, GehirnundSkelett
Die Kombination von Chemotherapie und Strahlenbehandlung ist bei Erkrankungen im Stadium III Standard.Chirurgische Resektion nach einleitender Strahlenbehandlung führt offenbar nicht zu besseren Ergebnissen als Standardbehandlungen ohne Operation.46Schädelbestrahlung
- Zytostatika + Immuncheckpoint-Inhibition: 4–6 Zyklen
Molekular zielgerichtete Therapien?bislang noch keine Zulassung fürs SCLC (s. u.)
ChirurgieSehr selten (< 5 %) indiziert, weil die Erkrankung zum Diagnosezeitpunkt oft schon disseminiert ist.5Bei kleinen Tumoren ist ein chirurgischer Eingriff zu erwägen.
Eine prophylaktische Ganzhirnbestrahlung vermindert das Risiko für Hirnmetastasen und hat einen begrenzten, aber statistisch signifikanten Effekt auf das Gesamtüberleben. Diese Effekte scheinen bei begrenzter Erkrankung etwas ausgeprägter zu sein als bei extensiver Erkrankung.1,33
Nicht-kleinzelliges Bronchialkarzinom (NSCLC)1,3,7
- Ungefähr 70 % aller Patient*innen mit NSCLC werden in einem Erkrankungsstadium diagnostiziert, in dem eine kurative Behandlung nicht möglich ist – entweder weil bereits Stadium IV erreicht ist (40 %) oder weil – in früheren Stadien – ungünstige prognostische Faktoren vorliegen (30 %).
- Chirurgie
- Eine möglichst vollständige chirurgische Resektion des Tumorgewebes ist die wichtigste kurative Behandlung.
- Allerdings sind nur 25 % der Patient*innen zum Zeitpunkt der Primäruntersuchung operabel.
- Davon kann nur die Hälfte mittels Thorakotomie radikal operiert werden.
- Chemotherapie
- Ist allein meist nicht kurativ.
- Eine postoperative Cisplatin-basierte Behandlung verlängert das Überleben.
47 - Kombinationen von zwei Zytostatika sind der Monotherapie überlegen. Dreifachkombinationen verlängern nicht die Überlebensdauer und führen stattdessen zu erhöhter Toxizität.
- Molekular zielgerichtete Therapien
BeiTyrosinkinase-Inhibitoren- in
genetischStadiendefiniertenIB–IIIASubgruppenbeimitbestimmten EGFR-aktivierenden Mutationen (del 19,ALKL858R): Osimertinib - Weitere ggf. infrage kommende Substanzen siehe unten.
- in
- Immuncheckpoint-
oder ROS1-Translokationen kann die molekular zielgerichtete TherapieBlockade mitKinaseinhibitorenPD1-Inhibitoren- bei
hohePD-L1-ExpressionRemissionsratenaufundTumorzelleneine≥ 50 %VerlängerungindesdenprogressionsfreienStadienÜberlebensIIA–IIIAerreichen,beimitEGFR/ALKdeutlichWildtyp:wenigerAtezolizumab - Weitere
Nebenwirkungenggf.alsinfrageunterkommendeZytostatikaSubstanzen siehe unten.2,48
- bei
- ebenfalls unter bestimmten Umständen indiziert (Näheres s.
:- gegen Wachstumsfaktorrezeptoren gerichtete Antikörper
Immuntherapie mit PD1-Inhibitoren- Angiogenesehemmer
.
- Strahlentherapie
- kurative Intention bei ausgewählten Patient*innen
- palliativer Effekt auf die meisten Lungenkrebs-bedingten Symptome
- Kommt auch bei Patient*innen mit inoperablem Tumor oder Rezidiv nach einer Operation infrage.
- Strahlenbehandlung zusätzlich zur Chemotherapie im primär inoperablen Stadium III verlängert das Überleben im Vergleich zur Strahlenbehandlung allein.
- Die Auswirkungen auf die Lebensqualität sind unklar.
Medikamentöse Therapie
- Eine
Kombinations-ChemotherapieKombinationschemotherapie bei kleinzelligem Karzinom verlängert die Lebenszeit. - Bei nicht-kleinzelligem Bronchialkarzinom kann mit neueren Regimen in 20–30 % der Fälle vorübergehend eine subjektive oder objektive Besserung erreicht werden.
49 - Molekular zielgerichtete Therapien haben mittlerweile einen hohen Stellenwert, besonders bei Nachweis onkogener Mutationen, z.
1
Kleinzelliges Bronchialkarzinom (SCLC)
- Die am häufigsten angewendeten Zytostatikakombinationen
- 1. Wahl: Cisplatin/Etoposid
1 - Anthrazyklinhaltige Regime, etwa mit Doxorubicin oder Epirubicin in Kombination mit Cyclophosphamid/Vincristin oder Etoposid, sind zwar eine mögliche Alternative zur platinhaltigen Kombination, werden jedoch wegen der Kardiotoxizität der Anthrazykline in der Erstlinientherapie deutlich seltener eingesetzt. Eine Strahlentherapie verstärkt die Kardiotoxizität zusätzlich.
2
- 1. Wahl: Cisplatin/Etoposid
- Ein objektives Ansprechen liegt bei 80–95 % der Patient*innen vor.
- Eine perorale Behandlung mit Etoposid kommt zuweilen bei Patient*innen mit ausgedehnter Erkrankung zur Anwendung.
- Immuntherapie (PD-1 Checkpointblockade)
2- In Phase-II-Studien wurden Hinweise auf eine Wirksamkeit von PD-1-Antikörpern bei SCLC gefunden.
- Kontrollierte Studien zu verschiedenen Monotherapien und Kombinationen werden zurzeit durchgeführt.
- Bislang ist noch kein PD-1-Antikörper zur Therapie des SCLC zugelassen.
- Die Anwendung beim SCLC ist bislang nur im Rahmen eines individuellen Therapieversuchs (off label) oder im Rahmen von Studien möglich (Stand Juli 2017).
- Vorläufige positive Ergebnisse gibt es z.
- Pembrolizumab
- Nivolumab
- Kombination aus Nivolumab und dem CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4)-Antikörper Ipilimumab
.
- In Phase-II-Studien wurden Hinweise auf eine Wirksamkeit von PD-1-Antikörpern bei SCLC gefunden.
Weitere molekular zielgerichtete Therapieansätze
2- Rovalpituzumab-Tesirine
- Konjugat aus einem Antikörper gegen Delta-Like-Protein3 (DLL-3) und einem Zytostatikum
- In Phase-II-Studien erreichte etwa 1/3 der Patient*innen unter der Therapie eine Remission, etwa ein weiteres Drittel eine progressionsfreie Stabilisierung der Erkrankung.
- Das Medikament ist derzeit nicht zugelassen und wird in weiteren Studien geprüft.
- Antiangiogenetisch wirkende Substanzen konnten in den bisherigen Studien keinen Vorteil hinsichtlich des Gesamtüberlebens erzielen und sind daher weder in Erst- noch in Zweitlinie indiziert.
- Weitere negative Phase-II-Studien liegen zu mTOR-Inhibitoren, HDAC-Inhibitoren und BCL-2 Antisense-Substanzen vor.
- Rovalpituzumab-Tesirine
Nicht-kleinzelliges Bronchialkarzinom (NSCLC)
- Mit der Erstlinien-Chemotherapie wird bei 20–30 % der Patient*innen eine Remission erreicht.
- Moderate Verlängerung des Gesamtüberlebens
- Eine adjuvante postoperative Chemotherapie kann die Überlebenszeit verlängern, auch dann noch, wenn sie erst spät (7–18 Wochen nach der OP) eingesetzt wird.
509
- Eine adjuvante postoperative Chemotherapie kann die Überlebenszeit verlängern, auch dann noch, wenn sie erst spät (7–18 Wochen nach der OP) eingesetzt wird.
- Systemische Therapien
- Chemotherapie
- Zweifachkombination ist Standard.
- meist Kombinationen mit Cisplatin
47,49 InternationalWeiterewerdeninfrageauchkommende Zytostatika sind u. a. Taxane, Gemcitabin,Topotecan und Vinorelbin angewendet. Der Nutzen dieser Medikamente ist begrenzt und wird diskutiert.DocetaxelPemetrexed oderPemetrexed können in der Zweitlinienbehandlung bei Nicht-Plattenepithelkarzinomen das Gesamtüberleben verlängernVinorelbin.3Pemetrexed kann u. U. auch als Erhaltungstherapie bei nicht-plattenepithelialem Lungenkarzinom im Stadium IV infrage kommen, das auf die Erstlinientherapie angesprochen hat (Ib/B–C).1
- Molekular zielgerichtete Medikamente sind bei ausgewählten Indikationen zugelassen.
3- Crizotinib (Kinaseinhibitor von ROS1, ALK und MET)
- Brigatinib (Kinaseinhibitor von ROS1, ALK,
METIGF-1R und EGFR) - Entrectinib (Kinaseinhibitor von ROS1, ALK, TRKA, TRKB und TRKC)
- Lorlatinib (Kinaseinhibitor von ROS1 und ALK)
- Larotrectinib (Kinaseinhibitor von TRKA, TRKB und TRKC)
- Pralsetinib (Inhibitor der RET-Kinase)
- Selpercatinib (Kinaseinhibitor von RET, VEGFR1 und VEGFR3)
- MET-Kinaseinhibitoren: Capmatinib, Tepotinib
- ALK-
Kinase-InhibitorenKinaseinhibitoren: Ceritinib, Alecitinib - EGFR-Tyrosinkinase-Inhibitoren: Afatinib,
ErlotinibDacomitinib,GefitinibErlotinib, Osimertinib - MEK1/2-Kinaseinhibitor
TramatinibTrametinib + BRAF-Kinaseinhibitor Dabrafenib1 - Immuntherapie mit Anti-PD-1 Antikörper: Nivolumab, Pembrolizumab, Atezolizumab1
- Nintedanib (Polykinaseinhibitor, hemmt unter anderem VEGFR und FGFR
Inhibitor) + Docetaxel - Ramucirumab (VEGFR2-Inhibitor) + Docetaxel
Necitumumab (Anti-EGFR-Antikörper) + Gemcitabin + Cisplatin- Bevacizumab (antiangiogenetisch wirksamer Antikörper) + platinhaltige Chemotherapiekombination
- Amivantamab (Inhibition von EGFR und c-Met)
- Sotorasib (Inhibition von KRASG12C)
- Antikörper-Wirkstoff-Konjugat
- Trastuzumab-Deruxtecan (HER2-Antikörper Trastuzumab, gebunden an den zytostatisch wirksamen Topoisomerase I-Inhibitor Deruxtecan)
- Chemotherapie
Strahlentherapie
- Kann Husten, Hämoptyse, Dyspnoe wegen Bronchialobstruktion und metastasenbedingte Knochenschmerzen lindern.
- Bei symptomatischen Hirnmetastasen werden zusätzlich Kortikosteroide zur Reduktion des perifokalen Ödems verabreicht.
- Prophylaktische Hirnbestrahlung für Patient*innen mit kleinzelligem Bronchialkarzinom und kompletter Remission nach Radiochemotherapie1-2,
5,337
Chirurgie
- Der gesamte Abschnitt basiert auf
dieserdiesenReferenzReferenzen.1-3 - Der Umfang der notwendigen Resektion hängt von der Ausbreitung des Tumorgewebes ab und ist vor Beginn der Operation nie mit Sicherheit vorhersehbar.
- Lobektomie
- Ist das bevorzugte Verfahren, wenn der Tumor auf einen einzelnen Lappen begrenzt ist.
- Der postoperative Verlauf ist meistens unkompliziert, die 30-Tage-Mortalität liegt unter 2 %.
- Pneumonektomie
- Ist nur selten indiziert.
- bei zentraler Tumorlokalisation
- Aufgrund des größeren Lungenparenchymverlustes und der Rechtsherzbelastung ist die Letalität 2- bis 3-mal höher als nach Lobektomie.
3
- Evtl. zusätzliche Resektion von Perikard, Thoraxwand oder Zwerchfell bei Invasion in diese Strukturen
- Sleeve-Lobektomie
- Lobektomie mit gleichzeitiger Resektion eines Haupt- oder Lappenbronchusabschnitts
- Bei zentralen Oberlappentumoren kann man damit in ausgewählten Fällen die Resektion des Unterlappens vermeiden.
- Wedge-Resektion
- Bezeichnet kleinere Eingriffe wie segmentäre und subsegmentäre Keilresektion; lässt sich bei kleineren Tumoren bei Patient*innen mit begrenzter Lungenfunktion anwenden.
- Extensive Resektionen bei N2- und T3-Erkrankungen
- Sind nur in ausgewählten Fällen indiziert.
- Carina-Resektion
- Pneumonektomie mit gleichzeitigem Entfernen der Carina sowie eines begrenzten Teils des gegenüberliegenden Hauptbronchus und der Trachea
- Wird in seltenen Fällen bei Carina-nahen und als N0 oder N1 klassifizierten Tumoren durchgeführt.
- Palliative Chirurgie
- Kann Patient*innen angeboten werden, die inoperabel sind oder ein Rezidiv bekommen haben.
- Zugang in der Regel bronchoskopisch
- bei Tumorinvasion oder Kompression von Hauptbronchus, Trachea oder Ösophagus
- intraluminale Stentanlage
- Abtragen der Tumormasse mit Laser oder Kryotherapie
Beratung in der Hausarztpraxis
Leitlinie: Patientenaufklärung1
- Patientenzentrierte Kommunikation
- Die Art der Vermittlung von Informationen und der Aufklärung der Patient*innen soll nach folgenden Grundprinzipien einer patientenzentrierten Kommunikation, die eine partizipative Entscheidungsfindung ermöglicht, erfolgen (Ib/A):
- Ausdruck von Empathie und aktives Zuhören
- direktes und einfühlsames Ansprechen schwieriger Themen
- wenn möglich, Vermeidung von medizinischem Fachvokabular, ggf. Erklärung von Fachbegriffen
- Strategien, um das Verständnis zu verbessern (Wiederholung, Zusammenfassung wichtiger Informationen, Nutzung von Grafiken u.
- Ermutigung, Fragen zu stellen.
- Erlaubnis und Ermutigung, Gefühle auszudrücken.
- Weiterführende Hilfe anbieten.
- Die kommunikativen Kompetenzen der aufklärenden Ärzt*innen lassen sich durch die Teilnahme an einem strukturierten Kommunikationstraining verbessern.
- Die Art der Vermittlung von Informationen und der Aufklärung der Patient*innen soll nach folgenden Grundprinzipien einer patientenzentrierten Kommunikation, die eine partizipative Entscheidungsfindung ermöglicht, erfolgen (Ib/A):
- Diagnosemitteilung
- Die Aufklärung über die Krankheit und deren Verlauf soll primär über die behandelnden Ärzt*innen erfolgen.
- Bei der Auseinandersetzung mit den Informationen sollen die Patient*innen durch alle an der Behandlung beteiligten Berufsgruppen unterstützt werden.
- Dazu soll der Stand des Aufklärungsprozesses nachvollziehbar dokumentiert werden.
- Vor der Informationsübermittlung soll erfragt werden, mit welchem Wissen, mit welchen Vorstellungen, Hoffnungen und Befürchtungen im Zusammenhang mit seiner Erkrankung die betroffene Person in das Gespräch geht.
- Informationen sollen schrittweise übermittelt werden mit regelmäßiger Rückversicherung, ob und inwieweit die Patient*innen diese verstanden haben. Hierbei sollen die Betroffenen ausdrücklich zu Fragen ermutigt werden.
- Angehörige sollen in ihrer Rolle als Unterstützer*innen und Mitbetroffene wahrgenommen und gewürdigt werden.
- Sie sollen nach ihren Bedürfnissen gefragt und bei Bedarf zum Annehmen von Unterstützungsangeboten ermutigt werden.
- Vorausschauende Versorgungsplanung (Advance Care Planning, ACP)
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung sollen das Angebot einer ACP erhalten.
- Gegenstand der Gespräche soll dabei sein:
- Umfang und Grenzen der Behandlung im Fall (erkrankungs-)typischer sowie häufiger und möglicher Szenarien und Komplikationen
- individuelle Präferenzen hinsichtlich der Versorgung in der letzten Lebensphase, des Betreuungs- und Sterbeortes sowie ggf. der Bestattung
- Benennung von Vorsorgebevollmächtigten oder Vorschlag einer Betreuer*in
.
- Thematisieren von Tod und Sterben
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung soll frühzeitig und bei Krankheitsprogress die ausdrückliche Bereitschaft vermittelt werden, über das Sterben an der Erkrankung zu sprechen.
- Dabei sollten auch Worte wie „Sterben“ und „Tod“ von den an der Behandlung Beteiligten in einfühlsamer und situativ angemessener Weise ausgesprochen werden.
- Der Äußerung eines Sterbe-/Todeswunsches eines Menschen mit einer nicht heilbaren Krebserkrankung soll mit Empathie und Gesprächsbereitschaft begegnet werden.
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung soll frühzeitig und bei Krankheitsprogress die ausdrückliche Bereitschaft vermittelt werden, über das Sterben an der Erkrankung zu sprechen.
- Unterstützende Gespräche
- Um den individuellen Hilfebedarf einzuschätzen und lokale Angebote zu vermitteln, sind Informationen zu folgenden Bereichen einzuholen:
- Wohnsituation
- soziale Einbindung (Familie,
FreundeFreund*innen,NachbarnNachbar*innen) - berufliche Situation
- verfügbare Pflegedienste
.
- Beratung zu sozialen und versicherungsrechtlichen Fragen nicht nur während der aktiven Erkrankung, sondern auch in der Rekonvaleszenzphase
Palliative Behandlung
Leitlinie: Palliativmedizinische Versorgung1
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung sollen nach Diagnosestellung frühzeitig das Angebot einer Integration von Palliativberatung und -versorgung erhalten (IIb/A).
- Das Angebot zur Integration von Palliativberatung und -versorgung bei Patient*innen mit einer nicht-heilbaren Lungenkarzinomerkrankung sollte frühzeitig (innerhalb der ersten 2 Monate) nach Diagnosestellung erfolgen (IIb/B).
- Die palliative Versorgung sollte durch palliativmedizinische qualifizierte Fachkräfte in allen palliativmedizinisch relevanten Dimensionen (physische, psychische, soziale und spirituelle Bedürfnisse) erfolgen und dokumentiert werden (IIb/B).
- Im Rahmen der Palliativberatung und -versorgung von Patient*innen mit nicht-heilbarer Lungenkarzinomerkrankung sollten folgende Aufgaben bewältigt werden (IIb/B):
- regelmäßiges Einschätzen physischer, psychosozialer und spiritueller Belastungen und Behandlung der entsprechenden Symptome
- Beratung und Koordination von Hilfestellungen
- aktive Initiierung von Gesprächen über Vorausverfügungen mit Blick auf mögliche Komplikationen und auf Aspekte des Lebensendes
- Wahrnehmung von Belastungen in der Familie und bei
FreundenFreund*innen mit Angebot der Unterstützung - Beratungen und Vermittlung hospizlicher, pflegerischer und anderer Versorgungsangebote
.
- In Studien wurden die positiven Effekte der frühzeitigen Palliativberatung und -versorgung dann erzielt, wenn
:- die Kontakte wenigstens in monatlichen Abständen – und –
- nach einem Primärkontakt
3drei Folgekontakte erfolgten.
- Strukturierte Palliativversorgung sollte in Entscheidungsprozesse bei Patient*innen mit einer nicht-heilbaren Lungenkarzinomerkrankung integriert werden (z.
- Schmerzen
- Übelkeit und Erbrechen
- Obstipation
- Maligne gastrointestinale Obstruktion
- Orale Beschwerden
- Mangelernährung und Dehydratation
- Dyspnoe
- Depression
- Angst
- Delir
Prävention
- Warnung vor dem Rauchen
- Tipps für den Rauchstopp
- Berufliche Exposition gegenüber ionisierender Strahlung und kanzerogenen Stoffen vermeiden.
- Bauliche Schutzmaßnahmen in Regionen mit erhöhter Radonbelastung
- Körperliche Aktivität
- Reichlich Obst und Gemüse
- Nahrungsergänzungsmittel wie Vitamine A, C, E oder Selen haben Metaanalysen zufolge keinen vorbeugenden Effekt gegenüber Lungenkrebs.
5310
Verlauf, Komplikationen und Prognose
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-3
Verlauf
- Symptomatischer Lungenkrebs ist zum Diagnosezeitpunkt in der Regel bereits fortgeschritten und inoperabel.
- Zum Diagnosezeitpunkt besteht bei 10–15 % eine lokalisierte Erkrankung. Von diesen sterben 50 % nach 5 Jahren, auch wenn die Operation potenziell kurativ war.
- Über die Hälfte hat zum Diagnosezeitpunkt Fernmetastasen.
Kleinzelliges Karzinom
- Zentral lokalisiert
- Verursacht eine Kompression der Bronchien.
- Häufig bereits zum Diagnosezeitpunkt metastasiert
Plattenepithelkarzinom
- Meist in den zentralen Bronchien lokalisiert
- Das Karzinom wächst intraluminal und lässt sich deshalb früh durch eine zytologische Untersuchung des Sputums nachweisen.
- Streuung in regionale Lymphknoten
Adenokarzinom und großzelliges Karzinom
- Haben annähernd den gleichen klinischen Verlauf.
- Peripher in der Lunge
- Fernmetastasen häufig
Anerkennung als Berufskrankheit
- Tritt ein Bronchialkarzinom im Zusammenhang mit der beruflichen Tätigkeit auf, kann diese Erkrankung als Berufskrankheit anerkannt werden.
5411 - Zuständig hierfür sind die gesetzlichen Unfallversicherungsträger.
DerBei Verdacht auf eine Berufskrankheitmussbestehtdort gemeldet werdenMeldepflicht (Meldebogen5512).- Es wird eine ausführliche Arbeits- und Gefährdungsanamnese erhoben, und ein Gutachten entscheidet über die Anerkennung als Berufskrankheit.
- Dann können bestimmte Maßnahmen auf Kosten der GUV durchgeführt werden:
- spezielle therapeutische Maßnahmen
- Einstellung der gefährdenden Tätigkeit
- Minderung der Erwerbsfähigkeit bis zur Zahlung einer Rente
.5613
- Manchmal muss die Tätigkeit erst vollständig aufgegeben werden, damit die Anerkennung als Berufskrankheit erfolgen kann.
Komplikationen
Der gesamte Abschnitt basiert auf dieser Referenz.3- Metastasen: häufig in Leber, Gehirn, Knochen, Herz, Abdomen, Haut
- Maligner Pleuraerguss
- Vena-cava-superior-Syndrom
- Parese des Nervus phrenicus
- Parese des Nervus recurrens
- Bronchus- oder Trachealstenose
- Ösophagusstenose
- Ateminsuffizienz
- Rechtsherzinsuffizienz
- Schlaganfall
Prognose
Der gesamte Abschnitt basiert auf dieser Referenz.3- Bei den meisten Langzeitüberlebenden war der Tumor primär reseziert worden. Die Vollständigkeit der Resektion scheint für Stadium Ia–IIb der wichtigste Prognosefaktor zu sein.1
- Nach einer chirurgischen Behandlung
liegtbeträgt die 5-Jahres-Überlebensrate für Männerbeica.4140 % und für Frauenbei 56> 50 %.57 - Mehr als die Hälfte aller Patient*innen mit Lungenkrebs sterben innerhalb eines Jahres nach Diagnosestellung. Die durchschnittliche Überlebenszeit liegt bei 10–12 Monaten, die 5-Jahres-Überlebensrate unter 20
30 - Die 5-Jahres-Überlebensrate bei kurativer Resektion des Plattenepithelkarzinoms beträgt 35–40 %, bei Adenokarzinom und großzelligem Karzinom 25 %.
- In einzelnen genetischen Subgruppen können mit molekular zielgerichteten Therapien deutlich höhere Ansprech- und Überlebensraten erzielt werden. Bei EGFR-mutierten Tumoren – etwa 12
heutebei30–36etwaMonaten3 Jahren.58 - Faktoren, die die Prognose beeinflussen:
- Stadium zum Diagnosezeitpunkt
- allgemeiner Gesundheitszustand der Patient*innen
- Alter der Betroffenen
- histologische, molekulare und genetische Eigenschaften des Tumors
- Proliferationsrate des Tumors
- Art und Intensität der Therapie
.
Diagnosezeitpunkt
- Die Prognose ist stadienabhängig. Lungenkrebs wird oft erst in einem fortgeschrittenen Stadium erkannt. Durch eine frühere Erkennung und Behandlung könnte man Morbidität und Mortalität reduzieren.
Bedeutung des Rauchens
- 9 von 10 Lungenkrebspatient*innen sind Raucher*innen oder ehemalige Raucher*innen.
- Nach einem Rauchstopp geht das durchschnittliche Risiko zwar zurück, bleibt aber immer über dem Niveau von Personen, die nie geraucht haben.
- Langzeitüberlebende Lungenkrebspatient*innen mit positiver Raucheranamnese haben weiterhin ein erhöhtes Krebsrisiko.
- Zwischen Rauchen und dem Lungenkrebsrisiko besteht eine Dosis-Wirkungs-Beziehung.
- Das Risiko steigt mit der Anzahl gerauchter Zigaretten und Raucherjahre, mit dem Grad der Nikotinabhängigkeit (tiefere Inhalation), mit dem Teer- und Nikotingehalt des inhalierten Rauchs.
- Selbstgedrehte Zigaretten ohne Filter bedeuten ein verdoppeltes Risiko im Vergleich zu Filterzigaretten.
- Männer mit einem Verbrauch von >
- Männer, die vor ihrem vollendeten 15. Lebensjahr mit dem Rauchen beginnen, haben ein 4-mal höheres Risiko als Männer, die erst nach dem vollendeten 25. Lebensjahr mit dem Rauchen anfangen.
- Rauchende Frauen haben ein höheres Lungenkrebsrisiko als rauchende Männer.
Verlaufskontrolle
- Behandlung und Nachsorge erfolgen unter der Regie eines auf Lungentumoren spezialisierten Zentrums, evtl. in Zusammenarbeit mit der Hausärzt*in.
Aufgaben der Hausärzt*innen
- Nebenwirkungen von Chemo- und Strahlentherapie behandeln, sowohl in der aktiven Behandlungsphase als auch bei Spätfolgen (Strahlenschäden, Stoffwechselstörungen, Parästhesien, Fatigue, muskuloskelettale Beschwerden etc.).
- Kontrolluntersuchungen auf Rezidive und auf Spätfolgen der Erkrankung und Therapie weiterführen.
- Hämatologische Parameter während der Zytostatika-Behandlung in Absprache mit dem behandelnden Zentrum überwachen.
Unter aktiver Behandlung
- Erstes Gespräch nach Entlassung aus dem Krankenhaus
- Gehen Sie zusammen mit den Patient*innen die Epikrise durch, überzeugen Sie sich, dass diese den Inhalt verstanden haben, legen Sie einen Plan für Kontrolluntersuchungen und Blutentnahmen zwischen evtl. Zytostatika-Zyklen fest und erklären Sie die Warnsymptome, bei denen die Patient*innen sofort mit Ihnen oder dem behandelnden Zentrum in Kontakt treten sollten.
- Infektions- und Leukozytenüberwachung
- Leukozyten erreichen meist 7–14 Tage nach einem Zyklus ihren Tiefpunkt.
- Sind die Leukozyten zu niedrig für den nächsten Zyklus, dann besprechen Sie mit der Klinik das weitere Vorgehen.
- Wenn Patient*innen zwischen zwei Chemotherapie-Zyklen Fieber entwickeln, dann behandeln Sie sie so, als hätten sie eine Sepsis, und weisen Sie sie unverzüglich in die Klinik ein. Das gilt für eine Körpertemperatur über 38,5
- Patient*innen mit Fieber, kombiniert mit Leukozyten unter 1 oder Neutrophilen unter 0,5, müssen grundsätzlich ins Krankenhaus eingewiesen und wie bei Sepsis behandelt werden.
- Erhöhtes Risiko für thromboembolische Ereignisse bei Krebspatient*innen
- körperliche Aktivität
- Beine hochlegen.
- Kompressionstrümpfe
- ggf. Prophylaxe mit standarddosiertem
niedermolekularenniedermolekularem Heparin (Enoxaparin oder Dalteparin mit sehr geringem Risiko für Blutungskomplikationen)
- Fortlaufende Anpassung der Schmerztherapie
- Nebenwirkungen der Therapie behandeln, wie z.
- Übelkeit
- neuropathische Schmerzen
- Fatigue
- Diarrhö
- Hautausschläge und Strahlenschäden der Haut
- Schleimhautulzera
- Inkontinenz und sexuelle Funktionsstörungen
Nach Abschluss der Behandlung im Krankenhaus
- Richten Sie das Hauptaugenmerk auf das Erkennen behandlungsbezogener Nebenwirkungen und auf die Frühdiagnostik von Rezidiven.
- Pneumokokken-Vakzine nach einem Jahr und danach alle 5 Jahre je nach messbarem Serum-Antikörper-Titer
- Influenza-Impfung nach den aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (RKI).
- Routinemäßige Röntgenuntersuchungen sind in der Hausarztpraxis nicht indiziert; das gilt auch für routinemäßige Blutproben, außer bei laufender Chemotherapie.
Fatigue
- Schwere, anhaltende Erschöpfung mit Unwohlsein, dem Gefühl von Kraftlosigkeit und schneller Ermüdbarkeit
- Keine oder unzureichende Linderung durch Ausruhen oder Schlaf
- Tritt bei Krebspatient*innen sehr häufig auf, besonders während und nach einer Strahlen- oder Zytostatika-Therapie.
- Von allen behandlungsbezogenen Beschwerden wird die Fatigue von Krebspatient*innen am belastendsten erlebt.
- Ein leichtes Trainingsprogramm begünstigt möglicherweise die berufliche Rehabilitation.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Es ist nie zu spät, mit dem Rauchen aufzuhören.
- Rauchen erhöht das Risiko für die Entwicklung eines neuen Lungenkrebses oder einer anderen Krebserkrankung.
- Es gibt Hinweise darauf, dass bestimmte Behandlungsformen, z.
RauchernRaucher*innen möglicherweise eine geringere Wirkung haben als beiNichtrauchernNichtraucher*innen.
Patienteninformationen in Deximed
- Lungenkrebs
Kleinzelliger LungenkrebsNicht-kleinzelliger LungenkrebsBrustfellkrebs, MesotheliomPleurapunktion und -drainageSchmerzen und Schmerztherapie- Warum sollten Sie das Rauchen aufgeben, und wie gelingt es?
Essen bei Appetitlosigkeit
Linderungsbehandlung bei fortgeschrittener KrebserkrankungWas ist Palliativmedizin?Angstbehandlung, PalliativmedizinÜbelkeit und Erbrechen, PalliativmedizinVerstopfung, PalliativmedizinMundbeschwerden, PalliativmedizinAtembeschwerden bei LungenkrebsGewichtsverlust bei KrebsDepression, PalliativmedizinDelirium, Palliativmedizin
Weitere Informationen
- Deutsche Krebshilfe:
StrahlenbehandlungStrahlentherapie
Illustrationen
 Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)
Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)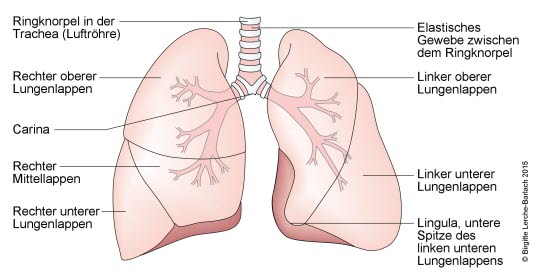 Normale Lunge und Bronchien
Normale Lunge und Bronchien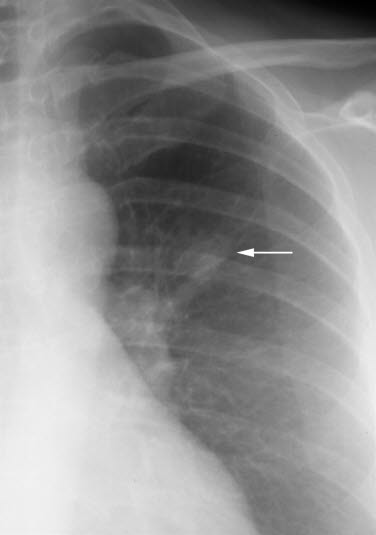 Lungenkrebs, Röntgen
Lungenkrebs, Röntgen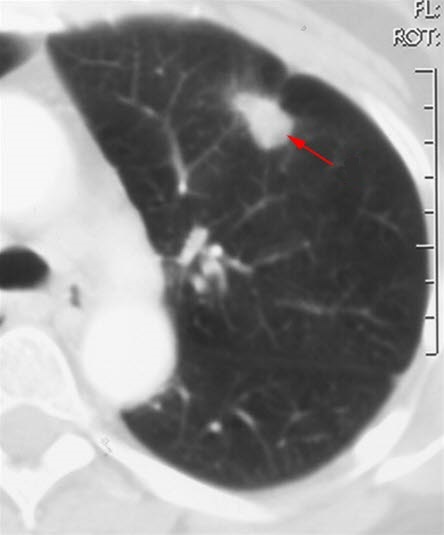 Lungenkrebs (CT)
Lungenkrebs (CT)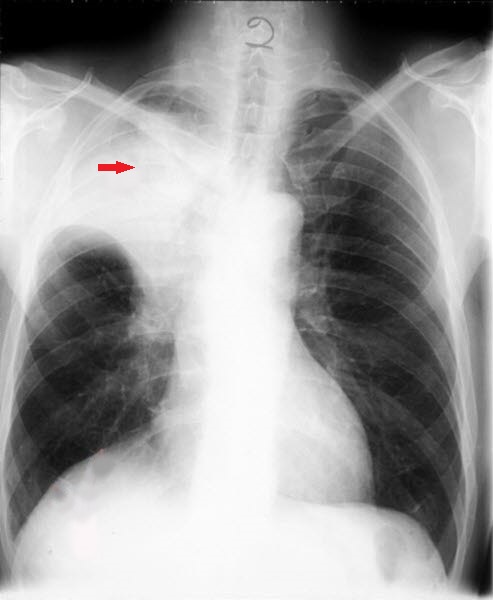 Kleinzelliges anaplastisches Karzinom, Röntgen
Kleinzelliges anaplastisches Karzinom, Röntgen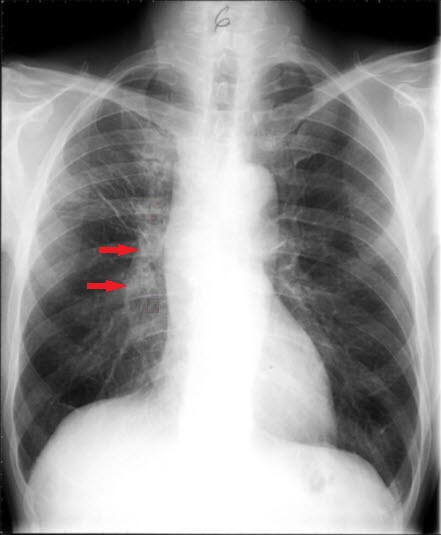 Kleinzelliges anaplastisches Karzinom, nach Behandlung, Röntgen
Kleinzelliges anaplastisches Karzinom, nach Behandlung, Röntgen
Lungenkrebs (CT)
Lungenkrebs, Röntgen
Normale Lunge und BronchienQuellen
Leitlinien
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP), Deutsche Krebsgesellschaft (DKG).
S3-Leitlinie
Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. AWMF-Leitlinie Nr. 020-007OL.KlasseS3, Stand2018.www.awmf.org Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie. Lungenkarzinom, nicht-kleinzellig (NSCLC) – Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen, Stand 2017.www.onkopedia.deDeutsche Gesellschaft für Hämatologie und Medizinische Onkologie. Lungenkarzinom, kleinzellig (SCLC) – Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen, Stand 2017.www.onkopedia.deDeutsche Gesellschaft für Neurologie. Hirnmetastasen und Meningeosis neoplastica, AWMF-Leitlinie Nr. 030-060. Klasse S2k, Stand 20142022. www.awmf.org
Literatur
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP), Deutsche Krebsgesellschaft (DKG).
S3-LeitliniePrävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. AWMF-Leitlinie Nr. 020-007OL S3, Stand20182022. www.awmf.org - Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO). Lungenkarzinom, kleinzellig (SCLC) - Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen. Stand
AprilJanuar20172023. www.onkopedia.com - Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO). Lungenkarzinom, nicht-kleinzellig (NSCLC) - Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen. Stand
2017November 2022. www.onkopedia.com HammerschmidtTravisS und Wirtz H. Dtsch Arztebl Int 2009; 106: 809-20. DOI: 10.3238/arztebl.2009.0809DOIJackman DM, Johnson BE. Small-cell lung cancer. Lancet 2005; 366: 1385-96. pmid:16226617PubMedTravis, W.D.WD, et al.,The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol, 2015. 10: 1243-60. PMID: 26291008 PubMed- Wittekind
,C.,TNM: Klassifikation maligner Tumoren. 2017: Wiley Batzler WU, Giersiepen K, Hentschel S, et al. : Cancer in Germany, 2003–2004. Incidence and Trends. In: Robert Koch Institut, V. GdeKiDe, (eds.): Contributions to Federal Health Reporting. Berlin: Mercedes Druck, 2008.AlbergDeutschesAJ,InstitutFordfürJG,MedizinischeSametDokumentationJM:undEpidemiology of lung cancer: ACCP evidence-based clinical practice guidelinesInformation (2nd editionDIMDI).ChestICD-10-GM2007;Version132: 29–55. pmid: 17873159PubMedNational Cancer Institute. SEER Cancer Statistics Review2023,1975-2011Stand 06.12.2022.seer.cancer.govHarris JE, Thun MJ, Mondul AM, Calle EE. Cigarette tar yields in relation to mortality from lung cancer in the cancer prevention study II prospective cohort, 1982-8. BMJ 2004; 328: 72-6.British Medical JournalHenley SJ, Thun MJ, Chao A, Calle EE. Association between exclusive pipe smoking and mortality from cancer and other diseases . J Natl Cancer Inst 2004; 96: 853-61.PubMedvan Loon AJ, Kant IJ, Swaen GM, Goldbohm RA, Kremer AM, van den Brandt PA. Occupational exposure to carcinogens and risk of lung cancer: results from The Netherlands cohort study. Occup Environ Med 1997; 54: 817-24.PubMedWichmann HE. Diesel exhaust particles. Inhal Toxicol 19 Suppl 2007; 1: 241 – 244. pmid: 17886072PubMedCollins LG, Haines C, Perkel R, Enck RE. Lung cancer: Diagnosis and management. Am Fam Physician 2007; 75: 56-63.PubMedTravis WD, Travis LB, Devesa SS. Lung cancer. Cancer 1995; 75(1 suppl): 191-202.Patz EF Jr. Imaging bronchogenic carcinoma. Chest 2000; 117(4 suppl 1): 90S-5S.Centers for Disease Control and Prevention. The health consequences of smoking. A report of the surgeon general. 2004. Accessed October 6, 2006, at: http://www.cdcdimdi.gov/tobacco/sgr/sgr_2004/index.htm.International Agency for Research on Cancer. Tobacco smoking and involuntary smoking. IARC Monographs on the evaluation of carcinogenic risks to humans. Vol 83. Lyons: IARC, 2004.Fontham ET, Correa P, Reynolds P, Wu-Williams A, Buffler PA, Greenberg RS, et al. Environmental tobacco smoke and lung cancer in nonsmoking women. A multicenter study. JAMA 1994; 271: 1752-9.Journal of the American Medical AssociationBoffetta P, Agudo A, Ahrens W, Benhamou E, Benhamou S, Darby SC, et al. Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe. J Natl Cancer Inst 1998; 90: 1440-50.PubMedBilello KS, Murin S, Matthay RA. Epidemiology, etiology, and prevention of lung cancer. Clin Chest Med 2002; 23: 1-25.PubMedHammond EC, Selikoff IJ, Seidman H. Asbestos exposure, cigarette smoking and death rates. Ann N Y Acad Sci 1979; 330: 473-90.PubMedGilliland FD, Hunt WC, Pardilla M, Key CR. Uranium mining and lung cancer among Navajo men in New Mexico and Arizona, 1969 to 1993. J Occup Environ Med 2000; 42: 278-83.PubMedGray A, Read S, McGale P, Darby S. Lung cancer deaths from indoor radon and the cost effectiveness and potential of policies to reduce them. BMJ 2009; 338: a3110.BMJ (DOI)Will C, Schewe C, Petersen I. Incidence of HPV in primary and metastatic squamous cell carcinomas of the aerodigestive tract: implications for the establishment of clonal relationships. Histopathology 2006; 48: 605 – 626. pmid:16623788PubMedGiuliani L, Favalli C, Syrjanen K et al. Human papillomavirus infections in lung cancer. Detection of E6 and E7 transcripts and review of the literature. Anticancer Res 2007; 27: 2697 – 2704. pmid:17695435PubMedHo JC, Wong MP, Lam WK. Lymphoepithelioma-like carcinoma of the lung. Respirology 2006; 11: 539 – 545. pmid:16916325PubMedLavolé A, Wislez M, Antoine M et al. Lung cancer, a new challenge in the HIV-infected population. Lung Cancer 2006; 51: 1 – 11Alberg AJ, Ford JG, Sarnet JM. Epidemiology of lung cancer: ACCP evi- dence-based clinical practice guidelines (2nd edition). Chest 2007; 132: 29 – 55. pmid: 17873159PubMedBeckles MA, Spiro SG, Colice GL, Rudd RM. Initial evaluation of the patient with lung cancer: symptoms, signs, laboratory tests, and paraneoplastic syndromes. Chest 2003; 123(1 suppl): 97S-104S.Merchut MP. Brain metastases from undiagnosed systemic neoplasms. Arch Intern Med 1989; 149: 1076-80.PubMedde- Deutsche Gesellschaft für Neurologie (DGN). Hirnmetastasen und Meningeosis neoplastica. AWMF-Leitlinie Nr. 030-060, Klasse S2k, Stand 2014 (abgelaufen).
www.awmfdgn.org PaulsonLungenkrebsscreeningDLmittels Niedrigdosis-Computertomografie.CarcinomasAuftrag:in the superior pulmonary sulcusS19-02.J Thorac Cardiovasc Surg 1975; 70Version:1095-10410, Stand: 19102020.PubMedRodriguezIQWiG-PanaderoBerichteF,–Borderas Naranjo F, Lopez Mejias JNr.Pleural metastatic tumours and effusions982.Frequency and pathogenic mechanisms in a post-mortem series. Eur Respir J 1989; 2: 366-9.2020PubMedWudel LJ Jr, Nesbitt JCwww.Superior vena cava syndromeiqwig.Curr Treat Options Oncol 2001; 2: 77-91.PubMedPress OW, Livingston R. Management of malignant pericardial effusion and tamponade. JAMA 1987; 257: 1088-92.Journal of the American Medical AssociationDalmau J, Rosenfeld MR. Paraneoplastic syndromes of the CNS. Lancet Neurol 2008; 7: 327-40.PubMedvan Klaveren RJ, Oudkerk M, Prokop M, et al. Management of lung nodules detected by volume CT scanning. N Engl J Med 2009; 361: 2221-9.PubMedDetterbeck FC, Lewis AZ, Diekemper R, et al. Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians Evidence-Based Clinical Practice Guideline. Chest 2013. doi:10.1378/chest.12-2377DOIManser R, Lethaby A, Irving LB, et al. Screening for lung cancer. Cochrane Database Syst Rev. 2013 Jun 21;6:CD001991. doi:10.1002/14651858.CD001991.pub3DOIThe Royal College of Radiologists. Making the best use of a Department of Clinical Radiology. Guidelines for doctors. Fourth edition. London: The Royal College of Radiologists, 1998.Bach-Gansmo T, Bogsrud TV, Aas M, Jørgensen LH, Fischer BM. Positronemisjonstomografi i utredningen av lungekreftpasienter Tidsskr Nor Lægeforen 2004; 124: 1088 - 9.Arroliga AC, Matthay RA. The role of bronchoscopy in lung cancer. Clin Chest Med 1993; 14: 87-98.PubMedMazzone P, Jain P, Arroliga AC, Matthay RA. Bronchoscopy and needle biopsy techniques for diagnosis and staging of lung cancer. Clin Chest Med 2002; 23: 137-58.PubMedAlbain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet 2009; 374: 379-86.PubMedThe International Adjuvant Lung Cancer Trial Collaborative Group. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med 2004;350:351-360.New England Journal of MedicineKim ES, Hirsh V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 2008; 372: 1809-18.PubMedNon-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ 1995;311:899-909.British Medical Journalde- Salazar MC, Rosen JE, Wang Z, et al. Association of Delayed Adjuvant Chemotherapy With Survival After Lung Cancer Surgery. JAMA Oncol 2017 May 1; 3(5): 610-619. pmid:28056112 PubMed
Peto R, Darby S, Deo H, Solcocks P, Whitley E, Doll R. Smoking, smoking cessation, and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ 2000; 321: 323-9.PubMedParsons A, Daley A, Begh R, Aveyard P. Influence of smoking cessation after diagnosis of early stage lung cancer on prognosis: systematic review of observational studies with meta-analysis. BMJ 2010; 340: b5569.BMJ (DOI)- Cortes-Jofre M, Rueda JR,
CorsiniAsenjo-MunozLobosGC, et al. Drugs for preventing lung cancer in healthy people. Cochrane Database Syst Rev2012 Oct 172020;103: CD002141.Cochrane (DOI)www.cochranelibrary.com - Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). Dortmund. Merkblätter und wissenschaftliche Begründungen zu den Berufskrankheiten der Anlage 1 zur Berufskrankheiten-Verordnung (BKV), zuletzt aktualisiert durch die Dritte Verordnung zur Änderung der Berufskrankheiten-Verordnung vom 22. Dezember 2014. Zugriff 24.1.2017. www.baua.de
- DGVU Formtexte für Ärzte: Ärztliche Anzeige bei Verdacht auf eine Berufskrankheit. www.dguv.de
- Mehrtens G,
G.Valentin,H., Schönberger,A. Arbeitsunfall und Berufskrankheit Strand TE, Rostad H, Moller B, Norstein J. Survival after resection for primary lung cancer: a population based study of 3211 resected patients. Thorax 2006;61(8):710-5.PubMedPao W. New approaches to targeted therapy in lung cancer. Proc Am Thorac Soc 2012; 9:72-3. pmid:22550248PubMed
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).
- Bei