Prüfungsrelevant für die Facharztprüfung Allgemeinmedizin1
- Indikationsstellung der Antikoagulation und Wahl des Antikoagulans entsprechend der Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft
- CHA2DS2-VASc-Score
- HAS-BLED-Score
- Detaillierte diagnostische Kenntnisse zu den häufigsten kardialen und extrakardialen Ursachen des Vorhofflimmerns
- CHADS2-Score
Allgemeine Informationen
Definition
Vorhofflimmern
- Vorhofflimmern ist eine chronische Erkrankung, wobei sich ein paroxysmales Vorhofflimmern zu einem persistierenden und schließlich zu einem permanenten Vorhofflimmern entwickelt.
- Zeichnet sich durch eine unregelmäßige Vorhofaktivität mit einer Frequenz von 350–600/min und durch völlig unregelmäßige AV-Überleitungen aus.2-3
- Die Ventrikelfrequenz ist unregelmäßig, mit Frequenzen zwischen 80 und 150/min, kann aber auch bis zu 200/min ansteigen, vor allem bei neu auftretendem Vorhofflimmern.
- Klinische Einteilung des Vorhofflimmerns3
- paroxysmal
- Verschwindet von selbst wieder, in der Regel innerhalb von 1–2 Tagen, nicht länger als 7 Tage andauernd.
- Paroxysmales Vorhofflimmern, das innerhalb von 7 Tagen kardiovertiert wird, gilt weiterhin als paroxysmal.3
- persistierend
- Geht nicht von alleine vorüber, kann aber in einen Sinusrhythmus umgewandelt werden.
- Abgrenzung gegenüber dem paroxysmalen Vorhofflimmern durch die Dauer > 7 Tage
- permanent
- Elektrische oder medikamentöse Kardioversion hat keinen Erfolg.
- Dauer > 1 Jahr
- paroxysmal
Vorhofflattern
- Ist eine Tachykardie, bei der sich der Vorhof 250- bis 350-mal pro Minute kontrahiert.
- Unbehandeltes Vorhofflattern hat häufig einen konstanten 2:1-AV-Block; seltener einen 3:1-AV-Block oder wechselnde Blockierung.
- Ein 2:1-AV-Block führt zu einer regelmäßigen Ventrikelfrequenz/Puls von ca. 150/min.
- Frequenzreduzierende Medikamente können zu wechselnden AV-Blocks (2:1, 3:1 und 4:1) und unregelmäßigen Ventrikelaktionen führen.
Häufigkeit
- Die Häufigkeit von Vorhofflimmern wird in Deutschland auf im Mittel 2,5 % der Bevölkerung geschätzt und nimmt mit steigendem Alter zu.
- Die Prävalenz von VHF stieg in der Gutenberg-Gesundheitsstudie über die Dekaden am stärksten an bei Männern, von 0,7 % bei 35- bis 44-Jährigen auf 10,6 % bei 65- bis 74-Jährigen.4
- In einer britischen Studie5 zeigten von akut eingewiesenen Patient*innen mit Vorhofflimmern:
- 33 % eine ischämische Herzerkrankung
- 24 % eine Herzinsuffizienz
- 26 % eine Hypertonie
- 7 % eine rheumatische Herzerkrankung.
- Vorhofflimmern kommt zudem häufig postoperativ vor, insbesondere nach einer Herzoperation.6
Ätiologie und Pathogenese
- Vorhofflimmern ist eine supraventrikuläre Tachyarrhythmie, die sich durch unkoordinierte Vorhofaktivität auszeichnet und die mechanische Vorhoffunktion vermindert.7
- Vorhofflimmern steht häufig in Verbindung mit anderen Herz-Gefäß-Erkrankungen.8
- Hypertonie und linksventrikuläre Hypertrophie
- KHK
- strukturelle Herzkrankheit, Kardiomyopathien, Klappenfehler
- Herzinsuffizienz, Myokarditis
- Nichtkardiale Risikofaktoren für Vorhofflimmern
- Hyperthyreose
- Diabetes mellitus
- Hypovolämie, z. B. bei Infektionen
- Adipositas
- chronischer Alkoholmissbrauch
- chronisch obstruktive Lungenkrankheit (COPD)
- chronische Nierenerkrankung.
- Genetische Faktoren können auch von Bedeutung sein.9
Pathophysiologie10
- Vorhofflimmern entsteht u. a. durch multiple, kleine elektrische Reentry-Wellen in den Vorhöfen. Die Erregung kreist in den Vorhöfen so langsam, dass sie immer wieder auf erregbares Gewebe trifft.
- Die Wellen können durch elektrische Trigger ausgelöst werden, meist in den myokardialen „Ästen”, die sich vom linken Vorhof in die proximalen 5–6 cm der Lungenvenen erstrecken.11
- Andere Faktoren, die zu einer Entwicklung von Vorhofflimmern beitragen können, sind die Aktivierung des Renin-Angiotensin-Aldosteron-Systems, eine hämodynamische Überlastung oder Fibrose in den Vorhöfen.12
- Vorhof-Remodellierung12
- Eine Periode mit Vorhofflimmern bewirkt zunächst elektrophysiologische Veränderungen („elektrische Remodellierung”) gefolgt von strukturellen Veränderungen („strukturelle Remodellierung”), die das Flimmern aufrechterhalten.
- Wenn das Vorhofflimmern mit einer schnellen Ventrikelfrequenz verbunden ist, kann diese zu einer Ventrikeldilatation führen und schließlich die systolische Funktion schwächen, was in der Regel als „Tachykardie-induzierte Kardiomyopathie” oder „Tachykardiomyopathie” bezeichnet wird.
- Aufgrund der Remodellierung wird die Kardioversion bei länger andauerndem Flimmern schwieriger.
Pathophysiologische Konsequenzen
- Durch die hohe Schlagfrequenz des Vorhofs kommt es nicht mehr zu einer relevanten Kontraktion des Vorhofs. Damit sinken dann das Minutenvolumen bzw. Herzzeitvolumen – bis zu 15 %. Da der AV-Knoten nur einen Teil der Vorhoferregung weiterleitet, kommt es zu unregelmäßigen Ventrikelaktionen.
- Dies kann zu Angina pectoris oder Herzinsuffizienz führen.
- Vorhofflimmern ist wahrscheinlich die Ursache für ca. 25 % aller embolischen Schlaganfälle.13
Disponierende Faktoren
- Herz-Gefäß-Erkrankungen
- meist Hypertonie, KHK, Herzinsuffizienz oder Herzklappenerkrankung
- Weitere disponierende Erkrankungen
- Hyperthyreose, Diabetes mellitus, chronische Lungenerkrankung
- Andere Auslöser
- akute und große Alkoholbelastung („Holiday-Heart-Syndrom“)
- Alkoholkonsum über 10 Einheiten (à 12 g Alkohol) pro Woche ist mit einem erhöhten Vorkommen und einer längeren Dauer von paroxysmalem Vorhofflimmern asszoziiert.14
- andere akute Erkrankung, nach Operationen, Medikation mit bronchodilatatorischen Substanzen
- akute und große Alkoholbelastung („Holiday-Heart-Syndrom“)
ICPC-2
- K78 Vorhofflimmern/-flattern
ICD-10
- I48 Vorhofflimmern und Vorhofflattern
- I48.0 Vorhofflimmern, paroxysmal
- I48.1 Vorhofflimmern, persistierend
- I48.2 Vorhofflimmern, chronisch
- I48.3 Vorhofflattern, typisch
- I48.4 Vorhofflattern, atypisch
- I48.9 Vorhofflimmern und Vorhofflattern, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Das EKG zeigt unregelmäßige RR-Intervalle, es gibt keine deutlichen P-Wellen und die Vorhofaktivität ist unregelmäßig.3
- Der Puls bei Flimmern: Hat einen unregelmäßigen Rhythmus und unregelmäßige Pulsstärke.
- Der Puls bei Flattern: Kann regelmäßig sein, ist aber schnell.
- Die Diagnose wird mit einem Ruhe-EKG oder einem 24-Stunden-Langzeit-EKG, evtl. längere Aufnahmen bei paroxysmalem Vorhofflimmern, gestellt.
Differenzialdiagnosen
- Andere Rhythmusstörungen
- Extrasystolen
Anamnese
- Nicht alle Patient*innen bemerken, dass sie Vorhofflimmern haben.
- Die Symptome sind abhängig von der Ventrikelfrequenz: je schneller, desto ausgeprägter sind die Beschwerden.
- Folgende Symptome sind typisch:
- Herzklopfen/Palpitationen
- verringertes körperliches Leistungsvermögen
- Dyspnoe
- Brustschmerzen
- Erschöpfung
- Schwindel, Synkope und Beinahe-Synkope.
- Patient*innen mit andauerndem Flimmern haben häufig weniger deutliche Symptome.
- Vorhofflattern ist meist paroxysmal und dauert einige Sekunden bis zu mehreren Stunden, manchmal über Tage oder noch länger.
- Episoden mit Vorhofflimmern ohne subjektive Symptome kommen häufig bei Patient*innen mit paroxysmalem Flimmern vor.
Folgendes abklären
- Ist der Zustand dauerhaft oder kommt er anfallsweise vor?
- Gibt es auslösende Faktoren?
- körperliche Aktivitäten, Alkoholkonsum, Infektionen
- Zugrunde liegende Erkrankungen?
- Herzkrankheit, Hypertonie, Diabetes, Hyperthyreose, Lungenerkrankung
- Evtl. frühere thromboembolische Episoden?
- Medikamenteneinnahme, -missbrauch, Alkoholkonsum?
Klinische Untersuchung
Palpation
- Schneller und unregelmäßiger Puls, häufig im Bereich 100–200/min
- Häufig regelmäßiger Puls, ca. 150/min bei 2:1-Vorhofflattern
Auskultation
- Unregelmäßiger Rhythmus, Herzfrequenz kann höher sein als die Pulsfrequenz.
- Pathologische Herztöne?
- Variierende Intensität des 1. Herztons
Andere Umstände
- Allgemeinzustand?
- Blutdruck?
- Lungenstauung, Atemfrequenz?
- Halsvenenstauung, Leberstauung, periphere Ödeme?
Ergänzende Untersuchungen in der Hausarztpraxis
EKG bei Vorhofflimmern
- Keine sicheren P-Wellen, gewöhnlich nur eine unregelmäßige Basislinie zwischen den QRS-Komplexen
- Unregelmäßiger Ventrikelrhythmus
- Hinweise auf eine linksventrikuläre Hypertrophie, abgelaufene Herzinfarkte oder andere Leitungsstörungen
- EKG ‒ Checkliste
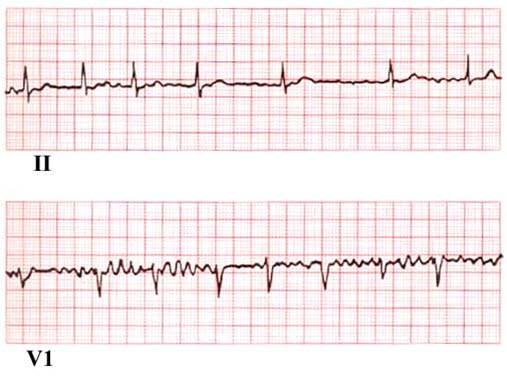
EKG bei Vorhofflimmern
EKG bei Vorhofflattern
- Flatterwellen, „Sägezahnmuster”, in der Grundlinie am besten in II und V1 zu erkennen.
- Bei 2:1-Vorhofflattern ist die Ventrikelfrequenz völlig regelmäßig, häufig ca. 150/min; die Flatterwellen können aber schwierig zu erkennen sein.
- Das Verhältnis zwischen Vorhof- und Ventrikelfrequenz kann zwischen 2:1, 3:1 und 4:1 variieren.
- Die Vorhoffrequenz ist 250–350/min.
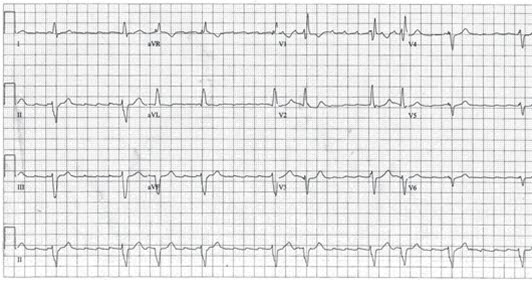
EKG bei Vorhofflattern
Blutuntersuchungen
Diagnostik bei Spezialist*innen
Echokardiografie
- Eine Echokardiografie sollte bei Patient*innen mit neu auftretendem Vorhofflimmern gemacht werden, u. a. um nach einer zugrunde liegenden Herzerkrankung zu suchen und das Risiko für ein Rezidiv nach einer Kardioversion zu beurteilen.
- Eine transösophageale Echokardiografie, um Vorhofthromben vor der Kardioversion auszuschließen10, ist erforderlich, wenn bei Patient*innen mit Vorhofflimmern von einer Dauer > 48 Stunden ohne vorherige, ausreichende Antikoagulation eine schnelle Kardioversion gemacht werden soll.
- Beim Nachweis von Vorhofthromben ist vorher eine 4- bis 6-wöchige Antikoagulation vor der Kardioversion notwendig.
- Eine Echokardiografie sollte auch durchgeführt werden, um mögliche zugrunde liegende Erkrankungen abzuklären (Vitium, Kardiomyopathie).
Evtl. Langzeit-EKG
- Bei einer klinisch-symptomatischen Arrhythmie, wenn das Ruhe-EKG aber keine Rhythmusstörung anzeigt.
- Um eine Frequenzvariation im Verlauf eines Tages zu bewerten.
- Um eine Tachykardie bei körperlichen Anstrengungen festzustellen.
- Bei Bedarf, um eine Verbindung zwischen Herzfrequenz und Symptomen festzustellen.
Belastungs-EKG
- Sollte erwogen werden:
- Zur Bewertung von Symptomen, die durch Aktivität ausgelöst werden.
- Wenn der Verdacht auf eine koronare Herzkrankheit besteht.
Elektrophysiologische Bewertung
- Bei Vorhofflimmern mit WPW-Syndrom oder anderen Formen der Präexzitation
- Bei Patient*innen, bei denen die Möglichkeit besteht, dass das Flimmern mit anderen intrakardialen Leitungsstörungen in Verbindung steht.
Indikationen zur Überweisung/Klinikeinweisung
- Nach dem ersten Auftreten des Vorhofflimmerns wird die Überweisung zu Spezialist*innen oder die Krankenhauseinweisung empfohlen.
- zur diagnostischen Abklärung
- zur Erörterung der Behandlungsstrategie (Frequenz- oder Rhythmuskontrolle)
- Die Dringlichkeit hängt von der Dauer der Anfälle und den Symptomen der Patient*innen ab.
- kurze Dauer der Anfälle (< 48 Stunden) und deutliche Symptome
- sofortige Einweisung zur schnellen Kardioversion
- Dauer der Anfälle > 48 Stunden und deutliche Symptome
- sofortige Einweisung zur Frequenzregulierung und Beurteilung einer evtl. Kardioversion
- Dauer der Anfälle > 48 Stunden und geringe Symptome
- Überweisung zur ambulant durchgeführten echokardiografischen Beurteilung
- Eine Kardioversion kann nach einer angemessenen Antikoagulationsbehandlung indiziert sein.
- kurze Dauer der Anfälle (< 48 Stunden) und deutliche Symptome
Checkliste zur Überweisung
Vorhofflimmern und -flattern
- Zweck der Überweisung
- Bestätigende Diagnostik? Therapieeinleitung oder Antikoagulation bereits begonnen?
- Anamnese
- Beginn und Dauer? Anhaltend, rezidivierend, evtl. Progression?
- Dauer der Anfälle? Evtl. auslösende Faktoren: Angst? Begleitende Symptome: Atembeschwerden, Brustschmerzen, Schwindel, Ohnmacht?
- Vorbestehende Krankheiten? Familiäre Prädisposition?
- Evtl. durchgeführte Behandlungsmaßnahmen und deren Wirkung?
- Medikation?
- Klinische Untersuchung
- Allgemeinzustand? Begleitsymptome?
- Blutdruck, Puls, Anzeichen von Stauung?
- Ergänzende Untersuchungen
Therapie
Therapieziele
- Symptome und Belastung des Herzens durch Frequenz- oder Rhythmuskontrolle verringern.
- Das Risiko für Thromboembolien und Schlaganfall vermindern.
Allgemeines zur Therapie
- Grundsätzlich sollten immer mögliche zugrunde liegende oder auslösende Ursachen behandelt werden.
- Elektrolytstörungen, Hypovolämie, Infektion, Hyperthyreose
- arterielle Hypertonie
- symptomatische Herzinsuffizienz (NYHA-Klassen II–IV)
- Herzklappenerkrankungen
- Kardiomyopathien
- angeborene Herzfehler
- koronare Herzerkrankung
- Diabetes mellitus
- chronisch obstruktive Lungenerkrankung (COPD) und Schlafapnoe
- chronische Niereninsuffizienz
- Zusätzlich wird eine rhythmus- oder frequenzregulierende Strategie – prognostisch gleichwertig – gewählt.
- Es kann zunächst – z. B. abhängig von der Schwere der Symptome – versucht werden, den Sinusrhythmus mit einer rhythmusregulierenden Behandlung wiederherzustellen und dann zu stabilisieren.
- In vielen Fällen kann die Rhythmuskontrolle langfristig nicht erzielt werden. Dies erfordert dann ein Umschwenken auf die frequenzregulierende Strategie.
- Je nach Alter und Vorerkrankungen kann aber auch von Anfang an eine Frequenzkontrolle sinnvoll sein.
- Vorhofflimmern und -flattern werden auf die gleiche Weise behandelt, von einzelnen Ausnahmen abgesehen.
- Das Schlaganfallrisiko ist bei Vorhofflattern mindestens genauso groß wie bei Vorhofflimmern.15
Welche Form von Vorhofflimmern bzw. -flattern liegt vor?
- Neu auftretend (Dauer)
- Paroxysmal: Geht von alleine vorüber, in der Regel innerhalb von 48 Stunden.
- Persistierend: Dauer länger als 7 Tage oder durch Kardioversion beendet
- Permanent: Dauer 1 Jahr oder länger, wenn eine Rhythmuskontrolle nicht länger indiziert ist.
Therapiemöglichkeiten
Antikoagulation
- Die meisten Patient*innen mit nachgewiesenem Vorhofflimmern sollen beraten werden auf Grundlage von CHA2D2Vasc und Has-Bled-Score – beide z. B. in ARRIBA eingebaut.
- Die Antikoagulation erfolgt unabhängig davon, ob es sich um ein neu aufgetretenes, paroxysmales, persistierendes oder permanentes Vorhofflimmern handelt.
- Bei klappenbedingtem (valvulärem) Vorhofflimmern ist nur Warfarin bzw. Phenprocoumon zugelassen.
- Von valvulärem Vorhofflimmern wird nur bei Vorliegen einer mittelschweren bis schweren Mitralstenose und/oder einer mechanischen Herzklappenprothese gesprochen.
- Bei nichtvalvulärem Vorhofflimmern sind als Alternative zu Warfarin bzw. Phenprocoumon auch neue orale Antikoagulanzien zugelassen.16
- Thrombinhemmer: Dabigatran
- Faktor Xa-Hemmer: Rivaroxaban, Edobaxan, Apixaban
- Von nichtvalvulärem Vorhofflimmern spricht man bei allen Patient*innen, auch solchen mit anderen Herzklappenerkrankungen, außer bei Patient*innen mit mittelschweren bis schweren Mitralstenose und/oder einer mechanischen Herzklappenprothese.
Frequenzkontrolle
- Medikamente, die die Herzfrequenz (Ventrikelfrequenz) verringern.
- Indizierte Medikamente
-
- Betablocker, z. B. Metoprolol, sind 1. Wahl.
- Non-Dihydropyridin-Kalziumantagonisten (Verapamil oder Diltiazem) sind Alternativen zur Frequenzkontrolle bei Patient*innen, die nicht an Herzinsuffizienz leiden.
- Cave: Bei Kombination von Betablocker und Verapamil Gefahr eines AV-Blocks!
- Amiodaron: Ermöglicht die wirksame Frequenzkontrolle bei permanentem Vorhofflimmern, hat aber zahlreiche Nebenwirkungen und ist deshalb nur ein Reservemittel.
- Digoxin: Nur in Ausnahmefällen einsetzen. Senkt Kammerfrequenz in Ruhe, nicht aber unter Belastung. Regelmäßige Blutspiegelkontrolle notwendig.
- Die Datenlage zur Sicherheit und Wirksamkeit von Digoxin bei Vorhofflimmern/-flattern ist mangelhaft, und es wurde eine Assoziation mit einer erhöhten Mortalität bei Erstverordnung und in Abhängigkeit vom Serumspiegel beobachtet.17-18
Rhythmusregulierung
- Kardioversion zur Beendigung des Vorhofflimmerns, evtl. gefolgt von Medikamenten, die einem neuen Anfall vorbeugen.
- Rhythmusregulierung ist besonders indiziert bei jungen Patient*innen und beim ersten Auftreten bzw. Rezidiv eines paroxysmalen Vorhofflimmerns.
- Kardioversion des Vorhofflimmerns
- medikamentöse oder elektrische Kardioversion
- Setzt eine Anfallsdauer von < 48 Stunden voraus oder eine angemessene Antikoagulationsbehandlung (INR > 2,0) in den letzten 3 Wochen oder eine transösophageale Echokardiografie, die Thromben im linken Vorhof ausschließt.
- Anfallsprophylaxe
- Die zugrunde liegenden Erkrankungen behandeln.
- Die Wahl evtl. anfallsprophylaktischer Medikamente hängt u. a. von der Komorbidität und dem Grad der Symptome ab.
- Alle indizierten Medikamente haben in unterschiedlichem Maß das Risiko, schwere ventrikuläre Arrhythmien (proarrhythmische Wirkung) auszulösen. Die Wahl einer anfallsprophylaktischen Behandlung sollte deshalb in Abstimmung mit den oder bei Kardiolog*innen erfolgen.19
- indizierte Medikamente
- Flecainid: Ist bei struktureller Herzerkrankung, Herzinsuffizienz, Koronarerkrankung kontraindiziert.
- Sotalol: nicht indiziert bei struktureller Herzerkrankung oder Herzinsuffizienz
- Amiodaron: Kann den Sinusrhythmus stabilisieren, hat aber zahlreiche Nebenwirkungen. 1. Wahl bei struktureller Herzerkrankung, Herzinsuffizienz oder Koronarerkrankung.
- Dronedaron: nicht indiziert bei struktureller Herzerkrankung; viele Einschränkungen, zahlreiche Wechselwirkungen und UAW
- Betablocker: Haben eine begrenzte anfallsprophylaktische Wirkung, können aber nützlich sein, wenn das Vorhofflimmern durch Stress ausgelöst wird.
- Die katheterbasierte Ablationsbehandlung (Radiofrequenz- bzw. Kryoablation) ist eine Alternative, um einem neuen Anfall mit Vorhofflimmern vorzubeugen, insbesondere bei hohem Leidensdruck und wenn die Symptomatik mit mindestens einem Klasse-I- und Klasse-III-Antirhythmikum nicht ausreichend gebessert werden kann.
- Viele Fragen zu dieser Option sind noch ungeklärt.
Insbesondere scheint es so zu sein, dass die Katheterablation der konservativen Therapie nicht überlegen ist. Zudem gibt es noch keine Daten über einen Zeitraum von 6 Jahren hinaus.20 - Auch sind die Daten aus den Studien nicht so ohne Weiteres auf die reale Versorgungslandschaft übertragbar, da natürlich die Ergebnisse entscheidend von der Qualität der Intervention abhängig sind.
- Viele Fragen zu dieser Option sind noch ungeklärt.
- Eine Empfehlung für den Vorhofohrverschluss kann wegen nicht ausreichender Datenlage nicht gegeben werden.
Neu aufgetretenes Vorhofflimmern
Allgemeines
- Die Behandlungsstrategie bei neu aufgetretenem Vorhofflimmern hängt davon ab, ob der Anfall kürzer oder länger als 48 Stunden gedauert hat (Grenze für Kardioversion bei Patient*innen, die nicht antikoaguliert werden), und von den Symptomen der Patient*innen.
- Wenn das Flimmern weniger als 48 Stunden angedauert hat, kann die Kardioversion ohne vorhergehende orale Antikoagulationsbehandlung erfolgen.
- Wenn das Flimmern länger als 48 Stunden angedauert hat, sollten die Patient*innen 3 Wochen vor der Kardioversion und mindestens 4 Wochen nach der Kardioversion eine angemessene orale Antikoagulationsbehandlung bekommen (INR > 2,0 bei Warfarin/Phenprocoumon).
- Kardioversion kann ohne vorhergehende Antikoagulation erfolgen, wenn mit einer Ösophagus-Echokardiografie ein arterieller Thrombus im Vorhof ausgeschlossen wurde.
- Die Patient*innen, die hämodynamisch instabil sind, sollten schnell eine elektrische Kardioversion bekommen, auch bei einer Anfallsdauer > 48 Stunden.
- Bei den meisten Patient*innen ist eine lebenslange Antikoagulationstherapie angeraten (Details siehe Abschnitt Antikoagulationsbehandlung).
Behandlung von Vorhofflimmern mit Dauer < 48 Stunden
- Patient*innen mit Vorhofflimmern/-flattern mit einer Dauer < 48 Stunden können ohne vorhergehende Antikoagulation eine Kardioversion bekommen.
- Eine aktuelle Studie kommt zu dem Schluss, dass es als sicher angesehen werden kann, bei hämodynamisch stabilen Patient*innen ein spontanes Umspringen in den Sinusrhythmus bis zu 48 Stunden nach Beginn von Vorhofflimmern abzuwarten.21
- Im Anschluss an die Kardioversion wird bei Patient*innen mit einem erhöhten thromboembolischen Risiko zunächst niedermolekulares Heparin und der Beginn mit einer oralen Antikoagulation (Warfarin/Phenprocoumon) empfohlen. Bei Erreichen des Ziel-INR (> 2,0) wird das niedermolekulare Heparin abgesetzt.
- Wenn vor der Kardioversion eine Frequenzreduktion notwendig ist:
- Betablocker sind die 1. Wahl, z. B. Metoprolol i. v.
- Non-Dihydropyridin-Kalziumantagonisten (Verapamil oder Diltiazem) sind Alternativen zur Frequenzkontrolle bei Patient*innen, die nicht an Herzinsuffizienz leiden.
- Amiodaron ist eine gute Alternative für Patient*innen mit Hypotonie oder Herzinsuffizienz.
- 300 mg i. v. über 15–30 min, evtl. gefolgt von einer Infusion 1.000 mg über die folgenden 24 Stunden
- Die Wahl der Kardioversionsmethode hängt u. a. vom klinischen Zustand der Patient*innen, der Hämodynamik und der Anamnese ab. Prinzipielle Einteilung (Details s. u.):
- medikamentöse Kardioversion, mehrere Alternativen
- elektrische Kardioversion unter Kurznarkose.
Behandlung von Vorhofflimmern mit Dauer > 48 Stunden
- Bei einer Anfallsdauer > 48 Stunden sollten die Patient*innen mindestens 3 Wochen lang eine angemessene Antikoagulation bekommen. Andernfalls sollten vor der Kardioversion arterielle Thromben durch eine Ösophagus-Echokardiografie ausgeschlossen werden.
- Eine frequenzregulierende Behandlung ist häufig notwendig.
- Betablocker sind die 1. Wahl, evtl. Non-Dihydropyridin-Kalziumantagonisten (Verapamil oder Diltiazem) bei Patient*innen ohne Herzinsuffizienz.
- Im Ruhezustand sollte eine Herzfrequenz von < 110/min erreicht werden, geringer bei Patient*innen mit Herzinsuffizienz.
Medikamentöse Kardioversion (stationäre Behandlung)
- Ist bei hämodynamisch stabilen Patient*innen indiziert.
- Wenn das Vorhofflimmern weniger als 7 Tage gedauert hat, kann man bei bis zu 95 % der Patient*innen mit einer medikamentösen Behandlung innerhalb von 24 Stunden einen Umschlag des Sinusrhythmus erreichen.22
- Bei mehr als 7 Tagen Dauer ist dies nur in 15–40 % der Fälle erfolgreich.
- Flecainid
- 1. Wahl, wenn zusätzliche keine weitere Herzkrankheit besteht (eine stabile KHK ist keine Kontraindikation), eine Echokardiografie sollte im Vorfeld gemacht werden.
- 4 mg/kg p. o., max. 300 mg (alternativ Infusion 50–150 mg i. v. über 10–30 min)
- Amiodaron
- 1. Wahl bei anderen Herzkrankheiten
- 300 mg i. v. über 15–30 min, gefolgt von einer Infusion 1.000 mg in den folgenden 24 Stunden
Elektrische Kardioversion
- Indikationen
- bei drohendem kardiogenem Schock (Ischämie, Hypotonie, Insuffizienz) als Folge von Vorhofflimmern
- bei Vorhofflimmern und verbreitertem QRS-Komplex mit Verdacht auf Präexzitation
- als Alternative zur medikamentösen Kardioversion
- bei misslungenem Versuch einer medikamentösen Kardioversion
- Bei Unsicherheit darüber, welche Art Tachyarrhythmie vorliegt.
- Wird nüchtern in intravenöser Anästhesie durchgeführt, meist Propofol.
Paroxysmales Vorhofflimmern
Allgemeines
- Folgende Entscheidungen müssen getroffen werden:
- Kardioversion eines akuten Anfalls?
- Anfallsprophylaktische Behandlung; Medikamente oder Ablationsbehandlung?
- Frequenzregulierende Behandlung?
- Bedarf einer Antikoagulation?
- Viele Patient*innen mit Vorhofflimmern haben kurz andauernde Anfälle mit unterschiedlich starken Symptomen.
- Es besteht eine hohe Tendenz zur spontanen Kardioversion.
- Eine evtl. zugrunde liegende Erkrankung, z. B. Herzinsuffizienz, sollte optimal behandelt werden.
Kardioversion von paroxysmalem Vorhofflimmern?
- Das Vorgehen bei Beschwerden auslösenden Symptomen oder bei Anfällen, die länger als einen Tag andauern, wird im Abschnitt Neu aufgetretenes Vorhofflimmern beschrieben.
- Folgende Voraussetzungen schränken den Erfolg einer Kardioversion ein (wegen des erhöhten Rezidivrisikos):
- Personen, die älter als 75 Jahre sind.
- Herzinsuffizienz NYHA-Klasse III–IV
- Dauer über 3 Jahre
- großer linker Vorhof
- wiederholter früherer Versuch.
Medikamentöse Behandlung
Anfallsprophylaktische Behandlung
- Wird bei Beschwerden auslösenden Symptomen und beim Wunsch, den Sinusrhythmus zu stabilisieren, erwogen.
- Die Wahl der Behandlung hängt u. a. von der Komorbidität und den Symptomen ab:
- bei Patient*innen ohne Koronarerkrankung, Herzinsuffizienz oder anderen Herzerkrankungen
- Flecainid: 50‒150 mg x 2 tgl.
- Sotalol: 40‒150 mg x 2 tgl.
- Dronedaron: 400 mg x 2 tgl. (nur mäßig effektiv)
- bei Herzinsuffizienz, mangelnder Wirkung oder Nebenwirkungen der oben aufgezählten Medikamente
- Amiodaron: 200 mg x 3 tgl. 1 Woche lang, 200 mg x 2 tgl. über 1 Woche, danach 200 (evtl. 100) mg als Erhaltungsdosis
- bei Patient*innen ohne Koronarerkrankung, Herzinsuffizienz oder anderen Herzerkrankungen
Frequenzkontrollierende Behandlung
- Wird zusätzlich zur evtl. anfallsprophylaktischen Behandlung empfohlen, um eine schnelle Ventrikelfrequenz bei einem neuen Anfall zu vermeiden.
- Betablocker sind die 1. Wahl, alternativ Non-Dihydropyridin-Kalziumantagonisten bei Patient*innen, die keine Herzinsuffizienz haben.
Radiofrequenzablation
- Gut dokumentierte Wirkung bei Patient*innen mit symptomatisch paroxysmalem Vorhofflimmern, wenn die Behandlung mit Antiarrhythmika keine Wirkung gezeigt hat.22
- Eine Studie zeigt keinen signifikanten Unterschied für das Vorkommen von Vorhofflimmern bei einer primären Ablation im Vergleich zur medikamentösen Arrhythmieprophylaxe.23
- Eine andere Studie zeigt einen Rückfall bei 34 % der Patient*innen innerhalb von 9 Monaten nach der Ablation im Vergleich zu 84 % Rezidiv bei Personen, die mit einem Antiarrhythmikum behandelt wurden.24
- Laut einer methodisch guten RCT mit 2.204 Patient*innen führt eine Ablation nicht zu einer signifikanten Reduktion eines zusammengesetzten Endpunktes (aus Tod, Schlaganfall mit bleibenden neurologischen Defiziten, schwerer Blutung, Klinikaufenthalt wegen kardiovaskulärer Erkrankung oder Rezidiv des Vorhofflimmerns) im Vergleich mit medikamentöser Behandlung.25
- Die Ablation führte zu einer signifikanten und klinisch relevanten Besserung der subjektiven Lebensqualität 12 Monate nach dem Eingriff.26
- Indikationen
- paroxysmales oder persistierendes Vorhofflimmern und ausgeprägte Symptome trotz fehlender Wirkung nach mindestens einem Versuch mit medikamentöser Behandlung
- Rezidiv nach medikamentöser Behandlung
- Patient*innen unter 70 Jahren, die keine andere zugrunde liegende Herzkrankheit haben.
- Indiziert für Patient*innen mit linksventrikulärer Dysfunktion, wenn die Ablation für eine langfristige Verbesserung der systolischen Funktion sorgen kann.27
- Die Lungenvenenisolation (Katheterablation) ist die am häufigsten angewandte Methode.28
- Der Grund dafür ist, dass elektrische Signale aus Foci in den Muskelfasern an der Einmündung der Lungenvene Flimmerepisoden auslösen.
- Diese Herde können identifiziert und mit Radiowellenenergie vom linken Vorhof isoliert werden.
- Ist bei ausgesuchten Patient*innen häufig primär erfolgreich mit einem relativ geringen Komplikationsrisiko (3 %).29
- In einer norwegischen Studie erreichten 61 % Symptomfreiheit. Es besteht aber ein Rezidivrisiko von 30–50 % während des 1. Jahres.30
- Komplikationen wie Herztamponade, Gehirnembolie und Lungenvenenstenose kommen vor, sind aber selten.
- Es kann i. d. R. nicht auf eine Antikoagulation verzichtet werden.
- Katheterablation des AV-Knotens/His-Bündels
- Insbesondere bei Patient*innen mit permanentem Vorhofflimmern indiziert, wenn eine angemessene Herzfrequenzkontrolle nicht mit Medikamenten erreicht werden kann.
- In einigen Fällen auch bei ausgesprochen symptomatischem paroxysmalem/persistierendem Vorhofflimmern, wenn eine andere Ablation nicht möglich ist.
- Die Patient*innen bleiben lebenslang auf einen Herzschrittmacher angewiesen. Das Vorhofflimmern bleibt bestehen, aber die Ventrikelfrequenz wird durch den Schrittmacher reguliert.
- Veröden der Reentry-Bahnen im rechten Vorhof
- indiziert bei Vorhofflattern
Persistierendes oder permanentes Vorhofflimmern
Regulierung der Ventrikelfrequenz
- Bei den meisten Patient*innen wird eine frequenzregulierende Behandlung gewählt.
- Es besteht kein prognostischer Unterschied zwischen dem Versuch der Sinusrhythmuskontrolle („Rhythmusstrategie”) oder der Frequenzkontrolle mit ständigem Vorhofflimmern („Frequenzstrategie”).
- Frühere Studien konnten im Vergleich zur Frequenzkontrolle keine Unterschiede beim Vorkommen von ischämischen Schlaganfällen, Gehirnblutungen oder plötzlichem Herztod nachweisen und auch keinen Unterschied in der Lebensqualität feststellen.31-32
- Eine neue Beobachtungsstudie (2012) zeigt bei der Rhythmusregulierung ein geringeres Vorkommen von Schlaganfällen und TIA als bei der Frequenzregulierung (II).33
- Eine weitere Beobachtungsstudie stellt während der ersten 4 Jahre keinen Unterschied bei der Mortalität zwischen Rhythmus- und Frequenzkontrolle fest, später besteht aber ein kleiner Vorteil bei der Rhythmuskontrolle (II).34
- Ein Cochrane-Review zeigt die gleiche Mortalität und eine bessere Lebensqualität bei der Rhythmuskontrolle im Vergleich zur Frequenzkontrolle (Ia)35, während eine andere Studie den annähernd gleichen funktionellen Status nach Rhythmus- oder Frequenzbehandlung zeigt.36
- Neue Studien zeigen, dass das Behandlungsziel von einem Ruhepuls mit 110 Schlägen pro Minute im Vergleich zur strengeren Frequenzkontrolle nicht zu erhöhtem Todesrisiko, komplizierenden Herzkrankheiten oder erhöhter Symptombelastung führt.2
- Bei andauernden Symptomen oder Anzeichen von Herzinsuffizienz werden eine strengere Frequenzkontrolle des Ruhepulses mit unter 80 Schlägen pro Minute und ein Puls von 110 Schlägen pro Minute bei mäßiger Anstrengung angestrebt.
- Es besteht kein prognostischer Unterschied zwischen dem Versuch der Sinusrhythmuskontrolle („Rhythmusstrategie”) oder der Frequenzkontrolle mit ständigem Vorhofflimmern („Frequenzstrategie”).
- Betablocker sind die 1. Wahl.
- z. B. Metoprolol 50–200 mg x 1 tgl.
- Amiodaron: Kann eine Alternative bei schnellem Vorhofflimmern und Herzinsuffizienz sein.
- Laut Fachinformation: „Als Sättigungsdosis 8–10 Tage lang 600 mg Amiodaronhydrochlorid (entsprechend 3 Tabletten Amiodaron 200) pro Tag.
- Anschließend Reduzierung auf eine Erhaltungsdosis, die im Allgemeinen 200 mg Amiodaronhydrochlorid (entsprechend 1 Tablette Amiodaron 200) während 5 Tagen pro Woche beträgt."
- Die Amiodaron-Behandlung wird in der Regel stationär begonnen und bedarf einer aufmerksamen Kontrolle der potenziellen unerwünschten Arzneimittelnebenwirkungen.
- Digoxin ist eine Alternative bei Herzinsuffizienz, sollte aber nur noch ein Ausnahmefällen eingesetzt werden, da es in einer neueren Studie zu einer vermehrten Sterblichkeit unter Digoxin gekommen ist (AFFIRM-Studie).37
- Bei Patient*innen ohne Herzinsuffizienz können Non-Dihydropyridin-Kalziumantagonisten eine Alternative sein: Verapamil: 80–120 mg x 3 tgl. evtl. dep. 120‒240 mg x 2 tgl.
- Bei den meisten Patient*innen ist eine lebenslange Antikoagulationstherapie notwendig.
Antikoagulationsbehandlung, Allgemeines
- Weiterführende Informationen siehe Artikel Antikoagulation.
- Ist die wichtigste Behandlung, um das Schlaganfallrisiko zu verringern.38
- Phenprocoumon/Warfarin (Vitamin-K-Antagonist)
- Hat eine gut dokumentierte, vorbeugende Wirkung gegen Schlaganfall sowohl bei valvulärem als auch bei nichtvalvulärem Vorhofflimmern.39
- valvuläres Vorhofflimmern: bei Patient*innen mit einer künstlichen Herzklappe, Mitralklappenstenose oder Herzinsuffizienz aufgrund eines Klappenfehlers
- Bei einer Antikoagulation mit Vitamin-K-Antagonisten wegen Vorhofflimmerns sollte laut DEGAM-Empfehlung in der Regel eine Ziel-INR von 2–3 angestrebt werden.40
- Hat eine gut dokumentierte, vorbeugende Wirkung gegen Schlaganfall sowohl bei valvulärem als auch bei nichtvalvulärem Vorhofflimmern.39
- Antikoagulation mit Vitamin-K-Antagonisten (VKA) ist deutlich besser als Clopidogrel + ASS, um vaskulären Ereignissen bei Patient*innen mit einem erhöhten Schlaganfallrisiko vorzubeugen (Ib).41
- Nach Schlaganfall oder TIA bei nichtvalvulärem Vorhofflimmern soll eine orale Antikoagulation einer dualen Thrombozytenfunktionshemmung (DAPT) vorgezogen werden (Ia/A).42
- Bei der Entscheidung für eine Antikoagulationsbehandlung soll zwischen Nutzen (thromboembolischen Ereignissen vorbeugen) und Risiko (Blutungsrisiko aufgrund der Behandlung) abgewogen werden. Die Entscheidung sollte durch den Einsatz etablierter Risikokalkulatoren gefällt werden.40
- CHA2DS2-VASc–Score: Berechnet das Risiko für thromboembolische Ereignisse.
- Das jährliche Schlaganfallsrisiko liegt bei einem CHA2DS2-VASc–Score von 2 zwischen 1,5–2,2 % (im Vergleich: 0,2–0,4 % bei Score 0).43
- Siehe Tabelle CHA2DS2-VASc-Score.
- HAS-BLED–Score: Berechnet das Blutungsrisiko.
- Siehe Tabelle HAS-BLED-Risiko-Score.
- Interpretation und Risikoeinschätzung anhand von CHA2DS2-VASc-Score und HAS-BLED-Score, siehe Abschnitt Antikoagulationsbehandlung: risikoadaptiertes Vorgehen.
Leitlinie: Hausärztliche Risikoberatung zur kardiovaskulären Prävention40
Absolutes kardiovaskuläres Risiko
- In der Primärprävention soll das globale, absolute kardiovaskuläre Risiko als vorrangige Entscheidungsgrundlage dienen.
- Zur Kalkulation des kardiovaskulären Risikos soll ein evaluierter Risiko-Algorithmus verwandt werden.
- Für die hausärztliche Versorgungsebene sollte zur Berechnung des Risikos der ARRIBA-Rechner angewandt werden (ARRIBA = absolute und relative Risikoreduktion: individuelle Beratung in der Hausarztpraxis).
Empfehlung zum Einsatz von Gerinnungshemmern
- Hochrisikopatient*innen (kardiovaskuläres Gesamtrisiko > 20 % in 10 Jahren) sollte ASS 75–100 mg angeboten werden.
- Bei einem Risiko < 10 % sollte ASS nicht eingesetzt werden.
- ASS sollte nicht eingesetzt werden, wenn der Blutdruck unkontrolliert erhöht ist (> 180 mmHg systol.).
- Clopidogrel sollte nur bei ASS-Unverträglichkeit eingesetzt werden.
- Eine duale Plättchenhemmung soll in der Primärprävention nicht eingesetzt werden.
- Bei Vorhofflimmern soll mit den Patient*innen das Schlaganfall-Risiko und das Risiko einer die Blutgerinnung hemmenden Therapie anhand eines validierten Risiko-Scores (z. B. CHA2D2Vasc) besprochen werden.
- Bei einer Antikoagulation mit Vitamin-K-Antagonisten wegen Vorhofflimmerns sollte eine Ziel-INR von 2–3 angestrebt werden.
Neue orale Antikoagulanzien (NOAK)
- In Interventionsstudien sind die neuen Antikoagulationsmittel in ihrer Wirkung beim Schutz vor Schlaganfällen bei Patient*innen mit nichtvalvulärem Vorhofflimmern Warfarin nicht unterlegen.44-49
- In neueren Publikationen ergeben sich Hinweise auf eine erhöhte ischämische Schlaganfallrate (Apixaban oder alle NOAK) und eine höhere Mortalität (Apixaban und Rivaroxaban oder für alle NOAK).50
- Ursache könnte auch eine unzureichende Dosierung der NOAK sein.
- Auf nicht angezeigte Dosisreduktionen sollte verzichtet werden.
- Wenn mit einem Vitamin-K-Antagonisten (wie Phenprocoumon/Warfarin) keine stabile INR-Einstellung, die nicht durch mangelnde Adhärenz verursacht ist, erreicht werden kann, oder es zu Unverträglichkeiten oder starken Wechselwirkungen mit anderen Medikamenten kommt, kann ein NOAK eingesetzt werden.
- Nach aktueller Datenlage gibt es aus Sicht der DEGAM und der AkdÄ keine Vorteile in Bezug auf Vorbeugung von thrombembolischen Ereignissen bei Vorhofflimmern im Vergleich zu Vitamin-K-Antagonisten.51
- Im Leitfaden der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) finden Sie eine ausführliche Beschreibung der NOAK.16
- Die aktuelle ESC-Leitlinie (Europäischen Gesellschaft für Kardiologie) spricht eine eindeutige Präferenz zugunsten von NOAK gegenüber Vitamin-K-Antagonisten aus.3,52
- Nach aktueller Datenlage gibt es aus Sicht der DEGAM und der AkdÄ keine Vorteile in Bezug auf Vorbeugung von thrombembolischen Ereignissen bei Vorhofflimmern im Vergleich zu Vitamin-K-Antagonisten.51
- Alle neuen Antikoagulanzien (NOAK) sind bei nichtvalvulärem Vorhofflimmern zur Vorbeugung von Schlaganfällen und systemischen Embolien zugelassen.
- Rivaroxaban, direkter Faktor-Xa-Hemmer
- 20 mg x 1
- bei GFR 15–49 ml/min: 15 mg x 1
- Apixaban, direkter Faktor-Xa-Hemmer
- 5 mg x 2
- Dosisanpassung
- nicht erforderlich bei mäßiger Nierenfunktionseinschränkung (CrCl 30–50 ml/min). Siehe auch Leitlinienkasten.16
- Bei GFR 15–29 ml/min oder 2 der Folgenden: ≥ 80 Jahre, ≤ 60 kg, Kreatinin ≥ 133 µmol/l (≥ 1,5 mg/dl) beträgt die Dosis 2,5 mg x 2.
- Dabigatran, direkter Thrombinhemmer
- 150 mg x 2
- Bei ≥ 75- bis 80-Jährigen, bei gleichzeitiger Einnahme von Verapamil oder bei GFR 30–50 ml/min beträgt die Dosis 110 mg x 2.
- Die Dosis von 110 mg x 2 ist auch zu erwägen bei Patient*innen > 75 Jahre, bei Patient*innen mit erhöhtem Blutungsrisiko, bei Patient*innen mit Gastritis, Ösophagitis oder gastroösophagealem Reflux, bei Patient*innen mit mäßig beeinträchtigter Nierenfunktion (Kreatinin-Clearance 30–50 ml/min), bei Komedikation mit Acetylsalicylsäure, Clopidogrel oder NSAR und bei Patient*innen, bei denen mithilfe eines Gerinnungstests im Talspiegel eine erhöhte Dabigatran-Exposition festgestellt wurde.
- Bei chronischen Nierenerkrankungen ist wegen des erhöhten Blutungsrisikos Vorsicht geboten.48
- Edobaxan, direkter Xa-Hemmer
- 60 mg x 1 tgl.
- bei GFR 15–49 ml/min: 30 mg x 1 tgl.
- bei Körpergewicht < 60 kg: 30 mg x 1 tgl.
- Bei hoher Kreatinin-Clearance Anwendung laut Fachinformation empfohlen „nur nach sorgfältiger Bewertung des individuellen Thromboembolie- und Blutungsrisikos“.
- Kontraindikationen und Vorsichtsmaßnahmen34,39
- Sollten nicht gegeben werden bei:
- mechanischer Herzklappe
- valvulärem Vorhofflimmern (künstlicher Herzklappe, Mitralklappenstenose oder Herzinsuffizienz aufgrund eines anderen Klappenfehlers)
- Schwangerschaft/Stillen
- aktiven Blutungen
- Malignom-Patient*innen mit akuter Venenthrombose
- schwerem Nierenversagen (GFR < 15 ml/min), Dialyse
- verminderter Leberfunktion mit Koagulopathie (Child-Pugh C, bei Rivaroxaban schon bei Child-Pugh B).
- Vorsicht bei:
- Dosisreduktion bei Patient*innen über 80 Jahre
- Verdacht auf schlechte Adhärenz/Compliance
- komorbiden Zuständen, die das Blutungsrisiko erhöhen, wie verminderte Nieren- oder Leberfunktion, Thrombozytopenie, Alkoholismus.
- Kontrollen vor Behandlungsbeginn: Hb, Thrombozyten, Leberenzyme, Bilirubin, Kreatinin und INR
- Sollten nicht gegeben werden bei:
- Immer mögliche Interaktionen überprüfen.
- Möglichst nicht Medikamente verabreichen, die P-pg oder CYP3A4 hemmen oder stimulieren.
- Enzymhemmer erhöhen die Blutungsgefahr, z. B. Amiodaron, Verapamil, Ketoconazol, Clarithromycin, Erythromycin, HIV-Medikamente.
- Induktoren vermindern die Wirkung, z. B. Rifampicin, Johanniskraut, Carbamazepin, Phenytoin.
- Neue orale Antikoagulanzien sollten generell nicht mit Plättchenhemmern, NSAR oder anderen Antikoagulanzien kombiniert werden.
- Patienteninformationen: Den Patient*innen einen Ausweis mit Informationen über die Dosis und Indikation, Begleitmedikation und Laborkontrollen aushändigen.53
- Behandlung: Eine regelmäßige Tabletteneinnahme sicherstellen, da sonst die Antikoagulation nicht sichergestellt ist.
- Über Kontraindikationen und die Möglichkeit von Interaktionen informieren.
- Für Patient*innen unter chronischer NOAK-Therapie bei Vorhofflimmern wird von der EHRA (European Heart Rhythm Association) ein strukturiertes Follow-up empfohlen.54Darin sollten folgende Maßnahmen enthalten sein:
- Dokumentation der Indikation für die Antikoagulation
- Überprüfung eines Basislabors mit Hb-Wert, Leber- und Nierenfunktionsparametern und Gerinnungsstatus
- Patienteninformation/-schulung
- mindestens jährliche Laborkontrollen der Basislaborwerte
- häufigere Kontrollen bei Patient*innen mit eingeschränkter Nierenfunktion oder bei älteren Menschen (alle 3–6 Monate).
- Alter ist per se kein Grund für Dosisreduktion. Zu beachten ist allerdings die im Alter häufig eingeschränkte Nierenfunktion.
Präferenz für Vit-Antagonist bzw. NOAK bei nichtvalvulärem Vorhofflimmern in verschiedenen Leitlinien
- In den ESC-Guidelines 2016 Präferenz für NOAK gegenüber Vit-K-Antagonisten bei Behandlungsbeginn3
- In den DEGAM-Empfehlungen 2013 wurden noch Vit-K-Antagonisten als Standard empfohlen, NOAK hingegen nur als Option für Patient*innen, bei denen Vit-K-Antagonisten nicht infrage kommen.51
- Auch die AkdÄ (Arzneimittelkommission der deutschen Ärzteschaft) vertrat zunächst diese Position.
- Aktuell unterstützt die DEGAM die im AkdÄ-Leitfaden 2019 modifizierte Position, dass zur Antikoagulation neben dem Einsatz eines Vit-K-Antagonisten auch die Anwendung eines NOAK vertretbar ist.16
- Die Entscheidung für Vit-K-Antagonist oder NOAK sollte sich ebenso wie die Auswahl des NOAK richten nach:16
- der klinischen Gesamtsituation
- Begleiterkrankungen
- Komedikation
- Präferenz der Patient*innen.
Empfehlungen der AkdÄ zur oralen Antikoagulation bei nichtvalvulärem Vorhofflimmern (von der DEGAM unterstützt)16
Nicht eingesetzt werden sollten NOAK statt VKA bei Patient*innen
- deren INR unter bereits bestehender Therapie mit VKA stabil im therapeutischen Bereich liegt (INR > 70 % der Zeit im therapeutischen Bereich).
- mit unsicherer Adhärenz.
- mit einem hohen Risiko für gastrointestinale Blutungen.
- mit schwerer Nierenfunktionseinschränkung (CrCl < 30 ml/min).
- im Fall von Edoxaban mit einer normalen Nierenfunktion (laut FDA bei CrCl > 95 ml/min nicht zugelassen)
- die Arzneimittel einnehmen, für die als Inhibitoren oder Induktoren von Cytochrom-P450-3A4 (CYP3A4) und P-Glykoprotein (P-gp) Wechselwirkungen beschrieben sind, sodass laut Fachinformationen eine gleichzeitige Behandlung kontraindiziert ist oder vermieden werden sollte (darunter Dronedaron, Amiodaron, Verapamil, Clarithromycin, HIV-Proteaseinhibitoren, Azol-Antimykotika, Ciclosporin, Carbamazepin, Hypericin).
- mit einem Antiphospholipid-Syndrom, das die Kriterien eines Hoch-Risiko-Profils erfüllt, wegen des erhöhten Risikos für rezidivierende thrombotische Ereignisse; bei Patient*innen mit einem Antiphospholipid-Syndrom, das die Kriterien eines Hoch-Risiko-Profils nicht erfüllt, sollte der Einsatz von NOAK in jedem Einzelfall kritisch geprüft werden.
- mit linksventrikulären Thromben.
- mit künstlichen Herzklappen (mit mechanischem und biologischem Herzklappenersatz).
Nur nach eingehender Prüfung sollten NOAK statt VKA angewendet werden bei
- mäßiger Nierenfunktionseinschränkung (CrCl 30–50 ml/min: Dosisreduktion erforderlich bei Dabigatran, Edoxaban, Rivaroxaban, nicht bei Apixaban).
- zusätzlicher Indikation für eine einfache und vor allem für eine duale Thrombozytenaggregationshemmung.
- Multimedikation (≥ 5 Arzneimittel): klinisch relevante Wechselwirkungen zwischen anderen Arzneimitteln und NOAK sind bisher nur eingeschränkt bekannt und können wegen der fehlenden Möglichkeit von Laborkontrollen nicht erfasst werden.
NOAK statt VKA sollten eingesetzt werden bei Patient*innen
- mit einem hohen Risiko für intrazerebrale Blutungen, wenn der Nutzen einer Antikoagulation als grundsätzlich größer eingeschätzt wird als das Risiko durch eine intrazerebrale Blutung.
- mit stark schwankenden INR-Werten trotz regelmäßiger Einnahme von VKA.
- mit einem erhöhten Risiko für spezifische Arzneimittel- oder Nahrungsmittelinteraktionen unter VKA.
- für die eine regelmäßige Kontrolle des INR-Wertes nicht möglich ist.
- mit neu diagnostiziertem nv-VHF, die akut einer Rhythmisierung oder Ablation zugeführt werden sollen, als Alternative zu parenteralen Antikoagulanzien während und unmittelbar nach der Intervention. Anschließend kann eine Umstellung auf VKA erwogen werden, falls eine Antikoagulation über einen längeren Zeitraum notwendig ist.
Bei der Auswahl eines NOAK ist u. a. zu berücksichtigen, dass
- nach den Daten der Zulassungsstudien nur für Apixaban im Vergleich zu Warfarin eine Reduktion der Schlaganfälle/Embolien, schweren Blutungen und der Gesamtmortalität nachgewiesen ist; auch unabhängige Übersichtsarbeiten zeigen einen Vorteil von Apixaban im Vergleich zu anderen NOAK.
- die Gabe von Dabigatran 2 x 150 mg/d bei einem hohen Risiko für ischämische Schlaganfälle angezeigt sein kann.
- Rivaroxaban nach Einschätzung der AkdÄ im Vergleich zu VKA keine Vorteile bietet.
- Edoxaban wegen der abnehmenden Wirksamkeit mit steigender Kreatinin-Clearance für den Alltag nicht geeignet zu sein scheint (laut FDA bei CrCl > 95 ml/min nicht zugelassen; zudem gibt es für Edoxaban im Unterschied zu den anderen DOAK kein zugelassenes Antidot).
Antikoagulationsbehandlung: risikoadaptiertes Vorgehen55-56
- Alle männlichen Betroffenen mit einem CHA2DS2-VASc-Score von 2 und mehr sollen beraten werden auf Grundlage von CHA2D2Vasc und Has-Bled-Score.
- Allen weiblichen Betroffenen mit einem CHA2DS2-VASc-Score von 3 und mehr sollen beraten werden auf Grundlage von CHA2D2Vasc und Has-Bled-Score.
- Bei einem CHA2DS2-VASc-Score von 1 bei Männern und einem CHA2DS2-VASc-Score von 2 bei Frauen soll die Antikoagulation mit den Betroffenen anhand von Nutzen und Schaden und ihren Präferenzen diskutiert werden.
- VKA sind bei Patient*inen, bei denen die Zeit der Antikoagulation stabil über 70 % im therapeutischen INR-Bereich liegt, Mittel der 1. Wahl.
- Siehe Tabelle CHA2DS2-VASc-Score.
Antikoagulationsbehandlung: Bewertung des Blutungsrisikos
- Zur Bewertung des Blutungsrisikos sollte ein etabliertes Risikomodell angewandt werden.
- HAS-BLED wird in den europäischen und amerikanischen Leitlinien empfohlen.
- HAS-BLED-Score ≥ 3 indiziert ein hohes Blutungsrisiko.
- Das bedeutet nicht, dass Antikoagulation kontraindiziert ist, aber dass die Intervention gegen modifizierbare Risikofaktoren optimiert werden muss (z. B. unkontrollierte Hypertonie, Alkohol, labiles INR, NSAR-Anwendung).
- Siehe Tabelle HAS-BLED-Risiko-Score.
Antagonisierung von Blutungen: Vit-K-Antagonisten
- Vit-K: 5–20 mg p. o. oder i. v., ggf. Wiederholung nach 8–12 Stunden
- Prothrombinkomplex (PPSB)57
- Fresh Frozen Plasma (FFP)57
Antagonisierung von Blutungen: NOAK
- Bis 2015 waren keinerlei spezifische Antidots für NOAK verfügbar.
- Dabigatran (Faktor-IIa-Inhibitor); 2015 Zulassung von Idarucizumab als Antidot für Dabigatran
- Idarucizumab ist ein monoklonales Antikörperfragment.
- Aufhebung der Gerinnungshemmung durch Dabigatran innerhalb weniger Minuten58
- Zeit bis zur effektiven Blutstillung: mehrere Stunden59
- anhaltende Wirkung von über 12 Stunden
- Dosis: 2 x 5 mg i. v. im Abstand von max. 15 min54
- Rivaroxaban, Apixaban, Edoxaban (Faktor-Xa-Inhibitoren)
- 2019 bedingte Zulassung von Andexanet alfa als Antidot gegen Apixaban und Rivaroxaban (an Auflage gebunden, dass Sicherheit und Wirksamkeit weiter untersucht werden).16
- Andexanet alfa ist ein rekombinates Molekül mit hoher Affinität an Faktor Xa.
- kompetitive Hemmung der Faktor-Xa-Antagonisten
- bei Behandlung mit Bolus und anschließender Infusion schneller und substanzieller Rückgang der Anti-Faktor-Xa-Aktivität
- Nach Ansicht der AkdÄ ist aufgrund unzureichender Daten ein Zusatznutzen für Andaxanet alfa nicht belegt.60
- 2019 bedingte Zulassung von Andexanet alfa als Antidot gegen Apixaban und Rivaroxaban (an Auflage gebunden, dass Sicherheit und Wirksamkeit weiter untersucht werden).16
- Gabe von Prothrombin-Komplex im Falle von schweren Blutungsereignissen54
Antithrombotische Behandlung bei Patient*innen mit Vorhofflimmern nach Stentimplantation bei akutem oder chronischem Koronarsyndrom
- Diese Komorbidität ist eine besondere Herausforderung, bei der das Gleichgewicht zwischen thromboembolischem Risiko und Blutungsrisiko genau bewertet werden muss. Die Bewertung erfolgt zusammen mit einer Kardiologin/einem Kardiologen.
- Die DEGAM empfiehlt für die Triple-Therapie folgendes Vorgehen bei ACS (und chronischem Koronarsyndrom):42
- OAK + BMS (chronisches Koronarsyndrom, ACS): Triple 4 Wochen, dann nur Phenprocoumon
- OAK + DES (chronisches Koronarsyndrom): Triple 1–3 Monate (Limus-Stent) bzw. 6 Monate (Paclitaxel-Stent), dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- OAK + DES (ACS): Triple 6 Monate, dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- Es soll bei Triple-Therapie nur Clopidogrel als ADP-Rezeptor-Blocker verwendet werden (höheres Blutungsrisiko mit Ticagrelor).
- reduziertes INR-Ziel 2,0–2,5 für die Dauer der Triple-Therapie
- Die Patient*innen sollen sorgfältig überwacht werden, z. B. durch monatliche Blutbildkontrollen.
- In den neuen ESC-Guidelines wird eine weitere Verkürzung der Phase mit Triple-Therapie nach PCI empfohlen, dies gilt sowohl für Patient*innen mit ACS als auch mit chronischem Koronarsyndrom.61
- chronisches Koronarsyndrom (unabhängig vom gewählten Stent):
- 1 Woche Triple-Therapie, dann ASS-Stopp
- OAK + Clopidogrel für 6 Monate
- dann nur noch OAK
- ACS (unabhängig vom gewählten Stent)
- 1 Woche Triple-Therapie, dann ASS-Stopp
- OAK + Clopidogrel für 12 Monate
- dann nur noch OAK
- Triple-Therapie mit Vit-K-Antagonist bzw. NOAK (neue orale Antikoagulanzien)
- Die DEGAM sieht in dieser herausfordernden Situation wegen der fehlenden Möglichkeit zur Gerinnungskontrolle eine Triple-Therapie mit NOAK kritisch und empfiehlt deshalb VKA.42
- Bei Triple-Therapie sollte die INR bei der oralen Antikoagulation mit Phenprocoumon auf 2–2,5 eingestellt werden.42
- Viele Kliniken und Fachspezialist*innen empfehlen inzwischen statt einer Triple-Therapie eine 2-fache Gerinnungshemmung mit einem NOAK und Clopidogrel. Die DEGAM kann diese Empfehlung nicht nachvollziehen. In den entsprechenden Studien waren die Vitamin-K-Antagonisten in den Kontrollgruppen mit einem INR-Ziel 2,0–3,0 im Vergleich mit den niedrig dosierten NOAK zu hoch dosiert worden. Aufgrund dieses „unfairen" Vergleiches war die höhere Blutungsrate unter VKA zu erwarten und spricht nicht gegen die VKA (Anm. des Reviewers).
- In den ESC-Guidelines werden NOAK für die Kombination mit Plättchenhemmern gegenüber Vit-K-Antagonisten bevorzugt.61
- chronisches Koronarsyndrom (unabhängig vom gewählten Stent):
Sekundärbehandlung
Perkutaner Herzohrverschluss
- Der perkutane (katheterbasierte) Verschluss des linken Herzohrs (Left Atrial Appendage) kommt hauptsächlich infrage bei Patient*innen mit einer Indikation für eine Antikoagulation, die diese Behandlung aber nicht tolerieren, und allenfalls bei Patient*innen, die ein hohes Schlaganfallrisiko, aber eine Kontraindikation für eine orale Langzeitkoagulation haben.
- Eine Netzwerk-Metaanalyse kam zu dem Ergebnis, dass der Verschluss des linken Herzohrs und die Therapie mit NOAK hinsichtlich ihrer Wirksamkeit gleichwertig sind, allerdings ist die vorhandene Datenlage immer noch unzureichend.62
Beurteilung der Fahreignung
- Siehe Artikel Beurteilung der Fahreignung.
- In Deutschland regelt die Bundesanstalt für Straßenwesen die Begutachtung zur Kraftfahreignung.63
- Dabei werden grundsätzlich unterschiedlich beurteilt:
- Fahrerlaubnis Gruppe 1: Kraftfahrzeuge bis 3,5 t und Motorräder
- Fahrerlaubnis Gruppe 2: Kraftfahrzeuge ab 3,5 t, Berufskraftfahrer mit und ohne Personenbeförderung.
- Wenn Fahrerlaubnisbewerber*innen oder -inhaber*innen unter Herzrhythmusstörungen leiden, die anfallsweise zu wiederholter Unterbrechung der Blutversorgung des Gehirns und damit zu Synkopen führen, sind sie nicht in der Lage, den gestellten Anforderungen zum Führen von Kraftfahrzeugen beider Gruppen gerecht zu werden.
- Grundlage der Beurteilung sollte in jedem Fall eine eingehende internistisch-kardiologische Untersuchung (einschließlich 24-Stunden-Langzeit-EKG, evtl. Einsatz eines Ereignisrekorders) sein.
- Bei komplexen Fragestellungen bietet es sich an, für Herzrhythmusstörungen spezialisierte Kardiolog*innen hinzuzuziehen, um die Ursache zu finden und eine entsprechende Therapie einzuleiten.63
- Näheres dazu siehe Artikel Beurteilung der Fahreignung.
Prävention
- Gute Behandlung von prädisponierenden Krankheiten (Hypertonie, Diabetes mellitus, Koronarerkrankungen, Herzinsuffizienz usw.)
- Dauerhafte Gewichtsreduktion bei übergewichtigen Personen verringert das Risiko für das Wiederauftreten von Vorhofflimmern.64
- Bei Patient*innen mit einer systolischen, linksventrikulären Dysfunktion oder einer linksventrikulären Hypertrophie haben ACE-Hemmer und AT-II-Blocker ein vorbeugendes Potenzial gegen Vorhofflimmern gezeigt (Ia).65
- Einer Metaanalyse zufolge verringert eine Statinbehandlung das Vorkommen von Vorhofflimmern nicht.66 Sie wird aber bei einer nachgewiesenen Herz-Gefäß-Erkrankung grundsätzlich als Sekundärprophylaxe empfohlen.
- Die Verabreichung von 1 g Omega-3-Fettsäuren67 oder 4 g Omega-3-Fettsäure täglich über 1 Jahr68 hat bei Patient*innen mit paroxysmalem Vorhofflimmern nicht zu einem selteneren Wiederauftreten des Vorhofflimmerns geführt.
- Weitgehende Alkoholabstinenz über 6 Monate bei Patient*innen, die regelmäßig Alkohol konsumierten, reduzierte in einer kleinen RCT Rezidive von Vorhofflimmern um fast 50 %.69
- Ein generelles Screening auf subklinisches Vorhofflimmern kann derzeit nicht empfohlen werden. 70
Verlauf, Komplikationen und Prognose
Verlauf
- Vorhofflimmern tritt häufig paroxysmal auf, bevor es sich zu einer permanenten Rhythmusstörung entwickelt.
- Bei über 50 % der Patient*innen mit akutem Flimmern findet innerhalb von 24–48 Stunden ein Umschlag statt.71
- Die subjektiven Beschwerden verringern sich oft, wenn das Vorhofflimmern permanent wird.
- Viele Patient*innen erleben Perioden oder Anfälle mit Flimmern ohne Symptome. Die Diagnose wird oft zufällig bei einer Routineuntersuchung gestellt.
- Eine elektrische Kardioversion sollte bei den meisten jüngeren Patient*innen mit neu aufgetretenem Vorhofflimmern erwogen werden.
- Die Wahrscheinlichkeit eines Rezidivs nach der elektrischen Kardioversion ist groß, und das Vorhofflimmern wird bei den meisten nach einigen Jahren permanent, unabhängig von der Behandlung.
Komplikationen
- Im Vergleich zu Personen mit Sinusrhythmus haben Patient*innen mit Vorhofflimmern eine doppelt so hohe Sterblichkeit und ein höheres Risiko, einen Schlaganfall zu erleiden.72
- permanentes vs. paroxysmales Vorhofflimmern
- Risiko für thromboembolische Komplikationen
- Ist direkt nach dem ersten Auftreten des Vorhofflimmerns, während der ersten Jahre mit chronischem Vorhofflimmern und in der ersten Zeit nach erfolgter Kardioversion zum Sinusrhythmus am größten.3
- Das Risiko für Komplikationen ist besonders hoch bei Patient*innen mit Mitralklappenfehler als zugrunde liegender Ursache.
- Eine unbehandelte schnelle Ventrikelaktion kann zu Herzinsuffizienz und/oder Kardiomyopathie führen.75
Prognose
- Prädiktoren für ein Rezidiv für Vorhofflimmern sind:
- lange andauerndes Vorhofflimmern (Dauer > 3 Monate)
- Herzinsuffizienz
- strukturelle Herzerkrankung
- Hypertonie
- hohes Alter (über 70) und
- ein vergrößerter linker Vorhof.76
- Risiko für Thromboembolien bei Kardioversion77
- 5–7 % ohne Antikoagulation
- 1–2 % mit konventioneller Antikoagulation
- Dies gilt nicht für neu auftretendes Vorhofflimmern, das innerhalb von 48 Stunden behandelt wird, wenn eine lang andauernde Antikoagulation nicht notwendig ist.
- Laut einer Metaanalyse liegt die jährliche Sterblichkeit beim Vorhofflimmern bei 4,7 % (46 % kardiale Todesursachen und 11 % aufgrund von ischämischem Schlaganfall, Hirnblutung oder anderen schweren Blutungen).78
- Eine amerikanische Follow-up-Studie von Patient*innen mit neu auftretendem Vorhofflimmern hat gezeigt, dass das Mortalitätsrisiko während der ersten 4 Monate nach dem Auftreten des Vorhofflimmerns erhöht war (OR 9,6).79
- Später war das Risiko mäßig erhöht im Verhältnis zur übrigen Bevölkerung (OR 1,6).
Verlaufskontrolle
- Kontrolle der Herzfrequenz
- Frequenzniveau < 110 Schläge pro Minute ergibt gleich gute Ergebnisse wie eine strengere Kontrolle.
- Verlaufskontrolle bei Antikoagulationsbehandlung
- Puls und Herzfrequenz zur individuellen Dosierung der frequenzreduzierenden Medikamente
- Blutdruck
- Gute Einstellung zugrunde liegender Erkrankungen bzw. der Begleiterkrankungen
- Bei Patient*innen, die Amiodaron einnehmen, sollten die Schilddrüsen- und Leberwerte kontrolliert werden.
- Patient*innen, die Flecainid nehmen, werden mit EKG kontrolliert (Risiko für verlängerte QT-Zeit).
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Über die Behandlung
- Über die regelmäßige Einnahme der Antikoagulanzien
- Gefährliche Medikamentenkombinationen, z. B. NSAR/Phenprocoumon, vermeiden.
- Bei Blutungen ärztliche Hilfe suchen.
Patienteninformationen in Deximed
Weitere Informationen
- Gesundheitsinformation.de: Was sind Gerinnungshemmer und worauf muss man achten?
Illustrationen
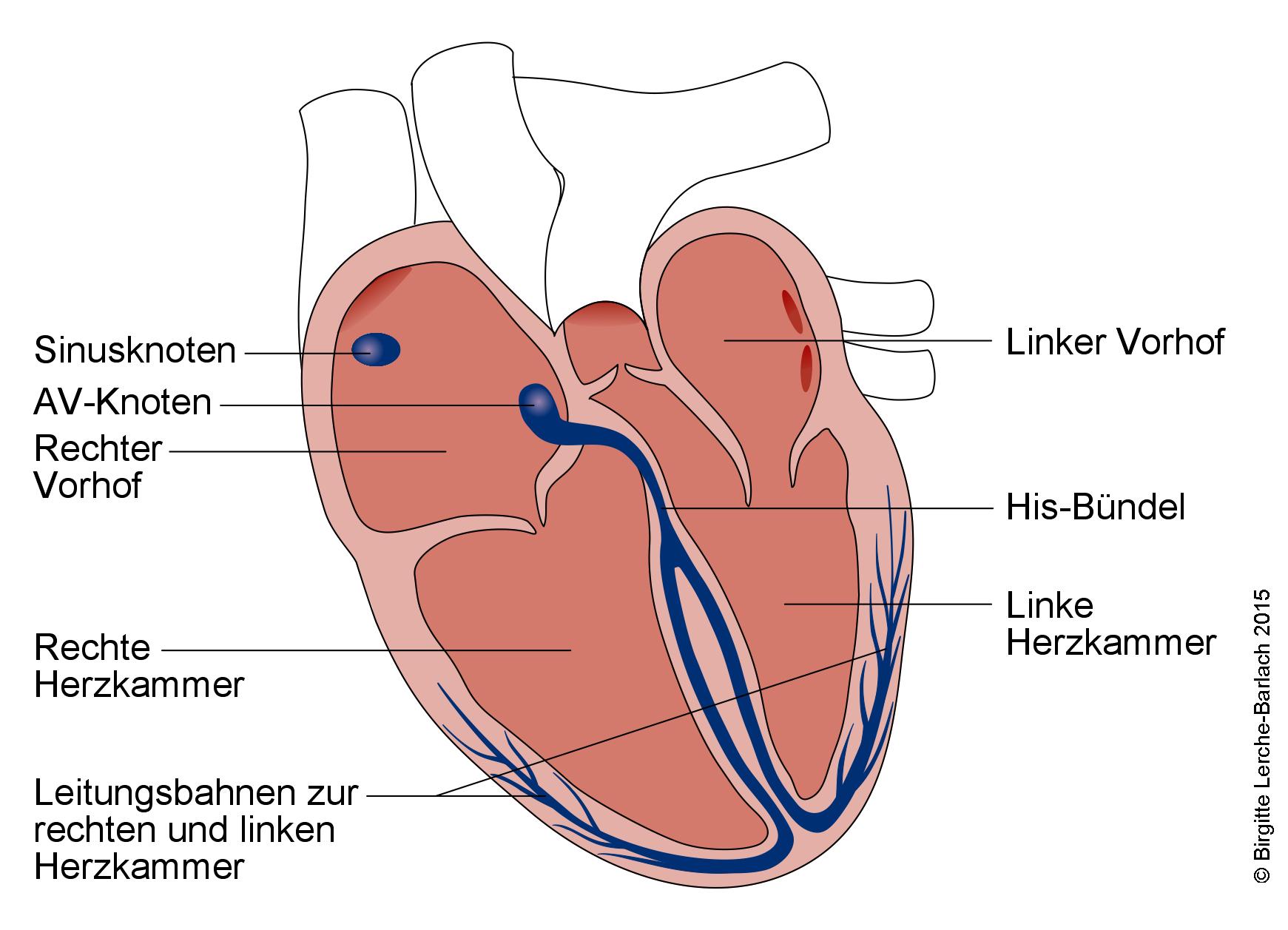
Leitungssystem des Herzens
EKG bei Vorhofflattern
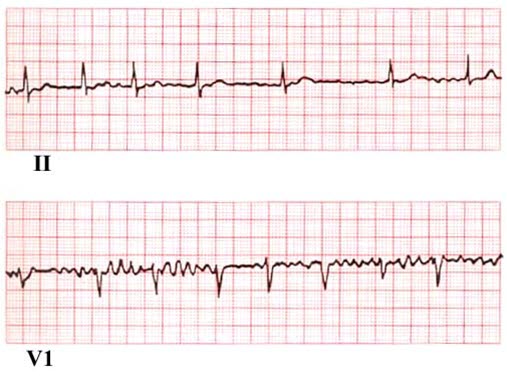
EKG bei Vorhofflimmern
Herzgeräusche beim Vorhofflimmern
Quellen
Leitlinien
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Hausärztliche Risikoberatung zur kardiovaskulären Prävention. AWMF-Leitlinie Nr. 053-024. S3, Stand 2016. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. DEGAM-Leitlinie Nr. 16: Neue Thrombozyten-Aggregationshemmer. AWMF-Leitlinie Nr. 053-041. S2e, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Neue orale Antikoagulantien. AWMF-Leitlinie Nr. 053-031. S1, Stand 2013 (abgelaufen). www.degam.de
- Deutschen Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e. V. Pocket-Leitlinie: Management von Vorhofflimmern (Version 2016). www.dgk.org
- The 2018 European Heart Rhythm Association. Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with atrial fibrillation. Stand 2018. www.academic.oup.com
- Arzneimittelkommission der deutschen Ärzteschaft. Leitfaden Orale Antikoagulation bei nicht valvulärem Vorhofflimmern. Empfehlungen zum Einsatz der direkten oralen Antikoagulanzien Dabigatran, Apixaban, Edoxaban und Rivaroxaban. 3. Auflage, Stand 2019. www.akdae.de
- European Society of Cardiology. Guidelines for Management of Atrial Fibrillation. Stand 2020. www.escardio.org
Literatur
- Lohnstein M, Eras J, Hammerbacher C. Der Prüfungsguide Allgemeinmedizin - Aktualisierte und erweiterte 3. Auflage. Augsburg: Wißner-Verlag, 2018.
- January CT, Wann LS, Alpert JS, Calkins H, Cleveland JC, Cigarroa JE, Conti JB, Ellinor PT, Ezekowitz MD, Field ME, Murray KT, Sacco RL, Stevenson WG, Tchou PJ, Tracy CM, Yancy CW. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2014; doi:10.1016/j.jacc.2014.03.021 DOI
- Deutsche Gesellschaft für Kardiologie. Pocket-Leitlinie: ESC Pocket Guidelines. Leitlinie für das Management von Vorhofflimmern, Version 2016. Düsseldorf 2017. leitlinien.dgk.org
- Schnabel RB, Wilde S. WIld PS, Munzel T, Blankenberg S. Vorhofflimmern. Prävalenz und Risikofaktorenprofil in der Allgemeinbevölkerung. Dtsch Arztebl Int 2012; 109(16): 293-9. www.aerzteblatt.de
- Zarifis J, Beevers DG, Lip GYH. Acute admissions with atrial fibrillation in a British multiracial hospital population. Br J Clin Pract 1997; 51: 91-6. PubMed
- Kaireviciutre A, Aidietis A, Lip GY. Atrial fibrillation following cardiac surgery: clinical features and preventative strategies. Eur Heart J 2009; 30: 410-25. European Heart Journal
- Fuster V, Rydén LE, Cannom DS, et al. Task force report. ACC/AHA/ESC guide-lines for the management of patients with atrial fibrillation. Europace 2006;8:651-745. PubMed
- Chamberlain AM, Agarwal SK, Folsom AR, et al. A clinical risk score for atrial fibrillation in a biracial prospective cohort (from the ARIC study) . Am J Cardiol 2011; 107: 85-91. PubMed
- Lubitz SA, Yin X, Fontes JD, et al. Association between familial atrial fibrillation and risk of new-onset atrial fibrillation. JAMA 2010; 304: 2263-9. www.ncbi.nlm.nih.gov
- Bilal Iqbal M, Taneja AK, Lip GYH, Flather M. Recent developments in atrial fibrillation. BMJ 2005; 330: 238-43. PubMed
- Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quiniou G, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659-66. New England Journal of Medicine
- Nattel S, Burstein B, Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications. Circ Arrhytm Electrophysiol 2008; 1: 62-73. www.ncbi.nlm.nih.gov
- Gutierrez C, Blanchard DG. Atrial fibrillation: diagnosis and treatment. Am Fam Physician 2011; 83: 61-8. www.ncbi.nlm.nih.gov
- Voskoboinik A, Kalman JM, De Silva A, et al. Alcohol Abstinence in Drinkers With Atrial Fibrillation. N Engl J Med 2020. pmid:31893513. www.ncbi.nlm.nih.gov
- Halligan SC, Gersh BJ, Brown RD, et al. The natural history of lone atrial flutter. Ann Intern Med 2004; 140: 265-68. www.ncbi.nlm.nih.gov
- Arzneimittelkommission der deutschen Ärzteschaft. Leitfaden Orale Antikoagulation bei nicht valvulärem Vorhofflimmern. Empfehlungen zum Einsatz der direkten oralen Antikoagulanzien Dabigatran, Apixaban, Edoxaban und Rivaroxaban. 3. Auflage, Stand 2019. www.akdae.de
- Washam JB, Stevens SR, Lokhnygina Y, et al. Digoxin use in patients with atrial fibrillation and adverse cardiovascular outcomes: A retrospective analysis of the Rivaroxaban Once Daily Oral Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF). Lancet 13 June 2015; 385 (9985): 2363–2370. doi:10.1016/S0140-6736(14)61836-5 DOI
- Lopes RD, Rordorf R, De Ferrari GM, et al. Digoxin and Mortality in Patients With Atrial Fibrillation. J Am Coll Cardiol 2018 Mar 13; 71(10): 1063-1074. pmid:29519345 PubMed
- Lafuente-Lafuente C, Valembois L, Bergmann JF, et al. Antiarrhythmics for maintaining sinus rhythm after cardioversion of atrial fibrillation. Cochrane Database Syst Rev. 2015 Mar 28;3:CD005049. Cochrane (DOI)
- Packer DL et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019 Apr 2;321(13):1261-1274. doi: 10.1001/jama.2019.0693. DOI
- Pluymaekers NAHA, Dudink EAMP, Luermans JGLM, et al. Early or Delayed Cardioversion in Recent-Onset Atrial Fibrillation. N Engl J Med 2019. pmid:30883054. pubmed.ncbi.nlm.nih.gov
- Dobrev D, Nattel S. New antiarrhythmic drug for treatment of atrial fibrillation. Lancet 2010; 375: 1212-23. PubMed
- Nielsen JC, Johannessen A, Raatikainen P, et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation. N Engl J Med 2012; 367: 1587-95. New England Journal of Medicine
- Wilber DJ, Pappone C, Neuzil P, et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation. A randomized controlled trial. JAMA 2010; 303: 333-40. PubMed
- Packer DL, Mark DB, Robb RA, et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation The CABANA Randomized Clinical Trial. JAMA 2019; 321: 1261-74. pmid:30874766. jamanetwork.com
- Mark DB, Anstrom KJ, Sheng S, et al. Effect of Catheter Ablation vs Medical Therapy on Quality of Life Among Patients With Atrial Fibrillation The CABANA Randomized Clinical Trial. JAMA 2019; 321: 1275-85. pmid:30874716. jamanetwork.com
- Anselmino M, Matta M, D'Ascenzo F, et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: a systematic review and meta-analysis. Circ Arrhythm Electrophysiol. 2014 Dec;7(6):1011-8. doi: 10.1161/CIRCEP.114.001938. DOI
- Oral H, Pappone C, Chugh A, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354: 934-41. New England Journal of Medicine
- Shapira AR. Catheter ablation of supraventricular arrhythmias and atrial fibrillation. Am Fam Physician 2009; 80: 1089-94. www.ncbi.nlm.nih.gov
- Wellens HJ. Pulmonary vein ablation in atrial fibrillation: hype or hope? Circulation 2000; 102: 2562-4. www.ncbi.nlm.nih.gov
- Wyse DG, Waldo AL, DiMarco JP, et al. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825-33. PubMed
- The AFFIRM Investigators. Quality of life in atrial fibrillation: The atrial fibrillation follow-up investigation of rhythm management (AFFIRM) study. Am Heart J 2005; 149: 112-20. PubMed
- Tsadok MA, Jackevicius CA, Essebag V, et al. Rhythm versus rate control therapy and subsequent stroke or transient ischemic attack in patients with atrial fibrillation. Circulation 2012; 126: 2680-7. www.ncbi.nlm.nih.gov
- Ionescu R, Abrahamowicz M, Jackevicius CA, et al. Comparative effectiveness of rhythm control vs rate control drug treatment effect on mortality in patients with atrial fibrillation. Arch Intern Med 2012. doi:10.1001/archinternmed.2012.2266 DOI
- Mead GE, Elder A, Flapan AD, Cordina J. Electrical cardioversion for atrial fibrillation and flutter. Cochrane Database of Systematic Reviews 2005, Issue 3. Art. No.: CD002903. DOI: 10.1002/14651858.CD002903.pub2. DOI
- Chung MK, Shemanski L, Sherman DG, et al. Functional status in rate- versus rhythm-control strategies for atrial fibrillation: results of the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Functional Status Substudy. J Am Coll Cardiol 2005; 46: 1891-9. PubMed
- Whitbeck MG, Charnigo RJ, Khairy P, et al. Increased mortality among patients taking digoxin--analysis from the AFFIRM study. Eur Heart J 2013; 34: 1481-8. www.ncbi.nlm.nih.gov
- Nattel S, Opie LH. Controversies in atrial fibrillation. Lancet 2006; 367: 262-72. PubMed
- Aguilar M, Hart R. Oral anticoagulants for preventing stroke in patients with non-valvular atrial fibrillation and no previous history of stroke or transient ischemic attacks. Cochrane Database Syst Rev 2005; 3: CD001927 Doi: 10.1002/14651858.CD001927.pub2. DOI
- Deutsche Gesellschaft für Allgemeinmedizin (DEGAM). Leitlinie: Hausärztliche Risikoberatung zur kardiovaskulären Prävention. S3. Stand 2017. www.awmf.org
- Connoly SJ, Camm AJ, Halperin JL, et al. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med 2011; 365: 2268-76. New England Journal of Medicine
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. DEGAM-Leitlinie Nr. 16: Neue Thrombozyten-Aggregationshemmer. AWMF-Leitlinie Nr. 053-041. S2e, Stand 2019. www.awmf.org
- van Doorn S, Debray TPA, Kaasenbrood F, et al. Predictive performance of the CHA2DS2-VASc rule in atrial fibrillation: a systematic review and meta-analysis. J Thromb Haemost 2017; 15: 1065-77. pmid:28375552 PubMed
- Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365: 883-91. New England Journal of Medicine
- Adam SS, McDuffie JR, Ortel TL, et al. Comparative Effectiveness of warfarin and new oral anticoagulants for the management of atrial fibrillation and venous thromboembolism: a systematic review. Ann Intern Med. 2012 Aug 28 . pmid:22928173 PubMed
- Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: A meta-analysis of randomised trials. Lancet 2013. DOI: 10.1016/S0140-6736(13)62343-0 DOI
- Dentali F, Riva N, Crowther M, et al. Efficacy and safety of the novel oral anticoagulants in atrial fibrillation: a systematic review and meta-analysis of the literature. Circulation 2012; 126: 2381-91. www.ncbi.nlm.nih.gov
- Hernandez I, Baik SH, Piñera A, Zhang Y. Risk of bleeding with dabigatran in atrial fibrillation. JAMA Intern Med 2015; 175: 18-24. doi:10.1001/jamainternmed.2014.5398 DOI
- Hicks T, Stewart F, Eisinga A. NOACs versus warfarin for stroke pevention inpatients with AF: a systematic review and meta-analysis. Open Heart 2016. doi:10.1136/openhrt-2015-000279 openheart.bmj.com
- arznei-telegramm: Vorhofflimmern: Neue orale Antikoagulanzien in der "realen Welt". arznei-telegramm 2018; Jg. 49. Nr. 10 www.arznei-telegramm.de
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Neue orale Antikoagulantien. AWMF-Leitlinie Nr-053-031, Stand 2013 (abgelaufen) www.degam.de
- Eckardt, L., Deneke, T., Diener, H.C. et al. Kommentar zu den 2016 Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) zum Management von Vorhofflimmern. Kardiologe 2017; 11: 193–204. doi:DOI 10.1007/s12181-017-0141-5 leitlinien.dgk.org
- ESC: Novel Oral Anticoagulants for Atrial Fibrillation. NOAC for AF Practical Guide. www.escardio.org
- Steffel J, Verhamme P, Potpara TS et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. European Heart Journal 2018; 16: 1330-39. pmid:30211938 www.ncbi.nlm.nih.gov
- Hobbs FDR et al on behalf of The European Primary Care Cardiovascular Society (EPCCS) stroke prevention in atrial fibrillation (SPAF) working group. EPCCS consensus guidance on SPAF in primary care. European Journal of Preventive Cardiology, Vol. 23 (5): 460-473, March 2016. www.ncbi.nlm.nih.gov
- Paulus Kirchhof et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. European Heart Journal (2016) 37, 2893–2962. www.cardio.se
- Zareh M, Davis A, Henderson S. Reversal of Warfarin-Induced Hemorrhage in the Emergency Department. West J Emerg Med 2011; 12: 386-392. doi:10.5811/westjem.2011.3.2051 DOI
- Pollack C, Reilly P, Eikelboom J, et al. Idarucizumab for Dabigatran Reversal. N Engl J Med 2015; 373: 511-520. doi:10.1056/NEJMoa1502000 DOI
- Der Arzneimittelbrief: Antodot Idarucizumab bei Blutungen unter Dagibatran: kein „Ausschalter“ Jahrgang 51, Nr. 12, Dezember 2017 www.der-arzneimittelbrief.de
- Stellungnahme der AkdÄ zu Andexanet alfa – frühe Nutzenbewertung § 35a SGB V. Stand 07.01.20. www.akdae.de
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020; 0: 1-126. doi:10.1093/eurheartj/ehaa612 DOI
- Sahay S, Nombela-Franco L, Rodes-Cabau J, et al . Efficacy and safety of left atrial appendage closure versus medical treatment in atrial fibrillation: a network meta-analysis from randomised trials. Heart 2017; 103: 139-47. doi:10.1136/heartjnl-2016-309782 DOI
- Bundesanstalt für Straßenwesen. Begutachtungsleitlinien zur Kraftfahreignung. Bergisch Gladbach, Stand 14.08.2017; Online-Ressource, letzter Zugriff 31.01.2018. www.bast.de
- Pathak RK, Middeldorp ME, Meredtih M, et al . Long-Term Effect of Goal Directed Weight Management in an Atrial Fibrillation Cohort: A Long-term Follow-Up StudY (LEGACY Study). J Am Coll Cardiol 2015. doi:10.1016/j.jacc.2015.03.002 DOI
- Healey JS, Baranchuk A, Crystal E, et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005; 45: 1832-9. PubMed
- Rahimi K, Emberson J, McGale P, et al. Effect of statins on atrial fibrillation: collaborative meta-analysis of published and unpublished evidence from randomised controlled trials. BMJ 2011; 342: d1250. pubmed.ncbi.nlm.nih.gov
- Macchia A, Grancelli H, Varini S, et al. Omega-3 fatty acids for the prevention of recurrent symptomatic atrial fibrillation: results of the FORWARD (Randomized Trial to Assess Efficacy of PUFA for the Maintenance of Sinus Rhythm in Persistent Atrial Fibrillation) trial.. J Am Coll Cardiol 2013; 61: 463-8. doi:10.1016/j.jacc.2012.11.021 DOI
- Darghosian L, Free M, Li J, et al. Effect of Omega-three polyunsaturated fatty acids on Inflammation, oxidative stress, and recurrence of atrial fibrillation. Am J Cardiol. 2014. PMID: 25465932 PubMed
- Voskoboinik A, Kalman JM, De Silva A, et al. Alcohol Abstinence in Drinkers with Atrial Fibrillation. N Engl J Med. 2020;382(1):20–28. doi:10.1056/NEJMoa1817591. www.ncbi.nlm.nih.gov
- arznei-telegramm. IST SUBKLINISCHES VORHOFFLIMMERN BEHANDLUNGSBEDÜRFTIG? a-t 2021; 52: 73-5. www.arznei-telegramm.de
- Lip GYH, Kamath S. Acute atrial fibrillation. Clinical Evidence 2001; 6: 1-7. www.ncbi.nlm.nih.gov
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham study. Stroke 1991; 22: 983-8. PubMed
- Ganesan AN, Chew DP, Hartshorne T, et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. Eur Heart J 2016; 37: 1591-602. pmid:2688818. pubmed.ncbi.nlm.nih.gov
- Kapłon-Cieślicka A, Budnik M, Gawałko M, et al. Atrial fibrillation type and renal dysfunction as important predictors of left atrial thrombus. Heart 2019. pmid:31040170. pubmed.ncbi.nlm.nih.gov
- Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003;107:2920-5. PubMed
- Van Gelder IC, Crijns HJ, Tieleman RG, Brugemann J, De Kam PJ, Gosselink AT, et al. Chronic atrial fibrillation: success of serial cardioversion therapy and safety of oral anticoagulation. Arch Intern Med 1996; 156: 2585-92. PubMed
- Consensus Conference on Atrial Fibrillation in Hospital and General Practice. Final consensus statement. Proc R Coll Physicians Edinb 1999;suppl 6: 2-3. www.ncbi.nlm.nih.gov
- Gomez-Outes A, Lagunar-Ruiz J, Terleira-Fernandez AI, et al. Causes of Death in Anticoagulated Patients With Atrial Fibrillation. J Am Coll Cardiol. 2016; 68: 2508-21. pmid: 27931607 PubMed
- Miyasaka Y, Barnes ME, Bailey KR, et al. Mortality trends in patients diagnosed with first atrial fibrillation a 21-year community-based study. J Am Coll Cardiol 2007; 49: 986-92. PubMed
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Hans-Otto Wagner, Dr. med., Facharzt für Allgemeinmedizin, Hamburg-Eppendorf (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).