Allgemeine Informationen
Definition
- Segmental auftretende und transmurale Entzündung, die den gesamten Magen-Darm-Trakt, von der Mundhöhle bis zum Anus, befallen kann.1
- Häufig kommt es zur Bildung von Stenosen, Fisteln oder Abszessen.2
- auch extraintestinale Komplikationen möglich
- Für viele Patient*innen beginnt die Erkrankung während der Berufsausbildung und dauert während des gesamten beruflichen Lebens an.
- hohe indirekte Kosten (Arbeitsausfall, Rente)
- Klinischer Verlauf, Befallsmuster und Ausmaß an extraintestinalen Manifestationen sind sehr variabel.
- Notwendigkeit einer komplexen Diagnostik und abgestuften Therapie3
Klassifikation
- Aktivitätsindex nach Best (CDAI – Crohn's Disease Activity Index)4
- Einteilung in Remission, milder, moderater oder schwerer Schub
- Summe aus 8 Faktoren:
- Anzahl der Stühle
- Bauchschmerzen
- Allgemeinzustand
- Komplikationen (sowohl gastrointestinal als auch extraintestinal)
- Einnahme von Motilitätshemmern (Loperamid, Opioide)
- tastbare abdominelle Resistenzen
- Hämatokrit
- Abweichung vom berechneten Idealgewicht.
- Einen automatischen Rechner für den Index finden Sie hier.
Häufigkeit
- Inzidenz
- 6,6 pro 100.000 Einw. in Deutschland5
- Prävalenz
- Prävalenz für M. Crohn in Deutschland etwa 100–200 pro 100.000 Einw.6
- In Deutschland sind über 400.000 Menschen von einer chronisch-entzündlichen Darmerkrankung betroffen (M. Crohn oder Colitis ulcerosa).7
- Prävalenz seit 1991 deutlich zunehmend8
- Alter und Geschlecht
Ätiologie und Pathogenese
- Die Erkrankung entsteht wahrscheinlich aus einem Zusammenspiel von genetischen Einflüssen, Mechanismen des Immunsystems und umweltbedingten Faktoren.7
- Pathophysiologisch liegt eine Dysfunktion des Immunsystems vor, das Signale der intestinalen Mikroflora fehlinterpretiert und dabei durch äußere Umweltfaktoren beeinflusst wird.
- Durch eine Barrierestörung des Darmepithels können Bakterien in die Schleimhaut eindringen.
- Es kommt es zur T-Zell-Aktivierung in der Darmschleimhaut mit Verstärkung bzw. Aufrechterhaltung der Entzündungsreaktion durch proinflammatorische Mediatoren.
- erhöhte Produktion von TNF-alpha, Interferon-gamma und Interleukin-12 und -2310
Genetische Faktoren
- Eltern mit chronisch entzündlicher Darmerkrankung (CED)11
- beide Eltern: > 30 % CED-Risiko beim Kind
- ein Elternteil: 10 % CED-Risiko beim Kind
- Geschwister mit CED11
- ein Geschwisterkind: 5 % CED-Risiko
- Genetischer Einfluss bei Morbus Crohn vermutlich größer als bei Colitis ulcerosa11
- Mehrere Gene beteiligt12
- Mutation im NOD2-Gen auf Chromosom 16 erhöht signifikant das Krankheitsrisiko.13-14
Umweltfaktoren
- Folgende Faktoren können das Risiko für Auftreten eines Morbus Crohn erhöhen:
ICPC-2
- D94 Chron. entzündl. Darmerkr./Colitis
ICD-10
- K50 Crohn-Krankheit
- K50.0 Crohn-Krankheit des Dünndarmes
- K50.1 Crohn-Krankheit des Dickdarmes
- K50.80 Crohn-Krankheit des Magens
- K50.81 Crohn-Krankheit der Speiseröhre
- K50.82 Crohn-Krankheit der Speiseröhre und des Magen-Darm-Traktes, mehrere Teilbereiche betreffend
Inkl.: Crohn-Krankheit sowohl des Dünndarmes als auch des Dickdarmes
Diagnostik
Diagnostische Kriterien
- Diagnosestellung durch klinisches Erscheinungsbild, Verlauf sowie Kombination aus endoskopischen, histologischen, radiologischen und laborchemischen Methoden.3
- Der akute Schub eines Morbus Crohn sollte endoskopisch verifiziert und mögliche Differenzialdiagnosen sollten ausgeschlossen werden.20
Differenzialdiagnosen
- Colitis ulcerosa
- Infektiöse Durchfallerkrankungen
- Clostridium difficile Enteritis
- IBS (Reizdarmsyndrom)
- Appendizitis
- Unspezifische Kolitis
- Divertikulitis
- Maligne Erkrankungen (z. B. Lymphom, Karzinom)
- Malabsorption: Zöliakie, Laktoseintoleranz
Anamnese
Allgemeines
- Bei Krankheitsbeginn können die klinischen Symptome sehr unterschiedlich sein (je nach Entzündungslokalisation und -schweregrad).
- Typische Symptome
- Bauchschmerzen, Punctum maximum im rechten Unterbauch im Bereich des terminalen Ileums
- teilweise Konglomerattumor palpabel
- Diarrhö, in der Regel unblutig
- Tenesmen
- perianale Beschwerden (Fisteln, Abszesse)
- Bauchschmerzen, Punctum maximum im rechten Unterbauch im Bereich des terminalen Ileums
- Mögliche Symptome
- Meteorismus, Übelkeit, Erbrechen und Gewichtsverlust
- Hämatochezie und Malabsorption
- Die Symptomatik ist oft unspezifisch und von schleichendem Beginn.
- Differenzialdiagnose zu infektiöser Gastroenteritis, die häufig abrupt beginnt.
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Die Anamnese bei Erstdiagnose sollte beinhalten:
- detaillierte Erfragung über Art und Beginn der Symptome
- bereits vorhandene Vorbefunde
- kürzliche Reiseanamnese
- Nahrungsmittelunverträglichkeiten
- Kontakte mit infektiösen Durchfallerkrankungen
- Raucheranamnese
- Familienanamnese
- Medikamentenanamnese (insbesondere auch bezüglich Antibiotika und nichtsteroidaler Antirheumatika)
- Impfstatus
- extraintestinale Manifestationen (Mund, Haut, Augen und Gelenke) sowie perianale Abszesse, Fisteln und Analfissuren.
Klinische Untersuchung
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Bei Erstdiagnose und bei Auftreten Crohn-typischer Symptome sollen eine körperliche Untersuchung inklusive einer oralen und perianalen Inspektion und die Beachtung evtl. vorliegender extraintestinaler Manifestationen erfolgen.
- Eine rektale Untersuchung soll spätestens im Rahmen der Koloskopie durchgeführt werden.
Allgemeines
- Variable Befunde
- je nach Krankheitslokalisation, -ausdehnung und -dauer
- Bei Malabsorption in schweren Fällen
- Gewichtsverlust
- niedrige B12-, Folsäure- und Eisenwerte
- Akuter Schub
- Besonders zu beachten sind Fieber oder Schüttelfrost als systemische Entzündungszeichen.
- Perianale Läsionen (Abszesse, Fisteln) treten sehr häufig auf.
Extraintestinale Manifestationen
- Bei 20–40 % der Patient*innen mit M. Crohn6
- Typische extraintestinale Manifestationen
- Anämie, vor allem Eisenmangelanämie
- Arthritis
- Erythema nodosum, Pyoderma gangraenosum
- Episkleritis, Iridozyklitis
- ankylosierende Spondylitis
- thrombembolische Ereignisse
- PSC und Overlap-Syndrom (PSC + Autoimmunhepatitis)
- Osteoporose
- Nephrolithiasis
- orale Aphthen
- Wachstumsverzögerung bei Kindern
Ergänzende Untersuchungen
- Blutuntersuchungen
- Entzündungsstatus, Ferritin, Nierenfunktion, Transaminasen und Cholestaseparameter3
- Vitamin B12 kann bei schwerer Ileitis erniedrigt sein.
- Elektrolyte bei starken Diarrhöen
- Stuhluntersuchungen
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- In der klinischen Differenzialdiagnostik gegenüber einer funktionellen Symptomatik sollte die quantitative Bestimmung von fäkalem Calprotectin genutzt werden.
- Eine intestinale Infektion (inkl. Clostridioides difficile) sollte bei der Erstdiagnostik und bei einer Schubsymptomatik im Verlauf ausgeschlossen werden.
- Bei Patient*innen mit entsprechender Reiseanamnese sollte eine ergänzende Diagnostik bezüglich landestypischer Erreger durchgeführt werden.
- Fäkales Calprotectin (oder Lactoferrin)
- bei entzündlichen Darmerkrankungen erhöht9,21
- zur Überwachung der Krankheit und ihrer Entzündungsaktivität geeignet22
- bei Erwachsenen Sensitivität von 93 % und Spezifität von 96 %, bei Kindern Spezifität niedriger (65 %)23
- Cave: Bei reinem Dünndarmbefall kann es negativ sein!3
- Bei Verdacht auf eine entzündliche Darmerkrankung kann ein Screening mit fäkalem Calprotectin die Anzahl notwendiger Endoskopien um 67 % reduzieren.24
- sowohl bei Erwachsenen als auch bei Kindern kosteneffektiv25
- mikrobiologische Testung auf pathogene Stuhlbakterien und C. difficile3
- bei schwerem Schub und/oder therapierefraktärem Verlauf zusätzlich Testung auf CMV
- Abdominelle Sonografie
- Kann Entzündungszeichen eines aktiven Morbus Crohn, vor allem im Dünndarmbereich, diagnostisch zuverlässig darstellen.26-27
Diagnostik bei Spezialist*innen
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
Apparative Diagnostik
- Bei Patient*innen mit klinischen Zeichen eines M. Crohn soll in der Initialdiagnostik eine Ileokoloskopie mit Stufenbiopsien erfolgen.
- Erlaubt neben der Detektion Crohn-typischer Veränderungen wie dem diskontinuierlichen Befall und den fissuralen Ulzerationen Aussagen zur Lokalisation und zum Schweregrad der Entzündung und zur Diagnostik sowie zur Einschätzung des Schweregrads von Stenosen.
- Bei der Initialdiagnostik soll die Lokalisation und Ausdehnung des M. Crohn durch eine Dünndarmdiagnostik evaluiert werden.
- Für die Dünndarmdiagnostik sollte eine MR-Enterografie durchgeführt werden.
- Alternativ kann bei guter Beurteilbarkeit auch eine Sonografie des Dünndarms erfolgen.
- Bei Patient*innen mit Verdacht auf das Vorliegen eines M. Crohn mit Dünndarmbefall kann bei unauffälligen Befunden im MRT und in der Darmsonografie eine Videokapselendoskopie durchgeführt werden.
- Eine Ösophago-Gastro-Duodenoskopie sollte durchgeführt werden.
- Bei perianalem Fistelleiden im Rahmen des M. Crohn soll zur Ausbreitungsdiagnostik ein MRT des Beckens oder eine transrektale Endosonografie durchgeführt werden (Expertenkonsens, starke Empfehlung, starker Konsens).
- Eine Enteroskopie sollte durchgeführt werden, wenn eine histologische Diagnosesicherung bei Verdacht auf isolierten Dünndarmbefall eines M. Crohn erforderlich ist oder wenn die Dilatation einer Dünndarmstenose durchgeführt werden soll.
Indikationen zur Überweisung
- Bei Verdacht auf Morbus Crohn sollten die Betroffenen zur Gastroenterologie überwiesen werden.
- zur Diagnosesicherung, Erstellung eines Therapiekonzepts und Festlegung der weiteren Verlaufskontrollen
- Eine stationäre Einweisung kann situationsbedingt notwendig sein.
Checkliste zur Überweisung
Morbus Crohn
- Zweck der Überweisung
- Bestätigung der Diagnose? Therapie? Sonstiges?
- Anamnese
- Beginn und Dauer? Verlauf? Wurde die Diagnose bereits früher gestellt: wann, wo?
- Symptomatik? Diarrhö: Anzahl der Stuhlentleerungen am Tag? Darmblutungen? Schmerzen? Gibt es Komplikationen? Allgemeinsymptome? Appetit? Gewichtsabnahme? Extraintestinale Beschwerden?
- Wird derzeitig behandelt: Medikamente? Wirkung/Erfolg?
- Beeinträchtigt die Erkrankung die Ernährung, die Lebensqualität, die Arbeitsfähigkeit oder das Wachstum bei Kindern?
- Klinische Untersuchung
- Allgemeinzustand der Patient*innen? Exazerbation? Fieber?
- Abdominalstatus: Kongolomerattumor?
- Perianale Beschwerden? Extraintestinale Befunde?
- Ergänzende Untersuchungen
- Hb, BSG, CRP, Leukozyten, Thrombozyten, Leberparameter, fäkales Calprotectin, Blut im Stuhl?
- Evtl. bakteriologische Untersuchung des Stuhls? Serologie? (Differenzialdiagnosen)
- Evtl. Ergebnisse von früheren Untersuchungen: Endoskopie, Ultraschall, MRT?
Therapie
Therapieziele
- Symptomlast reduzieren und Auftreten von Komplikationen verhindern.28
- Mukosaheilung, um Voranschreiten der Erkrankung zu vermeiden.20
- Partizipative Entscheidungsfindung zwischen Ärzt*in und Patient*in für ein Therapiekonzept kann die Adhärenz steigern.20
Allgemeines zur Therapie
- Eine langfristige systemische Steroidtherapie soll vermieden werden.3
- Gängige Praxis ist die „akzelerierte Step-Up-Strategie":20
- Beginn mit niedrig-potenter Therapie, die bei fehlendem Ansprechen nach kurzen Beobachtungszeiträumen schrittweise auf höherpotente Medikationen eskaliert wird.
- Alternative bei schwerem Schub oder Patient*innen mit prognostisch ungünstigen Faktoren ist die „Top-Down-Strategie":20
- unverzüglicher Einsatz hochpotenter Kombinationstherapien (z. B. Infliximab plus ein Thiopurin) und ggf. Deeskalation im Verlauf
- Nach Therapiebeginn oder -wechsel sollten zur Evaluation des Therapieansprechens innerhalb der ersten 3 Monate neben klinischen Parametern biochemische Marker wie CRP und/oder fäkales Calprotectin sowie eine Darmsonografie herangezogen werden.3
Schmerztherapie
- Im akuten Schub und bei chronisch-aktiven Verläufen kann bei anhaltenden Bauchschmerzen trotz antiinflammatorischer Therapie eine symptomatische Schmerztherapie mit Paracetamol, Spasmolytika oder ggf. Opioiden durchgeführt werden.6
- Eine Dauertherapie mit Opioiden sollte vermieden werden.6
Akuter Schub
Leichte Krankheitsaktivität
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Mesalazin wird zur Behandlung eines milden akuten M.-Crohn-Schubes häufig eingesetzt. Aufgrund heterogener Studienergebnisse und geringer klinischer Wirksamkeit kann der Einsatz jedoch nicht mit ausreichender Evidenz empfohlen werden.
- Bei Patient*innen mit Befall der Ileozökalregion und/oder des rechtsseitigen Kolons und leichter Entzündungsaktivität soll initial Budesonid gegeben werden.
- Dosierung Budesonid6
- 9 mg Budesonid pro Tag (Einmalgabe oder verteilt über 3 Einzeldosen)
Hohe Krankheitsaktivität
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Patient*innen mit Befall der Ileozökalregion und/oder des rechtsseitigen Kolons und hoher Entzündungsaktivität sollen initial mit systemisch wirkenden Steroiden behandelt werden.
- Patient*innen mit aktiver Colitis-Crohn sollen initial mit systemischen Glukokortikoiden behandelt werden.
- Ziel der systemischen Steroidtherapie ist ein schnelles Ansprechen.3
- Dosierung systemische Glukokortikoide3
- Prednisolon 1 mg/kg Körpergewicht mit einem Maximum von 75 mg/d
Distaler Befall
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Bei distalem Kolon-Befall können Suppositorien, Klysmen oder Schäume (Mesalazin, Budesonid, Steroide) eingesetzt werden.
- Der Einsatz von lokalen Therapien (Suppositorien, Klysmen oder Schäume) bei der distalen Colitis-Crohn kann eine mögliche Ergänzung des Therapiekonzeptes bei geeigneten Patient*innen darstellen, jedoch fehlen hierzu Studiendaten bzw. ein sicherer Wirksamkeitsnachweis. 3
Befall des oberen Gastrointestinaltraktes
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Patient*innen mit ausgedehntem Dünndarmbefall und/oder Befall des oberen GI-Traktes sollten initial mit systemisch wirkenden Steroiden behandelt werden.
- Eine frühzeitige immunsuppressive Therapie oder Therapie mit TNF-alpha-Antikörpern (im Falle von Infliximab ist die Kombination mit Thiopurinen zu erwägen), Ustekinumab oder Vedolizumab sollten erwogen werden.
- Medikamente alphabetisch geordnet; keine Priorisierung
Steroidrefraktärer/steroidabhängiger Verlauf
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
Steroidrefraktär
- Der steroidrefraktäre M. Crohn mit mittlerer bis hoher Krankheitsaktivität sollte primär mit TNF-alpha-Antikörpern (im Falle von Infliximab ggf. kombiniert mit einem Thiopurin) oder Ustekinumab oder Vedolizumab behandelt werden.
- Medikamente alphabetisch geordnet; keine Priorisierung
- Bei einem isolierten Befall der Ileozökalregion, kurzer Anamnese und fehlendem Ansprechen auf Steroide ist das operative Vorgehen (Ileozökalresektion) verglichen mit der Therapie mit Infliximab als gleichwertig anzusehen.
- Bei einer elektiv geplanten Operation sollte präoperativ eine Beurteilung des Ernährungszustandes erfolgen und bei der Feststellung von Defiziten ein Ausgleich mit enteraler oder parenteraler Zusatzernährung vorgenommen werden.
- Eine präoperative Steroidtherapie sollte zur Senkung des perioperativen Komplikationsrisikos reduziert oder wenn möglich beendet werden.
Steroidabhängig
- Patient*innen mit einem steroidabhängigen M. Crohn sollten mit Thiopurinen, MTX oder einem TNF-alpha-Antikörper (im Falle von Infliximab ggf. kombiniert mit Thiopurinen), Ustekinumab oder Vedolizumab behandelt werden.
- Medikamente alphabetisch geordnet; keine Priorisierung
- Steroidabhängig: Patient*in kann nach 3 Monaten das Prednisolon nicht unter 10 mg täglich reduzieren oder innerhalb von 3 Monaten nach Beendigung der Steroidtherapie erneuter Schub.29
Therapieprinzipien bei Kindern und Jugendlichen
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Bei Kindern und Jugendlichen soll zur Remissionsinduktion des M. Crohn primär eine exklusive, enterale Ernährungstherapie statt einer Therapie mit Steroiden durchgeführt werden.
- Bei Kindern mit einem mittelschweren oder schweren M. Crohn soll eine frühzeitige immunsuppressive Therapie und/oder Therapie mit Biologika erfolgen.
- Bei Wachstumsverzögerung, umschriebenem Befall oder anhaltender Krankheitsaktivität trotz optimierter konservativer Therapie soll eine elektive Operation frühzeitig erwogen werden.
- Pubertätsentwicklungsverzögerungen sollten bei heranwachsenden Patient*innen nicht mit wachstumsfördernden Hormonen behandelt werden.
Remissionserhalt
Ziel
- Ziel einer Langzeittherapie ist Erhaltung der steroidfreien klinischen Remission mit einer Normalisierung der Lebensqualität.3
Indikation
- Die Indikation zur remissionserhaltenden Therapie, die Wahl des anzuwendenden Medikamentes und die Dauer der Therapie sollten unter Berücksichtigung des individuellen Krankheitsverlaufs, des spezifischen Risikoprofils, der Vortherapien und der Patientenpräferenz festgelegt werden.3
- Beispielsweise indiziert bei Patient*innen mit steroidrefraktärem oder -abhängigem Verlauf, schwerem Schub sowie ausgedehntem Dünndarmbefall, häufigen Schüben (≥ 2/Jahr) oder prognostisch ungünstigen Faktoren20
- Vor Einleitung der Therapie Ausschluss einer latenten Hepatitis- oder Tuberkulose-Infektion sowie Überprüfung und ggf. Komplettierung des Impfstatus20
- Cave: Während der immunsupprimierenden Therapie sollte keine Impfung mit Lebendimpfstoffen erfolgen!
Dauer der Therapie
- Eine generelle Empfehlung zur Dauer einer remissionserhaltenden Therapie mit Immunsuppressiva oder Biologika kann aufgrund fehlender Evidenz nicht gegeben werden.3
- Bei einer länger bestehenden, stabilen klinischen Remissionsphase unter einer Thiopurin- oder Biologika-Therapie ohne begleitende Steroidmedikation und ohne nachweisbare Entzündungszeichen kann eine Beendigung der immunsuppressiven Therapie erwogen werden.3
Prinzipien des Remissionserhalts
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Nach einer Remissionsinduktion sollte in Abhängigkeit von der remissionsinduzierenden Substanz und der Krankheitsvorgeschichte eine remissionserhaltende Therapie mit Azathioprin/6-Mercaptopurin, MTX, TNF-alpha-Antikörpern, Ustekinumab oder Vedolizumab durchgeführt werden.
- Bei mildem Verlauf kann ein abwartendes Verhalten ohne remissionserhaltende Therapie erwogen werden.
- Cave: Die Wirkung der remissionserhaltenden Medikamente setzt in der Regel erst nach mehreren Wochen ein!
- Bei TNF-alpha-Antikörpern oder Ustekinumab ist ein schnelleres Ansprechen zu erwarten im Vergleich zu langsam wirkenden Substanzen wie z. B. Thiopurinen.3
Übersicht der eingesetzten Medikamente
Azathioprin/6-Mercaptopurin (Azathioprin wird in der Leber zu 6-Mercaptopurin umgewandelt)
- Wirkmechanismus
- Purinanaloga (Antimetabolite)
- Dosierung (jeweils oral, gilt für Patient*innen ohne Nieren- oder Leberfunktionseinschränkung):3
- Azathioprin: 2–2,5 mg/kg KG/d
- 6-Mercaptopurin: 1–1,5 mg/kg KG/d
- Nebenwirkungen30
- Pankreatitis, Leukopenie, Übelkeit, allergische Reaktionen und Infektionen
- Therapieüberwachung31
- Während der ersten 8 Wochen der Behandlung sollte mindestens einmal pro Woche ein Blutbild einschließlich Thrombozytenzählung angefertigt werden.
- Nach 8 Wochen kann die Häufigkeit der Blutuntersuchungen reduziert werden.
- Es wird empfohlen, monatlich ein vollständiges Blutbild anzufertigen, mindestens jedoch alle 3 Monate.
- Wegen des erhöhten Risikos für den Nicht-Melanom-Hautkrebs wird ein regelmäßiges Hautkrebsscreening empfohlen.3
- Besonderheiten31
- Ungefähr 10 % der Patient*innen weisen aufgrund eines genetischen Polymorphismus einen Mangel an Thiopurin-Methyl-Transferase (TPMT) auf.
- Daher können sie Azathioprin u. U. nicht vollständig metabolisieren und sind deshalb einer höheren myelotoxischen Wirkung ausgesetzt.
- Besondere Vorsicht ist daher bei gleichzeitiger Anwendung von Aminosalicylsäurederivaten, einschließlich Sulfasalazin, die das Enzym TPMT hemmen, angezeigt.
- Um einen möglichen Mangel an Thiopurin-Transferase zu ermitteln, ist es möglich, vor der Anwendung des Arzneimittels, die TPMT-Aktivität phänotypisch oder genotypisch zu bestimmen.
MTX (Methotrexat)
- Aufgrund der deutlich geringeren Datenlage im Vergleich zu den Thiopurinen kommt die Remissionserhaltung mit Methotrexat nur bei einer Unverträglichkeit oder Ineffektivität von Thiopurinen infrage.3
- Wirkmechanismus
- Folsäure-Antagonist (Hemmung der Dihydrofolat-Reduktase)
- Dosierung (für Patient*innen ohne Einschränkung der Leber- oder Nierenfunktion):32
- Einleitung der Behandlung: 25 mg/Woche subkutan
- Erhaltungstherapie: 15 mg/Woche subkutan
- Nur die parenterale Anwendung (i. m. oder s. c.) zeigt in Studien ausreichende Signifikanz zum Erreichen einer Remission.3
- Nebenwirkungen (Auswahl)32
- Beeinträchtigung des hämatopoetischen Systems und Erkrankungen des Gastrointestinaltrakts (Stomatitis, Dyspepsie, abdominelle Schmerzen, Übelkeit, Appetitlosigkeit und abnorme Leberfunktionstests wie z. B. erhöhte ALT, AST, Bilirubin, AP)
- Genotoxisch/teratogen: Während der Behandlung und während eines Zeitraums von mindestens 6 Monaten nach Absetzen der Behandlung mit Methotrexat ist eine zuverlässige Verhütungsmethode anzuwenden (gilt sowohl bei männlichen als auch weiblichen Patient*innen).
- Therapieüberwachung32
- vor Therapieeinleitung: großes Blutbild mit Differenzialblutbild und Thrombozyten, Leberenzymen, Bilirubin, Serumalbumin, Röntgenaufnahme des Thorax und Nierenfunktionstests
- Während der Therapie (während der ersten 6 Monate mindestens monatlich und anschließend mindestens alle 3 Monate): Untersuchung der Mundhöhle und des Rachens auf Schleimhautveränderungen, großes Blutbild mit Differenzialblutbild und Thrombozyten, Leber- und Nierenfunktionstest
TNF-alpha-Antikörper
- Präparate
- Infliximab, Adalimumab (in USA und Schweiz zudem Certolizumab Pegol)3
- Wirkmechanismus
- Hemmung des proinflammatorischen Tumornekrosefaktors
- Dosierung
- abhängig von Präparat, immer parenterale Gabe (subkutane oder intravenöse Gabe im Abstand von einigen Wochen)
- Nebenwirkungen (Auswahl)33
- akute infusionsbedingte Reaktionen, einschließlich anaphylaktische Reaktionen
- erhöhte Infektanfälligkeit
- Veränderungen der Leberfunktion, Anstieg von Leberenzymen
- Therapieüberwachung
- vor jeder Gabe Laborkontrolle, u. a. Entzündungsparameter (CRP, Leukozyten)
- Bei Patient*innen mit sekundärem Wirkverlust einer TNF-alpha- Antikörpertherapie sollte ein reaktives therapeutisches Drug Monitoring (Serumspiegel) erfolgen.3
- Wegen des nicht auszuschließenden Risikos für maligne Melanome wird ein regelmäßiges Hautkrebsscreening empfohlen.3
- Besonderheiten
- immunvermitteltes Therapieversagen durch Antikörper-Bildung möglich34
- Suche nach Antikörpern bei erniedrigten Serumspiegeln trotz korrekter Einnahme
Ustekinumab
- Wirkmechanismus35
- Anti-IL12- und Anti-IL23-Inhibitor
- Dosierung36
- Therapieeinleitung: gewichtsabhängige intravenöse Einzeldosis
- Therapieerhaltung: nach 8 Wochen subkutane Gabe
- Nebenwirkungen36
- Häufigste Nebenwirkungen sind Infektionen der oberen Atemwege, Nasopharyngitis, Sinusitis und Kopfschmerzen.
- akute infusionsbedingte Reaktionen, einschließlich anaphylaktische Reaktionen
- Therapieüberwachung
- regelmäßige Kontrollen auf erhöhte Entzündungsparameter und klinische Infektionszeichen (in ersten 3 Monaten alle 4 Wochen, danach etwa alle 3 Monate)37
Vedolizumab
- Wirkmechanismus38
- Darmselektiver Integrin-Antagonist, der eine Einwanderung von T-Lymphozyten in das Darmgewebe verhindert.
- Dosierung39
- Therapieeinleitung: 300 mg i. v. in Woche 0, 2 und 6
- Erhaltungstherapie: 300 mg i. v. alle 8 Wochen
- Abbruch der Therapie, wenn nach 14 Wochen keine Hinweise auf einen therapeutischen Nutzen vorliegen.
- Nebenwirkungen (Auswahl)39
- am häufigsten: Infektionen (wie Nasopharyngitis, Infektionen der oberen Atemwege, Bronchitis, Influenza und Sinusitis), Kopfschmerzen, Übelkeit, Fieber, Müdigkeit, Husten, Arthralgie
- akute infusionsbedingte Reaktionen, einschließlich anaphylaktische Reaktionen
- möglicherweise mit progressiver multifokaler Leukoenzephalopathie (PML) assoziiert
- Therapieüberwachung39
- Patientenpass aushändigen.
- regelmäßige Kontrolle auf neurologische Symptome (PML)
- Infusion nur in medizinisch professioneller Umgebung
Empfehlungen für Patient*innen
- Rauchen sollte unverzüglich beendet werden.
- Raucher*innen haben signifikant höhere Rezidivraten.40
- Ausgewogene Ernährung und möglichst wenige Nahrungsmittel ausschließen.41
- FODMAP
- Eine Metaanalyse aus dem Jahre 2017 zeigt, dass eine Low-FODMAP-Diät die Beschwerden lindern kann, jedoch sind weitere Studien notwendig.42
- Kindern und Jugendlichen und ihren Familien soll eine psychosoziale Unterstützung angeboten werden.3
- Komplementäre Therapien können bei Patientenwunsch supportiv eingesetzt werden.
Extraintestinale Manifestationen und ihre Therapie
- Generell sollte bei extraintestinalen Manifestationen die Notwendigkeit für eine Therapieintensivierung überprüft werden.3
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
Anämie
- Eisen
- Eine Eisensubstitution soll bei nachgewiesener Eisenmangelanämie eingeleitet werden.
- Bei milder Eisenmangelanämie (Hämoglobin 11–11,9 g/dl bei nicht-schwangeren Frauen oder 11–12,9 g/dl bei Männern) und fehlender Entzündungsaktivität kann die orale Eisengabe erfolgen.
- Bei Nichtansprechen auf orale Eisensubstitution oder bei moderater oder schwerer Anämie oder aktiver CED soll eine intravenöse Eisensubstitution erfolgen.
- Vitamin-B12-Mangelanämie
- Bei einem Vitamin B12-Mangel, der auf einer Mangelernährung beruht, kann die Substitution peroral erfolgen.
- Bei Resektion des terminalen Ileums oder Entzündung des terminalen Ileums sollte eine parenterale Substitution erfolgen.
- Folsäure
- Ein Folsäuremangel sollte bei makrozytärer Anämie primär peroral ausgeglichen werden.
- Erythropoetin
- Bei refraktärer Anämie trotz Eisensubstitution und Optimierung der CED-Therapie sollte nach Ausschluss anderer Ursachen ein Therapieversuch mit Erythropoetin-Derivaten unternommen werden.
- Bluttransfusion
- Bluttransfusionen mit Erythrozytenkonzentraten sollen restriktiv nach den Kriterien des Patient-Blood-Management und nur bei schwerer, symptomatischer Anämie erfolgen.
Augenerkrankungen
- Bei Verdacht auf eine okuläre Manifestation sollen eine fachärztliche ophthalmologische Untersuchung und Mitbehandlung durchgeführt werden.
- Etwa 4–12 % der Patient*innen sind betroffen, am häufigsten Episkleritis.
Gelenkbeteiligung
- Eine analgetische Therapie kann mit physikalischen Maßnahmen oder mit Paracetamol, Metamizol, COX2-Hemmern und ggf. niedrig potenten Opioiden durchgeführt werden, falls eine Intensivierung der CED-Therapie nicht ausreichend wirksam ist.
- Unselektive NSAR sollten nicht bei CED eingesetzt werden.
- Zur Behandlung der peripheren Arthritiden sollten Sulfasalazin, Methotrexat oder TNF-alpha-Antikörper eingesetzt werden.
- Axiale Spondyloarthritiden sollten mit TNF-αalpha-Antikörpern behandelt werden.
Hautmanifestationen
- Erythema nodosum
- korreliert häufig mit einer intestinalen Krankheitsaktivität
des Morbus Crohn - Deshalb sollte primär eine Therapieintensivierung erfolgen.
- korreliert häufig mit einer intestinalen Krankheitsaktivität
- Pyoderma gangraenosum
- Zunächst und zeitlich befristet hochdosierte systemische Steroidtherapie und bei fehlendem Therapieerfolg Therapie mit Calcineurininhibitoren oder eine TNF-alpha-Antikörpertherapie
Primär sklerosierende Cholangitis (PSC)
- Beim Nachweis einer PSC kann Ursodesoxycholsäure eingesetzt werden.
Osteopenie/Osteoporose
- Bei Nachweis einer Osteopenie/Osteoporose sollte eine Therapieintensivierung der Grunderkrankung erwogen, eine Vitamin-D-Substitution begonnen, ein Nikotinabusus beendet, bei bestehendem Untergewicht eine Ernährungstherapie eingeleitet und regelmäßiger Sport empfohlen werden.
Nephrolithiasis
- Bei Patient*innen mit nachgewiesenen Oxalatnierensteinen sollte eine oxalatarme Ernährung erfolgen.
Thrombophilie
- Bei stationären und/oder immobilisierten Patient*innen mit CED sollte eine medikamentöse Thromboseprophylaxe erfolgen.
- Bei nachgewiesener tiefer Beinvenenthrombose und/oder Lungenembolie besteht bei Patient*innen mit CED keine allgemeine Kontraindikation für eine therapeutische Antikoagulation.
Fatigue
- Patient*innen mit Fatigue kann eine regelmäßige physische Aktivität und eine Strukturierung des Tagesablaufs empfohlen werden.
- Eine psychotherapeutische Behandlung kann eine Minderung der Symptomlast begünstigen.
Operative Therapie
- Patient*innen mit komplexer Erkrankung sollten interdisziplinär diskutiert und chirurgische Optionen frühzeitig im Behandlungskonzept berücksichtigt werden.6
- Komplexe Operationen bei M. Crohn sollten von CED-erfahrenen Chirurg*innen in Zentren durchgeführt werden.6
- Die Indikation zur Operation sollte immer unter Berücksichtigung der Gesamtsituation der Patient*innen und nie aufgrund eines Endoskopie- oder Radiologiebefunds allein erfolgen.
- Falls eine Darmresektion nötig wird, sollte eine segmentale, sparsame Resektion durchgeführt werden, um ein Kurzdarmsyndrom zu vermeiden.6
- Postoperativ kann bei lokalisiertem Befall mit Entfernung des Crohn-tragenden Darmsegments ggf. auf eine remissionserhaltende Therapie verzichtet werden.34
- endoskopische Kontrolle nach 6 Monaten sinnvoll
Operationsindikationen
- Notfalloperation
- Ileus, Perforation, fulminante Kolitis oder massive Blutung
- Elektive Operation
- bei kurzstreckigem, isoliertem Ileozökalbefall mit höherer Krankheitsaktivität6
- Viele dieser Patient*innen werden im weiteren Verlauf operiert werden müssen, sodass sie über die Möglichkeit einer frühen Operation aufgeklärt werden sollen.
- zielgerichtete Operation bei konkreten Problemen, z. B. Abszessen und Fisteln43
- Kolonstenosen unklarer Dignität6
- bei Wachstumsverzögerung, umschriebenem Befall oder anhaltender Krankheitsaktivität trotz optimierter konservativer Therapie soll eine elektive Operation bei Kindern und Jugendlichen frühzeitig erwogen werden.3
- bei kurzstreckigem, isoliertem Ileozökalbefall mit höherer Krankheitsaktivität6
Weitere Operationsindikationen
- Stenosen
- Fisteln
- Abszesse
- Bei abdominellen Abszessen sollte eine antibiotische Behandlung unter Beachtung der Vorgeschichte (insb. Antibiotikaanamnese) und der lokalen Resistenzlage in Kombination mit interventioneller oder chirurgischer Drainagebehandlung durchgeführt werden.6
Schwangerschaft
S3-Leitlinie: Diagnostik und Therapie des M. Crohn3
- Vor einer geplanten Konzeption soll bei Patientinnen mit M. Crohn eine Remission angestrebt werden.
- Akute Krankheitsschübe während der Schwangerschaft sollten ohne Verzögerung therapiert werden.
- Die bevorzugten Substanzen sind Steroide.
- Zudem kann der Einsatz von TNF-alpha-Antikörpern erwogen werden.
- Methotrexat soll vor einer geplanten Schwangerschaft abgesetzt werden. TNF-alpha-Antikörper und Thiopurine sollten während der Schwangerschaft bei weiter bestehender Indikation fortgeführt werden.
- Eine Fortführung oder Beendigung anderer Medikamente zur Therapie des M. Crohn einschließlich Vedolizumab und Ustekinumab während der Schwangerschaft sollte individuell geprüft werden.
- Steroide und Biologika sollten während der Stillzeit indikationsgerecht fortgeführt werden.
Verlauf, Komplikationen und Prognose
Verlauf
- Morbus Crohn ist eine chronische Erkrankung, die durch akute Schübe und Remissionsphasen gekennzeichnet ist.
- Nach dem Erreichen einer Remission besteht grundsätzlich das Risiko eines erneuten Schubes.3
- Das Risiko für die einzelnen Patient*innen ist schwer abzuschätzen.
- In klinischen Studien liegt die Rezidiv-Häufigkeit bei 30–60 % im 1. Jahr und von 40–70 % im 2. Jahr.
Komplikationen
- Ileus aufgrund von narbigen oder inflammatorischen Stenosen oder Briden
- Intraabdominale Abszesse
- Fistelbildung und perianale Läsionen
- Bakterielle Fehlbesiedlung des Dünndarms
- Malabsorption, Mangelzustand und Ernährungsprobleme
- Wachstumsverzögerung bei Kindern und Jugendlichen
- Extraintestinale Manifestationen
- Viele junge Patient*innen mit einer entzündlichen Darmerkrankung haben mit psychischen Problemen zu kämpfen und neigen zu Depression oder einem verminderten Selbstwertgefühl.
- Auch Eltern und Angehörige sind davon betroffen.
- Fatigue (Erschöpfungssyndrom)
- Häufig bei M. Crohn (29–77 %), kann die Lebensqualität und Arbeitsfähigkeit deutlich beeinträchtigen.44
- Osteoporose
- durch Vitamin-D-Mangel oder als Nebenwirkung der Steroid-Therapie
Prognose
- Insgesamt besteht eine gute Prognose mit einem extrem niedrigen Risiko für ein krankheitsbedingtes Versterben.45
Prognostisch ungünstige Faktoren20
- Aktiver Nikotinkonsum
- Junges Erstmanifestationsalter (< 40 Jahre)
- Notwendigkeit zur Steroidtherapie bei Erstdiagnose
- Perianale Erkrankung bei Erstdiagnose
- Komplexe perianale Erkrankung
- Stenosierende Erkrankung
- Gewichtsverlust von > 5 kg vor Diagnosestellung
- Jegliche Kolonresektion
- ≥ 2 Dünndarmresektionen
Verlaufskontrolle
Allgemeines
- Es sollten regelmäßige Verlaufskontrollen, sowohl bei der Hausärztin/beim Hausarzt als auch bei der Gastroenterologin/beim Gastroenterologen, erfolgen.
- Die Intervalle hängen u. a von der Krankheitsaktivität, -ausbreitung und/oder evtl. Komplikationen ab.
- Therapie und Verlaufskontrollen werden von Spezialist*innen durchgeführt, weitere Kontrollen können nach Rücksprache in der Hausarztpraxis erfolgen.
- Hierbei ist es wichtig, auf sekundäre psychische Probleme zu achten; regelmäßige Kontrollen können eine wichtige Hilfe sein.
Karzinomprophylaxe
- Eine spezifische Karzinomüberwachung sollte beim M. Crohn nur bei Kolonbefall analog zur Colitis ulcerosa durchgeführt werden.3
- Die Überwachungsstrategie für Colitis ulcerosa finden Sie im verlinkten Artikel unter „Karzinomüberwachung".
Vorgehen während der COVID-19-Pandemie
Leitlinie: Betreuung von CED-Patient*innen während der Covid-19-Pandemie46
- Patient*innen mit einer CED haben generell kein erhöhtes Risiko für eine Infektion mit SARS-CoV-2.
- Dennoch sollten Patient*innen sorgfältig individuelle Schutzmaßnahmen ergreifen.
- Patient*innen mit einer CED und einer immunsuppressiven Therapie haben ein erhöhtes Risiko für eine SARS-CoV-2-Infektion und sollten deshalb sorgfältig individuelle Schutzmaßnahmen umsetzen.
- Der Grad der Risikoerhöhung scheint dabei für einzelne Immunsuppressiva unterschiedlich zu sein.
- Patient*innen mit einer CED und einer SARS-CoV-2-Infektion haben unter bestimmten Bedingungen (Komorbiditäten/Risikofaktoren) ein erhöhtes Risiko für einen schweren Verlauf der COVID-Erkrankung.
- Diese Patient*innen sollten sorgfältig bezüglich einer raschen Verschlechterung ihrer Erkrankung überwacht werden.
- Patient*innen mit einer CED und einer immunsuppressiven Therapie haben generell kein erhöhtes Risiko für einen schweren Verlauf einer SARS-CoV-2-Infektion.
- Eine immunsuppressive Therapie sollte deshalb bei einer leichten bis moderaten COVID-Erkrankung nicht reduziert werden.
- Ausnahmen bilden die längerdauernde Therapie mit systemischen Steroiden insbesondere in Dosierungen größer 20 mg Prednisonäquivalent pro Tag.
- Diese sollte daher möglichst vermieden oder soweit klinisch vertretbar reduziert und beendet werden.
- Während der Sars-CoV-2-Pandemie sollte eine Biologika-Therapie mit zu erwartendem raschen Wirkeintritt gegenüber einer hochdosierten systemischen Steroidtherapie im akuten Schub bevorzugt eingesetzt werden.
- Bei Patient*innen mit schwerer COVID-19-Erkrankung sollte die Therapie mit Thiopurinen, Methotrexat und Tofacitinib pausiert und nach Überwinden der Infektion wieder aufgenommen werden.
- Hospitalisierte Patient*innen mit einer CED und COVID-19-Erkrankung sollten mindestens eine prophylaktische Thromboseprophylaxe erhalten.
- Bei ambulanten COVID-19-erkrankten Patient*innen sollte entsprechend ihres individuellen Risikoprofils und ihrer Begleitmedikation die Entscheidung für eine Thromboseprophylaxe großzügig getroffen werden.
- Während der Pandemie sollten Patientenvorstellungen in Einrichtungen des Gesundheitswesens restriktiv erfolgen.
- CED-Sprechstunden sollten unter Berücksichtigung der Dringlichkeit der Vorstellung und unter Optimierung der Infektionsschutzmaßnahmen wie räumlicher Distanzierung und nach Ausnutzen von Möglichkeiten der Telemedizin fortgeführt werden.
Patienteninformationen
Patienteninformationen in Deximed
Patientenorganisationen
Patientenleitlinie
- Morbus Crohn, Diagnostik und Therapie (nicht-fachsprachliche Version der S3-Leitlinie von 2021)
Illustrationen

Crohn-Ulkus im Sigma (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
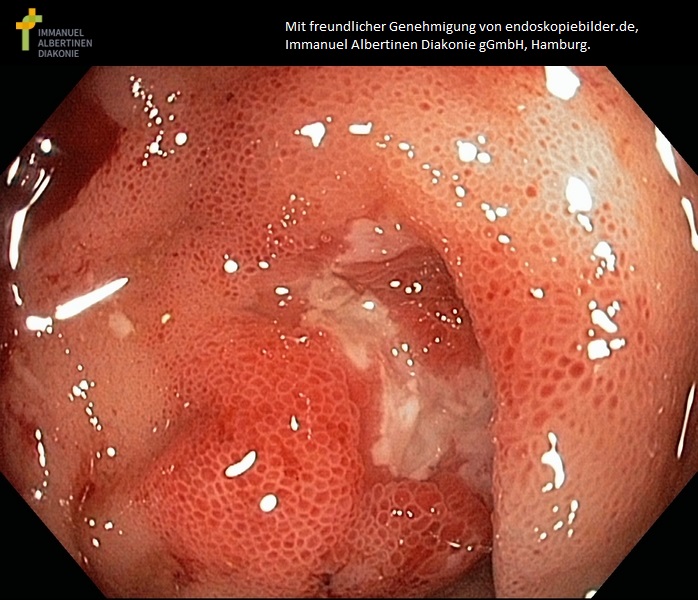
Ileitis terminalis (M. Crohn) (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Dickdarm, Übersicht

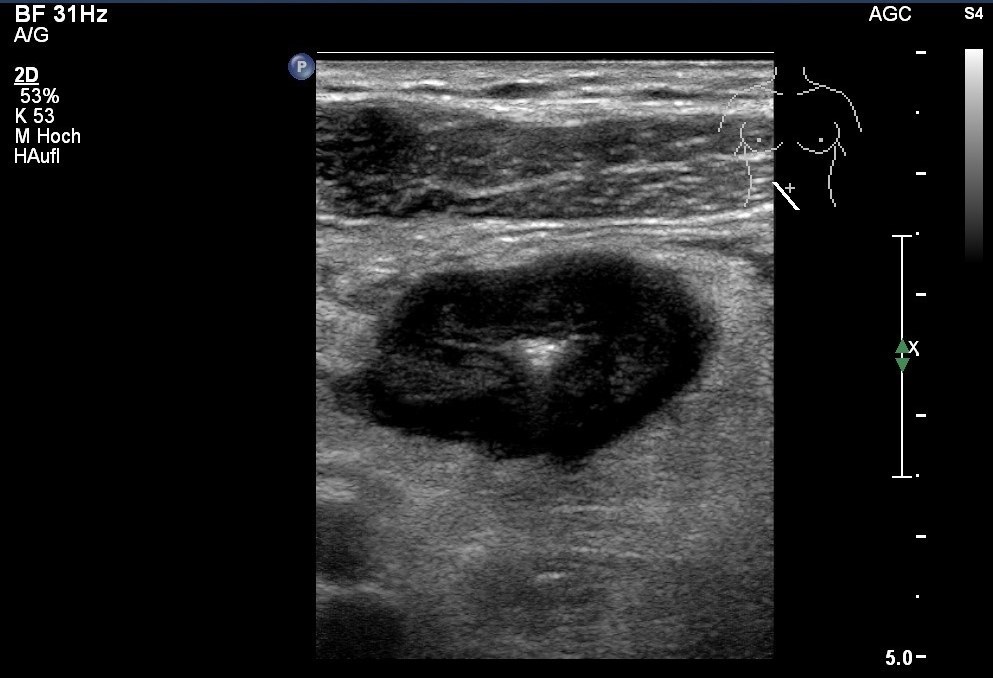

Sonografie: Echoarme Kokarde bei M. Crohn. Wandverdickung mit Lumeneinengung, echoreich verdicktes parakolisches Fettgewebe (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
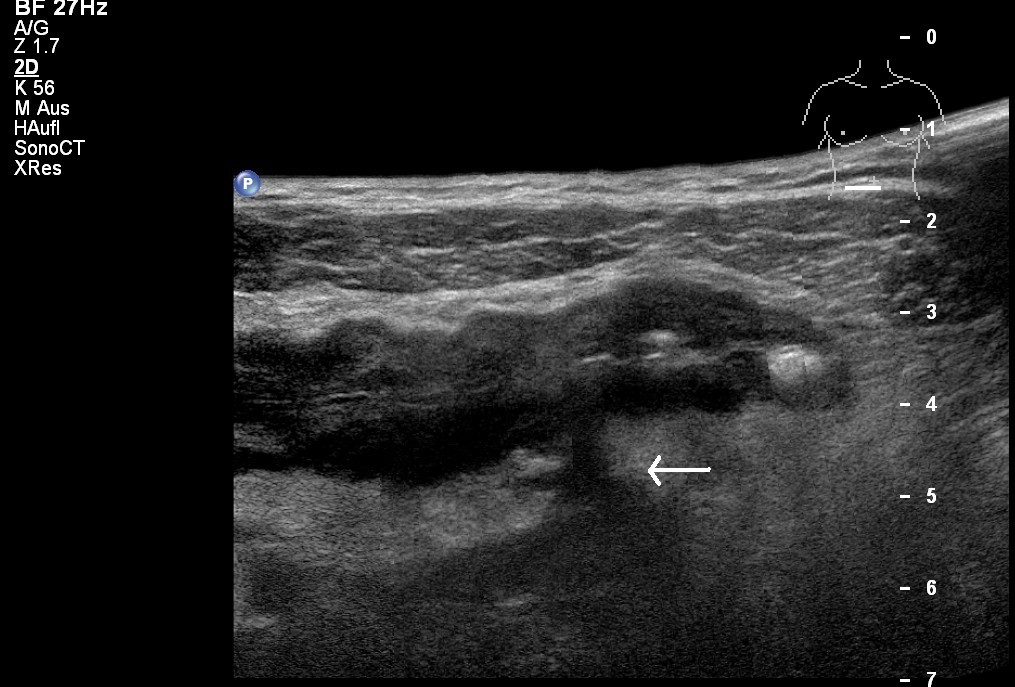
Sonografie: M. Crohn mit Fistel ins parakolische Fettgewebe (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Diagnostik und Therapie des M. Crohn. AWMF-Leitlinie Nr. 021-004. S3, Stand 2021. www.awmf.org
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Addendum zu den S3-Leitlinien Morbus Crohn und Colitis ulcerosa: Betreuung von Patienten mit chronisch–entzündlichen Darmerkrankungen in der COVID-19 Pandemie. Stand 2020. www.awmf.org
Literatur
- Wilkins T, Jarvis K, Patel J. Diagnosis and management of Crohn's disease. Am Fam Physician 2011; 84: 1365-75. www.ncbi.nlm.nih.gov
- Reinsahen M. Perianale Fisteln bei Morbus Crohn. Gastro-News 2019; 6: 43-50. link.springer.com
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Diagnostik und Therapie des M. Crohn. AWMF-Leitlinie Nr. 021-004, Stand 2021. www.awmf.org
- Best WR, Becktel JM, Singleton JW, et al. Development of a Crohn's disease activity index. National Cooperative Crohn's Disease Study. Gastroenterology 1976; 70(3): 439-44. pubmed.ncbi.nlm.nih.gov
- Ott C, Obermeier F, Thieler S et al. The incidence of inflammatory bowel disease in a rural region of Southern Germany: a prospective population-based study. Eur J Gastroenterol Hepatol 2008; 20: 917-23. pubmed.ncbi.nlm.nih.gov
- Preiß JC, Bokemeyer B, Buhr HJ, et al. Updated German clinical practice guideline on “diagnosis and treatment of Crohn‘s disease”. Z Gastroenterol 2014; 52: 1431–84. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e.V.. Patientenleitlinie "Diagnostik und Therapie des Morbus Crohn". Stand 2021. www.awmf.org
- Loftus CG, Loftus EV, Jr., Harmsen WS et al. Update on the incidence and prevalence of Crohn's disease and ulcerative colitis in Olmsted County, Minnesota. Inflamm Bowel Dis 2007; 13: 254-61. pubmed.ncbi.nlm.nih.gov
- Kalla R, Ventham NT, Satsangi J, et al. Crohn's disease. BMJ. 2014 Nov 19;349:g6670. doi: 10.1136/bmj.g6670. DOI
- Suryaprasad AG, Prindiville T. The biology of TNF blockade. Autoimmun Rev 2003; 2: 346-57. PubMed
- Halme L, Paavola-Sakki P, Turunen U, et. al. Family and twin studies in inflammatory bowel disease. World J Gastroenterol 2009; 12: 3668-72. PubMed
- Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002; 347: 417-29. PubMed
- Hampe J, Cuthbert A, Croucher PJP, Mirza MM et al. Association between insertion mutation in NOD2 gene and Crohn's disease in German and British populations . Lancet 2001; 357: 1925-8. PubMed
- Abraham C, Cho JH. Inflammatory bowel disease. N Engl J Med 2009; 361: 2066-78. New England Journal of Medicine
- Takeuchi K, Smale S, Premchand P, et al. Prevalence and mechanism of nonsteroidal anti-inflammatory drug-induced clinical relapse in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2006; 4: 196-202. PubMed
- Rath HC, Schultz M, Freitag R, et al. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect Immun 2001; 69: 2277-85. PubMed
- Feagan BG. Maintenance therapy for inflammatory bowel disease. Am J Gastroenterol 2003; 98: 6-17. PubMed
- Andersson RE, Olaison G, Tysk C et a. Appendectomy is followed by increased risk of Crohn's disease. Gastroenterology 2003; 124(1): 40-6. pubmed.ncbi.nlm.nih.gov
- Garcia Rodriguez LA, Ruigomez A, Panes J. Acute gastroenteritis is followed by an increased risk of inflammatory bowel disease. Gastroenterology 2006; 130: 1588-1594. pubmed.ncbi.nlm.nih.gov
- Fischer S, Neurath MF. Leitliniengerechte Therapie des Morbus Crohn. Gastroenterologe 2019; 14: 423-30. doi.org
- Tibble J, Teahon K, Thjodleifsson B, Roseth A, Sigthorsson G, Bridger S, Foster R, Sherwood R, Fagerhol M, Bjarnason I. A simple methood for assessing intestinal inflammation in Crohns's disease. Gut 2000; 47: 506-13. www.ncbi.nlm.nih.gov
- Yamamato T. The clinical value of faecal calprotectin and lactoferrin measurement in postoperative Crohn's disease. United European Gastroenterology Journal 2015; 3: 5-10. doi:10.1177/2050640614558106. DOI
- Holtman GA, Lisman-van Leeuwen Y, Reitsma JB, et al.. Noninvasive tests for inflammatory bowel disease: A meta-analysis.. Pediatrics 2016; 137: 1-11. doi:10.1542 pediatrics.aappublications.org
- van Rheenen PF, de Vijver EV, Fidler V. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. BMJ 2010; 341: c3369. BMJ (DOI)
- Yang Z, Clark N, Park KT. Effectiveness and cost-effectiveness of measuring fecal calprotectin in diagnosis of inflammatory bowel disease in adults and children. Clin Gastroenterol Hepatol 2014; 12: 253-62. pmid:23883663 PubMed
- Dong J, Wang H, Zhao J, Zhu W, et al. Ultrasound as a diagnostic tool in detecting active Crohn's disease: a meta-analysis of prospective studies. Eur Radiol. 2014 Jan;24(1):26-33. doi: 10.1007/s00330-013-2973-0. www.ncbi.nlm.nih.gov
- Wang H, Zhao J, Zhu W, et al. Ultrasound as a diagnostic tool in detecting active Crohn's disease: a meta-analysis of prospective studies. Eur Radiol. 2014 ;24(1):26-33. doi: 10.1007/s00330-013-2973-0. DOI
- Frøslie KF, Jahnsen J, Moum BA, et al. Mucosal healing in inflammatory bowel disease: results from a Norwegian population- based cohort. Gastroenterology 2007; 133: 412-22. pubmed.ncbi.nlm.nih.gov
- Gomollón F et al. 3rd European evidence- based consensus on the diagnosis and management of Crohn’s disease 2016: part 1: diagnosis and medical management on behalf of ECCO. Journal of Crohn's and Colitis 2017; 11(1): 3-25. doi.org
- Chande N, Patton PH, Tsoulis DJ, et al. Azathioprin oder 6-Mercaptopurin zur Erhaltung einer Remission bei Morbus Crohn. Cochrane Review 2015. www.cochrane.org
- Ratiopharm. Fachinformation Azathioprin. Stand 2018. Letzter Zugriff 31.12.2021. www.ratiopharm.de
- Ratiopharm. Fachinformation MTX. Stand 2019. Letzter Zugriff 31.12.2021. www.ratiopharm.de
- MSD. Fachinformation Remicade. Stand 2009. Letzter Zugriff 31.12.2021. www.ema.europa.eu
- Lichtenstein GR et al. ACG Clinical Guideline: Management of Crohn's Disease in Adults. Am J Gastroenterol 2018; 113: 481-517. pubmed.ncbi.nlm.nih.gov
- Eckert N. Chronisch-entzündliche Darmerkrankungen: Ustekinumab wirkt bei M. Crohn. Dtsch Arztebl 2017; 114(14): 691. www.aerzteblatt.de
- Janssen. Fachinformation Stelara. Stand 2013. Letzter Zugriff 01.01.2022. www.ema.europa.eu
- Deutsche Gesellschaft für Rheumatologie. Behandlung mit Ustekinumab. Stand 2021. Letzter Zugriff 01.01.2022. dgrh.de
- Dingermann T. Der kleine Unterschied. Pharmazeutische Zeitung 2019. www.pharmazeutische-zeitung.de
- Takeda. Fachinformation Entyvio. Stand 2018. Letzter Zugriff 01.01.2022. www.ema.europa.eu
- Cosnes J, Beaugerie L, Carbonnel F et al. Smoking cessation and the course of Crohn's disease: an intervention study. Gastroenterology 2001;120:1093-9. www.ncbi.nlm.nih.gov
- Kelly D, Fleming R. Nutritional considerations in inflammatory bowel disease. Gastroenterol Clin North Am 1995; 24: 597-611. www.ncbi.nlm.nih.gov
- Zhan YL, Zhan YA, Dai SX. Is a low FODMAP diet beneficial for patients with inflammatory bowel disease? A meta-analysis and systematic review. Clin Nutr. 2017 May 24. pmid:28587774 PubMed
- Farmer RG, Hawk WA, Turnbull RB, Jr. Indications for surgery in Crohn's disease: analysis of 500 cases. Gastroenterology 1976;71:245-50. www.ncbi.nlm.nih.gov
- Grimstad T, Norheim KB, Isaksen K et al. Fatigue in Newly Diagnosed Inflammatory Bowel Disease. J Crohns Colitis 2015; 9: 725-30. pmid:25994356 PubMed
- Ghazi LJ. Crohn Disease. Medscape, last updated Jul 26, 2019. emedicine.medscape.com
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Addendum zu den S3-Leitlinien Morbus Crohn und Colitis ulcerosa „Betreuung von Patienten mit chronisch–entzündlichen Darmerkrankungen in der COVID-19 Pandemie". AWMF-Register-Nr. 021 – 030, 021 -009, 021-004. www.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung Allgemeinmedizin, Frankfurt a. M.
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).