Zusammenfassung
- Definition:Karzinom des Kolons oder Rektums. Fast 2/3 davon sind im Rektum und Colon sigmoideum lokalisiert. 98 % sind Adenokarzinome. Die Ursachen sind genetische und Umweltfaktoren.
- Häufigkeit:Die Lebenszeitinzidenz beträgt ca. 5 % bei Männern und ca. 4 % bei Frauen. Die Inzidenz liegt in Deutschland bei etwa 40/100.000/Jahr; das kolorektale Karzinom ist die zweithäufigste krebsbedingte Todesursache bei Männern und Frauen.
- Symptome:Die Symptome hängen von der Lokalisation ab und treten in der Regel erst bei fortgeschrittener Erkrankung auf. Die häufigsten Spätsymptome sind veränderter Stuhl, Gefühl der unvollständigen Darmentleerung, Anämie, Blut oder Schleim im Stuhl und Schmerzen bei der Defäkation.
- Befunde:Der klinische Befund hängt von der Lokalisation ab. Durch rektale Palpation können bis zu 10 % der Fälle erkannt werden. Ansonsten Befunde nur in der Bildgebung einschließlich Endoskopie.
- Diagnostik:Komplette Koloskopie ist Goldstandard. Evtl. Rektoskopie bei Verdacht auf Rektumkarzinom. Die Histologie bestätigt die Diagnose.
- Therapie:Das Karzinom wird chirurgisch möglichst komplett reseziert. Bei einem fortgeschrittenen Kolonkarzinom ist meist eine adjuvante Chemotherapie, bei fortgeschrittenem Rektumkarzinom eine neoadjuvante Radiochemotherapie angezeigt. Metastasen werden medikamentös, evtl. mit Strahlentherapie, und in einigen Fällen chirurgisch oder mit lokoregionär ablativen Verfahren behandelt.
Allgemeine Informationen
- Sofern nicht anders gekennzeichnet, basiert dieser Abschnitt auf der S3-Leitlinie Kolorektales Karzinom.1
Definition
- Maligner Tumor im Kolon oder Rektum
- Fast 2/3 der Karzinome sind im Rektum und Colon sigmoideum lokalisiert.
- Der Großteil sind Adenokarzinome.
TNM-Klassifikation (Tumor, Nodes, Metastases) von kolorektalen Karzinomen (KRK)2-3
- TX: keine Aussage über den Primärtumor möglich
- Tis: Tumor in situ
- T1: Tumorausbreitung in die Submukosa
- T2: Tumorausbreitung in die Tunica muscularis (Muscularis propria)
- T3: Tumorausbreitung in die Subserosa oder ins perirektale/perikolische Gewebe
- T4a: Tumorausbreitung in das viszerale Peritoneum
- T4b: Befall anderer Organe oder Strukturen
- N0: keine Anzeichen für Lymphknotenbefall
- N1: Metastasen in 1–3 regionären Lymphknoten
- N2: Metastasen in 4 oder mehr regionären Lymphknoten
- M0: keine Anzeichen für Fernmetastasen
- M: Fernmetastasen
UICC-Stadieneinteilung von kolorektalen Karzinomen4
- Siehe Tabelle: Kolorektales Karzinom, Klassifikation der Tumorstadien (UICC).
Dukes-Klassifikation (TNM- oder UICC-Systeme werden empfohlen)5
- Stadium A: Der Tumor infiltriert die Submukosa oder Lamina muscularis mucosae, keine lokalen oder Fernmetastasen (entspricht T1–2).
- Stadium B: Der Tumor infiltriert die Muscularis propria und die Subserosa, keine lokalen oder Fernmetastasen (entspricht T3–4).
- Stadium C: Tumorinfiltration und lokale Metastasen in die Lymphknoten (C1 entspricht N1, C2 entspricht N2)
- Stadium D: Tumorinfiltration und Fernmetastasen (entspricht M1)
Häufigkeit
- Der Abschnitt basiert auf dieser Referenz.6
- Neuerkrankungen in Deutschland 2018
- ca. 33.920 Männer und 26.710 Frauen
- rohe Neuerkrankungsrate
- Männer 82,9/100.000
- Frauen 63,3/100.000
- europabezogen standardisierte Neuerkrankungsrate
- Männer 52,1/100.000
- Frauen 32,7/100.000
- Kolorektale Karzinome zählen zu den häufigsten Tumorerkrankungen in Deutschland.
- bei Frauen zweithäufigste
- bei Männern dritthäufigste
- bei beiden Geschlechtern zweithäufigste Ursache für Krebssterblichkeit
- Lebenszeitrisiko und Mortalität
- Das Lebenszeitrisiko, an einem kolorektalen Karzinom zu erkranken, beträgt 4–6 %.
- Das Risiko, an einem kolorektalen Karzinom zu versterben, liegt bei 2,5–3 %.
Ätiologie und Pathogenese
Genetische Faktoren
- Erbliche Faktoren spielen eine Rolle.
- Das scheint insbesondere bei rechtsseitigen Karzinomen zuzutreffen.
- Der Nutzen vorgezogener Früherkennungsuntersuchungen bei Personen mit familiärer Belastung ist allerdings ungewiss.7
- Familiäre Häufung
- Verwandte 1. Grades von KRK-Erkrankten haben ein erhöhtes Risiko, selbst ein KRK zu bekommen.8
- Das Ersterkrankungsalter ist bei diesen deutlich niedriger als bei Menschen ohne betroffene Verwandte.
- Genetische Risikogruppen
- hereditäres nonpolypöses Kolonkarzinom (HPNCC), dominant vererbbar, Penetranz bei 70–85 %
- Familiäre adenomatöse Polyposis (FAP), dominant vererbbar: Unbehandelt erkranken alle Familienmitglieder vor dem 40. Lebensjahr an Krebs.
Lebensstil
- Ballaststoffarme Ernährung
- inverse Korrelation zwischen Ballaststoffaufnahme und Karzinomrisiko
- Fleischkonsum
- Der Verzehr von rotem und verarbeitetem Fleisch erhöht das Risiko für Karzinome in den distalen Bereichen des Kolons.
- Übermäßiger Alkoholkonsum
- Erhöht das KRK-Risiko, besonders bei unzureichender Folsäure- und/oder Methioninaufnahme.
- Rauchen
- Erhöht das Risiko für Kolonadenome und kolorektale Karzinome.
Prädisponierende Faktoren
- Alter
- 1 % unter 40 Jahren
- 5 % unter 50 Jahren
- Adenom/Dysplasie-Sequenz
- Polypen > 1–1,5 cm
- 30 % aller sporadisch auftretenden kolorektalen Karzinome bilden sich aus Sägezahn-Adenomen oder Polypen, insbesondere aus breitbasigen Polypen.
- Dysplasien gehen mit einem erhöhten Karzinomrisiko einher.
- je nach Anzahl, Größe und Auftreten Kontrollkoloskopie nach 1–5 Jahren
- Genetische Faktoren und Lebensstilfaktoren (s. o.)
- Entzündliche Darmerkrankungen
- Chronische entzündliche Darmerkrankungen werden mit der Ausbildung von Dysplasien und Karzinomen in Verbindung gebracht.
- Die Therapie mit 5-Aminosalicylsäure (5-ASA) oder Sulfasalazin bei einer Colitis ulcerosa reduziert die Wahrscheinlichkeit für das Auftreten eines KRK.
- Orale 5-ASA ist nicht wirksamer als orales Sulfasalazin, scheint aber besser verträglich zu sein.9
- Da bei Colitis ulcerosa die Kolonkarzinom-Mortalität durch eine endoskopische Überwachung gesenkt werden kann, sollen regelmäßige Überwachungskoloskopien erfolgen (IIIa/A).9 Siehe Artikel Colitis ulcerosa, Abschnitt Verlaufskontrolle.
- Bei Crohn-Colitis ist der Nutzen eines endoskopischen Überwachungsprogramms zur Früherkennung eines Karzinoms ungeklärt. Näheres siehe Artikel Morbus Crohn.
ICPC-2
- D75 Bösartige Neubildung Colon/Rektum
ICD-10
- Nach ICD-10-GM Version 202310
- C18 Bösartige Neubildung des Kolons
- C18.0 Zäkum
- C18.1 Appendix vermiformis
- C18.2 Colon ascendens
- C18.3 Flexura coli dextra [hepatica]
- C18.4 Colon transversum
- C18.5 Flexura coli sinistra [lienalis]
- C18.6 Colon descendens
- C18.7 Colon sigmoideum
- C18.8 Kolon, mehrere Teilbereiche überlappend
- C18.9 Kolon, nicht näher bezeichnet
- C19 Bösartige Neubildung am Rektosigmoid, Übergang
- C20 Bösartige Neubildung des Rektums
Diagnostik
Diagnostische Kriterien
- Histologie aufgrund einer Biopsie nach einer Endoskopie oder chirurgischen Tumorresektion
Differenzialdiagnosen
- Benigne Adenome
- Primäre Obstipation
- IBS (Reizdarmsyndrom)
- Entzündliche Darmerkrankungen (Morbus Crohn oder Colitis ulcerosa)
Screening
Leitlinie: Kolorektales Karzinom1und Richtlinie Früherkennung von Krebserkrankungen11
- Mit der Darmkrebs-Vorsorge/-Früherkennung für die asymptomatische Bevölkerung sollte ab dem Alter von 50 Jahren begonnen werden.
- Es ist vorgesehen, dass die gesetzlichen Krankenversicherungen ihre Versicherten im Alter von 50, 55, 60 und 65 Jahren schriftlich zur Untersuchung einladen.
- Eine obere Altersbegrenzung für die Darmkrebsvorsorge/-früherkennung kann bei steigender Lebenserwartung nicht gegeben werden.
- Hier ist eine individuelle Entscheidung unter Berücksichtigung der Begleiterkrankungen angezeigt.
Koloskopiescreening
- Die Richtlinien des Gemeinsamen Bundesausschusses über die Früherkennung von Krebserkrankungen11 sehen ein allgemeines Koloskopie-Screening für alle Männer ab dem 50. Lebensjahr und für alle Frauen ab dem 55. Lebensjahr vor.
- Männer im Alter zwischen 50 und 54 Jahren können zwischen einem Test auf okkultes Blut und einer Koloskopie wählen.
- Versicherte haben ab diesem Zeitpunkt Anspruch auf insgesamt 2 Koloskopien zur Früherkennung.
- Die 2. Koloskopie kann frühestens 10 Jahre nach Durchführung der 1. Koloskopie beansprucht werden.
- Jede ab dem Alter von 65 Jahren durchgeführte Koloskopie zählt als 2. Koloskopie.
- Verwandte 1. Grades von Patient*innen, bei denen ein Adenom oder Kolonkarzinom vor dem 50. Lebensjahr nachgewiesen wurde, sollten 10 Jahre vor dem Lebensalter zum Zeitpunkt des Adenom- bzw. Karzinomnachweises koloskopiert werden.
- bei Verwandten von Patient*innen mit kolorektalem Karzinom spätestens im Alter von 40–45 Jahren
- Bei unauffälligem Befund sollte die Koloskopie mindestens alle 10 Jahre wiederholt werden.
- Nachkontrollen aller Patient*innen mit einem Adenom über 1 cm, multiplen oder villösen Adenomen
- Laut Berechnungen könnten damit 70 % aller distalen Karzinome bis zum 75. Lebensjahr und 50 % bis zum 75.–80. Lebensjahr verhindert werden.
Bei familiärer adenomatöser Polyposis (FAP, Polyposis coli)
- Allen Familienmitgliedern wird ab dem 10. Lebensjahr im Anschluss an eine humangenetische Beratung eine prädiktive genetische Diagnostik empfohlen.
- Familienmitglieder, bei denen die Mutation bestätigt oder nicht ausgeschlossen wurde, sollten ab dem 10. Lebensjahr jährlich rektosigmoidoskopiert werden.
- Bei Nachweis von Adenomen sollte jährlich eine vollständige Koloskopie erfolgen.
- Finden sich keine Polypen, erfolgt die Koloskopie erstmals im Alter von 15 Jahren und ab dem 20. Lebensjahr jährlich.
- Bei nachgewiesener FAP ist eine Proktokolektomie indiziert, wenn möglich nach Abschluss der Pubertät.
- Polypen an anderen Stellen
- Patient*innen mit FAP haben häufig Polypen im Duodenum, etwas weniger im Magen.
- Eine regelmäßige Ösophago-Gastro-Duodenoskopie wird spätestens ab dem 25. bis 30. Lebensjahr empfohlen; bei unauffälligem Befund im 3-Jahres-Abstand, kürzere Intervalle je nach Befund.
Wirksamkeitsnachweise
- Das Screening mittels Sigmoidoskopie, und möglicherweise in noch höherem Grad mittels Koloskopie12, führt zu einer geringeren Sterblichkeit aufgrund von KRK.13
- Senkung der KRK-Inzidenz um 1/3
- Senkung der Sterblichkeit an KRK um fast die Hälfte
- Dass durch die Teilnahme am Screening die Gesamtmortalität gesenkt werden kann, das heißt, die durchschnittliche Lebenserwartung verbessert werden kann, ist nicht belegt. Die bislang relativ niedrige Akzeptanz des Koloskopiescreenings in der Bevölkerung limitiert allerdings die Aussagekraft der bisherigen Studien.
- Die Sigmoidoskopie gehört in Deutschland nicht zu den gängigen diagnostischen Verfahren. Von einer Koloskopie sind jedoch mindestens so hohe Effekte auf die KRK-Morbidität und Mortalität zu erwarten.
- Auch das Screening auf okkultes Blut im Stuhl führt zu einer geringeren Sterblichkeit aufgrund von KRK. Der Rückgang entspricht der Größenordnung des Screenings mittels Sigmoidoskopie.14
- Verschiedene Studien haben gezeigt, dass das Screening auf Blut im Stuhl in der Altersklasse 50–74 Jahre einen positiven Test in 7–8 % der Fälle ausweist.15
- In einer Studie zeigten ca. 40 % dieser Patient*innen ein fortgeschrittenes Adenom oder Karzinom bei einer nachfolgenden Koloskopie.15
- Der Anteil mit positivem Test hängt von der Testart, der Toleranzgrenze und dem Alter der getesteten Gruppe ab.
- Die Deutsche Gesellschaft für Innere Medizin rät im Rahmen ihrer Initiative Klug Entscheiden von einem Screening auf okkultes Blut im Stuhl bei Personen ab, die an einer Koloskopie-Vorsorge teilnehmen.
- Verschiedene Studien haben gezeigt, dass das Screening auf Blut im Stuhl in der Altersklasse 50–74 Jahre einen positiven Test in 7–8 % der Fälle ausweist.15
- In einer nordamerikanischen Studie mit einer Nachsorge über 30 Jahre konnte eine geringere Sterblichkeit an KRK im Vergleich zur Kontrollgruppe festgestellt werden, während sich die Sterblichkeit insgesamt bei beiden Gruppen nicht unterschied.16
Anamnese
- Symptome treten meist erst in fortgeschrittenen Stadien auf, insbesondere, wenn sich der Tumor im rechten Kolon befindet.
- Bei distalen Tumoren kann es auch im frühen Stadium zu Symptomen kommen:
- veränderter Stuhlgang
- Gefühl der unvollständigen Darmentleerung
- evtl. Blut im Stuhl
- Schleim im Stuhl
- Schmerzen bei der Defäkation.
- Dunkler Stuhl, Diarrhö, Gewichtsverlust und Subileus/Ileus sind weitere Symptome, die an ein KRK denken lassen sollten.
- Auftreten einer Anämie
- Sepsis mit Fäkalkeimen (Streptococcus bovis, Clostridium septicum)
Klinische Untersuchung
- Durch die Bauchdecke tastbare Raumforderung, insbesondere an den Flanken?
- Tumor der Leber?
- Palpabler Tumor bei digital-rektaler oder gynäkologischer Untersuchung?
- Anzeichen von Anämie?
Ergänzende Untersuchungen in der Hausarztpraxis
- Blut im Stuhl: immunchemischer Stuhlbluttest (iFOBT; Nachweis von humanem Hämoglobin mithilfe von Antikörpern)17
- Sensitivität 79 %
- Spezifität 94 %
- Ein Einzeltest hat die gleiche Sensitivität und Spezifität wie ein wiederholter Test.
- Hb, Leukozyten, Na, K, Ca, Ferritin, Kreatinin, Albumin, BSG, CRP
- Leberfunktionstest (möglicher Hinweis auf Metastasen)
- Ggf. Ultraschall des Abdomens
Diagnostik bei Spezialist*innen
Endoskopie mit Biopsie
- Anorektoskopie
- nur bei Verdacht auf Rektumkarzinom
- Bei Blutungen sollte eine vollständige Koloskopie durchgeführt werden.
- Flexible Sigmoidoskopie
- Nachweis von ca. 60 % aller Krebserkrankungen; ist in Deutschland zum Screening nicht vorgesehen.
- Koloskopie
- „Goldstandard“ zur Diagnostik des KRK
- Möglichkeit, Polypen zu entfernen.
- Indikation bei hohem Alter und schlechtem Allgemeinzustand der Patient*innen sorgfältig abwägen.
Weitere bildgebende Verfahren
- CT von Abdomen und Thorax
- Ausbreitungsdiagnostik
- Die besten Ergebnisse bietet das Mehrschicht-CT (MSCT).1
- Zystoskopie und evtl. Urografie
- bei Rektumkarzinom mit Verdacht auf Infiltration in Blase oder Harnleiter
- Kolposkopie
- im Rahmen der gynäkologischen Untersuchung
- Endosonografie (transrektaler Ultraschall)
- Dies ist bei kleinen und äußerlichen Tumoren das genaueste Verfahren, die Genauigkeit hängt aber auch von der Geschicklichkeit der durchführenden Ärzt*innen ab.
- Virtuelle Kolonografie
- Ein diagnostisches Verfahren, mit dem mittels CT- oder MRT-Daten die Innenwand von Kolon und Rektum endoskopieähnlich abgebildet werden kann.
- Scheint nicht die Sensitivität und Spezifität einer Koloskopie zu erreichen.16-18
- Kommt nur in speziellen klinischen Situationen infrage, z. B. bei inkompletter Koloskopie aufgrund eines stenosierenden Tumors.
Indikationen zur Überweisung
- Koloskopie im Rahmen der Krebsfrüherkennung ab dem 55. Lebensjahr
- Bei Risikopatient*innen entsprechend der Leitlinien frühere Koloskopie (siehe Leitlinienkasten im Abschnitt Screening)
- Bei Nachweis von Blut im Stuhl
- Bei klinischem Verdacht auf ein KRK
Therapie
- Sofern nicht anders gekennzeichnet, basiert dieser Abschnitt auf der S3-Leitlinie Kolorektales Karzinom.1
Therapieziele
- Heilung, erhöhte Lebensqualität, Symptomlinderung je nach Stadium19-20
- Tumor entfernen, um eine Obstruktion und Perforation des Darms zu verhindern.
- Permanentes Stoma vermeiden.
- Metastasierung verhindern und ggf. Metastasen reduzieren.
- Nebenwirkungen der Therapie möglichst gering halten.
Therapie im Überblick
Entscheidungsebenen
- Allgemeinzustand: Wie gut kann die betroffene Person eine intensive Therapie tolerieren?
- ggf. Ausweichen auf weniger invasive Verfahren
- Krankheitsausdehnung und Lokalisation: Resezierbar? Lokoregionäre Intervention möglich?
- 1/3 der Patient*innen hat bei der Diagnose bereits Fernmetastasen. Die Möglichkeit der kurativen Resektion sollte in diesem Fall durch ein multidisziplinäres Team beurteilt werden.
- Bei primär resektabler Metastasierung soll die Operationsfähigkeit geprüft werden. Ist diese primär nicht gegeben, so sollte die Operabilität und Resektabilität in regelmäßigen, nachfolgenden Untersuchungen (z. B. alle 8 Wochen) geklärt werden.
- Molekularbiologie des Tumors: Molekular zielgerichtete Therapie?
- Die Bestimmung von RAS- und BRAF-Mutationen im Tumorgewebe soll möglichst noch vor Einleitung der Erstlinientherapie erfolgen.
Standardtherapie nach Stadium – UICC (TNM, Dukes)
- Stadium I (T1–T2, Stadium A)
- chirurgische Resektion und Anastomose
- Stadium IIA–IIB (T3–T4, Stadium B)
- chirurgische Resektion und Anastomose
- evtl. Strahlentherapie bei Rektumkarzinom
- adjuvante Chemotherapie in ausgewählten Risikosituationen (IIIb/B), z. B. T4, Tumorperforation/-einriss, Operation unter Notfallbedingungen, Anzahl untersuchter Lymphknoten zu gering
- Stadium IIIA, IIIB, IIIC (T1–T4, N1–N2, M0 und Stadium C)
- chirurgische Resektion und Anastomose
- Chemotherapie als zusätzliche Behandlung, evtl. auch Strahlentherapie (Rektumkarzinom). Adjuvante Antikörpertherapie befindet sich in der Erprobung.
- Stadium IV (alle T-Stadien, alle N-Stadien, M1 und Stadium D)
- chirurgische Resektion/Anastomose oder Bypass
- chirurgische Resektion isolierter Metastasen in Leber, Lunge, Ovarien
- palliative Strahlentherapie (insbesondere bei Rezidiv im Becken)
- palliative Chemotherapie
Medikamentöse Therapie
Adjuvante Chemotherapie
- Wer?
- Bei Patient*innen mit einem R0-resezierten Kolonkarzinom im Stadium III (Ausbreitung in die Lymphknoten) soll eine adjuvante Chemotherapie erfolgen (Ia/A).
- Welche Therapie?
- empfohlene Schemata
- FOLFOX: Folinsäure/5-FU/Oxaliplatin
- XELOX: Oxaliplatin/Capecitabine
- bei Kontraindikationen gegen oxaliplatinhaltige Regime: Monotherapie mit Fluoropyrimidinen
- empfohlene Schemata
Präoperative (neoadjuvante) Therapie des Rektumkarzinoms
- Bei Tumoren des unteren und mittleren Rektumdrittels in den UICC-Stadien II und III (cT3/4 und/oder cN+) soll eine neoadjuvante Radiochemotherapie oder Kurzzeit-Radiotherapie erfolgen (Ib/A).
- Näheres siehe Abschnitt Strahlentherapie.
Chemotherapie in der metastasierten oder palliativen Situation
- Standard: Irinotecan oder Oxaliplatin
- Ansprechrate 39–55 %
- Das progressionsfreie Überleben erhöht sich um 7–9 Monate.
- Bei reduziertem Allgemeinzustand, der eine intensive Chemotherapie nicht erlaubt, steht eine primär palliative, symptomatische Behandlung im Vordergrund.
- ggf. initiale Behandlung mit einem Fluoropyrimidin + Bevacizumab oder dosisreduzierte Chemotherapie (+/–Bevacizumab)
- bei Tumoren ohne RAS-Mutation (RAS-Wildtyp) im linksseitigen Kolon (ab linke Flexur) oder im Rektum ggf. Anti-EGFR-Monotherapie
- Peritonealkarzinomatose
- Gilt in der Regel als unheilbar.
- ggf. hypertherme intraperitoneale Chemotherapie (HIPEC) an einem spezialisierten Zentrum
Strahlentherapie
- Rektumkarzinom (ggf. als Radiochemotherapie)
- neoadjuvant oder adjuvant
- Kann das Risiko für lokale Rezidive reduzieren, allerdings ohne relevante Senkung der Überlebensraten.
- palliativ
- auch bei inoperablen, lokalen Rezidiven angezeigt
- neoadjuvant oder adjuvant
- Kolonkarzinom
- Wirksamkeit nicht belegt
Operative Therapie
Allgemeine Operationsverfahren
- Kolonresektion
- Standardtherapie, wenn dies der Zustand der Patient*innen zulässt.
- Subtotale Kolektomie
- z. B. bei Ileus aufgrund einer linksseitigen Obstruktion
- evtl. mit entlastender Ileostomie oder Kolostomie
- evtl. endoluminale Stentanlage gefolgt von einer Resektion nach 1–2 Wochen
- Sigmoidostomie
- z. B. bei Ileus aufgrund eines Rektumkarzinoms
- Minimalinvasive Verfahren
- Laparoskopie
- transanale endoskopische Mikrochirurgie
Operationsverfahren bei Kolonkarzinomen
- Karzinom in den Ringfalten, dem Colon ascendens und dem rechten Colon transversum
- rechtsseitige Hemikolektomie (Ileotransversostomie) mit End-zu-End-Anastomose
- Karzinom im linken Colon transversum und Colon descendens
- linksseitige Hemikolektomie
- Karzinom im Colon sigmoideum
- radikale Sigmoidostomie mit mindestens 5 cm makroskopisch freiem Darm
Spätfolgen nach der Operation
Stomaprobleme
- Typische Probleme
- störende Bandagierung, parastomale Hernien, Hautirritationen, Retraktion (Stoma zu niedrig), Leckage, kosmetische Beschwerden, Prolaps und Freisetzung übel riechender Gase
- Komplikationen persistieren meist über lange Zeiträume.
- Risikofaktoren
- Ileostoma (Komplikationen häufiger als bei Kolostoma)
- ungünstige Platzierung des Stomas
- Adipositas
- chronisch entzündliche Darmerkrankung
- ischämische Darmerkrankung
- hohes Patient*innenalter
- frühere Bauchwandhernien
- Therapie
- ausführliche Aufklärung der betroffenen Person durch Enterostoma-Therapeut*in
- bei Hautirritationen im Stomabereich evtl.:
- Zinksalbe
- spezielle hydokolloide Stoma- oder Hautschutzpuder
- Diese können als Hilfsmittel auf ein separates Rezept zulasten der gesetzlichen Krankenkasse verordnet werden.
- ggf. chirurgische Korrektur
- Vorbeugung
- Kleine und häufigere Mahlzeiten können Probleme mit flüssigem Stuhl mindern.
- Es gibt spezielle Broschüren zur Ernährung bei Stoma.
- Näheres siehe auch Abschnitt Patienteninformationen.
Urogenitale Funktionsstörungen nach Rektum-OP
- Pathomechanismus
- Verletzung autonomer Nerven des Beckens und entlang der großen Zentralgefäße kann zu Funktionsstörungen des Urogenitalsystems führen.
- Häufige Störungen
- Miktionsstörungen
- Näheres siehe Artikel LUTS, Symptome des unteren Harntraktes.
- sexuelle Dysfunktion bei Männern
- erektile Dysfunktion
- Ejakulationsstörungen: ausbleibende, schmerzhafte oder retrograde Ejakulation
- sexuelle Dysfunktion bei Frauen
- verringerte vaginale Lubrikation, Dyspareunie, Orgasmusstörungen
- Eine erschwerte Penetration kann auftreten, wenn Vagina und Uterus in die Kavität gewandert sind, die nach der Resektion des Rektums entstanden ist.
- Miktionsstörungen
- Verstärkende Faktoren
- Begleiterkrankungen wie Diabetes mellitus oder vaskuläre Erkrankungen
- hohes Patientenalter
- Strahlentherapie
Leber- und Lungenmetastasen
- Kolorektale Karzinome metastasieren vor allem in Leber und Lunge. Etwa 20–30 % der Patient*innen haben zum Zeitpunkt der Diagnose Metastasen meistens in der Leber.
- In 20–25 % der Fälle können die Metastasen kurativ entfernt werden.
- Diagnostik
- Als bildgebende Verfahren kommen Sonografie (Leber), Mehrschicht-CT oder -MRT, evtl. PET/PET-CT infrage.
- Eine Biopsie kann zu einer örtlichen Tumorzelldissemination und damit zu einer schlechteren Überlebensrate führen.
- Chirurgische Verfahren (Leber)
- Die chirurgische Resektion von Metastasen wird standardmäßig als offenes oder laparoskopisches Verfahren durchgeführt.
- Ablationstherapie
- Die Radiofrequenz-Ablation (RF) ist eine Therapiealternative für Patient*innen mit nicht-resektablen kolorektalen Lebermetastasen.
- Wirksamkeit der Therapie
- Unbehandelt sterben alle Patient*innen mit Lebermetastasen nach 4 Jahren, während 30–50 % 5 Jahre nach einer vollständigen Resektion noch leben.
- Eine neoadjuvante Chemotherapie verlängert die Überlebenszeit, und ca. 1/5 der Patient*innen kann später lokal behandelt werden.
- Treten später erneut Metastasen auf, kann der Eingriff wiederholt werden. Die Ansprechraten sind dann ebenso gut wie bei der ersten Resektion.
Supportiv- und Palliativbehandlung
Symptomlindernde Behandlung (Auswahl)19-20
- Schmerzen
- Fatigue
- Gewichtsverlust
- Übelkeit und Erbrechen
- Obstipation
- Orale Beschwerden, z. B. Mundtrockenheit
- Atembeschwerden.
Weitere Maßnahmen (Auswahl)
- Behandlung von häufigen Begleitsymptomen und Komplikationen, z. B.:
- Wiederbefähigung zur Teilhabe am normalen gesellschaftlichen Leben
- Wenn die betroffene Person noch im Berufsleben steht: Erwerbsfähigkeit erhalten oder wiederherstellen (Rehabilitation).
- Auch in der nicht-kurativen Situation rehabilitative Maßnahmen symptomorientiert empfehlen.
Prävention
Endoskopische Kontrolle
- Siehe Abschnitt Screening.
Lebensstil
- Primärprävention
- Nikotinverzicht, regelmäßige Bewegung und Vermeidung von Übergewicht sind wahrscheinlich die wirksamsten Maßnahmen.
- Sekundärprävention
- Vermeidung von Übergewicht, körperliche Aktivität und eine Ernährung, die reich an Gemüse, Obst und Vollkornprodukten ist, können das Sterblichkeitsrisiko in den ersten 5 Jahren nach der Diagnosestellung reduzieren.21
- Ernährung
- Alkohol in Maßen
- Zur Reduktion des Risikos eines KRK sollte der Alkoholkonsum limitiert werden (IIa/B).1
- Nikotinentwöhnung
- Bei Patient*innen, die rauchen und dies auch nach der Therapie fortsetzen, besteht ein höheres Rezidivrisiko.22
Verlauf, Komplikationen und Prognose
- Sofern nicht anders gekennzeichnet, basiert dieser Abschnitt auf der S3-Leitlinie Kolorektales Karzinom.1
Verlauf
- Oft akuter Beginn
- Etwa 1/4 der Erkrankungen beginnt mit einer akuten Darmobstruktion oder -perforation.
- Der Verlauf hängt davon ab, in welchem Stadium der Krebserkrankung die Diagnose gestellt wird (siehe Abschnitt Prognose).
Komplikationen
- Siehe Abschnitt Spätfolgen nach der Operation.
Metastasen
- Lokalisation bei Erstdiagnose eines metastasierten KRK23
Ileus
- Tritt bei etwa 1 von 7 KRK-Betroffenen auf.25
- Bei einer kurzen Lebenserwartung sollte eine medikamentöse Behandlung in Erwägung gezogen werden.
Prognose
- Der Abschnitt basiert auf diesen Referenzen.26-27
Rezidive
- 80 % der Rezidive treten innerhalb eines Jahres auf, nur wenige Rezidive nach 4 Jahren.
- Bei Patient*innen, die primär geheilt wurden, besteht dennoch das Risiko, dass erneut ein KRK auftritt. Dies gilt insbesondere für Menschen, die zu häufigen Adenomen neigen oder bei dem Verdacht einer erblichen Prädisposition für kolorektale Karzinome.
Überlebensrate
- 5-Jahres-Überlebensrate KRK gesamt: ca. 65 %
- In den letzten 30 Jahren hat sich die Überlebensrate um ca. 20 % verbessert.
- 5-Jahres-Überlebensrate bei Kolonkarzinom nach Dukes-Stadien
- Dukes-Stadium A: > 90 %
- Dukes-Stadium B: ca. 70 %
- Dukes-Stadium C: ca. 40–50 %
- 5-Jahres-Überlebensrate nach UICC-Stadien
- Kolonkarzinom
- Stadium I–IV: bis 95 % – bis 85 % – bis 65 % – bis 5 %
- Rektumkarzinom
- Stadium I–IV: bis 95 % – bis 85 % – bis 55 % – bis 5 %
- Kolonkarzinom
Verlaufskontrolle
- Alle Patient*innen (IIb/B)1
- komplette Koloskopie innerhalb von 6 Monaten postoperativ
- Folgekoloskopie nach 1 Jahr
- bei unauffälligem Befund alle 5 Jahre
- darüber hinaus im Stadium UICC I
- Eine regelmäßige Nachsorge ist nach R0-Resektion in Anbetracht der geringen Rezidivrate und der günstigen Prognose nicht zu empfehlen.
- UICC-Stadien II oder III1
Patienteninformationen
Patienteninformationen in Deximed
Patientenverbände
- Deutsche Krebshilfe: Gemeinsam gegen den Krebs
- Deutsche Krebshilfe: Krebsprävention und Krebsfrüherkennung
- Deutsches Krebsforschungszentrum: Schmerzen bei Krebs
- Für Betroffene mit Stoma:
Illustrationen

Ulzeröses Kolonkarzinom (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
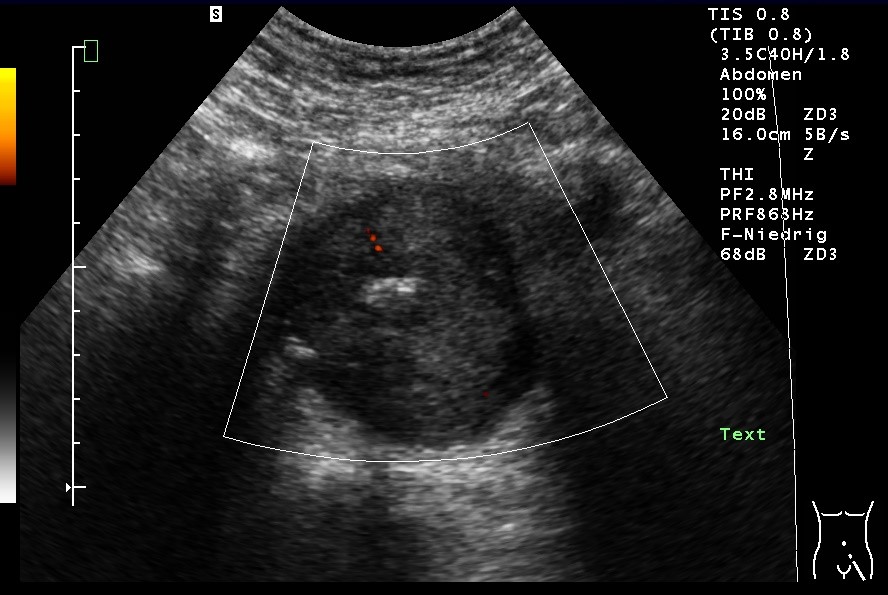
Kolonkokarde bei Kolonkarzinom mit aufgehobener Wandschichtung (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
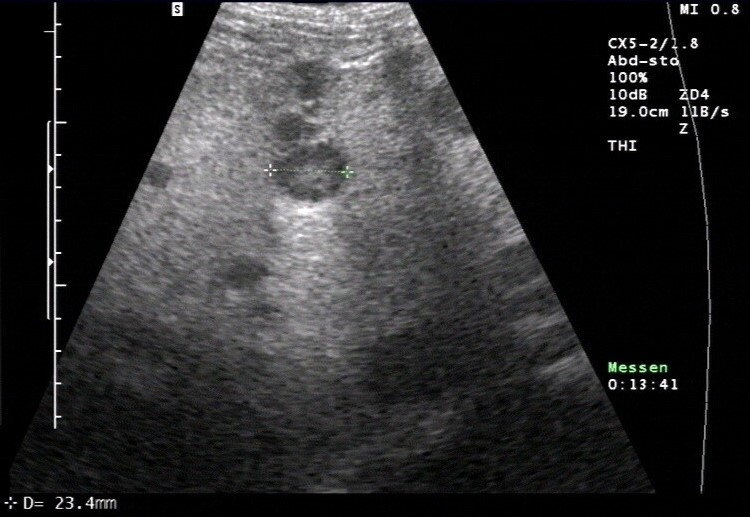
Sonografie: Lebermetastase mit typischem Halo und dorsaler Schallverstärkung (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Kolorektales Karzinom. AWMF-Leitlinie 021–007OL. S3, Stand 2017. www.awmf.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL. S3, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL. S3, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Colitis ulcerosa – Living Guideline. AWMF-Leitlinie Nr. 021-009. S3, Stand 2021 (abgelaufen). www.awmf.org
Literatur
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. S3-Leitlinie Kolorektales Karzinom. AWMF-Leitlinie 021–007OL, Stand 2017. www.awmf.org
- Deutsche Krebsgesellschaft. Tumorstadien bei Enddarmkrebs. Onko-Internetportal. 14.04.2021 www.krebsgesellschaft.de
- American Society of Clinical Oncology. Colorectal Cancer: Stages. November 2018. www.cancer.net
- Wittekind C, Meyer HJ: TNM Klassifikation maligner Tumoren, 7. Auflage. Wiley-VCH, Weinheim 2010.
- Dukes-Klassifikation. Pschyrembel online. Letzte Aktualisierung Dezember 2021 www.pschyrembel.de
- Krebs in Deutschland für 2017/2018. 13. Ausgabe. Robert Koch-Institut (RKI) (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland (GEKID) (Hrsg). Berlin, 2021 www.gekid.de
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG). Darmkrebs-Früherkennung bei familiärem Risiko: Nutzen für unter 55-Jährige ist unklar. Pressemitteilung 26.07.2013. www.iqwig.de
- Byrne RM, Tsikitis VL. Colorectal polyposis and inherited colorectal cancer syndromes. Ann Gastroenterol 2018;31:24-34. PMID: 29333064 PubMed
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Colitis ulcerosa - Living Guideline. AWMF-Leitlinie Nr. 021-009. S3, Stand 2021 (abgelaufen). register.awmf.org
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2023, Stand 16.09.2022. www.dimdi.de
- Gemeinsamer Bundesausschuss: Richtlinie für organisierte Krebsfrüherkennungsprogramme (Erstfassung und Programm zur Früherkennung von Darmkrebs) und Änderung der Krebsfrüherkennungs-Richtlinie, vom 19. Juli 2018. Inkrafttreten 19.10.2018. BAnz AT 18.10.2018 B3. www.g-ba.de
- Brenner H, Stock C, Hoffmeister M. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies. BMJ. 2014 Apr 9;348:g2467. doi: 10.1136/bmj.g2467. DOI
- Elmunzer BJ, Hayward RA, Schoenfeld PS, Saini SD, et al. Effect of Flexible Sigmoidoscopy-Based Screening on Incidence and Mortality of Colorectal Cancer: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. PLoS Med. 2012;9(12):e1001352. pubmed.ncbi.nlm.nih.gov
- Holme Ø, Bretthauer M, Fretheim A, et al. Flexible sigmoidoscopy versus faecal occult blood testing for colorectal cancer screening in asymptomatic individuals. Cochrane Database Syst Rev. 2013 Sep 30;9. www.ncbi.nlm.nih.gov
- Imperiale TF, Ransohoff DF, Itzkowitz SH et al. Multitarget stool DNA testing for colorectal-cancer screening. N Engl J Med 2014; 370:1287-1297. DOI: 10.1056/NEJMoa1311194. DOI
- Shaukat A, Mongin SJ et al. Long-Term Mortality after Screening for Colorectal Cancer. N Engl J Med 2013; 369:1106-1114. www.nejm.org
- Lee JK, Liles EG, Bent S, et al. Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis. Ann Intern Med 2014; 160:171. pubmed.ncbi.nlm.nih.gov
- Konishi T, Shimada Y, Hsu M, et al. Association of Preoperative and Postoperative Serum Carcinoembryonic Antigen and Colon Cancer Outcome. JAMA Oncology 2018; 4: 309-15. pmid:29270608 PubMed
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL, Klasse S3, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL, Klasse S3, Stand 2019. www.awmf.org
- Van Blarigan EL, Fuchs CS, Niedzwiecki D et al. Association of Survival With Adherence to the American Cancer Society Nutrition and Physical Activity Guidelines for Cancer Survivors After Colon Cancer Diagnosis The CALGB 89803/Alliance Trial. JAMA Oncol 2018; 4: 783-790. pmid:29710284 www.ncbi.nlm.nih.gov
- Yang B, Jacobs EJ, Gapstur SM, et al. Active Smoking and Mortality Among Colorectal Cancer Survivors: The Cancer Prevention Study II Nutrition Cohort. J Clin Oncol 2015; 33: 885-93. doi:10.1200/JCO.2014.58.3831 DOI
- Holch JW, Demmer M, Lamersdorf C et al. Pattern and Dynamics of Distant Metastases in Metastatic Colorectal Cancer. Visc Med 2017; 33: 70-5. PMID: 28612020 PubMed
- Braunwarth E, Stättner S. Multimodales Management nichtresektabler Lebermetastasen – neue Therapieoptionen mit Ausblick auf sekundäre Resektion. Gastroenterol Hepatol Erkr 2021; 19, 10–7. doi.org
- Boeding JRE, Ramphal W, Crolla RMPH et al. Ileus caused by obstructing colorectal cancer-impact on long-term survival. Int J Colorectal Dis 2018; 33: 1393-1400. PMID: 30046958 PubMed
- Stein DE, Lisle DM, Kumar PP, Nowak-Choi KA. Colorectal cancer. BMJ Best Practice. Last reviewed: 14 Oct 2022, last updated: 26 May 2022. bestpractice.bmj.com
- National Cancer Institute (NIH). Cancer Stat Facts: Colorectal Cancer. Last access 14.11.2022. seer.cancer.gov
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Jean-François Chenot, Prof. Dr. med., Facharzt für Allgemeinmedizin, Institut für Community Medicine, Universitätsmedizin Greifswald (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).
Link lists
Notfälle
Relevante Artikel
Leitlinien
- AWMF-Leitlinie Kolorektales Karzinom
- Internationale Leitlinie - ESMO Management of patients with colon and rectal cancer
- AWMF-Leitlinie Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung
- AWMF-Leitlinie Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten