Allgemeine Informationen
Definition
- Der folgende Artikel gibt allgemeine Informationen zum Blasenkarzinom für die hausärztliche Versorgung, während die eingefügten Leitlinieninhalte vor allem fachspezifisch sind und zur genaueren Information bei tiefergehendem Interesse dienen.
- Das Harnblasenkarzinom ist nach dem Prostatakarzinom die häufigste urologische Krebsart.
- Das Karzinom geht in der Regel (> 90 %) vom Urothel aus.1-5
- Plattenepithelkarzinome sind in Mitteleuropa untypisch. Sie treten häufiger in Regionen mit Bilharziose auf.6
- Urothelkarzinome kommen nicht selten an verschiedenen Stellen der Blase und ableitenden Harnwege gleichzeitig vor.7
- Blasenkrebs kann von einer lokalisierten Erkrankung mit niedriger Sterberate bis zur extrem aggressiven Krankheit mit hoher Sterblichkeit variieren.
- Blasentumoren werden nach dem TNM-System klassifiziert.
- Die genaue Stadieneinteilung und Abstufung sind entscheidend, um die optimale Behandlung zu wählen.
Klassifikationen
TNM-Klassifikation8
- Die Behandlung und die anschließenden Verlaufskontrollen sind abhängig von Ausbreitung und histopathologischen Charakteristika der Erkrankung festzulegen.
- TX – keine Aussage über den Primärtumor möglich
- T0 – kein Anhalt für Primärtumor
- Ta – nicht infiltrativ, papillär
- Tis – in situ (intraepithelial), „flacher Tumor“, Carcinoma in situ (CIS)
- T1 – Invasion in die Submukosa (Lamina propria)
- T2 – Infiltration der Muskulatur (Muscularis propria)
- T2a – innere Hälfte
- T2b – äußere Hälfte
- T3 – Infiltration des perivesikalen Gewebes
- T3a – mikroskopisch
- T3b – makroskopisch (extravesikale Raumforderung)
- T4 – Invasion in Nachbarorgane
- T4a – Invasion in Prostata, Uterus, Vagina
- T4b – Invasion in Becken- und abdominale Wand (fixierter Tumor)
- NX – keine Aussage über regionäre Lymphknoten möglich
- N0 – kein Anhalt für regionäre Lymphknotenmetastasen
- N1 – Metastase in einem Lymphknoten im kleinen Becken
- N2 – Metastase in mehreren Lymphknoten im kleinen Becken
- N3 – Lymphknotenmetastasen in Höhe der Iliaca-communis-Gefäße
- MX – keine Aussage über Fernmetastasen möglich
- M0 – keine Fernmetastasen
- M1 – Fernmetastasen vorhanden
Histologische Klassifikation
- Seit 2016 gilt ein neues Klassifikationssystem der WHO.9
- grobe Einteilung in infiltrative und nichtinvasive Tumoren
- genauere Einteilung anhand der Histopathologie inklusive Atypiegrad der Krebszellen
Grading
- Differenzierungsgrad der Krebszellen, d.h. Abweichung der Tumorzellen von gesunden Zellen des Normalgewebes
- G1: gut differenziert
- G2: mäßig differenziert
- G3: schlecht differenziert
Häufigkeit
- Inzidenz7
- 2016 erkrankten in Deutschland 16.470 Personen an einem invasiven Harnblasenkarzinom, gut 1/4 davon Frauen.
- Hinzu kamen noch rund 13.500 Erkrankte an nichtinvasiven papillären Karzinomen (Ta) und In-situ-Tumoren (Tis) der Blase.
- Werden nach ICD-10 nicht zu den bösartigen Tumoren gezählt, können sich aber zu bösartigen Tumoren entwickeln.
- Geschlecht und Alter
- Das mediane Erkrankungsalter in Deutschland beträgt für Frauen 75, für Männer 73 Jahre.6
- Die Inzidenz ist mit dem Alter zunehmend.
- Tumortypen8
- Bei etwa 75–85 % der Patient*innen begrenzen sich die Tumoren zum Zeitpunkt der Diagnose auf die Mukosa (Stadium Ta–Tis) oder auf die Submukosa (Stadium T1).
- Aus dieser Gruppe stammen die meisten Langzeitüberlebenden.
- Bei den restlichen Patient*innen dringt der Tumor in die Muskelschicht (Muscularis propria) der Blase ein (Stadium T2–4) und/oder hat sich auf die regionalen Lymphknoten ausgebreitet (Stadium N1–3).
- Bei etwa 75–85 % der Patient*innen begrenzen sich die Tumoren zum Zeitpunkt der Diagnose auf die Mukosa (Stadium Ta–Tis) oder auf die Submukosa (Stadium T1).
Ätiologie und Pathogenese
- Das Blasenkarzinom ist verhältnismäßig einzigartig unter den humanen Tumoren, weil viele seiner ätiologischen Faktoren bekannt sind.
- Aus diesem Grund gilt besondere ärztliche Aufmerksamkeit bei einer möglichen Exposition gegenüber bekannten urothelialen Karzinogenen.
Disponierende Faktoren
- Es scheint eine genetische Disposition für Blasenkrebs zu geben.10-11
- gehäuft bei Patient*innen mit HNPCC (Lynch-Syndrom), vor allem bei Vorliegen einer MSH2–Mutation6
- Rauchen von Tabak1,5,12
- Verdreifacht das Risiko, an einem Harnblasen-Karzinom zu erkranken.
- Unter den Patient*innen mit histologisch hochgradig malignen Tumoren finden sich besonders viele Starkraucher.
- Rauchen erhöht die Mortalität bei Blasenkrebs.
- Wer mit dem Rauchen aufhört, verringert das Risiko; allerdings ist das erhöhte Risiko erst nach 20–30 Jahren aufgehoben.
- Darüber hinaus sind zahlreiche Karzinogene bekannt, u. a. Farbstoffe (aromatische Amine), die in bestimmten Industrien verwendet werden.
- Besonders gefährdet sind Produktionsarbeiter*innen in der Grafik-, Metall- (Eisen/Aluminium), Maler- und Gummiindustrie.
- als Berufskrankheit anerkannt
- Weitere gesichert kanzerogene Substanzen sind Cyclophosphamid, Chlornaphazin, Phenazetin und Aristolochiasäure.13
- Chronische Entzündungen der Harnblase können die Entstehung eines Harnblasenkarzinoms begünstigen.13
- Eine Strahlentherapie im kleinen Becken kann mit einer Latenzzeit von mehreren Jahren zur Entwicklung eines Harnblasenkarzinoms führen.13
- Schistosomiasis in Entwicklungsländern erhöht das Risiko für ein Plattenepithelkarzinom.
ICPC-2
- U76 Bösartige Neubildung der Blase
ICD-10
- C67 Bösartige Neubildung der Harnblase
Diagnostik
Diagnostische Kriterien
- Die Erkrankung ist lange Zeit symptomlos.
- Zu den klinischen Zeichen und Befunden, die den Verdacht auf das Vorliegen eines Harnblasenkarzinom begründen, gehören:13
- Mikrohämaturie
- schmerzlose Makrohämaturie
- positive Urinzytologie
- unspezifische Reizsymptome wie Pollakisurie, Drangsymptomatik oder Dysurie.
- In diesen Fällen ist eine weitere Diagnostik notwendig.
Screening
Leitlinie: Harnblasenkarzinom – Screening13
- Es kann kein diagnostischer Marker zum Screening auf das Vorliegen eines Harnblasenkarzinoms oder zur systematischen Früherkennung des Harnblasenkarzinoms in der Gesamtbevölkerung oder in Risikopopulationen empfohlen werden.
- Die Anwendung kommerziell verfügbarer Blut- und Urintests zur Früherkennung und zum Screening für das Vorliegen eines Harnblasenkarzinoms außerhalb von Studien soll nicht erfolgen.
- Bei Hochrisikokollektiven (Raucher, berufsbedingte Risikogruppen) kann durch Urinuntersuchungen auf Mikrohämaturie ein Harnblasenkarzinom früher erkannt werden, als bei bereits symptomatischen Patient*innen.
- Eine wiederholt gesicherte asymptomatische Mikrohämaturie sollte eine urologische Evaluation nach sich ziehen.
- Kommerziell verfügbare Urintests, beispielsweise der Tumormarker NMP22 (aus urothelialen Tumorzellen freigesetztes nukleares Matrix-Protein), haben eine zu geringe Spezifität (unter 90 %)14
- Das Screening auf asymptomatische Hämaturie wird auch in den USA (von der U.S. Preventive Services Task Force) nicht empfohlen, weil der positiv-prädiktive Wert für Blasenkrebs bei einer mikroskopischen Hämaturie bei < 10 % liegt.15
Differenzialdiagnosen
- Andere Ursachen für eine Hämaturie
- Harnwegsinfektion
- Geschlechtsverkehr
- artifizielle Hämaturie, z. B. Kontamination mit Menstruationsblut
- Urolithiasis
- Prostatavarizen
- Trauma
- Erkrankungen der Nieren, u. a. Nephritiden
Anamnese
- Viele Patient*innen sind lange symptomfrei, bis die Krankheit weit fortgeschritten ist.
Hämaturie
- Schmerzlose intermittierende oder kontinuierliche Hämaturie, makroskopisch oder mikroskopisch, ist das wichtigste Symptom (85–90 % der Patient*innen).1,16
- Der Grad der Hämaturie entspricht nicht der Ausbreitung und dem Schweregrad der Erkrankung.
- Eine schmerzlose makroskopische Hämaturie gilt bis zum Beweis des Gegenteils als Urothelkarzinom.
Harnentleerungsstörungen
- Irritative Symptome von der Blase (Dysurie, Harndrang, Pollakisurie) können auf Blasenkrebs zurückgeführt werden.
- Bei therapieresistenter Zystitis sollte ein Blasenkarzinom ausgeschlossen werden.
- Diese Symptome sollten vor allen Dingen bei Männern Verdacht wecken.
- Tritt insbesondere bei muskelinvasivem Karzinom und bei ausgedehntem Carcinoma in situ auf.
- Tritt selten allein bei Ta/T1-Tumoren auf.
- Entleerungsprobleme können vorliegen, wenn der Tumor in der Nähe der Urethra oder dem Blasenhals liegt.
Symptome von Metastasen
- Einige Patient*innen werden durch die Metastasen symptomatisch.
- Hepatomegalie
- supraklavikuläre Lymphadenopathie
- Lymphödem in den unteren Extremitäten
Klinische Untersuchung
- Urinuntersuchung auf Hämaturie
- Sonografie zum Ausschluss eines Harnstaus oder einer Urolithiasis als Ursache für Hämaturie
- Laboruntersuchungen können evtl. auf einen Organbefall durch Metastasen hinweisen.
Leitlinie: Harnblasenkarzinom – Primärdiagnostik13
- Bei Patient*innen mit klinischem Verdacht auf ein Harnblasenkarzinom sollte zum Ausschluss eines Harnstaus primär eine Sonografie erfolgen.
- Bei Patient*innen mit Verdacht auf ein Harnblasenkarzinom soll als Standard in der Primärdiagnostik eine Weißlicht-Zystoskopie durchgeführt werden.
- Die flexible Zystoskopie führt gegenüber der rigiden Zystoskopie bei gleicher Effektivität zu einer Reduktion der Morbidität und zur Verbesserung des Patientenkomforts.
- Eine Fluoreszenz-basierte Zystoskopie kann in der Primärdiagnostik des Harnblasenkarzinoms eingesetzt werden
- Bei zystoskopischem Verdacht auf ein Harnblasenkarzinom soll eine histologische Sicherung erfolgen.
- Nach Ausschluss eines Harnblasentumors durch eine Zystoskopie als Ursache für eine Mikro- bzw. Makrohämaturie oder eine positive Zytologie soll eine Abklärung des oberen Harntraktes erfolgen.
Weitere Diagnostik bei Spezialist*innen
Zystoskopie
- Die Diagnose wird durch Zystoskopie mit Biopsie bestätigt.
- Bei der Zystoskopie kann die Darstellung von tumorösen Veränderungen durch spezielle Lichtquellen verbessert werden:
- Weißlicht:
- langjähriger Standard
- helle, weiße Lichtquelle
- Fluoreszenz-basiert:
- vor Zystoskopie Gabe der fotoaktiven Substanz Hexaminolävulinsäure über Katheter in die Blase
- Anreicherung in tumorösem Gewebe und Vorstufen, jedoch auch in entzündetem Gewebe (cave: falsch-positive Befunde)
- unter Blaulicht Aufleuchten der suspekten Bereiche in pink
- Weißlicht:
Transurethrale Resektion (TUR)
- TUR des Tumors bis zu den Muskelfaszien mit 2 Zielsetzungen:
- diagnostisch
- Lokalisation, Größenbeurteilung und Biopsie zur Stadieneinteilung
- Ist die Grundlage für die Wahl der weiteren Behandlung.
- therapeutisch
- vollständige Entfernung der nicht-muskelinfiltrierenden Tumoren
- palliative Resektion der muskelinfiltrierenden Tumoren.
- diagnostisch
- Abhängig vom zystoskopischen Befund und Histopathologie des Tumors erfolgt die bildgebende Diagnostik zum Staging.
Leitlinie: Harnblasenkarzinom – bildgebende Diagnostik13
Nicht-muskelinvasives Harnblasenkarzinom
- Beim Erstbefund eines nicht-muskelinvasiven Harnblasenkarzinoms sollte routinemäßig außer Sonografie keine bildgebende Abklärung des oberen Harntrakts erfolgen.
- Bei Erstdiagnose eines nicht-muskelinvasiven Harnblasenkarzinoms sollte bei einer Tumorlokalisation im Bereich des Trigonums und/oder bei multiplen Tumoren und/oder bei High-Grade-Tumoren eine Bildgebung des oberen Harntrakts erfolgen.
- Wenn eine bildgebende Abklärung des oberen Harntraktes bei Vorliegen eines nicht-muskelinvasiven Harnblasenkarzinoms (Primärbefund oder Rezidiv) indiziert ist, dann sollte eine CT-Urografie durchgeführt werden.
- Alternativ zur CT-Urografie können ein MRT mit mehreren Untersuchungszeitpunkten vor und nach Kontrastmittelapplikation oder ein Ausscheidungsurogramm (AUG) durchgeführt werden.
- Für die Detektion von Zweittumoren des oberen Harntrakts bei Erstdiagnose eines nicht-muskelinvasiven Harnblasenkarzinoms soll keine nuklearmedizinische Diagnostik (PET oder PET/CT) durchgeführt werden.
Muskelinvasives Harnblasenkarzinom
- Bei Patient*innen mit einem muskelinvasiven Harnblasenkarzinom soll eine Computertomografie (CT) des Abdomens (mit CT-Urografie), des Beckens und des Thorax mit Kontrastmittel durchgeführt werden. Statt CT Becken kann eine MRT des Beckens erfolgen.
- Eine kraniale CT oder eine Knochenszintigrafie sollen nur bei klinischer Symptomatik und/oder auffälligen diagnostischen Befunden erfolgen.
Bildgebende Diagnostik17-18
- CT-Urografie (CT mit und ohne Kontrast)
- Das urotheliale Blasenkarzinom ist eine multifokale Erkrankung. In den oberen Harnwegen können simultan urotheliale Tumoren auftreten. Diese werden bei der CT-Urografie als Fülldefekte dargestellt.
- Kann Hydroureter/Hydronephrose nachweisen, was auf einen infiltrierenden Tumor hindeutet, der in den intramuralen Teil des Ureters eingedrungen ist.
- MRT
- Ermöglicht Evaluation des Lymphknotenstatus im Becken und Retroperitoneum sowie evtl. Fernmetastasen und Evaluation der lokalen Ausdehnung des Tumors
- Ultraschall
- Kann dazu beitragen, Blasentumoren zu visualisieren.
- abdominal bei gut gefüllter Harnblase
- intrakavitär mit Ultraschallsonde via Zystoskopie
- Kann dazu beitragen, Blasentumoren zu visualisieren.
Urinzytologie
- Wird bei der urologischen Diagnostik meist routinemäßig während der Zystoskopie durchgeführt.
Indikation zur Überweisung
- Bei Verdacht auf ein Harnblasenkarzinom zur Zystoskopie und ggf. Biopsie
Therapie
Therapieziele
- Heilung
- Verhinderung von Progress
- Ggf. palliative Versorgung
Allgemeines zur Therapie
- Der Abschnitt basiert auf diesen Referenzen.1,4
- Die Behandlung von Blasenkarzinomen umfasst die transurethrale Resektion (TUR-B), intravesikale Installationsbehandlung, Zystektomie, Strahlenbehandlung, Chemotherapie oder Kombinationen davon. Neuerdings ist zusätzlich eine Immuntherapie mit Checkpoint-Inhibitoren im metastasierten Stadium möglich.
- TUR-B ist die Initialbehandlung bei allen Patient*innen mit Blasenkarzinom.
- Zusätzlich zur Tumorresektion werden Biopsien in endoskopisch verdächtigen Umgebungen durchgeführt.
- Eine fluoreszenz-assistierte TUR-B hat im Vergleich zu einer normalen Weißlicht-TUR-B eine höhere Detektionsrate für Tumoren und Carcinomata in situ.13
- Wird von der Leitlinie daher auch als mögliche Alternative in der Primärdiagnostikempfohlen.
- Die weitere Behandlung hängt vor allem davon ab, ob der Blasentumor nur bis in die Submukosa reicht (T1) oder muskelinfiltrierend (T2–4) wächst und in welche Risikogruppe er fällt.
Risikostratifizierung
- Bei nicht-muskelinvasiven Harnblasenkarzinomen wird das Risiko für Rezidive und Progress nach dem EORTC Risikoscoring berechnet.19
- Einteilung in niedriges, intermediäres oder hohes Risiko und dementsprechend Auswahl der Therapie.
Leitlinie: Risikostratifizierung des nicht-muskelinvasiven Harnblasenkarzinoms 13
Niedriges Risiko
- Solitärer Tumor pTa G1 <3cm
- Solitärer Tumor pTa G2 (low grade) <3cm
- PUNLMP (papillary urothelial neoplasm of low malignant potential)
Intermediäres Risiko
- Solitärer Tumor pTaG1 ≥3cm
- Multifokale Tumoren pTaG1
- Solitärer Tumor pTaG2 (low grade) ≥3cm
- Multifokale Tumoren pTaG2 (low grade)
- Jeder Tumor pTa G2 (high grade)
- Jeder Tumor pTaG2 (wenn keine genaueres Grading bekannt ist)
- Jedes Karzinom aus der Niedrig-Risiko-Gruppe, das innerhalb von 12 Monaten rezidiviert
Hohes Risiko
- Alle T1 Tumoren
- Alle G3 (high grade) Tumoren
- Jedes Cis
- Multiple rezidivierende und große Tumoren (> 3 cm) Ta G1/G2 (wenn die genannten Voraussetzungen gleichzeitig vorliegen)
- Aggressive histologische Varianten des Urothelkarzinoms mit lymphoepithelialer, plasmazytoider, plattenepithelialer, mikropapillärer und / oder kleinzelliger Komponente sowie „nested" Variante
Therapie des nicht-muskelinfiltrierenden Harnblasenkarzinoms
Leitlinie: Therapie des nicht-muskelinfiltrierenden Harnblasenkarzinoms13
TUR-B
- Wenn technisch möglich, sollte eine Resektion kleiner Blasentumoren in toto durchgeführt werden.
- Ist keine Zystektomie geplant, soll eine Nachresektion bei Patient*innen mit nicht-muskelinvasivem Urothelkarzinom der Harnblase mit folgender Konstellation durchgeführt werden:
- bei Tumoren, bei denen die primäre TUR inkomplett war.
- wenn in der initialen TUR kein Muskel im histopathologischen Präparat nachweisbar war, außer pTa-Low-Grade.
- bei pT1-Tumoren
- bei allen High-Grade-Tumoren, mit Ausnahme der Patient*innen mit primärem Carcinoma in situ (pTis).
- Eine Nachresektion sollte innerhalb von 6 Wochen nach der ersten Resektion durchgeführt werden.
Instillationstherapie
- Die Chemotherapie-Frühinstillation kann bei Patient*innen mit klinisch nicht-muskelinvasivem Blasentumor durchgeführt werden, sofern weder eine ausgeprägte Blutung noch eine Blasenperforation vorliegt.
- einmalig bei der TUR-B mit Mitomycin C, alternativ auch mit Doxorubicin
- Patient*innen mit einem primären, unifokalen bzw. Low-Risk-Urothelkarzinom der Harnblase profitieren am meisten von einer Frühinstillation.
- Bei Patient*innen mit einem Urothelkarzinom der Harnblase im Low-Risk-Stadium soll nach TUR und Frühinstillation keine weitere adjuvante Chemotherapie-Instillation vorgenommen werden.
- Bei Patient*innen mit einem erstdiagnostizierten Urothelkazinom der Harnblase im Intermediate-Risk-Stadium sollte nach ausführlicher Beratung entweder eine Chemotherapie-Instillation (Mitomycin C) oder eine Instillationstherapie mit Bacille-Calmette-Guerin (BCG) durchgeführt werden.
- Ist bei Patient*innen mit einem Urothelkarzinom der Harnblase im High-Risk-Stadium keine Früh-Zystektomie indiziert, soll eine BCG-Instillationstherapie vorgenommen werden. Bei kompletter Remission nach der Induktionsphase soll zusätzlich eine Erhaltungstherapie für die Dauer von mindestens 1 bis höchstens 3 Jahren erfolgen.
- Das Ansprechen einer BCG-Induktions- und Erhaltungstherapie bei Patient*innen mit High-Risk-Urothelkarzinomen der Harnblase sollte über eine histologische Sicherung mittels transurethraler Resektion und Urinzytologie kontrolliert werden.
Zystektomie
- Bei einem High-Risk-Blasenkarzinom ist die Zystektomie eine Therapieoption.
- Bei einem Frührezidiv oder einer Tumorpersistenz mit Hochrisikokonstellation eines nicht-muskelinvasiven Blasenkarzinoms nach BCG-Induktionstherapie soll eine Zystektomie durchgeführt werden.
Sonderfall isoliertes Carcinoma in situ
- Bei alleinigem Carcinoma in situ soll eine BCG-Therapie nach dem Induktions- und Erhaltungsschema erfolgen.
- Alternativ zur BCG-Therapie kann beim alleinigen Carcinoma in situ nach umfassender Aufklärung über die Vor- und Nachteile eine radikale Zystektomie durchgeführt werden.
- Eine BCG-Therapie sollte nach folgendem Schema verabreicht werden:13
- Induktionszyklus mit 6 BCG-Instillationen in wöchentlichen Abständen
- Erhaltungstherapie mit jeweils 3 BCG-Instillationen in wöchentlichen Abständen 3, 6 und 12 Monate nach Beginn des Induktionszyklus
- Bei High-Risk-Tumoren weitere 3 BCG-Instillationen in wöchentlichen Abständen jeweils 18, 24, 30 und 36 Monate nach Beginn des Induktionszyklus nach Abwägung von Nutzen und Risiken bzw. Nebenwirkungen
- Eine BCG-Therapie (Induktions- und Erhaltungstherapie) reduziert bei Intermediate- und High-Risk-Tumoren die Rezidivrate signifikant gegenüber einer Chemotherapie-Instillation. Ein Einfluss auf die Progressionsrate ist nicht gesichert.
- Eine BCG-Therapie soll in voller Dosis und ohne begleitende prophylaktische Antibiotikagabe erfolgen.
- Ein Unterschied zwischen den verfügbaren BCG-Stämmen in Bezug auf Wirksamkeit und Nebenwirkungsrate ist derzeit nicht belegt.
Therapie des muskelinfiltrierenden Harnblasenkarzinoms
- Nach der Diagnose eines muskelinvasiven Harnblasenkarzinoms soll das gesamte Behandlungskonzept interdisziplinär mit Urologie, internistischer Onkologie, Strahlentherapie und weiteren beteiligten Fachdisziplinen besprochen werden.6
Leitlinie: Therapie des lokalisierten, muskelinfiltrierenden Harnblasenkarzinoms13
Radikale Zystektomie
- Die radikale Zystektomie in Verbindung mit einer bilateralen pelvinen Lymphadenektomie ist die Standardtherapie mit kurativer Intention für das lokal begrenzte muskelinvasive Harnblasenkarzinom.
- Bei der radikalen Zystektomie sollen in der Regel die gesamte Blase und unmittelbare Nachbarorgane, beim Mann Prostata und Samenblasen, bei der Frau Uterus, Adnexe und Anteile der vorderen Vaginalwand, entfernt werden.
- Bei Patient*innen mit einem muskelinvasiven Harnblasenkarzinom, die keine neoadjuvante Therapie erhalten, soll eine radikale Zystektomie möglichst innerhalb von 3 Monaten nach Diagnosestellung erfolgen.
- Eine partielle Zystektomie soll aufgrund nicht nachgewiesener Gleichwertigkeit nicht als Standardtherapie empfohlen werden.
Chemotherapie
- Patient*innen mit muskelinvasivem Harnblasenkarzinom (≥ T2) sollen über die Möglichkeiten einer neoadjuvanten oder adjuvanten Chemotherapie unter Berücksichtigung ihrer individuellen Situation aufgeklärt werden.
- Eine neoadjuvante Chemotherapie sollte 3–4 Zyklen einer cisplatinhaltigen Kombinationschemotherapie beinhalten.
- Die adjuvante Kombinationschemotherapie (3–4 Zyklen) nach Zystektomie soll cisplatinbasiert sein.
Radiatio
- Es besteht keine Indikation zur adjuvanten Radiotherapie/Radiochemotherapie nach radikaler Zystektomie mit R0-Resektion (mikroskopisch freie Resektionsränder, d.h. vollständige Entfernung des Tumorgewebes; Anm. d. Red.)
Multimodale, primär organerhaltende Therapie
- Die multimodale, primär organerhaltende Therapie (TUR-B gefolgt von Radiochemotherapie, Salvage-Zystektomie bei invasivem Rest- oder Rezidivtumor) stellt eine Alternative zur radikalen Zystektomie mit kurativer Zielsetzung für Patient*innen mit muskelinvasivem Urothelkarzinom dar.
- Salvage-Zystektomie: Zystektomie mit kurativem Charakter bei Patient*innen, die nach vorausgegangenem Therapieversuch mittels TUR-B und Radiochemotherapie noch restliches Tumorgewebe in der Blase haben20 (Anmerkung der Redaktion)
- Die multimodale, primär organerhaltende Therapie sollte Patient*innen mit lokal begrenzten, muskelinvasivem Urothelkarzinom (cT2–4 cN0/Nx M0) angeboten werden, die sich nicht für eine radikale Zystektomie eignen oder die eine Alternative zur radikalen Operation anstreben. Besonders geeignete Patient*innen sind solche mit frühen Tumoren (cT2N0) ohne Hydronephrose oder assoziiertem Carcinoma in situ, bei denen die initial transurethrale Resektion zur möglichst kompletten Tumorentfernung führt.
- Die Radiosensibilisierung im Rahmen der simultanen Radiochemotherapie (RCT) sollte mit einer Cisplatin-basierten Chemotherapie oder mit einer Kombination von 5-Fluorouracil und Mitomycin C erfolgen.
Salvage-Zystektomie
- Patient*innen mit muskelinvasivem Urothelkarzinom, die histologisch keine komplette Remission des invasiven Karzinoms nach RCT aufweisen, soll eine Salvage-Zystektomie empfohlen werden.
Harnableitung nach Zystektomie13
- Nach radikaler Zystektomie kommen zum Einsatz:
- inkontinente Harnableitungen
- Formen der Harnleiterhautfistel
- Ileum- oder Kolon-Conduit
- kontinente Harnableitungen
- katheterisierbare Pouchformen
- orthotoper Harnblasenersatz (Neoblase)
- transrektale Harnableitung (Formen der Ureterosigmoideostomie).
- inkontinente Harnableitungen
- Es liegen keine zuverlässigen Daten aus randomisierten kontrollierten Studien zum Vergleich der unterschiedlichen Techniken zur Anlage der Harnableitung nach radikaler Zystektomie vor.
- Betroffene sollen über alle Formen der Harnableitungen sowie deren Vor- und Nachteile ausführlich aufgeklärt werden.
Chemotherapie6
- Beim lokalisierten muskelinvasiven Blasenkarzinom wird die Prognose durch die zusätzliche neoadjuvante oder adjuvante Chemotherapie verbessert, sodass diese Therapieoptionen mit allen Patient*innen des Tumorstadiums ≥ cT2 besprochen werden sollten.
- Argumente für eine neoadjuvante Therapie sind die höhere Anzahl der in Studien untersuchten Patient*innen und der bessere Allgemeinzustand von Betroffenen vor einer Zystektomie.
- Argumente für eine adjuvante Chemotherapie sind das präzisere Staging durch die histopathologische Untersuchung des Zystektomie-Präparates.
- Die perioperative Chemotherapie führt zu einer Verbesserung der Gesamtüberlebensrate um absolut 5–10 % nach 10 Jahren.21
Therapie des metastasierten Harnblasenkarzinoms
- Die Kombinationschemotherapie des Blasenkarzinoms basiert auch im metastasierten Stadium auf Cisplatin, wobei ein relevanter Anteil der in der Regel älteren Patient*innen nicht Cisplatintherapie-fähig ist.6
Leitlinie: Therapie des metastasierten Harnblasenkarzinoms13
- Patient*innen mit metastasiertem Urothelkarzinom der Harnblase soll eine cisplatinhaltige Chemotherapie angeboten werden, wenn der Allgemeinzustand und die Komorbiditäten dies zulassen.
- Patient*innen mit zumindest einem der folgenden 5 Parameter sollten nicht mit Cisplatin-basierter Chemotherapie behandelt werden:
- WHO- oder ECOG-Performance-Status (PS) von ≥ 2 oder Karnofsky-PS ≤ 70 %
- Kreatinin-Clearance (gerechnet oder gemessen) ≤ 60 ml/min
- Ausgewählte Patient*innen mit gutem EGOC-Performance-Status (0–1), mäßig eingeschränkter Nierenfunktion (GFR 40–60 ml/min) und ohne weitere Komorbiditäten können mit Cisplatin in aufgeteilten Dosen behandelt werden.
- Hörverlust in der Audiometrie (≥ Grad 2 CTCAE-Version 4)
- periphere Neuropathie (≥ Grad 2 CTCAE-Version 4)
- NYHA-Klasse > III Herzinsuffizienz
- Patient*innen, die nicht für eine cisplatinbasierte Chemotherapie geeignet sind und einen guten EGOC-Performance-Status (0–1) haben, sollten mit Gemcitabin/Carboplatin behandelt werden.
- Patient*innen, die nicht für eine cisplatinbasierte Chemotherapie geeignet sind, können mit den Checkpoint-Inhibitoren Atezolizumab oder Pembrolizumab behandelt werden, wenn sie einen positiven PD-L1 Status (Oberflächenprotein, das die Immunantwort hemmt und vermehrt von Tumorzellen sezerniert werden kann; für weiterführende Infos s. Artikel Onkologische Therapien, Medikamente, Anm. d. Red.) aufweisen.
- Patient*innen, die eine Immuntherapie mit Checkpoint-Inhibitoren erhalten, sollen vor Therapiebeginn eine ausführliche Aufklärung über mögliche immunvermittelte Nebenwirkungen erhalten. Insbesondere soll darauf hingewiesen werden, dass auch mehrere Monate nach Therapieende immunvermittelte Nebenwirkungen auftreten können.
Zweitlinientherapie
- Bei Progress nach primärer Chemotherapie oder perioperativer Chemotherapie bzw. Immuntherapie eines metastasierten Urothelzellkarzinoms sollen alle Patient*innen auf die Fähigkeit zur Zweitlinienbehandlung überprüft werden. Insbesondere soll auf die Möglichkeit einer Studienteilnahme hingewiesen werden.
- Patient*innen mit einem metastasierten Urothelkarzinom, die eine Progression unter bzw. nach einer platinhaltigen Therapie erfahren, sollen als Zweitlinie eine Behandlung mit dem Immuncheckpoint-Inhibitor Pembrolizumab erhalten.
- Patient*innen mit einem metastasierten Urothelkarzinom, die eine Progression unter bzw. nach einer platinhaltigen Therapie erfahren und eine Kontraindikation gegen Immuncheckpoint-Inhibitoren haben, sollten als Zweitlinie eine Behandlung mit Vinflunin erhalten.
- Patient*innen mit einem metastasierten Urothelkarzinom, die nach platinhaltiger Primärtherapie und guter Verträglichkeit ein therapiefreies Intervall von mindestens 6 Monaten zeigten, jedoch eine Kontraindikation gegen Immuncheckpoint-Inhibitoren haben, können alternativ eine Wiederaufnahme einer platinhaltigen Kombinationstherapie erhalten.
- Patient*innen mit einem metastasierten Urothelkarzinom, die eine Progression unter bzw. nach einer Therapie mit den Checkpoint-Inhibitoren Atezolizumab oder Pembrolizumab in der Erstlinie erfahren, können eine Kombinations- oder Monochemotherapie als Zweitlinie erhalten.
Metastasenresektion nach Chemotherapie
- Eine Metastasenresektion in kurativer Absicht bei Patient*innen mit primärem Urothelkarzinom der Harnblase kann bei geeigneten Patient*innen nach multidisziplinärer Abstimmung als Therapieoption durchgeführt werden. In der Regel handelt es sich dabei um Patient*innen mit einem guten Performancestatus (PS 0–1), die gut auf eine Chemotherapie angesprochen haben, und lediglich Lymphknotenmetastasen oder eine Oligometastasierung anderer Lokalisation aufweisen.
- Eine Metastasenresektion bei Patient*innen, die nicht auf eine Chemotherapie angesprochen haben, ist unter kurativem Aspekt nicht sinnvoll. Bei Patient*innen mit symptomatischen Metastasen kann eine Metastasenresektion in palliativer Absicht diskutiert werden.
Therapie von Knochenmetastasen
- Patient*innen mit symptomatischen ossären Metastasen oder drohender Instabilität soll eine oder mehrere der folgenden Therapieoptionen angeboten werden:
- medikamentöse Schmerztherapie
- Strahlentherapie
- operative Intervention (i. d. R. in Kombination mit Bestrahlung)
- Bisphosphonat oder Denosumab
- Zur Prävention von Kieferosteonekrosen soll vor der Gabe von Bisphosphonaten oder Denosumab eine zahnärztliche Untersuchung und die ggf. erforderliche zahnärztliche Sanierung sowie eine Unterweisung und Motivation der Patient*innen zu besonders sorgfältiger Mundhygiene stattfinden.
Palliative Zystektomie
- Bei mangelnder Symptomkontrolle (Blutungen, Fäkalurie, Harnaufstau, Schmerzen) durch weniger invasive Maßnahmen kann eine Zystektomie in palliativer Indikation (palliative Zystektomie) auch bei Patient*innen mit lokal fortgeschrittenem (pT4b) und/oder metastasiertem (M1) Stadium durchgeführt werden.
Performance-Status
- Zur Beurteilung des physischen Zustands von Krebspatient*innen werden vor allem 2 Scores angewendet:
- WHO-ECOG(Eastern Cooperative Oncology Group)-Score und
- Karnofsky-Index
- Im Folgenden ist jeweils der ECOG-Score genannt, in Klammern der entsprechende Karnofsky-Score22
- Grad 0: normal, Aktivität ohne Einschränkungen wie vor der Erkrankung (90-100 %)
- Grad 1: ambulant, kann sich selbst versorgen, Einschränkungen bei anstrengenden körperlichen Aktivitäten, leichte Haus- oder Büroarbeit möglich (70-80 %)
- Grad 2: ambulant, tagsüber mobil in mehr als 50 % der Zeit, kann sich selbst versorgen, nicht arbeitsfähig (50-60 %)
- Grad 3: > 50 % der Zeit bettlägerig, pflegebedürftig (30-40 %)
- Grad 4: bettlägerig, stationäre Behandlung erforderlich (10-20 %)
- Grad 5: tot (0 %)
Einteilung von Nebenwirkungen (CTCAE)
- Zur Einteilung der Nebenwirkungen einer onkologischen Therapie verwendet man die CTCAE-Klassifikation (Common Terminology Criteria for Adverse Events)
- Für die Nebenwirkungen (beispielsweise Übelkeit, Thrombopenie, Neuropathie) existieren 6 Schweregrade von 0 (Nebenwirkung nicht vorhanden) bis 5 (Patient tot).
- Die englischsprachige Datenbank zum Nachschlagen der Kriterien und Schweregrade finden Sie hier.
Palliative Behandlung
- Der Abschnitt basiert auf diesen Referenzen.23-24
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Maligne gastrointestinale Obstruktion
- Mundtrockenheit
- Mangelernährung und Dehydratation
- Atembeschwerden
- Depression
- Angst
- Delirium
Verlauf, Komplikationen und Prognose
Verlauf
- Häufig asymptomatischer Verlauf bis zum Auftreten von Mikro/Makrohämaturie
- 75 % aller Harnblasenkarzinome sind bei Diagnosestellung als nicht-muskelinvasive Blasenkarzinome auf die Mukosa oder die Submukosa beschränkt und haben eine geringe Mortalität.6
- Bei den restlichen 25 % liegt anfänglich ein muskelinvasiver Tumor mit deutlich schlechterer Prognose vor.
- Insbesondere für schlecht differenzierte Ta-Tumoren und Tis (die noch nicht als Harnblasenkarzinome gelten) besteht ein erhöhtes Risiko für Progression und Rezidiv.7
Komplikationen
- Hämaturie
- Harnblasentamponade
- Dysurie (Frauen, Männer)
- Inkontinenz (Frauen, Männer)
- Beckenschmerzen
- Perioperative Komplikationen bei Zystektomie
- Nebenwirkungen der Chemo- und/oder Immuntherapie und/oder Radiatio
Prognose
- Die Mehrheit der Patient*innen hat einen Tumortyp mit guten Heilungschancen; allerdings tritt auch bei diesen Patient*innen nicht selten ein Rezidiv auf, und sie sollten lebenslang von Spezialist*innen kontrolliert werden.
- Nichtinfiltrierende Blasenkarzinome haben eine 5-Jahres-Überlebensrate von > 80 %.25
- Bei einem metastasierten Harnblasenkarzinom leben nach 2 Jahren nur noch 5–10 % der Patient*innen.25
Überlebensraten
- Relative 5-Jahres-Überlebensrate des Harnblasenkarzinoms in Deutschland7
- Frauen 45 %
- Männer 55 %
- Die höheren relativen 5-Jahres-Überlebensraten von Männern gegenüber Frauen korrespondieren mit einer günstigeren Verteilung der Tumorstadien (36 % gegenüber 24 % UICC I).6
- Relative 10-Jahres-Überlebensrate7
- Frauen 41 %
- Männer 49 %
Verlaufskontrollen
- Sollten durch Fachärzt*innen für Urologie/Onkologie durchgeführt werden.
- Ziele der Nachsorge sind die frühzeitige Diagnose eines Rezidivs mit dem Ziel der Verlängerung der Überlebenszeit/Erhöhung der Heilungschance, die Erkennung von Nebenwirkungen der Therapie und Vorsorge.6
Leitlinie: Harnblasenkarzinom – Nachsorge
Nachsorge des nicht-muskelinvasiven Harnblasenkarzinoms
- Die Nachsorge erfolgt stratifiziert nach der Risikogruppen-Einteilung in Low-, Intermediate- und High-Risk-nicht-muskelinvasive Harnblasenkarzinome.
- Sie umfasst abhängig vom Risiko Zystoskopie, Urinzytologie und Bildgebung.
Nachsorge des muskelinvasiven Harnblasenkarzinoms
- Die Nachsorgeprogramme bei muskelinvasiven Blasenkarzinom-Patient*innen richten sich zunächst nach der Wahl der kurativ intendierten Behandlung.
- Das Nachsorgeschema für Patient*innen nach radikaler Zystektomie und Harnableitung unterscheidet sich deutlich von der Nachsorge für Patient*innen nach Radio-(Chemo-)Therapie der Harnblase.
- Zudem muss das Nachsorgeprogramm von muskelinvasiven Blasenkarzinom-Patient*innen mehrere medizinische Bereiche abdecken. Dazu gehören:
- Früherkennung von Tumorrezidiven – Lokalrezidive, Urethrarezidive nach Zystektomie, Rezidive des oberen Harntraktes und Fernmetastasen
- metabolische Veränderungen
- funktionelle Störungen
- psychoonkologisch-sozialer Status.
Patienteninformationen
Patienteninformationen in Deximed
- Harnblasenkrebs
Harnblasenkrebs, UntersuchungenHarnblasenkrebs, BehandlungHarnblasenkrebs – Der Weg zurück in den Alltag- Krebstherapien, Medikamente
- Schmerzen und Schmerztherapie
- Essen bei Appetitlosigkeit
Weitere Informationen
- Deutsche Krebshilfe: Ratgeber Blasenkrebs
- Deutsches Krebsforschungszentrum: Schmerzen bei Krebs
Illustrationen
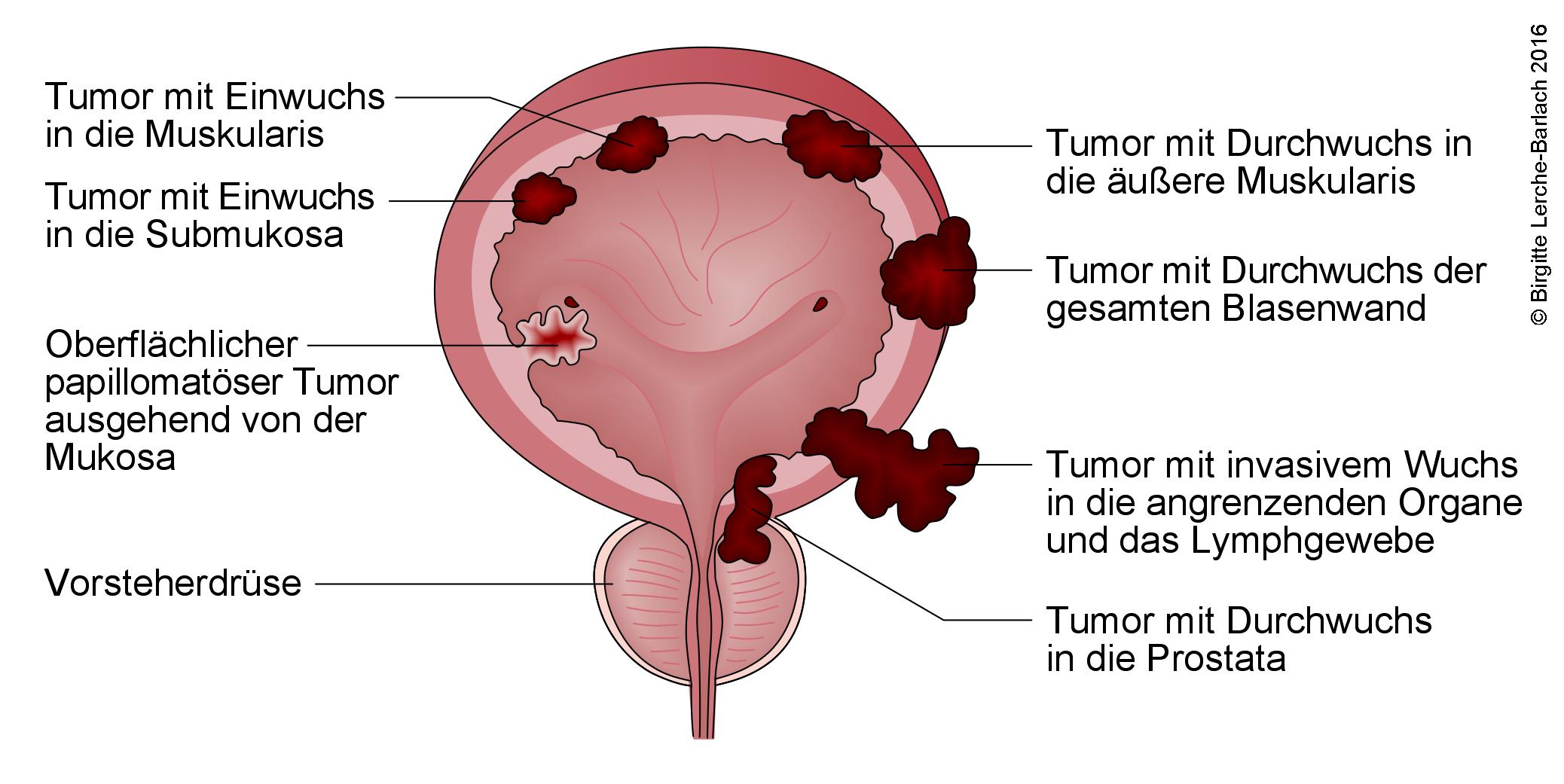
Tumoren der Harnblase
Sonografie: Tumor der Harnblase (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Urologie. Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. AWMF-Leitlinie Nr. 032-038OL. S3, Stand 2020. www.awmf.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL. S3, Stand 2014. www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL. S3, Stand 2019. www.awmf.org
- European Association of Urology. Guidelines on Non–Muscle-invasive Urothelial Carcinoma of the Bladder, Stand 2016. www.europeanurology.com
- European Society for Medical Oncology. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up, Stand 2014. www.esmo.org
Literatur
- European Association of Urology. Guidelines on Non–Muscle-invasive Urothelial Carcinoma of the Bladder, Stand 2016. www.europeanurology.com
- Gakis G, Efstathiou J, Lerner SP, et al. ICUD-EAU International Consultation on Bladder Cancer 2012: radical cystectomy and bladder preservation for muscle-invasive urothelial carcinoma of the bladder. Eur Urol 2013; 63: 45-57. PubMed
- Stenzl A, Cowan NC, De Santis M, et al. Treatment of muscle-invasive and metastatic bladder cancer: update of the EAU guidelines. Eur Urol 2011; 59: 1009-18. PubMed
- Babjuk M, Oosterlinck W, Sylvester R, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder, the 2011 update. Eur Urol 2011; 59: 997-1008. PubMed
- European Society for Medical Oncology. Bladder cancer: ESMO Practice Guidelines for diagnosis, treatment and follow-up, Stand 2014. www.esmo.org
- Onkopedia. Blasenkarzinom (Urothelkarzinom). Stand 2019. Letzter Zugriff 29.08.2020. www.onkopedia.com
- RKI. Zentrum für Krebsregisterdaten. Harnblasenkrebs. Stand 17.12.2019. Letzter Zugriff 29.08.2020. www.krebsdaten.de
- The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours. www.europeanurology.com
- Humphrey PA, Moch H, Cubilla AL, et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part B: Prostate and Bladder Tumours . Eur Urol 2016; 70(1): 106-119. pubmed.ncbi.nlm.nih.gov
- García-Closas M, Malats N, Silverman D, et al. NAT2 slow acetylation, GSTM1 null genotype, and risk of bladder cancer: results from the Spanish Bladder Cancer Study and meta-analyses. Lancet 2005; 366: 649-59. PubMed
- Engel LS, Taioli E, Pfeiffer R, et al. Pooled analysis and meta-analysis of glutathione S-transferase M1 and bladder cancer: a HuGE review. Am J Epidemiol 2002; 156: 95-109. pubmed.ncbi.nlm.nih.gov
- Janković S, Radosavljević V. Risk factors for bladder cancer. Tumori 2007; 93: 4-12. PubMed
- Deutsche Gesellschaft für Urologie. S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. AWMF-Leitlinie Nr. 032/038OL, Stand 2020. www.awmf.org
- Grossman HB, Messing E, Soloway M, et al. Detection of bladder cancer using a point-of-care proteomic assay. JAMA 2005; 293(7): 810-6. pubmed.ncbi.nlm.nih.gov
- Chou R, Dana T. Screening adults for bladder cancer: a review of the evidence for the U.S. preventive services task force. Ann Intern Med 2010; 153: 461-8. pubmed.ncbi.nlm.nih.gov
- Pashos CL, Botteman MF, Laskin BL, Redaelli A. Bladder cancer: epidemiology, diagnosis, and management. Cancer Pract 2002; 10: 311-22. PubMed
- Turney BW, Willatt JM, Nixon D, et al. Computed tomography urography for diagnosing bladder cancer. BJU Int 2006; 98: 345-8. PubMed
- Kundra V, Silverman PM. Imaging in oncology from the University of Texas M. D. Anderson Cancer Center. Imaging in the diagnosis, staging, and follow-up of cancer of the urinary bladder. AJR Am J Roentgenol 2003; 180: 1045-54. PubMed
- Sylvester RJ, van der Meijden AP, Oosterlinck W et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006; 49: 466-75. pubmed.ncbi.nlm.nih.gov
- Frohneberg D. Muskelinvasives Harnblasenkarzinom. Teil 3. Dtsch Arztebl Int Int 2007; 104(13): A-868. www.aerzteblatt.de
- Advanced Bladder Cancer Metaanalysis Collaboration: Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urology 48:202-205, 2005. pubmed.ncbi.nlm.nih.gov
- Onkopedia. ECOG–WHO–Zubrod Performance Status Scale. Letzter Zugriff 10.11.2020. www.onkopedia.com
- Deutsche Krebsgesellschaft.Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL, Stand 2014. www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL, Stand 2019. www.awmf.org
- Steinberg GD. Bladder Cancer. Medscape, last updated May 06, 2020. emedicine.medscape.com
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Klaus Gebhardt, Facharzt für Allgemeinmedizin, Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).