Allgemeine Informationen
Definition
- Asthma ist eine chronisch-entzündliche Erkrankung der Atemwege, die durch bronchiale Hyperreagibilität und reversible Atemwegsobstruktion zu respiratorischen Symptomen führt.1-2
- Man unterscheidet grundsätzlich folgende Formen:2
- allergisches (extrinsisches) Asthma
- Auslöser sind spezifische Allergene.
- Assoziation mit anderen allergischen/atopischen Erkrankungen
- nichtallergisches (intrinsisches) Asthma
- Auslöser sind z.
- Auslöser sind z.
- weitere Phänotypen
- z.
- z.
- allergisches (extrinsisches) Asthma
Die Obstruktion bei Asthma basiert in erster Linie auf folgenden Vorgängen:1Konstriktion der glatten BronchialmuskulaturÖdem der Schleimhäute in den AtemwegenUmbau der Atemwegswände („Remodeling“)Sekretansammlung.
Verschiedene Auslöser können bei bronchialer Hyperreagibilität zu einer Bronchokonstriktion führen.z. B. Allergene, Atemwegsinfektionen, thermische und chemische Reize, Rauch und Staub sowie körperliche BelastungEine bronchiale Hyperrreagibilität kann auch bei Gesunden vorkommen.1-2
Bei einemAsthmaanfall bei Kindern und Jugendlichenbzw. einer Exazerbation kommt es zu einer temporären Verschlechterung der Symptomatik und Lungenfunktion.Die Ausprägung ist sehr variabel und reicht von leichten bis zu potenziell lebensbedrohlichen Verläufen.
Die Diagnose des Asthmas ist im Wesentlichen eine klinische, auf Basis der Symptome mit Nachweis einer variablen Atemwegsobstruktion bzw. bronchialen Hyperreagibilität.Die Behandlung erfolgt als medikamentöse Stufentherapie und richtet sich nach dem Grad der Asthmakontrolle unter der jeweiligen Behandlung.Patientenschulung und Einweisung in die Inhalationstechniken sind essenzielle Bestandteile der Therapie.
Definition schweres Asthma2
- Bei Kindern und Jugendlichen liegt ein schweres Asthma vor, wenn bei sachgerechter und adäquat durchgeführter Therapie mit dem Ziel einer guten Asthmakontrolle dauerhaft (> 6 Monate) eine Add-on-Therapie mit einem langwirkenden Anticholinergikum (LAMA) oder einem monoklonalen Antikörper erfolgen und/oder eine hohe inhalative Glukokortikoid(ICS)-Tagesdosis verabreicht werden muss.
Häufigkeit
- Prävalenz in Deutschland
- Etwa 10
- Die 12-Monats-Prävalenz liegt bei 4,0
- Im Gegensatz zu Erwachsenen sind Jungen häufiger betroffen als Mädchen.2-3
- Asthma ist die häufigste chronische Erkrankung im Kindesalter.4
- Bei Kindern handelt es sich überwiegend um allergisches Asthma.
- Etwa 10
- Prävalenz weltweit
- Während die Prävalenz von Asthma in der westlichen Welt in den letzten Jahrzehnten zugenommen hat, nahm die Zahl der Krankenhauseinweisungen und Todesfälle deutlich ab.3,5-6
- Weltweit litten im Jahr 2015 etwa 358,2
- Als mögliche Gründe für den Anstieg der Häufigkeit in den letzten Jahrzehnten werden diskutiert:
- weniger Kontakt zu nicht-pathogenen Bakterien (Hygiene-Hypothese)7
- genetische und epigenetische Faktoren8-9
- Umwelteinflüsse (z.
.10-11 - Die lange Zeit ansteigende Prävalenz von Asthma scheint in der westlichen Welt zuletzt ein Plateau erreicht zu haben.12
Ätiologie und Pathogenese
- Asthma ist eine heterogene Erkrankung mit unterschiedlichen pathophysiologischen Mechanismen.1
- Die Entstehung von Asthma ist multifaktoriell mit genetischer Disposition und exogenen Faktoren sowie Verstärkung durch psychosoziale Aspekte.2
- Lebensumstände wie Ernährung und Hygiene spielen vermutlich eine große Rolle, da es zwischen verschiedenen Weltregionen große Unterschiede in der Häufigkeit von Asthma gibt.
Ursachen für Asthma
- Genetische und epigenetische Faktoren
- Umweltfaktoren
- Luftverschmutzung, z.
- Verschmutzung und Allergene in Innenräume, z.
- Exposition gegenüber Zigarettenrauch in der Schwangerschaft und frühen Kindheit führt zu einem erhöhten Erkrankungsrisiko.
- In Schottland wurde nach Einführung des Rauchverbots 2006 ein jährlicher Rückgang der Anzahl stationärer Behandlungen von Kindern mit Asthma von 18 % festgestellt.14
- Eine Kindheit auf einem Bauernhof (Diversität an Mikroorganismen) hat protektive Wirkung.10,15
- Luftverschmutzung, z.
- Exposition gegenüber Tieren
Die Frage, ob Haustiere allergiefördernd oder -präventiv wirken, ist zum jetzigen Zeitpunkt nicht eindeutig geklärt.1Die aktuelle deutsche Leitlinie zur Allergieprävention empfiehlt:16Personen ohne erhöhtes Allergierisiko sollten die Haustierhaltung nicht einschränken.Familien mit erhöhtem Allergierisiko sollten keine Katzen anschaffen.Hundehaltung ist nicht mit einem höheren Allergierisiko verbunden.
- Allergien gegen Hausstaubmilben und Katzen gelten
schon langeals wichtiger Faktor bei der Entwicklung von weiteren Allergien.4,1716 - Anhaltender Kontakt mit anderen Tieren in den ersten Lebensjahren scheint dagegen mit einem reduzierten Risiko für Asthma oder andere atopische Erkrankungen assoziiert zu sein.10
Exposition gegenüber Katzenallergen kann zu einer Antikörperproduktion führen, jedoch ohne Sensitivierung; dies kann eine Erklärung dafür sein, dass die Haustierhaltung das Risiko reduziert, Asthma zu entwickeln.18
- Rezidivierende Virusinfektionen der oberen Atemwege in einem frühen Lebensstadium
- Es ist unklar, ob Infektionen an der Entstehung von Asthma beteiligt sind oder dieser vorbeugen (Hygiene-Hypothese).1
- In einer Studie wurde festgestellt, dass diese das Risiko, Asthma bis zum Schulalter zu entwickeln, reduzieren.
1917 - Jedoch scheinen respiratorische Virusinfektionen, besonders RSV- und Rhinovirus-Infektionen, sowohl für das Auftreten von Asthma als auch für das Provozieren akuter Asthmaanfälle von Bedeutung zu sein.
- Etwa 80–95
2018
- Etwa 80–95
- Adipositas
- Übergewicht ist mit der Entstehung der Erkrankung, einem schwereren Verlauf und schlechterem Therapieansprechen assoziiert.
2119
- Übergewicht ist mit der Entstehung der Erkrankung, einem schwereren Verlauf und schlechterem Therapieansprechen assoziiert.
- Assoziation zu atopischen Erkrankungen
2220-2523 - Medikamente
- Eine Metaanalyse zeigt Hinweise, dass die Exposition gegenüber Paracetamol früh im Leben mit einer späteren Entwicklung von Asthma assoziiert ist.
2624 - Bei einer prospektiven Untersuchung einer Geburtskohorte aus 620 Kindern mit Allergieerkrankungen in der Familie wurde kein Zusammenhang zwischen einer Paracetamol-Einnahme und der Entwicklung von Asthma gefunden.
2725 - Eine Behandlung mit Breitbandantibiotika während der fetalen Entwicklung und in der frühen Lebensphase ist möglicherweise mit vermehrtem Auftreten von Asthma assoziiert. Eindeutige Belege fehlen aber bisher.
2826-2927 - Es wird empfohlen, Paracetamol und Breitbandantibiotika in der Schwangerschaft und ersten Lebensphase nur bei klarer Indikation einzusetzen.1
- Eine Metaanalyse zeigt Hinweise, dass die Exposition gegenüber Paracetamol früh im Leben mit einer späteren Entwicklung von Asthma assoziiert ist.
Pathogenese
- Der Krankheitsprozess ist bei Asthma sehr variabel.
- Die Einteilung der Asthmaformen in Phänotypen folgt der Annahme, dass die Erkrankung bestimmter Patientengruppen sowohl durch eine ähnliche Pathophysiologie als auch durch ähnliche klinische Merkmale gekennzeichnet ist.2
- Man unterscheidet folgende Phänotypen:2
- allergisches (extrinsisches) Asthma
- atopische Disposition
- häufig begleitet von Allergien
- Nachweis spezifischer IgE im Serum
- saisonaler (z.
- nichtallergisches (intrinsisches) Asthma
- ohne Nachweis einer Sensibilisierung
- oft Atemwegsinfektion als Trigger
.
- weitere Sonderformen (siehe nächster Abschnitt)
- allergisches (extrinsisches) Asthma
- Asthma kann auf verschiedenen Wegen Einfluss auf die Atemwege haben:
- Veränderungen der Schleimhäute
- Veränderungen der Immunantwort
- Veränderungen der neuromuskulären Antwort
- Veränderungen der Gefäßversorgung
.
- Meist kommt es zu einem erhöhten Aufkommen von eosinophilen Granulozyten, Mastzellen, T-Lymphozyten und Entzündungsmediatoren und anderen Zytokinen in den Atemwegen.
- Die Entzündungs- und Wachstumsfaktoren führen zu einer Hypertrophie und Hyperplasie der glatten Muskulatur und dadurch zur Obstruktion.
- Die Reflexaktivität und Sensibilität der Bronchialwand ist verändert, was zu der bronchialen Hyperreagibilität beiträgt.
Sonderformen des Asthmas1
- „
TypeTyp-2“- bzw. „Type-2-High“-Asthma- Beruht auf der Erkenntnis, dass bestimmte Zytokine wie IL-5 und IL-13 nicht nur von
Allergen-spezifischenallergenspezifischen T-HelferzellenHelfer-Zellen, sondern auch vonAllergen-unspezifischenallergenunspezifischen „Innate Lymphoid Cells"“ (ILC2) freigesetzt werden können. KlinischDiebedeutsamdamitkönnteassoziiertenderEntzündungsmarkerPhänotypBluteosinophileeinesund exhaliertes Stickstoffmonoxid werden als „TypeTyp-2-HighBiomarker“-Asthmasfür das Ansprechen auf eine Therapie mit inhalativen Glukokortikosteroiden oder bestimmten Anti-Interleukin-Biologika seinbezeichnet.UmstrittenEinerseits spricht eine Typ-2-Entzündung therapeutisch meist gut auf inhalative Kortikosteroide (ICS) und orale Kortikosteroide (OCS) an, andererseits beeinflussen ICS und OCS die Marker der Typ-2-Entzündung erheblich.- Es ist
jedochumstritten,welcher klinische Biomarker (wie z. B. exhaliertes NO oder Periostin)ob ein „Type-2-HighLow“-Phänotyp überhaupt bei einem klassischen Asthmaamexistiert.bestenBeiidentifiziertNachweis niedriger Typ-2-Marker sollte geprüft werden, ob- möglicherweise eine andere Diagnose vorliegt, die ein Asthma imitiert.
- eine chronische Infektion das Entzündungsgeschehen überlagert.
- die Typ-2-Marker durch eine hochdosierte Glukokortikoid-Therapie iatrogen supprimiert sind.
- Folgende Grenzwerte für die Typ-2-Entzündung wurden für Patient*innen mit Asthma unter bestehender ICS-Therapie vorgeschlagen:
- eosinophile Granulozyten im Blut ≥ 150/μl – und/oder –
- Stickstoffmonoxid im Exhalat (FeNO) ≥ 20 ppb – und/oder –
- eosinophile Granulozyten im Sputum ≥ 2 % – und/oder –
- allergische Pathogenese (positive Anamnese in Zusammenhang mit Nachweisen einer entsprechenden Sensibilisierung gegen typische Aeroallergene)
- Beruht auf der Erkenntnis, dass bestimmte Zytokine wie IL-5 und IL-13 nicht nur von
- Eosinophiles
vs.versus nicht-eosinophiles Asthma- Die Unterscheidung der Subtypen erfolgt vor allem anhand von
SputumuntersuchungenSputum- Untersuchungen und anhand des - Ab welchem Grenzwert der Bluteosinophilen-Konzentration von einer „Blut-Eosinophilie“ gesprochen werden kann, ist noch nicht abschließend geklärt.
- Würde man einen Grenzwert von 150 Eosinophilen/μl postulieren, wäre die Mehrheit „eosinophil“
,.wWürde man einen Grenzwert von 300 Eosinophilen/μl postulieren, wäre die Mehrheit „nicht-eosinophil“. - Definition laut NVL: zweimaliger Nachweis ≥ 300 Eosinophilen/μl Blut außerhalb von Exazerbationen in den vergangenen 2 Jahren2
- Würde man einen Grenzwert von 150 Eosinophilen/μl postulieren, wäre die Mehrheit „eosinophil“
- Therapeutisch bedeutsam ist, dass sich die Patient*innen mit eosinophilem und nicht-eosinophilem Asthma in ihrem Ansprechen auf ICS deutlich unterscheiden.
DesweiterenDes Weiteren gewinnt diese Klassifikation eine zunehmende Bedeutung für die Indikationsstellung einer Biologikatherapie, da eine Eosinophilenvermehrung das Ansprechen auf bestimmte Biologika wahrscheinlicher macht (wie Anti-IgE,Omalizumaboder Anti-IL-4-Rezeptor alpha, Dupilumab, Tezepelumab) oder überhaupt erst ein Ansprechen voraussagt (wie bei denAnti-IL-5-BiologikaMepolizumab, Reslizumab und Benralizumab).
- Die Unterscheidung der Subtypen erfolgt vor allem anhand von
- „Cough Variant Asthma“
- Patient*innen leiden unter chronischem, trockenem
- Die Lungenfunktion und die Röntgenaufnahme der Thoraxorgane sind normal.
- 1/3 der Patient*innen mit Cough
-Variant-Asthma entwickelt im weiteren Verlauf ein klassisches Asthma. - Patient*innen mit Cough
-Variant-Asthma sprechen gut auf klassische antiasthmatische Therapieoptionen an, eine frühzeitige Therapie kann den Übergang in ein klassisches Asthma verhindern.
- Patient*innen leiden unter chronischem, trockenem
- Aspirin Exacerbated
AirwayRespiratory Disease (AERD)- früher: „Asthma bei Aspirinintoleranz“
- Intoleranz gegenüber Hemmern der Cyclooxygenase-1 (COX-1) wie Acetylsalicylsäure (ASS) oder Ibuprofen
- Es wird vermutet, dass diese pharmakologische Intoleranz eine vorbestehende Schädigung der Atemwege lediglich aggraviert, nicht jedoch auslöst.
- Die genaue Prävalenz ist unklar, Angaben schwanken zwischen 5,5
- klassischerweise begleitet von
- Anstrengungsinduzierte Bronchokonstriktion
- früher: „Anstrengungsasthma
"“ - Körperliche Belastung führt zur Atemwegsobstruktion.
- Als Ursache wird eine wiederholte Austrocknung der Schleimhäute, die ein Remodeling der Atemwege und die Entwicklung einer bronchialen Hyperreagibilität fördert, postuliert.
- Tritt gehäuft bei Ausdauersportarten (vermehrte Atemleistung) auf.
- Cave bei Sportler*innen: Behandlung mit Beta-2-Sympathomimetika unterliegt den Regularien der WADA (World Anti-Doping Association)!
- früher: „Anstrengungsasthma
Prädisponierende Faktoren
Faktoren, die die Entstehung oder den Verlauf von Asthma beeinflussen können
- Genetische Prädisposition
- Kinder mit genetischer Vorbelastung (sog. Risikokinder) sind dadurch definiert, dass mindestens ein Elternteil oder Geschwister unter einer atopischen
ErkrankungenErkrankung leiden.1628
- Kinder mit genetischer Vorbelastung (sog. Risikokinder) sind dadurch definiert, dass mindestens ein Elternteil oder Geschwister unter einer atopischen
AllergenexpositionUmweltbedingungenAtemwegsinfektionenVorhandensein anderer Erkrankungen des atopischen Formenkreises (z. B. Ekzem, Rhinitis) 2- Tabakrauch
- Einnahme von Antibiotika und Paracetamol in der Schwangerschaft durch die Mutter27-29
- Psychosoziale Belastungen2
GeschlechtKörpergewichtErnährungMedikamenteAdipositas19
Auslösende Faktoren
- Siehe auch den Artikel Asthmaanfall bei Kindern und Jugendlichen.
- Es gibt zahlreiche Faktoren, die einen akuten Asthmaanfall auslösen können:
ICPC-2
- R96 Asthma
ICD-10
- J45 Asthma
- J45.0 Vorwiegend allergisches Asthma bronchiale
- J45.1 Nichtallergisches Asthma bronchiale
- J45.8 Mischformen des Asthma bronchiale
- J45.9 Asthma bronchiale, nicht näher bezeichnet
- J46 Status asthmaticus, inkl. akutes schweres Asthma bronchiale
Diagnostik
Diagnostische Kriterien
KlassischerweiseDieliegenDiagnosebeiAsthmaKindernsollanamnestischanhandwiederholtederEpisodenAnamnese,voncharakteristischererschwerter AtmungSymptome undAtemnotdervor,Befunde deroftLungenfunktionsprüfungenbegleitetgestelltvon trockenem Reizhustenwerden undgeräuschvollersollteAusatmungtypischeinsbesondereBiomarkerbei oder nach körperlicher Belastung (z. B. auch Spielen oder Lachen)berücksichtigen.1- Bei jungen Kindern,
wirddie zur Kooperation beiverdächtigerderAnamneseLungenfunktionsprüfung noch nicht in der Lage sind, ist die Diagnosestellung erschwert. Neben familien- undKlinikeigenanamnestischen Hinweisen auf atopische Erkrankungen sollen gezielt erfragt/getestet werden:1- ≥ 3 asthmatypische Episoden im letzten Jahr
- stationärer Aufenthalt wegen Symptomatik einer Atemwegsobstruktion
- giemende Atemgeräusche/trockener Husten ohne Infekt, insbesondere bei körperlicher Anstrengung
- Ansprechen der Symptome auf einen Therapieversuch mit antiasthmatisch wirkenden Medikamenten
- Nachweis einer Sensibilisierung gegenüber Aeroallergenen und/oder Blut-Eosinophilie
- Ein positiver Reversibilitätstest, in Zusammenhang mit einer typischen Asthma-Symptomatik, sichert die Diagnose Asthma
gestellt, wenn sich eine reversible obstruktive Ventilationsstörung dokumentieren lässt.1 Die Diagnose wird gestützt durch einen positiven allergologischen Befund.Je jünger das betroffene Kind, desto schwerer ist die Diagnose zu stellen.1VieleAuchKleinkinderbeimachenfehlenderrezidivierendeSABA-ReversibilitätobstruktivekannBronchitideneindurch.DieAsthmameistendiagnostiziertdieserwerden,rezidivierendenfallsobstruktivenweitereBronchitidenHinweisesindaufreineinvirusinfektassoziiert,Asthma (erhöhte Typ-2-Marker unddieeinSymptomatikAnsprechenverschwindetaufnachICS-demTherapie)3. Lebensjahr.
Im Kleinkindalter lässt sich die Diagnose in der Regel nicht mit absoluter Sicherheit stellen.1Wichtige Verdachtsmomente sind Atopie, positive Familienanamnese für Allergien und/oder Asthma und infektunabhängige respiratorische Symptome, wobei es gilt, wichtigeDifferenzialdiagnosenauszuschließen (z. B.Mukoviszidose,gastroösophagealer Reflux)vorliegen.
Akuter Asthmaanfall
- Zur Diagnostik und Therapie des akuten Asthmaanfalls siehe
dieden Artikel:
Leitlinien zur Diagnostik
- In Deutschland existieren sowohl eine Leitlinie von der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin (DGP)1 als auch eine Nationale Versorgungsleitlinie Asthma (NVL).2 Der folgende Leitlinienkasten fasst die gemeinsamen Aussagen der beiden Leitlinien zusammen.
- Deutliche Abweichungen voneinander sind kursiv gekennzeichnet.
Leitlinie: Asthma – Diagnostik1-2
Die 4 Säulen der Diagnose Asthma
Anamnese, Beschwerden und körperliche UntersuchungReversible AtemwegsobstruktionChronisch entzündliche Veränderung der AtemwegeBronchiale Hyperreagibilität
Anamnese
Typische Beschwerden
- Anfallsartig auftretende Atemnot, oftmals nachts
- Trockener Husten ohne Infekt, bei oder nach körperlicher Belastung
- Exspiratorische Atemnebengeräusche (Giemen, Brummen, Pfeifen)
BrustengeAnhaltender nächtlicher Husten ohne Infekte
Asthmaspezifische Anamnese
- Auslösefaktoren
- z.
- bei Kindern oft körperliche Belastung (Sport, Spielen, auch Lachen)
- Allergenexposition (z. B. Haustiere und Schimmelbefall)
- z.
- Risikofaktoren
- Komorbiditäten
- z.
- z.
Besonderheiten des Kindes- und Jugendalters
- Frage nach Passivrauchbelastung
- Bei Jugendlichen Frage nach Aktivrauchen und Berufswunsch
- Möglichkeit, präventiv tätig zu werden.
- Anamnese bei Kindern ≤
Klinische Untersuchung
- Zielt auf den Nachweis von Zeichen einer Atemwegsobstruktion ab.
- Der Untersuchungsbefund kann im Intervall unauffällig sein.
- Mögliche Befunde in der Untersuchung
- exspiratorischer Stridor
- verlängertes Exspirium
- trockene Nebengeräusche (Giemen, Pfeifen, Brummen) bei der Auskultation, ggf. durch eine forcierte Exspiration zu provozieren.
- hypersonorer Klopfschall aufgrund der Lungenüberblähung bei schwergradigem Asthma
- bei schwerer Obstruktion: sehr leises Atemgeräusch
- Bei Kindern sollte zusätzlich geachtet werden auf:
- Atopie-Zeichen, z.
- Einziehungen jugulär, interkostal und epigastrisch als Zeichen von Dyspnoe
- einen erhöhten Thoraxdurchmesser durch Überblähung
- Zeichen eines minderwüchsigen und dystrophen Kindes (erhöhte Atemarbeit)
- Differenzialdiagnosen ausschließen (z.
- Differenzialdiagnosen ausschließen (z.
- Atopie-Zeichen, z.
Lungenfunktionsdiagnostik
- Um die Diagnose eines Asthmas zu erhärten, soll eine variable, (partiell) reversible Atemwegsobstruktion durch eine Lungenfunktionsprüfung, typischerweise durch Spirometrie, nachgewiesen werden.
- Normalbefund in der Lungenfunktionsdiagnostik schließt ein Asthma nicht aus.
Spirometrie mit Darstellung der vollständigen Fluss-Volumen-Kurve
- Messung forcierte Vitalkapazität (FVC), Einsekundenkapazität (FEV1) und Verhältnis FEV1/FVC (Tiffeneau-Index)
BewertungZurderQualitätskontrolle sollenbestenmindestensWerte aus3akzeptablenakzeptableMessungenVersucheohneaufgezeichnetausgeprägtewerden. Die Differenz(biszwischen dem größten und zweitgrößten Wert für FEV1 und FVC soll nicht mehr als 5 %%)undderwenigerErgebnisseals 150 ml betragen.- Bild einer obstruktiven Ventilationsstörung
- Reduktion des altersabhängigen Quotienten aus FEV1 und FVC (Tiffeneau-Index)
- Reduktion der absoluten Einsekundenkapazität
- Reduktion der maximalen endexpiratorischen Atemstromstärke
- Bewertung anhand der altersspezifischen Referenzwerte der Global Lung Initiative
- Zur Interpretation der Ergebnisse verweist die NVL auf die DGP-Leitlinie Spirometrie.
3130 im Kindesalter keine Einteilung in Schweregerade entsprechend FEV1/FVC wie bei Erwachsenenstattdessen Angabe z-Werte (Standardabweichung vom Soll-Mittelwert)
- Zur Interpretation der Ergebnisse verweist die NVL auf die DGP-Leitlinie Spirometrie.
- Besonderheiten bei Kindern ≤
- Die Durchführung der Spirometrie ist nur bei entsprechender Mitarbeit der Kinder möglich.
- Das bei jüngeren Kindern bestehende Größenverhältnis von Atemwegen zum Lungenvolumen macht die Dokumentation zusätzlicher Lungenfunktionsparameter (FEV0,5 und FEV0,75) erforderlich.
- Selbst wenn die Ausatemzeit länger als 1 sec ist, liegt der FEV1/FVC-Quotient bei gesunden Kindern bis zum 6.
- Die Werte können also bei Kindern vor dem Schulalter nicht, wie bei älteren üblich, zur Beurteilung einer Atemwegsobstruktion verwendet werden.
- Häufig ist die Beurteilung einer obstruktiven Ventilationsstörung erst nach Durchführung eines Reversibilitätstestes möglich.
Reversibilitätstestung
- Bei Patient*innen mit nachgewiesener Atemwegsobstruktion soll zur Bestätigung der Diagnose zunächst ein Reversibilitätstest mit kurzwirkenden Beta-2-Sympathomimetika (SABA) durchgeführt werden.
Eine Reversibilitätstestung kann auch bei einer „normalen" Lungenfunktion sinnvoll sein, da der persönliche Bestwert trotz des im Normbereich liegenden Wertes deutlich höher sein kann.- Spirometrie vor und 15 min nach Inhalation zunächst eines kurzwirksamen Beta-2-Sympathomimetikums (SABA)
- bei Kindern Inhalation bis zu 4 Hübe eines SABA-Dosieraerosols (z.
- alternativ erneute Spirometrie nach 6–8 Wochen Therapie mit inhalativen Kortikosteroiden zur Beurteilung der Reversibilität
- bei Kindern Inhalation bis zu 4 Hübe eines SABA-Dosieraerosols (z.
- FEV1-Zunahme >
- Das bei Erwachsenen geforderte Kriterium der Zunahme um 200
- Immer ist
zunächstdie Form der Fluss-Volumen-Kurve zu beurteilen:auchAuch bei numerisch nicht ausreichender FEV1-Zunahme kann eine Normalisierung eines primär konkav deformierten exspiratorischen Schenkels aufeineeinklinischbehandlungsbedürftigesrelevante Reversibilität der obstruktiven VentilationsstörungAsthma hinweisen.
- Das bei Erwachsenen geforderte Kriterium der Zunahme um 200
- Besonderheiten des Kindesalters (≤
- bei auskultierbarer Obstruktion Prüfung der Reversibilität nach Gabe eines SABA
Messung der Hyperreagibilität (Provokationstest)
- Die Messung der Überempfindlichkeit der Atemwege ist bei entsprechendem Verdacht sinnvoll, sofern die Anamnese mit einem Asthma vereinbar ist, jedoch keine klinischen Zeichen und/oder eine obstruktive Ventilationsstörung nachweisbar sind.
- Voraussetzungen: Beachtung von Kontraindikationen und Erfahrung der Anwender*innen
- Methoden der Provokationstestung
- unspezifische inhalative Provokation mit Pharmaka (z.
- standardisierte Belastung (mittels
Laufbandeines Laufbands oder besonders bei Kleinkindern „Free Running Test“) - Kaltluftprovokation
- unspezifische inhalative Provokation mit Pharmaka (z.
- Bei Kindern mit Beschwerden bei körperlicher Anstrengung wird ein Lauf-Belastungstest empfohlen.
- Test wird als positiv gewertet bei:
- FEV1-Abfall ≥
- FEV1-Abfall
um≥ 10–15% bei Erwachsenen und ≥ 12 % bei Kindern und Jugendlichen bei rein körperlicher Belastung
- FEV1-Abfall ≥
Verdopplung des spezifischen Atemwegswiderstandes ≥ 2,0 kPa x sec
Ganzkörperplethysmografie
- Erlaubt die Bestimmung des spezifischen Atemwegswiderstandes und des intrathorakalen Gasvolumens und eignet sich zur Objektivierung der Lungenüberblähung.
- Überdies ist die qualitative Beurteilung der inspiratorischen und exspiratorischen Atemwegswiderstände möglich.
- Auch bei mangelhafter Mitarbeit bei den spirometrischen Untersuchungen hilfreich.
- Während gut angeleitete Kindergartenkinder oftmals in der Lage sind, eine Spirometrie durchzuführen, kann aus Gründen der Kooperationsfähigkeit eine vollständige Bodyplethysmografie in der Regel erst ab dem Schulkindalter erfolgen.
Messung des exspiratorischen Spitzenfluss (Peak Expiratory Flow, PEF)
- Entsprechend der aktuellen NVL kein Stellenwert in der Primärdiagnostik
- Die Diagnose des Asthmas soll nicht ausschließlich durch Anwendung der Peak-Flow-Messung (PEF) gestellt werden.
- Die häusliche Messung des PEF-Wertes ist jedoch für die Beurteilung des Verlaufs der Erkrankung und der Beurteilung der Asthmakontrolle hilfreich.
- Messung allenfalls ergänzend
- Die täglich
2-maligezweimalige Messung (morgens und abends, vor Inhalation von Medikamenten) erlaubt die Einschätzung der PEF−Variabilität. - Regelmäßige häusliche Peak-Flow-Messungen werden im Kindesalter vor allem im Rahmen von Patientenschulungen eingesetzt, insbesondere wenn es dem Kind schwerfällt, Atemwegsbeschwerden subjektiv wahrzunehmen.
- Eine generelle Empfehlung für Kinder gibt es jedoch nicht.
- Die täglich
Weitere Untersuchungen
Fraktion von Stickstoffmonoxid (FeNO) in der Ausatemluft
KannNoninvasiverzurBiomarkerDiagnosesicherungdereingesetztAtemwegsinflammation- Die
werdenFeNO-Messung im Kindes-, Jugend- und Erwachsenenalter ist technisch schnell und einfach durchzuführen (bei Verfügbarkeit eines entsprechenden Gerätes, in der lungenfachärztlichen Diagnostik, Anm. d. Red.) und reproduzierbar. - Erhöhte FeNO-Werte in der Ausatmungsluft korrelieren bei Patient*innen mit Asthmasymptomen mit einer Typ-2-Atemwegsentzündung.
DiagnostischerDieZusatznutzenunterenvonGrenzwerteFeNO in der Primärdiagnostik ist Gegenstand der aktuellen Forschung.Hohe FeNO-Werten erhöhen die Wahrscheinlichkeit für die Diagnose Asthma und für das Ansprechen auf ICS.Ein niedriger FeNO-Wert schließt die Diagnose Asthma nicht aus.
Der empfohlene Grenzwert (laut der American Thoracic Society)liegt für Kinderliegen beiFeNOKindern<bei 20<parts25perppbbillion) und bei Erwachsenen)bei 25 ppb.
- Die Messung der Atemwegsinflammation mittels FeNO
-Bestimmungalsist„wertvollenein wichtiger Baustein im Rahmen von Diagnostik und Management“bezeichnetvon Asthma und als diagnostisches Instrument in der pneumologisch-fachärztlichen Praxis unverzichtbar. - Bei Kindern und Jugendlichen erwies sich das regelmäßig kontrollierte FeNO als aussagekräftiger Parameter,
siehtum nach geplantem ICS-Absetzen einen Asthmarückfall noch vor dem Auftreten klinischer Symptome vorherzusagen.
- Sieht die
NVL „dieAnwendung von FeNO in der Diagnostik als nicht ausreichend im Nutzen belegt, da konfirmatorische Studien fehlen, die den diagnostischen Zusatznutzen abschließend klären würden.“Jedoch bringe die Bestimmung von FeNO insbesondere zusammen mit anderen diagnostischen Verfahren einen Zugewinn an Sicherheit bei der Diagnose.
Röntgenuntersuchung
- Bei Kindern und Jugendlichen nicht generell empfohlen
- ggf. Einsatz zum Ausschluss von Differenzialdiagnosen bei atypischen Symptomen oder diskrepanten Befunden
- in diesem Fall jedoch nur postero-anteriore Aufnahme; zusätzliche Seitaufnahme bei Kindern und Jugendlichen obsolet
Laboruntersuchung
- Bei fehlendem Ansprechen auf die Therapie, häufigen Bronchialinfekten, Lungeninfiltraten oder bei schwerem Asthma sollte aus differenzialdiagnostischen Gründen eine ergänzende Labordiagnostik erfolgen.
- Leukozytenzahl und CRP bei V.
- absolute Eosinophilenzahl (Eosinophile/μl)
- je
alshöher die Bluteosinophilen-Zahl (und der FeNO-Wert), desto höher das Exazerbationsrisiko bei Patient*innen mit Asthma - wichtiger prognostischer Marker für
eosinophiledasAtemwegsentzündungAnsprechenundaufdieeineWirksamkeitTherapieeinermit Anti-IL-5-Therapie(R)-Biologika: je höher der Bluteosinophilenwert, desto wahrscheinlicher das Ansprechen
- je
- Gesamt-IgE im Blut
- bei Werten über 100
- bei Werten >
- bei Werten über 100
- Leukozytenzahl und CRP bei V.
Allergologische Stufendiagnostik
- Siehe Artikel Allergiediagnostik bei Kindern.
- Sollte laut NVL nur bei Patient*innen mit V.
Sollte lautLaut DGP in der lungenfachärztlichen Diagnostik bei jedem neu diagnostizierten Asthmadurchgeführt werden.erforderlich- Stufendiagnostik
- Allergieanamnese einschließlich Berufsanamnese (ggf. Fragebogen)
- Allergie-Hauttestung (z. B. Prick-Test)
- Bestimmung von spezifischem und Gesamt-IgE
ggf. allergenspezifischen Organprovokationstests (Cave: stets Notfalltherapie vorhalten!)Provokationstestung- diagnostische Expositionskarenz
Überprüfung der Diagnose
- Die Diagnose Asthma soll laut NVL überprüft bzw. infrage gestellt werden:
- bei unzureichender Kontrolle trotz leitliniengerechter Therapie – oder –
- nach einem mehrmonatigen Auslassversuch unter Berücksichtigung saisonaler Triggerfaktoren
.
- Ziel ist die Vermeidung von Fehldiagnosen und einer Über- bzw. Fehlversorgung.
- Die DGP weist zudem darauf hin, dass die Diagnose Asthma nicht immer bereits bei der Eingangsuntersuchung gestellt werden kann. Daher sind Verlaufsbeobachtungen sinnvoll, da sie Aufschluss über die spontanen und/oder medikamentös verursachten Schwankungen des Krankheitsbildes erlauben.
- Die GINA empfiehlt Untersuchungen auf Nebennierenrindeninsuffizienz in Betracht zu ziehen, wenn Patient*innen dauerhaft auf orale Glukokortikoide oder hohe Dosen von ICS + LABA angewiesen sind.31
Algorithmus für die Diagnostik des Asthmas
- Die NVL bietet
eineinenFließschemaAlgorithmus für die Diagnostik des Asthmas an.- Die DGP nennt für die lungenfachärztliche Versorgung zwei weitere essenzielle diagnostische Bausteine, die von der NVL nicht als obligat angesehen werden, den Nachweis eines erhöhten bronchialen Entzündungsniveaus mittels FeNO-Messung (in der pneumologisch-fachärztlichen Praxis) und die allergologische Stufendiagnostik.1
Differenzialdiagnosen
Säugling
- Virusinduzierte obstruktive Bronchitis
- Bronchiolitis (RS-Virus)
- Angeborener Herzfehler
- Fremdkörperaspiration
- Mukoviszidose (zystische Fibrose)
- Kongenitale Anomalien, z.
Kleinkind
- Bronchiolitis
- Pseudokrupp
- Epiglottitis
- Keuchhusten
- Fremdkörperaspiration
- Virale Bronchitis
- Pneumonie
- Mukoviszidose (zystische Fibrose)
- Diabetische Ketoazidose
- Gastroösophagealer Reflux (v.
Kinder und Jugendliche
- Chronische Bronchitis
- Pneumonie
- Pneumothorax
- Hyperventilation
- Diabetische Ketoazidose
- Fremdkörperaspiration
- Psychogen bedingte Atembeschwerden
- Stimmbanddysfunktion (Vocal Cord Dysfunction, VCD)
- Gastroösophagealer Reflux (v.
Anamnese
- Siehe den Leitlinienkasten Anamnese.
- Die meisten Kinder entwickeln Asthmasymptome vor dem 5. Lebensjahr.32
- Bei Kleinkindern sind folgende Besonderheiten in der Anamnese zu beachten:
Klinische Untersuchung
- Siehe Leitlinienkasten Abschnitt Klinische Untersuchung.
Ergänzende Untersuchungen in der Hausarztpraxis
- Die Durchführbarkeit der diagnostischen Maßnahmen ist bei Kindern abhängig vom Alter und der Kooperationsfähigkeit.
- Eine zuverlässige Lungenfunktionsdiagnostik ist häufig erst ab dem 4.–5. Lebensjahr möglich.
Lungenfunktionsdiagnostik
- Siehe Leitlinienkasten Abschnitt Lungenfunktionsdiagnostik.
Labordiagnostik
Zur Diagnosestellung sind keine Laboruntersuchungen erforderlich, sie sind jedoch zur Differenzialdiagnostik geeignet.2- Siehe Leitlinienkasten Abschnitt Laboruntersuchung.
AbsoluteNVL: zur Diagnosestellung keine Laboruntersuchungen erforderlich, jedoch zur Differenzialdiagnostik geeignet2- DGP: Sieht absolute Eosinophilenzahl
(Eosinophile/μl)Markerals wichtigen Biomarker füreosinophiledieAtemwegsentzündunglungenfachärztlicheundDiagnostikWirksamkeitzureiner AntiEingrenzung des Asthma-IL-5-TherapieAssoziation zwischen einer erhöhten Eosinophilenzahl (> 400/µl)Phänotyps und derAnzahl an Exazerbationen, einer verminderten Asthmakontrolle und dem Risiko für akute respiratorische EreignisseAsthma-Prognose.341
Diagnostik bei Spezialist*innen
- Für weitere apparative Untersuchungen siehe Leitlinienkasten Abschnitt Weitere Untersuchungen.
- Für allergologische Stufendiagnostik siehe Leitlinienkasten Abschnitt Allergologische Stufendiagnostik.
Indikationen zur Überweisung/Klinikeinweisung
- Indikationen zur Überweisung an (pädiatrische) Pneumolog*innen2
- Überweisungsindikation prüfen:
WennZweifel an der Diagnosebestehen.bei unzureichenderunzureichende Asthmakontrolle trotz intensivierter Behandlungbei vorausgegangenervorausgegangene NotfallbehandlungBeiVerdacht auf Begleiterkrankungen, die die Asthmakontrolle negativ beeinflussen.
- Überweisung indiziert:
Bei KindernKinder undJugendlichenJugendliche, deren Asthma eine Behandlung der Therapiestufe 4–5 erfordert.ZurIndikationsstellung und Initiierung der Behandlung mit monoklonalen Antikörpern bei Kindern und Jugendlichen.- Vor dem Übergang in Stufe 5 oder 6 sollte eine erweitere Diagnostik in einem kinderpneumologischen Zentrum erfolgen.
- Überweisungsindikation prüfen:
- Indikationen zur Krankenhauseinweisung2
- Bei einem schweren oder lebensbedrohlichen Asthmaanfall sollte nach der Initialtherapie die sofortige Einweisung in ein Krankenhaus organisiert werden, ggf. mit notärztlicher Begleitung (bei lebensbedrohlichem Anfall).
- Zeigt sich 30–60
Minutenmin nach der initialen Versorgung des leichten bis mittelschweren Asthmaanfalls keine nachhaltige Besserung, empfiehlt die Leitliniengruppe die umgehende Einweisung in das Krankenhaus bzw. die weitergehende Behandlung in der Notaufnahme.
Therapie
Therapieziele
ZielErreichen und derAsthmabehandlungErhaltisteineres, über einen langen Zeitraum eine gute Asthmakontrolle zu erreichen.Asthma-Remission1-2,35- Vermeidung von:2
- akuten und chronischen Krankheitserscheinungen (z.
- Beeinträchtigung der physischen, psychischen und geistigen Entwicklung
- Beeinträchtigung der Aktivitäten im Alltag (z.
- Komplikationen und Folgeschäden
- unerwünschten Wirkungen der Therapie
. - Verbesserung der gesundheits- und asthmabezogenen Lebensqualität
Allgemeines zur Therapie
Grundsätze in der Behandlung von Asthma
- Aktuelles Konzept der medikamentösen Asthmatherapie: weg von der Symptom-Bekämpfung mit kurzwirksamen und nebenwirkungsreichen Medikamenten, hin zur Symptom-Prävention mit nachhaltigen und nebenwirkungsarmen Medikamenten1
- Grundlage der Therapie ist der Grad der Asthmakontrolle.1-2
- Es werden
3drei Grade der Asthmakontrolle definiert:- kontrolliertes Asthma
- teilweise kontrolliertes Asthma
- unkontrolliertes Asthma
.
- Verlaufsbeobachtung und wiederholte Beurteilung der Asthmakontrolle
- Beurteilung der Therapieziele und ggf. Anpassung (Intensivierung/Reduktion)
- Es werden
- Meidung der auslösenden Faktoren (z.
- Stufenbasierte, medikamentöse Langzeittherapie
- Verbrauch an Bedarfsmedikation durch langfristige antientzündliche Therapie möglichst minimieren.
- Information und Patientenschulung von Betroffenen und Angehörigen
- Bei allergischem Asthma ggf. Versuch der frühzeitigen Hyposensibilisierung
- Zur Behandlung bei Erwachsenen siehe auch den Artikel Asthma.
- Zur Akuttherapie im Asthmaanfall siehe auch:
Grad der Asthmakontrolle
- Siehe Tabelle Grade der Asthmakontrolle bei Kindern und Jugendlichen.
- Cave: Unterschiede in der Asthmakontrolle zwischen NVL und GINA!
- Bei Kindern und Jugendlichen wird jegliches Vorhandensein von Symptomen tagsüber bzw. jeglicher Einsatz einer Bedarfsmedikation in einer beliebigen Woche von der Leitliniengruppe der NVL Asthma bereits als Hinweis für eine Verminderung der Symptomkontrolle angesehen.2
- In der GINA
2020werden Kinder ab einem Alter von 6 Jahren, Jugendliche und Erwachsene gemeinsam betrachtet. Asthmasymptome dürfen bis zu 2-mal in der Woche auftreten bzw. die Bedarfsmedikation bis zu 2-mal in der Woche angewandt werden, bevor eine Einschränkung der Symptomkontrolle gesehen wird.3331 - Diese leichte Abwandlung trägt dem Umstand Rechnung, dass die GINA einen internationalen Geltungsbereich mit teilweise anderen sozioökonomischen Verhältnissen und Versorgungsstandards als Deutschland aufweist.2
Klimabewusste Verordnung von inhalativen Arzneimitteln
- Die Angaben zu diesem Abschnitt beziehen sich auf die entsprechende Leitlinie der DEGAM.
3633 - Dosieraerosole (DA) benutzen Treibmittel, um den Wirkstoff in tiefe Lungenabschnitte zu transportieren.
- Diese schädigen zwar die Ozonschicht nicht, sind aber starke Treibhausgase.
- Dadurch haben DA im Vergleich zu Pulverinhalatoren ein vielfach höheres Schädigungspotenzial für die Atmosphäre.
- Nichtsdestotrotz sind DA in folgenden Fällen indiziert:
- bei Kindern <
- bei akutem Asthmaanfall
.
- bei Kindern <
- Verschreibende, Apotheker*innen und Patient*innen sollten berücksichtigen, dass zwischen den einzelnen DA beträchtliche Unterschiede in ihrem Global Warming Potential bestehen, und das DA mit einem möglichst niedrigen GWP bevorzugen, wenn sie klinisch vergleichbar wirksam sind.
- Bei stabilem Asthma ab einem Alter von 5 Jahren sind andere inhalative Arzneimittel genauso effektiv wie ein DA.
Medikamentöse Therapie
Medikamentöse Stufentherapie bei Kindern und Jugendlichen
- Siehe Tabelle Medikamentöses Stufenschema Asthma bei Kindern und Jugendlichen.
- Cave: Unterschiede in der medikamentösen Stufentherapie zwischen NVL und GINA!
- GINA empfiehlt
seit der neuesten Version von 2020keine Monotherapie mit SABA bei Jugendlichen und Erwachsenen mehr, sondern immer eine Kombination mit inhalativen Kortikosteroiden (ICS). Generell sollten alle jugendlichen und erwachsenen Patient*innen mit Asthma ICS erhalten.3331- Grund ist die vermutliche Risikoerhöhung für Exazerbationen durch eine Monotherapie mit SABA.
- bei mildem Asthma Fixkombination aus ICS + Formoterol auch als Bedarfsmedikation
- in Deutschland als reine Bedarfsmedikation jedoch in Stufe 1 und 2 nicht zugelassen
(Stand 2020)234
- in Deutschland als reine Bedarfsmedikation jedoch in Stufe 1 und 2 nicht zugelassen
Dosierung inhalativer Kortikosteroide (ICS)
- Siehe Vergleichstabelle der Dosierungen inhalativer Kortikosteroide (ICS) für Kinder und Jugendliche.
Behandlung im akuten Asthmaanfall
- Siehe Artikel Asthmaanfall bei Kindern und Jugendlichen.
- In Deutschland existieren sowohl eine Leitlinie von der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin (DGP)1 als auch eine Nationale Versorgungsleitlinie Asthma (NVL).2 Der folgende Leitlinienkasten fasst die gemeinsamen Aussagen der beiden Leitlinien zusammen. Deutliche Abweichungen voneinander sind kursiv gekennzeichnet.
Leitlinie: Medikamentöse Behandlung bei Kindern und Jugendlichen1-2
Allgemeines zur medikamentösen Therapie
- Ziel: Optimale Asthmakontrolle erreichen.
- Atemwegsobstruktion vermeiden.
- Bronchiale Hyperreagibilität reduzieren.
- Asthmabedingte Atemwegsentzündung unterdrücken.
- Die medikamentöse Asthmatherapie zielt darauf ab, den Status eines kontrollierten Asthmas nach dem Prinzip „so viel wie nötig, jedoch so wenig wie möglich
"“ zu erreichen,und diesen aufrechtzuerhalten. - Bei Kindern und Jugendlichen soll die medikamentöse Langzeittherapie so begonnen und angepasst werden, dass alle Alltagsaktivitäten ohne Bedarfsmedikation möglich sind.
- Ergänzung der Pharmakotherapie durch nichtmedikamentöse Maßnahmen
- Bestmögliches Wissen der Patient*innen über ihre Erkrankung und das Selbstmanagement ist anzustreben.
- Insbesondere komplexe Therapieschema führen oft zu mangelnder Therapieadhärenz.
Die Medikamente werden in 2 Klassen eingeteilt
- Langzeittherapeutika („Controller“)
- Die Langzeittherapie von Kindern und Jugendlichen wird empfohlen, wenn eine Bedarfsmedikation benötigt wird, um Alltagsaktivitäten ohne Asthmasymptome zu bewältigen.
- ICS: Die Therapie mit inhalativen Kortikosteroiden (ICS) bildet die Grundlage der Langzeittherapie.
- keine Monotherapie mit langwirkendem Beta-2-Sympathomimetikum (LABA) oder langwirkendem Anticholinergikum (LAMA) empfohlen
- Bedarfsmedikamente („Reliever“)
- SABA: Kurzwirksame Beta-2-Sympathomimetika (SABA) sind in jeder Therapiestufe als Bedarfsmedikation einzusetzen.
- Cave: Die GINA
2020sprichtempfiehltsichkeinefür die bevorzugte Gabe von ICS + Formoterol gegenüber SABA-Monotherapiemehr!als Bedarfsmedikation aus, da bei vergleichbarer Symptomkontrolle ein vermindertes Exazerbationsrisiko erzielt werden könne.3331 - Die DGP nennt ICS + Formoterol bei Kindern und Jugendlichen ab 12 Jahren als mögliche Alternative.1
- Cave: Die GINA
- Ein geringer Bedarf an SABA ist ein wichtiges Ziel und ein Kriterium für den Erfolg der Therapie.
- Eine Alternative stellt eine Fixkombination aus ICS und Formoterol (ab 12 Jahren) dar, wenn diese auch die Langzeittherapie darstellt.
- SABA: Kurzwirksame Beta-2-Sympathomimetika (SABA) sind in jeder Therapiestufe als Bedarfsmedikation einzusetzen.
Applikationsformen: inhalativ, oral, parenteral
- Inhalative Applikation soll bevorzugt werden.
- höhere lokale Konzentrationen, schneller Wirkeintritt und weniger systemischen Nebenwirkungen
- Behandlung gemäß medikamentösem Stufenschema
- Die Therapie orientiert sich am Grad der Asthmakontrolle.
- Trotz adäquater Therapie und Therapieadhärenz gibt es Fälle, in denen keine gute Asthmakontrolle erreicht wird.
- Die Therapie orientiert sich am Grad der Asthmakontrolle.
Verlaufsbeurteilung: Asthmakontrolle
- Einteilung in
3drei Grade entsprechend den Beschwerden, der Einschränkungen im Alltag und dem Gebrauch der Bedarfsmedikation - kontrolliertes Asthma
- teilweise kontrolliertes Asthma
- unkontrolliertes Asthma
. - Siehe Tabelle Grade der Asthmakontrolle bei Kindern und Jugendlichen.
- :
Medikamentöse Stufentherapie
- Die NVL aus dem Jahr 2020 empfiehlt bei Kindern und Jugendlichen eine Stufentherapie mit 6 Stufen.2
- Hiervon abweichende Empfehlungen der DPG-LL sind als solche gekennzeichnet.1
Initiale Behandlung bei Kindern und Jugendlichen
- Die NVL empfiehlt:2
- Bei Kriterien eines teilweise kontrollierten Asthmas sollte die Langzeittherapie in der Regel auf Stufe 2 begonnen werden.
- Bei Kriterien eines unkontrollierten Asthmas sollte die Langzeittherapie mindestens auf Stufe 3 begonnen werden.
Hinweise zum „Off-Label-Use“
- In der NVL Asthma empfohlene Therapieoptionen sind nicht für alle adressierten Patientengruppen oder Indikationen zugelassen.
- Dosisangaben in der NVL weichen teilweise von den Fachinformationen ab.
- Kriterien für „Off-Label-Use“ (zulassungsüberschreitender Einsatz eines Arzneimittels)
- nachgewiesene Wirksamkeit
- günstiges Nutzen-Risikoprofil
- fehlende Alternativen – Heilversuch
- Siehe Tabelle Medikamentöses Stufenschema Asthma bei Kindern und Jugendlichen.
Therapiestufe 1 bei Kindern und Jugendlichen
- Bedarfstherapie
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- SABA als Bedarfsmedikament für Patient*innen mit nur leichten oder seltenen Beschwerden
- z.
- Alternative in begründeten Fällen (Nebenwirkungen oder Kontraindikationen gegen SABA)
- Ipratropiumbromid als Zusatz oder Alternative zu SABA
- ab 12 Jahren: Fixkombination aus ICS niedrigdosiert + Formoterol (Stand
20202023: jedoch nicht zugelassen in Deutschland)
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- Nach GINA besteht unter alleiniger SABA-Therapie ein erhöhtes Risiko für Exazerbationen.
3331 - Deshalb sollte dies für Jugendliche und Erwachsene nicht mehr durchgeführt werden.
- Laut GINA soll die hierzulande nicht zugelassene bedarfsweise Inhalation eines ICS zusammen mit einem schnell-, aber dennoch langwirkenden LABA erfolgen (Budesonid plus Formoterol).
- Bei Notwendigkeit von Bedarfsmedikation, um Alltagsaktivitäten ohne Asthmasymptome zu bewältigen:
- antientzündliche Langzeittherapie mit ICS (Therapiestufe 2) empfohlen
Therapiestufe 2 bei Kindern und Jugendlichen
- Bedarfstherapie
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- z.
- z.
- Alternative in begründeten Fällen (Nebenwirkungen oder Kontraindikationen gegen SABA)
- Ipratropiumbromid als Zusatz oder Alternative zu SABA
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- Langzeittherapie
- bevorzugt niedrigdosiertes inhalatives Kortikosteroid (ICS)
- z.
- Gabe als Einmaldosis oder aufgeteilt auf 2 tägliche Dosen
- ggf. Verwendung von Inhalationshilfen (Spacer)
- z.
- Alternative in begründeten Fällen
- ab 12 Jahren: bedarfsorientierte Anwendung der Fixkombination aus ICS niedrigdosiert + Formoterol
- in diesem Fall keine weitere Bedarfstherapie mit SABA notwendig
- ab 12 Jahren: bedarfsorientierte Anwendung der Fixkombination aus ICS niedrigdosiert + Formoterol
- Leukotrienrezeptorantagonist Montelukast (LTRA) als Monotherapie
- bei Nebenwirkungen oder Kontraindikationen für ICS
- in Deutschland nur für Kinder zugelassen
- Bei Patient*innen über 15 Jahren nicht empfohlen, außer wenn sie nicht zur Inhalation von ICS in der Lage sind oder inakzeptable Nebenwirkungen auftreten.
- bevorzugt niedrigdosiertes inhalatives Kortikosteroid (ICS)
Therapiestufe 3 bei Kindern und Jugendlichen
- Bedarfstherapie
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- z.
- z.
- Alternative in begründeten Fällen (Nebenwirkungen oder Kontraindikationen gegen SABA)
- Ipratropiumbromid als Zusatz oder Alternative zu SABA
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- Langzeittherapie
- mitteldosiertes inhalatives Kortikosteroid (ICS)
- z.
- Beginn zunächst mit unterer mittelhoher Dosis
- z.
- mitteldosiertes inhalatives Kortikosteroid (ICS)
- Laut DGP alternative Bedarfstherapie in Stufe 3 bei Kindern und Jugendlichen >
- Fixkombination aus ICS/LABA als Langzeit- und Bedarfstherapie
- (Single Inhaler) Maintenance and Reliever Therapy (SMART)
3735- Weniger schwere Asthmaexazerbationen, aber eine relevante Verbesserung in Bezug auf Asthmasymptome, Lebensqualität und Lungenfunktion lässt sich nicht belegen.
- Das
Arzneitelegrammarznei-telegramm rät von SMART bei Patient*innen ab, die eine hochdosierte ICS-Erhaltungstherapie benötigen.
- Für Kinder sind die Kombinationen Budesonid/Formoterol und Fluticason/Salmeterol zugelassen.
Therapiestufe 4 bei Kindern und Jugendlichen
- Überweisung zur pädiatrischen Pneumologie
- Bedarfstherapie
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- z.
- z.
- Fixkombination aus ICS und LABA (Formoterol), wenn dies auch die Langzeittherapie darstellt.
- bei Jugendlichen ab 12 Jahren
- Alternative in begründeten Fällen (Nebenwirkungen oder Kontraindikationen gegen SABA)
- Ipratropiumbromid als Zusatz oder Alternative zu SABA
- inhalatives kurzwirksames Beta-2-Sympathomimetikum (SABA)
- Langzeittherapie
- Kombination aus ICS mitteldosiert und langwirkendem Beta-2-Sympathomimetikum (LABA)
- z.
- vorrangige Empfehlung der DGP
- z.
- Kombination aus ICS mitteldosiert und Leukotrienrezeptorantagonist (LTRA)
- Kombination aus ICS mitteldosiert und LABA und LTRA
- alternativ bei unzureichender Kontrolle unter Dreifach-Kombination:
- Kombination aus ICS mitteldosiert und LABA und LTRA und langwirkendem Anticholinergikum (LAMA)
- Risiko für unerwünschte Wirkungen geringer als bei Aufdosierung des ICS
- Kombination aus ICS mitteldosiert und langwirkendem Beta-2-Sympathomimetikum (LABA)
Die DGP nennt in dieser Stufe schon Kombinationen mit hochdosiertem ICS, die jedoch in der NVL erst in der (zusätzlichen) Therapiestufe 5 folgen.1Daneben verzichtet die DGP auf eine Empfehlung von LAMA als Teil der Langzeittherapie.
Therapiestufe 5 bei Kindern und Jugendlichen
Zusätzliche Stufe in der NVL zur Differenzierung zwischen Einsatz von mittel- und hochdosierten ICS- Vor/bei Übergang zu Therapiestufe 5
- Evaluation der Wirksamkeit der verschiedenen möglichen Therapieoptionen der Stufe 4
- aus Sicherheitsbedenken bezüglich höherer ICS-Dosierung
- Prüfung der Indikation zu einer stationären Rehabilitation
- kontrollierte Therapie (Adhärenz) und Verhaltensschulung
- Überweisung zur pädiatrischen Pneumologie und Vorstellung in einem kinderpneumologischen Zentrum zur erweiterten Diagnostik
- Evaluation der Wirksamkeit der verschiedenen möglichen Therapieoptionen der Stufe 4
- Bedarfstherapie
- Bedarfstherapie wie in Therapiestufe 4
- Möglichkeiten der Langzeittherapie (die ersten beiden Kombinationen werden auch von der DGP genannt, die letzten drei kursiv gedruckten nur von der NVL)
- Kombination aus ICS hochdosiert und langwirkendem Beta-2-Sympathomimetikum (LABA)
- z.
- vorrangige Empfehlung der DGP
- z.
Kombination aus ICS hochdosiert und Leukotrienrezeptorantagonist (LTRA)Kombination aus ICS hochdosiert und LABA und LTRA- Kombination aus ICS hochdosiert und LABA und LAMA
- Kombination aus ICS hochdosiert und Leukotrienrezeptorantagonist (LTRA)
- Kombination aus ICS hochdosiert und LABA und LTRA
- Kombination aus ICS hochdosiert und LABA und LTRA und LAMA
- Kombination aus ICS hochdosiert und langwirkendem Beta-2-Sympathomimetikum (LABA)
Therapiestufe 6 bei Kindern und Jugendlichen
- Vor/bei Übergang zu Therapiestufe 6
- Evaluation der Wirksamkeit der verschiedenen möglichen Therapieoptionen der Stufe 5
- Vorstellung in einem kinderpneumologischen Zentrum mit der Möglichkeit zur invasiven Diagnostik
- Ausschluss von Differenzialdiagnosen und Komorbiditäten mit höherer Bedeutung vor der Behandlung mit monoklonalen Antikörpern oder OCS
- Prüfung der Indikation zu einer stationären Rehabilitation
- Bedarfstherapie
- Bedarfstherapie wie in Therapiestufe 4
- Langzeittherapie
- zusätzlich Anti-IgE-Antikörper (Omalizumab für mindestens 4 Monate) bei Kindern ab 6 Jahren, wenn folgende Kriterien vorliegen:
- schweres IgE-vermitteltes allergisches Asthma – und –
- positiver Hauttest oder In-vitro-Reaktivität gegen ein ganzjährig auftretendes Aeroallergen – und –
- IgE-Serumkonzentration unter Berücksichtigung des Körpergewichts im therapierbaren Bereich – und –
- erfolgte Eliminierung vermeidbarer Allergenexpositionen
.
- alternativ Anti-IL-4-Rezeptor-Antikörper oder Anti-IL-5-Antikörper
- Die Indikationsstellung und Initiierung einer Behandlung mit monoklonalen Antikörpern soll bei Kindern und Jugendlichen durch in der Versorgung von schwerem Asthma erfahrene pädiatrische Pneumolog*innen erfolgen.
- Aus der Gruppe der Anti-IL-4-R-Antikörper ist ab
126 Jahren Dupilumab zugelassen. - Aus der Gruppe der Anti-IL-5-Antikörper ist Mepolizumab für die Behandlung des Asthmas ab 6 Jahren zugelassen.
- DGP und GINA nennen ab dem 12. Lebensjahr zusätzlich Anti-Thymus-Stroma-Lymphopoietin-Antikörper (Tezepelumab) als Option
- zusätzlich Anti-IgE-Antikörper (Omalizumab für mindestens 4 Monate) bei Kindern ab 6 Jahren, wenn folgende Kriterien vorliegen:
- Alternative in begründeten Fällen
- orale Kortikosteroide (OCS)
- letzte Therapieoption bei Kindern und Jugendlichen nach Ausschöpfung aller anderen Maßnahmen
- Langzeittherapie mit OCS mit Gefahr schwerer Nebenwirkungen: genaue Aufklärung und Verlaufsbeurteilung
- Gabe in niedrigster noch effektiver Dosis
- Einsatz bei unzureichender Asthmakontrolle trotz der Kombination der verschiedenen Therapieoptionen der vorherigen Stufe sowie zusätzlich monoklonaler Antikörper
- Osteoporose-Prophylaxe bei Dauerbehandlung
- orale Kortikosteroide (OCS)
Sicherheitsaspekte im Kindes- und Jugendalter
- Bei Langzeittherapie mit inhalativen Kortikosteroiden (ICS)
- Einstellung auf die niedrigste wirksame Dosierung
- regelmäßige Kontrolle der Körpergröße mit Erfassung in einer Wachstumskurve
- bei Verdacht auf Nebennierenrinden-Suppression: Diagnostik bzw. Behandlung
Therapieanpassung orientiert an der Asthmakontrolle
- Kontrolliertes Asthma
- Therapiereduktion erwägen (siehe Stufenschema).
- Vor einer möglichen Reduktion der Therapie mit ICS soll das Asthma für mindestens 3 Monate kontrolliert sein.
- Davon ausgenommen sind Patient*innen mit saisonalem Asthma. Hier orientiert sich die Therapie an der saisonalen Pollenexposition, sodass eine Reduktion bereits nach kürzeren Zeiträumen möglich wird.
- Da die Vermeidung einer Übertherapie im Kindesalter besonders relevant ist, kann ggf. versucht werden, die Therapie bereits nach 2 Monaten mit stabiler Asthmakontrolle zu reduzieren.
- bei Absetzen einer Therapie mit Kortikosteroiden oder monoklonalen Antikörpern engmaschige Überwachung empfohlen
- Teilweise kontrolliertes oder unkontrolliertes Asthma
- Überprüfung der Inhalationstechnik (Vorführung durch die Patient*innen) und Therapieadhärenz
- Überprüfung des Schulungsbedarfes
- Allergie- und Umweltkontrolle
- Beachtung von Komorbiditäten und aggravierenden Faktoren
- Überprüfung der Diagnose Asthma
- Teilweise kontrolliertes Asthma
- Therapieintensivierung erwägen (siehe Stufenschema).
- Unkontrolliertes Asthma
- Therapieintensivierung empfehlen (siehe Stufenschema).
- Beobachtung, Wiedervorstellung (nach Intensivierung innerhalb von 3 Monaten)
Spezifische (Allergen-)Immuntherapie (SIT) bei allergischem Asthma
BeiDie Indikation für eine SIT bei zumindest teilkontrolliertem, IgE-vermitteltem, allergischen Asthma soll als Therapieoption neben Allergenkarenz und Pharmakotherapie geprüft werden.- Drei Voraussetzungen (DGP)
- eindeutiger kausaler Zusammenhang zwischen respiratorischen Symptomen und entsprechender Allergenexposition
- Nachweis einer korrespondierenden allergenspezifischen Sensibilisierung
- Einsatz von Präparaten, deren Wirksamkeit bei Patient*innen mit
allergischemAsthmasolldurchdie Indikation zu einer spezifischen Immuntherapie (SIT) geprüft werden, wenn die allergische Komponente der asthmatischen Beschwerden gut dokumentiert ist (nachgewiesene spezifische Sensibilisierung und eindeutigekontrollierte klinischeSymptomatikStudiennachbelegtAllergenexposition)ist.
- Indikationsstellung und Auswahl der Antigene und der Applikationsform durch allergologisch qualifizierte Ärzt*innen
- Sondervotum der DEGAM: Die Indikationsstellung sowie die Auswahl der Antigene und der Applikationsform sollen von allergologisch erfahrenen Ärzt*innen vorgenommen werden.
- Kein Ersatz für antiasthmatische Therapie
- Indikationsstellung restriktiver als bei der allergischen Rhinokonjunktivitis
- Zwei Formen
- subkutane Immuntherapie (SCIT)
- sublinguale Immuntherapie (SLIT)
- Kontraindikation:
- Siehe Artikel Allergenspezifische Immuntherapie (SIT).
Inhalationstechnik und Wahl des Inhalationssystems
- Auswahl des Inhalationssystems2
- Anpassung an kognitive und motorische Fähigkeiten und Alter der Patient*innen
- in Absprache mit den Patient*innen (Präferenzen)
- nach Möglichkeit nur ein einheitliches Inhalationssystem (nur ein Typ Dosieraerosol oder Pulverinhalator)
- Wechsel des Inhalationssystems im Behandlungsverlauf vermeiden (Gefahr von Handhabungsfehlern).
- nach Wechsel Neueinweisung der Patient*innen in die Handhabung
- Schulung der Patient*innen im Gebrauch der Inhalationssysteme1-2
- alleiniger Hinweis auf Beipackzettel meist nicht ausreichend
- Demonstration der Funktionsweise und ggf. Anweisungen mit Bildern
- regelmäßige Überprüfung der Inhalationstechnik (insbesondere bei unzureichender Asthmakontrolle)
- Die Deutsche Atemwegsliga e.
- Auf der Seite der NVL gibt es Patientenblätter, u.
- Asthma – Unterschiede bei Inhalier-Geräten
- Asthma – Wechsel des Inhalier-Gerätes
.
- Allgemeinen Prinzipien der Anwendung von Inhalationssystemen
:2- vor der Inhalation
- tiefe Ausatmung (Ausnahme Vernebler)
- Dosieraerosole vor der Anwendung schütteln.
- während der Inhalation
- optimales Atemmanöver abhängig von der Art des Inhalationssystems
- Dosieraerosol und Vernebler: möglichst langsame und tiefe Inspiration
- Pulverinhalator: forcierte Inhalation mit möglichst hoher Atemstromstärke (für kleine Kinder oder bei Asthmaanfall nicht geeignet)
- nach der Inhalation
- endinspiratorische Atempause von mindestens 3, eher 5 sec
- Gerät absetzen (Exhalation in das Gerät vermeiden).
- vor der Inhalation
- Inhalierhilfen (z.
- Können ab dem 1. Lebensjahr verwendet werden.
- Erhöhen die Deposition des Medikaments in der Lunge.
- Können durch verminderte Deposition im Mundraum hilfreich sein, lokale Nebenwirkungen zu vermeiden.
3836
- Die am besten geeigneten Applikationssysteme für Kinder:2
- Kinder unter 5 Jahren
- bevorzugt Treibgasdosieraerosole mit Spacer
- möglichst frühzeitiger Ersatz einer Gesichtsmaske durch Mundstück (z.
- Kinder ab 5 Jahren
- Dosieraerosol mit Spacer und Mundstück
- Siehe Tabelle Asthma bei Kindern und Jugendlichen, prinzipiell geeignete Inhalationssysteme.
- Kinder unter 5 Jahren
Akutmedikation1-2,3937
- Einsatz bei akuten Beschwerden und im Asthmaanfall bei Kindern und Jugendlichen
- Kurzwirksame Beta-2-Sympathomimetika (SABA)
- z.
- wichtigste Behandlung bei akuten Asthmabeschwerden in allen Therapiestufen
- z.
- Kurzwirksame Anticholinergika
- Orale Kortikosteroide (OCS)
- z.
- Frühzeitige orale Kortikosteroide reduzieren die Wahrscheinlichkeit für eine Krankenhauseinweisung.
4240
- z.
- Sauerstoffgabe
- Sauerstoff wird im Asthmaanfall als Gabe mit niedriger Flussrate empfohlen.
- Ziel: Sauerstoffsättigung von >
- Ziel: Sauerstoffsättigung von >
- Sauerstoff wird im Asthmaanfall als Gabe mit niedriger Flussrate empfohlen.
- Magnesiumsulfat
- Theophyllin
- Verordnungen in den letzten Jahren rückläufig2
- Aus Sicht der NVL kein Stellenwert mehr in der Behandlung des Asthmas2
- geringe therapeutischen Breite, Nebenwirkungspotenzial und verfügbare Alternativen
- Gabe als Einzelfallentscheidung nur noch in lebensbedrohlicher Situation und bei fehlendem Ansprechen auf die Initialtherapie1
- Bestimmung der Serumspiegel nach erstmaliger Gabe
Langzeitbehandlung1-2,3937
- Inhalative Kortikosteroide (ICS)
- z.
- Inhalative Kortikosteroide (ICS) sind die effektivsten Präparate zur Dauermedikation, die zur Verfügung stehen.1,
4442-4543 - Siehe Vergleichstabelle der Dosierungen inhalativer Kortikosteroide (ICS) für Kinder und Jugendliche.
- nachgewiesene Effekte
- Eingrenzung der Schleimhautentzündung in den Atemwegen
- Reduktion der bronchialen Hyperreagibilität
- Verbesserung der Lungenfunktion
- seltenere Asthmasymptome, seltenere und leichtere Exazerbationen
- Reduktion der Bedarfsmedikation
4442 - Reduktion der Krankenhauseinweisungen und Todesfälle
- Nebenwirkungen: Es kann zu lokalen Nebenwirkungen (Mundsoor, Dysphonie) kommen.
- Empfehlung, dass die Patient*innen nach Applikation den Mund mit Wasser ausspülen.
- ggf. Verwendung eines Spacers zur Reduktion der Ablagerung im Mund- und Rachenraum
3836 - Die regelmäßige Verwendung kann bei Kindern zu einer Reduktion des Längenwachstums führen.
4644-4745 - regelmäßige Kontrolle der Körpergröße mit Erfassung in einer Wachstumskurve2
- z.
- Langwirkende Beta-2-Sympathomimetika (LABA)
- z.
- Einsatz in Kombination mit einem ICS, nicht als Monotherapie empfohlen1-2,
4846 - Vier Studien, die die Behandlung von ICS allein mit einer Kombinationstherapie aus ICS und LABA untersuchten, zeigten:
4947- weniger Exazerbationen unter Kombinationstherapie als mit ICS allein
- im Vergleich zu ICS-Monotherapie kein erhöhtes Risiko für schwerwiegende asthmabedingte Ereignisse unter Kombinationstherapie
.
- z.
- Leukotrienrezetorantagonisten (LTRA): Montelukast
- in Deutschland nur zur Behandlung von leichtem und mittelschwerem Asthma zugelassen1
- Montelukast kann als Monotherapie bei Kindern von 2–14 Jahren in Therapiestufe 2 eingesetzt werden.2
- Einsatz wird wegen neuropsychiatrischer Nebenwirkungen zunehmend kritisch gesehen.1
- Montelukast ist als Zusatztherapie einsetzbar, wenn die Behandlung mit ICS keine ausreichende Kontrolle bringt (d. h. in Therapiestufe 4 oder 5).2,
5048-5351 - Langwirksame Anticholinergika (LAMA): Tiotropium
- LAMA sollten nicht als Monotherapie eingesetzt werden, ggf. additiv in der Langzeittherapie.2
- Anti-IgE-Antikörper: Omalizumab
- Der monoklonale Antikörper bindet an im Körper zirkulierende Antikörper vom Typ IgE.
- Kann bei schwerem Asthma, das trotz optimaler Behandlung unkontrolliert ist, eingesetzt werden.
4442,5452 - In Deutschland zugelassen für Kinder ab 6 Jahren, Jugendliche und Erwachsene in Therapiestufe 62
- Sehr kostenintensive Behandlung, sollte von Spezialist*innen verschrieben werden.1-2
- Das arznei-telegramm rät von Omalizumab wegen negativer Nutzen-Schaden-Bilanz ab.53
- möglicherweise vermehrtes Auftreten von kardiovaskulären Ereignissen wie Herzinfarkten und Lungenembolien54
- Anti-IL-4-Rezeptor-Antikörper: Dupilumab55
- Einsatz ab 6 Jahren bei Personen mit Asthma-Typ-2-Entzündung
- Fertigspritze in einer Dosierung von 200 oder 300 mg für subkutane Injektion
- Bei der ersten Anwendung bei Jugendlichen und Erwachsenen werden mit zwei Spritzen, abhängig von den weiteren Asthma-Medikamenten, insgesamt 400 oder 600 mg des Wirkstoffs gespritzt.
- Danach wird die Therapie alle 2 Wochen mit einer Spritze (200–300 mg) fortgeführt.
- Patient*innen können sich nach ärztlicher Schulung auch selbst spritzen.
- Das arznei-telegramm bevorzugt bei der Notwendigkeit von Biologika das länger erprobte und günstigere Mepolizumab gegenüber Dupilumab.56
- Anti-IL-5-Antikörper: Mepolizumab
- Anti-IL-5-Antikörper als Zusatztherapie reduzieren die Anzahl der Exazerbationen bei Patient*innen mit schwerem, schlecht kontrolliertem eosinophilen Asthma um ca. 50 %.57
- Mepolizumab als Vertreter dieser Gruppe für Kinder ab 6 Jahren zugelassen
- Für das arznei-telegramm ist ein Nutzen von Mepolizumab bei schwerem refraktärem Asthma nur belegt, wenn eine Bluteosinophilenzahl von mindestens 150/µl vorliegt. Am stärksten profitieren Patient*innen mit Eosinophilenzahlen von 500/µl und höher.53
- Mepolizumab wird vom arznei-telegramm gegenüber Dupilumab und Tezepelumab wegen des höheren Erprobungsgrades, des nachgewiesenen Einsparpotenzials für orale Glukokortikoide sowie der niedrigeren Kosten bevorzugt.56,58
- Anti-Thymus-Stroma-Lymphopoietin-Antikörper: Tezepelumab59
- Einsatz ab 12 Jahren als Add-on-Erhaltungstherapie bei schwerem Asthma
- Die empfohlene Dosis beträgt 210 mg Tezepelumab als subkutane Injektion alle 4 Wochen.
- Das arznei-telegramm sieht für Tezepelumab keine Indikation und bevorzugt bei schwerem eosinophilem Asthma das länger erprobte Mepolizumab.58
- Spezifische Immuntherapie (SIT)
- Siehe auch Artikel Allergenspezifische Immuntherapie (SIT).
Frfrühzeitiger Einsatz bei Kindern mit kontrolliertem IgE-vermitteltem allergischem Asthma bronchiale mit eindeutigem Nachweis eines verantwortlichen Allergens1- zwei Formen
- subkutane Immuntherapie (SCIT)
- sublinguale Immuntherapie (SLIT)
- SIT reduziert die Symptome und den Medikamentenbedarf bei Kindern mit Allergie.
5560-5661 - Kann bei Kindern mit allergischer Rhinokonjunktivitis das Risiko für die Entstehung von Asthma senken.
5661-5762
Weitere Therapien
Nichtmedikamentöse Maßnahmen bei Asthma
- Die medikamentöse Therapie des Asthmas soll regelmäßig durch nichtmedikamentöse Therapiemaßnahmen ergänzt werden.1-2
- Ziel ist u.
- Ziel ist u.
- Die nichtmedikamentösen Maßnahmen bei Asthma umfassen:
- Patientenschulung und Informationsangebote
- Physiotherapie und Atemphysiotherapie
- körperliche Aktivität
- Vermeidung der Allergenexposition oder anderer Auslöser
- Gewichtsreduktion bei Adipositas
- ggf. Raucherentwöhnung
- ggf. Sozial- und Berufsberatung
- Unterstützung durch das familiäre und soziale Umfeld
.
Informationsangebote und Patientenschulung
- Allen Patient*innen mit Asthma und medikamentöser Langzeittherapie soll ein strukturiertes, verhaltensbezogenes Schulungsprogramm empfohlen und ermöglicht werden.1-2,
5863- Bei Kindern und Jugendlichen nach Möglichkeit die Eltern einbeziehen.
- Regelmäßige Nachschulungen anbieten.2
- Nachgewiesene Wirkungen2,
5863-5964
- Verbesserung der Asthmakontrolle mit weniger Asthmaanfällen
- Verbesserung der Lebensqualität
- Reduktion der Krankenhaus-, Arbeitsunfähigkeits- bzw. Schulfehltage
- aktive Teilnahme der Patient*innen (bei Kindern und Jugendlichen auch deren Familien) an der Krankheitsbewältigung
- Inhalte von Schulungsprogrammen
- Pathophysiologie und Auslöser der Erkrankung
- Behandlungsgrundsätze
- Inhalationstechniken
- Therapieadhärenz
- Fähigkeit zum Selbstmanagement
- individueller Asthma-Aktionsplan bzw. Selbstmanagementplan2
- z.
- selbstständige Behandlungsanpassung
- z.
- z.
Vermeidung der Auslöser
- Identifizierte Auslöser, z.
- keine potenziell anfallsauslösenden Medikamente (ASS, NSAR oder Betablocker)
- Allergenkarenz
- Anpassung der häuslichen Umgebung
- Feuchtes Innenraumklima und Schimmelbefall vermeiden.
- Maßnahmen zur Reduktion der Allergenexposition, z.
6065-6267
- Die NVL bewertet milbendichte Matratzenschoner als Maßnahme, die potenziell zur Allergenreduktion beitragen kann.2
Physiotherapie
- Atemphysiotherapie
- Mobilisation der Atemmuskulatur und Erlernen und Stärken von physiologische Atemmustern1
- Soll allen Patient*innen mit Koinzidenz von Asthma und dysfunktionaler Atmung (auch VCD) angeboten werden.2
- Soll Patient*innen mit Asthma und zusätzlichem Behandlungsbedarf oder durch Atemnot ausgelöste Angst empfohlen werden.2
- Ziel ist eine Kontrolle von Atemnot, Hustenreiz und Angst.
- Auch Atemtraining mit Relaxationstraining oder Biofeedbackmethoden können zu einer Verbesserung von Symptomen und Lebensqualität führen.
6368
Körperliche Aktivität
- Allen Patient*innen mit Asthma soll körperliches Training (z.
- Anstrengungsinduzierte Symptome sind oft Ausdruck einer unzureichenden Asthmakontrolle.
- ggf. Intensivierung der Langzeittherapie entsprechend der Stufentherapie
- Effekte von regelmäßiger sportlicher Aktivität sind:
6469- Verringerung der Asthmasymptomatik
- Besserung der Belastbarkeit
- Verbesserung der Lebensqualität
- Verringerung der Morbidität
- Vermeidung einer Stigmatisierung
.
- Bei Asthma und Adipositas ist eine Gewichtsreduktion empfohlen.2
- Maßnahmen der Gewichtsreduktion erfordern eine nachhaltige Gestaltung inklusive körperlicher Betätigung.
Rehabilitation
- Kann bei teilweise kontrolliertem oder unkontrolliertem Asthma sinnvoll sein, um eine normale Teilhabe am alltäglichen Leben zu ermöglichen.
- Insbesondere nach stationär behandelten Asthmaanfällen sollten rehabilitative Maßnahmen in Betracht gezogen werden.
- Multimodaler Ansatz umfasst u.
- personalisierte Diagnostik
- Prüfung der Auslöser und Allergenexposition
- Optimierung der Behandlung
- Patientenschulung
- Physiotherapie und Trainingstherapie
- psychologische Beratung und Psychotherapie
- Raucherentwöhnung
- Ernährungsberatung
- Berufsberatung
.
Asthma und Begleiterkrankungen
- Rhinitis
- Asthma ist mit chronisch-entzündlichen Erkrankungen der oberen Atemwege assoziiert.
- Einige Autor*innen betrachten entzündliche Erkrankungen gleicher Pathogenese in den oberen und unteren Atemwegen als einheitliches Krankheitsbild (Hypothese der „United Airways“).
- Chronisch-entzündliche Erkrankungen der oberen Atemwege sollten zuverlässig diagnostiziert und behandelt werden, um der Entstehung oder Verschlechterung des Asthma bronchiale vorzubeugen.1
- Reflux
- Ein gastroösophagealer Reflux tritt bei Patient*innen mit Asthma deutlich häufiger auf als in der Normalbevölkerung.1
- Eine symptomatische Refluxerkrankung sollte behandelt werden.
- Die säurehemmende Behandlung führt bei asthmatischen Kindern mit oder ohne Refluxsymptomen jedoch nicht zu einer Verbesserung des Verlaufs der Asthmaerkrankung.
6570-6671
- Psychische Erkrankungen
- Vor allem Angsterkrankungen und Depressionen treten häufig begleitend mit Asthma auf.
- Diese sind unterdiagnostiziert und können Behandlung und Selbstmanagement erschweren.
- Bei Kindern und Jugendlichen kann durch psychische Komorbiditäten die körperliche, seelische und schulische Entwicklung beeinträchtigt sein.1
- Psychosoziale und psychotherapeutische Behandlungen sind häufig Bestandteil einer pneumologischen Rehabilitation.
6772
Komplementäre Therapie
- Patient*innen und deren Eltern sollen gefragt werden, ob sie für die Behandlung des Asthmas alternative oder komplementäre Verfahren anwenden und ggf. über damit einhergehende Risiken aufgeklärt werden.2
- Für die folgenden Maßnahmen kann aufgrund einer unzureichenden Datenlage keine gesicherte Aussage oder wegen unzureichender bzw. fehlender Wirksamkeit in den unterschiedlichen Studien keine Empfehlung ausgesprochen werden.1-2
- Akupunktur
- Homöopathie
- Chiropraxis
- Ernährungsmaßnahmen (Fischöl, Salzrestriktion, Vitamin-C-Gabe, Mineralstoffsupplementation bzw. -restriktion)
- Hypnose oder Relaxationstechniken
- Ionisierer der Raumluft (Air Ionisers)
- Luftfeuchtigkeitskontrolle
- Speläotherapie
- traditionelle chinesische Medizin (TCM)
- Phytotherapeutika
- bronchiale Thermoplastie
.
- Bei Patient*innen mit unkontrolliertem Asthma und häufigen Exazerbationen sollte der Vitamin-D-Spiegel bestimmt und wenn notwendig Vitamin D substituiert werden.2
- Bei bestimmten Patient*innen mit niedrigen Vitamin-D-Spiegeln und häufigen Asthmaanfällen, die mit systemischen Kortikosteroiden behandelt werden mussten, könnte ein präventiver Effekt für weitere Asthmaanfälle vorliegen.
- Zudem bestehen keine Hinweise für schwere unerwünschte Wirkungen.
Empfehlungen für Patient*innen
- Schulung zum Selbstmanagement1-2
- Korrekte Inhalationstechniken erlernen.
- Warnzeichen eines Asthmaanfalls erkennen.
- Führt zu reduzierter Morbidität und geringerem Bedarf an medizinischer Versorgung.
5863
- Körperliche Aktivität
- Im akuten Asthmaanfall
- Das Kind sollte im Asthmaanfall nicht unbeaufsichtigt sein.
- Für eine ruhige Umgebung sorgen, in der das Kind eine bequeme Position einnehmen kann.
- Bei leichtem Anfall und guter Kenntnis der Erkrankung kann die Behandlung selbstständig durchgeführt werden.
Berufswahl bei Jugendlichen mit Asthma
- Die Angaben basieren auf der DGP-Leitlinie.1
- Um Jugendlichen ausreichend Zeit zu gewähren, sich mit einer passenden Berufswahl auseinander zu setzen, sollte der Beratungsprozess nicht erst dann beginnen, wenn die Schulzeit zu Ende ist. Vielmehr sollten schon vor Verfestigung eines Berufswunsches erste Hinweise im Rahmen der kinderärztlichen Betreuung erfolgen.
- Generell gilt: das alleinige Vorliegen einer allergischen Sensibilisierung gegenüber gängigen Aeroallergenen sowie eine unspezifische bronchiale Hyperreagibilität gehen zwar mit einer erhöhten Wahrscheinlichkeit für das Neuauftreten von Asthma einher, reichen aber nicht als alleiniges Entscheidungskriterium.
- Sofern möglich sollte eine Arbeitsplatzerprobung je nach Angebot als Praktikum, Grundbildungslehrgang, Förderungslehrgang, Berufsvorbereitungsjahr oder Berufsgrundbildungsjahr wahrgenommen werden.
- Lediglich Jugendlichen mit einem schweren Asthma sollte von einem Beruf mit Risikoprofil für Asthma grundsätzlich abgeraten werden.
- Berufe mit einem hohen Risikoprofil umfassen u. a.:
- mehlverarbeitende Berufe, Gärtnerei, Floristik, Schreinerei, Tiermedizin, Kosmetik, Zahntechnik, Lackiererei, Abfallwirtschaft
Prävention
Allgemeines
- Siehe auch den Artikel Allergieprävention.
DieEmpfehlungenDGP-aus der Leitlinietrifft folgende Aussagen zur PrAllergiepräventionbei Asthma:128
Das vulnerable Fenster (Window of Opportunity) fFürdiedenEntwicklung eines Asthmas liegt in utero und im sehr frühen Kindesalter.Daher sollten primäre präventive Interventionsmaßnahmen ebenfalls früh, möglicherweise schon währendZeitraum derSchwangerschaft begonnen werden, um eine Chance auf Erfolg zu haben.Im Wesentlichen erstrecken sich diese Maßnahmen auf die Reduktion von Passivrauchexposition und auf die Stärkung natürlicher Schutzfaktoren, die als Folge der modernen Zivilisation zugunsten von Risikofaktoren abgenommen haben.
EmpfehlungenNeugeborene solltenersten 4–6 Monate soll nach Möglichkeit ausschließlich gestillt werden.NachAbhängigdemvonvollendetender4.BereitschaftLebensmonatdessollSäuglings sollte mit der Fütterung von Beikosteingeffrührthestens ab Beginn des 5. und spätestens ab Beginn des 7. Lebensmonats begonnen werden; es soll keine Verzögerung der Beikosteinführung erfolgen.KinderÜbergewicht/Adipositas beimitFrauenAllergierisiko sollten keine Fell-vor undFedertiereinanschaffenderbzw.Schwangerschafthalten. Katzenhaltung istsowie beidiesenKinderngenerell nicht zu empfehlen.Hohe Luftfeuchtigkeitundmangelnde Ventilation in Räumen, flüchtige organische Verbindungen (z. B. Formaldehyd), aktive und passive Tabakrauchexposition, sowie KfZ-AbgasexpositionJugendlichen sollen aus Gründen der Asthmaprävention vermieden werden.AuchEinige Studien zeigen, dass ein niedriger Versorgungsgrad mit langkettigen Omega-3-Fettsäuren bei Schwangeren, Stillenden und Säuglingeuglingen mit einem höheren Risiko für allergische Erkrankungen beim Kind, insbesondere Asthma undKinderWheezing (Giemen), einhergeht und dass dieses Risiko durch Supplementierung von langkettigen Omega-3-Fettsäuren gesenkt werden kann.- Cave: Aufgrund der Heterogenität der Studienlage nur Statement der Leitliniengruppe und keine Empfehlung!
- Personen ohne erkennbares erhöhtes Allergierisiko sollen die Haustierhaltung mit Katzen oder Hunden nicht einschränken.
- Familien mit erhöhtem
AsthmarisikoAllergierisiko oder mit Kindern mit bereits bestehendem atopischem Ekzem sollten eine Katze nicht neu anschaffen.
- Familien mit erhöhtem
- Alle Kinder sollen nach den
allgemeinenderzeitigen Empfehlungen geimpft werden. - Es soll bei der Beratung zum Geburtsmodus berücksichtigt werden, dass Kinder, die durch einen elektiven Kaiserschnitt geboren wurden, ein gering erhöhtes Asthmarisiko haben.
- Beim Einsatz von
ÜbergewichtAntibiotika im Kleinkindesalter sollte berücksichtigt werden, dass die Antibiotikaeinnahme des Kindes in den ersten beiden Lebensjahren mit einer mittleren Erhöhung des Risikos für allergisches Asthma und schwachen Erhöhung des Risikos fürAdipositasHeuschnupfen undsindEkzem im späteren Leben einhergeht. Beim Einsatz von Antibiotika in der Schwangerschaft sollte berücksichtigt werden, dass eine Antibiotikaeinnahme der Mutter in der Schwangerschaft mitAsthmaeinerpositivmittlerenassoziiertErhöhung des Risikos für das Kind für das Auftreten eines Asthmas im späteren Leben einhergeht.- Cave: nur Statement, keine Empfehlung!
- Aktive und
solltenpassivebeiExpositionKinderngegenüber Tabakrauch soll vermieden werden. Dies gilt bereits während der Schwangerschaft. - Ein Innenraumklima, das Schimmelpilzwachstum begünstigt (hohe Luftfeuchtigkeit, mangelnde Ventilation), sollte vermieden werden.
- Die Exposition gegenüber kraftfahrzeugbedingten Emissionen und Innenraumluftschadstoffen sollte gering gehalten werden.
Stellungnahmen/Statements,Telemedizinjedoch keine Empfehlungen2
EsLautgibtNVLkeinenkönntenAnhalttelemedizinischedafür,Maßnahmendassin derEinsatzVersorgungpartiellvonoder extensiv hydrolisierter Säuglingsnahrungen der Asthmaprävention dient.Es sind keine diätetischen Restriktionen im Hinblick auf die Ernährung der Mutter während der Schwangerschaft und Stillzeit erforderlich.Kinder ohne Allergierisiko müssen nicht auf Haustiere verzichten.Eine Hausstaubmilbensanierung ist zur Primärprävention nicht zu empfehlen, zur Sekundär- und Tertiärprävention jedoch ratsam.Eine höhere Anzahl älterer Geschwister, der Besuch einer Kindertagesstätte, das Aufwachsen auf einem Bauernhof mit Tieren sowie Wurminfektionen sind negativPatient*innen mit Asthmaassoziiertan Bedeutung gewinnen.- bisher unzureichende Evidenz für eine Empfehlung telemedizinischer Verfahren
- Beispiele sind SMS-Erinnerungssysteme, Smartphone- und Tablet-Apps oder Gaming-basierte Interventionen bei Jugendlichen.
Spezifische Immuntherapie
AktiveKeinTabakrauchvermeidungErsatzundfürstrikteseineMeidenAsthmatherapie,vonkannEnvironmentaljedochTobacco Smoke (ETS) ist die wichtigste Präventionsmaßnahmefrühzeitig in derSchwangerschaftBehandlung des allergischen Asthmas eingesetzt werden.- Allergenspezifische Immuntherapie (SIT, Hyposensibilisierung) reduziert die Asthmasymptome, den Medikamentenbedarf und die allergenspezifische bronchiale Hyperreagibilität.74
- Daher empfiehlt die Leitlinie zur Allergieprävention:28
- Bei Patient*innen mit bestehender allergischer Rhinitis/Rhinokonjunktivitis sollte eine allergenspezifische Immuntherapie zur Prävention von noch nicht bestehendem Asthma empfohlen werden.
- Hinweise für präventive Wirkung
- Bei Patient*innen mit allergischer Rhinitis konnte die Entstehung von Asthmasymptomen (Etagenwechsel) durch eine subkutane Immuntherapie bis zu 7 Jahre nach Beendigung der 3-jährigen Therapie reduziert werden. 75
Impfungen
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Asthma erhöht, wie andere chronische Erkrankungen, das Risiko, an Grippe und Pneumokokken-Infektionen zu erkranken.
- Patient*innen mit Asthma sollen daher Impfungen gemäß den Empfehlungen der STIKO angeboten werden.
Verlauf, Komplikationen und Prognose
Verlauf
- Die Atemwegsentzündung verursacht wiederkehrende Episoden mit Atemnot, Engegefühl in der Brust und Husten.
- Verlauf der Erkrankung kann sehr fluktuieren, v.
- Die Anzahl an Krankenhauseinweisungen aufgrund von Asthmaanfällen ist heutzutage deutlich rückläufig (Effekt der ICS-Langzeittherapie).
6976
- Verlauf der Erkrankung kann sehr fluktuieren, v.
- Kindern mit viralen Atemwegsinfektionen als Auslöser der Asthmasymptome geht es im Sommer aufgrund der selteneren Infekte meist besser.
Komplikationen
- Schwerer und lebensbedrohlicher Asthmaanfall
- Die Mortalität bei Kindern zwischen 0 und 14 Jahren ist im Laufe der Zeit gesunken und in Europa sehr niedrig.
- In Deutschland wurden im Jahr 2018 insgesamt 577 Kinder und Jugendliche < 15 Jahre mit einem Status asthmaticus behandelt, von denen alle überlebten.
6976
- Übergang in eine Mischform mit chronisch obstruktiver Lungenkrankheit (Asthma-COPD-Overlap-Syndrom, ACOS)
- Sicherheitsaspekte einer ICS-Dauertherapie im Kindes- und Jugendalter
- Einstellung auf die niedrigste wirksame Dosierung
- sekundäre Nebennierenrindeninsuffizienz
7077
bei Verdacht auf Nebennierenrinden-Suppression: Diagnostik bzw. Behandlung- insbesondere bei Patient*innen mit hochdosierten inhalativen Kortikosteroiden (v.
- Warnzeichen sind Gewichtsabnahme, Müdigkeit, Übelkeit und Erbrechen.
- Entwicklungs- und Wachstumsverzögerung bei Kindern unter Kortikosteroidtherapie
- regelmäßige Kontrolle der Körpergröße mit Erfassung in einer Wachstumskurve2
- Erhöhtes Risiko, an Influenza und Pneumokokken-Infektionen zu erkranken.2
Prognose
- Bei einem großen Anteil von Kindern und Jugendlichen mit Asthma verschwinden die Beschwerden im Laufe des Lebens.
- Während der Pubertät kommt es insbesondere bei Jungen zu einer Verbesserung der Symptome.4
- Bei älteren Kindern gibt es eine Tendenz zu abnehmenden Beschwerden mit zunehmendem Alter, jedoch treten oft noch Symptome im Erwachsenenalter auf.
7178
-
- Prädiktoren für anhaltendes Asthma sind Atopie, reduzierte Lungenfunktion und bronchiale Hyperreagibilität.
- Alter bei Krankheitsbeginn
- Die Prognose scheint mit dem Alter bei Krankheitsbeginn assoziiert zu sein. Insbesondere bei spätem Beginn im Erwachsenenalter ist das Risiko für Lungenfunktionseinschränkungen und Exazerbationen erhöht.
7279
- Die Prognose scheint mit dem Alter bei Krankheitsbeginn assoziiert zu sein. Insbesondere bei spätem Beginn im Erwachsenenalter ist das Risiko für Lungenfunktionseinschränkungen und Exazerbationen erhöht.
- Kinder mit nur leicht ausgeprägtem Asthma haben eine gute Prognose.
7380 - Bei schwerem Asthma besteht häufig ein erhöhtes Risiko für die Entwicklung einer chronisch obstruktiven Lungenerkrankungen, insbesondere wenn die Patient*innen rauchen.
- Die Auswirkungen auf das soziale und berufliche Leben (z.
7178
Verlaufskontrolle
- Kontinuierliche Verlaufskontrolle und -beurteilung
- Langfristige Asthmakontrolle sichern und niedrigste effektive Therapiestufe wählen.
- Für die Anpassung der Stufentherapie siehe Leitlinienkasten Abschnitt Therapieanpassung.
- Eine Verlaufskontrolle ist auch bei kontrolliertem Asthma sinnvoll, da die Erkrankung fluktuieren kann.
- Langfristige Asthmakontrolle sichern und niedrigste effektive Therapiestufe wählen.
- Kontrolle des Wachstums bei Kindern und Jugendlichen anhand des Perzentilenschemas während einer ICS-Dauertherapie
- Impfungen anhand STIKO-Empfehlungen
- Bei jeder Verlaufskontrolle sollen folgende Parameter erhoben werden:2
- Asthmasymptome tagsüber, nachts und bei körperlicher Belastung
- Häufigkeit des Einsatzes von Bedarfsmedikation
- Einschränkungen der Aktivitäten des Alltags
- Therapieadhärenz und Inhalationstechnik
- Häufigkeit des Auftretens und Auslöser von Exazerbationen
- Wirksamkeit und Verträglichkeit der medikamentösen Therapie
.
Versorgungskoordination
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Die NVL empfiehlt Langzeitbetreuung und Dokumentation im Rahmen eines strukturierten Behandlungsprogramms.
- in der Regel durch Hausärzt*innen oder Kinder- und Jugendärzt*innen
- in besonderen Fällen (dauerhaft hohe Instabilität oder schwerer Krankheitsverlauf) durch (pädiatrische) Pneumolog*innen
- bei Stabilisierung des Zustands ggf. Weiterbehandlung durch die Hausärzt*innen oder Kinder- und Jugendärzt*innen
- Für Indikationen zur Überweisung bzw. Einweisung in ein Krankenhaus siehe Abschnitt Indikationen zur Überweisung/Krankenhauseinweisung.
- Ziel einer Überweisung ist nicht primär die Übergabe der Langzeitbehandlung, sondern Beurteilung und ggf. Anpassung der Behandlung.2
- Nach einem Krankenhausaufenthalt: Indikation für eine sich direkt anschließende Rehabilitationsmaßnahme bei Kindern und Jugendlichen prüfen.
empfohleneEmpfohlene Konsultationshäufigkeit- Die NVL verzichtet auf eine Festlegung genauer Frequenzen für durchzuführende Untersuchungen: Krankheitsverlauf und Einschätzung der Notwendigkeit durch die behandelnden Ärzt*innen entscheidend.2
- Nach einem Asthmaanfall sollte eine zeitnahe Wiedervorstellung mit folgenden Maßnahmen erfolgen.2
- Risikofaktoren für Verschlechterung der Asthmakontrolle identifizieren.
- Asthmaaktionsplan aushändigen bzw. überarbeiten.
- Schulung bzw. Nachschulung anregen.
- Notwendigkeit einer Intensivierung der Langzeittherapie prüfen.
- Indikation zu einer Rehabilitation prüfen.
- Laut GINA ist die Lungenfunktionsdiagnostik der wichtigste Parameter für das Langzeitrisiko. Diese sollte bei Diagnosestellung, 3–6 Monate nach Therapiebeginn und danach in regelmäßigen Abständen, mindestens jährlich, wiederholt werden.
3331
Mögliche Fragen in der Verlaufskontrolle
- Siehe Tabelle Asthma bei Kindern und Jugendlichen – Kontrollfragen.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Selbstmanagement, auch bei akuten Beschwerden
- individueller Asthma-Aktionsplan bzw. Selbstmanagementplan2
- ggf. Tagebucheintragungen und in begründeten Fällen PEF-Messungen
- Eine Schulung und Informationsangebote für die Patient*innen und ihre Angehörigen empfehlen.
- Anleitungen zur korrekten Inhalationstechnik geben.
- Siehe auch die Deutsche Atemwegsliga – Richtig inhalieren.
- Möglichkeit der Unterstützung durch eine Patientenselbsthilfeorganisation
Informationsmaterial
- Nationale VersorgungsLeitlinie (NVL) Asthma: Patientenblätter
- Langzeitbehandlung mit Kortisonspray bei Asthma
- Unterschiedliche Inhaliergeräte bei Asthma
- Wechsel des Inhaliergerätes bei Asthma
- Asthma: Warum es hilft, aufs Rauchen zu verzichten.
- allergisches Asthma und Tierallergie
- Deutsche Atemwegsliga e. V.: Informationsmaterial Asthma
- Deutsche Atemwegsliga e. V.: Suche nach Spezialist*innen
- Alpha-1-Zentren
- Lungenfachkliniken
- Physiotherapeut*innen mit Spezialisierung Atemphysiotherapie
- Patientenschulungen
Patienteninformationen in Deximed
Asthma
AsthmaWie wird Asthma diagnostiziert?Wie kann ein Asthmaanfall vermieden werden?Erste Hilfe bei AsthmaAsthmaanfall bei ErwachsenenAnstrengungsasthmaAsthma, Ursachen und auslösende FaktorenAsthma und AllergieAsthma und RauchenWarum sollten Sie das Rauchen aufgeben, und wie gelingt es?Asthma und SchwangerschaftBerufsbedingtes AsthmaAsthma bei Sportler*innen
Asthma bei Kindern und Jugendlichen
- Asthma bei Kindern
AsthmabehandlungAsthmaanfall bei Kindern- Gesundheitsinformation.de: Asthma – Informationen für Eltern
Patientenorganisationen
- Deutsche Patientenliga Atemwegserkrankungen e. V.
- Deutscher Allergie und Asthmabund e. V.
- Arbeitsgemeinschaft Lungensport in Deutschland e. V.: Fit zum Atmen
Illustrationen
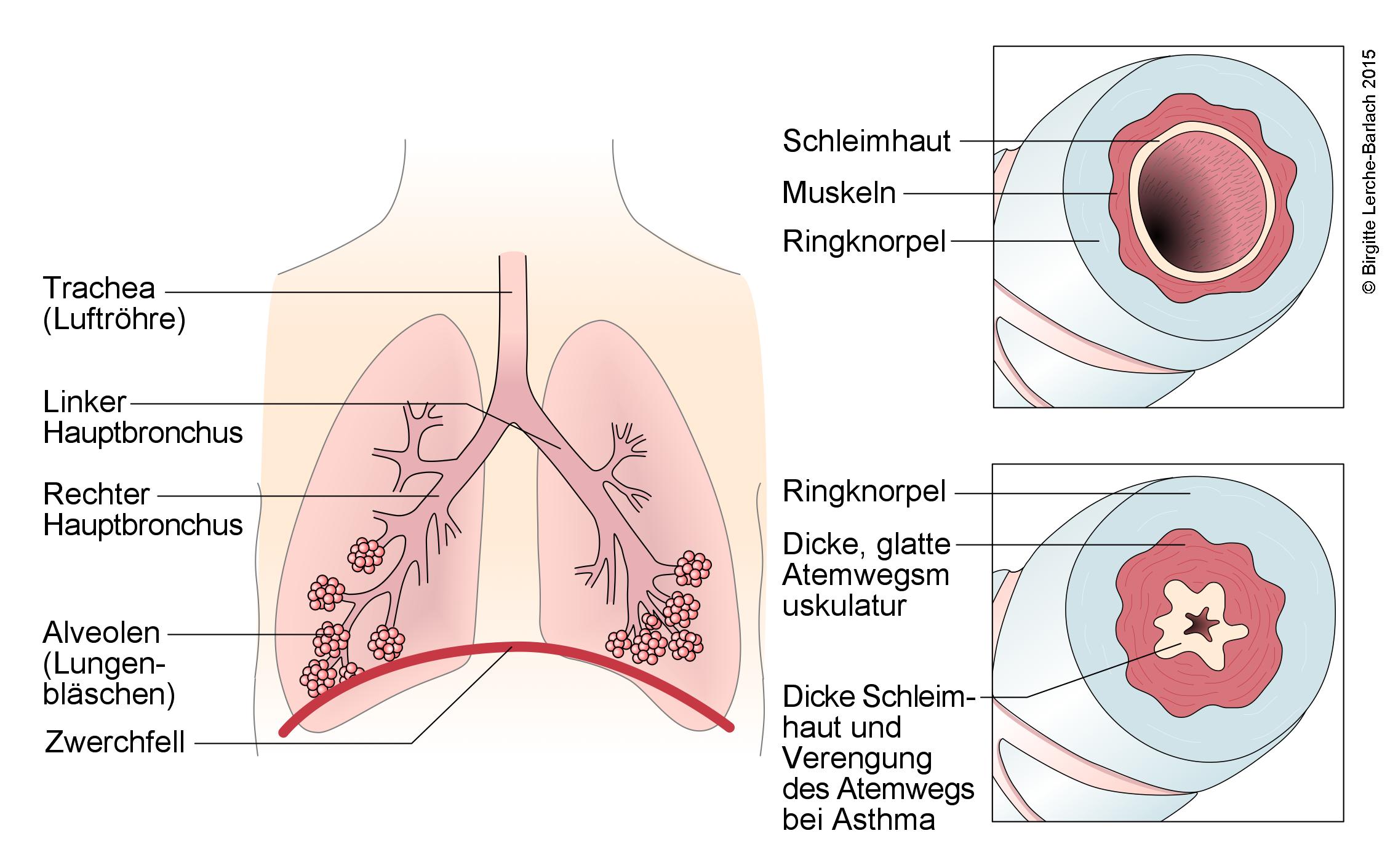
Atemwege und Veränderungen bei Asthma bronchiale
Quellen
Leitlinien
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Fachärztliche Diagnostik und Therapie von Asthma. S2k, AWMF-Leitlinie Nr. 020-009. Stand 2023. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Klimabewusste Verordnung von inhalativen Arzneimitteln. S1, AWMF-Nr. 053-059. Stand 2022. www.degam.de
- Global Initiative for Asthma. Pocket Guide for Asthma Management and Prevention. Stand 2022. www.ginasthma.com
- Deutsche Gesellschaft für Allergologie und klinische Immunologie. Allergieprävention. AWMF-Leitlinie Nr. 061-016. S3, Stand 2021. www.awmf.org
- Ärztliches Zentrum für Qualität in der Medizin (ÄZQ). Nationale Versorgungsleitline Asthma. 4. Auflage, Stand 2020. www.leitlinien.de
Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Diagnostik und Therapie von Patienten mit Asthma. AWMF-Leitlinie Nr. 020-009. S2k, Stand 2017.www.awmf.orgGlobal Initiative for Asthma. Pocket Guide for Asthma Management and Prevention. Stand 2020.www.ginasthma.comDeutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Spirometrie. AWMF-Leitlinie Nr. 020-017. S2k, Stand 2015.www.awmf.org
Literatur
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Fachärztliche Diagnostik und Therapie von
Patienten mitAsthma. S2k, AWMF-Leitlinie Nr. 020-009, Stand20172023. www.awmf.org - Ärztliches Zentrum für Qualität in der Medizin (ÄZQ). Nationale Versorgungsleitline Asthma. 4. Auflage, Stand 2020. www.leitlinien.de
- Schmitz R, et al. Verbreitung häufiger Allergien bei Kindern und Jugendlichen in Deutschland. Ergebnisse der KiGGS Studie – Erste Folgebefragung (KiGGS Welle 1) Bundesgesundheitsbl 2014 · 57:771–778 edoc.rki.de
- Gibson GJ, Loddenkemper R, Sibille Y, et al. (Hrsg) (2013). The European lung white book. Respiratory health and disease in Europe. European Respiratory Society, Sheffield. www.ncbi.nlm.nih.gov
- GBD 2015 Chronic Respiratory Disease Collaborators. Global, regional, and national deaths, prevalence, disability-adjusted life years, and years lived with disability for chronic obstructive pulmonary disease and asthma, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet Respir Med. 2017 Sep;5(9):691-706. pubmed.ncbi.nlm.nih.gov
- Moorman JE, Akinbami LJ, Bailey CM, Zahran HS, King ME, Johnson CA, Liu X. National surveillance of asthma: United States, 2001-2010. Vital Health Stat 3. 2012 Nov;(35):1-58. PubMed PMID: 24252609 www.ncbi.nlm.nih.gov
- Ramsey CD, Celedón JC. The hygiene hypothesis and asthma. Curr Opin Pulm Med. 2005 Jan;11(1):14-20. Review. PubMed PMID: 15591883 www.ncbi.nlm.nih.gov
- Dietert RR. Maternal and childhood asthma: risk factors, interactions, and ramifications. Reprod Toxicol. 2011 Sep;32(2):198-204. doi: 10.1016/j.reprotox.2011.04.007 Epub 2011 May 6. Review. PubMed PMID: 21575714 www.ncbi.nlm.nih.gov
- Halapi, E; Bjornsdottir, US (January 2009). "Overview on the current status of asthma genetics". The clinical respiratory journal. 3 (1): 2–7. doi:10.1111/j.1752-699X.2008.00119.x PMID 20298365. www.ncbi.nlm.nih.gov
- Riedler J, Braun-Fahrländer C, Eder W, Schreuer M, et al. Exposure to farming in early life and development of asthma and allergy: a cross-sectional survey . Lancet 2001; 358: 1129-33. PubMed
- Kelly FJ, Fussell JC. Air pollution and airway disease. Clin Exp Allergy. 2011 Aug;41(8):1059-71. doi: 10.1111/j.1365 2222.2011.03776.x Epub 2011 May 30. Review. PubMed PMID: 21623970 www.ncbi.nlm.nih.gov
- Sears MR. Trends in the prevalence of asthma. Chest. 2014 Feb;145(2):219-225. doi: 10.1378/chest.13-2059 PubMed PMID: 24493506 www.ncbi.nlm.nih.gov
- Ahluwalia SK, Matsui EC. The indoor environment and its effects on childhood asthma. Curr Opin Allergy Clin Immunol. 2011 Apr;11(2):137-43. doi: 10.1097/ACI.0b013e3283445921 Review. PubMed PMID: 21301330 www.ncbi.nlm.nih.gov
- Mackay D, Haw S, Ayres JG, et al. Smoke-free legislation and hospitalizations for childhood asthma. N Engl J Med 2010; 363: 1139-45. New England Journal of Medicine
- Mutius E, Vercelli D. Farm living: effects on childhood asthma and allergy. Nat Rev Immunol. 2010 Dec;10(12):861-8. doi: 10.1038/nri2871. Epub 2010 Nov 9. Review. PubMed PMID: 21060319 www.ncbi.nlm.nih.gov
Deutsche Gesellschaft für Allergologie und klinische Immunologie. Allergieprävention. AWMF-Leitlinie Nr. 061-016, Stand 2014.www.awmf.org- Lau S, Illi S, Sommerfeld C, Niggeman B, et al
.. Early exposure to house dust mite and cat allergens and development of childhood asthma: a cohort study. Lancet 2000; 356: 1392-7.PubMed Platts-Mills T, Vaughan J, Squillace S, Woodfolk J, Sporik J. Sensitisation, asthma, and a modified Th2 response in children exposed to cat allergen: a population-based cross-sectional study. Lancet 2001; 357: 752-6PubMed- Illi S, von Mutius E, Lau S, Bergmann R, Niggemann B, Sommerfeld C, Wahn U. Early childhood infectious diseases and the development of asthma up to school age: a birth cohort study. BMJ 2001; 322: 390-5. PubMed
- Johnston SL, Pattemore PK, Sanderson G, Smith S, Lampe F, Josephs L, Symington P, O'Toole S, Myint SH, Tyrrell DA, et al. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. BMJ. 1995 May 13;310(6989):1225-9. PubMed PMID: 7767192 www.ncbi.nlm.nih.gov
- Beuther DA. Obesity and asthma. Clin Chest Med. 2009 Sep;30(3):479-88, viii. doi: 10.1016/j.ccm.2009.05.002Review. PubMed PMID:19700046 www.ncbi.nlm.nih.gov
- van der Hulst AE, Klip H, Brand PL. Risk of developing asthma in young children with atopic eczema: A systematic review. J Allergy Clin Immunol 2007; 120: 565-9. PubMed
- Bergmann RL, Edenharter G, Bergmann KE, Forster J, Bauer CP, Wahn V, et al. Atopic dermatitis in early infancy predicts allergic airway disease at 5 years. Clin Exp Allergy 1998; 28: 965-70. PubMed
- Russell G, Ninan TK. Respiratory symptoms and atopy in Aberdeen school children: evidence from two surveys 25 years apart. BMJ 1992; 304: 873-5. PubMed
- Goksör E, Loid P, Alm B, et al.
.The allergic march comprises the coexistence of related patterns of allergic disease not just the progressive development of one disease. Acta Paediatr 2016 Dec; 105(12): 1472-1479. pmid:27381249 PubMed - Etminan M, Sadatsafavi M, Jafari S, et al. Acetaminophen use and the risk of asthma in children and adults: a sytematic review and metaanalysis. Chest 2009; 136: 1316-23. PubMed
- Lowe AJ, Carlin JB, Bennett CM, et al. Paracetamol use in early life and asthma: prospective birth cohort study. BMJ 2010; 341: c4616. BMJ (DOI)
- Warner JO, ETAC Study Group. Early treatment of the atopic child. A double-blinded, randomized, placebo-controlled trial of cetirizine in preventing the onset of asthma in children with atopic dermatitis: 18 months' treatment and 18 months' posttreatment follow-up. J Allergy Clin Immunol 2001; 108: 929-37. PubMed
- Örtqvist AK, Lundholm C, Kieler H, et al. Antibiotics in fetal and early life and subsequent childhood asthma: nationwide population based study with sibling analysis. BMJ 2014; 349: g6979. dx.doi.org
- Deutsche Gesellschaft für Allergologie und klinische Immunologie. Allergieprävention. AWMF-Leitlinie Nr. 061-016, Stand 2021. register.awmf.org
- Hershenson MB. Rhinovirus-Induced Exacerbations of Asthma and COPD. Scientifica (Cairo). 2013;2013:405876. doi: 10.1155/2013/405876 Epub 2013 Feb 21. Review. PubMed PMID: 24278777 PMID:24278777 www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Spirometrie. AWMF-Leitlinie Nr. 020 – 017. Stand 2015. www.awmf.org
- Global Initiative for Asthma. Pocket Guide for Asthma Management and Prevention. Stand 2022. ginasthma.org
- Kemp JP, Kemp JA. Management of asthma in children. Am Fam Physician 2001; 63:1341-8, 1353-4
.pubmed.ncbi.nlm.nih.gov Global Initiative for Asthma. POCKET GUIDE FOR ASTHMA MANAGEMENT AND PREVENTION. Stand 2020.ginasthma.orgPrice DB, Rigazio A, Campbell JD, et al. Blood eosinophil count and prospective annual asthma disease burden: A UK cohort study. Lancet Respir Med 2015; 3(11): 849-58.pubmed.ncbi.nlm.nih.govKeeley D, McKean M. Asthma and other wheezing disorders of childhood. Clin Evid 2003; 9: 287-317. pubmed.ncbi.nlm.nih.gov- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. Klimabewusste Verordnung von inhalativen Arzneimitteln. S1, AWMF-Nr. 053-059. Stand 2022. www.degam.de
arzneitelegrammKempe S. Neue Empfehlungen zu Bedarfsmedikation und Biologika. Pneumo News 2022; 14: 40. link.springer.com- arznei-telegramm. Therapiekritik – Ein Inhalator zur Erhaltungs- und Bedarfstherapie – eine smarte Idee? a-t 2020; 51: 2-3. www.arznei-telegramm.de
- Leach CL, Colice GL. A pilot study to assess lung deposition of HFA-beclomethasone and CFC-beclomethasone from a pressurized metered dose inhaler with and without add-on spacers and using varying breathhold times. J Aerosol Med Pulm Drug Deliv. 2010 Dec;23(6):355-61. doi: 10.1089/jamp.2009.0783 Epub 2010 Jun 24. PubMed PMID: 20575669 www.ncbi.nlm.nih.gov
- Courtney AU, McCarter DF, Pollart SM. Childhood asthma: Treatment update. Am Fam Physician 2005; 71: 1959-68. PubMed
- Rodrigo GJ, Castro-Rodriguez JA. Anticholinergics in the treatment of children and adults with acute asthma: a systematic review with meta-analysis. Thorax 2005; 60: 740-6. PubMed
- Vézina K, Chauhan BF, Ducharme FM. Inhaled anticholinergics and short-acting beta(2)-agonists versus short-acting beta2-agonists alone for children with acute asthma in hospital. Cochrane Database Syst Rev. 2014 Jul 31 (7):CD010283. doi: 10.1002/14651858.CD010283.pub2 Review. PubMed PMID: 25080126 www.ncbi.nlm.nih.gov
- Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW. Early emergency department treatment of acute asthma with systemic corticosteroids (Cochrane review). Cochrane Database Syst Rev 2004; (4): CD002178. Cochrane (DOI)
- Powell C, Kolamunnage-Dona R, Lowe J, et al. MAGNEsium Trial In Children (MAGNETIC): a randomised, placebo-controlled trial and economic evaluation of nebulised magnesium sulphate in acute severe asthma in children. Health Technol Assess 2013; 17: 1-216. doi:10.3310/hta17450 DOI
- Mintz M. Asthma updage: Part II. Medical management. Am Fam Physicians 2004; 70: 1061-6. www.ncbi.nlm.nih.gov
- National Asthma Education and Prevention Program. Expert panel report. Guidelines for the diagnosis and management of asthma: update on selected topics, 2002. Bethesda, Md.: U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health, National Heart, Lung, and Blood Institute, 2003; NIH publication no. 02-5074. www.ncbi.nlm.nih.gov
- Kelly HW, Sternberg AL, Lescher R, et al. Effect of inhaled glucocorticoids in childhood on adult height. N Engl J Med 2012; 367: 904-12. New England Journal of Medicine
- Zhang L, Prietsch SOM, Ducharme FM. Inhaled corticosteroids in children with persistent asthma: effects on growth. Cochrane Database of Systematic Reviews 2014, Issue 7. Art. No.: CD009471. DOI: 10.1002/14651858.CD009471.pub2. DOI
- Turner S, Richardson K, Murray C, Thomas M, Hillyer EV, Burden A, Price DB; Respiratory Effectiveness Group. Long- Acting β-Agonist in Combination or Separate Inhaler as Step-Up Therapy for Children with Uncontrolled Asthma Receiving Inhaled Corticosteroids. J Allergy Clin Immunol Pract. 2017 Jan - Feb;5(1):99-106.e3. doi: 10.1016/j.jaip.2016.06.009 Epub 2016 Jul 13. PubMed PMID: 27421902. www.ncbi.nlm.nih.gov
- Busse WW, Bateman ED, Caplan AL, et al. Combined Analysis of Asthma Safety Trials of Long-Acting β2-Agonists. N Engl J Med 2018; 378(26): 2497-2505. pmid:29949492 www.nejm.org
- Chauhan BF, Ben Salah R, Ducharme FM. Addition of anti-leukotriene agents to inhaled corticosteroids in children with persistent asthma. Cochrane Database Syst Rev 2013 Oct 2;10:CD009585. Cochrane (DOI)
- Robertson CF, Price D, Henry R, et al. Short-course montelukast for intermittent asthma in children: a randomized controlled trial. Am J Respir Crit Care Med 2007; 175: 323-9. PubMed
- Chauhan BF, Jeyaraman MM, Singh Mann A, Lys J, Abou-Setta AM, Zarychanski R, Ducharme FM. Addition of anti leukotriene agents to inhaled corticosteroids for adults and adolescents with persistent asthma. Cochrane Database Syst Rev. 2017 Mar 16;3:CD010347. doi: 10.1002/14651858.CD010347.pub2. Review. PubMed PMID: 28301050 www.ncbi.nlm.nih.gov
- Castro-Rodriguez JA, Rodrigo GJ. The role of inhaled corticosteroids and montelukast in children with mild-moderate asthma: results of a systematic review with meta-analysis. Arch Dis Child 2010; 95: 365-70. PubMed
- Busse WW, Morgan WJ, Gergen PJ, et al. Randomized trial of omalizumab (Anti-IgE) for astma in inner-city children. N Engl J Med 2011; 364: 1005-15. New England Journal of Medicine
- arznei-telegramm. MEPOLIZUMAB (NUCALA) BEI SCHWEREM REFRAKTÄREN EOSINOPHILEN ASTHMA. a-t 2016; 47: 34-36. www.arznei-telegramm.de
- arznei-telegramm. KARDIOVASKULÄRE NEBENWIRKUNGEN UNTER OMALIZUMAB (XOLAIR). a-t 2009; 40: 76. www.arznei-telegramm.de
- Gesundheitsinformation/IQWiG. Dupilumab (Dupixent) bei schwerem Asthma. Stand 15.07.2022. Letzter Zugriff 04.03.23. www.gesundheitsinformation.de
- arznei-telegramm. NEUE INDIKATION: DUPILUMAB (DUPIXENT) JETZT AUCH BEI ASTHMA BRONCHIALE. a-t 2019; 50: 67-68. www.arznei-telegramm.de
- Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5 therapies for asthma. Cochrane Database of Systematic Reviews 2017; Issue 9. Art: No.: CD010834. pmid:10.1002/14651858.CD010834.pub3 Cochrane (DOI)
- arznei-telegramm. TEZEPELUMAB (TEZSPIRE): NEUER ANTIKÖRPER BEI SCHWEREM ASTHMA. a-t 2023; 54: 12-14. www.arznei-telegramm.de
- Siebenand S. Tezepelumab ist zugelassen. Pharmazeutische Zeitung 2022. www.pharmazeutische-zeitung.de
- Pifferi M, Baldini G, Marrazzini G, Baldini M, Ragazzo V, Pietrobelli A, et al. Benefits of immunotherapy with a standardized Dermatophagoides pteronyssinus extract in asthmatic children: a three-year prospective study. Allergy 2002; 57: 785-90. PubMed
- Mener DJ, Lin SY. Improvement and prevention of asthma with concomitant treatment of allergic rhinitis and allergen-specific therapy. Int Forum Allergy Rhinol 2015; 5 Suppl 1: 45-50. pmid:26072703 PubMed
- Moller C, Dreborg S, Ferdousi HA, Halken S, Host A, Jacobsen L, et al. Pollen immunotherapy reduces the development of asthma in children with seasonal rhinoconjunctivitis (the PAT-study). J Allergy Clin Immunol 2002; 109: 251-6. PubMed
- Wolf FM, Guevara JP, Grum CM, Clark NM, Cates CJ. Educational interventions for asthma in children (Cochrane review). Cochrane Database Syst Rev 2004;(4):CD000326. Cochrane (DOI)
- Guevara JP, Wolf FM, Grum CM, Clark NM. Effects of educational interventions for self management of asthma in children and adolescents: systematic review and meta-analysis. BMJ 2003; 326: 1308-9. pubmed.ncbi.nlm.nih.gov
- Woodcock A, Forster L, Matthews E, Martin J, Letley L, Vickers M, et al. Control of exposure to mite allergen and allergen-impermeable bed covers for adults with asthma. N Engl J Med 2003; 349: 225-36. New England Journal of Medicine
- Kilburn S, Lasserson TJ, McKean M. Pet allergen control measures for allergic asthma in children and adults (Cochrane review). Cochrane Database Syst Rev 2004; (4): CD002989. Cochrane (DOI)
- Murray CS, Foden P, Sumner H, et al. Preventing Severe Asthma Exacerbations in Children. A Randomized Trial of Mite-Impermeable Bedcovers. Am J Respir Crit Care Med 2017; 196: 150-8. pmid:28282501 PubMed
- Lehrer PM, Vaschillo E, Vaschillo B, Lu SE, Scardella A, Siddique M, Habib RH. Biofeedback treatment for asthma. Chest. 2004 Aug;126(2):352-61. PubMed PMID:15302717 www.ncbi.nlm.nih.gov
- Eichenberger PA, Diener SN, Kofmehl R, et al. Effects of exercise training on airway hyperreactivity in asthma: a systematic review and meta-analysis. Sports Med. 2013 ;43(11):1157-70. doi: 10.1007/s40279-013-0077-2. www.ncbi.nlm.nih.gov
- Stordal K, Johannesdottir GB, Bentsen BS, et al. Acid suppression does not change respiratory symptoms in children with asthma and gastro-oesophageal reflux disease. Arch Dis Child 2005; 90: 956-60. PubMed
- Holbrook JT, Wise RA, Gold BD, et al. Lanzoprazole for children with poorly controlled asthma. JAMA 2012; 307: 373-80. www.ncbi.nlm.nih.gov
- Ahnert J, Löffler S, Müller J, Vogel H. [Systematic literature review on interventions in rehabilitation for children and adolescents with asthma bronchiale]. Rehabilitation (Stuttg). 2010 Jun;49(3):147-59. doi:10.1055/s-0030-1254081. Epub 2010 Jun 8. Review. German. PubMed PMID: 20533145 www.ncbi.nlm.nih.gov
- Beggs S, Foong YC, Le HC, Noor D, Wood-Baker R, Walters JA. Swimming training for asthma in children and adolescents aged 18 years and under. Cochrane Database Syst Rev. 2013 Apr 30;(4):CD009607. doi: 10.1002/14651858.CD009607.pub2 Review. PubMed PMID: 23633375 www.ncbi.nlm.nih.gov
- Abramson MJ, Puy RM, Weiner JM. Injection allergen immunotherapy for asthma. Cochrane Database of Systematic Reviews 2010, Issue 8. Art. No.: CD001186. pubmed.ncbi.nlm.nih.gov
- Jacobsen L, Niggemann B, Dreborg S, Ferdousi HA, Halken S, Høst A, Koivikko A, Norberg LA, Valovirta E, Wahn U, Möller C; (The PAT investigator group). Specific immunotherapy has long-term preventive effect of seasonal and perennial asthma: 10-year follow-up on the PAT study. Allergy. 2007 Aug;62(8):943-8. PubMed PMID: 17620073. www.ncbi.nlm.nih.gov
- Gesundheitsberichterstattung des Bundes. Gemeinsam getragen von RKI und Destatis. Diagnosedaten der Krankenhäuser. Jahr 2018 (letzter Zugriff 02.10.2020). www.gbe-bund.de
- Sannarangappa V, Jalleh R . Inhaled Corticosteroids and Secondary Adrenal Insufficiency. The Open Respiratory Medicine Journal 2014; 8: 93-100. www.ncbi.nlm.nih.gov
- Kjellman B, Gustafsson PM. Children with asthma followed up for 21 years; severity improved, but patients seldom grow out of asthma by adulthood. Läkartidningen 2000; 97: 4572-7. www.ncbi.nlm.nih.gov
- Lange P, Çolak Y, Ingebrigtsen TS, Vestbo J, Marott JL. Long term prognosis of asthma, chronic obstructive pulmonary disease, and asthma-chronic obstructive pulmonary disease overlap in the Copenhagen City Heart study: a prospective population-based analysis. Lancet Respir Med. 2016 Jun;4(6):454-62. doi: 10.1016/S2213-2600(16)00098-9 Epub 2016 Apr 6. PubMed PMID: 27061878 www.ncbi.nlm.nih.gov
- Horak E, Lanigan A, Roberts A, et al. Longitudinal study of childhood wheezy bronchitis and asthma: outcome at age 42. BMJ 2003; 326: 422-3. PubMed
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung
, Innere Medizin, Frankfurt Monika Lenz, Fachärztin fürAllgemeinmedizin,Neustadt am RMübenbergeJonas Klaus, Arzt, Freiburg im Breisgaunster- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).