Zusammenfassung
- Definition:Autosomal-rezessiv vererbte Erkrankung, ausgelöst durch einen Defekt im Cystic-Fibrosis-Transmembrane-Conductance-Regulator(CFTR)-Gen, das einen Chloridkanal der exokrinen Drüsen beeinflusst (typisch in Atemwegen und im Magen-Darm-System). Durch den Defekt entsteht ein besonders zäher Schleim, der Drüsenausgänge verstopft und so zu Infektionen und Folgeschäden führt.
- Häufigkeit:Häufigkeit in Deutschland ca. 1:3.300 (häufigste tödliche Erbkrankheit). 59 % der Betroffenen werden im 1. Lebensjahr diagnostiziert, 6,8 % als Erwachsene.
- Symptome:Charakteristisch sind rezidivierende Infektionen der Atemwege (bei bis zu 99 % der Betroffenen). Häufig kommt es ebenfalls zu exokriner Pankreasinsuffizienz mit Malabsorption.
- Befunde:Reduzierter Allgemein- und Ernährungszustand, verzögerte Entwicklung bei Kindern, Zeichen der Hypoxie (z. B. Trommelschlegelfinger), erhöhter Chloridgehalt im Schweiß, zäher Schleim in Atemwegen.
- Diagnostik:Neugeborenenscreening (in Deutschland seit 2016); Pilokarpin-Iontophorese-Schweißtest; CFTR-Genanalyse; bei unklaren Fällen elektrophysiologische Spezialverfahren.
- Therapie:Interdisziplinäre Behandlung erforderlich. Symptomatische Therapie zur Verminderung von Komplikationen und Folgeschäden.
Allgemeine Informationen
Definition
- Andere Namen der Mukoviszidose sind zystische Fibrose (CF) oder zystische Pankreasfibrose.
- Bei der CF handelt es sich um eine autosomal-rezessiv vererbte Erkrankung der exokrinen Drüsen, die zur Absonderung eines ungewöhnlich zähen Schleims (Mukus) führt.1-2
- Durch den zähen Schleim kommt es zur Verstopfung der Drüsen und deren Ausgänge in verschiedenen Organen.3
- Charakteristisch für die Erkrankung sind u. a.:
- chronisch bakterielle Infektionen der Atemwege und Nasennebenhöhlen
- reduzierter Abbau von Fett als Folge der exokrinen Pankreasinsuffizienz
- Infertilität bei Männern aufgrund obstruktiver Azoospermie
- erhöhte Konzentration von Chlorid im Schweiß.1
Häufigkeit
- Die Inzidenz beträgt bei Europäer*innen ca. 1 pro 3.300.1
- In Deutschland werden ca. 59 % der Betroffenen im 1. Lebensjahr diagnostiziert. Ca. 6,8 % werden mit 18 Jahren oder später diagnostiziert.1
- CF ist die häufigste lebensverkürzende Erbkrankheit in Deutschland.4
- Der Anteil der Erwachsenen mit CF nimmt durch die gestiegenen Überlebenschancen immer weiter zu.5
Ätiologie und Pathogenese
- Autosomal-rezessive vererbte Multisystemerkrankung
- CFTR-Gen
- lokalisiert auf dem langen Arm von Chromosom 7
- Kodiert für das Protein Cystic Fibrosis Transmembrane Conductance Regulator (CFTR).
- Durch den Defekt wird der Chloridtransport an der Zellmembran verringert, wodurch es zu einem Wasserentzug und in Folge zu zähem Sekret in den betroffenen Organen kommt.5
- Insgesamt sind ca. 1.900 Mutationen nachgewiesen, am häufigsten ist die F508del-Mutation.3
Pathophysiologie
- Durch den Defekt im Chloridkanal entsteht ein besonders zäher Schleim, der die Drüsen und Ausführungsgänge vieler Organe verstopfen kann.
- In den Atemwegen führt die unzureichende Hydrierung des tracheobronchialen Epithels dazu, dass die mukoziliäre Funktion beeinträchtigt wird, außerdem wird das Sputum dick und viskös und wird schlecht abgeleitet, was Infektionen begünstigt.5
- Häufig betroffen sind neben der Lunge auch Pankreas, Leber, Gallenwege sowie männliche Geschlechtsorgane.4
Prädisponierende Faktoren
- Autosomal-rezessiv vererbte Erkrankung
ICPC-2
- T99 Endokrin/metabolisch/Ernährungskrankheit IKA
- R83 Atemwegsinfektion IKA
- Angeborener Defekt der Atemwege
- R95 Chronisch obstruktive Lungenkrankheit
ICD-10
- E84 Zystische Fibrose
- E84.0 Zystische Fibrose mit Lungensymptomen
- E84.1 Zystische Fibrose mit Darmsymptomen
- E84.8 Zystische Fibrose mit sonstigen näher bezeichneten Symptomen
- E84.9 Nicht näher bezeichnete zystische Fibrose
- J84 Sonstige interstitielle Lungenkrankheiten
- J84.1 Sonstige näher bezeichnete interstitielle Lungenkrankheit
- J84.9 Nicht näher bezeichnete interstitielle Lungenkrankheit
Diagnostik
Diagnostische Kriterien
- Durch das Neugeborenenscreening wird CF mittlerweile häufig schon vor dem Auftreten erster Symptome diagnostiziert.4
- Die klinische Symptomatik variiert stark und kann gerade bei Neugeborenen asymptomatisch sein.
Leitlinie: Diagnostische Kriterien bei zystischer Fibrose1,4
- Für die Diagnose Mukoviszidose müssen mindestens 1 diagnostischer Hinweis vorliegen und 1 CFTR-Funktionsstörung nachgewiesen sein.
- Diagnostische Hinweise sind:
- ein positives Neugeborenenscreening – oder –
- Geschwister mit Diagnose einer Mukoviszidose – oder –
- mindestens ein klinischer Hinweis auf eine Mukoviszidose.
- Der Nachweis einer CFTR-Funktionsstörung erfolgt durch:
- erhöhte Schweißchloridwerte (≥ 60 mmol/l) bei mindestens 2 unabhängigen Messungen – oder –
- Nachweis zweier Mukoviszidose-verursachenden CFTR-Mutationen (in trans) – oder –
- Nachweis einer charakteristischen Abnormalität der CFTR-Funktion mittels nasaler Potentialdifferenzmessung (NPD) oder intestinaler Kurzschlussstrommessung (ICM).
- Bei Diagnosestellung soll die fäkale Pankreaselastase im Stuhl zur Untersuchung der exokrinen Pankreasfunktion bestimmt werden.
- Bei normaler exokriner Pankreasfunktion (fäkale Elastase > 200 µg/g Stuhl) soll im 1. und 2. Lebensjahr die Bestimmung der Pankreaselastase alle 3 Monate durchgeführt werden.
- Bei Verschlechterung der Gewichtszunahme und/oder auffälligen Stühlen sollen Kontrollen der Pankreasfunktion jederzeit veranlasst werden, und eine Behandlung soll rasch eingeleitet werden.
- Bei Diagnosestellung und einmal jährlich soll eine Sonografie des Abdomens durchgeführt werden.
Differenzialdiagnosen
- Andere Lungenkrankheiten einschließlich Asthma
- Andere Malabsorptionszustände
Anamnese
- Der Abschnitt basiert auf dieser Referenz.1
- Durch das Neugeborenenscreening wird CF mittlerweile häufig vor dem Auftreten erster Symptome diagnostiziert.4
- Häufig fallen die Erkrankten durch rezidivierende respiratorische Infekte auf, die meist in den ersten Lebensmonaten auftreten.3
- Häufig reduzierter Allgemein- und Ernährungszustand, verzögerte Entwicklung bei Kindern
- Im Erwachsenenalter sind insbesondere die Ausprägungen einer chronisch sinopulmonalen Erkrankung, einer rezidivierenden oder chronischen Pankreatitis (nicht-biliär, nicht-alkoholisch) und/oder einer obstruktiven Azoospermie Anlass für eine Diagnostik auf Mukoviszidose.3
Klinische Hinweise auf CF
- Die folgenden klinischen Hinweise können Anlass für eine Mukoviszidose-Diagnostik sein.1,3-5
- Respiratorische Symptomatik
- chronischer Husten
- rezidivierende Atemwegserkrankungen
- zu Beginn häufig Infektion mit S. aureus, später Pseudomonas aeruginosa
- Bronchiektasien
- im Verlauf COPD
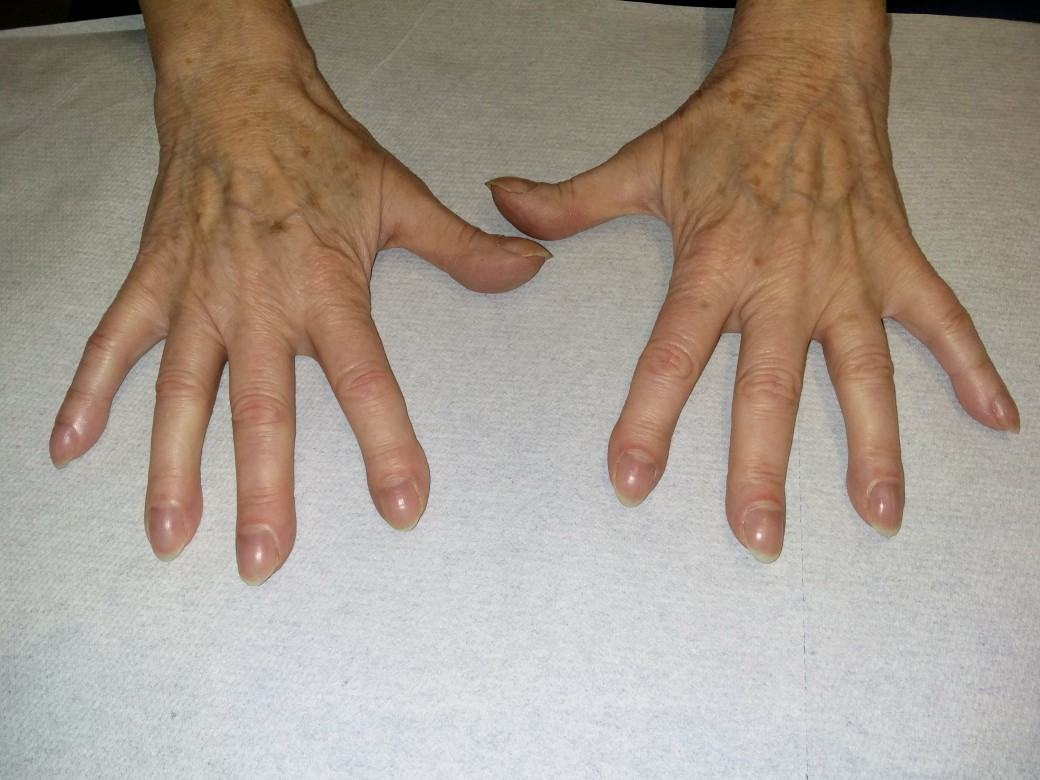 Trommelschlegelfinger
Trommelschlegelfinger -
- durch chronische Hypoxie im Verlauf Trommelschlegelfinger
- Exokrine Pankreasinsuffizienz
- chronische Durchfälle (Fettstühle)
- Malabsorptionssyndrom mit Kachexie
- Mangel der fettlöslichen Vitamine
- im Verlauf Fibrose des Pankreas und Zystenbildung
- evtl. pankreatogener Diabetes mellitus
- Leber und Gallenwege
- im Verlauf biliäre Zirrhose möglich
- Cholelithiasis
- Leberversagen ist eine häufige Todesursache bei CF.
- Darm
- Mekoniumileus bei Neugeborenen
- Genitale Erkrankung
Ergänzende Untersuchungen in der Hausarztpraxis
- Erfassung des Ernährungszustandes
- Untersuchungen der Lungenfunktion
- Zeigt reduzierte FVC, FEV1, PEF und gesamte Lungenkapazität.
Diagnostik bei Spezialist*innen
- Neugeborenenscreening1,3
- in allen deutschsprachigen Ländern
- nach Einwilligung und Aufklärung der Eltern
- Testung auf immunreaktives Trypsin (IRT) und Pankreatitis-assoziiertes Protein (PAP)
- Falls Schritte 1 und 2 positiv ausfallen, folgt eine DNA-Mutationsanalyse.
- Bei positivem Neugeborenenscreening liegt bei 1 von 4–5 Kindern tatsächlich eine Mukoviszidose vor.4
- Schweißtest
- Goldstandard zur Diagnosestellung1-2
- Kann ab dem 3. Lebenstag durchgeführt werden.
- Sensitivität ca. 96,5 %, Spezifität ca. 99 %1
- Die Haut wird mit Pilokarpin stimuliert, der Schweiß wird anschließend über 30 min gesammelt. Im Anschluss wird die Chloridkonzentration bestimmt.
- ≤ 29 mmol/l: unauffällig = Mukoviszidose unwahrscheinlich
- 30–59 mmol/l: Kontrollbereich = Weitere Diagnostik auf Mukoviszidose erforderlich; Diagnose kann durch Nachweis zweier CFTR-Mutationen gesichert werden.
- ≥ 60 mmol/l: vereinbar mit der Diagnose Mukoviszidose, molekulargenetische Diagnostik zur Diagnosesicherung empfohlen
- Molekulargenetische Diagnostik
- Steht erst an zweiter Stelle nach dem Schweißtest.1,4
- Aufklärung der Patient*innen bzw. der Erziehungsberechtigten vor Durchführung einer genetischen Analyse und Anbieten einer genetischen Beratung.
- Bei Eltern von Mukoviszidose-Patient*innen mit nachgewiesener CFTR-Mutation kann eine Heterozygotentestung erfolgen (= molekulargenetische Untersuchung klinisch gesunder Personen; genetische Beratung vor der Untersuchung und danach erforderlich).1
- Bei der molekulargenetischen Diagnostik muss das Gendiagnostikgesetz (Deutschland) bzw. das Gentechnikgesetz (Österreich) bzw. das Bundesgesetz über genetische Untersuchungen beim Menschen (Schweiz) berücksichtigt werden.
- Elektrophysiologische Messungen1,4
- Bei Patient*innen mit uneindeutigem Ergebnis kann eine elektrophysiologische Messung der CFTR-Kanalfunktion erfolgen (nasale Potenzialdifferenz NPD, intestinale Kurzschlussstrommessung ICM).
Indikationen zur Überweisung
- Bei Verdacht auf CF sollte ein interdisziplinärer Behandlungsansatz verfolgt werden.
- In die Behandlung mit einbezogen werden sollten u. a. Pädiater*in, Internist*in, Pneumolog*in, Gastroenterolog*in und Humangenetiker*in.
Therapie
Leitlinie: Therapie der Mukoviszidose4
Physiotherapie
- Physiotherapie soll zeitnah nach Diagnosestellung begonnen werden.
- Die physiotherapeutischen Behandlungen sollen von Physiotherapeut*innen durchgeführt werden, die eine Zusatzqualifikation in atemtherapeutischen Techniken erworben haben, z. B. in Deutschland „Grundkurs Physiotherapie bei chronischen Lungenerkrankungen und Mukoviszidose“.
- Eine Inhalation mit atemwegserweiternden Medikamenten (z. B. Salbutamol) kann vor der Physiotherapie durchgeführt werden.
- Inhalation mit Dornase alfa kann durchgeführt werden.
- Eine Inhalation von hypertoner Kochsalzlösung soll durchgeführt werden.
- Inhalationen mit kurzwirksamen Beta2-Sympathomimetika können durchgeführt werden.
- Bei Hinweisen auf bronchiale Hyperreagibilität soll eine leitliniengerechte Therapie eingeleitet werden (siehe Nationale Versorgungsleitlinie Asthma).
Antibiotische Behandlung
- Bei Erstnachweis von S. aureus soll eine antibiotische Therapie mit gegen S. aureus empfohlenen, sensibel getesteten Antibiotika erfolgen.
- Bei wiederholtem Nachweis von S. aureus (PSSA, MSSA oder MRSA) soll nur bei pulmonaler Exazerbation antibiotisch behandelt werden.
- Eine antibiotische Dauerprophylaxe soll nicht durchgeführt werden.
- Bei Erstnachweis von H. influenzae soll eine antibiotische Therapie mit gegen H. influenzae gerichtete Antibiotika durchgeführt werden.
- Bei erstem Nachweis von Pseudomonas aeruginosa soll eine frühe Eradikation mittels Tobramycin inhalativ für 4 Wochen oder mittels Ciprofloxacin p. o. kombiniert mit Colistin inhalativ über 3 Wochen erfolgen. Für den Fall, dass eine Inhalation nicht möglich ist, sollte eine intravenöse Kombinationstherapie als Möglichkeit in Betracht gezogen werden.
- Bei Patient*innen mit chronischer Pseudomonas-aeruginosa-Infektion soll eine inhalative antibiotische Suppressionstherapie durchgeführt werden.
- Eine antibiotische Prophylaxe zur Verhinderung einer Infektion durch P. aeruginosa soll nicht durchgeführt werden.
CFTR-Modulatoren
- Kinder im Alter zwischen 12–24 Monaten mit mindestens einer Gating Mutation (G551D, G178R, S549N, S549R, G551S, G970R, G1244E, S1251N, S1255P, oder G1349D) und einem Gewicht von mindestens 7 kg sollten Ivacaftor als mutationsspezifische Therapien erhalten.
- Ergänzung durch G-BA und EMA (2021): Erheblicher Zusatznutzen für Wirkstoffkombination Ivacaftor, Elexacaftor und Tezacaftor. Anwendung bei Patient*innen ab 6 Jahren, deren zystische Fibrose mindestens einer F508del-Mutation im CFTR-Gen geschuldet ist. 6-7
Behandlung von Lungen und Atemwegen
- Eine generelle Therapie der Lungenerkrankung bei Mukoviszidose sollte weder mit inhalativem noch mit oralem NAC erfolgen.
- Eine Nasenspülung mit physiologischer Kochsalzlösung sollte regelmäßig durchgeführt werden.
Ernährung
- Die Ernährung soll bedarfsangepasst sein, um ein altersentsprechendes Gedeihen zu gewährleisten.
- Es soll mit einer Supplementierung von Pankreasenzymen begonnen werden, wenn eine exokrine Pankreasinsuffizienz nachgewiesen wurde. Therapieziele sind eine normale Gewichtsentwicklung, eine optimale Versorgung mit Mikronährstoffen und ggf. ein Fettabsorptionskoeffizient von > 85 %.
- Bei einer Leberbeteiligung kann Ursodesoxycholsäure gegeben werden.
Therapieziele
- Symptomatische Therapie
- Lebensqualität erhöhen.
- Lebenszeit verlängern.
- Komplikationen vermeiden.
Allgemeines zur Therapie
- Eine umfassende interdisziplinäre Therapie erhöht die Überlebenszeit und lindert die Symptome – die Behandlung sollte wenn möglich in einem Mukoviszidose-Zentrum erfolgen.1,5,8-9
- Auch psychosoziale Aspekte sollten in der Behandlung beachtet werden.10
- Das Risiko für psychische Erkrankungen wie Depressionen scheint bei Patient*innen mit CF erhöht zu sein und sollte bedacht werden.
- Die Diagnose sollte sowohl den Patient*innen als auch den Eltern zeitnah detailliert erklärt werden – auch im Hinblick auf verbesserte Therapiemöglichkeiten, erhöhte Lebenserwartung und die Notwendigkeit einer konsequenten Langzeittherapie.1
- Eine Gentherapie ist bisher nicht verfügbar.5,11-13
- Medikamentöse Behandlung8-9
- Antibiotika bei bronchopulmonalen Infekten
- CFTR-Modulatoren
- Sekretolytika
- Ernährung
- Je besser der Ernährungsstatus der Betroffenen ist, umso besser sind Überlebenszeit, Lungenfunktion, Allgemeinzustand, mentale Kapazität.14-15
- Physiotherapeutische Behandlung16-17
- zur Drainage des zähen Bronchialsekrets
Empfehlungen für Patient*innen
- Kochsalz und Flüssigkeit sollten in ausreichender Menge zugeführt werden.
- Allgemein wird eine bedarfsangepasste Ernährung empfohlen.3,14
- Moderate körperliche Aktivität scheint sich förderlich auf die Lungenfunktion sowie die allgemeine Fitness auszuwirken.16
Therapieansätze
CFTR-Modulatoren
- Kausaler Therapieansatz mit Ivacaftor für Kinder ab 6 Jahren und Erwachsene seit 2012 in Deutschland möglich4-5
- Bewirkt eine vermehrte Öffnung der CFTR-Kanäle und dadurch einen verbesserten Chloridtransport; der zähe Schleim wird so verflüssigt.
- zugelassene Dosierung: 2 x/d 150 mg
- Zunahme der FEV1, Reduktion bronchopulmonaler Infektionen
- Seit 2018 ist eine Kombinationstherapie aus Lumacaftor/Ivacaftor für Kinder von 2–11 Jahren zugelassen.
- 2021 wurde ein erheblicher Zusatznutzen für die Kombinationstherapie aus Ivacaftor, Tezacaftor und Elexacaftor nachgewiesen.6-7
- Wirkung: Verbesserung der Lungenfunktion mit FEV1 als Hauptindikator
- Wirkmechanismus: Elexacaftor und Tezacaftor erhöhen die Zahl der CFTR-Proteine auf der Zelloberfläche.
- Voraussetzung
- mindestens eine F508del-Mutation im CFTR-Gen
- Alter ab 6 Jahren
- Dosierung und Anwendung
- Für Patient*innen ab 12 Jahren oder mit Gewicht von ≥ 30 kg enthält jede Tablette 75 mg Ivacaftor, 50 mg Tezacaftor und 100 mg Elexacaftor.
- Für jüngere oder kleinere Patient*innen enthält jede Tablette 37,5 mg Ivacaftor, 25 mg Tezacaftor und 50 mg Elexacaftor.
- Einnahme zusammen mit einem anderen Arzneimittel, das ausschließlich Ivacaftor enthält.
- Empfohlene Tagesdosis 2 Tabletten der angemessenen Stärke, die morgens mit fetthaltiger Nahrung eingenommen werden, und 1 Tablette Ivacaftor (150 mg bei jenen mit der höheren Dosis, 75 mg bei jenen mit der niedrigeren Dosis) am Abend, etwa 12 Stunden später.
- häufige Nebenwirkungen (mehr als 1 von 10 Betroffenen)
- Kopfschmerzen, Durchfall und Infektionen der oberen Atemwege
- Verordnungsfähigkeit18
- Verordnung bei o. g. erfüllten Voraussetzungen möglich
- Außerhalb der Zulassung, z. B. bei zwei Mutationen ohne F508del, und bei schlechtem Gesundheitszustand kann ein Off-Label-Antrag für individuellen Heilversuch bei der Krankenkasse gestellt werden. Es erfolgt eine Einzelfallentscheidung durch die Krankenkasse.
Ernährung
- Bei Fett-Malabsorption sollen Pankreasenzyme (Amylase, Lipase und Protease) substituiert werden.4
- Vitaminsubstitution – zusätzliche Gabe von Vitamin A, D, E und K ist erforderlich.
- Bei Unterernährung kann eine Erhöhung der Kalorienzufuhr erwogen werden, hochkalorische Nahrung kann notwendig werden.
- Der Ernährungszustand ist ein wichtiger Prädiktor für die Krankheitsprognose.14-15,19
- Schlechte Ernährung ist mit verzögerter Pubertät, höherem Risiko für Pneumothorax und schlechteren Ergebnissen nach einer Lungentransplantation verbunden.20
- In Ausnahmefällen kann eine Ernährung über eine Sonde notwendig werden.21
Behandlung der Lungen und Atemwege
- Die wiederkehrenden Infektionen führen im Verlauf zu einem zunehmenden Verlust der Lungenfunktion.
- Infektionen sollten mit Antibiotika behandelt werden.
- Eine prophylaktische Antibiotikagabe sollte nicht erfolgen.4
- Im Verlauf kommt es häufig zu chronischen Infektionen, häufig durch Pseudomonas aeruginosa.1,3-4
- Eradikation einer Besiedlung mit Pseudomonas aeruginosa: z. B. mit Tobramycin inhalativ für 4 Wochen3
- Durch chronische Infektion mit Pseudomonas aeruginosa kommt es zu einem Abfall in der Lungenfunktion.
- Zur Therapie der chronischen Pseudomonas-aeruginosa-Infektion sind Tobramycin, Colistin, Aztreonam und Levofloxacin zugelassen.
- Bei Hinweisen auf bronchiale Hyperreagibilität soll eine leitliniengerechte Therapie eingeleitet werden.
- Bronchospasmus
- Inhalationen mit kurzwirksamen Beta2-Sympathomimetika können durchgeführt werden.
- Sekretolyse
- Inhalation mit hypertoner Kochsalzlösung und Dornase alfa22-23
- Mukolytika4
- Eine generelle Therapie der Lungenerkrankung bei Mukoviszidose sollte weder mit inhalativen noch mit oralem N-Acetylcystein erfolgen.
Physiotherapie für die Lunge
- Soll zeitnah nach Diagnosestellung begonnen werden.1
- Tägliche Drainage des zähen Sekrets, z. B. durch Klopfmassage
Lungentransplantation
- Im Endstadium der Erkrankung ist eine zunehmende respiratorische Insuffizienz für die meisten Patient*innen die lebensbegrenzende Komplikation.
- Unter bestimmten Voraussetzungen kann dann eine Lungentransplantation vorgenommen werden.
- Die Indikation zur Transplantation sollte multidisziplinär gestellt werden und ist Spezialzentren vorbehalten.
- Die mediane 5-Jahres-Überlebensrate nach Lungentransplantation liegt derzeit bei etwa 7,5 Jahren.24
- Die Transplantation stellt eine krankheitsmildernde, keinesfalls eine heilende Maßnahme dar.
Prävention
Leitlinie: Impfungen4
- Kinder mit Mukoviszidose sollen alle von der STIKO empfohlenen Impfungen erhalten.
- Zusätzlich soll eine Hepatitis-A-Impfung ab dem Alter von 12 Monaten und jährlich die intramuskuläre tetravalente Influenza-Impfung ab dem Alter von 6 Monaten gegeben werden.
- Zumindest bei Kindern < 6 Monate soll die Impfung aller Haushaltskontakte und Betreuer*innen erfolgen.
Verlauf, Komplikationen und Prognose
Verlauf
- CF ist eine chronische und progressiv verlaufende Erkrankung.
Fertilität
- Männer
- Die Azoospermie ist durch das beidseitige Fehlen des Vas deferens zu erklären, was bei fast allen männlichen Patienten vorliegt.
- Die Produktion von Spermien ist jedoch normal, eine künstliche Befruchtung ist daher möglich.
- Frauen
- Die Fertilität scheint nicht eingeschränkt zu sein.
- Frauen mit adäquater Lungenfunktion und Ernährungszustand können eine Schwangerschaft gut bewältigen.25-26
Komplikationen
- Unterernährung
- Biliäre Zirrhose
- Reduzierte Knochendichte27
- Zunehmende Lungeninsuffizienz
- Bronchiektasen
- Lungenentzündung
- Sonstige Lungenkomplikationen
- Stressinkontinenz
- sehr häufig (> 50 %) bei Frauen mit CF29
- Dünndarmobstruktion
- durch verdickten Stuhl und Schleim im terminalen Ileum
- Endokrine Pankreasinsuffizienz
- 20–30 % der Erwachsenen mit zystischer Fibrose entwickeln eine endokrine Pankreasinsuffizienz.30
- Beginn meistens zwischen 18 und 24 Jahren
- Der mit zystischer Fibrose assoziierte Diabetes (CFRD) ist dadurch charakterisiert, dass das Pankreas kleine Mengen Insulin produziert, die aber nicht ausreichen, um auf die Einnahme von Kohlenhydraten in vollem Umfang zu reagieren.
Prognose
- Tödliche, nicht heilbare Krankheit. Die Überlebensraten verbessern sich jedoch stetig.
- Heute geborene CF-Patient*innen können mittlerweile mit einer Lebenserwartung von 50 Jahren rechnen.
- Betroffene werden in Deutschland aktuell im Schnitt 47,5 Jahre alt.31
- Kardiopulmonale Erkrankungen stellen mit ca. 75 % die häufigste Todesursache dar.31
Verlaufskontrolle
Leitlinie: Kontrolluntersuchungen4
- Röntgen-Thoraxaufnahmen in a.p.-Projektion sollten jährlich, beginnend mit Diagnosestellung und bei therapierefraktären pulmonalen Symptomen durchgeführt werden.
- Alternativ kann der Einsatz von MRT- und Niedrig-Dosis-CT-Untersuchungen erfolgen. Voraussetzung hierfür sind das Vorhandensein spezieller technischer Gegebenheiten, entsprechende alters- und gewichtsadaptierte Protokolle und kinderradiologische Expertise.
- Kontrolluntersuchungen sollten regelmäßig stattfinden und u. a. Lungenfunktion, Ernährungszustand, Infektionen, evtl. Komplikationen sowie psychosoziale Umstände beinhalten.4,8
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Prognoseverbesserung durch konsequente Behandlung
- Steigende Lebenserwartung aufgrund verbesserter Therapie
- Ausführliche Aufklärung über die Erkrankung und mögliche Komplikationen
Patienteninformationen in Deximed
Illustrationen

Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)
Quellen
Kompetenzzentren
- Mukoviszidose e. V. – Bundesverband Cystische Fibrose (CF): CF-Ambulanzen in Deutschland
Leitlinien
- Gesellschaft für Pädiatrische Pneumologie (GPP). Mukoviszidose bei Kindern in den ersten beiden Lebensjahren, Diagnostik und Therapie. AWMF-Leitlinie Nr. 026-024. S3, Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. (DGKJ). Diagnose der Mukoviszidose. AWMF-Leitlinie Nr. 026-023. S2k, Stand 2013. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. (DGKJ). Lungenerkrankung bei Mukoviszidose. AWMF-Leitlinie Nr. 026-022. S3, Stand 2013. www.awmf.org
Literatur
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. (DGKJ). Diagnose der Mukoviszidose. AWMF-Leitlinie Nr. 026-023. S2k, Stand 2013. www.awmf.org
- De Boeck K, Wilschanski M, Castellani C, et al. Cystic fibrosis: terminology and diagnostic algorithms. Thorax 2006; 61: 627-35. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. (DGKJ). Lungenerkrankung bei Mukoviszidose. AWMF-Leitlinie Nr. 026-022. S3, Stand 2013. www.awmf.org
- Gesellschaft für Pädiatrische Pneumologie (GPP). Mukoviszidose bei Kindern in den ersten beiden Lebensjahren, Diagnostik und Therapie. AWMF-Leitlinie Nr. 026-024. S3, Stand 2020. www.awmf.org
- Schwarz C. Zystische Fibrose: Mukoviszidose ist längst keine Kinderkrankheit mehr. Dtsch Arztebl 2017; 114(9): 14. doi:10.3238/PersPneumo.2017.03.03.03 DOI
- G-BA. Neue Arzneimitteltherapie bei Mukoviszidose: G-BA vergibt Bestnote. 18.02.2021. Letzter Zugriff 20.08.22. www.g-ba.de
- EMA. Kaftrio (Ivacaftor/Tezacaftor/Elexacaftor). Stand 12/2021. Letzter Zugriff 20.08.22. www.ema.europa.eu
- Flume PA, O'Sullivan BP, Robinson KA, et al. Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health. Am J Respir Crit Care Med 2007; 176: 957-69. PubMed
- Murphy MP, Caraher E. Current and Emerging Therapies for the Treatment of Cystic Fibrosis or Mitigation of Its Symptoms. Drugs R D 2016 Mar; 16(1): 1-17. pmid:26747453 PubMed
- Quittner AL, Abbott J, Georgiopoulos AM, et al. International Committee on Mental Health in Cystic Fibrosis: Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus statements for screening and treating depression and anxiety. Thorax 2016; 71: 26-34. thorax.bmj.com
- Bobadilla JL, Macek M Jr, Fine JP, et al. Cystic fibrosis: a worldwide analysis of CFTR mutations - correlation with incidence data and application to screening. Hum Mutat 2002; 19: 575-606. PubMed
- Boyle MP. Strategies for identifying modifier genes in cystic fibrosis. Proc Am Thorac Soc 2007; 4: 52-57. PubMed
- Haston CK, Hudson TJ. Finding genetic modifiers of cystic fibrosis. N Engl J Med 2005; 353: 1509-11. PubMed
- Zemel BS, Jawad AF, FitzSimmons S, Stallings VA. Longitudinal relationship among growth, nutritional status, and pulmonary function in children with cystic fibrosis: analysis of the Cystic Fibrosis Foundation National CF Patient Registry. J Pediatr 2000; 137: 374-80. PubMed
- Konstan MW, Butler SM, Wohl ME, Stoddard M, Matousek R, Wagener JS, et al. Growth and nutritional indexes in early life predict pulmonary function in cystic fibrosis. J Pediatr 2003; 142: 624-30. PubMed
- Radtke T, Nevitt SJ, Hebestreit H, Kriemler S. Physical training for cystic fibrosis. Cochrane Database of Systematic Reviews, 01 November 2017. www.cochranelibrary.com
- Flume PA. Airway clearance techniques. Semin Respir Crit Care Med 2003; 24: 727-36. PubMed
- Mukoviszidose e.V., Bundesverband Cystische Fibrose (CF). Kaftrio (Trikafta) – Triple-Therapie für Mukoviszidose (CF). Stand 20.07.2022. Letzter Zugriff 21.08.22. www.muko.info
- Lai HJ. Classification of nutritional status in cystic fibrosis. Curr Opin Pulm Med 2006; 12: 422-7. PubMed
- Burton CM, Milman N, Carlsen J, Arendrup H, Eliasen K, Andersen CB, et al. The Copenhagen National Lung Transplant Group: survival after single lung, double lung, and heart-lung transplantation. J Heart Lung Transplant 2005; 24: 1834-43. PubMed
- Shimmin D, Lowdon J, Remmington T. Enteral tube feeding for cystic fibrosis. The Cochrane Collaboration, 22 July 2019. www.cochranelibrary.com
- Jones AP, Wallis C. Dornase alfa for cystic fibrosis. Cochrane Database of Systematic Reviews 2010; 3: CD001127. doi:10.1002/14651858.CD001127.pub2 DOI
- Liang J, Higgins T, Ishman SL, et al. Medical management of chronic rhinosinusitis in cystic fibrosis: a systematic review. Laryngoscope. 2014 ;124(6):1308-13. PMID: 24338982 PubMed
- Christie JD et al. The Registry of the International Society for Heart and Lung Transplantation: 29th Adult Lung and Heart-Lung Transplant Report—2012. J Heart Lung Transpl 2012; 31: 1073-1086. doi:10.1016/j.healun.2012.08.004 DOI
- McMullen AH, Pasta DJ, Frederick PD, et al. Impact of pregnancy on women with cystic fibrosis. Chest 2006; 129: 706-11. PubMed
- Gilljam M, Antoniou M, Shin J, et al. Pregnancy in cystic fibrosis: fetal and maternal outcome. Chest 2000; 118: 85-91. PubMed
- Boyle MP. Update on maintaining bone health in cystic fibrosis. Curr Opin Pulm Med 2006; 12: 453-8. PubMed
- Flume PA, Strange C, Ye X, Ebeling M, Hulsey T, Clark LL. Pneumothorax in cystic fibrosis. Chest 2005; 128: 720-8. PubMed
- Orr A, McVean RJ, Webb AK, Dodd ME . Questionnaire survey of urinary incontinence in women with cystic fibrosis . BMJ 2001; 322: 1521. PubMed
- Moran A, Hardin D, Rodman D, et al. Diagnosis, screening and management of cystic fibrosis related diabetes mellitus: a consensus conference report. Diabetes Res Clin Pract 1999; 45: 61-73. PubMed
- Deutsches Ärzteblatt. Lebenserwartung von Patienten mit Mukoviszidose steigt. 23.11.2018. Zuletzt aufgerufen am 29.04.2020. www.aerzteblatt.de
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung Allgemeinmedizin, Frankfurt a. M.
- Laura Morshäuser, Ärztin, Freiburg im Breisgau
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).