Allgemeine Informationen
Definition
- Colitis ulcerosa (CU) bildet zusammen mit M. Crohn (MC) die 2 Hauptformen der chronisch entzündlichen Darmerkrankungen (CED).1
- Im Gegensatz zum MC sind in der Regel nur Schleimhaut von Rektum und Kolon betroffen, und die Entzündung breitet sich kontinuierlich vom Rektum nach oral aus.2-3
- Therapie und Karzinomüberwachungsprogramm erfolgen anhand der Ausdehnung, Aktivität sowie der möglichen Komorbidität einer primär sklerosierenden Cholangitis (PSC).4
- sehr starke Assoziation von CU mit PSC
Klassifikation
- Endoskopische Einteilung bezüglich der Ausdehnung (Montreal-Klassifikation)5
- Proktitis: auf das Rektum begrenzt
- Linksseitenkolitis: Ausdehnung bis zur linken Flexur
- ausgedehnte Kolitis: Befall über die linke Flexur hinaus bis zur Pankolitis
- Endoskopische Einteilung bezüglich der entzündlichen Aktivität (Mayo-Klassifikation)6
- mild: gerötete Mukosa, geringe Blutungsneigung
- moderat: Erosionen, deutlich kontaktvulnerabel
- schwer: Ulzerationen, Spontanblutungen
Häufigkeit
- Inzidenz
- 3,0–3,9 pro 100.000 Personen in Deutschland7
- Prävalenz
- 160–250 pro 100.000 Personen
- Alter
- 25 % der Patient*innen sind bei Diagnosestellung jünger als 18 Jahre.7
Ätiologie und Pathogenese
- Aktuelles pathogenetisches Modell geht von genetisch suszeptiblen Individuen aus, die getriggert durch Umweltfaktoren eine CED mit Aktivierung des mukosalen Immunsystems im Darm entwickeln.8
Genetische Faktoren
- Verwandte 1. Grades von Patient*innen mit CU haben ein 10- bis 15-fach erhöhtes Risiko, das absolute Risiko liegt bei etwa 5 %.4
- Verschiedene Gene beteiligt10
Weitere Faktoren
- NSAR-Präparate
- Können zum Ausbruch oder zur Verschlechterung der Krankheit führen.10-11
- Rauchen
- Raucher*innen haben ein 42 % niedrigeres Risiko an CU zu erkranken.12
- Rauchen erhöht aber Risiko, an Morbus Crohn zu erkranken.13
- Stillen
- durch Stillen über mindestens 6 Monate signifikante Risikominderung des Kindes für späteres Auftreten einer CU14
- Appendizitis
- Mikrobiom
- Möglicherweise führt veränderte Zusammensetzung des Mikrobioms zu gestörter Interaktion und Barrierefunktion zwischen Immunsystem der Darmschleimhaut und dem Mikrobiom.9
- Gastroenteritis
- Bis zu 50 % aller Schübe treten bei Gastroenteritis mit nachweislich darmpathogenem Erreger auf.16
Pathogenese
- Mehrere Zytokine sind an einem entzündlichen Prozess nachweislich beteiligt.
- Dysbalance zwischen pro- und antiinflammatorischen Zytokinen 17
- Aktuelle Therapien greifen weiterhin primär in Effektorantwort des Immunsystems ein (z. B. TNF-alpha-Antikörper).17
- kausale Therapie aktuell nicht absehbar
ICPC-2
- D94 Chron. entzündl. Darmerkr./Colitis
ICD-10
- K51 Colitis ulcerosa
- K51.0 Ulzeröse (chronische) Pankolitis
- K51.2 Ulzeröse (chronische) Proktitis
- K51.3 Ulzeröse (chronische) Rektosigmoiditis
- K51.8 Sonstige Colitis ulcerosa
- K51.9 Colitis ulcerosa, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Klassische Anamnese mit blutigen Durchfällen
- Komplette körperliche Untersuchung inklusiver oraler und perianaler Inspektion
- Typische sonografische und endoskopische Befunde mit histologischem Nachweis
Differenzialdiagnosen
- IBS (Reizdarmsyndrom)
- Morbus Crohn
- Cave: Backwash-Ileitis – Entzündung des terminalen Ileums bei CU!
- vermutlich Induktion einer Entzündung des terminalen Ileums durch Rückfluss von Fäzes durch die Ileocoecal-Klappe
- erschwerte Differenzialdiagnose zwischen MC und CU
- Cave: Backwash-Ileitis – Entzündung des terminalen Ileums bei CU!
- Infektiöse Durchfallerkrankungen
- Clostrium-difficile-Kolitis
- Ischämische Kolitis
- Maligne Erkrankungen
Leitlinie: Diagnostik der Colitis ulcerosa4
- Die Diagnose einer Colitis ulcerosa basiert auf dem Nachweis einer charakteristischen Kombination von klinischen, laborchemischen, endoskopischen, radiologischen und pathomorphologischen Befunden.
- Einen Goldstandard für die Diagnose gibt es nicht.
- Anamnese
- Art und Beginn der Symptome
- kürzliche Reiseanamnese
- Nahrungsmittelunverträglichkeiten
- Kontakte mit infektiösen Durchfallerkrankungen
- Impfstatus
- Knapp die Hälfte der Patient*innen benötigt immunsuppressive Behandlung, sodass Erhebung und ggf. Vervollständigung des Impfstatus empfohlen werden.
- Raucheranamnese
- Familienanamnese
- Medikamentenanamnese
- insbesondere bezüglich Antibiotika und nichtsteroidaler Antirheumatika
- Fragen bezüglich extraintestinaler Manifestationen
- Mund, Haut, Augen, Gelenke, perianale Abszesse, Fisteln und Analfissuren
- Klinische Untersuchung
- komplette körperliche Untersuchung inkl. oraler und perianaler Inspektion
- rektale Untersuchung spätestens im Rahmen der Koloskopie
- Bei Kindern und Jugendlichen zusätzlich Entwicklung von Gewicht, Länge und Pubertätsstadium erfassen.
- Labor
- Entzündungsstatus (CRP+Leukos)*, Eisenhaushalt, Nierenfunktion, Transaminasen und Cholestaseparameter (Letzteres mit Hinblick auf mögliche PSC)
- mikrobiologische Stuhldiagnostik auf bakteriell infektiöse Erreger inklusive Clostridium-difficile-Toxin
- bei schwerem Schub und therapierefraktärem Verlauf bzw. vor Intensivierung einer immunsuppressiven Therapie inklusive Untersuchungen auf Zytomegalie-Virus (CMV)
- immunhistochemischer CMV-Nachweis aus endoskopisch gewonnenen Proben und/oder molekularbiologischer Nachweis aus Gewebeproben oder aus Vollblut
- fäkale Neutrophilenmarker (z. B. Calprotectin) zur Abgrenzung der Beschwerden gegenüber (funktioneller) Reizdarmsymptomatik
- Calprotectin-Wert dient auch zur Verlaufsdiagnostik.
- Endoskopie
- Ileokoloskopie mit Biopsien (mind. 2 pro Segment) aus terminalem Ileum und allen Kolonsegmenten unter Einschluss des Rektums
- Bei Zweifel bezüglich Diagnose sollte Endoskopie inkl. Histologiegewinnung im Intervall (z. B. nach 3–6 Monaten) wiederholt werden.
- Bei nicht eindeutig zu klassifizierender Kolitis sollte Diagnostik des oberen Gastrointestinaltrakts mittels Ösophagogastroduodenoskopie (mit Biopsien) und des mittleren Gastrointestinaltrakts mittels MRT des Dünndarms und/oder abdomineller Sonografie durchgeführt werden.
- Differenzialdiagnostik zu M. Crohn, der auch oberen GI-Trakt sowie Dünndarm befällt.*
- Sonografie
- Abdominelle Sonografie sollte Bestandteil der Diagnostik bei Erstdiagnose und in Verlaufsdiagnostik sowie beim schweren akuten Schub zur Erfassung von Komplikationen sein.
- z. B. Stenosen, Abszesse, Fisteln*
- Abdominelle Sonografie sollte Bestandteil der Diagnostik bei Erstdiagnose und in Verlaufsdiagnostik sowie beim schweren akuten Schub zur Erfassung von Komplikationen sein.
* Anmerkungen der Redaktion
Anamnese
- Klinisches Bild variiert stark.
- Leitsymptome sind blutige Durchfälle, Tenesmen und imperativer Stuhldrang.18
- Schweregrad der Symptome korreliert nur wenig mit Ausdehnung der Kolitis.
- Proktitis kann sehr starke Beschwerden verursachen, wohingegen ausgedehnte Kolitis nur leichte Symptome auslösen kann.
Extraintestinale Manifestationen
- Bei etwa 1/4 bis 1/3 der Patient*innen, u. a.:19-20
- Arthralgien
- Hautveränderungen: Erythema nodosum, Pyoderma gangraenosum
- Auge: Uveitis, Iritis
- primär sklerosierende Cholangitis
- Zudem sekundäre Komplikationen, wie Eisenmangel durch gestörte Resorption oder Osteoporose durch dauerhafte Steroidtherapie20
Klinische Untersuchung
- Remissionsphase
- meist kein wesentlicher Befund
- Akuter Schub
- Beurteilung des Allgemeinzustands
- Blutdruck, Temperatur, Puls und Ernährungszustand
- Zeichen für systemische Entzündung?
- Untersuchung des Abdomens
- abgeschwächte Darmgeräusche (paralytischer Ileus)
- abdominelle Abwehrspannung
- Peritonitiszeichen?
- Beurteilung des Allgemeinzustands
Ergänzende Untersuchungen in der Hausarztpraxis
- Calprotectin im Stuhl – bei entzündlichen Darmerkrankungen erhöht
- bei Erwachsenen Sensitivität von 93 % und Spezifität von 96 %, bei Kindern Spezifität niedriger (76 %)21
- Bei Verdacht auf entzündliche Darmerkrankung kann ein Screening mit fäkalem Calprotectin die Anzahl notwendiger Endoskopien um 67 % reduzieren.21
- sowohl bei Erwachsenen als auch Kindern kosteneffektiv22
- Werte unter 50 µg/g haben negativ prädiktiven Wert von 96 % bezüglich einer entzündlichen Darmerkrankung.23
- Abdominelle Sonografie
- mögliche Wandverdickungen sichtbar (Zeichen der Entzündung)
- Überblick über Krankheitsausdehnung
- Erhöhtes Risiko für Mangelernährung und Mikronährstoffmangel
- initiale Untersuchung auf Vorliegen eines Mangels an Mikronährstoffen empfohlen4
- Eisen, Vitamin D, Folsäure, Zink, Selen
- initiale Untersuchung auf Vorliegen eines Mangels an Mikronährstoffen empfohlen4
Diagnostik bei Spezialist*innen
Histopathologie
- Typische Befunde4
- diffuse panmukosale chronische Entzündung (Lymphozyten und Plasmazellen) in Kombination mit Störung der
Kryptenarchitektur/Kryptenatrophie - Plasmozytose im basalen Schleimhautstroma
- Paneth-Zell-Metaplasien distal der rechten Kolonflexur
- Reduktion der Zahl von Becherzellen bzw. des Muzingehalts der Einzelzellen
- kontinuierliche Verteilung der entzündlichen und strukturellen Schleimhautveränderungen, abnehmender Gradient von distal nach proximal
- diffuse panmukosale chronische Entzündung (Lymphozyten und Plasmazellen) in Kombination mit Störung der
- Histologische Beurteilung oft schwierig
- Bei 1/3 der Fälle ist eine sichere Differenzierung zwischen Colitis ulcerosa und Morbus Crohn, vor allem im Frühstadium, nicht möglich.24
Indikationen zur Überweisung/Krankenhauseinweisung
- Bei klinischem Verdacht auf Colitis ulcerosa Überweisung zur Endoskopie
- Patient*innen mit Colitis ulcerosa sollten von Gastroenterolog*innen in Zusammenarbeit mit Hausärzt*innen behandelt werden.
- Bei Anzeichen einer schweren/fulminanten Kolitis mit systemischer Beteiligung (Fieber) und/oder ausgeprägter Exsikkose oder Anämie durch hohe Stuhlfrequenz stationäre Einweisung
Checkliste zur Überweisung
Colitis ulcerosa
- Zweck der Überweisung
- Bestätigung der Diagnose? Therapie? Sonstiges?
- Anamnese
- Beginn und Dauer? Verlauf? Wurde die Diagnose bereits früher gestellt: wann, wie?
- Symptomatik? Diarrhö: Anzahl der Stuhlentleerungen am Tag? Darmblutungen? Schmerzen? Nächtliche Symptome? Gibt es Komplikationen? Allgemeine Symptome? Appetit? Gewichtsabnahme? Extraintestinale Beschwerden?
- Wird derzeitig behandelt: Medikamente? Wirkung/Erfolg?
- Beeinträchtigt die Erkrankung: die Ernährung? die Lebensqualität? die Arbeitsfähigkeit? das Wachstum bei Kindern?
- Klinische Untersuchung
- Allgemeinzustand der Patient*innen? Ernährungszustand? Fieber?
- Abdominalstatus?
- Extraintestinale Befunde?
- bei Kindern: Wachstum, Größe, Perzentil-Tabelle
- Ergänzende Untersuchungen
- Hb, BSG, CRP, Leukozyten, Leberparameter, fäkales Calprotectin, Blut im Stuhl?
- Bakteriologische Untersuchung des Stuhls?
- Evtl. Ergebnisse von früheren Untersuchungen: Endoskopie, Ultraschall, MRT?
Therapie
Therapieziele
- Rasches Erreichen und Bewahrung einer steroidfreien klinischen Remission4
Allgemeines zur Therapie
- Für Wahl der Therapie Schweregrad und Ausdehnung der Erkrankung ausschlaggebend.2,18,25
- individuell angepasste Therapie
- Leichte Fälle können in der Hausarztpraxis behandelt werden.
- Schwerere Fälle werden von Gastroenterolog*innen behandelt.
- Medikamentösen Therapiemöglichkeiten und -risiken sollten gegen operative Therapie abgewogen werden.4
- Proktokolektomie kurative Option, jedoch können postoperativ Komplikationen und weiterhin extraintestinale Manifestationen auftreten.
- Spezielle Diät oder Ernährungstherapie zur Remissionsinduktion oder -erhaltung sollte nicht empfohlen werden.4
- Schmerztherapie mit Paracetamol oder Novalgin
- NSAR und Opiode relativ kontraindiziert wegen mukosaschädigender bzw. motilitätsstörender Wirkung26
Medikamentöse Therapie
Proktitis
Leitlinie: Therapie der leichten bis mäßig aktiven Proktitis4
- Mesalazin ≥ 1.000 mg/d als Suppositorium
- Dosis mindestens 1 g, Vorteil für höhere Dosen nicht belegt
- Mesalazinschaum und Mesalazineinläufe äquivalente therapeutische Alternative
- Bei Versagen der Monotherapie sollte rektale Mesalazinanwendung entweder mit topischen Steroiden oder mit oraler Gabe von Mesalazin freisetzenden Präparaten kombiniert werden.
- z. B. 2 g Budesonid-Rektalschaum (topisches Steroid) oder 3 g Salofalk (orales Mesalazin) jeweils 1 x/d
- Therapiedauer
- Beträgt normalerweise 2–4 Wochen, teilweise auch 6 oder mehr Wochen.
- Bis zum Ansprechen der Therapie können bis zu 3–4 Wochen vergehen.
Leichte Formen der Kolitis
Leitlinie: Therapie der Linksseitenkolitis4
- Rektales Mesalazin in Form von Einläufen oder Schäumen (≥ 1 g/d) in Kombination mit oralen, Mesalazin freisetzenden Präparaten (≥ 3 g/d)
- Soll der topischen Steroidtherapie vorgezogen werden.
- Systemische Steroidtherapie (0,5–1 mg/kg KG/d Prednisolonäquivalent) bei Verschlechterung der klinischen Symptomatik unter o. g. Therapie oder bei Persistieren der Blutungen über mehr als 14 d.
- Bei unzureichendem Ansprechen oder Unverträglichkeit von 5-ASA-freisetzenden Präparaten sollte Budesonid MMX 9 mg/d eingesetzt werden.
- Orale 5-ASA-Präparate (Salofalk)
Mäßige schwere Kolitis
Leitlinie: Therapie der leichten bis mäßig schweren Pankolitis4
- Orales, Mesalazin freisetzendes Präparat in einer Dosierung ≥ 3 g/d in Kombination mit Mesalazineinläufen oder -schäumen
- Wenn Symptome nicht auf o. g. Therapie ansprechen oder bereits bei Diagnosestellung eine schwere Form vorliegt, soll systemische Steroidtherapie (0,5–1 mg/kg KG/d Prednisolonäquivalent) begonnen werden.
Schwere Kolitis
- Kriterien nach Truelove und Witts für schwere Kolitis:27
- schwere Diarrhöen mit ≥ 6 makroskopisch blutigen Stühlen pro Tag
- Fieber an wenigstens 2 von 4 Tagen
- Tachykardie und Anämie und
- BSG > 30 mm/h.
Leitlinie: Therapie der schweren Kolitis4
- Patient*innen mit schwerem akutem Schub sollten stationär behandelt werden.
- Behandlung sollte in enger Zusammenarbeit in interdisziplinärem Team inkl. erfahrene Abdominalchirurg*innen erfolgen.
- Systemische Steroidtherapie (1 mg/kg KG Prednisolonäquivalent pro Tag)
- Therapiedauer von mindestens 3 Wochen
- Bei unzureichendem Ansprechen auf systemische Steroide bzw. bei Kontraindikationen oder Intoleranzen, Einsatz von:
- TNF-Antikörpern
- Im Falle von Infliximab vorzugsweise Kombinationstherapie mit Thiopurin
- Tofacitinib – oder –
- Ustekinumab – oder –
- Ciclosporin A – oder –
- Tacrolimus.
- TNF-Antikörpern
- Weitere Maßnahmen im stationären Aufenthalt4
- parenteraler Flüssigkeits- und Elektrolytausgleich
- Absetzen aller motilitätshemmenden sowie sonstiger potenziell mukosaschädigender Medikamente
- Gefahr eines toxischen Megakolons
- Sigmoidoskopie, um Diagnose zu bestätigen und gleichzeitig Biopsien abzunehmen, die intestinale CMV-Reaktivierung ausschließen lassen.
- Ausschluss Infektion mit Clostridium difficile
- Thromboseprophylaxe
- Ernährungstherapie bei Patient*innen mit Malnutrition, vorzugsweise enteral
Fulminante Kolitis
Leitlinie: Therapie der fulminanten Kolitis4
- Patient*innen mit fulminanter Krankheitsaktivität, die refraktär auf Behandlung mit intravenösen Steroiden sind, sollten mit Infliximab (vorzugsweise als Kombinationstherapie mit einem Thiopurin) oder mit Ciclosporin A oder Tacrolimus behandelt werden.
- Proktokolektomie sollte mit in Erwägung gezogen werden.
- Proktokolektomie kann ebenso indiziert sein, wenn nach 4–7 Tagen keine Verbesserung des klinischen Zustands eintritt.
Immunmodulierende Medikamente
- Generelle Priorisierung bezüglich Wahl der geeigneten Therapie bei steroidrefraktärem Verlauf kann aufgrund fehlender Vergleichsstudien nicht gegeben werden.4
- Bei individueller Entscheidung zur Wahl der geeigneten Substanz spielt die persönliche Erfahrung mit de jeweiligen Substanzen eine wichtige Rolle.4
- Vor Beginn einer immunsuppressiven oder immunmodulatorischen Therapie sollten gezielte Anamnese, Röntgenaufnahme der Lunge und Interferon-gamma-Release-Assay (IGRA) erfolgen, um eine aktive oder latente Tuberkulose-Infektion auszuschließen.4
- Zudem sollte bei diesen Patient*innen Infektionsscreening auf Hepatitis B, Tuberkulose und EBV durchgeführt werden.4
- Vor Einleitung der Therapie Kontrolle des Impfstatus und ggf. Komplettierung, da unter Immunsuppression Lebendimpfungen kontraindiziert sind.4
- Patient*innen, die eine 3-fache immunsuppressive Therapie erhalten, sollten PJP-Prophylaxe erhalten.4
- Azathioprin oder 6-Mercaptopurin
- Hemmung der Nukleinsäure-Synthese
- Vermutlich vergleichbar gute klinische Wirksamkeit bei Patient*innen (NNT = 5), die auf Sulfasalazin/5-ASA nicht ansprechen oder es nicht vertragen.28
- zur Immunmodulation bei Patient*innen mit steroidrefraktärer Kolitis24
- Nur zur Langzeittherapie angewendet, da Wirkung langsam einsetzt (mehrere Wochen bis zu 6 Monaten).28-29
- EBV-seronegative erwachsene Patient*innen sollten möglichst nicht mit Thiopurinen behandelt werden.4
- Erhöhen das Lymphomrisiko, wobei das absolute Risiko bei unter 1 % über Zeitraum von 10 Jahren liegt.28,30
- Bei EBV-assoziierter lymphoproliferativer Erkrankung sollte immunmodulatorische Therapie mit Thiopurinen beendet werden.4
- mögliche Toxizität, z. B. Knochenmarkdepression (meist reversibel)
- Interaktion mit Allopurinol, das Abbau von Azathioprin hemmt und somit Risiko einer Knochenmarkdepression erhöht.31
- in diesem Fall Dosisreduktion von Allopurinol auf 1/4
- Ciclosporin A
- Tacrolimus
- Tofacitinib
- Januskinase-Inhibitor
- in 3 Studien Überlegenheit gegenüber Placebo bei schwerer Kolitis, jedoch bislang fehlende Vergleichsstudien mit etablierten Medikamenten4
- Laut arznei-telegramm erhöhtes Krebsrisiko, Thromboembolierisiko und vermehrt kardiovaskuläre Ereignisse sowie erhöhte Mortalität unter Tofacitinib32
- Hierzu exisiert auch ein Rote-Hand-Brief.
- Ustekinumab
- humaner monoklonaler Antikörper gegen Interleukin-12 und -23
- Wirksamkeit gegenüber Placebo in Induktions- und Erhaltungstherapie nachgewiesen33
- 8 Wochen nach Therapiebeginn etwa 15 % (vs. 5 % mit Placebo) in klinischer Remission
- Erhaltungstherapie alle 8 Wochen bei Patient*innen mit initialem Ansprechen führt bei 44 % der Patient*innen zu klinischer Remission in Woche 44 (vs. 24 % mit Placebo)
- möglicherweise Assoziation mit Malignomen (7 Fälle vs. 1 in Placebogruppe, davon 3 mit Nicht-Melanom-Hautkrebs)
- häufigste Nebenwirkungen (> 5 %) Nasopharyngitis und Kopfschmerzen34
- TNF-alpha-Blocker
- TNF-Antikörper wurden bisher nie in direkten Vergleichsstudien gegeneinander getestet.4
- In zwei Netzwerk-Metaanalysen erwies sich jedoch zumindest bei biologikanaiven Patient*innen Therapie mit Infliximab als am effektivsten, gefolgt von Golimumab und Adalimumab.4
- Infliximab wirkt bei mäßiger bis schwerer Colitis ulcerosa besser als Placebo.35
- Ca. 2 von 3 Patient*innen sprechen auf Therapie mit Infliximab an.36
- Bei hoher Krankheitsaktivität, negativem ANCA-Titer und vorhandenem IL23R-Gen (mit Colitis ulcerosa assoziiert) ist ein Ansprechen auf Infliximab wahrscheinlicher.37
- erhöhtes Risiko für Auftreten einer opportunistischen Infektion38
- Andere Biologika
- nach Versagen der konventionellen Therapie unter Vedolizumab (Ingetrin-Antagonist) bei 31,3 % der Patient*innen Remission in Woche 52 im Vergleich zu 22,5 % unter Adalimumab (TNF-alpha-Blocker)39
Weitere Therapien
- Fäkale Mikrobiota-Transplantation („Stuhltransplantation“) mit wöchentlichem Einlauf über 6 Wochen führte zur vollständigen Remission bei 24 % (9 von 38) der Patient*innen im Vergleich zu 5 % in Placebogruppe.40
- Weitere Studien sind vor standardmäßigem Einsatz notwendig.
Operative Therapie
- Indiziert bei therapierefraktärer Colitis ulcerosa, Wachstumsstörungen im Kindesalter oder maligner Entartung
Leitlinie: Operative Verfahren4
- Standardoperation: restaurative Proktokolektomie mit ileoanaler Anastomose
- in der Regel mit protektivem Ileostoma
- Einzeitige Operation sollte nur in selektionierten Einzelfällen erfolgen.
- J-Pouch sollte Rekonstruktion der Wahl sein.
- Pouchchirurgie sollte nur in dafür spezialisierten Zentren durchgeführt werden.
- Operation erzielt für Patient*innen bestmögliche Lebensqualität mit durchschnittlich 5–6 Stuhlgängen pro Tag und Erhalt der Kontinenz bei über 90 % der Patient*innen.
- Patient*innen mit medikamentös therapierefraktärem fulminantem Schub sollten dringlich operiert werden.
- Freie oder gedeckte Perforation sollte als Notfallindikation operiert werden.
- Bei Patientenwunsch kann elektive Operation erfolgen, wenn die Risiken der konservativen Behandlungsstrategien gegen die Risiken einer Operation abgewogen werden.
Notfalloperation
- Zahl der notfallchirurgischen Eingriffe bei akuter Colitis ulcerosa sinkt und beträgt heutzutage weniger als 10 % in den ersten 5 Jahren nach Diagnosestellung.41
Elektive Operation
- Präoperativ sollte bei schwerer Mangelernährung (BMI < 19, Gewichtsverlust von mehr als 10 % in den letzten 6 Monaten vor der Operation und/oder Serumalbumin < 30 g/l, deutliche Kachexie) vor elektiver Operation gezielte Ernährungstherapie für mindestens 7 Tage erfolgen.4
Ileoanale Anastomose
- Operationstechnik
- Rektum wird bis zum Beckenboden disseziert und dort abgesetzt.
- Bildung eines ca. 18 cm langes Ileum-J-Reservoir (Pouch) und Anastomose mit Anus.
- Die Anlage eines entlastenden doppelläufigen Ileostomas für ca. 3 Monate ist notwendig.
- Bei laparoskopischem Vorgehen seltener Wundproblemen bei gleichzeitig besserem kosmetischem Ergebnis als bei offener Operation. Nachteile sind längere Operationszeit, höhere Kosten und spezielle Ausbildung der Chirurg*innen.42
Rezidivprophylaxe
Leitlinie: Remissionserhaltung4
- 5-Aminosalizylate sollen primär als remissionserhaltende Therapie eingesetzt werden, wenn Ansprechen auf Aminosalizylate oder Steroide besteht.
- Applikationsart von 5-ASA soll sich nach dem Befallsmuster richten; so sollten die Proktitis und die linksseitige Kolitis primär rektal therapiert werden.
- Als Zweitlinien-Therapie soll Kombination von oralen und rektalen 5-ASA verwendet werden.
- Kortikosteroide sollen zur Remissionserhaltung nicht eingesetzt werden.
- Remissionserhaltende Therapie mit 5-ASA sollte bei Effektivität mindestens 2 Jahre durchgeführt werden.
- Apathogener Escherichia(E.)-coli-Stamm Nissle 1917 sollte als Alternative zu 5-Aminosalizylaten in Erwägung gezogen werden.
- Unter dem Aspekt der Karzinom-Prävention soll den Patient*innen eine Langzeittherapie mit 5-ASA angeboten werden.
- Bei erneuten Schüben soll remissionserhaltende Therapie eskaliert werden, wobei es verschiedene Möglichkeiten gibt:
- Dosiseskalation einer oralen/rektalen Kombinationstherapie mit Aminosalizylaten
- Anti-TNF-Therapie
- Therapie mit Vedolizumab
- Therapie mit Thiopurinen.
- Bei erfolgreichem Ansprechen auf die immunmodulierende Substanz im schweren Schub sollte die Therapie mit der entsprechenden Substanz fortgesetzt werden.
- Ausnahme Calcineurin-Inhibitoren, die wegen der starken Nebenwirkungen nach spätestens 6 Monaten auf Azathioprin/Mercaptopurin oder Vedolizumab umgestellt werden sollten.
- Aufgrund fehlender Evidenz kann keine Empfehlung zur Dauer einer Remissionserhaltung mit Thiopurinen, TNF-Antikörpern, Ustekinumab, Tofacitinib und Vedolizumab gemacht werden.
- langfristige Fortsetzung der Remissionserhaltung häufig notwendig
- Unbehandelt erleiden innerhalb 1 Jahres nach erreichter Remission 80 % der Patient*innen ein Rezidiv.
- Eine Behandlung mit 5-ASA-Präparaten senkt Rezidivhäufigkeit um etwa 16–50 %.43-44
Prävention
- Da kolitisassoziierte Kolonkarzinommortalität durch endoskopische Überwachung gesenkt werden kann, sollten angepasst an Risikostratifizierung Überwachungskoloskopien erfolgen.4
- Siehe Abschnitt Verlaufskontrolle.
- Erhöhtes Osteoporose-Risiko?
- mögliche Prädisposition für Osteoporose aufgrund der medikamentösen Behandlung mit Steroiden
- Empfehlung: körperliche Aktivität, Rauchverzicht, kein oder nur moderater Alkoholkonsum
- evtl. Substitution von Kalzium und Vitamin D
- ggf. Knochendichtemessung
Karzinompräventiver Effekt von 5-ASA
- Als Wirkungsmechanismen erhöhte Apoptose und reduzierte Zellproliferation vermutet
- dadurch Hemmung des Tumorwachstums bzw. Verhinderung einer Tumorentstehung45
- Medikamentöse Behandlung mit 5-ASA kann das kolorektale Karzinomrisiko vermutlich bis zu 80 % reduzieren.46-47
Empfehlungen für Patient*innen
- Keine zuverlässigen Belege, dass eine spezielle Ernährung vorbeugende oder therapeutische Wirkung hat.4
- Laut Metaanalyse von 2017 gibt es Hinweise, dass eine FODMAP-Diät Beschwerden lindern kann, wobei aber mehr Studien notwendig sind.48
- Isolierter Mikronährstoffmangel sollte durch entsprechende orale oder parenterale Supplemente behandelt werden.
- Generelle Vitamin- oder Spurenelementsubstitution ist nicht sinnvoll.4
- Über 50 % der Patient*innen mit CED in Deutschland nutzen komplementärmedizinische Therapien.49
- Jedoch sprechen 30–70 % der Patient*innen nicht mit ihren behandelnden Ärzt*innen über diese Maßnahmen.4
- Daher sollten Patient*innen aktiv über eine Anwendung komplementärer Heilmethoden befragt werden.4
- Idealerweise ist ein integratives Konzept anzustreben, bei dem konventionelle und komplementäre Therapieverfahren verschmelzen.4
Leitlinie: Komplementäre Therapieverfahren4
- Beurteilung naturheilkundlicher und komplementärmedizinischer Verfahren soll nach Kriterien einer evidenzbasierten Medizin erfolgen.
- Mögliche komplementäre Therapieoptionen sind:
- achtsamkeitsbasierte Verfahren zur Stressreduktion
- Yoga zur Verbesserung der Lebensqualität
- Akupunktur im leichten bis moderaten Schub
- Curcumin komplementär zu Aminosalizylat in Remissionsinduktion sowie -erhaltung
- Kombination aus Myrrhe, Kamillenblütenextrakt und Kaffeekohle in Remissionserhaltung
- Plantago ovata (Flohsamen) in einer remissionserhaltenden Behandlung.
- Weitere unkonventionelle Verfahren können aufgrund der unzureichenden Datenlage nicht empfohlen werden.
- Eisensubstitution kann ggf. erfoderlich sein.
- Orale Eisenpräparate können die Symptome verschlechtern.
- ggf. intravenöse Eisenzufuhr, vor allem bei akuten Schüben
- Loperamid
Verlauf, Komplikationen und Prognose
Verlauf
- Colitis ulcerosa verläuft meist schubweise, wobei chronisch-kontinuierliche und fulminante Verläufe nicht selten sind.
- Verlauf individuell sehr verschieden
- Akuter fulminanter Schub kann jederzeit auftreten.
- Nach erreichter Remission und abgeschlossener Behandlung mit Immunmodulatoren oder Biologika kommt es bei mindestens der Hälfte der Patient*innen zu Rückfall innerhalb von einigen Jahren.50
- Bei Rezidiv neigt die Krankheit meist zum selben Befall, kann aber auch nach oral voranschreiten.
- Änderung des Befalls im Kolon kann sowohl in den ersten Jahren nach Diagnosestellung als auch im späteren Krankheitsverlauf vorkommen.51
- Kinder mit Colitis ulcerosa haben oft schwerere Krankheitsverläufe.
- Bis zum 16. Lebensjahr erhöhtes Risiko, wegen eines Schubs stationär behandelt werden zu müssen und häufigeres Nicht-Ansprechen auf initiale Therapie im Vergleich zu Erwachsenen.4
Schwangerschaft
- Schwangerschaft trotz CU ist möglich.
- Möglichst in inaktiver Krankheitsphase planen.
- Optimale medikamentöse Behandlung ist wesentlich.
- Operative Eingriffe sollten vermieden werden.
- Bei Behandlung mit TNF-alpha-Antikörpern sollte Vakzinierung mit Lebendimpfstoffen (Rotavirus) bei Neugeborenen für 9 Monate vermieden werden, da Antikörper plazentagängig sind.4
Komplikationen
Fulminante Kolitis52
- Bei 5–15 % der Betroffenen kommt es zu fulminanter Kolitis.
- Entstehung in der Regel spontan, kann aber auch durch Infektionen, Medikamente (NSAR, Antibiotika) oder eine im schweren Schub durchgeführte Röntgenkontrastuntersuchung bzw. Koloskopie ausgelöst werden.
- Toxisches Megakolon aufgrund der Perforationsgefahr gefürchtet
- Systemische Steroidtherapie kann Symptome maskieren.
Postoperative Komplikationen nach Proktokolektomie
- Darmverschluss, Pouchitis, Strikturen, Pouchdysfunktionen und evtl. reduzierte Fertilität bei Frauen25,53
Kolorektales Karzinom
- Das Risiko für die Entstehung eines kolorektalen Karzinoms (KRK) ist erhöht.54-57
- Bei gleichzeitigem Vorliegen von PSC ist das Risiko für KRK nochmals deutlich erhöht.
- Behandlung mit 13–20 mg/kg KG Ursodesoxycholsäure pro Tag zur Prophylaxe eines kolitisassoziierten Karzinoms empfohlen4
- Mortalität aufgrund eines Karzinoms im Vergleich zur Normalbevölkerung vermutlich nicht erhöht52
- Prognostisch negative Faktoren
- Erkrankungsdauer über 10 Jahre
- früher Krankheitsbeginn
- ausgedehnte Kolitis
- familiäre Häufung von Kolorektalkarzinomen
- Patient*innen mit sklerosierender Cholangitis
- fehlende Langzeitbehandlung mit 5-ASA-Präparaten
Psychische Probleme
- Viele junge Patient*innen mit entzündlicher Darmerkrankung haben mit psychischen Problemen zu kämpfen.
- Auch Angehörige sind davon betroffen.
Prognose
- Aufgrund besserer medikamentöser und chirurgischer Therapiemöglichkeiten hat sich Prognose bei Colitis ulcerosa in letzten 20–30 Jahren verbessert.58
- Mithilfe der medikamentösen Therapie erreichen 2 von 3 Patient*innen klinische Remission, und 80 % der Patient*innen, die Behandlungsplan befolgen, verbleiben in der Remission.59
- Mortalität im Vergleich zur Gesamtbevölkerung nicht erhöht1
- Schub einer schweren CU hat eine mittlere Proktokolektomierate von 27 % und eine Mortalitätsrate von 1 %.60
- Todesursache in diesem Fall häufig toxisches Megakolon und daraus resultierenden Komplikationen wie z. B. Perforation
Verlaufskontrolle
- Regelmäßige Verlaufskontrollen – sowohl bei Hausärzt*in als auch bei Gastroenterolog*in
- u. a. Untersuchung auf Entzündungsaktivität (Stuhlfrequenz, Tenesmen, Darmsonografie, Calprotectin im Stuhl), Anämie, Ernährungsstatus und Mikronährstoffmangel sowie extraintestinale Manifestationen
- Intervalle hängen von Krankheitsaktivität, -ausbreitung und -dauer ab.
Karzinomüberwachung
Leitlinie: Überwachungsstrategie zur Früherkennung eines kolorektalen Karzinom bei Colitis ulcerosa4,61
- Erste Kontrollkoloskopie
- 6–8 Jahre nach Erstmanifestation
- bei allen Patient*innen unabhängig von der Krankheitsaktivität
- zur Erfassung des Befallsmusters und Festlegung der Überwachungsstrategie
- Entnahme von zumindest 2 Biopsien aus jedem Kolonsegment, zusätzlich zu gezielten Biopsien zur Erfassung des Befallsmusters
- Krankheitsaktivität auf Rektum beschränkt
- keine Aufnahme in regelmäßiges Koloskopieüberwachungsprogramm
- Zur Kontrolle und um Ausdehnung der Colitis ulcerosa nicht zu übersehen, kann alle 5 Jahre Koloskopiekontrolle sinnvoll sein.
- Bei Befall über das Rektum hinaus richtet sich das Kontrollintervall anhand der Risikostratifizierung:
- hohes Risiko (PSC, Stenose, intraepitheliale Neoplasie innerhalb der letzten 5 Jahre, ausgedehnte Kolitis mit ausgeprägter Entzündung oder erstgradige Verwandte mit kolorektalem Karzinom < 50 Jahre)
- jährlich
- intermediäres Risiko (Kolitis mit milder oder mäßiger Entzündung, viele Pseudopolypen, erstgradige Verwandte mit KRK ≥ 50 Jahre)
- alle 2–3 Jahre
- niedriges Risiko (es liegen keine der genannten Faktoren vor)
- alle 4 Jahre
- hohes Risiko (PSC, Stenose, intraepitheliale Neoplasie innerhalb der letzten 5 Jahre, ausgedehnte Kolitis mit ausgeprägter Entzündung oder erstgradige Verwandte mit kolorektalem Karzinom < 50 Jahre)
- Bei Z. n. Proktokolektomie
- bei Vorliegen von Risikofaktoren jährlich endoskopische Kontrolluntersuchung
- andernfalls bei Beschwerden oder spätestens alle 2 Jahre Pouchoskopie
Vorgehen während der COVID-19-Pandemie
Leitlinie: Betreuung von Patient*innen mit CED während der COVID-19-Pandemie62
- Patient*innen mit CED haben generell kein erhöhtes Risiko für Infektion mit SARS-CoV-2.
- Dennoch sollten Patient*innen sorgfältig individuelle Schutzmaßnahmen ergreifen.
- Patient*innen mit CED und immunsuppressiven Therapie haben ein erhöhtes Risiko für eine SARS-CoV-2-Infektion und sollten deshalb sorgfältig individuelle Schutzmaßnahmen umsetzen.
- Grad der Risikoerhöhung scheint dabei für einzelne Immunsuppressiva unterschiedlich zu sein.
- Patient*innen mit CED und SARS-CoV-2-Infektion haben unter bestimmten Bedingungen (Komorbiditäten/Risikofaktoren) ein erhöhtes Risiko für einen schweren Verlauf der COVID-Erkrankung.
- Diese Patient*innen sollten sorgfältig bezüglich einer raschen Verschlechterung ihrer Erkrankung überwacht werden.
- Patient*innen mit CED und immunsuppressiver Therapie haben generell kein erhöhtes Risiko für einen schweren Verlauf einer SARS-CoV-2-Infektion.
- Immunsuppressive Therapie sollte deshalb bei leichter bis moderater COVID-Erkrankung nicht reduziert werden.
- Ausnahme bildet eine längerdauernde Therapie mit systemischen Steroiden insbesondere in Dosierungen > 20 mg Prednisonäquivalent/d.
- Diese sollte daher möglichst vermieden oder soweit klinisch vertretbar reduziert und beendet werden.
- Während der Sars-CoV-2-Pandemie sollte eine Biologika-Therapie mit zu erwartendem raschen Wirkeintritt gegenüber einer hochdosierten systemischen Steroidtherapie im akuten Schub bevorzugt eingesetzt werden.
- Bei Patient*innen mit schwerer COVID-19-Erkrankung sollte die Therapie mit Thiopurinen, Methotrexat und Tofacitinib pausiert und nach Überwinden der Infektion wieder aufgenommen werden.
- Hospitalisierte Patient*innen mit CED und COVID-19-Erkrankung sollten mindestens prophylaktische Thromboseprophylaxe erhalten.
- Bei ambulanten COVID-19-erkrankten Patient*innen mit CED sollte entsprechend ihres individuellen Risikoprofils und ihrer Begleitmedikation die Entscheidung für eine Thromboseprophylaxe großzügig getroffen werden.
- Während der Pandemie sollten Patientenvorstellungen in Einrichtungen des Gesundheitswesens restriktiv erfolgen.
- CED-Sprechstunden sollten unter Berücksichtigung der Dringlichkeit der Vorstellung und unter Optimierung der Infektionsschutzmaßnahmen wie räumlicher Distanzierung und nach Ausnutzen von Möglichkeiten der Telemedizin fortgeführt werden.
Patienteninformationen
Patienteninformationen in Deximed
Patientenorganisationen
Illustrationen
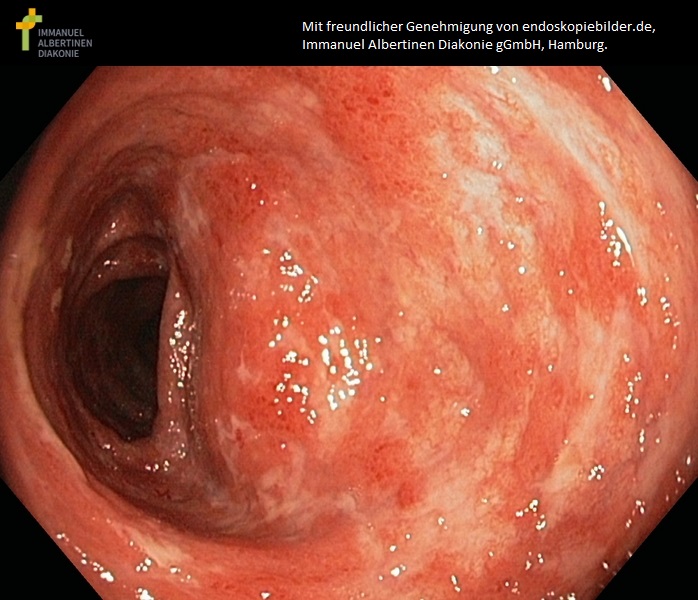
Colitis ulcerosa mit mittlerer Aktivität (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
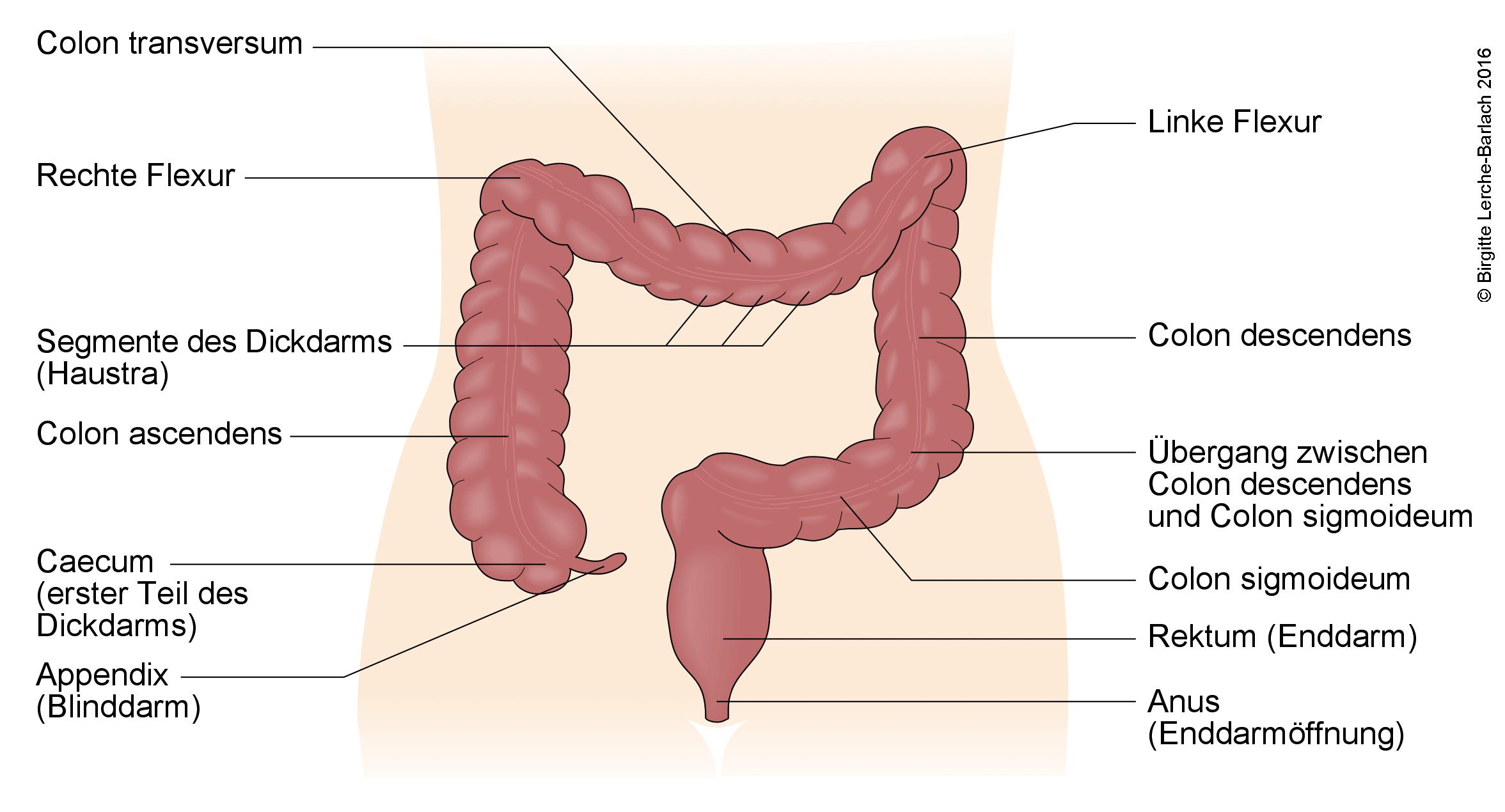
Dickdarm (Kolon), Übersicht
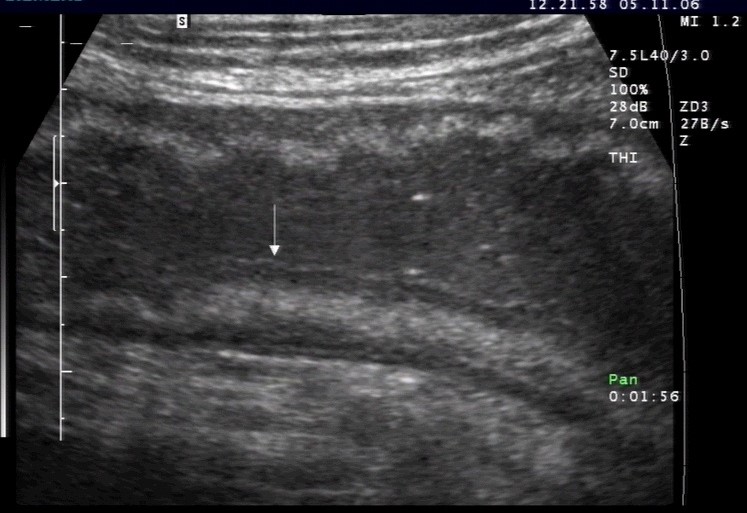
Verdickung der Darmwand im Rahmen eines akuten Schubes (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg).
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Colitis ulcerosa: Diagnostik und Therapie. AWMF-Leitlinie Nr. 021-009. S3, Stand 2021. www.awmf.org
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Addendum zu den S3-Leitlinien Morbus Crohn und Colitis ulcerosa: Betreuung von Patienten mit chronisch–entzündlichen Darmerkrankungen in der COVID-19 Pandemie – offene Fragen und Antworten. AWMF-Leitlinie Nr. 021-030, 021-009, 021-004. Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Kolorektales Karzinom. AWMF-Leitlinie Nr. 021-007OL. S3, Stand 2017. www.awmf.org
Literatur
- Basson MD. Ulcerative Colitis. Medscape, last updated Jul 26, 2019. emedicine.medscape.com
- Carter MJ, Lobo AJ, Travis SP, for the IBD Section, British Society of Gastroenterology. Guidelines for the management of inflammatory bowel disease in adults. Gut 2004; 53 (suppl 5): 1-16. www.ncbi.nlm.nih.gov
- Langan RC, Gotsch PB, Krafczyk MA. Ulcerative colitis: Diagnosis and treatment. Am Fam Physician 2007; 76: 1323-30. PubMed
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Colitis ulcerosa: Diagnostik und Therapie. Stand 2021. www.awmf.org
- Silverberg MS, Satsangi J, Ahmad T et al. Toward an Integrated Clinical, Molecular and Serological Classification of Inflammatory Bowel Disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19: 5-36. pubmed.ncbi.nlm.nih.gov
- Schroeder KW, Tremaine WJ, Ilstrup DM. Coated Oral 5-Aminosalicylic Acid Therapy for Mildly to Moderately Active Ulcerative Colitis. NEJM 1987; 317: 1625-9. www.nejm.org
- Däbritz J, Gerner P, Enninger A, et al. Chronisch-entzündliche Darmerkrankungen bei Kindern und Jugendlichen. Dtsch Arztebl Int 2017; 114: 331-8. pubmed.ncbi.nlm.nih.gov
- Fischer S, Rath T, Neurath MF. Chronisch-entzündliche Darmerkrankungen Morbus Crohn und Colitis ulcerosa. Der Internist 2018; 59 : 681–693. doi.org
- Becker C, Neurath MF, Wirtz S. The Intestinal Microbiota in Inflammatory Bowel Disease. ILAR J 2015; 56(2): 192-204. pubmed.ncbi.nlm.nih.gov
- Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002; 347: 417-29. PubMed
- Forrest K, Symmons D, Foster P. Systematic review: is ingestion of paracetamol or non-steroidal anti-inflammatory drugs associated with exacerbations of inflammatory bowel disease? Aliment Pharmacol Ther 2004; 20: 1035-43. PubMed
- Mahid SS,Minor KS,Soto RE et al. Smoking and Inflammatory Bowel Disease: A Meta-Analysis. Mayo Clin Proc 2006; 81(11): 1462-71. pubmed.ncbi.nlm.nih.gov
- Rath HC, Schultz M, Freitag R, et al. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect Immun 2001; 69: 2277-85. PubMed
- Kappelman MD, Bousvaros A. Nutritional concerns in pediatric inflammatory bowel disease patients. Mol Nutr Food Res 2008; 52: 867–874. pubmed.ncbi.nlm.nih.gov
- Frisch M, Pedersen BV, Andersson RE. Appendicitis, mesenteric lymphadenitis, and subsequent risk of ulcerative colitis: cohort studies in Sweden and Denmark. BMJ 2009; 338: b716. pubmed.ncbi.nlm.nih.gov
- Nayar M, Rhodes JM. Management of inflammatory bowel disease. Postgrad Med J 2004; 80: 206-13. PubMed
- Siegmund B. Pathogenese chronisch-entzündlicher Darmerkrankungen. Berlin, Heidelberg: Springer, 2020. link.springer.com
- Kornbluth A, Sachar DB, for the Practice Parameters Committee of the American College of Gastroenterology. Ulcerative colitis practice guidelines in adults (update): American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2004; 99: 1371-85. PubMed
- Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol 2006; 12: 4819-31. PubMed
- Ott C, Schölmerich J. Extraintestinal manifestations and complications in inflammatory bowel diseases. Nat Rev Gastroenterol Hepatol 2013; 10(10): 585-95. pubmed.ncbi.nlm.nih.gov
- van Rheenen PF, De Vijver EV, Fidler F. Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. BMJ 2010; 341: c3369. BMJ (DOI)
- Yang Z, Clark N, Park KT. Effectiveness and cost-effectiveness of measuring fecal calprotectin in diagnosis of inflammatory bowel disease in adults and children. Clin Gastroenterol Hepatol 2014; 12: 253-62. pmid:23883663 PubMed
- Turvill J. High negative predictive value of a normal faecal calprotectin in patients with symptomatic intestinal disease. Frontline Gastroenterology 2012; 3: 21-28. doi:10.1136/flgastro-2013-100429 www.ncbi.nlm.nih.gov
- Collins P, Rhodes J. Ulcerative colitis: diagnosis and management. BMJ 2006; 333: 340-3. PubMed
- Cima RR, Pemberton JH. Medical and surgical management of chronic ulcerative colitis. Arch Surg 2005; 140: 300-10. PubMed
- Whaley KG, Rosen MJ. Contemporary Medical Management of Acute Severe Ulcerative Colitis. Inflamm Bowel Dis 2019; 25(1): 56-66. pubmed.ncbi.nlm.nih.gov
- Truelove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955; 4947: 141-8. pubmed.ncbi.nlm.nih.gov
- Nielsen OH, Vainer B, Rask-Madsen J. Review article: the treatment of inflammatory bowel disease with 6-mercaptopurine or azathioprine. Aliment Pharmacol Ther 2001; 15: 1699-708. PubMed
- Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review. Gut 2002; 50: 485-9. www.ncbi.nlm.nih.gov
- Beaugerie L, Brousse N, Bouvier AM, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet 2009; 374: 1617-25. PubMed
- Fachinformation Azathioprin. Stand Juli 2016. Letzter Zugriff 24.05.2020. www.ratiopharm.de
- arznei-telegramm. ERHÖHTES KREBSRISIKO UNTER JAK-HEMMER TOFACITINIB (XELJANZ). a-t 2021; 52: 15-6. www.arznei-telegramm.de
- Sands BE, Sandborn WJ, Panaccione R, et al. Ustekinumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med 2019; 381(139): 1201-14. pubmed.ncbi.nlm.nih.gov
- Janssen. Fachinformation Stelara. Stand 2020. Letzter Zugriff 18.06.2021. s3.eu-central-1.amazonaws.com
- Wang Y, MacDonald JK, Benchimol EI, et al.. Type I interferons for induction of remission in ulcerative colitis. Cochrane Database of Systematic Reviews 2015. doi:10.1002/14651858.CD006790.pub3 DOI
- Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Eng J Med 2005; 353: 2462-76. New England Journal of Medicine
- Jürgens M, Laubender RP, Hartl F. Disease activity, ANCA, and IL23R genotype status determine early response to infliximab in patients with ulcerative colitis. Am J Gastroenterol 2010; 105: 1811-9. PubMed
- Ford AC, Peyrin-Biroulet L.. Opportunistic infections with anti-tumor necrosis factor-alpha therapy in inflammatory bowel disease: meta-analysis of randomized controlled trials. Am J Gastroenterol 2013; 108 (8): 1268-76. pmid:23649185 PubMed
- Sands BE, Peyrin-Biroulet L, Lotfus EV, et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis. NEJM 2019; 381: 1215-26. www.nejm.org
- Moayyedi P, Surette MG, Kim PT, et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial. Gastroenterology 2015; 149: 102-9. DOI:10.1053/j.gastro.2015.04.001 DOI
- Jahnsen J, Aadland E, Moum B, Schulz T, Sauar J, Lygren I et al. Inflammatory bowel disease, disease course and status 5 years after diagnosis. Gastroenterology 2000; 118 (suppl 2): A118. www.gastrojournal.org
- Bach SP, Mortensen NJM. Revolution and evolution: 30 years of ileoanal pouch surgery. Inflamm Bowel Dis 2006; 12: 131-45. PubMed
- Gisbert JP, Gomollon F, Mate J, Pajares JM. Role of 5-aminosalicylic acid (5-ASA) in treatment of inflammatory bowel disease. A systematic review. Dig Dis Sci 2002; 47: 471 - 88. PubMed
- Klotz U. The role of aminosalicylates at the beginning of the new millenium in the treatment of chronic inflammatory bowel disease. Eur J Clin Pharmacol 2000; 56: 353 - 62. PubMed
- Allgayer H, Kruis W. Aminosalicylates: potential antineoplastic actions in colon cancer prevention. Scand J Gastroenterol 2002; 38: 125 - 31. PubMed
- Eaden J, Abrams K, Ekbom A, Jackson E, Mayberry J. Colorectal cancer prevention in ulcerative colitis: a case-control study. Aliment Pharmacol Ther 2000; 14: 145 - 53. PubMed
- Bernstein CN, Eaden J, Steinhart AH, Munkholm P, Gordon P. Cancer prevention in inflammatory bowel diseases and the chemoprophylatic potential of 5-aminosalicylic acid. Inflamm Bowel Dis 2002; 8: 356 - 61. PubMed
- Zhan YL, Zhan YA, Dai SX. Is a low FODMAP diet beneficial for patients with inflammatory bowel disease? A meta-analysis and systematic review. Clin Nutr. 2017. pmid:28587774 PubMed
- Langhorst J, Anthonisen IB, Steder-Neukamm U et al. Amount of systemic steroid medication is a strong predictor for the use of complementary and alternative medicine in patients with inflammatory bowel disease: results from a German national survey. Inflamm Bowel Dis 2005; 11: 287–295. pubmed.ncbi.nlm.nih.gov
- Torres J, Boyapati RK, Kennedy NA, et al. Systematic Review of Effects of Withdrawal of Immunomodulators or Biologic Agents From Patients With Inflammatory Bowel Disease. Gastroenterology 2015; 149: 1716-30. pmid:26381892 PubMed
- Moum B, Ekbom A, Vatn M, Elgjo K. Change in the extent of colonoscopic and histological involvement in ulcerative colitis over time. Am J Gastroenterol 1999; 94: 1564-9. PubMed
- Hovde Ø, Småstuen MC, Høivik ML, et al. Mortality and causes of death in ulcerative colitis: Results from 20 years of follow-up in the IBSEN study. Inflamm Bowel Dis 2016; 22(1):141-145. pubmed.ncbi.nlm.nih.gov
- Olsen KØ, Joelsson M, Laurberg S et al. Fertility after ileal pouch-anal anastomosis in women with ulcerative colitis. Br J Surg 1999; 86: 493-5. PubMed
- Cvancarova M, Hovde O, Wanderaas M, et al. Do patients with longstanding IBD have higher cancer risk compared to the general population? Results from the IBSEN study. J Clin Oncol 2015; 33: Abstract 1573. meetinglibrary.asco.org
- Olén O, Erichsen R, Sachs MC, et al. Colorectal cancer in ulcerative colitis: a Scandinavian population-based cohort study. Lancet 2020. doi:10.1016/S0140-6736(19)32545-0. www.thelancet.com
- Collins PD, Mpofu C, Watson AJ, Rhodes JM. Strategies for detecting colon cancer and/or dysplasia in patients with inflammatory bowel disease. Cochrane Database Syst Rev, issue 2, 2006. www.ncbi.nlm.nih.gov
- Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48: 526-35. www.ncbi.nlm.nih.gov
- Sutherland LR. Maintenance therapy for inflammatory bowel disease: what really works. Can J Gastroenterol 1997; 11: 261-4. PubMed
- Kornbluth A, Marion JF, Salomon P, Janowitz HD. How effective is current medical therapy for severe ulcerative and Crohn's colitis? An analytic review of selected trials. J Clin Gastroenterol 1995; 20: 280-4. PubMed
- Turner D, Walsh CM, Steinhart AH et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroenterol Hepatol 2007; 5: 103-10. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Kolorektales Karzinom. Stand 2017. AWMF-Leitlinie Nr. 021-007OL www.awmf.org
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e.V. (DGVS). Addendum zu den S3-Leitlinien Morbus Crohn und Colitis ulcerosa: Betreuung von Patienten mit chronisch–entzündlichen Darmerkrankungen in der COVID-19 Pandemie – offene Fragen und Antworten. AWMF-Register-Nr. 021 – 030, 021 -009, 021-004. Stand 2020. www.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).