Allgemeine Informationen
Definition
DasCushing-Syndromentstehtistinfolgedefinierteinesalsdauerhaftpathologischer,erhöhtenendogenerGlukokortikoidspiegels.1teilweiseHyperkortisolismusmit variierend erhöhten Androgenmengendurch:1-2
Begriffserklärung1Das Cushing-Syndrom bezeichnet die klinischen Folgen eines chronischen Hyperkortisolismus.endogen ausgelöstexogen bei einer Langzeittherapie mit hohen Glukokortikoiddosen (iatrogen)
Das endogene Cushing-Syndrom wird unterteilt in:- ACTH-abhängige
(Form: autonome ACTH-ÜberproduktionProduktionhypophysmit sekundärodererhöhtemektopKortisolspiegel (M. Cushing, ca. 80 %)und - ACTH-unabhängige Form: autonome Kortisolproduktion der Nebennierenrinde (
NNR-Tumorca. 20 %)Formen.
- ACTH-abhängige
UnterAbzugrenzendem Morbus Cushing versteht manist dasendogene,deutlichhypothalamisch-hypophyshärufigereausgelöste ACTH-abhängigeiatrogene Cushing-Syndrom(„zentralerdurchCushing“)exogene Zufuhr von Glukokortikoiden zu therapeutischen Zwecken.
Häufigkeit
DieDas endogeneErkrankungCushing-Syndrom istselteneine seltene Erkrankung.- Inzidenz
etwaca. 0,2–35,0Fälle aufpro 1 Mio.EinwohnerPersonen/Jahr2
DieGeschlecht- Frauen
Hzu Mäufigkeitnnerndes exo- bzwca.iatrogenen3:13
- Frauen
- Alter
- Kann
Cushing-SyndromsprinzipiellsteigtinmitjedemerhöhtenAlterVerordungszahlen für Glukokortikoide und ist geradeauftreten. - bei
KindernErwachsenennichtamseltenhäufigsten im 5.–6. Lebensjahrzehnt13 HäufigkeitersterderGipfelSubtypenimbeim endogenen Cushing-SyndromKindesalter3-4Der Morbus Cushing, ein ACTH-produzierendes Hypophysenadenom, macht 65–70 % der Fälle aus.Ein ACTH-produzierender Tumor außerhalb der Hypophyse liegt in 10–15 % der Fälle vor.Die übrigen 15–20 % sind auf eine Erkrankung der Nebennierenrinde mit ACTH-unabhängiger Ursache zurückzuführen.
Geschlechterunterschied5Bei Frauen liegt das Prävalenzverhältnis zwischen hypophysärer und ektoper ACTH-Produktion bei etwa 10:1.Bei Männern liegt das Verhältnis bei etwa 3:1.
Ätiologie
und PathogeneseExogenACTH-abhängigeversusFormendogen(80 %)DerMikroadenomebeidesweitemHypophysenvorderlappenshäufigsteverursachenGrundca.für85–90ein Cushing-Syndrom sind iatrogene (exogene) Ursachen.Einnahme von Glukokortikoiden
Beim endogenen Cushing-Syndrom sind etwa 70% der ACTH-abhängigen Fälle.2-3- Selten
aufdurcheinenTumoren mit ektoper ACTH-produzierendenProduktionHypophysentumor(kleinzelligezurückzuführen.Bronchialkarzinome, Karzinoide)3 - Sehr selten: hypothalamische Überfunktion, ektope CRH-Sekretion
ZentraleACTH-unabhängigeversusFormperiphere(20Ursache%)ACTH-produzierenderAmHypophysentumor, der zu einer bilateralen Nebennierenrinden-Hyperplasie führt: zentrales Cushing-Syndrom = Morbus Cushing.Ektopische ACTH-Produktionhäufigsten durcheinenunilateralesnichthypophysären Tumor, der zu einer Nebennierenrinden-Hyperplasie führt.meist (Metastasen von)kortisolproduzierendesBronchial-NebennierenadenomoderPankreaskarzinomen
Primär Kortisol produzierender Nebennierenrindentumor
PathophysiologieBeim endogenen Cushing Syndrom lassen sich mehrere genetische Varianten nachweisen.62Da in verschiedenen Geweben Kortisolrezeptoren existieren,Seltener sinddie Symptome eines Hyperkortisolismus vielfältig.:2RezeptorenbilateraleanmakronoduläreneuronalenoderStrukturenmikronoduläreim Hirn erklären die neuropsychiatrischen Symptome.NebennierenhyperplasieRezeptoren in der Muskulatur vermitteln die Muskelatrophie und die proximale Myopathie.Verringerte Glukosetoleranz,kortisolproduzierendesDiabetes mellitusNebennierenkarzinomundHyperlipidämiesind auf Wirkungen des Kortisols in den Muskeln, im Fettgewebe und in der Leber zurückzuführen.
PigmentierungBei einer ACTH-Überproduktion kommt es zu einer vermehrten Hautpigmentierung, da ACTH und MSH (melanozytenstimulierendes Hormon) aus einem gemeinsamen Vorläuferprotein abgespalten werden, mit jedem vermehrt produzierten ACTH also auch ein MSH-Protein entsteht.Die Hyperpigmentierung fehlt, wenn Kortisol ACTH-unabhängig erhöht ist („weißer Cushing“).
Prädisponierende FaktorenPathogeneseBehandlungDurch exzessive ACTH-Stimulation oder autonome Produktion in der Nebenniere kommt es zum permanenten Kortisolüberschuss.- Die normale Variation des Kortisolspiegels im Tagesverlauf ist aufgehoben.5
- Die CRH-Produktion im Hypothalamus wird durch negatives Feedback inhibiert, während eine autonome ACTH-Produktion der Hypophyse kaum inhibiert wird.5
- Symptome und Komorbiditäten sind mit
Glukokortikoidendem(iatrogenermetabolischen Syndrom sowie der katabolen Stoffwechsellage bei Patient*innen mit Cushing)-Syndrom assoziiert.2
ICPC-2
- T99 Endo./metab./ernäh. Erkrank., andere
ICD-10
- E24 Cushing-Syndrom
- E24.0 Hypophysäres Cushing-Syndrom
- E24.1 Nelson-Tumor
- E24.2 Arzneimittelinduziertes Cushing-Syndrom
- E24.3 Ektopisches ACTH-Syndrom
- E24.4 Alkoholinduziertes Pseudo-Cushing-Syndrom
- E24.8 Sonstiges Cushing-Syndrom
- E24.9 Cushing-Syndrom, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
EsKlinischersindV.zweia.Fragenaufzudieklären:Liegt ein Cushing-Syndrom vor?ErkrankungUmSicherungwelchenderTypDiagnose durch laborchemische Tests- Bildgebung (erst nach biochemischer Sicherung der Diagnose)2
Differenzialdiagnosen
- Wichtigste Differenzialdiagnose des Cushing-Syndroms
handeltistesdassich?metabolischeBestehtSyndrom mit Adipositas, arterieller Hypertonie und Typ-2-Diabetes.3 - Es gibt eine
ACTHVielzahl an Differenzialdiagnosen zu den einzelnen Symptomen des Cushing-abhängige oder eine ACTH-unabhängige Ursache?Syndroms.2
- Kann
Funktioneller Hyperkortisolismus
BeimEine Reihe von Erkrankungen und Umständen kann zu erhöhten Plasma-Kortisolspiegeln führen, ohne dass ein endogenes Cushing-Syndromistbestehtdas(funktionellerfreieHyperkortisolismus).6- Physischer
KortisolStress- intensive sportliche Belastung
- Operationen, Trauma
- Malnutrition
- Schwangerschaft
- Mentaler Stress
- Drogen, Alkohol, Entzug
- schwere Depression
- Anorexia nervosa
- Hospitalisationen
- Metabolische Abnormalitäten
- schlecht kontrollierter Diabetes mellitus
- schwere Adipositas, viszerale Adipositas
- hypothalamische Amenorrhö
- polyzystisches Ovarialsyndrom
- erhö
hthtes kortisolbindendes Globulin
Anamnese
- Die Krankheitsentwicklung verläuft meist schleichend.
KortisolZwischenkannSymptombeginn und Diagnosestellung vergehen im Mittel 2–3 Jahre.Serum5, imSpeichelund im24-Stunden-Urinbestimmt werden.KortisolImhatVordergrundeinederzirkadianevonRhythmikPatient*innenmitgeäußertenphysiologischBeschwerden stehen höheren Werten am Morgen als am Abend.äufig:3AngabeVeränderungen desAbnahmezeitpunktes!äußeren Erscheinungsbildes und des Habitus- Der Vergleich mit älteren Fotos kann hilfreich sein.6
evtlDysregulationen der Körperfunktionen (z.ErmittlungB.des Tagesprofils mit Abnahme 8.00Amenorrhö,12.00Libido- und18.00 UhrBeim Cushing-Syndrom ist die zirkadiane Rhythmik aufgehobenPotenzverlust,allerdingsdepressiveauchVerstimmung,beiMuskel-anderenoderschweren Erkrankungen und unter starkem StressKnochenschmerzen).
Stressfreie Blutabnahme anstreben!
Symptome1-3
BeiGewichtszunahme- Fatigue
- Schlafstörungen
- Haarverlust
- Rücken-
unklaremundBefundKnochenschmerzen - Muskelschwäche
- Hyperpigmentierungen
nach der Blutabnahme(Gelenke,kannNarben,einperioral,Suppressionstestbukkale Schleimhaut) - Wundheilungsstörungen
- Neigung zu Ekchymosen, Hämatomen
- Zyklusunregelmäßigkeiten, Amenorrhö
- Libidoverlust
- Potenzverlust
- St. n. Fraktur (
Dexamethason-KurztestOsteoporose) 7Depression,durchgeführt werden.AngststörungTagSteht1:klinisch8.00nichtUhrseltenKortisolimbasalVordergrund(Serum), 23undUhristEinnahmedahervonnicht2zumg DexamethasonTag 2: 8.00 Uhr erneute Kortisolbestimmung (Serum): normalerweise Suppression Kortisol unter 3 µg/dl (0,1 µmol/l)Ein negativer Test (ausbleibende Suppression, Kortisol > 3 µg/dl (> 0,1 µmol/l)) spricht für ein Cushing-Syndrom.
Sollte auch der Dexamethason-Kurztest uneindeutig ausfallen, schließt sich ein Langtest (meist unter stationunterschären Bedingungen) antzen.7
adrenales Cushing-Syndrom = ACTH deutlich supprimiertnichtadrenales Cushing-Syndrom = ACTH erhStöht
unter stationären BedingungenCRH stimuliert die ACTH-SyntheseAnstieg ACTH bei Hypophysenadenomfehlender Anstieg bei:ektoper ACTH-Synthese (ACTH erhöht ohne Ansprechen auf CRH)Kortisolproduktion in der NNR (ACTH supprimiert und nicht stimulierbar)
Differenzialdiagnosen
Verschiedene Ursachen des Syndromsiatrogenes Cushing-Syndromhypophysäres Cushing-SyndromNebennierenrindenadenomadrenokortikales Karzinomektopische ACTH-Produktion
Begleitende ErkrankungenAdipositas
Pseudo-Syndrome
Neben dem Cushing-Syndrom können auch andere Erkrankungen zu einem Hyperkortisolismus führen.Bei Pseudo-Cushing-Syndromen sind die Kortisolwerte in der Regel nur leicht erhöht.Die Symptome sind weniger stark ausgeprägt als beim Cushing-Syndrom.3StressEin erhöhter Kortisolspiegel bei großem physischem Stress, etwa bei schwerwiegender Erkrankung, ist normal.Auch psychischer Stress undDepressionenkönnen zu erhöhten Kortisolwerten führen.
Veränderter TagesrhythmusEin veränderter Tagesrhythmus, etwa infolge von Schichtarbeit, kann ebenfalls zu einem erhöhten Kortisolspiegel führen.
Weitere mögliche Ursachen für einen erhöhten Kortisolspiegel sind schweresÜbergewichtundchronischer Alkoholismus.
Anamnese
Es gibt große Schwankungen in der Symptomatik des Cushing-Syndroms.8Die Entwicklung des Hyperkortisolismus verläuft oft schleichend.Das Alter der Patienten sowie die Schwere und die Dauer des Bestehens des Hyperkortisolismus spielen bei der Ausprägung der Symptome eine große Rolle.9Da in verschiedenen Geweben Kortisolrezeptoren existieren, sind die Symptome vielfältig.
Bei Erwachsenen
Das Cushing-Syndrom ruft Symptome hervor, die auf die Wirkung eines oder mehrerer der HormoneKortisol, Androgene und/oder Aldosteron zurückzuführen sind.Bei einer ACTH-Überproduktion kommt es zur NNR-Hyperplasie und vermehrter Produktion aller NNR-Hormone.Beim kortisolproduzierenden NNR-Tumor stehen die Wirkungen des Kortisols im Vordergrund.
Gesteigerter Appetit, Gewichtszunahme und StammfettsuchtHirsutismusBeim ACTH-abhängigen Cushing-Syndrom ist bei Frauen der Androgenspiegel häufig erhöht, und die Betroffenen können einen Hirsutismus entwickeln.Bei der Virilisierung von Frauen ist auch ein Nebennierenrindenkarzinom in Betracht zu ziehen.
Hautblutungen (Blutungsneigung)Atrophische Haut, StriaeProximale Myopathie, MuskelschwächeOsteoporose: HäufigeRückenschmerzen, können ein frühes Anzeichen des Cushing-Syndroms sein.ErhöhteErmüdbarkeitTherapieresistenteHypertonieAmenorrhöund verringerte Fertilität10, häufigpolyzystisches Ovarialsyndrom(PCO)11InfektanfälligkeitBei mehr als der Hälfte der Betroffenen neuropsychiatrische Probleme, insbesondereDepression12Herabgesetzte LibidoundImpotenzEin erhöhter Kortisolspiegel kann zu hypogonadotropemHypogonadismusführen, wobei bei Männern die Testosteronproduktion herabgesetzt ist und bei Frauen ein erniedrigter Östrogenspiegel vorliegt.
Bei Kindern
Die häufigsten Symptome bei Kindern sind:1GewichtszunahmeStammfettsucht, Striae, Vermehrung des Unterhautfettgewebes in Gesicht und Nackenreduziertes Längenwachstumverzögerte Pubertät
Klinische Untersuchung
HäufigArterielle(bei mehr als 2/3)8HypertonieStammfettsuchtrundesRotes, gerundetes GesichtWangenrötungStammbetonte FettsuchtDiabetesSupraklavikuläremellitusoder verringerte GlukosetoleranzFettpolstergonadaleStiernacken- Dünne
DysfunktionHaut - Livide Striae
- Hirsutismus
, - Akne
Hypertonie
Verbreitet (bei etwa 1/3 bis 2/3)proximaleProximale Muskelschwäche(und Striae) als spezifischstes Anzeichen des Cushing-Syndromsatrophische Haut mit verlangsamter Wundheilung, verringerter Widerstandsfähigkeit und Neigung zu blauen Flecken, StriaeDepressionund affektive LabilitätOsteoporose
Weniger verbreitet (bei weniger als 1/3)ÖdemePolydipsie,PolyuriePilzinfektionenHyperpigmentierung (nur bei erhöhtem ACTH-Spiegel)Gesichtsfeldausfall bei hypophysärem Tumor?
Laborwerte
Allgemeines
NormalerweiseErgänzendeist der Kortisolspiegel direkt vor dem Aufwachen in den frühen Morgenstunden am höchsten und unmittelbar nach Mitternacht am niedrigsten.Abweichungen von dieser Tagesrhythmik sind bei Patienten mit dem Cushing-Syndrom häufig und stellen oft die erste nachweisbare biochemische Veränderung dar.Zu Beginn können die morgendlichen Kortisolwerte noch normal sein und sollten bei klinischem Verdacht auf ein Cushing-Syndrom mit dem abendlichen Kortisolspiegel verglichen werden, ggf. Serum-Tagesprofil erstellen (8.00/12.00/18.00 Uhr).Die Diagnostik erfolgtUntersuchungen in derRegelhausärztlichenalsPraxis- Ein
StufendiagnostikScreeningmitkannmehrerenimTestshausärztlichenzurBereichSicherungdurchgeführtder Diagnose und zur Lokalisation der Ursachewerden.8
KortisolbestimmungIndikation zum Screening- Es
sindsollteninsbesonderenurfolgende Untersuchungen indiziert:13Kortisol imSerumoderSpeichel,Patient*innen mitUhzeitangabeeinerund/oderhohenalsklinischenTagesprofilKortisolspiegel im24A-Stundenpriori-Urin(ambulant schwerer durchführbar)Dexamethason-Kurztest
Anhand dieser initialen Tests kann der Großteil der Betroffenen identifiziert werden, sie sind mitunter jedoch auch bei Gesunden positiv.Kortisol im SerumIm ambulanten Bereich am leichtesten durchführbar.Erlaubt eine Orientierung.Sensitiver ist das Tagesprofil (8–12–18 Uhr).Stressfreie Blutabnahme anstreben.Bei der Messung im Serum wird das Ergebnis durch die Menge des kortisolbindenden Globulins beeinflusst (ist u. a. bei Schwangerschaft und Einnahmeoraler Kontrazeptivaerhöht).Medikamente wie Phenytoin, Carbamazepin und Glitazone steigern die Verstoffwechselung von Dexamethason und können zu falsch positiven Ergebnissen führen.
Kortisol im SpeichelDie Patienten erhalten ein Reagenzglas und einen kleinen Schwamm, den sie in den Mund nehmen und in das Reagenzglas geben, wenn er sich mit Speichel vollgesogen hat.Die Konzentration des Kortisols im Speichel gibt Aufschluss über das freie Kortisol im Plasma.Zusätzliche Informationen finden Sie im PatientenartikelKortisol, Speicheltest.
Kortisol im 24-Stunden-UrinIm Gegensatz zu Messungen des Kortisols im Blut wird das Ergebnis hierbei nicht durch das kortisolbindende Globulin beeinflusst.Leicht erhöhte Kortisolwerte im 24-Stunden-Urin sind bei Stress, akuter Krankheit, Pseudo-Cushing-Syndromen undpolyzystischem Ovarialsyndromhäufig.
Dexamethason-Kurztest7,14-15Unabhängig vom Gewicht nimmt die Patientin/der Patient um 23 Uhr 2 mg Dexamethason ein, und am nächsten Morgen um 8 Uhr wird dasKortisol im Serumbestimmt.Tag 1: 8.00 Uhr Kortisol basal (Serum), 23 Uhr Einnahme von 2 mg DexamethasonTag 2: 8.00 Uhr erneute Kortisolbestimmung (Serum): normalerweise Suppression Kortisol unter 3 µg/dl (0,1 µmol/l)Ein negativer Test (ausbleibende Suppression, Kortisol > 3 µg/dl (> 0,1 µmol/l) sprichtWahrscheinlichkeit für ein Cushing-Syndrom getestet werden.
Die Kortisol-Eigenproduktion wird bei gesunden Personen durch die Zufuhr von Glukokortikoiden gehemmt.6- Ein
KortisolwertScreeningvonwirdunterempfohlen<bei:2- Patient*innen
3mitµg/dlmehreren(<Symptomen,0,1dieµmol/l) spricht gegen und > 3 µg/dl (> 0,1 µmol/l)charakteristisch füreineneinHyperkortisolismusCushing-Syndrom sind.
- Patient*innen
- Patient*innen
Untersuchungen- mit Hypophysen- oder Nebennieren-Inzidentalom
ElektrolyteK+Patient*innen mit für ihr Alter untypischen Symptomen (häufigz.verringert),B. OsteoporoseCa++(häufigbeierhöhtjungen Menschen)
- Verbreitete Erkrankungen wie
BlutzuckerAdipositas,evtl.DiabetesGlukosebelastungDabeimellitus
zeigt sich u. U. eine gestörte Glukosetoleranz und evtl. eineoderHyperglykämiearterielle Hypertonie rechtfertigen ein Screening nicht.6
Weitere- Ein
Untersuchungen beim Endokrinologen
Besteht eine ACTH-abhängige oder eine ACTH-unabhängige Ursache?Laborscreening
ACTH- Kein Goldstandardtest, Anamnese und Klinik sind unverzichtbare Bestandteile der diagnostischen Endbeurteilung.6
adrenalesEin Screening sollte auf keinen Fall lediglich über die Bestimmung eines basalen Kortisols oder ACTH durchgeführt werden.3- Vor einem Laborscreening sollte eine exogene Kortikosteroidzufuhr ausgeschlossen sein (inkl. Quellen wie intraartikuläre Injektionen, Crèmes oder pflanzliche/nicht verschreibungspflichtige Arzneimittel v. a. aus dem asiatischen Raum)6
- Zur Erhärtung des V. a. ein Cushing-Syndrom
=kannACTHgemäßdeutlichLeitliniensupprimiert nichtadrenaleseinerCushing-Syndromder=3ACTHfolgendenerhöhtProbenahmeTests verwendet werden:2,6,9DasImACTHhausärztlichenwirdBereichnormalerweisesollteschnellbeidurchklinischemPlasmaproteasenVerdachtabgebaut.alsUmerstediesUntersuchungzueinverhindern1-mg-Dexamethason-Hemmtest durchgeführt werden,mussdadas Blutdieser ingekühlten Röhrchen mit EDTA gesammelt, in Eiswasser gegeben und schnell an das Labor weitergeleitet werden.
InterpretationderWerteACTH-WertePraxismorgenshäufigvonamunterpraktikabelsten2 pmol/l bei gleichzeitig erhöhten Kortisolwerten deuten auf eine ACTH-unabhängige Ursache, also ein adrenales Cushing-Syndrom hinist.WerteBeivonpositivemüber 4 pmol/l deuten auf eine ACTH-abhängige Ursache bzw. ein nichtadrenales Cushing-Syndrom hin.Der Bereich von 2–4 pmol/l bildet eine Grauzone, bei der ein erneuter Test und evtl. ein CRH-Test (Corticotropin-releasing Hormone) erforderlich seinBefund kann weitere Diagnostik mit den anderen Verfahren erfolgen oder die Überweisung an Endokrinolog*innen erwogen werden.3-42
Niedrig dosierter Dexamethason-Langtest (High Dose)7Hemmtest
- Sensitivität 99 %, Spezifität 91 %
- Durchführung9
-
- abendliche Einnahme von 1 mg Dexamethason
abendszwischenan23.00mehrerenundTagen24.00hintereinanderUhr inBlutentnahmederzurRegelKortisolbestimmungunterzwischenstation8.00 und 9.00 Uhr- beim Cushing-Syndrom fehlende Suppression von Kortisol, normalerweise Suppression auf < 1,8 μg/dl (50 nmol/l)
- abendliche Einnahme von 1 mg Dexamethason
Bestimmung von Kortisol im 24-Stunden-Sammelurin
- Sensitivitä
rentBedingungen94 %, Spezifität 93 % - Zur Durchführung siehe auch Artikel Kortisol, Urin.
Messung des spätabendlichen Speichelkortisols
- Sensitivität 99 %, Spezifität 93 %
- Zur Durchführung siehe auch Artikel Kortisol, Speichel.
Allgemeines Labor
- Blutbild
CRHGlukose, HbA1c- Nachweis eines Diabetes mellitus
Diagnostik bei Spezialist*innen
- Nach Nachweis eines Hyperkortisolismus werden weitere Laboruntersuchungen und bildgebende Verfahren zur Lokalisationsdiagnostik durchgeführt.
Labor
- Im nächsten Schritt wird die Frage nach ACTH-
Testabhängigem bzw. ACTH-unabhängigem Hyperkortisolismus beantwortet.12,6BeimACTH hoch/normal: hypophysäre/ektope Ursache- Zwischen hypophysärer und ektoper Ursache kann mit dem CRH-Test weiter differenziert werden
der(beiPatientin/demunklarenPatientenFällenintravenös 100 µg CRH verabreichtevtl. CRH stimuliert dieACTH-Synthese.SowohlMessungdermitDexamethasonSinus-Suppressionstest als auch der CRHpetrosus-Test basieren darauf, dass die ACTH-Produktion außerhalb der Hypophyse in der Regel autonomer ist als beim Morbus Cushing.Anstieg ACTHKatheter nach CRH-Gabebei Hypophysenadenom (ACTH-Regulation durch CRH erhalten)fehlender Anstieg bei:ektoper ACTH-Synthese (ACTH erhöht mit vermindertem Ansprechen auf CRH)Kortisolproduktion in der NNR (ACTH supprimiert und nicht stimulierbar).
- ACTH tief/nicht messbar: adrenale Ursache
- Zwischen hypophysärer und ektoper Ursache kann mit dem CRH-Test weiter differenziert werden
Bildgebung
ErstBildgebung erst nachAbschlussSicherung derendokrinologischen Diagnostik!Meist kann erst die Kombination aus Labordiagnostik und Bildgebung die Ursache eines Hyperkortisolismus identifizieren, insbesondere da es nicht selten auffällige bildgebende Befunde sowohl an Hypophyse als auch an NNR gibt, die jedoch nicht krankheitsauslösend sind.
Bildgebende Diagnostik der HypophyseBei ACTH-Überproduktion und Verdacht auf einen M. Cushing (zentralen Cushing)MRT der HypophyseCave: Bei etwa 10 % der gesunden Erwachsenen lässt sich durch moderne, hochauflösende MRT-Untersuchungen ein Mikroadenom der Hypophyse nachweisen. Die meisten davon bilden jedoch keine Hormone.Diagnose16Beim Morbus Cushing ist bei bis zu 70 % der Patienten ein Adenom nachweisbar.Bei dem größten Teil davon handelt es sich um Mikroadenome mit einem max. Durchmesser von weniger als 10 mm.
Bildgebung der Nebennierenbei hohen Kortisol- und erniedrigten ACTH-WertenSonografie und MRT/CT der NebennierenDadurch lässt sich zwischenNebennierentumorenund einer Nebennieren-Hyperplasie unterscheiden.Meist handelt es sich um Adenome, vor allem bei Erwachsenen; Karzinome sind im Kindesalter 3-mal häufiger als Adenome.SonderfälleIn seltenen Fällen kommt es zu einer bilateralen Hyperplasie, die ACTH-unabhängig auftritt.17Bei Patienten mit zentralem M. Cushing finden sich nicht selten große Hyperplasieknoten in einer oder in beiden Nebennieren (makronoduläre Nebennierenrinden-Hyperplasie), die an Adenome erinnern können. Daher nie eine Nebennierenoperation aufgrund des CT-morphologischen Befundes ohne vorherige Funktionsdiagnostik durchführen!1
Octreotid-Szintigrafie/Somatostatin-Rezeptor-Szintigrafie: bei ektopen ACTH-produzierenden Tumoren182inadrenalesKombinationCushing-Syndrom: CT der Nebennieren ohne Kontrastmittel- hypophysäres Cushing-Syndrom (Morbus Cushing): Dünnschicht-MRT der Hypophyse mit
MRTKontrastmittel - ektopes
oderCushing-Syndrom: CTdesvonHalsesHals,BrustkorbsThorax undAbdomensAbdomen sowie ggf. weitere funktionelle Bildgebung (DOTATATE-PET, FDG-PET, DOPA-PET)
Auch eine PET kann bei schwieriger Diagnostik in Betracht gezogen werden.19Evtl. bilaterale Katheterisierung des Sinus petrosus inferior (mit CRH-Test) in speziellen neuro(chirurgischen) Zentren
Indikationen zur Überweisung
- Bei Verdacht auf ein endogenes Cushing-Syndrom kann
diedasBasisdiagnostikBasis-Screening in derHausarztpraxishausärztlichen Praxis erfolgen. DieBeiweitereerhärtetemDiagnostikVerdacht solltebeidiederÜberweisungFachärztin/demanFacharztEndokrinolog*innenfür Endokrinologie bzwerfolgen.stationär durchgeführt werden.6
Checkliste zur ÜberweisungCushing-SyndromZweck der ÜberweisungBestätigende Diagnostik? Therapie? Sonstiges?
AnamneseBeginn und Dauer? Primär oder sekundär? Progression?Gewichtszunahme?Fettleibigkeit?Hirsutismus? Hautblutungen? Striae? Sonstiges?Sonstige relevante Krankheiten?Regelmäßige Medikamente?
Klinische UntersuchungStammfettsucht? Vollmondgesicht? Hirsutismus?Hypertonie? Sonstiges?
Ergänzende Untersuchungen
Therapie
Therapieziele
- Ziele der Behandlung sind:11
- Normalisierung des Hormonspiegels bzw. Hemmung der Kortisolwirkung zur Eliminierung der Krankheitszeichen und -symptome
VerhinderungBehandlung vonKomplikationenKomorbiditäten
Allgemeines zur Therapie
Der MorbusDas Cushing-Syndromwirdistprimgrundsärtzlichoperativtherapiebedürftig, unbehandeltbehandeltbeträgt die 5-Jahres-Mortalität ca. 50 %.203- Nach einer gezielten biochemischen und radiologischen Diagnostik/Lokalisation ist eine kausale Behandlung möglich.6
- Primäre Therapieoption ist die operative Entfernung hormonproduzierender Raumforderungen (hypophysär, adrenal, ektop).
- Bei inoperablen Patient*innen bestehen medikamentöse Optionen zur Krankheitskontrolle.
Operative Therapie
- Option für alle Subtypen mit lebenslanger Remission ist die bilaterale Adrenalektomie, aufgrund der verursachten Nebenniereninsuffizienz mit dem Risiko lebensbedrohlicher Addison-Krisen ist dies aber im Allgemeinen keine Primärtherapie.2
Zentrales Cushing-Syndrom (M. Cushing)
- Therapie der Wahl ist die transsphenoidale Resektion des Hypophysenadenoms.11
- Die Operation sollte in einem hierfür spezialisierten Zentrum durchgeführt werden.2
- Ergänzende Strahlentherapie nur bei Persistenz der Erkrankung nach Operation oder bei einem Rezidiv.2
Adrenales Cushing-Syndrom
- Bei singulärem benignem Tumor Adrenalektomie der entsprechenden Seite11
- Bei bilateraler mikronodulärer Hyperplasie erfolgt die beidseitige Adrenalektomie.11
- Bei häufig mild verlaufender bilateraler makronodulärer Hyperplasie kann im Sinne eines Debulkings eine einseitige Adrenalektomie erfolgen oder versuchsweise eine medikamentöse Therapie.2
- Bei Nebennierenrindenkarzinomen ist eine En-bloc-Resektion des Tumors mit umgebendem retroperitonealem Fettgewebe die Standardtherapie.12
Ektopes Cushing-Syndrom
- Bei ektopem Cushing-Syndrom möglichst Resektion des jeweiligen Tumors2
- Bei dem seltenen okkulten Cushing-Syndrom (keine Tumordarstellung in der Bildgebung) medikamentöser Therapieversuch oder bilaterale Adrenalektomie2
Medikamentöse Therapie
- Pharmakologische Therapie bei inoperablen Patient*innen oder ektopen Quellen im Rahmen eines malignen Tumors6
- Durch neue Wirkstoffe zunehmende Bedeutung in den vergangenen Jahren2
- Zur Verfügung stehen:5-6
transsphenoidale Operation der Hypophyseevtl. Strahlentherapie der Hypophyse (auch z. B. per „Gamma-Knife“)ggf. bilaterale Adrenalektomie
Bei einem Nebennierenadenom erfolgt eine laparoskopische einseitige Adrenalektomie.Bei ektopischer ACTH-Produktion erfolgt eine zielgerichtete Operation, Chemotherapie oder Strahlentherapie, je nach zugrunde liegendem Tumor.
SomatostatinagonistMorbus CushingDiePasireotidPrimärbehandlung(beimdes Morbuszentralen Cushingbesteht in einer transsphenoidalen Operation der Hypophyse (80 % Erfolgsquote-Syndrom).Ziel ist es, das ACTH-produzierende Adenom zu entfernen, ohne dass die Patientin/der Patient anschließend an einerHypophyseninsuffizienzleidet.Nach der Operation benötigen die Patienten eine Substitutionsbehandlung mit Kortison, anfänglich meist in hohen Dosen, bis die Eigenproduktion wieder ausreicht.Tritt nach der Hypophysenoperation ein Rezidiv auf, sind eine erneute Operation, eine konventionelle Strahlentherapie, eine Behandlung der Hypophyse per Gamma-Knife oder eine bilaterale Adrenalektomie in Betracht zu ziehen.21-23Cave: Entwicklung eines Nelson-Tumors: Nach bilateraler Adrenalektomie kommt es durch fehlende Rückkopplungsmechanismen zu einer unkontrollierten ACTH-Sekretion mit Ausbildung eines rasch wachsenden ACTH-produzierenden Hypophysenadenoms!113
Bei bestehenden Kontraindikationen gegen die Operation, adjuvant, bei Rezidiven oder im Vorfeld der Operation20SteroidogeneseinhibitorenBehandlungMetyrapon,mitKetoconazol,Somatostatinanaloga wie z. B. Pasireotid24ggf. in Kombination mit CabergolinMitotanBehandlungEtomidatmiti.Steroidsyntheseblockernv.(wiezuretwaraschenKetoconazolKontrolle bei schwerem Verlauf2514oder Metyrapon) in Betracht zu ziehen.Als Glukokortikoidrezeptorblocker kann Mifepriston eingesetzt werden.
Die medikamentöse Therapie ist aufgrund der Nebenwirkungen häufig nur eingeschränkt möglich und sollte spezialisierten Abteilungen vorbehalten bleiben.
GlukokortikoidrezeptorblockerEktopes ACTH-SyndromIn der Regel lässt sich der Primärtumor nicht radikal entfernen, sodass eine begleitende Therapie erfolgen muss:Entweder eine bilaterale Adrenalektomieoder eine Behandlung mit Steroidsynthesehemmern (vorzugsweise Ketoconazol + Octreotid), um die Überproduktion der Nebennierenrinde zu begrenzen.Mifepriston
Nebennierenadenom oder KarzinomIn diesem Fall ist eine Operation indiziert.einseitige Adrenalektomie
Bei metastasierendenTumoren der Nebennierenrindewird versucht, einen palliativen, die steroidsynthesehemmenden Effekt zu erzielen.
Verlauf, Komplikationen und Prognose
Komplikationen und Komorbiditäten
- Auch nach erfolgreicher Therapie können Komorbiditäten anhalten oder sind nur langsam reversibel.2
- arterielle Hypertonie (58–85 %)
- partiell reversibel (Persistenz in 24–56 % der Fälle)
- Diabetes mellitus (80–90 % gestörte Glukosetoleranz, 20 % Diabetes mellitus)
- partiell reversibel
- Dyslipidämie (40–70 %)
- Persistenz eines abnormen Lipidprofils in ca. 1/3 der Fälle
- Myopathie (40–70 % periphere Muskelschwäche)
- persistierend für mehrere Jahre
- Depression (50–80 %)
- häufig Persistenz
- Osteoporose (22–57 %)
- Normalisierung der Knochendichte innerhalb von Jahren möglich
- Hyperkoagulabilität (erhöhtes Risiko für thrombotische und thrombembolische Ereignisse)
- persistierend über Jahre trotz Remission
- Infektanfälligkeit (erhöhtes Risiko für schwere Infektionen)
- reversibel
Verlauf und Prognose
- Unbehandelt verläuft die Cushing-Erkrankung
unabhängig von der Ursacheletal mitzunehmenderkardiovaskulärenSymptomatikKomplikationen als häufigster Todesursache.
KomplikationenPrognose- Unbehandelt
ergibtbeträgtsichdieeineMortalitätungünstigeca.Prognose50mit%geringernachLebenserwartung5 Jahren.3
- Nach vollständiger Entfernung eines Tumors günstige Prognose3
- Morbidität und Mortalität sind vorwiegend mit den durch den Glukokortikoidexzess verursachten Komorbiditäten/Komplikationen assoziiert.15
- Bei Patient*innen mit Morbus Cushing treten relativ häufig Rezidive auf (15–50 %).2
Postoperativer Verlauf und Verlaufskontrolle
- In der
TherapieRegel kommt eshäufigzuRezidiveneiner tertiären (hypothalamischen) Nebenniereninsuffizienz,weshalbdahereineobligateengmaschigepostoperativeKontrolleBehandlungdurchmiteinen Endokrinologen/endokrinologische Abteilung erfolgen sollteHydrokortison. Bei Hypophysentumoren, die ACTH produzieren (M. Cushing)2HierzuristVermeidungeineeinestranssphenoidalepostoperativenOperationGlukokortikoidentzugssynsdroms (Fatigue, Depression, Myopathie, Gelenkbeschwerden) passager erhöhte Hydrokortisondosis vor derHypophyseErhaltungsdosisinvonvielen20–25Fmg/d2
- Langfristig Verlaufskontrollen 1-mal jä
llenhrlichkurativ und führt zu einem Rückgang der sekundhinsichtlich:2- Rezidiv
- Komorbiditä
ren Nebennierenrindenhyperplasieten.
Verlaufskontrolle
DieBeiVerlaufskontrollePatient*innensolltenachdurchtranssphenoidalereineHypophysenoperationFachärztin/einenUntersuchungFacharztderfürHypophysenfunktionEndokrinologieunderfolgenggf. Substitution2AufgrundSchulung derhohenPatient*innenRezidivneigungzumnachUmgangdermitTherapieNebennierenkrisen,sindAushändigungregelmäßigevonKontrollenNotfallausweisgeboten.und Notfallset2
Patienteninformationen
Patienteninformation in Deximed
Illustrationen
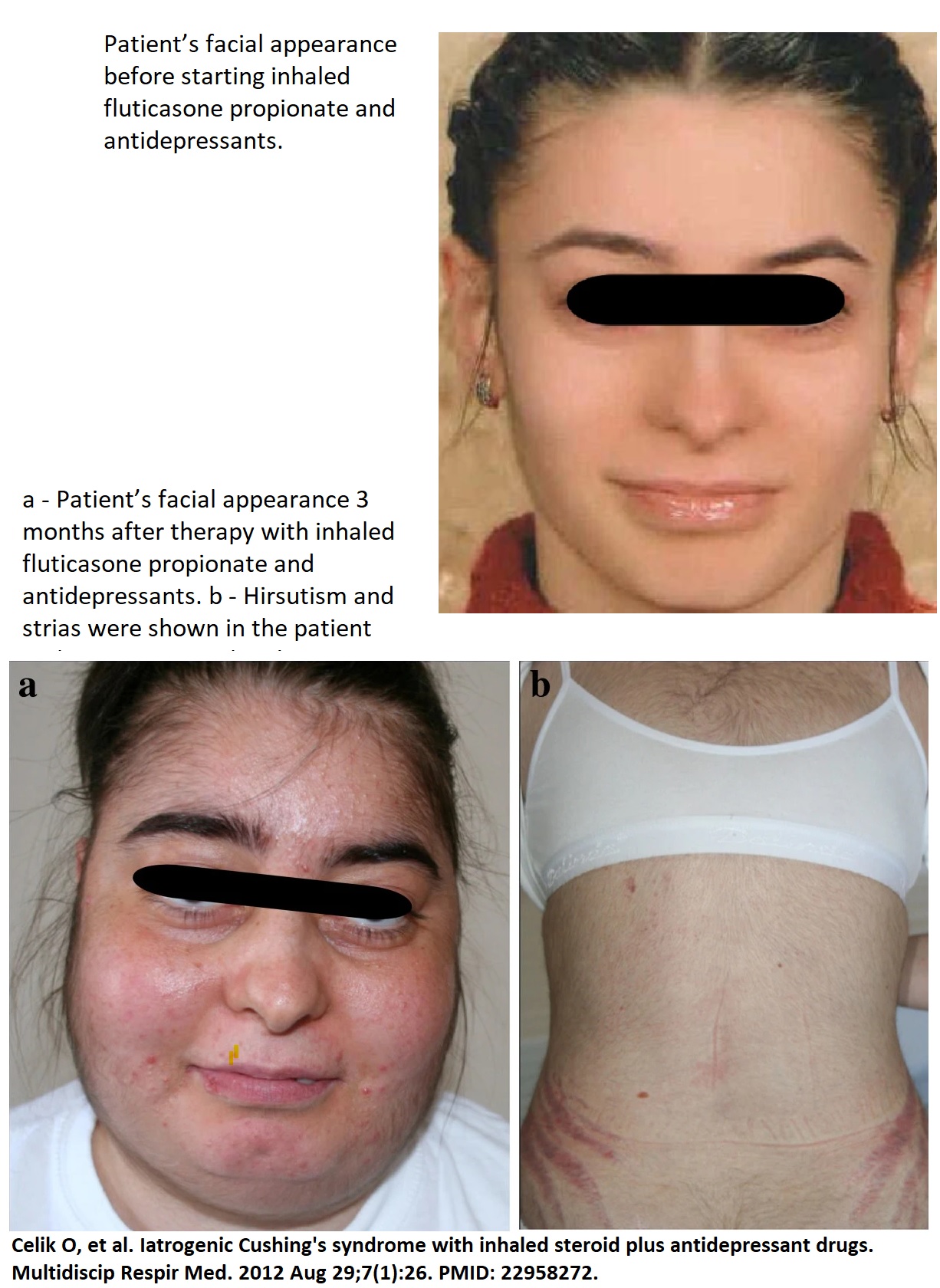
Iatrogenes Cushing-Syndrom mit typischen Symptomen: rotes gerundetes Gesicht, Akne, Hirsutismus, Striae

Niere und Nebenniere
Quellen
Leitlinien
- Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie. Operative Therapie von Nebennierentumoren. AWMF-Leitlinie Nr. 088-008. S2k, Stand 2017. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin, Deutsche Gesellschaft für Endokrinologie. Cushing-Syndrom. AWMF-Leitlinie Nr. 027-033. S1, Stand 2010. www.awmf.org
- Pituitary Society. Consensus on diagnosis and management of Cushing's disease: a guideline update. Stand 2021. www.eprints.whiterose.ac
- Endocrine Society. Treatment of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2015. www.endocrine.org
- Endocrine Society. Diagnosis of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2008. www.endocrine.org
Literatur
- Niemann L. Recent Updates on the Diagnosis and Management of Cushing’s Syndrome. Endocrin Metab 2018; 33: 139-146. doi:10.3803/EnM.2018.33.2.139 DOI
- Vogel F, Braun L, Reincke M. Morbidität und Mortalität beim Cushing-Syndrom. Internist 2022; 63: 34-42. doi:10.1007/s00108-021-01222-7 DOI
- Fornara P, Kawan F. Hyperkortisolismus (Cushing-Syndrom, Morbus Cushing, adrenales Cushing-Syndrom). eMedpedia, publiziert 07.01.15, Zugriff 15.08.22. www.springermedizin.de
- Deutsche Gesellschaft für Kinder- und Jugendmedizin, Deutsche Gesellschaft für Endokrinologie. Cushing-Syndrom. AWMF-Leitlinie Nr. 027-033, Stand 2010. www.awmf.org
Newell-PriceLonserJ, Bertagna X, Grossman ABR, NiemanLKL, Oldfield E. Cushing'’ssyndromedisease: pathobiology, diagnosis, and management.LancetJ2006Neurosurg 2017;367126:1605404-17417. doi:10.3171/2016.1.JNS152119PubMedDOINewellGasser M, Meier C. Cushing-PriceSyndrom 2016. Swiss Med Forum 2016; 16: 515-519. doi:10.4414/smf.2016.02681 DOI- Schilling T, Räpple D, Heymer J,
Trainer P, Besser Met al.TheEndokrinologischediagnosis and differential diagnosis of Cushing's syndrome and pseudo-Cushing's statesNotfälle.EndocrNotfallRevRettungsmed19982021;1924:64783-72.PubMed Orth DN. Cushing's syndrome. N Engl J Med 1995; 332: 791-803.New England Journal of MedicineNewell-Price J, Morris DG, Drake WM et al. Optimal response criteria for the human CRH test in the differential diagnosis of ACTH-dependent Cushing's syndrome. J Clin Endocrinol Metab 2002; 87: 1640-5.PubMedLacroix A, Feelders RA, Stratakis CA, Nieman LK. Cushing's syndrome. Lancet 2015; 386: 913-2797. doi:10.10161007/S0140s10049-6736(14)61375020-1Laborlexikon. Dexamethason Kurztest. Stand 201600766-9www.laborlexikon.deDOIBoscaro M, BarzonKirk L,FalloHashFR, Katner H, et al. Cushing'ssyndrome. The Lancet 2001; 357Disease:783-91.ClinicalThe LancetKatayama M, Nomura K, Ujihara M et al. Age-dependent decline in cortisol levelsManifestations andclinicalDiagnosticmanifestations in patients with ACTH-independent Cushing's syndromeEvaluation.ClinAmEndocrinolFam(Oxf) 1998; 49: 311-6.PubMedLado-Abeal J, Rodriguez-Arnao J, Newell-Price JD et al. Menstrual abnormalities in women with Cushing's disease are correlated with hypercortisolemia rather than raised circulating androgen levels. J Clin Endocrinol Metab 1998; 83: 3083-8.PubMedKaltsas GA, Korbonits M, Isidori AM et al. How common are polycystic ovaries and the polycystic ovarian syndrome in women with Cushing's syndrome? Clin Endocrinol (Oxf)Physician 2000;5362:4931119-5001127.PubMedKelly WFwww.Psychiatric aspects of Cushing's syndromeaafp.QJM 1996; 89: 543-51.PubMedorg- Endocrine Society. Diagnosis of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2008 www.endocrine.org
PasqualiStiefelhagenR, Ambrosi B, Armanini D et alP.CortisolDasandCushing-SyndromACTHistresponseeinetodiagnostischeoralFallgrube.dexamethasoneInfoinDiabetologieobesity2017;and effects of sex, body fat distribution, and dexamethasone concentrations11:a dose-response study47.J Clin Endocrinol Metab 2002; 87doi:16610.1007/s15034-75.017-1224-xPubMedFindling JW, Raff H, Aron DC. The low-dose dexamethasone suppression test: A reevaluation in patients with Cushing's syndrome. J Clin Endocrinol Metab 2004; 89: 1222-6.PubMedHall WA, Luciano MG, Doppman JL et al. Pituitary magnetic resonance imaging in normal human volunteers: Occult adenomas in the general population. Ann Intern Med 1994; 120: 817-20.Annals of Internal MedicineLacroix A, Ndiaye N, Tremblay J et al. Ectopic and abnormal hormone receptors in adrenal Cushing's syndrome. Endocr Rev 2001; 22: 75-110.PubMedTorpy DJ, Chen CC, Mullen N et al. Lack of utility of (111)In-pentetreotide scintigraphy in localizing ectopic ACTH producing tumors: follow-up of 18 patients. J Clin Endocrinol Metab 1999; 84: 1186-92.PubMedSundin A, Eriksson B, Bergstrom M et al. PET in the diagnosis of neuroendocrine tumors. Ann N Y Acad Sci 2004; 1014: 246-57.PubMedDOI- Endocrine Society. Treatment of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2015. www.endocrine.org
NagesserDeutscheSK,GesellschaftvanfürSetersAllgemein-AP,undKievit J et alViszeralchirurgie.Long-termOperativeresultsTherapieofvontotal adrenalectomy for Cushing's diseaseNebennierentumoren.WorldAWMF-LeitlinieJNr.Surg088-008.2000;Stand24: 108-132017.PubMedEstrada J, Boronat M, Mielgo M et alwww.The long-term outcome of pituitary irradiation after unsuccessful transsphenoidal surgery in Cushing's diseaseawmf.N Engl J Med 1997; 336: 172-7.New England Journal of MedicineSheehan JM, Vance ML, Sheehan JP et al. Radiosurgery for Cushing's disease after failed transsphenoidal surgery. J Neurosurg 2000; 93: 738-42.PubMedorg- Vetter Ch. Deutsches Ärzteblatt. Cushing-Syndrom: Somatostatin-Analogon drosselt die ACTH-Sekretion. Dtsch Arztebl 2012; 109
(12): A-587/ B-510 / C-506. www.aerzteblatt.de DeutschesFleseriuÄrzteblattM, Auchus R, Bancos I et al.EMAConsensus on diagnosis and management of Cushing's disease:GrünesaLichtguidelinefürupdate.KetoconazolThebeiLancet Diabetes & Endocrinology 2021;9:847-875. eprints.whiterose.ac.uk- Nguyen H. Endogenous Cushing
-SyndromSyndrome.SeptemberMedscape,2014updated Mar 13, 2020. Zugriff 17.08.22.wwwemedicine.aerzteblattmedscape.decom
AutorenAutor*innen
CarolineMichaelBeierHandke, Prof. Dr. med.,FachärztinFacharzt fürAllgemeinmedizinInnere Medizin,HamburgKardiologie und Intensivmedizin, FreiburgTerjeDieJohannessen,ursprünglicheprofessorVersionidiesesallmennmedisin,ArtikelsInstituttbasiertforaufsamfunnsmedisinskeeinemfag,entsprechendenNorgesArtikeltekniskim norwegischen hausärztlichen Online-naturvitenskapeligeHandbuchuniversitet,NorskTrondheimCeciliaElektroniskMattsson, docent och överläkare, Endokrinsektionen, Medicinkliniken, Norrlands universitetssjukhus, UmeLegehåndbok (MedibasNEL, https://legehandboka.no/)John Cooper, spesialist i allmennmedisin og indremedisin, Medisinsk avdeling, Sentralsjukehuset i Rogaland, StavangerStein Vaaler, overlege dr.med., Senter for Klinisk Epidemiologi, Rikshospitalet, Universitetet i Oslo