Allgemeine Informationen
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-6
Definition
- Benigne Prostatahyperplasie
- Bezeichnet die histologische Veränderung, die einer benignen Prostatavergrößerung zugrunde liegt.
- Die Vergrößerung eines Organs beruht bei der Hyperplasie auf einer Vermehrung von Zellen, anders als bei einer Hypertrophie, bei der sie auf einer Vergrößerung der Zellen beruht.
- Kann zur Harnwegsobstruktion führen.
- Benigne Prostataobstruktion
- Ist ein klinischer Zustand mit Abflussbehinderung der Urethra an ihrem Durchtritt durch die Prostata.
- Die variable Trias aus Symptomatik, Prostatavolumen und Blasenauslassobstruktion bei Männern wird heute im Deutschen als „benignes Prostatasyndrom“ (BPS) bezeichnet.
- Im englischsprachigen Raum wird die Erkrankung als „Lower Urinary Tract Symptoms (LUTS) Suggestive of BPH“ bezeichnet, d. h. als „Symptomatik des unteren Harntrakts, die auf eine BPH hinweist“.
Häufigkeit
- Eine histologisch benigne Prostatahyperplasie (BPH) kommt vor bei:
- 10 % der 40-jährigen
- 50 % der 50-jährigen
- 70–80 % der über 60-jährigen Männer.
- Eine BPH mit mittleren bis schweren Symptomen (gemessen an einem PSS-Wert > 7) betrifft:
- ca. 20 % der deutschen Männer zwischen 50 und 60 Jahren
- ca. 40 % der deutschen Männer über 70 Jahre.
- Was einem mäßigen Anstieg zu Häufigkeitsangaben von früher bzw. aus anderen Ländern entspricht.
- Ca. 25 % der Männer mit symptomatischer BPH bedürfen einer Behandlung, die den Harnabfluss verbessert.
Ätiologie und Pathogenese
- Eine Hyperplasie der Prostata beruht wahrscheinlich auf altersbedingten Veränderungen der Hormonproduktion und Veränderungen im Verhältnis zwischen Androgenen und Östrogen im Körper.
- Die Bildung von Testosteron und dessen Metabolit Dihydrotestosteron ist eine unabdingbare Voraussetzung für die Entstehung einer BPH.7
- Männer, die kein Testosteron bilden, bekommen keine BPH.
- Die Testosteron-Serumspiegel korrelieren nicht mit Inzidenz und Verlauf der BPH.
- Möglicherweise spielt Dihydrotestosteron, das in der Prostata aus Testosteron gebildet wird, eine zentrale Rolle bei der BPH-Entstehung.
- Der Pathomechanismus auf endokriner Ebene ist noch nicht vollständig aufgeklärt.
- Die gutartige Prostatavergrößerung ist schwer vom Größenwachstum der physiologischen Alterung abzugrenzen.
- Die Bildung von Testosteron und dessen Metabolit Dihydrotestosteron ist eine unabdingbare Voraussetzung für die Entstehung einer BPH.7
- Die Symptome sind auf eine Dysfunktion im Zusammenspiel zwischen Blase, Blasenhals, Prostata und Urethra infolge einer gutartigen Prostatavergrößerung zurückzuführen.
- Es besteht keine starke Korrelation zwischen den Symptomen und der Größe der Prostata.
- Bei zunehmender Obstruktion kann die Blase den verstärkten Widerstand noch eine Zeit lang durch einen erhöhten Detrusordruck kompensieren.
- Später ist die Blase dazu nicht mehr imstande, und es kommt zu Restharn und Harnverhalt. Dies kann Harnwegsinfekte begünstigen.
- Eine BPH-bedingte Abflussstörung kann die Zunahme altersbedingter Blasenfunktionsstörungen beschleunigen.
- Eine Detrusorhyperaktivität trägt bei einem Teil der Patienten zu einer verstärkten Miktionsfrequenz bei.8
- Detrusorhyperaktivität liegt häufig bei Patienten mit überaktiver Blase (OAB) vor, oft in Kombination mit obstruktiven Blasenentleerungsstörungen.
- Die Tatsache, dass OAB bei Männern wie Frauen gleichermaßen häufig vorkommt, unterstützt die Theorie, dass die alternde Blase – und möglicherweise auch das Gehirn – Ursache der OAB ist, zumal eine Blasenauslassobstruktion (Bladder Outlet Obstruction, BOO) bei Frauen extrem selten ist.
Prädisponierende Faktoren
- Hohes Alter
- Adipositas
- Diabetes9
- Hoher Alkoholkonsum
- Körperliche Inaktivität
- Produktion von Androgenen (s. o.)
ICPC-2
- Y85 Benigne Prostatahypertrophie
ICD-10
- Nach ICD-10-GM Version 202210
- N40 Prostatahyperplasie
Diagnostik
Diagnostische Kriterien
- Typische Symptome
- schwacher Harnstrahl
- häufiges Wasserlassen
- Häufiger klinischer Befund
- palpatorisch vergrößerte Prostata
- Nützliche Zusatzinformationen
- Restharn?
- Urodynamik?
Differenzialdiagnosen
Abflusshindernis
- Prostatakarzinom
- Chronische Prostatitis
- Blasenhalsobstruktion
- Urethrastriktur
Erkrankungen der Harnblase
- Harnwegsinfekt
- Detrusorinstabilität
- Reduzierte Blasenkontraktilität
- Harnblasenkarzinom
- Steinerkrankung
- Divertikel
- Bei überaktiver Blase
- neurologische Erkrankungen
- endokrinologische Erkrankungen (z. B. Diabetes mellitus)
- psychische Faktoren
- Herzinsuffizienz mit Nykturie
- Medikamente (z. B. Diuretika)?
Anamnese
- Art, Lokalisation, Schweregrad, Beginn und Dauer der Beschwerden
- Auswirkungen für die Patienten
- Anzeichen für Abflussbehinderungen
- Startschwierigkeiten (verzögerter Beginn der Miktion)
- schwacher Harnstrahl
- verlängerte Miktionszeit
- Gefühl der unvollständigen Entleerung
- Harnstottern (unterbrochene Miktion)
- Drang zu pressen/drücken.
- Nachtröpfeln
- Brennen oder Schmerzen bei der Miktion
- früherer akuter Harnverhalt
- Von der Blase ausgehende Symptome
- plötzlicher, imperativer Harndrang
- häufiges Wasserlassen
- kleine Mengen
- nächtliche Miktion
- Schmerzen bei der Blasenfüllung
- Inkontinenz
- Evtl. akuter Harnverhalt
- Ein Miktionsprotokoll kann wertvolle Hinweise liefern.
- Der IPSS-Fragebogen (Internationaler Prostatasymptomen Score) liefert diagnostisch ebenfalls anamnestische Hinweise.
- Weitere wichtige Informationen
- Fieber?
- Dysurie?
- Hämaturie?
- Schmerzen, die auf einen Stein in den Harnwegen schließen lassen?
- Frühere invasive Harnwegsdiagnostik oder -therapie?
- Somatische und psychische Vor- oder Begleiterkrankungen?
- Prostata- oder Blasenkarzinome in der Familie?
Wie sind IPSS-Ergebnisse zu deuten?
- Punktezahl unter 8: geringe Symptome
- Punktezahl 8–19: mäßige Symptome
- Punktezahl über 19: erhebliche Symptome
- Der IPSS-Wert allein reicht nicht aus, um die notwendigen therapeutischen Maßnahmen zu bestimmen. Entscheidend ist dabei u. a., ob Operationsindikationen vorliegen und wie hoch der Leidensdruck des Patienten ist.1
Klinische Untersuchung
- Digital rektale Untersuchung
- Vergrößerte Prostata: Wenn bei rektaler Palpation die obere Begrenzung der Prostata nicht ertastet werden kann, ist die Drüse in der Regel größer als 50 ml.
- Die Untersuchung hat ihre Grenzen: unterschiedliche Befunde je nach Untersucher*in, niedrige Sensitivität und geringer prädiktiver Wert für den Nachweis eines Prostatakarzinoms.12
- Die Sensitivität des Palpationsbefundes für ein Prostatakarzinom ist nur 30–50 %, die Spezifität ist jedoch höher.
- Siehe auch TrainAMed Digital-rektale Untersuchung (Uni Freiburg).
- Typischer Prostatabefund bei benigner Prostatavergrößerung:
- symmetrisch vergrößert
- feste, elastische Konsistenz
- ebene Oberfläche
- normale Konfiguration
- deutliche Abgrenzung des Organs
- verschiebbare rektale Mukosa.
- Harnverhalt?
- durch Perkussion, evtl. auch Palpation nachweisbar
- Viel Restharn kann den fälschlichen Eindruck einer vergrößerten Prostata erwecken.
- Sonografie (Nierenstau?)
Ergänzende Untersuchungen in der Hausarztpraxis
- Urinstatus
- Etwaige positive Urinbefunde sind nicht einer BPH zuzuschreiben, sondern sollten weiter abgeklärt werden.
- Serumkreatinin
- Messung des Restharns (Sonografie) in folgenden Fällen:8
- ausgeprägte Symptome
- Verdacht auf chronischen Harnverhalt
- sehr schwacher Strahl.
- Messung der Miktionsdauer
- Bei Verdacht auf reduzierte Harnflussrate: Test zu Hause mehrmals wiederholen.
- Miktionsprotokoll
Prostata-spezifisches Antigen (PSA)
- Das PSA ist ein hochsensitiver aber wenig spezifischer Marker für das Prostata-CA. Ein erhöhter Wert kann auch Ausdruck einer BPH sein. Ein P-CA kann Ursache eines Harnverhalts sein.
- 1 g Prostatagewebe erhöht das PSA um bis zu 0,15 ng/ml, während Prostatakarzinomgewebe etwa eine 10- bis 30-fache PSA-Menge freisetzt. Aufgrund der erheblichen Mengenunterschiede an Gewebe bei BPH (viel Gramm) und Prostatakarzinom (wenig Gramm) sind Grenzwerte (Normalwerte) nicht in der Lage, zwischen einem PCA oder einer BPH zu differenzieren.13
- Für die Verlaufskontrolle einer PBH-Finasterid-Therapie ist das PSA ein guter Prädiktor.
- Ein PSA-Test kann im Einzelfall bei Männern angezeigt sein, deren Symptome eine Erkrankung der Prostata vermuten lassen (und deren weitere Lebenserwartung mindestens 10 Jahre beträgt)12 – der Patient sollte jedoch gründlich über die diagnostischen Unsicherheiten der Testergebnisse informiert werden.
- PSA und Prostatabiopsie sind indiziert, wenn aufgrund des Palpationsbefundes ein Verdacht auf Prostatakarzinom besteht.2
- Männer, deren Brüder und/oder Väter an einem Prostatakarzinom erkrankt sind/waren, sollen auf das über 2-fach erhöhte Risiko, ein Prostatakarzinom im Laufe ihres Lebens zu entwickeln, aufmerksam gemacht werden (IIa/A).2
- Die DEGAM empfiehlt folgendes Vorgehen im Umgang mit der Bestimmung des PSA-Wertes im Rahmen der Früherkennungsuntersuchung im hausärztlichen Bereich:3
- Männer, die von sich aus nach einer Früherkennungsuntersuchung fragen – mit oder ohne PSA-Wert-Bestimmung – sollen ergebnisoffen über die Vor- und Nachteile aufgeklärt werden.
- Männer sollten im Rahmen der Früherkennungsuntersuchung nicht aktiv auf die Bestimmung des PSA-Wertes angesprochen werden.
- Nutzen und Risiken (Überdiagnose und Übertherapie) in natürlichen Zahlen und auch grafisch darstellen.
- geeignete Grafiken für das Aufklärungsgespräch in der DEGAM-Praxisempfehlung Hausärztliche Beratung zu PSA-Screening3
- Aussagekraft von positiven und negativen Testergebnissen erklären.
- Die Evidenz für den Nutzen einer digital-rektalen Untersuchung reicht nicht aus, um sie generell empfehlen zu können.
- Die Normalwerte sind altersabhängig.
- Die Wahrscheinlichkeit eines Prostatakarzinoms ist je nach Studie:2
- 9–17 % bei PSA < 4
- 3% bei PSA 0,28
- 5% bei PSA 0,42
- 8% bei PSA 0,63
- 11% bei PSA 0,83
- 14% bei PSA 1,07
- 18% bei PSA 1,46
- 24% bei PSA 2,1–3,0
- 27% bei PSA 3,1–4,0
- 20–45 % bei PSA = 4–10
- 30–75 % bei PSA > 10.
- 9–17 % bei PSA < 4
- Ein mäßig erhöhter PSA-Wert kann falsch positiv sein, insbesondere in Verbindung mit einem Harnwegsinfekt. In diesem Fall ist der PSA-Test nach Behandlung des Infekts zu wiederholen.
- Näheres zum Nutzen des eines PSA-Screenings siehe die Artikel Erhöhter PSA-Wert und Prostatakarzinom.
Diagnostik bei Urolog*in
- Ist in der primären Abklärung einer unkomplizierten BPH in der Regel nicht erforderlich.
- In Abhängigkeit von den dominanten Symptomen und Befunden evtl.:
- CT-Urografie
- Sonografie
- ggf. transrektal zur Messung des Prostatavolumens und zur Führung der Nadel bei Prostatabiopsien
- Zystoskopie
- Urodynamik (Druck-Fluss-Messung)
- Eine Obstruktion in den unteren Harnwegen wird durch gleichzeitige Messung von Blasendruck, Abdominaldruck und Harnfluss nachgewiesen.
- MRT (ergänzend)
Indikationen zur Überweisung
- Eine Überweisung zu Spezialist*innen ist in folgenden Fällen angebracht:
- ausgeprägte Symptome
- unklare oder untypische Symptome oder Befunde
- Verdacht auf Prostatakarzinom, sofern der Patient eine weitere Abklärung wünscht.
- häufige Harnwegsinfekte
- Hämaturie
- Verdacht auf Urethrastriktur
- Verdacht auf neurologische Erkrankungen (z. B. neurogene Blasenfunktionsstörungen bei multipler Sklerose oder Polyneuropathie)
- Überweisung bei Verdacht auf Prostatakarzinom
- tastbare Veränderungen an der Prostata bei digital-rektaler Untersuchung (DRU) (asymmetrisch, Festigkeit, Knoten)
- PSA > 4 ng/ml oder jährliche PSA-Zunahme > 0,75 ng/ml bei Patienten mit einer Lebenserwartung von mehr als 10 Jahren
- bei einem realen PSA-Anstieg während einer Behandlung mit einem 5-Alpha-Reduktasehemmer (der PSA-Wert wird durch 5-Alpha-Reduktase-Hemmer abgesenkt)
- Umgehende Überweisung bei folgenden Anzeichen:
- ausgeprägter Restharn: > 300 ml oder kompletter Harnverhalt mit Katheterbedarf
- Hydronephrose
- eingeschränkte Nierenfunktion (erhöhtes Serumkreatinin).
Checkliste zur Überweisung
Benignes Prostatasyndrom
- Zweck der Überweisung
- Abklärung und evtl. Behandlung von Miktionsproblemen
- Abklärung und evtl. Biopsie aufgrund eines erhöhten PSA-Werts
- Hämaturie (Zystoskopie?)
- Anamnese
- Beginn und Dauer?
- Miktionsbeschwerden?
- Entleerungsschwierigkeiten?
- Imperativer Harndrang?
- Nächtliche Beschwerden?
- Harnverlust?
- Hämaturie?
- Hämatospermie?
- Harnverhalt?
- Therapieversuch?
- Sonstige relevante Krankheiten?
- Medikamente?
- Klinische Untersuchung
- Allgemeinzustand
- BMI
- DRU: vergrößerte Prostata, Verhärtung?
- Ergänzende Untersuchungen
Therapie
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-6
Therapieziele
- Beschwerden lindern, die die Lebensqualität beeinträchtigen.
- Komplikationen verhindern.
- Mögliche Strategien sind:
- Information und Beratung, mit oder ohne Verlaufskontrolle
- medikamentöse Behandlung
- invasive Behandlung.
Leitlinie: Therapie des benignen Prostatasyndroms1
- Eine rein konservative Behandlung soll bei folgenden Befunden nicht erwogen werden (absolute Operationsindikationen):
- rezidivierender Harnverhalt
- rezidivierende Harnwegsinfektionen
- konservativ nicht beherrschbare, rezidivierende Makrohämaturien
- Harnblasenkonkremente
- Dilatation des oberen Harntraktes, eingeschränkte Nierenfunktion oder Niereninsuffizienz durch Blasenauslassobstruktion (Bladder Outlet Obstruction, BOO).
- Bei Abwesenheit absoluter Operationsindikationen sind die subjektiven Beschwerden des Patienten richtungsweisend für die Behandlung.
- Ein abwartend-beobachtendes Vorgehen (Watchful Waiting)
- Sollte bei Patienten in Erwägung gezogen werden, die einen geringen Leidensdruck haben und/oder zunächst Änderungen im Lebensstil zur Linderung der Symptomatik umsetzen können (IIa/B).
- Sollte risikoadaptiert eingesetzt werden (IIa/B).
- bei erhöhtem Progressionsrisiko nicht geeignet (Ic/B)
- Hat keinen Einfluss auf den natürlichen Verlauf der BOO (IIa/B).
- Beginn einer Therapie bei Leidensdruck des Patienten
- evtl. Operation bei klinisch relevanter BOO
- konservative Therapie
- Wenn keine klinisch relevante BOO vorliegt.
- bei Kontraindikationen gegen OP
- Wenn der Patient eine OP ablehnt.
- Ist eine konservative Therapie indiziert, sind folgende medikamentöse Optionen geeignet:*
- bei benigner Prostatavergrößerung (Prostatavolumen über 30–40 ml)
- Monotherapie mit 5-Alpha-Reduktasehemmer (Langzeittherapie, mind. 1 Jahr) – oder –
- Alphablocker + 5-Alpha-Reduktasehemmer
- Wenn eine symptomatische Therapie und nicht eine Reduktion der BPS-Progression im Vordergrund steht: Monotherapie mit Alphablocker oder PDE-5-Hemmer.
- ohne Prostatavergrößerung (Prostatavolumen unter 30–40 ml)
- Alphablocker und/oder Antimuskarinikum (Monotherapie oder Kombination) – oder –
- PDE-5-Hemmer – oder –
- intravesikale Injektion von Botulinumtoxin Typ A.
- bei benigner Prostatavergrößerung (Prostatavolumen über 30–40 ml)
- Bei Versagen der konservativen Therapie kann eine Operation erwogen werden.
- Siehe Algorithmus Therapie des benignen Prostatasyndroms.
* Wirkstoffe und empfohlene Dosierungen siehe folgende Abschnitte zu den einzelnen Wirkstoffgruppen.
Empfehlungen für Patienten
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Regulierung der Flüssigkeitszufuhr (Gesamtmenge ca. 1.500 ml/24 Stunden)
- Gleichmäßige Verteilung über den Tag, Vermeidung übermäßiger Flüssigkeitszufuhr am Abend und vor bestimmten Aktivitäten
- Eine stark verminderte Flüssigkeitszufuhr kann bei irritativen Blasenbeschwerden („Speichersymptome“) jedoch zur Zunahme der Beschwerden führen.
- Reduktion bzw. Vermeidung des diuretischen und irritativen Effekts von übermäßiger Kaffee- und Alkoholzufuhr, scharfen Gewürzen
- Überprüfung bzw. Vermeidung von diuretischen Medikamenten am Abend, ggf. Medikamentenumstellung
- „Ausstreichen“ der Harnröhre („Melken“) nach der Miktion zur Verhinderung des Nachträufelns
- Es kann eine wiederholte Miktion versucht werden, um bei chronischem Restharn die Restharnmenge, Infektionstendenz oder nachgewiesene Detrusorinstabilität zu reduzieren.
- Der Patient sollte sich beim Toilettengang stets genügend Zeit lassen.
- Nach dem Gefühl der vollständigen Blasenentleerung sollte er noch einige Minuten warten und noch einmal versuchen, Wasser zu lassen.
- Sofern nochmals Urin infolge einer weiteren Entleerung kommt, sollte er das Ganze noch einmal wiederholen.
- Blasentraining
Medikamentöse Therapie
Phytotherapie
- Für den Einsatz von Phytotherapeutika beim BPS können derzeit keine abschließenden allgemeinen Empfehlungen gegeben werden (Ib/A).
- Phytotherapeutika, die in Studien eine Überlegenheit gegenüber Placebo gezeigt haben, können bei Patienten mit geringen bis moderaten Beschwerden und Leidensdruck in Betracht kommen, wenn chemisch definierte Präparate abgelehnt werden (Ia/B).
- Bisher wurde in keiner Studie ein Einfluss auf die BPS-Progression (z. B. Verminderung der Häufigkeit akuter Harnverhalte oder der Notwendigkeit operativer/instrumenteller Eingriffe an der Prostata) nachgewiesen.
- Nichtglykosidische Beta-Sitosterole verbessern LUTS und urodynamische Parameter. Daten zur Langzeitwirkung und -sicherheit sowie zur Wirksamkeit auf das Komplikationsrisiko fehlen jedoch.
- Hinweise auf eine Wirksamkeit von Extrakten aus Brennesselwurzel, Pollen, Kürbissamen oder der Rinde des afrikanischen Pflaumenbaums auf BPH-Symptome stammen überwiegend aus Studien niedriger Qualität und bedürfen daher der Überprüfung.
Alpha-1-Blocker (Alpha-1-Adrenozeptorantagonisten)
- Blockieren die alpha-adrenerg evozierte Kontraktion der glatten Prostata- und Blasenhalsmuskulatur.
- Führen zur raschen Symptomreduktion und zur Hemmung der symptomatischen Progression.
- Alle in Deutschland zur Verfügung stehenden Alpha-1-Blocker sind in adäquater Dosierung gleich effektiv und reduzieren den IPSS im Vergleich zu Placebo um 1–4 Punkte (Ib/A).
- Signifikante Reduktionen des IPSS treten bereits 1 Woche nach Therapiebeginn ein (IIa/B).
- Die langfristigen Effekte sind abhängig vom Prostatavolumen bei Therapiebeginn.
- Es existieren Hinweise, dass Alpha-1-Blocker bei Patienten mit benigner Prostatavergrößerung (> 30 ml) langfristig weniger effektiv sind (IIa/B).
- Haben keinen Einfluss auf die Prostatagröße (Ib/A).
- Haben einen geringen Einfluss auf die BOO (IIa/B).
- Können langfristig (> 1 Jahr) akute Harnverhaltungen oder die Notwendigkeit einer Prostataoperation nicht verhindern (IIa/B).
- Die Nebenwirkungsprofile der einzelnen Alpha-1-Blocker sind unterschiedlich (Ib/A).
- Mögliche Nebenwirkungen
- Müdigkeit und Abgeschlagenheit
- Schwindel
- Kopfschmerz
- Diarrhö
- Schwellung der Nasenschleimhaut
- grippale Symptome
- hypotone Dysregulation
- Synkopen.
- Ein erhöhtes Risiko für Schwindel, hypotone Dysregulation oder Synkopen wurde insbes. für Doxazosin und Terazosin beobachtet (relatives Risiko 3,71–5,53), seltener für Silodosin oder Tamsulosin.
- Wirkungen auf den Blutdruck sind bei Menschen, die an Hypertonie leiden, ausgeprägter als bei Normotonikern.
- Studien zeigten, dass Alpha-1-Blocker, die ursprünglich bei der Hypertoniebehandlung eingesetzt wurden (Doxazosin, Terazosin), eine geringere Verträglichkeit aufweisen als jene, die primär für die BPS-Behandlung entwickelt wurden (Alfuzosin, Silodosin, Tamsulosin).
-
Begleitmedikationen mit Diuretika, Betablockern, ACE-Hemmern oder Kalziumkanal-Antagonisten zur Therapie der arteriellen Hypertonie können in Kombination mit Alpha-1-Blockern, insbes. bei Doxazosin oder Terazosin, zur Verstärkung der kardiovaskulären Nebenwirkungen führen.
- Nicht mit PDE5-Hemmer (s. u.) kombinieren!14
- Cave: orthostatische Hypotonie!
-
Bei Patienten mit BPS und Alpha-1-Blockertherapie ist die gleichzeitige Verabreichung anderer Alpha-1-Blocker zur Hypertonie-Behandlung kontraindiziert.
- Patienten über die Blutdrucksenkung informieren!
- Insbesondere für Silodosin ist eine erhöhte Rate von Ejakulationsstörungen (anomale Ejakulation mit Reduktion des Ejakulatvolumens) nachgewiesen worden.
- Galenische Zubereitungen mit verzögerter Wirkstofffreisetzung (Retard-Formulierungen) zeigen im Vergleich zu solchen mit schneller Freisetzung prinzipiell eine verbesserte Verträglichkeit.
- Alle o. g. Nebenwirkungen sind prinzipiell nach Absetzen des Alpha-1-Blockers reversibel.
- Wirkstoffe und empfohlene Tagesdosierung
- Alfuzosin nicht-retardiert 3 x 2,5 mg
- Alfuzosin retard 2 x 5 mg oder 1 x 10 mg
- Doxazosin nicht-retardiert 1 x 2–8 mg
- Doxazosin retard 1 x 4–8 mg
- Silodosin 1 x 4–8 mg
- Tamsulosin 1 x 0,4 mg
- Terazosin 1 x 5–10 mg
5-Alpha-Reduktasehemmer
- Blockieren die Metabolisierung von Testosteron zu Dihydrotestosteron.
- Es kommt zu einer Apoptoseinduktion von Epithelzellen der Prostata, die zu einer Größenreduktion von 18–28 % und zu einer Halbierung der Serum-PSA-Werte nach einer Behandlungsdauer von 6–12 Monaten führt.
- Sind bei Patienten mit BPS und einem Prostatavolumen ab 30–40 ml zur Symptomreduktion und Progressionshemmung, d. h. zur Vermeidung eines akuten Harnverhaltes oder einer Operation, geeignet.
- Eine relevante Symptomreduktion tritt erst nach mehreren Monaten ein.
- Die Behandlung wird als Langzeittherapie (> 1 Jahr) empfohlen (Ib/A).
- Finasterid hat einen geringen Einfluss auf die BOO (IIa/B).
- Zu anderen 5-Alpha-Reduktasehemmern liegen keine Daten zur Wirkung auf die BOO vor.
- Mögliche Nebenwirkungen
- Ejakulationsstörungen (2,4 % vs. 0,7 % unter Placebo)
- Libidoverlust (4,6 % vs. 2,6 %)
- erektile Dysfunktion (7,1 % vs. 3,8 %)
- Gynäkomastie (1,6 % vs. 0,5 %)
- erhöhtes Risiko für die Entwicklung eines Diabetes mellitus im Vergleich mit Alpha-1-Blockern (76 vs. 60 Fälle pro 10.000 Patienten)15
- Die Nebenwirkungen lassen meist im Verlauf der Behandlung nach.
- Möglicherweise senkt Finasterid das Prostatakarzinom-Risiko.16-17
- teilweise widersprüchliche Datenlage
- offenbar kein Einfluss auf die Mortalität
- Wirkstoffe und empfohlene Tagesdosierungen
- Dutasterid 1 x 0,5 mg
- Finasterid 1 x 1–5 mg
Muskarinrezeptor-Antagonisten
- Vermindern in 12-wöchigen Untersuchungen statistisch signifikant Blasenspeichersymptome (imperativer Harndrang, Pollakisurie, Dranginkontinenz) (Ia/A).
- Können zur Therapie des imperativen Harndranges, der Dranginkontinenz und der gesteigerten Miktionsfrequenz (überaktive Blase) bei Männern ohne BOO eingesetzt werden.
- Können derzeit nicht für andere Symptome des BPS und zur Behandlung von BOO empfohlen werden.
- In Studien trat Mundtrockenheit unter Muskarinrezeptor-Antagonisten signifikant häufiger auf als unter Placebo. Alle anderen Muskarinrezeptor-Antagonisten-assozierten Nebenwirkungen waren nicht häufiger als unter Placebo (Ia/A).
- Wirkstoffe und empfohlene Tagesdosierungen
- Darifenacin 1 x 7,5–15 mg
- Fesoterodin 1 x 4–8 mg
- Oxybutynin 1 x 7,5–15 mg
- Propiverin 2–3 x 15 mg
- Solifenacin 1–10 mg
- Tolterodin nicht-retardiert 2 x 1–2 mg
- Tolterodin retard 1 x 4 mg
- Trospium nicht-retardiert 2–3 x 15 mg
- Trospium retard 1 x 60 mg
Phosphodiesterase-Inhibitoren (PDE5-Inhibitoren)
- Wirken über eine Entspannung der glatten Muskulatur, u. a. in der Prostata.
- Verbessern die Symptomatik bei Männern mit moderaten und schweren Symptomen des unteren Harntraktes mit oder ohne erektile Dysfunktion (Ic/A).
- Für Tadalafil 5 mg/d gibt es in einer Studie Hinweise, dass nicht nur eine Verbesserung der subjektiven Parameter (IPSS), sondern auch der objektiven Parameter (Qmax) eintreten (Ic/A).
- Haben keinen Einfluss auf die BOO (nur Daten für Tadalafil) (IIa/B).
- Nicht mit Alpha-1-Blocker kombinieren!14
- Cave: orthostatische Hypotonie!
- Näheres zur Sicherheit und Verträglichkeit finden Sie im Artikel Erektile Dysfunktion.
- Wirkstoffe (keine Zulassung für die Behandlung der BPH und assoziierter Symptome)
- Sildenafil
- Tadalafil
- Vardenafil
Kombination Alpha-1-Blocker und 5-Alpha-Reduktasehemmer
- Der komplementäre Wirkmechanismus der beiden Substanzen macht diese Kombination attraktiv.18
- Sollte als Primärtherapie für Patienten mit moderaten bis ausgeprägten Miktionsbeschwerden (Qmax < 15 ml/s), verbunden mit einem erhöhten Progressionsrisiko, angeboten werden (Ia/A).
- Die Abschätzung des Progressionsrisikos erfolgt primär über das Prostatavolumen.
- Der Vorteil der Kombinationstherapie gegenüber der Alpha-1-Blocker-Monotherapie nimmt mit dem Prostatavolumen zu.
- klinisch relevanter Grenzwert: 30–40 ml
- Nur als langfristiger Therapieansatz (> 1 Jahr) zu empfehlen (Ia/A).
- Die Symptomlinderung kann auch nach Absetzen des Alpha-1-Blockers bis zu 12 Monate weiter anhalten.
- Die Wirkung auf die BOO ist unbekannt, dürfte aber wegen der begrenzten Wirkung der Einzelsubstanzen gleichermaßen gering sein.
- Die Nebenwirkungsrate ist trotz additiver Effekte der Einzelsubstanzen moderat.
- Dosierungsbeispiele
- Dutasterid 0,5 mg + Tamsulosin 0,4 mg/d (als Fixkombination erhältlich)
- Finasterid 5 mg + Tamsulosin 0,4 mg/d19
Kombination Alpha-1-Blocker und Muskarinrezeptor-Antagonist1,20
- Ist effektiv hinsichtlich der Verbesserung von Blasenspeichersymptomen und diesbezüglich der Monotherapie mit Alpha-1-Blockern überlegen.
- Wirkt unabhängig vom Prostatavolumen und PSA (Ib/A).
- Unter der Behandlung steigt die Restharnmenge geringfügig. Allerdings ist das Risiko für einen (akuten) Harnverhalt und die Notwendigkeit der Blasenkatheterisierung nicht erhöht.
- Geringer Einfluss auf die BOO (IIa/B)
- Mundtrockenheit häufiger als unter Alpha-1-Blocker-Monotherapie (Ia/A)
- Alle bisherigen Angaben und Studienergebnisse beziehen sich auf eine maximale Therapiedauer von 3 Monaten.
- Dosierungsbeispiele20
- Tolterodin retard 4 mg + Tamsulosin 0,4 mg/d
- Oxybutynin 10 mg + Tamsulosin 0,4 mg/d
- Solifenacin 5 mg + Tamsulosin 0,4 mg/d
- Tolterodin retard 4 mg + Doxazosin 4 mg/d
Instrumentelle/operative Verfahren
- Folgende Verfahren haben sich in Deutschland etabliert:21
- transurethrale Resektion (TUR-P)
- offene Adenomenukleation
- transurethrale Elektrovaporisation (TUEVRP)
- transurethrale Inzision der Prostata (TUIP)
- Holmium-Laserresektion der Prostata (HoLRP)
- Holmium-Laser-Enukleation der Prostata (HoLEP).
- Eine Reihe von Verfahren wurde ausgeschlossen und aus dem Leistungskatalog der gesetzlichen Kassen gestrichen. Hierzu gehören:21
- interstitielle Laserkoagulation (ILK)
- Holmium-Laser-Ablation der Prostata (HoLAP)
- Holmium-Laser-Blasenhalsinzision (HoBNI)
- transurethrale Nadelablation (TUNA)
- Hybrid-Laser-Therapie
- hochintensivierte fokussierte Ultraschalltherapie des BPS (HIFU)
- wasserinduzierte Thermotherapie (WIT)
- Thulium-Laser-Ablation
- transurethrale Äthanolablation der Prostata (TEAP).
Verlauf, Komplikationen und Prognose
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-6
Verlauf
- Eine BPH entwickelt sich normalerweise langsam, aber die Symptome können die Lebensqualität erheblich einschränken.
- Eine unbehandelte BPH hat einen schwankenden Verlauf; bei ca. 50 % erfolgt eine fortschreitende Verschlechterung der Symptome und der Harnflussrate.
- Bei 30 % bleiben die Symptome unverändert.
- 20 % erfahren eine spontane Verbesserung der Symptome.
Komplikationen
- Blasensteine
- Blasendivertikel
- Harnwegsinfekte
- Hydronephrose
- Reduzierte Nierenfunktion
- Akuter Harnverhalt bei 1–2 % pro Jahr bei Männern mit Symptomen
Prognose
- Eine gutartige Prostatavergrößerung ist auch bei Vorhandensein von Symptomen nur selten eine lebensbedrohliche Erkrankung.
- 15–25 % der über 75-jährigen Männern werden operiert.
Verlaufskontrolle
- Der gesamte Abschnitt basiert auf diesen Referenzen.1,6
- Beurteilung des Ansprechens auf die Therapie
- Beurteilung von Nebenwirkungen
- IPSS-Fragebogen
- Palpation der Prostata
- Urinprobe
- Evtl. PSA
- Evtl. Restharnbestimmung
- Evtl. Urodynamik
- Evtl. Nierenfunktion
Leitlinie: Behandlung und Verlaufskontrolle bei Männern mit nichtneurogenen LUTS einschl. beninger prostatabedingter Obstruktion6
- Patienten, bei denen man sich für ein beobachtend-abwartendes Vorgehen (Watchful Waiting) entschieden hat, sollten nach 6 Monaten nachuntersucht werden und danach jährlich.
- Voraussetzung: keine Symptomverschlechterung oder Auftreten absoluter Operationsindikationen
- Patienten, die Alpha-1-Blocker oder Muskarinrezeptor-Antagonisten erhalten, sollten 4–6 Wochen nach Therapiestart wieder einbestellt werden, um das Ansprechen auf die Behandlung zu beurteilen. Dasselbe gilt für Kombinationen von Alpha-1-Blockern mit 5-Alpha-Reduktasehemmern oder Muskarinrezeptor-Antagonisten.
- Wenn Patienten eine Symptomlinderung erfahren, ohne dass belastende Nebenwirkungen auftreten, kann die Behandlung fortgeführt werden.
- Weitere Verlaufskontrollen sollten nach 6 Monaten und danach jährlich erfolgen.
- Voraussetzung: keine Symptomverschlechterung oder Auftreten absoluter Operationsindikationen
- Bei Patienten, die 5-Alpha-Reduktasehemmer erhalten,
- sollten nach 12 Wochen und erneut nach 6 Monaten das Ansprechen auf die Behandlung und vorhandene Nebenwirkungen beurteilt werden.
- sollten regelmäßige PSA-Tests erfolgen, vorausgesetzt, die Lebenserwartung ist über 10 Jahre, eine Screening-Diagnostik ist vom Patienten grundsätzlich erwünscht und eine Prostatakrebs-Diagnose würde das therapeutische Vorgehen verändern.
- sollte ein zusätzlicher PSA-Ausgangswert 6 Monate nach Therapiebeginn ermittelt werden.
- Jeder bestätigte PSA-Anstieg unter einer 5-Alpha-Reduktasehemmer-Therapie sollte abgeklärt werden.
- Nach einem instrumentellen/operativen Eingriff an der Prostata sollten 4–6 Wochen nach Katheterentfernung das Ansprechen auf die Behandlung und vorliegende Nebenwirkungen beurteilt werden.
Patienteninformationen
Worüber sollten Sie die Patienten informieren?
- Was sind normale Miktionsmuster?
- Über die Behandlungsalternativen
- Medikamente: Möglichkeiten und Nebenwirkungen
- Operation: Möglichkeiten und Komplikationen
- Bei Männern, die von Problemen beim Wasserlassen berichten, sollte eine PSA-Messung erfolgen. Sie sollten den Patienten über mögliche Konsequenzen wie Biopsien und evtl. Radikalbehandlung bei nachgewiesenem Prostatakarzinom informieren.
Patienteninformationen in Deximed
Weitere Informationen
- Gesundheitsinformation.de: Blasentraining
- Deutsche Kontinenzgesellschaft: Toiletten- und Trinkprotokolle
Video
- TrainAMed Digital-rektale Untersuchung (Universität Freiburg)
Illustrationen

Harnwege und männliche Geschlechtsorgane
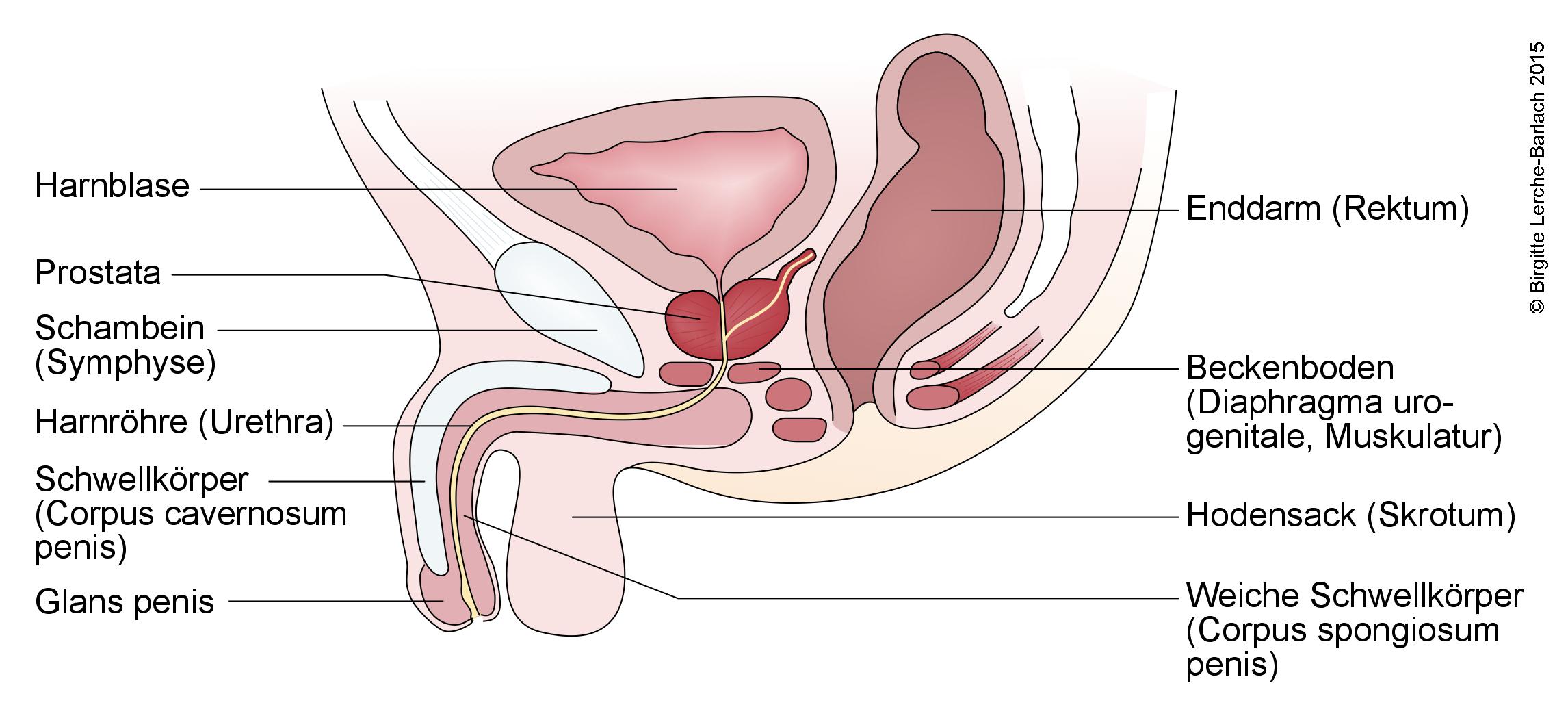
Männliche Geschlechtsorgane in der Seitansicht, Normalbefund
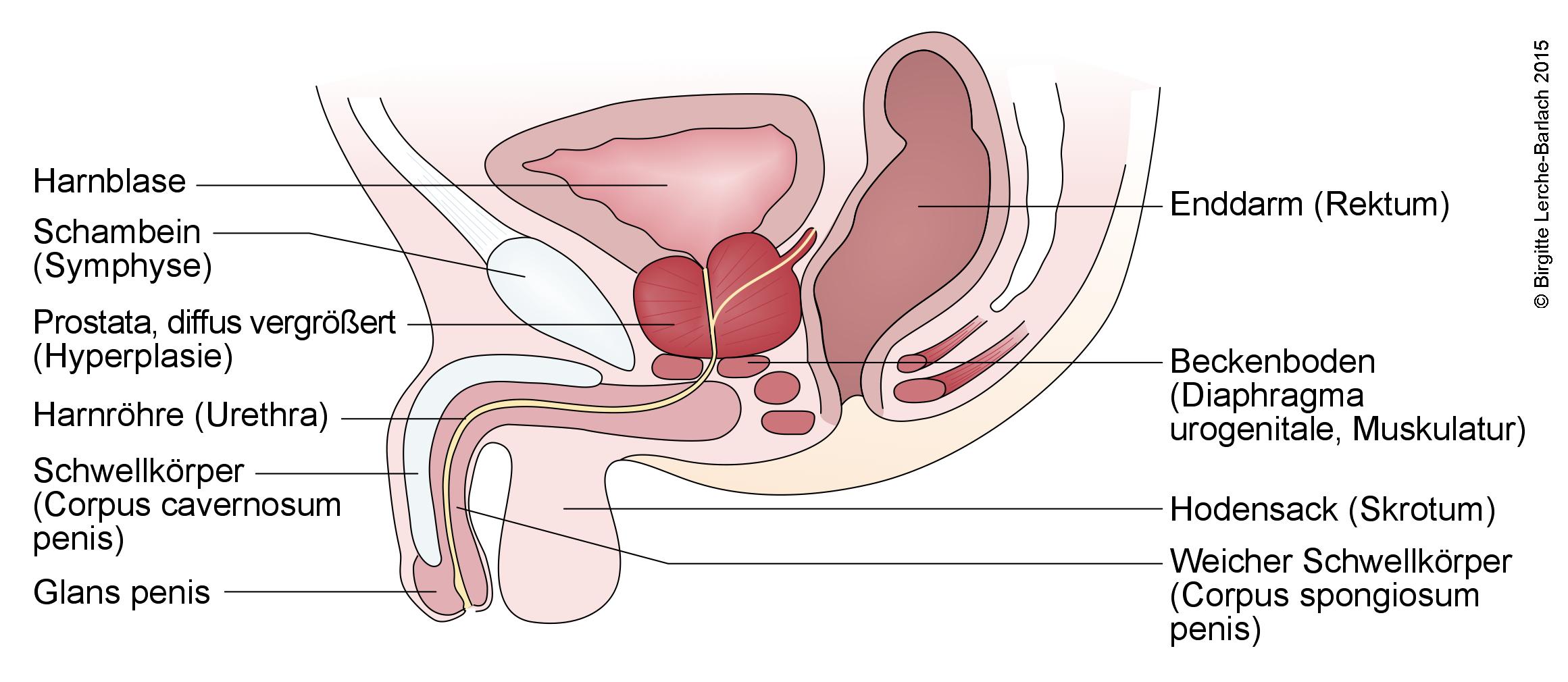
Männliche Geschlechtsorgane bei Prostatahyperplasie
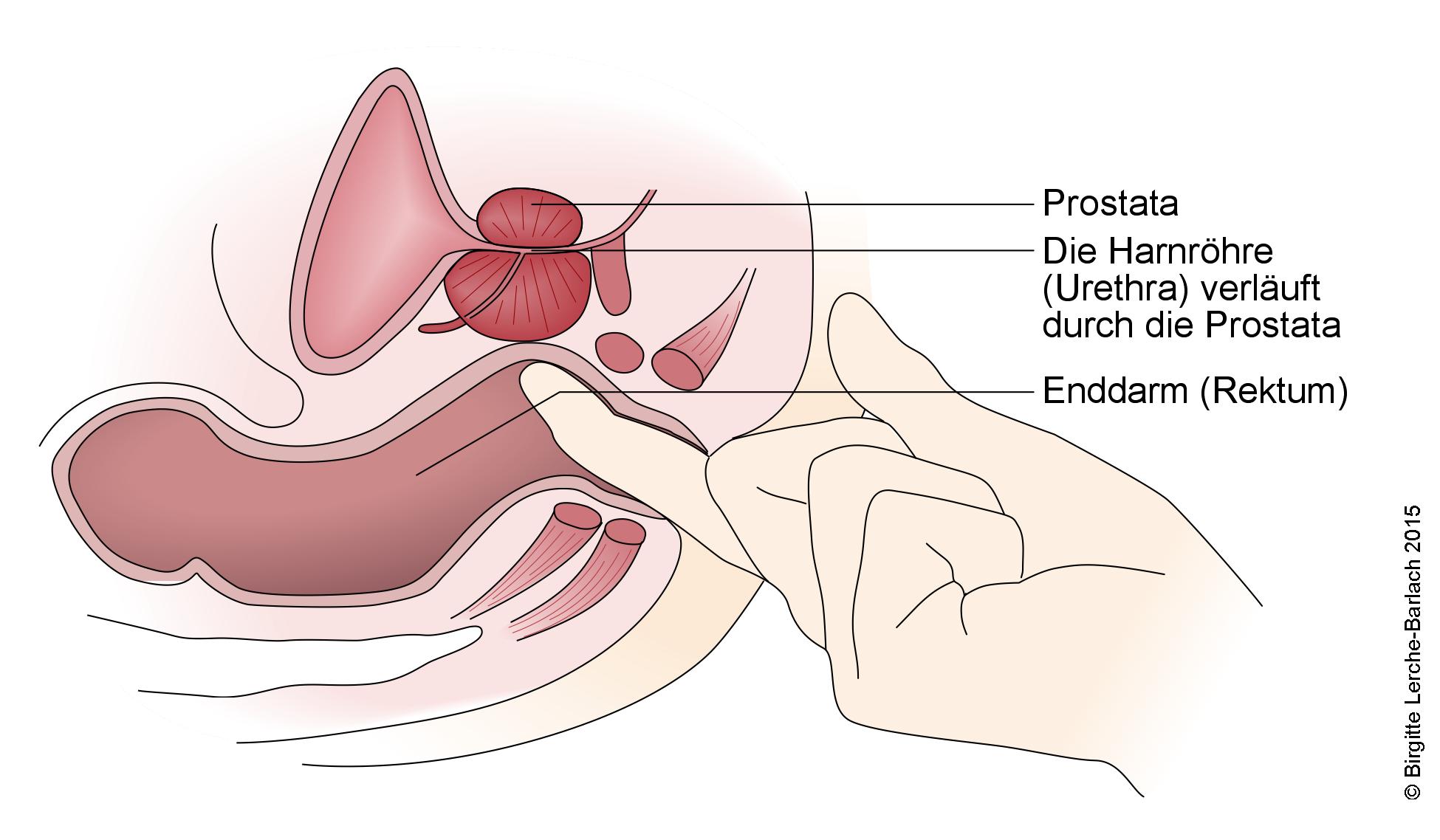
Untersuchung der Prostata
Sonografie: Prostata, Normalbefund (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Sonografie: Prostatahyperplasie (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Quellen
Leitlinien
- Deutsche Gesellschaft für Urologie. Benignes Prostatasyndrom (BPS), Diagnostik und Differenzialdiagnostik. AWMF-Leitlinie Nr. 043-034. S2e, Stand 2009 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Urologie. Benignes Prostatasyndrom (BPS), Therapie. AWMF-Leitlinie Nr. 043-035. S2e, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Urologie. S3-Leitlinie Prostatakarzinom. AWMF-Leitlinie Nr. 043-022OL. S3, Stand 2021. www.awmf.org
- Deutsche Gesellschaft für Neurologie. Diagnostik und Therapie der erektilen Dysfunktion. AWMF-Leitlinie Nr. 030-112. S1, Stand 2018. www.awmf.org
Literatur
- Deutsche Gesellschaft für Urologie. Benignes Prostatasyndrom (BPS), Therapie. AWMF-Leitlinie Nr. 043-035, Klasse S2e, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Urologie. S3-Leitlinie Prostatakarzinom. AWMF-Leitlinie Nr. 043-022OL. S3, Stand 2021. www.awmf.org www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin. DEGAM- Praxisempfehlung. Hausärztliche Beratung zu PSA-Screening. Stand: 4/2018 www.degam.de
- Gratzke C, Bachmann A, Descazeaud A et al. EAU Guidelines on the Assessment of Non-neurogenic Male Lower Urinary Tract Symptoms including Benign Prostatic Obstruction. Eur Urol 2015; 67:1099-1109. PMID: 25613154. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Urologie. Benignes Prostatasyndrom (BPS), Diagnostik und Differenzialdiagnostik. AWMF-Leitlinie Nr. 043-034. S2e, Stand 2009 (abgelaufen). www.awmf.org
- Oelke M, Bachmann A, Descazeaud A et al. EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction. Eur Urol 2013; 64:118-40. PMID: 2354133 PubMed
- van der Sluis TM, Vis AN, van Moorselaar RJ et al. Intraprostatic testosterone and dihydrotestosterone. Part I: concentrations and methods of determination in men with benign prostatic hyperplasia and prostate cancer. BJU Int 2012; 109:176-82. PMID: 21992222 PubMed
- Sarma AV, Wei JT. Benign prostatic hyperplasia and lower urinary tract symptoms. N Engl J Med 2012; 367: 248-57. New England Journal of Medicine
- Sarma AV, St Stauver JL, Hollingsworth JM, et al. Diabetes treatment and progression of benign prostatic hyperplasia in community-dwelling black and white men. Urology 2012; 79: 102-8. PubMed
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2022. Stand 17.09.2021 www.dimdi.de
- Pearson R, Williams PM. Common questions about the diagnosis and management of benign prostatic hyperplasia. Am Fam Physician. 2014 Dec 1;90(11):769-774. PMID: 25611711 PubMed
- McVary KT, Roehrborn CG, Avins AL, et al. Update on AUA guideline on the management of benign prostatic hyperplasia. J Urol. 2011;185(5):1793–1803. PMID: 21420124 PubMed
- Manski D. Urologielehrbuch.de – Diagnose und Therapie urologischer Krankheiten. Auflage 2015. www.urologielehrbuch.de
- Deutsche Gesellschaft für Neurologie. Diagnostik und Therapie der erektilen Dysfunktion. AWMF-Leitlinie Nr. 030-112, Klasse S1, Stand 2018. www.awmf.org
- Wei L, Lai EC-C, Kao-Yang Y-H, et al. CCBY Open access Research Incidence of type 2 diabetes mellitus in men receiving steroid 5α-reductase inhibitors: population based cohort study. BMJ 2019; 365: l1204. doi:10.1136/bmj.l1204. www.bmj.com
- Robinson D, Garmo H, Bill-Axelson A, et al. Use of a 5α-reductase inhibitors for lower urinary tract symptoms and risk of prostate cancer in Swedish men: natiowide, population based case-control study. BMJ 2013; 346: f3406. BMJ (DOI)
- Thompson IM Jr, Goodman PJ, Tangen CM, et al. Long-term survival of participants in the prostate cancer prevention trial. N EnglJ Med 2013; 360: 603-10. pmid:23944298 PubMed
- Fullhase C, Chapple C, Cornu JN, et al. Systematic review of combination drug therapy for non-neurogenic male lower urinary tract symptoms. Eur Urol 2013; 64: 228-43. PMID: 23375241 PubMed
- Höfner K, Ulrich S, Berges R. Kombinationsbehandlung des BPS mit Tamsulosin und Finasterid Literaturübersicht und Verordnungsdaten. Urologe 2017; 56: 645–53. DOI: 10.1007/s00120-016-0296-x DOI
- Filson CP, Hollingsworth JM, Clemens JQ, Wei JT. The efficacy and safety of combined therapy with α-blockers and anticholinergics for men with benign prostatic hyperplasia: a meta-analysis. J Urol 2013; 190: 2153-60. pmid:23727412 PubMed
- Gemeinsamer Bundesausschuss 'G-BA' (2010) Nichtmedikamentöse lokale Verfahren zur Behandlung des benignen Prostatasyndroms. Abschlussbericht. Berlin, G-BA www.g-ba.de
- Tacklind J, Macdonald R, Rutks I et al. Serenoa repens for benign prostatic hyperplasia. Cochrane Database Syst Rev 2012; 12: CD001423. PMID: 23235581 PubMed
- Gacci M, Corona G, Salvi M, et al. A systematic review and meta-analysis on the use of phosphodiesterase 5 inhibitors alone or in combination with α-blockers for urinary tract symptoms due to benign prostatic hyperplasia. Eur Urol 2012; 61: 994-1003. PubMed
- Glazener C, Boachie C, Buckley B, et al. Urinary incontinence in men after formal one-to-one pelvic-floor muscle training following radical prostatectomy og transurethral resection of the prostate (MAPS): two parallell randomised controlled trials. Lancet 2011; 378: 328-37. PubMed
- Roehrborn CG, Barkin J, Gange SN, et al. Five year results of the prospective randomized controlled prostatic urethral L.I.F.T. study. Can J Urol 2017 Jun; 24(3): 8802-8813. pmid:28646935 PubMed
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
Til Uebel, Dr. med., Facharzt für Allgemeinmedizin, Neckargemünd (Review)- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).