Allgemeine Informationen
Definition
- Neurodegenerative Erkrankung des Plexus myentericus, die zu gestörter Motilität des Ösophagus bis zur funktionellen Obstruktion führt.1-2
- Insbesondere die Motilität des distalen Ösophagus und die Funktion des unteren Ösophagussphinkters sind betroffen.
- Klinische Symptome sind Schluckstörung (Dysphagie), Regurgitation von unverdauten Speisen, retrosternale Schmerzen.
- erhöhtes Risiko für das Auftreten eines Ösophaguskarzinoms
- Die Diagnostik umfasst Endoskopie, Ösophagus-Manometrie und Ösophagus-Breischluckuntersuchung.2
- Therapie medikamentös oder interventionell
- Verschiedene interventionelle Verfahren stehen zur Verfügung (z. B. Ballondilatation).
Häufigkeit
- Insgesamt seltene Erkrankung
- Altersgipfel der Erstmanifestation zwischen 60 und 70 Jahren
- Alter und Geschlecht
- erstmaliges Auftreten am häufigsten bei 60- und 70-Jährigen, aber auch bei Jüngeren, und das geschlechtsunabhängig
- Die Erkrankung kann auch im Kindesalter beginnen, praktisch jedoch nicht vor dem 8. Lebensjahr.
Ätiologie und Pathogenese
- Ätiologie der primären (idiopathische) Achalasie weitgehend unbekannt
- Untergang von Nervenzellen im Plexus myentericus (Auerbach-Plexus)1
- Teil des autonomen enterischen Nervensystems (ENS)
- Die Erkrankung wird häufig zu den neurodegenerativen Erkrankungen gezählt.2
- Der Plexus myentericus steuert die Motilität im Gastrointestinaltrakt.
- Erkrankung betrifft v. a. den unteren Ösophagussphinkter (UÖS).1-2
- Im Ausgangszustand ist der UÖS kontrahiert und verhindert den Reflux von Magensäure.
- im Rahmen des Schluckvorganges Öffnung zur Passage von Nahrung in den Magen
- bei Achalasie dauerhafte Kontraktion und fehlende Erschlaffung des UÖS
- Die Nahrung tritt erst in den Magen über, wenn der Kontraktionsdruck des UÖS überwunden wird.
- Druckerhöhung im Ösophagus und Regurgitation sowie Aspiration von Nahrung führen zu den Komplikationen der Erkrankung.
ICPC-2
- D84 Speiseröhrenerkrankung
ICD-10
- K22.: Sonstige Krankheiten des Ösophagus
- K22.0: Achalasie der Kardia
Diagnostik
Diagnostische Kriterien
- Oft verzögerte Diagnosestellung aufgrund der unspezifischen Beschwerden1-2
- Klinisch progrediente Dysphagie und Regurgitation von unverdauter Nahrung
- Diagnosesicherung durch erweiterte Diagnostik (Endoskopie, Ösophagogramm, Manometrie)
Differenzialdiagnosen
- Gastroösophagealer Reflux
- Ösophaguskarzinom
- Ösophagusspasmen
- Ösophagusdivertikel
- Sklerodermie
- Peptische Striktur
- Schlaganfall mit Dysphagie
- Neurodegenerative Erkrankungen (z. B. Parkinson-Syndrom)
- Chagas-Krankheit
- endemisch in Südamerika, verursacht durch Trypanosoma cruzi
- Kann zur Schädigung des Plexus myentericus führen und somit nur schwer von einer Achalasie zu unterscheiden.
Anamnese
- Berichtete Beschwerden1,6-8
- Schluckstörung (Dysphagie) als Leitsymptom (ca. 90 %)
- anfangs nur episodisch, im Verlauf chronisch-progredient
- ggf. Verschlechterung durch psychische Belastung
- Sodbrennen
- Aufstoßen oder Erbrechen (Regurgitation)
- retrosternale Schmerzen oder Schmerzen beim Schlucken (Odynophagie)
- Heiserkeit oder Halsschmerzen
- häufiges Verschlucken
- Husten nach dem Essen/Trinken (Aspiration)
- „Steckenbleiben von Speichel/Getränken/Speisen in der Kehle"
- unklare Fieberschübe und/oder Pneumonien (evtl. stumme Aspirationen!)
- verminderte Nahrungs- oder Trinkmengen und unbeabsichtigter Gewichtsverlust
- Schluckstörung (Dysphagie) als Leitsymptom (ca. 90 %)
- Im Verlauf ggf. Abnahme der Schmerzsymptomatik, da die Wandspannung des dilatierten Ösophagus abnimmt.
Klinische Untersuchung
- Allgemeine körperliche Untersuchung
- Zeichen von Mangelernährung und Gewichtsverlust
- Auskultation der Lunge (Aspirationspneumonie)
- Beobachtung des Schluckvorganges
- z. B. 50–100 ml Wasser
- Schmerzen, Regurgitation, Husten, Veränderungen der Stimme nach dem Schlucken?
Diagnostik bei Spezialist*innen
- Ösophagogastroskopie
- Diagnosestellung nur in etwa 1/3 der Fälle endoskopisch möglich2
- Befund abhängig vom Erkrankungsstadium
- Typisch ist ein erhöhter Widerstand am gastroösophagealen Übergang.2
- im fortgeschrittenen Stadium Dilatation des Ösophagus mit Nahrungsresten
- Ausschluss anderer Ursachen (Ösophaguskarzinom, Strikturen)
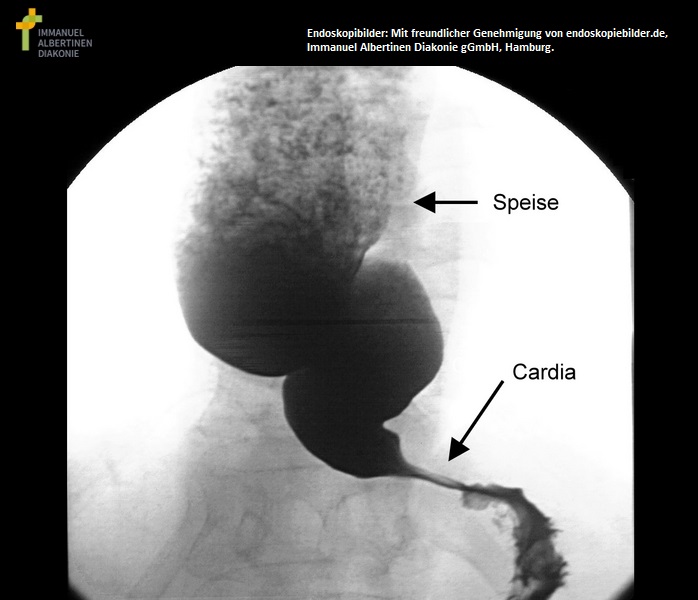
 Achalasie, Röntgen
Achalasie, Röntgen
- Ösophagus-Breischluck (Barium-Ösophagogramm)
- dynamische Röntgenuntersuchung des Schluckvorgangs mit kontrastmittelangereichtertem Nahrungsbolus1-2,9-10
- typische Befunde
- verminderte Peristaltik im distalen Abschnitt
- Dilatation des prästenotischen Ösophagus, spitz zulaufender gastroösophagealer Übergang, fadenförmiger Kontrastmittelübertritt im Kardiabereich („Vogelschnabel" oder „Sektglasform")
- Ösophagusmanometrie
Indikationen zur Überweisung
- Bei Verdacht auf die Erkrankung
Checkliste zur Überweisung
Achalasie
- Zweck der Überweisung
- Bestätigende Diagnostik? Therapie? Sonstiges?
- Anamnese
- Beginn und Dauer? Entwicklung?
- Grad der Schluckbeschwerden? Sonstige Beschwerden? Gewichtsabnahme?
- Andere relevante Krankheiten? Regelmäßige Medikamente?
- Auswirkungen der Beschwerden auf Arbeitsfähigkeit, Lebensqualität?
- Klinische Untersuchung
- Allgemeinzustand
- Ergänzende Untersuchungen
- Evtl. Gastroskopie? Evtl. Röntgen?
Therapie
Therapieziele
- Verbesserung der Schluckfähigkeit und Symptomlinderung
- Verhinderung von Komplikationen (Aspirationspneumonie, Ösophaguskarzinom)
- Insgesamt Verbesserung der Lebensqualität
Allgemeines zur Therapie
- Es existiert keine kurative Therapie.1
- Eine langfristig wirksame medikamentöse Therapie steht nicht zur Verfügung.
- Verschiedene endoskopische und operative Verfahren kommen infrage.
- Gemeinsames Prinzip ist die Reduktion des Widerstandes des unteren Ösophagusshinkters (UÖS).
- Eine Therapieentscheidung sollte individuell erfolgen.
- Patientenalter, Komorbiditäten, Leidensdruck, Komplikationen
- Empfehlungen der amerikanischen Leitlinien (Stand 2013)10gleichwertige interventionelle Primärtherapien
- mehrfache endoskopische pneumatische Dilatation mit zunehmendem Ballondurchmesser („Graded Dilatation")
- laparoskopische Myotomie mit teilweiser Fundoplicatio
Medikamentöse Therapie
Operative Therapie
Endoskopische Verfahren
- Pneumatische Dilatation (PD)
- endoskopische Ballondilatation des UÖS1-2,13
- einmalige Dilatation oder mehrfach mit steigendem Ballondurchmesser („Graded Dilatation")
- Führt zu Beschwerdefreiheit über > 5 Jahre in 40–85 %.2
- Verfahren ist der laparoskopischen OP in einer Beobachtungsstudie nach 2 Jahren gleichwertig.13-14
- jedoch schlechtere Ergebnisse bei jüngeren Patient*innen
- Komplikationen: Perforation (0–10 %), Blutungen (0,4 %)1-2
- Häufig sind wiederholte Behandlungen notwendig (ca. 50 % in 5 Jahren).1-2
- endoskopische Ballondilatation des UÖS1-2,13
- Botulinumtoxin-Injektion in den UÖS
- Stent-Therapie
- Einlage eines Metall-Stent in den UÖS
- bisher wenige Daten zur Langzeiteffektivität
- Komplikationen: Stent-Wanderung (bis zu 27 %)2
Chirurgische Verfahren
- Laparoskopische Myotomie der Kardia und des UÖS (nach Heller)1
- Perorale endoskopische Myotomie (POEM)
- neueres Verfahren mit peroralem, endoskopischem Zugang in Vollnarkose
- selektive Abtragung der zirkulären Muskelschicht des distalen Ösophagus und UÖS1
- Vergleichsstudie zeigt bessere Langzeitergebnisse nach 2 Jahren im Vergleich zur PD.17
- erfolgreiche Behandlung in 92 % der Fälle
- vergleichbare Ergebnisse mit der laparoskopischen OP1
- neueres Verfahren mit peroralem, endoskopischem Zugang in Vollnarkose
- Offene Myotomie der Kardia und des UÖS (modifiziert nach Gottstein und Heller)
- Ösophagektomie
- Therapie der letzten Wahl
- ggf. im Endstadium der Erkrankung notwendig
Verlauf, Komplikationen und Prognose
Verlauf
- Unbehandelt chronisch progrediente Erkrankung
Komplikationen
- Aspiration mit Gefahr der Aspirationspneumonie
- Mangelernährung und Gewichtsverlust
- Dilatation des Ösophagus bis zum Megaösophagus
- Ösophaguskarzinom18
- Ösophagitis
- Perforation nach der Behandlung
Prognose
- Deutliche Besserung der Symptome und objektiver Messkriterien nach Therapie (Ballondilatation oder Operation)11
- Trotz Behandlung häufig Restsymptomatik mit Dysphagie, Brustschmerzen oder Refluxsymptomen.19
Verlaufskontrolle
- Verlaufskontrolle bzgl. klinischer Symptomatik und möglichem Rezidiv
- ggf. erneute Ösophagusmanometrie
- Kontroll-Endoskopie aufgrund des erhöhten Krebsrisikos2
- z. B. alle 2 Jahre zum Ausschluss eines Ösophaguskarzinoms
Patienteninformationen
Patienteninformationen in Deximed
Selbsthilfegruppen
Illustrationen

Achalasie, mit sichtbarer Dilatation im Röntgen


Achalasie
Quellen
Leitlinien
- Deutsche Gesellschaft für Neurologie. Neurogene Dysphagien. AWMF-Registernummer 030-111. S1, Stand 2020. www.awmf.org
Literatur
- Pandolfino JE, Gawron AJ. Achalasia. A systematic review. JAMA. 2015;313(18):1841-1852 . doi:10.1001/jama.2015.2996 www.ncbi.nlm.nih.gov
- Gockel, I; Müller, M; Schumacher, J. Achalasie – eine oft zu spät diagnostizierte und ätiologisch ungeklärte Krankheit. Dtsch Arztebl Int 2012; 109(12): 209-14. doi:10.3238/arztebl.2012.0209 DOI
- Enestvedt BK, Williams JL, Sonnenberg A. Epidemiology and practice patterns of achalasia in a large multi-centre database. Aliment Pharmacol Ther. 2011;33(11):1209-1214. PubMed
- Booy JD, Takata J, Tomlinson G, et al. The prevalence of autoimmune disease in patients with esophageal achalasia. Dis Esophagus. 2012;25:209-213 PubMed
- Park W, Vaezi MF. Etiology and pathogenesis of achalasia: the current understanding, Am J Gastroenterol. Am J Gastroenterol 2005; 100: 1404-1414. pmid:15929777 PubMed
- Tsuboi K, Hoshino M, Srinivasan A, et al. Insights gained from symptom evaluation of esophageal motility disorders: a review of 4,215 patients. Digestion. 2012;85(3):236-242. PubMed
- Sinan H, Tatum RP, Soares RV, Martin AV, Pellegrini CA, Oelschlager BK. Prevalence of respiratory symptoms in patients with achalasia. Dis Esophagus. 2011;24(4):224-228. PubMed
- Deutsche Gesellschaft für Neurologie. Neurogene Dysphagien. AWMF-Registernummer 030/111. S1, Stand 2020. www.awmf.org
- Kopelman Y, Triadafilopoulos G. Endoscopy in the diagnosis and management of motility disorders. Dig Dis Sci. 2011;56:635-654. PubMed
- Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 23 July 2013. doi:10.1038/ajg.2013.196 DOI
- Roll GR, Rabl C, Ciovica R et.al. A controversy that has been tough to swallow: is the treatment of achalasia now digested?. J Gastrointest Surg 2010; 14: 33-45. PubMed
- Wang L, Li YM, Li L. Meta-analysis of randomized and controlled treatment trials for achalasia. Dig Dis Science 2009; 54: 2303-11. pubmed.ncbi.nlm.nih.gov
- Katzka DA, Castell DO. Review article: an analysis of the efficacy, perforation rates and methods used in pneumatic dilation for achalasia. Aliment Pharmacol Ther. 2011;34:832-839. pubmed.ncbi.nlm.nih.gov
- Boeckxstaens GE, Annese V, des Varannes SB, et al. Pneumatic dilation versus laparoscopic Heller's myotomy for idiopathic achalasia. N Engl J Med 2011; 364: 1807-16. New England Journal of Medicine
- Leyden JE, Moss AC, MacMathuna P. Endoscopic pneumatic dilation versus botulinum toxin injection in the management of primary achalasia. Cochrane Database Syst Rev. 2014. (12): CD005046. www.cochranelibrary.com
- Campos GM, Vittinghoff E, Rabl C, Takata M, Gadenstätter M, Lin F, Ciovica R. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg. 2009 Jan;249(1):45-57. doi: 10.1097/SLA.0b013e31818e43ab Review. PubMed PMID: 19106675 www.ncbi.nlm.nih.gov
- Ponds FA, Fockens P, Lei A, et al. Effect of Peroral Endoscopic Myotomy vs Pneumatic Dilation on Symptom Severity and Treatment Outcomes Among Treatment-Naive Patients With Achalasia A Randomized Clinical Trial. JAMA 2019; 322: 134-44. pmid:31287522. www.ncbi.nlm.nih.gov
- Zendehdel K, Nyrén O, Edberg A et. al. Risk of Esophageal Adenocarcinoma in Achalasia Patients, a Retrospective Cohort Study in Sweden . Am J Gastroenterol 2011; 106: 57-61. PubMed
- Frankhuisen R, van Herwaarden MA, Heijkoop R, et al. Persisting symptoms and decreased health-related quality-of-life in a cross-sectional study of treated achalasia patients. Aliment Pharmacol Ther. 2007;26:899-904. PubMed
Autor*innen
- Jonas Klaus, Arzt in Weiterbildung, Neurologie, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).