Allgemeine Informationen
Definition
- Malaria ist die bedeutendste Infektionserkrankung bei Reiserückkehrer*innen.1
- Sie wird durch Protozoen der Gattung Plasmodium ausgelöst, die durch den Stich der fast ausschließlich dämmerungs- und nachtaktiven Anopheles-Mücke übertragen werden.2
Häufigkeit
- Weltweit
- Malaria ist mittlerweile in ca. 100 Ländern eine endemische Erkrankung, etwa 40 % (3,4 Mrd.) der Weltbevölkerung leben in Malaria-Endemiegebieten.3
- Afrika ist mit rund 94 % aller Malariafälle am häufigsten betroffen.4
- Nahezu die Hälfte der Malariafälle weltweit konzentriert sich in nur 5 Ländern: Nigeria (25 %), Demokratische Republik Kongo (11 %), Mosambik (5 %), Uganda (4 %) und Indien (4 %).5
- Sehr selten treten autochthone Fälle in gemäßigten Zonen, z. B. Griechenland, auf.1
- Karten aktueller Endemiegebiete finden sich auf der Seite der deutschen Gesellschaft für Tropenmedizin: www.dtg.org.
- 2019 erkrankten schätzungsweise rund 229 Mio. Menschen weltweit an Malaria, 409.000 Menschen starben an der Erkrankung.4
- Bei rund 67 % handelt es sich um Kinder unter 5 Jahren. Die meisten von ihnen sterben an zerebraler Malaria oder Anämie.
- Malaria ist mittlerweile in ca. 100 Ländern eine endemische Erkrankung, etwa 40 % (3,4 Mrd.) der Weltbevölkerung leben in Malaria-Endemiegebieten.3
- Deutschland
- In Deutschland wurden in den letzten Jahren bei steigender Reisetätigkeit etwa 1.000 importierte Malariafälle jährlich gemäß IfSG-Meldepflicht registriert.5
- Bei etwa 80 % der importierten Malariafälle in Deutschland handelt es sich um Malaria tropica, und etwa 75 % der Infektionen werden aus Afrika mitgebracht.1
- Besonders viele Fälle traten bei Reisen in westafrikanische Länder und nach Kenia auf. Indien und Pakistan waren die wichtigsten Infektionsländer außerhalb Afrikas.3
- Importierte Fälle
- Jährlich reisen rund 125 Mio. Menschen aus nicht betroffenen Teilen der Welt in Endemiegebiete. Mindestens 10.000 von ihnen infizieren sich mit Malaria.6
- Die Zahlen gelten als unsicher, da keine zuverlässigen Angaben zur Meldung und Behandlung von Krankheitsfällen im Aufenthaltsland vorliegen.
- Überproportional erkranken Migrant*innen der 1. oder 2. Generation aus Malaria-Endemiegebieten, die sich beim Besuch bei Freund*innen und Verwandten infiziert haben (Visiting Friends and Relatives, VFRs).5,7
- Gründe hierfür sind häufig:
- eine reduzierte Risikowahrnehmung
- die irrtümliche Annahme einer anhaltenden Teilimmunität gegen Malaria
- sowie der Besuch ländlicher Regionen mit hoher Malariatransmission.
- Hausärzt*innen sollten daher die Gelegenheit nutzen, das Thema Malariaprophylaxe beim Praxisbesuch anzusprechen.5
- Gründe hierfür sind häufig:
- Jährlich reisen rund 125 Mio. Menschen aus nicht betroffenen Teilen der Welt in Endemiegebiete. Mindestens 10.000 von ihnen infizieren sich mit Malaria.6
- In sehr seltenen Fällen werden Malaria-Erreger auch außerhalb ihrer Verbreitungsgebiete übertragen:1,3
- Durch infizierte Moskitos, die mit Flugzeugen bzw. im Gepäck importiert werden.
- Durch lokal vorhandene Moskitos, die sich an einem parasitämischen Menschen infiziert haben.
- Übertragung durch Transfusion oder Transplantation, durch Laborexposition, durch Nadeln und Spritzen (z. B. bei i. v. Drogengebrauch)
- konnatal.
Ätiologie und Pathogenese
Ätiologie
- Malaria wird durch Protozoen der Gattung Plasmodium ausgelöst; diese werden in 5 Arten unterteilt:
- P. falciparum
- Verursacht weltweit die meisten Infektionen und ist zugleich geografisch am weitesten verbreitet.
- Häufigster Erregertyp in Afrika südlich der Sahara, in Südostasien und im pazifischen Raum. Auf Haiti kommt nur Plasmodium falciparum vor.8
- P. vivax
- Kommt überwiegend in Nordafrika, im vorderen Orient, in Pakistan, Indien, Nepal, Sri Lanka und in Mittelamerika vor.
- Jedoch nimmt die Häufigkeit von Plasmodium falciparum auch in diesen Gebieten zu.8
- P. malariae
- P. malariae ist weltweit verbreitet.
- P. ovale
- P. ovale kommt überwiegend in Westafrika vor.8
- P. knowlesi
- P. knowlesi beschränkt sich überwiegend auf Südostasien, ist aber auch dort sehr selten.
- P. falciparum
- Klinisch unterscheidet man 4 Malariatypen:1
- Malaria tropica
- Wird durch eine Infektion mit dem Erreger P. falciparum verursacht
- häufig schwere Verläufe, unbehandelt hohe Letalität
- Malaria tertiana
- Wird durch P. vivax und P. ovale verursacht.
- Verläuft in der Mehrzahl ohne lebensbedrohliche Komplikationen, jedoch häufig mit stark ausgeprägter Symptomatik.
- Durch in der Leber verbleibende Parasitenstadien, den Hypnozoiten, können nach mehreren Wochen bis noch nach Jahren Rezidive auftreten.
- Malaria quartana
- Wird durch P. malariae ausgelöst.
- Ist selten und verläuft im Allgemeinen harmlos.
- Aufgrund eines sehr langsamen Vermehrungszyklus (> 72 Stunden) ist bei dieser Form eine sehr lange Inkubationszeit möglich.
- Zudem kann es bei zu kurzer Therapiedauer zu persistierenden Infektionen oder späten Rückfällen kommen.
- Knowlesi-Malaria
- In Südostasien kann P. knowlesi, eine Plasmodien-Art, die natürlicherweise bei Makaken (Affen sind natürliches Reservoir) vorkommt, auf den Menschen übertragen werden und zu fulminanten Verläufen führen.
- Malaria tropica
Pathogenese
- Plasmodien sind intrazelluläre Parasiten.
- Sie haben einen zweiteiligen Entwicklungszyklus.
- Ein Zyklus im menschlichen Wirt und
- einer in der Überträgermücke.3
Lebenszyklus des Parasiten3
-
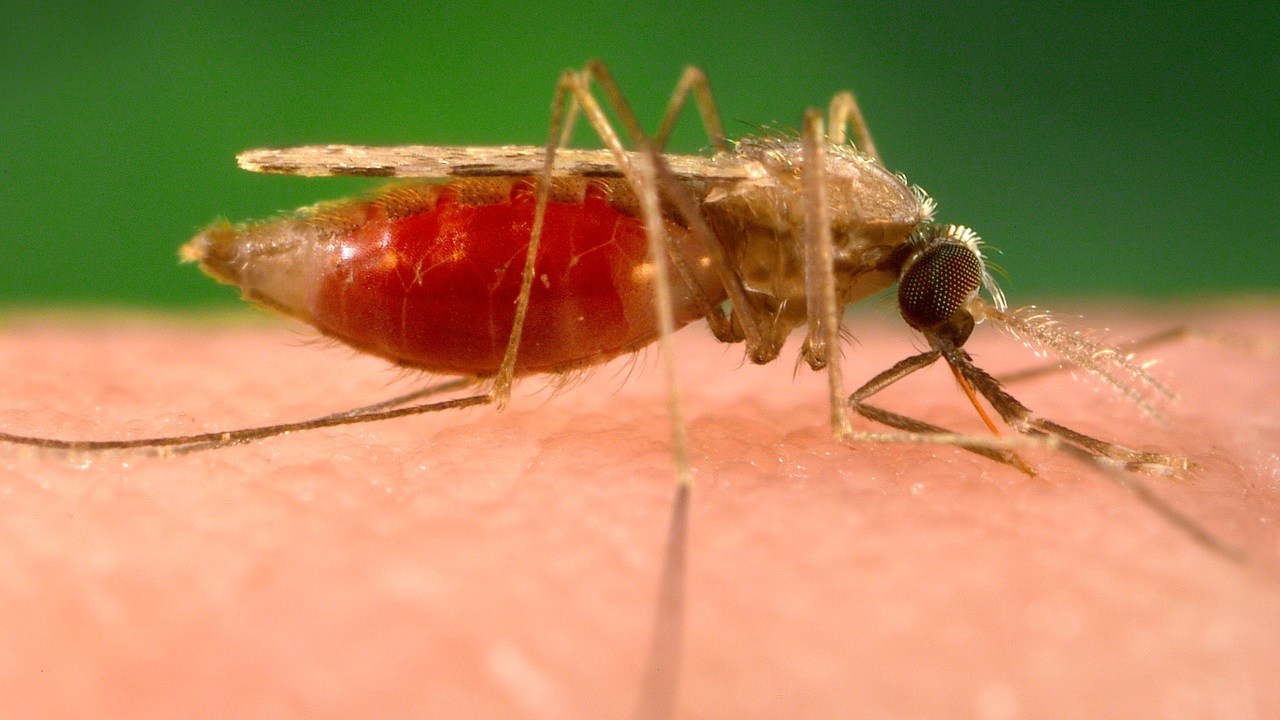
Die Weibchen der Anopheles-Mücke nehmen mit einer Blutmahlzeit unreife Formen des Parasiten (Gametozyten) auf.
 Anopheles-Mücke bei der Blutmahlzeit
Anopheles-Mücke bei der Blutmahlzeit - In ihnen entwickeln sich die Gametozyten weiter zu Sporozoiten, dem Stadium, das beim Menschen eine Infektion auslöst. Die Sporozoiten werden beim Stechen über den Speichel der Mücke auf den Menschen übertragen.
- In der menschlichen Leber entwickeln sich die Sporozoiten durch Teilung zu sog. Gewebeschizonten, die während einer Inkubationszeit von 1–3 Wochen heranreifen und später zu Merozoiten zerfallen.
- Die Zahl der pro Gewebeschizonten gebildeten Merozoiten schwankt mit der Plasmodienart. Bei P. falciparum ist die Zahl am höchsten.
- Die Merozoiten treten aus dem Lebergewebe ins Blut über und befallen die Erythrozyten.
- Bei P. vivax und P. ovale entwickelt sich nur ein Teil der Schizonten zu reifen Formen mit Merozoiten, die dann periodisch ins Blut gelangen.
- Ein anderer Teil der Schizonten verbleibt in einer Art Ruhephase in einzelliger Form über Monate oder Jahre. Durch bisher noch wenig bekannte Stimulation (Stress, Infektionen) reifen diese Hypnozoiten zu merozoitenhaltigen Schizonten und führen dann zu den für die Malaria tertiana charakteristischen Rückfällen.
- In den Erythrozyten vermehren sich die Merozoiten erneut und entwickeln sich zu sog. Blutschizonten. Nach weiteren 48–72 Stunden zerfallen die infizierten Erythrozyten und setzen dabei wieder Merozoiten frei, die anschließend weitere Erythrozyten befallen.
- Einige von ihnen differenzieren sich in den Erythrozyten zu geschlechtlichen Formen (Gamogonie). Es entstehen Makro- und Mikrogametozyten.
- Von Mücken aufgenommene Makro- und Mikrogameten vereinigen sich und bilden eine Oozyste, aus der Sporozoiten hervorgehen, die über den Speichel einen neuen Wirt infizieren können.
- Die erythrozytäre Phase mit Invasion, Proliferation und Zellruptur kann sich unzählige Male wiederholen. Mit zunehmender Parasitämie wird die Erkrankung nach und nach ernster.
Prädisponierende Faktoren
- Aufenthalt in Endemiegebieten ohne (ausreichende) Prophylaxe (Medikamente, Schutz vor Mücken)
- Schwangere und Kinder sind besonders anfällig für lebensbedrohliche Infektionen mit Malaria tropica (P. falciparum).
- Mangelnde Immunität
- Nur wiederholte Malaria-Infektionen im Kindesalter führen zur Immunität.
- Absolute Immunität ist unmöglich, erworbene Immunität kann nach einigen Jahren Aufenthalt außerhalb des Endemiegebiets wieder verlorengehen.
ICPC-2
- A73 Malaria
ICD-10
- B50 Malaria tropica durch Plasmodium falciparum
- B51 Malaria tertiana durch Plasmodium vivax
- B52 Malaria quartana durch Plasmodium malariae
- B53 Sonstige parasitologisch bestätigte Malaria
- B54 Malaria, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Fieber nach Aufenthalt in einem Malariagebiet (insbesondere in den
ersten 4 Monaten nach Rückkehr)1- Aber auch ein schweres Krankheitsbild nach Aufenthalt in einem Malariagebiet ohne Fieber, insbesondere wenn passende Laborveränderungen (Hämolyse, Thrombozytopenie, Nierenversagen) vorliegen, kann für Malaria sprechen.1
- Insgesamt sind weder Symptome noch klinische Befunde hinreichend zuverlässig, um Malaria ausschließlich anhand des klinischen Krankheitsbildes diagnostizieren zu können.9
- Mikroskopischer Nachweis von Parasiten im Blutausstrich oder im „dicken Tropfen"
Differenzialdiagnosen
- Der gesamte Abschnitt basiert auf dieser Referenz.3
- Fieber anderer Genese nach einem Aufenthalt im Malariagebiet
- Eine fieberhafte Erkrankung, die weniger als 7 Tage nach Ankunft in einem Malariagebiet auftritt, ist wahrscheinlich keine Malaria.
- Spezifische Differenzialdiagnosen können Erkrankungen umfassen, wie:
- Grippe
- Harnwegsinfekt
- Typhus
- infektiöse Hepatitis
- Dengue-Fieber oder andere tropische Virusinfektionen
- Leptospirose
- Rickettsiose.
Anamnese
- Fieber nach Aufenthalt in einem Malariagebiet1
- Gliederschmerzen, Kopfschmerzen und Abgeschlagenheit nach vermehrter Malariaexposition in Hochtransmissionsgebieten
- bei Semiimmunität auch Fehlen von Fieber möglich1
- Die anamnestische Angabe der Einnahme einer Malaria-Prophylaxe
schließt eine Malaria nicht aus.1
Infektion mit P. vivax und P. ovale (Malaria tertiana)
- Beim ersten Malaria-Anfall bleiben die regelmäßigen Fieberschübe häufig noch aus, das Fieber steigt und sinkt zufällig im Laufe des Tages.
- Innerhalb weniger Tage entwickeln sich regelmäßige, im zweitägigen Intervall wiederkehrende Fieberschübe.3
- Nach 3–4 Stunden sind die Patient*innen wieder fieberfrei, bis es nach ca. 48 Stunden zu einem erneuten Fieberschub kommt.3
- Weitere mögliche Symptome sind Müdigkeit, Kopfschmerzen, Schwindel, mäßige gastrointestinale Symptome, Myalgien, Arthralgien, Rückenschmerzen und trockener Husten.
- Zwischen den Anfällen fühlen sich die Patient*innen möglicherweise müde, aber ansonsten gesund.
- Ein Malaria-Anfall dauert normalerweise maximal 2 Wochen, Rezidive sind aber jederzeit möglich.
Infektion mit P. malariae (Malaria quartana)
Infektion mit P. knowlesi
- Das klinische Bild wird durch tägliche Fieberschübe mit oft hohen Parasitämien bestimmt.3
- Es kann zu einer komplizierten Malaria kommen.1
Infektion mit P. falciparum (Malaria tropica)
- Abgeschlagenheit, Kopf- und Gliederschmerzen sowie unregelmäßige fieberhafte Temperaturen, auch Durchfälle kommen häufig vor.3
- Der Fiebertyp ist kein diagnostisches Kriterium für eine Malaria tropica, da es nicht zum Auftreten eines rhythmischen Wechselfiebers kommt.3
- Es kann zu einer komplizierten Malaria kommen.1
Komplizierte Malaria
- Eine Malaria wird als kompliziert definiert, wenn klinische oder laborchemische Befunde eines Organversagen vorliegen oder wenn eine Hyperparasitämie besteht.1
- Bei einer komplizierten Malaria ist eine andere therapeutische Strategie zu wählen, als bei einer unkomplizierten Malaria.1
- Kriterien für eine komplizierte Malaria (mind. 1 Kriterium):1
- Klinik: Bewusstseinsstörungen, epileptische Anfälle, respiratorische Insuffizienz, Schock oder Hypotension, Spontanblutungen, Urinausscheidung < 400 ml/24 Stunden, Hämoglobinurie (sog. Schwarzwasserfieber), ausgeprägte Schwäche mit Unfähigkeit zu sitzen, zu stehen oder zu laufen.
- Labor: Hypoglykämie, Azidose oder Laktaterhöhung, Hyperkaliämie > 5,5 mmol/l, Kreatinin > 2,5 mg/dl (> 221 µmol/l) bzw. im Verlauf rasch ansteigende Kreatinin-Werte, schwere Anämie, Bilirubin > 3 mg/dl (50 µmol/l) mit Parasitämie > 100.000/µl
- Parasitämie mit P. falciparum > 250.000/µl (≥ 5 %), P. knowlesi > 100.000/µl (≥ 2 %)
- Unabhängig von den o. g. Kriterien kann in Abhängigkeit von
Komorbiditäten, Alter, klinischem Bild, Ko-Medikation oder anderen
anamnestischen, klinischen oder labordiagnostischen Kriterien die
Entscheidung getroffen werden, ein Management und eine Therapie im Sinne einer komplizierten Malaria einzuleiten.
Klinische Untersuchung
- Fieberspitzen, anfallsartig oder nicht, nach Aufenthalt in einem Malaria-Endemiegebiet
- Hinweise auf eine komplizierte Malaria
- Atemfrequenz?
- Sauerstoffsättigung?
- Herzfrequenz?
- Blutdruck?
- Bewusstseinszustand?
- Neurologische Ausfälle?
- Pupillen?
- Ikterus?
- Weiterhin kann es zu einer Splenomegalie (etwa 26 % der Fälle) und einer Hepatomegalie (etwa 14 % der Fälle) kommen.3
Ergänzende Untersuchungen
- Das Resultat der Diagnostik soll bei kritisch kranken Patient*innen mit Malariaverdacht ohne Zeitverzug (idealerweise innerhalb 1 Stunde) vorliegen, bei leicht kranken Patient*innen innerhalb weniger Stunden.1
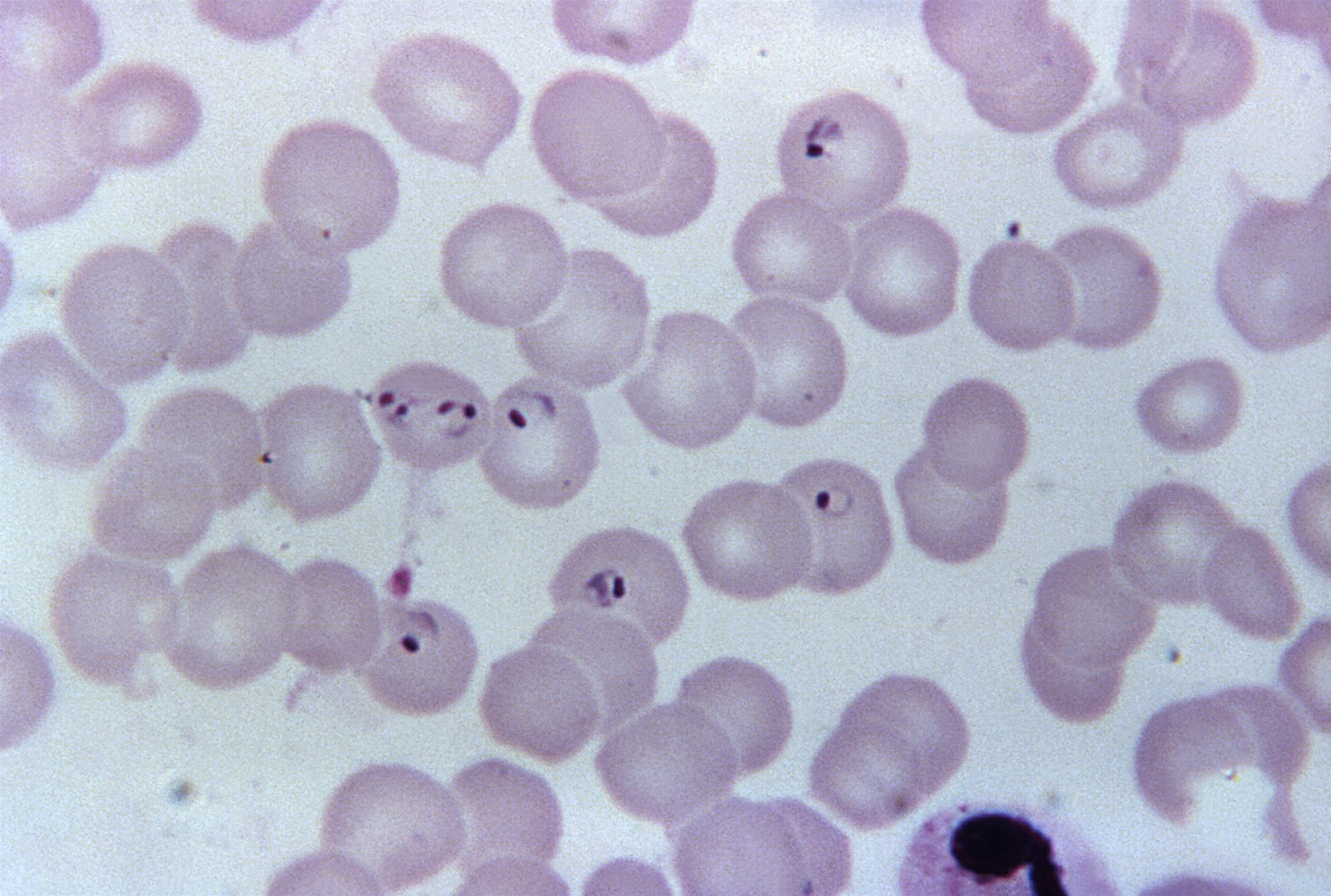
Mikroskopie von „dickem Tropfen“ und Blutausstrich
-
Der mikroskopische Nachweis von Erregern im Blut ist der Goldstandard der Malaria-Diagnostik (hohe Sensitivität und Spezifität, geringe Kosten).1
 Plasmodium falciparum
Plasmodium falciparum- Die Mikroskopie des „dicken Tropfens“ stellt die wichtigste diagnostische Untersuchungsmaßnahme dar: Es handelt sich um eine Anreicherungsmethode, bei der ein Tropfen Kapillarblut ohne Fixierung mit Giemsa-Lösung gefärbt wird. Die Parasitendichte ist gegenüber dem konventionellen Blutausstrich deutlich erhöht, was zu einer hohen Sensitivität beiträgt.
- Der dünne Blutausstrich weist eine deutlich geringere Sensitivität auf, ist aber zur Unterscheidung der verschiedenen Malaria-Arten besser geeignet; deshalb werden beide Untersuchungen gleichzeitig durchgeführt. Er wird ebenso wie der „dicke Tropfen“ mit Giemsa-Lösung gefärbt, aber zuvor fixiert.
- Bei unklarer Diagnose muss die mikroskopische Untersuchung täglich wiederholt werden.1
- Zu Beginn der klinischen Erscheinungen kann die Parasitendichte im peripheren Blut noch sehr gering sein.
- Der Nachweis von Plasmodien ist nicht beweisend für das Vorliegen einer Malaria-Erkrankung, da semiimmune Einwohner*innen von Endemiegebieten klinisch gesunde Träger*innen sein können.
- Andererseits schließt ein negatives Untersuchungsergebnis die Erkrankung nicht sicher aus.3
- Grundsätzlich soll bei Infektionen mit P. falciparum und P. knowlesi immer auch die Parasitendichte (als Parasitenzahl/µl oder als prozentualer Anteil der infizierten Erythrozyten an der Gesamterythrozytenzahl3) ermittelt werden, da die Höhe der Parasitämie die Wahl des therapeutischen Vorgehens mitbestimmt.1
- Das Blut kann unabhängig vom Fieberrhythmus abgenommen werden.1
Schnelltests (RDT)
- Der RDT (Rapid Diagnostic Test) beruht auf dem immunologischen Nachweis von Plasmodien-Antigenen mittels monoklonaler Antikörper auf Papierstreifen.1
- Stellen in der Praxis eine hilfreiche Orientierung zur Mikroskopie dar, falls diese nicht sofort verfügbar ist.1
- Bei positivem Testergebnis kann in der Regel sofort mit der Therapie begonnen werden und die Mikroskopie (mit Bestimmung der Spezies und der Parasitendichte) parallel dazu veranlasst werden.
- Bei negativem Testergebnis ist zum sicheren Ausschluss immer noch eine mikroskopische Abklärung vorzunehmen.
Serologie
- Wird nur selten verwendet. Ist nur dann von Wert, wenn der Verdacht auf eine zurückliegende Malaria-Infektion besteht.1
- Eine Unterscheidung zwischen einer akuten oder einer bereits ausgeheilten Infektion ist nicht möglich.
- Antikörper lassen sich auch nach mehr als 10 Jahren noch nachweisen.
- Häufig kommt es zu Kreuzreaktionen. Die Untersuchungsergebnisse müssen daher mit Vorsicht interpretiert werden.
PCR
- Mittlerweile gut validiertes kommerzielles System, um Plasmodien spezifisch nachzuweisen.1
- Zunehmender Einsatz in der Routinediagnostik als Ergänzung und teilweise auch alternativ zu RDT und Mikroskopie.1
- Der Nachweise von Plasmodium spp. mittels PCR ist sehr sensitiv (< 1 Parasit pro Mikroliter Blut) und spezifisch.1
- Die PCR-Diagnostik ist besonders bei speziellen Fragestellungen interessant.
- Speziesdifferenzierung bei geringer Parasitendichte
- Speziesdifferenzierung, wenn eine P.-knowlesi-Infektion vorliegen könnte (sehr ähnliche Morphologie zu P. malariae).
- sicherer Ausschluss einer Plasmodieninfektion, z. B. vor Organtransplantationen
- Nachweis von Resistenzmakern
Blutuntersuchungen
- Blutbild
- normale Leukozytenwerte oder eine mäßige Leukopenie
- Thrombozytopenie (80 % der Fälle einer akuten Malaria)
- Anämie (in ca. 30 % der Fälle)11
- Bei komplizierter Malaria (tropica):
- erhöhte Transaminasen, Bilirubin
- Laktatazidose (Blutgase mit Säure-Basen-Status)
- Hypoglykämie
- erhöhter Kreatininwert
- möglicherweise Anzeichen einer Verbrauchskoagulopathie (DIC) (Gerinnungsstatus?)
- CRP-Wert (häufig erhöht, kann aber im Frühstadium der Erkrankung noch normal sein.)
- Häufig erhöhter LDH-Wert
Sonstige Untersuchungen
- Zur weiteren Differenzierung komplizierte Malaria/unkomplizierte Malaria sinnvoll:1
- Harnmenge
- Röntgen-Thorax
- Blutkulturen (bakterielle Ko-Infektion?)
- EKG
- Bei Bewusstseinsstörungen: cCT oder cMRT (intrazerebrale Blutung, Hirnödem, Herniation?)1
Indikationen zur Überweisung/Klinikeinweisung
- Umgehend, sofern der Verdacht auf Malaria besteht.
- Die Patient*innen sollten in eine Klinik eingewiesen werden, die eine mikroskopische Untersuchung von dem „dicken Tropfen“ und dem dünnen Blutausstrich durchführen kann.1
- Eine Liste aller tropenmedizinischen Institutionen in Deutschland finden Sie auf der Seite der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG) e. V.
Therapie
Therapieziele
- Prophylaxe: Eine Infektion verhindern.
- Therapie: Die Infektion ausheilen.
Allgemeines zur Therapie
- Die Therapie ist grundsätzlich abhängig von:3
- dem Erreger
- der Resistenzlage
- der zuvor durchgeführten Chemoprophylaxe
- dem klinischen Bild (unkomplizierter oder komplizierter Verlauf der Malaria tropica).
- Malaria tertiana oder Malaria quartana können in der Regel ohne Vorliegen von Risikokonstellation/Komorbiditäten ambulant therapiert werden.1
- Malaria tropica und Knowlesi-Malaria sollten generell stationär behandelt werden.1
- Die komplizierte Malaria sollte intensivmedizinisch betreut werden.1
- Falls eine zweifelsfreie Speziesbestimmung nicht rasch möglich sein sollte, sollte wie bei einer Malaria tropica behandelt werden. Die Spezifizierung sollte die Einleitung der akuten Therapie nicht verzögern.1
- Zur Behandlung von Malaria stehen verschiedene Medikamente zur Verfügung. Sie hemmen allesamt den Reifeprozess der Parasiten in den Erythrozyten (schizontozidale Wirkung).
- Die unkomplizierte Malaria wird in der Regel oral behandelt.1
- Die komplizierte Malaria intravenös.1
Medikamentöse Therapie
Therapie bei maligner Malaria (P. falciparum oder P. knowlesi)
- Bei unkomplizierter Malaria tropica ohne Anzeichen einer schweren Infektion besteht die Behandlung der Wahl aus der Gabe von:1
- Artemether/Lumefantrin (80 mg/ 480 mg Tag 1: 2 x innerhalb von 0 und 8 Stunden, Tag 2 + 3: 2 x tgl., bei Übergewichtigen, nichtimmunen Patient*innen ggf. 5-Tagestherapie als Off-Lable-Use) – oder –
- Dihydroartemisinin/Piperaquin (40 mg/ 320 mg < 75 kg KG: 3 Tabletten pro Tag über 3 Tage; > 75 kg KG: 4 Tabletten pro Tag)
- als Alternative: Atovaquon-Proguanil (1.000 mg/ 400 mg 1 x tgl. über 3 Tage), nicht bei Versagen einer vorausgegangenen
korrekt eingenommenen Chemoprophylaxe mit Atovaquon/Proguanil.
- Bei komplizierter Malaria tropica erfolgt bei entsprechender Verfügbarkeit in erster Linie die intravenöse Verabreichung von:
- Artesunat, in Deutschland nicht zugelassen, die meisten Universitätskliniken haben dies jedoch vorrätig lagernd (2,4 mg/kg KG als Bolus über etwa 5 min i. v. nach 0, 12, 24, 48 und 72 Stunden)1
- in Ausnahmefällen (z. B. Allergien): Chinin (Loading Dose: 20 mg Chinindihydrochlorid/kg KG i. v. über 4 Stunden, Erhaltungsdosis: 8-stündlich 10 mg Chinindihydrochlorid/kg KG i. v. über 4 Stunden, jeweils über 4 Stunden i. v.)1,12
- nach parenteraler Therapie orale Folgetherapie erforderlich analog der Therapie bei unkomplizierter Malaria.1
- In Teilen von Südostasien nimmt die Zahl artemisininresistenter P.-falciparum-Stämme zu (Artemether/Artesunat). Um dem Problem zu begegnen, laufen aktuell in den betroffenen Regionen Studien zur Therapie mit einer arteminisinhaltigen Dreifachkombination.10
Therapie bei benigner Malaria (P. ovale, P. vivax, P. malariae)
- Malaria tertiana (P. ovale, P. vivax): Behandlung mit Artemether/Lumefantrin, Dihydroartemisinin/Piperaquin oder Atovaquon/Proguanil in derselben Dosierung wie bei Malaria tropica (s. o.); hinzuweisen ist darauf, dass es sich hierbei um einen Off-Label-Use handelt.1
- alternativ in Einzelfällen Chloroquin oder Hydroxychloroquin (Cave: hohe Resistenzrate!)
- Bei Malaria tertiana soll eine anschließende Rezidivprophylaxe mit Primaquin (bei P. vivax: 0,5 mg Base/kg KG 1 x tgl. über 14 Tage; bei P. ovale 0,25 mg Base/kg KG 1 x tgl. über 14 Tage) erfolgen.
- vor Gabe Glukose-6-Phosphat-Dehydrogenase-Mangel ausschließen (Enzymbestimmung aus EDTA-Blut)1
- Malaria quartana (P. malariae): Behandlung mit Dihydroartemisinin/Piperaquin analog zur unkomplizierten Malaria tropica1
- alternativ: Atovaquon/Proguanil, in Einzelfällen: Chloroquin oder
Hydroxychloroquin - Da bei P. malariae keine Hypnozoiten vorliegen, ist eine Anschlussbehandlung mit Primaquin nicht erforderlich.3
- alternativ: Atovaquon/Proguanil, in Einzelfällen: Chloroquin oder
Kurzinformation: Medikamente für die Malaria-Therapie
- Artesunat
- Das Präparat kann von Guilin Pharmaceutical Factory, Guangxi, Volksrepublik China, bezogen werden; diese Firma wurde 2010 im Rahmen des „WHO Drug Prequalification Programme“ zertifiziert. Es ist auch im Rahmen von Compassionate Programmes über Importfirmen zu erhalten (z. B. ACE Pharmaceuticals BV, Niederlande).1
- keine Änderung der Dosis bei Niereninsuffizienz, unter Hämofiltration oder Hämodialyse oder bei Leberinsuffizienz
- Nebenwirkungen: fieberhafte Reaktionen, Übelkeit und Erbrechen, Durchfall, vorübergehende Retikulozytopenie, Neutropenien sowie transfusionspflichtige Hämolysen bis zu 4 Wochen nach Therapie.
- Blutbildkontrollen nach 14 Tagen und nach 28 Tagen sinnvoll.
- Atovaquon-Proguanil
- Nebenwirkungen: Übelkeit und Erbrechen, Bauchschmerzen, Durchfall, Husten, manchmal reversible Transaminasen-Anstiege
- Interaktionen: Metoclopramid, Rifampicin, Rifabutin und Doxycyclin können einen Abfall des Atovaquon-Spiegels bewirken. Proguanil kann die gerinnungshemmende Wirkung von Kumarinen verstärken.
- Kontraindikationen: Kreatinin-Clearance unter 30 ml/min
- Artemether/Lumefantrin
- Um die Resorption von Lumefantrin im Darm zu verbessern, sollte das Medikament zusammen mit Milch oder anderen fetthaltigen Nahrungsmitteln eingenommen werden.12
- Nebenwirkungen: Kopfschmerzen, Schwindel, Schlafstörungen, Palpitationen, abdominale Schmerzen
- Interaktionen: Zu erwarten bei gleichzeitiger Gabe von Substanzen, die ebenfalls durch CYP3A4 metabolisiert werden; Substanzen, die die QTc-Zeit verlängern.
- Kontraindikationen: u. a. Verlängerung der QTc-Zeit oder Einnahme von Medikamenten, die die QTc-Zeit verlängern können, Elektrolytstörungen, symptomatische Herzrhythmusstörungen in der Vorgeschichte etc.
- Dihydroartemisinin-Piperaquin
- Die Einnahme sollte nüchtern erfolgen.
- Nebenwirkungen: Anämie, Kopfschmerzen, QT-Zeitverlängerung, Herzrhythmusstörungen, Asthenie, Fieber, Atemwegssymptome, abdominelle Beschwerden, zerebraler Krampfanfall, Husten, Übelkeit und Erbrechen, manchmal reversible Transaminasen-Anstiege
- Interaktionen: Medikamente, von denen bekannt ist, dass sie das QTc-Intervall verlängern, Vorsicht bei Einnahme von Theophyllin.
- Kontraindikationen: QTc-Verlängerung, symptomatische Herzrhythmusstörungen oder klinisch relevante Bradykardie in der Anamnese, jegliche Herzerkrankungen, die für Arrhythmien prädisponieren.
- unter Therapie EKG-Kontrollen sinnvoll
- Primaquin
- Nebenwirkungen: Übelkeit und Erbrechen; hämolytische Anämie bei Glukose-6-Phosphat-Dehydrogenase-Mangel (deshalb vor Primaquin-Gabe Ausschluss eines G6PD-Mangels)
- Kontraindikationen: Schwangerschaft, Stillzeit und Kinder unter 1 Jahr
- Chloroquin
- Nebenwirkungen: meist gering, evtl. Übelkeit und Erbrechen, sehr selten neuropsychiatrische Symptome oder zerebelläre Dysfunktion
- Kontraindikationen: Psoriasis, Porphyrie
- Chinin
- Bei schwerer hepatischer Dysfunktion oder Nierenversagen soll die Erhaltungsdosis um 30 % reduziert werden.
- Dosis um die Hälfte reduzieren, wenn die QTc-Zeit um mehr als 25 % des Ausgangswertes oder auf > 500 msec ansteigt.
- viele Nebenwirkungen: hyperinsulinämische Hypoglykämie, Tinnitus, Hör- und Sehstörungen, Übelkeit, Lebertoxizität, Herzrhythmusstörungen (supraventrikuläre und ventrikuläre Extrasystolen, Sinusbradykardie, ventrikuläre Tachykardie), selten Coombs-Test-positive Hämolyse, Thrombozytopenie, Vaskulitis, granulomatöse Hepatitis, Entwicklung eines Lungenödems
- unter Therapie engmaschige Blutzucker- und EKG-Kontrollen sinnvoll
Weitere Therapien
- Dosierungsempfehlungen der Malaria-Therapie bei Kindern oder in der Schwangerschaft finden sich in der S1-Leitlinie der Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit: Malaria, Diagnostik und Therapie.1
- Supportive Maßnahmen sind bei der komplizierten Malaria für die Prognose mitentscheidend:1
- Fieber senken: Paracetamol, kein ASS wegen der Thrombozyten-Aggregationshemmung, auch NSAID eher vermeiden (Risiko des Stressulkus).
- Anämie: Erythrozytentransfusion ab einem Hb < 7g/dl (< 4,3 mmol/l), Vorerkrankungen beachten.
- Hämostasestörung: Eine grundsätzliche Heparinisierung ist nicht indiziert. Eine Substitution von FFP, Frischblut oder
Thrombozytenkonzentraten ist nur selten nötig. - zerebrale Krampfanfälle: Benzodiazepin-Derivate
- Volumenmangel: vorsichtige Flüssigkeitskorrektur (Cave: Gefahr des Lungenödems!)
- Akutes Nierenversagen: Die Indikationen zur Akutdialyse sind bei komplizierter Malaria nicht unterschiedlich zu anderen Erkrankungen.
- Lungenödem: Die Indikation zur Beatmung sollte zugunsten eines ausgewogenen Volumenmanagements im Hinblick auf eine ausreichende systemische Perfusion frühzeitig gestellt werden.
- An das gleichzeitige Vorliegen einer bakteriellen Sepsis sollte gedacht und ggf. empirisch intravenös antibiotisch behandelt werden.
- Initial sind tägliche EKG-Kontrollen empfohlen, um Rhythmusstörungen oder medikamentenbedingte QTc-Zeit-Veränderungen zu erkennen und entsprechend therapieren zu können.
Prävention
Allgemeines
- Das Malariarisiko wird von der Aufenthaltsdauer, dem Aufenthaltsort, der Jahreszeit und der Prävalenz und Vektorkompetenz infektiöser Anopheles-Mücken bestimmt.10
- Reisende, die ein erhöhtes Expositionsrisiko haben (Langzeitreisende; Reisende, die Familie/Freunde besuchen) oder ein erhöhtes Risiko für einen schweren Verlauf einer Malaria haben (Schwangere, Kinder < 5 Jahre, Reisende > 65 Jahre, komplexe Vorerkrankungen, Immunsuppression, Asplenie), sollten sich von Spezialist*innen für Tropenmedizin/Reisemedizin beraten lassen.10
Schutz vor Mückenstichen
- Das Expositionsrisiko ist zwischen Sonnenuntergang und Sonnenaufgang am höchsten. Während dieser Zeit sollte helle Kleidung den ganzen Körper bedecken, exponierte Körperstellen sollten zudem mit Mückenschutzmittel (mit DEET oder Icaridin) behandelt werden.10
- Auch die Imprägnierung der Kleidung mit Permethrin bietet guten Schutz vor Mückenstichen.10
- Nachts sollten mit Pyrethroiden (Permethrin, Deltamethrin o. Ä.) imprägnierte Moskitonetze verwendet werden.10
- Hotelzimmer mit Klimaanlagen sind häufig frei von Mücken.10
Chemoprophylaxe
- Die Chemoprophylaxe zielt hauptsächlich auf die Verhinderung einer Malaria tropica.
- Sie wirkt nicht gegen die Entstehung von Hypnozoiten, sodass Rezidive einer Malaria tertiana nach Chemoprophylaxe möglich sind.10
- Sie bietet keinen absoluten Schutz gegen eine Malaria-Infektion, zudem sollten stets die möglichen Nebenwirkungen gegenüber dem tatsächlichen Risiko einer Infektion abgewogen werden.
- Die Entscheidung über die Art der Malaria-Prophylaxe soll anhand des konkreten Reisezieles, der Reisezeit, der Reisedauer und des Reisestils von den Ärzt*innen individuell getroffen werden.3
- Die medikamentöse Prophylaxe bei Malaria besteht in erster Linie aus folgenden Wirkstoffen:
- Atovaquon-Proguanil
- Mefloquin
- Doxycyclin.
- Die Empfehlungen zu den verschiedenen Medikamenten beruhen überwiegend auf den jeweiligen Vor- und Nachteilen der Präparate, nicht auf ihrer Schutzwirkung.
- Aktuelle Empfehlungen zur Malaria-Prophylaxe und Therapie finden Sie auch auf der Seite der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit.
Atovaquon-Proguanil
- Ist normalerweise gut verträglich.
- Behandlung: 1 Tbl. (250/100 mg) pro Tag (> 40 kg KG), 1–2 Tage vor und bis 7 Tage nach Reise10
- Es handelt sich um die teuerste Variante.
- Zugelassen für Kinder ab einem Körpergewicht ab 11 kg10
- Sollte nicht von Schwangeren verwendet werden.10
Mefloquin
- Günstige Alternative bei Beachten der Kontraindikationen und des Nebenwirkungspotenzials
- Ausstellung eines Patientenpasses notwendig10
- Nebenwirkungen: möglicher Zusammenhang mit erhöhten Vorkommen von psychiatrischen Symptomen wie Albträumen, Angstzuständen, Depressionen, Unruhezuständen und Verwirrung
- Bei Auftreten entsprechender Symptome sollte die Einnahme von Mefloquin beendet und ärztlicher Rat gesucht werden.
- Patient*innen, die unter Depressionen, einer generalisierten Angststörung, einer Psychose, Schizophrenie oder anderen psychiatrischen Erkrankungen leiden oder gelitten haben, sowie Patient*innen mit Epilepsie, sollten von einer Behandlung mit Mefloquin absehen.10
- In den meisten Fällen zeigen sich die Nebenwirkungen nach der 3. Dosis, weshalb die prophylaktische Einnahme bereits 2–3 Wochen vor der geplanten Reise begonnen werden sollte, um sicherzustellen, dass das Präparat vertragen wird.10
- Das Medikament ist für Kinder ab einem Körpergewicht von 5 kg zugelassen. Es ist nur in einer Tablettengröße erhältlich, die Tabletten müssen geteilt werden.
- Kann während des 2. und 3. Trimenons einer Schwangerschaft verwendet werden.
Doxycyclin
- Doxycyclin ist in Deutschland als Mittel zur Malaria-Prophylaxe nicht zugelassen.
- Ist normalerweise gut verträglich.
- Sollte aufgrund des Risikos phototoxischer Reaktionen (< 3 %) bei starker Sonnenexposition vermieden werden.10
- Das Medikament ist erst ab einem Alter von 8 Jahren zugelassen.
- Während der Schwangerschaft und während der Stillzeit sollte auf eine Behandlung mit Doxycyclin verzichtet werden.
- Behandlung: 1–2 Tage vor bis 4 Wochen nach einem Aufenthalt10
Dosierung10
- Atovaquon-Proguanil (250 mg/100 mg)
- Erwachsene oder Kinder > 40 kg: 1 Tablette täglich
- Die Behandlung wird 1 Tag vor der Ankunft im Malariagebiet begonnen und endet 1 Woche nach der Abreise.
- Atovaquon-Proguanil (62,5 mg/25 mg)
- Kinder 11–20 kg: 1 Tablette täglich
- Kinder 20–30 kg: 2 Tabletten täglich
- Kinder 30–40 kg: 3 Tabletten täglich
- Die Behandlung wird 1 Tag vor der Ankunft im Malariagebiet begonnen und endet 1 Woche nach der Abreise.
- Mefloquin (250 mg)
- Erwachsene > 45 kg: 250 mg (1 Tablette) pro Woche
- Kinder 30–45 kg: 187,5 mg (3/4 Tablette) pro Woche
- Kinder 20–30 kg: 125 mg (1/2 Tablette) pro Woche
- Kinder 5–20 kg: 62,5 mg (1/4 Tablette) pro Woche
- Idealerweise sollte mit der Einnahme bereits 3 Wochen, spätestens jedoch 1 Woche vor Reiseantritt begonnen und die Medikation bis 4 Wochen nach der Abreise beibehalten werden.
- Doxycyclin (100 mg)
- Kinder < 8 Jahre: kontraindiziert
- Kinder 8–10 Jahre (< 36 kg): 1/2 Tablette täglich
- Kinder 11–13 Jahre (< 50 kg): 3/4 Tablette täglich
- Kinder ab 13 Jahren und Erwachsene (> 50 kg): 1 Tablette täglich
- Die Behandlung wird am Tag der Ankunft im Malariagebiet begonnen und endet 4 Wochen nach der Abreise.
Malaria-Prophylaxe in der Schwangerschaft
- Während der Schwangerschaft besteht ein erhöhtes Risiko für eine komplizierte Malaria-Infektion. Die Malaria tropica kann überdies zu Fehl- und Frühgeburten führen.
- Die Chemoprophylaxe bietet keinen absoluten Schutz vor einer Erkrankung, weshalb schwangeren Frauen von einer Reise in Malaria-Endemiegebiete abgeraten werden sollte, sofern diese nicht zwingend notwendig ist.10
- Entschließt sich die Schwangere dennoch, die Reise anzutreten, sollte eine Chemoprophylaxe angewendet werden.
- Mefloquin ist ab dem 1. Trimenon der Schwangerschaft für die Prophylaxe empfohlen.10
- Atovaquon-Proguanil: bisher keine ausreichenden Daten zur Anwendung in der Schwangerschaft, Anwendung während der Schwangerschaft und Stillzeit allenfalls unter strenger Risikoabwägung10
Malaria-Prophylaxe während der Stillzeit
- Die zur Malaria-Prophylaxe verwendeten Medikamente gehen nur in geringen Mengen in die Muttermilch über.
- Die Konzentration der Medikamente in der Muttermilch ist zu gering, um das Kind vor einer Malaria zu schützen.10
Malaria-Prophylaxe bei Kindern
- Die Kombination Atovaquon/Proguanil ist für Kinder ab 11 kg Körpergewicht zur Prophylaxe zugelassen.
- Mefloquin ist für Kinder unter 5 kg Körpergewicht und vor dem 3. Lebensmonat nicht geeignet.
- Doxycyclin darf erst ab dem 9. Lebensjahr verordnet werden.3
Notfallmäßige Selbstbehandlung10
- Bei Reisen in Gebiete, wo das Risiko einer Malaria tropica so gering ist, dass eine medikamentöse Prophylaxe nicht empfehlenswert erscheint (Risiko zwischen 1:10.000 und 1:50.000), kann notfalls zur Selbstmedikation gegriffen werden (sog. Standby-Medikation).
- Dies gilt allerdings nur bei Aufenthalten in abgelegenen Gebieten, in denen ärztliche Hilfe nicht innerhalb 48 Stunden nach dem Einsetzen des Fiebers möglich ist.
- Eine Selbstbehandlung kommt dann infrage, wenn bei plötzlichem Fieber der Verdacht auf eine Malaria-Infektion besteht. Da das Fieber allerdings häufig andere Ursachen hat, ersetzt die Selbstmedikation keinesfalls die anschließende Untersuchung und Abklärung der Symptome durch medizinisch geschultes Personal.
- Folgende Medikamente kommen bei der Selbstbehandlung von Malaria tropica zur Anwendung:
- Artemether-Lumefantrin: 4 Tbl. (80/480 mg) initial, dann 4 Tbl. nach 8, 24, 36, 48, 60 Stunden
- Atovaquon-Proguanil: je 4 Tbl. (1000/400 mg) als Einzeldosis über 3 aufeinanderfolgende Tage
Impfstoff
- Der einzige bisher zugelassene Impfstoff RTS,S/AS01 erreichte in der Phase-3-Studie nur eine Impfstoffwirksamkeit von 26–50 %.15
- Die WHO empfiehlt am 06.10.2021 die breite Anwendung dieses Impfstoffes gegen P. falciparum bei Kindern ab 5 Monaten in Subsahara-Afrika und anderen Regionen mit mäßigen bis hohen P. falciparum Übertragungsraten (4 Dosen). 16
- Neuer von der Universität Oxford entwickelter Impfstoff R21 mit stärkerem Adjuvans erreichte bei Kleinkindern in der Phase-2-Studie 76 % Wirksamkeit beim Schutz vor der Erkrankung (muss 3 x i. m. gegeben werden, Auffrischung nach 1 Jahr).
1617
Meldepflicht
- Meldepflicht gemäß Infektionsschutzgesetz Deutschland (IfSG): Gemäß § 7 Abs. 3 IfSG ist der direkte oder indirekte Nachweis von Plasmodium sp. nichtnamentlich direkt an das RKI zu melden.
- Primär meldepflichtig ist das diagnostizierende Labor, das den einsendenden Ärzt*innen einen Durchschlag des Meldebogens schickt. Die einsendenden Ärzt*innen sind verpflichtet, dem Labor nicht zur Verfügung stehende demografische, anamnestische und klinische Angaben auf dem Meldebogen zu ergänzen und den so ergänzten Meldebogen direkt an das RKI zu senden.3
Verlauf, Komplikationen und Prognose
Verlauf
- In den meisten Fällen kommt es bei einer Infektion mit P. falciparum innerhalb von 3 Monaten nach Rückkehr aus dem Malaria-Endemiegebiet zu ersten Symptomen.
- Treten die Symptome erst später auf, so handelt es sich fast immer um eine Infektion mit P. vivax, P. ovale oder P. malariae.
1718
Allgemeines
- Der Erreger P. falciparum führt (relativ häufig) zum Ausbruch einer komplizierten Malaria mit hoher Sterblichkeit. Die anderen 4 humanpathogenen Erreger verursachen in der Regel nur eine benigne Form.
- In seltenen Fällen kann auch eine Infektion mit P. vivax oder P. knowlesi einen lebensbedrohlichen Krankheitsverlauf nach sich ziehen.
Inkubationszeit1819
- P. falciparum: durchschnittlich 12 Tage (7–15 Tage)
- P. vivax und P. ovale: durchschnittlich 13–14 Tage (12–18 Tage), manchmal auch deutlich länger (< 10–12 Monate)
- P. malariae: durchschnittlich 34 Tage (18–40 Tage)3
- P. knowlesi: mindestens 1 Woche (geringe Erfahrungswerte)
Natürlicher Krankheitsverlauf
- Bei einer Infektion mit P. vivax oder P. ovale kann es noch mehrere Jahre (bei P. vivax bis zu 2 Jahren, bei P. ovale bis zu 5 Jahren3) nach der Erstinfektion zu Rezidiven kommen.
- Eine Infektion mit P. malariae kann nach mehreren Jahrzehnten noch zu Rezidiven führen. Bei P. malariae werden keine Hypnozoiten gebildet. Hier sind aufgrund möglicher sehr niedriger Parasitämien Latenzzeiten von bis zu 40 Jahren bis zum Auftreten einer Symptomatik beschrieben.3
- Die Infektion mit P. knowlesi geht mit einer rapiden Parasitämie einher, das Risiko für schwere Krankheitsverläufe ist hoch.
- Auch bei unkomplizierter Malaria tropica kann es in den Wochen nach Therapie zu einem Hb-Abfall von 1–2 g/dl kommen, sodass abhängig vom Hb nach Therapie und Komorbiditäten Verlaufskontrollen indiziert sein können. Der durch die Malaria verursachte Abfall des Hb ist normalerweise bis zum Tag 28 ausgeglichen.1
Komplikationen
- Zu den möglichen Komplikationen der komplizierten Malaria zählen:
- zerebrale Malaria mit neurologischen Störungen, Krampfanfällen durch Hirnödem, Hirnblutung, Herniation
- hämolytische Anämie
- ARDS (Acute Respiratory Distress Syndrome)
- akute tubuläre Nekrose und Nierenversagen
- akute zentrilobuläre Nekrose mit Ikterus, jedoch ohne Leberversagen
- Laktatazidose und Hypoglykämie
- Schock und Multiorganversagen
- spontane Blutungen und Verbrauchskoagulopathie (DIC)
- sekundäre gramnegative Sepsis
- sekundäre Pneumonie
Prognose
- Bei benigner Malaria ist die Prognose gut.
- P. falciparum (Malaria tropica) weist bei ausbleibender oder unzureichender Behandlung von nichtimmunen Personen eine Mortalität von 20 % auf.3
- Das Risiko für schwere Verläufe ist besonders bei Kleinkindern, Schwangeren und im höheren Alter sowie bei Komorbiditäten erhöht.1
- Bei der Malaria tropica wirken sich eine frühzeitige Diagnose und ein umgehender Behandlungsstart positiv auf die Prognose aus. In Einzelfällen kann sie allerdings bereits innerhalb von 24 Stunden zum Tod führen.
- Die Mortalität bei schweren Verlaufsformen der durch P. falciparum ausgelösten Malaria tropica mit gravierenden Komplikationen ist trotz moderner intensivmedizinischer Behandlungsmöglichkeiten sehr hoch.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Darüber, dass Malaria eine bedrohliche Erkrankung ist, die in wenigen Stunden zum Tod führen kann.10
- Präventive Maßnahmen verringern das Ansteckungsrisiko.10
- Hierzu gehören:
- Expositionsprophylaxe
- Chemoprophylaxe
- notfallmäßige Selbstbehandlung.
- Hierzu gehören:
- Bei fieberhaften Erkrankungen während und bis zu 3 Monate nach dem Aufenthalt in einem Malaria-Endemiegebiet sollte schnellstmöglich ärztliche Hilfe gesucht werden, um eine potenzielle Malaria-Infektion auszuschließen.
- Ein Fieberthermometer sollte auf Reisen mitgenommen werden.10
- Nach Infektion sollten die Patient*innen informiert werden, dass bei allen Malariaformen Wochen bis Monate nach abgeschlossener Behandlung Rezidive möglich sind, sodass bei erneutem Fieber eine umgehende Wiedervorstellung erforderlich ist.1
Patienteninformationen in Deximed
- Malaria
- Technikerkrankenkasse: Was ist Malaria?
Illustrationen
Plasmodium falciparum
Anopheles-Mücke bei der Blutmahlzeit (Foto: James Gathany, PHIL – CDC)
Quellen
Leitlinien
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit. Malaria, Diagnostik und Therapie. AWMF-Leitlinie Nr. 042-001. S1, Stand 2021. www.awmf.org
Literatur
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit. Malaria, Diagnostik und Therapie. AWMF-Leitlinie Nr. 042-001. Stand: 28.02.2021 , gültig bis 31.05.2023. www.awmf.org
- Greenwood BM, Bojang K, Whitty CJM, Targett GAT. Malaria. Lancet 2005; 365: 1487-98. PubMed
- Robert Koch-Institut. Malaria. RKI-Ratgeber für Ärzte. Stand 2015. www.rki.de
- World Health Organization. Malaria. WHO, 2021. www.who.int
- Deutsche Gesellschaft für Tropenmedizin, Malariaempfehlungen Empfehlungen zur Prophylaxe und Therapie der Malaria der DTG 2019. www.dtg.org
- World Health Organization. International travel and Health. WHO. 2017 www.who.int
- Smith AD, Bradley DJ, Smith V et al. Imported malaria and high risk groups: observational study using UK surveillance data 1987-2006. BMJ 2008; 337: 120. www.ncbi.nlm.nih.gov
- Berufsverband deutscher Internisten e.V., Malaria: Formen & Vorkommen, Letzte Aktualisierung: 29.01.2019. www.internisten-im-netz.de
- Taylor SM, Molyneux ME, Simel DL, Meshnick SR, Juliano JJ. Does this patient have malaria? JAMA 2010; 304: 2048-56. PubMed
- Camilla Rothe, Deike Rosenbusch, Martin Alberer et al.. Empfehlungen zur Malariaprophylaxe. Flugmedizin, Tropenmedizin, Reisemedizin 2021; 28: 162-198. www.dtg.org
- Eriksson B, Hellgren U, Rombo L. Changes in erythrocyte sedimentation rate, C-reactive protein and hematological parameters in patients with acute malaria. Scand J Infect Dis. 1989;21(4):434-41. PubMed
- Guidelines for the treatment of malaria. Second edition. WHO. March 2010. www.paho.org
- Abdulla S, Schellenberg JA, Nathan R, Mukasa O, et al. Impact on malaria morbidity of a programme supplying insicticide treated nets in children aged under 2 years in Tanzania: community cross sectional study. BMJ 2001; 322: 270-3. PubMed
- Lengeler C. Insecticide-treated bed nets and curtains for preventing malaria. pubmed.ncbi.nlm.nih.gov
- aerzteblatt.de. Malaria: Neuer Impfstoff erzielt höhere Schutzwirkung. Montag, 26. April 2021. www.aerzteblatt.de
- WHO: WHO recommends groundbreaking malaria vaccine for children at risk. 06.10.2021 (letzter Zugriff am 07.10.2021). www.who.int
- Datoo MS, Natama, HM, Somé A, et al. High Efficacy of a Low Dose Candidate Malaria Vaccine, R21 in 1 Adjuvant Matrix-M™, with Seasonal Administration to Children in Burkina Faso. Preprints with The Lancet 2021. www.thelancet.com
- Lalloo DG, Hill CR. Preventing malaria in travellers. BMJ 2008; 336: 1362-6. pubmed.ncbi.nlm.nih.gov
- White NJ. Malaria, Manson´s Tropical Diseases. 23rd edition, Elsevier-Saunders. 2013. p 532-601.
Autor*innen
- Kristine Scheibel, Dr. med., Fachärztin für Allgemeinmedizin, Norderney
- Birgit Wengenmayer, Dr. med., Fachärztin für Allgemeinmedizin, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).