Allgemeine Informationen
Definition
- Die Clostridioides-difficile-assoziierte Diarrhö (CDI oder CDAD) ist eine Durchfallerkrankung, die durch das anaerobe Bakterium Clostridioides difficile (früher: Clostridium difficile) verursacht wird.1-2
- Sie tritt besonders häufig nach einer Antibiotikabehandlung auf (siehe auch Antibiotika-assoziierte Diarrhö).3
- Es gibt sowohl ambulant, als auch nosokomial erworbene Erkrankungen.4
- Ambulante Erkrankungen sind jedoch weitaus seltener.5
- Durch Toxinbildung kann es zu einer pseudomembranösen Kolitis kommen.
Häufigkeit
- Ca. 5–25 % der Patient*innen, die Antibiotika einnehmen, entwickeln eine Diarrhö6, 15–20 % dieser Erkrankungen sind auf C. difficile zurückzuführen.5
- Clostridioides difficile ist der häufigste Erreger nosokomialer und Antibiotika-assoziierte Durchfallerkrankungen.7
- Bei etwa 1 von 100 antibiotisch behandelten Patient*innen muss mit einer C.-difficile-Infektion gerechnet werden.5
- Ungefähr 3 % der gesunden Bevölkerung, 15–35 % der Krankenhaus-Patient*innen sowie 50–60 % der Bewohner*innen von Pflegeeinrichtungen tragen den Erreger in sich.8
- Die Inzidenz der CDI beträgt in Deutschland 5–20 Fälle pro 100 000 Einw.7
- Die Häufigkeit der CDI nimmt weltweit zu.7
- In den vergangenen Jahren kamen es in Deutschland zu einer stetigen Zunahme von schweren, meldepflichtigen CDI.7
- Am häufigsten von einer CDI betroffen sind hospitalisierte, schwer kranke, ältere Patient*innen.9
Ätiologie und Pathogenese
- Clostridioides difficile
- obligat anaerobes, grampositives, sporenbildendes Stäbchenbakterium
- Kommt ubiquitär in der Umwelt sowie im Darm von Mensch und Tier vor.5
- Vor allem symptomatische Patient*innen scheiden große Mengen von Bakterien/Sporen mit ihrem flüssigen Stuhl aus.5
- C. difficile besitzt eine hohe Toleranz gegen Wärme und Austrocknung sowie gegen eine Reihe verschiedener chemischer Substanzen, einschließlich vieler Desinfektionsmittel.5
- Die Bakterien können so lange an Gegenständen überleben und über Hände oder Stethoskop übertragen werden.10
- Der Infektionsweg erfolgt oral durch Aufnahme der Bakterien (Sporen).5
- Ob eine Infektion über die Luft möglich ist, ist bislang nicht geklärt.1
- Clostridioides difficile, PCR Ribotyp 027 (NAP1/BI/027)
- Clostridioides-difficile-assoziierte Diarrhö
- C. difficile gilt als Erreger von Durchfallerkrankungen in Zusammenhang mit einer Antibiotikatherapie.
- Folgende Antibiotika sind besonders häufig mit Diarrhö und pseudomembranöser Kolitis assoziiert:13
- Cephalosporine: deutlich höheres Risiko bei Cephalosporinen der 3. Generation
- Breitbandpenicilline: z. B. Ampicillinderivate, Piperacillin (auch in Kombination mit Tazobactam)
- Clindamycin
- Clarithromycin: vor allem bei hoher Dosierung (3 x 500 mg)
- Fluorochinolone
- Zwei Metaanalysen zeigten, dass Antibiotikatherapien das Risiko für eine Clostridioidesinfektion um das 5- bis 7-Fache (OR 3,5–6,9) erhöhen.14-15
- höchstes Risiko bei Einnahme von Clindamycin (OR 16‒20)
- erhöhtes Risiko bei Einnahme von Fluorchinolonen (OR 5,5) und Cephalosporinen (OR 5,5)
- erhöhtes, aber etwas geringeres Risiko bei Penicillinen, Makroliden und Sulfonamiden (OR 2–3)
- kein erhöhtes Risiko bei der Einnahme von Tetrazyklinen (OR 0,9)
- Desweiteren nimmt das Risiko für Clostridiodes-Infektionen nachweislich
- bei kumulativer Antibiotikadosierung
- mit der Länge der Behandlung und
- mit der Anzahl eingesetzter Antibiotika zu.16
- Pseudomembranöse Kolitis
Pathophysiologie
- Das auslösende Ereignis für eine C.-difficile-Kolitis sind Störungen der normalen Mikroflora im Dickdarm durch Einnahme von Antibiotika, sodass das Wachstum von Clostridioides difficile begünstigt wird.
- Krankheitsauslösend wirken die Virulenzfaktoren Enterotoxin A und Zytotoxin B, die nicht von allen C.-difficile-Stämmen (apathogene Stämme) produziert werden.5
- Durch die Toxine kommt es zu einer zytotoxischen Schädigung der Intestinalzellen, dies führt zu Diarrhö und Kolitis.5
- Das Risiko und der Schweregrad einer Erkrankung hängen entscheidend von disponierenden Faktoren auf Seiten des Wirtes ab.5
- Störungen der Darmphysiologie/ der mikrobiellen Darmflora z. B. durch Antibiotikabehandlung
- gastrointestinale Grundkrankheiten
- gastrointestinale Eingriffe
- immunologischer Status
- Beispielsweise protektiv ist das Vorhandensein von spezifischen Antikörpern gegen Enterotoxine.
Prädisponierende Faktoren
- Antibiotikatherapien stellen den wichtigsten Risikofaktor dar.9
- Säurehemmende Medikamente scheinen zu einem deutlich höheren Risiko für eine Clostridioides-Infektion zu führen.18
- Die tägliche Einnahme von Protonpumpen-Inhibitoren verdoppelt das Risiko nahezu (II).19-20
- Hohes Alter21
- Stationärer Aufenthalte erhöhen das Risiko.
- Patient*innen, die bei Einweisung ins Krankenhaus kolonisiert sind, sind laut einer Metaanalyse einem 6-mal höheren Risiko für eine Infektion im Lauf des Krankenhausaufenthalts ausgesetzt.22
- Immunsupprimierende Therapie5
- Vorangegangene gastrointestinale Operationen17
- Entzündliche Darmerkrankungen17
- Einnahme von nichtsteroidalen Entzündungshemmern
- Hier wurde ein um 30 % häufigeres Auftreten von CDI beschrieben.5
- Chemotherapie17
- Patient*innen ohne Blinddarm haben möglicherweise ein erhöhtes Risiko für eine Clostridioides-Infektion.23
- Malnutrition17
ICPC-2
- D70a Gastrointest. Infekt., Bakterien
ICD-10
- A04.- Sonstige bakterielle Darminfektionen
- A04.7- Enterokolitis durch Clostridium difficile Inkl.: Lebensmittelvergiftung durch Clostridium difficile Pseudomembranöse Kolitis
- Info: Soll eine rekurrente Infektion mit Clostridium difficile angegeben werden, ist eine zusätzliche Schlüsselnummer (U69.40!) zu benutzen.
- A04.70 Enterokolitis durch Clostridium difficile ohne Megakolon, ohne sonstige Organkomplikationen
- A04.71 Enterokolitis durch Clostridium difficile ohne Megakolon, mit sonstigen Organkomplikationen
- Info: Benutze (eine) zusätzliche Schlüsselnummer(n), um (eine) infektionsbedingte Organkomplikation(en) anzugeben.
- A04.72 Enterokolitis durch Clostridium difficile mit Megakolon, ohne sonstige Organkomplikationen
- A04.73 Enterokolitis durch Clostridium difficile mit Megakolon, mit sonstigen Organkomplikationen
- Info: Benutze (eine) zusätzliche Schlüsselnummer(n), um (eine) infektionsbedingte Organkomplikation(en) anzugeben.
- A04.7- Enterokolitis durch Clostridium difficile Inkl.: Lebensmittelvergiftung durch Clostridium difficile Pseudomembranöse Kolitis
- A04.79 Enterokolitis durch Clostridium difficile, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Eine C.-difficile-Infektion (CDI) liegt vor, wenn eines oder mehrere der folgenden Kriterien erfüllt sind:5
- Durchfall oder toxisches Megakolon, und Nachweis von C.-difficile-Toxin A und/oder B oder kultureller Nachweis von toxinproduzierenden C. difficile im Stuhl
- pseudomembranöse Kolitis nachgewiesen durch eine Endoskopie
- histopathologischer Nachweis von C.-difficile-Infektion (mit oder ohne Durchfall) in einer Endoskopie, Kolektomie oder Autopsie
- Folgende Parameter gelten neben dem klinischen Befund als Risikofaktoren für einen schweren Verlauf der CDI:3
- Fieber > 38,5 °C
- Leukozytose > 15.000 × 109/l
- Linksverschiebung > 20 % stabkernige Granulozyten
- Hypalbuminämie < 30 g/l
- Kreatininanstieg > 50 % des Ausgangswertes
- Laktaterhöhung ≥ 5 mmol/l
- Alter > 65 Jahre
- signifikante Komorbidität (z. B. Niereninsuffizienz, Immunsuppression
u. a.)
Differenzialdiagnosen
- Sonstige Darminfektionen
- Antibiotika-assoziierte Diarrhö
- Divertikulitis
- Entzündliche Darmerkrankungen
- Ischämische Kolitis
- Clostridium-innocuum-Infektion24
- opportunistischer Erreger bei vorwiegend immungeschwächten Patient*innen
- ähnliche Symptome wie bei einer C.-difficile-Infektion
- aber negativer Toxinnachweis
- sehr häufig Resistenz gegenüber Vancomycin
Anamnese
- Durchfall, in der Regel 2–4 Wochen (Variationsbreite: 0–12 Wochen) nach begonnener Antibiotikatherapie
- Prädisponierende Faktoren?
- Meist abrupter Beginn mit wässrigem Durchfall von charakteristisch fauligem Geruch (mindestens 3 Stuhlgänge pro Tag für 2 oder mehrere Tage)5
- selten Blut im Stuhl
- in seltenen Fällen Ausbleiben des Durchfalls bei schweren Verläufen aufgrund eines paralytischen Ileus5
- Fieber (in 28 % der Fälle)5
- Bauchschmerzen (in 22 % der Fälle)5
- Beeinträchtigter Allgemeinzustand
Klinische Untersuchung
- Fieber
- Evtl. geschwächter Allgemeinzustand
- Evtl. Dehydrierung
- In seltenen Fällen Anzeichen von Ileus oder Peritonitis25
Ergänzende Untersuchungen
Stuhldiagnostik
- Die anaerobe Kultur auf Spezialmedien in Kombination mit dem Toxinnachweis im Kulturüberstand ist der diagnostische Goldstandard zum Nachweis einer Clostridioides-Infektion.7
- Toxinnachweis5
- meist in der Routinediagnostik durch Enzymimmunoassays
- Aufgrund der geringeren Sensitivität sollten bei Verdacht immer mehrere Proben getestet werden.
- Alternativ ist der Toxinnachweis durch eine Zytotoxizitätstest möglich, ist hochsensitiv und -spezifisch, gilt eigentlich als Goldstandard, aber ist arbeits- und zeitaufwendig sowie schlecht standardisiert und wird daher nicht von allen Laboren angeboten.
- meist in der Routinediagnostik durch Enzymimmunoassays
- Nachweis des Common Antigens5
- durch Enzymimmunoassays für den Nachweis des Glutamat-Dehydrogenase-Enzyms
- Hochsensitiv, aber wenig spezifisch, da auch nichttoxinbildende Stämme und andere Clostridienspezies nachgewiesen werden (Screeningverfahren).
- Bei einem positiven Ergebnis ist die Durchführung eines weiteren Testes (z. B. Zytotoxizitätstest) nötig.
- Diagnostisch empfiehlt sich aufgrund der hohen Sensitivität dieses 2‑stufige Vorgehen; dies hat sich in der Routinediagnostik bisher aber noch nicht durchsetzt.5,26
- Kultur auf Selektivagarmedien5
- empfindlichste Methode zum Nachweis von C. difficile
- Da auch nichttoxigene Stämme nachgewiesen werden, muss bei positiven Kulturergebnis auch hier der Toxinnachweis erfolgen.
- Nachteil: lange Zeitdauer bis zum Ergebnis
- unerlässlich für die Durchführung der Antibiotika-Empfindlichkeitstestung, sowie der Erregertypisierung
- Resistenztestung für Antibiotika5
- Abgesehen von epidemiologischen Untersuchungen wird die routinemäßige Resistenztestung bei C. difficile selten angewendet, da die meisten Erreger auf eine Metronidazol- oder Vancomycin-Therapie ansprechen.
- Bislang erfolgte der Nachweis metronidazol- und vancomycinresistenter Stämme in Spanien sowie in Österreich bei einem Touristen aus Großbritannien.
- Abgesehen von epidemiologischen Untersuchungen wird die routinemäßige Resistenztestung bei C. difficile selten angewendet, da die meisten Erreger auf eine Metronidazol- oder Vancomycin-Therapie ansprechen.
- Erregertypisierung
- Werden heute in erster Linie durch die PCR-Ribotypisierung sowie die MLVA (Multi-Locus-Variable-Number-Tandem Repeats Analyse) durchgeführt.5,27
- Wichtig für Untersuchungen zu Vorkommen und Ausbreitung der verschiedenen Erregerstämme, für die Aufklärung von Ausbrüchen und Transmissionsketten sowie die Charakterisierung von Stämmen mit besonderen Virulenzeigenschaften.5
- Umgang mit den Proben5
- Transportzeit bei Raumtemperatur 2 Stunden, da das Toxin ansonsten zerfällt.
- Bei 2–8°C können die Proben maximal 3 Tage gelagert werden.
- Eine längere Lagerung ist bei –80 °C möglich.
- Das Einfrieren der Proben bei –20 °C und mehrere Auftau- und Einfrierzyklen sollten jedoch vermieden werden.
Labor
- Hb, CRP, BSG, Leukozyten (häufig ausgeprägte Leukozytose)5
- Elektrolyte (Na, K, Ca) und Kreatinin
- Albumin (ein massiver Proteinverlust kann bereits früh im Krankheitsverlauf auftreten)5
Diagnostik bei Spezialist*innen
- Endoskopie
- Der makroskopische Befund einer pseudomembranösen Kolitis ist in vielen Fällen so charakteristisch, dass die Diagnose der CDI auch mittels Endoskopie (Koloskopie/Sigmoidoskopie) gestellt werden und eine Therapieeinleitung auch ohne vorherigen mikrobiologischen Nachweis eingeleitet werden kann.5
- Zeigt bei schwereren Fällen gelbgraue, fleckweise fibrinöse Membranen (Pseudomembranen) auf, die die Darmwand bedecken.
- Diese lassen sich leicht entfernen und verursachen punktuell Blutungen.
- Röntgen
- Übersichtaufnahme des Abdomens bei stationärer Aufnahme und im Verlauf im Hinblick auf die Entwicklung einer toxischen Dilatation (bei fulminantem Verlauf)
- CT
- Kann segmentale entzündliche Wandverdickungen zeigen.28
Indikation zur Klinikeinweisung
- Bei schwer beeinträchtigten Patient*innen oder Verdacht auf pseudomembranöse Kolitis sollten die Patient*innen zur weiteren Diagnostik und Therapie eingewiesen werden.
Checkliste zur Einweisung
Clostridioides difficile, pseudomembranöse Kolitis
- Zweck der Einweisung
- Diagnostik und Therapie
- Anamnese
- Beginn und Dauer? Auslösende Ursache (Antibiotika)? Evtl. prädisponierende Faktoren? Entwicklung?
- Symptomatik? Diarrhö: Anzahl Entleerungen pro Tag, Blut im Stuhl? Fieber? Bauchschmerzen?
- Evtl. durchgeführter Behandlungsversuch; Wirkung?
- Konsequenzen?
- Klinische Untersuchung
- Allgemeinzustand? Dehydrierung? Abdominalstatus?
- Ergänzende Untersuchungen
Therapie
Therapieziele
- Die Infektion bei Betroffenen heilen.
- Eine Ansteckung anderer Personen vermeiden.
Allgemeines zur Therapie
- Bei leichten Verläufen und Patient*innen ohne Risikofaktoren kann es ausreichen, das auslösende Antibiotikum abzusetzen. Die Erkrankung heilt dann nach 2–3 Tagen spontan aus.5
- Eine Rehydrierung mit adäquater Flüssigkeits- und Elektrolytgabe ist wichtig.9
- Der Einsatz von Antiperistaltika (z. B. Loperamid, Opiate oder Racecadotril) ist bei pseudomembranöser Kolitis wegen der Gefahr eines toxischen Megakolons relativ kontraindiziert.1
- Indikationen für eine Antibiotikatherapie sind:3,5
- schwere oder fortbestehende Symptome
- bei Vorliegen von Risikofaktoren für einen schweren
Verlauf - ältere und/oder Patient*innen mit Grundleiden
-
- Situationen, in denen die aktuelle Antibiotikabehandlung fortgesetzt werden muss.
- Die perorale Antibiotikatherapie scheint deutlich wirksamer zu sein als eine intravenöse Therapie und ist nach Möglichkeit vorzuziehen.29
Medikamentöse Therapie
- Medikamente der 1. Wahl sind:5
- Metronidazol 4 x 250 mg oder 3 x 500 mg oral/i. v. für 10 Tage
- Vancomycin 4 x 125 mg oral für 10 Tage
- In begründeten Ausnahmen (z. B. intestinale Motilitätsstörung) kann die perorale Applikation auf 4 x 500 mg p. o. (max. Tagesdosis 2 g) erhöht werden.3
- Ist der Verlauf nicht rapide und die Symptomatik (noch) nicht schwer, sollte Metronidazol bevorzugt werden. 30
- Vancomycin oral sollte primär eingesetzt werden:5
- bei schwerem, lebensbedrohlichem Krankheitsverlauf
- bei Schwangeren
- Kindern unter 10 Jahren.
- Aufgrund seiner lokalen Wirkung wirkt Vancomycin schneller und ohne systemische Nebenwirkungen.30
- Bei Patient*innen mit lebensbedrohlichen Krankheitsbildern (PMC, toxisches Megakolon) wird eine kombinierte Therapie mit Vancomycin (oral oder über enterale Sonden) und Metronidazol (i. v.) empfohlen.5
- Für eine bessere Wirksamkeit der Kombination von Metronidazol plus Vancomycin gibt es allerdings keine gesicherte Evidenz.30
- Therapie mit Fidaxomicin?26
- Basierend auf neuen Erkenntnissen zur Pathophysiologie der CDI und publizierten klinischen Daten (Stand 2020) halten manche Autor*innen das Antibiotikum Fidaxomicin aktuell sowohl in der ersten Episode als auch im Rezidivfall für die Therapie der Wahl der CDI.
- Dosis: 2 x 200 mg p. o./d für 10 Tage
- Fidaxomicin ist hinsichtlich der Rezidivrate Vancomycin signifikant überlegen.
- Aufgrund des hohen Listenpreises des Fidaxomicins hat sich dies bislang in der Praxis nur begrenzt durchgesetzt.
- In diesem Kontext empfehlen die Autor*innen eine Priorisierung von Patient*innen, die ein besonders hohes Rezidivrisiko haben oder von einer Erhaltung ihrer intestinalen Mikrobiota im Verlauf ihrer weiteren Behandlung profitieren, z. B. Menschen mit allogener Stammzelltransplantation.
- Basierend auf neuen Erkenntnissen zur Pathophysiologie der CDI und publizierten klinischen Daten (Stand 2020) halten manche Autor*innen das Antibiotikum Fidaxomicin aktuell sowohl in der ersten Episode als auch im Rezidivfall für die Therapie der Wahl der CDI.
Rezidivtherapie
- Die Therapie eines ersten Rezidivs kann in gleicher Weise wie bei der Ersterkrankung erfolgen.5
- Alternativ kann die Therapie des ersten Rezidivs mit Fidaxomicin erfolgen.3,26
- Multiple Rezidive können mit einer Intervalltherapie behandelt werden.
- z. B. Vancomycin 125 mg 4 x tgl. für 10 Tage, gefolgt entweder von einer allmählichen Reduzierung der Dosis bis zu einer Dosis von 125 mg pro Tag oder von Pulsregimen, d. h. 125–500 mg/d alle 2–3 Tage mindestens 3 Wochen lang
- Alternativ kommen Fidaxomicin oder der Mikrobiomtransfer mittels Stuhlübertragung infrage.3
- Metronidazol sollte bei multiplen Rezidiven aufgrund der Neurotoxizität bei prolongierter Gabe nicht eingesetzt werden.3
Weitere Therapien
Chirurgische Therapie
- Bei Peritonitis infolge von Perforation, Abszessen oder toxischem Megakolon und Ileus
- Entfernung der geschädigten Darmabschnitte (Kolektomie), ggf. Anlage eines Ileostomas10
Mikrobiomtransfer (Stuhlübertragung)31-38
- Der fäkale Mikrobiomtransfer stellt eine wirksame Therapieergänzung zur Antibiotikatherapie dar, die bei Patient*innen mit Rezidiven bzw. rekurrierenden Clostridioides-difficile-Infektionen infrage kommt.
- Aktuell zeigte eine Registerstudie von 2020 mit bisher 259 Teilnehmer*innen eine Abheilung bei 90 % der von CDI Betroffenen nach einem Monat, meist nach nur einer Anwendung.34
- Autor*innen des Deutschen Ärzteblatts 2020 bezeichnen diesen in Kombination mit einer Antibiotikatherapie sogar als Therapie der 1. Wahl bei rezidivierenden Clostridioides-difficile-Infektion.39
- Voraussetzung ist ein intensives Screening des Donors, z. B. auf HIV, Hepatitis,
Enteropathogene, Stuhlparasiten, multiresistente Erreger. - Es gibt verschiedene Applikationsformen (duodenal, intrakolonisch, oral als Kapseln)
- Die Einnahme verkapselter Mikrobiota-Präparationen ist ähnlich wirksam wie die endoskopische Applikation, bietet aber den Vorteil der anwendungsfreundlicheren bzw. längerfristigen Einnahme.39
- Die Bestimmung therapeutisch-aktiver Bestandteile der fäkalen Mikrobiota ist Ziel der weiteren Forschung, um letztendlich rekombinant hergestellte Präparate herstellen zu können.39
Antikörpertherapie
- Eine Studie zeigt, dass eine einfache Infusion mit monoklonalen Antikörpern gegen das Clostridioides-Toxin in Verbindung mit einer Antibiotikatherapie die Rezidive innerhalb von 3 Monaten von 25 % auf 7 % reduziert (Ib).40
- Bezlotoxumab ist in Europa seit Anfang 2017 zugelassen (nur kombiniert mit einer Antibiotikatherapie) zur Vorbeugung wiederauftretender Clostridioides-difficile-Infektionen bei Erwachsenen mit hohem Rezidivrisiko.41
- Nebenwirkungen
- Herzinsuffizienz
- Übelkeit
- Fieber
- Kopfschmerzen
- Infusionsreaktionen
- Nebenwirkungen
Prävention
- Restriktiver Einsatz von Antibiotika42
- Hygienische Maßnahmen zur Prävention der Weiterverbreitung
- Händewaschen mit Seife und Wasser reduziert das Ansteckungsrisiko (alkoholhaltige Desinfektionsmittel helfen nicht).43-44
- Isolierungsmaßnahmen (Einzelzimmer/Kohortenisolierung mit eigener Nasszelle) für Patient*innen im Krankenhaus/in der Pflegeeinrichtung
- bei begründetem Verdacht Einleitung auch schon vor Eintreffen des mikrobiologischen Befundes
- strenge Hygiene und Verwendung von Handschuhen und Schutzkitteln
- tägliche Wischdesinfektion und gründliche Reinigung der Patientenumgebung
- sachgerechte Aufbereitung von Medizinprodukten sowie von Gegenständen des täglichen Bedarfs sowie sachgerechte Abfallentsorgung
- An der Entwicklung eines Impfstoffes wird derzeit gearbeitet.45
Probiotika46-50
- Es gibt Studien, die darauf hindeuten, dass die Behandlung mit Probiotika in Verbindung mit einer Antibiotikatherapie eine vorbeugende Wirkung sowohl im Hinblick auf Antibiotika-assoziierte Diarrhö als auch auf eine Clostridioides-difficile-Infektion haben kann (Ib).
- Andere Studien wiederum zeigen nicht nur keine positiven Effekte durch Probiotika, sondern auch schädigende Auswirkungen nach Einnahme.
- So gab es z. B. Berichte über Todesfälle durch Fungiämien und Septikämien im Zusammenhang mit der Gabe von Saccharomyces boulardii.44
- Insgesamt besteht weiterhin Forschungsbedarf, um die Dosis und den Typ des Probiotikums und evtl. Nebenwirkungen abzuklären und allgemeine Empfehlungen zum Einsatz geben zu können.
Meldepflicht gemäß IfSG
- In Deutschland besteht Meldepflicht nach § 6 Abs. 1 Satz 1 Nr. 1 IfSG auf die Erkrankung sowie den Tod an einer Clostridioides-difficile-Infektion mit klinisch schwerem Verlauf.5
- Ein klinisch schwerer Verlauf liegt laut Infektionsschutzgesetz § 6 vor, wenn:
- die erkrankte Person zur Behandlung einer ambulant erworbenen Clostridioides-difficile-Infektion in eine medizinische Einrichtung aufgenommen wird.
- die erkrankte Person zur Behandlung der Clostridioides-difficile-Infektion oder ihrer Komplikationen auf eine Intensivstation verlegt wird.
- ein chirurgischer Eingriff, z. B. Kolektomie, aufgrund eines Megakolons, einer Perforation oder einer refraktären Kolitis erfolgt.
- die erkrankte Person innerhalb von 30 Tagen nach der Feststellung der Clostridioides-difficile-Infektion verstirbt und die Infektion als direkte Todesursache oder als zum Tode beitragende Erkrankung gewertet wurde.
Verlauf, Komplikationen und Prognose
Verlauf
- Variiert von asymptomatischen bis zu sehr schweren Fällen.
- Rezidivierende Infektionen mit C. difficile treten bei 20–30 % der Fälle auf.2
- Als gesicherte Risikofaktoren für ein Rezidiv gelten:3
- Alter der Betroffenen > 65 Jahre
- fortgesetzte oder erneute Antibiotikatherapie
- vorangegangenes Rezidiv.
- Als gesicherte Risikofaktoren für ein Rezidiv gelten:3
- Infektionen mit C. difficile Ribotyp 027 zeigen meist einen schwereren Verlauf, eine niedrigere Heilungsrate und häufigere Rückfälle als Infektionen mit gewöhnlicheren Bakterientypen.11
- Der Behandlungserfolg wird rein klinisch definiert.5
- Mikrobiologische Kontrolluntersuchungen nach klinischer Heilung sind nicht notwendig, da nach adäquater Therapie und Sistieren der Symptomatik bei bis zu 30 % der Patient*innen der Toxinnachweis positiv bleibt.
- Ein Rückschluss auf die Ansteckungsfähigkeit ist hieraus nicht möglich.
- Unter pragmatischen Gesichtspunkten sollten daher Isolierungsmaßnahmen noch für einen Zeitraum von 48 h nach Sistieren der Durchfälle aufrechterhalten werden.
Komplikationen
- In 3 % der Fälle zeigt die Erkrankung einen fulminanten Verlauf mit Auftreten
Prognose
- Leichte Fälle heilen oft spontan aus oder sprechen auf eine Therapie gut an.
- Die schwere Clostridioides-difficile-bedingte Diarrhö ist eine potenziell lebensbedrohliche Krankheit.
- Die postoperative 30-Tage-Letalität nach Kolektomie wird mit 24–80 % angegeben.7
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Ausgeprägte pseudomembranöse Kolitis (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
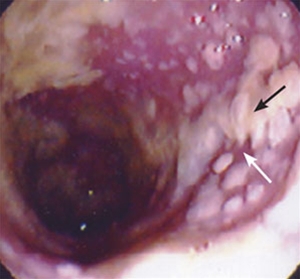
Pseudomembranöse Kolitis
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Gastrointestinale Infektionen und Morbus Whipple. AWMF-Leitlinie-Nr. 021-024. S2k, Stand 2015. www.awmf.org
RKI-Ratgeber
- Robert Koch-Institut. Infektionskrankheiten. Clostridioides difficile. RKI-Ratgeber für Ärzt*innen. Stand 02.02.2018. www.rki.de
Literatur
- Schroeder MS. Clostridium difficile - associated diarrhea. Am Fam Physician 2005; 71: 921-8. PubMed
- Starr J. Clostridium difficile associated diarrhoea: diagnosis and treatment. BMJ 2005; 331: 498-501. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Gastrointestinale Infektionen und Morbus Whipple. AWMF-Leitlinie-Nr. 021-024, Stand 2015. www.awmf.org www.awmf.org
- Khanna S, Pardi DS, Aronson SL, et al. The epidemiology of community-acquired Clostridium difficile infection: a population-based study. Am J Gastroenterol 2012; 107: 89-95. PubMed
- Robert Koch Institut. Infektionskrankheiten, Clostridioides difficile, RKI-Ratgeber, Berlin, Stand: 02.02.2018. www.rki.de
- Edith Bennack, Antibiotikainduzierte Diarrhö-Von lästig bis lebensbedrohlich, Pharmazeutische Zeitung, 09.05.2016. www.pharmazeutische-zeitung.de
- Lübbert C, John E, von Müller L: Clostridium difficile infection— guideline-based diagnosis and treatment. Dtsch Arztebl Int 2014; 111: 723–31. www.aerzteblatt.de
- Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013;108:478-498. PubMed
- Winslow BT, Onysko M, Thaompson KA, et al. Common questions about Clostridium difficile infection. Am Fam Physician. 2014 Mar 15;89(6):437-442. PubMed
- Dallal RM, Harbrecht BG, Boujoukas AJ, Sirio CA, Farkas LM, Lee KK, et al. Fulminant Clostridium difficile: an underappreciated and increasing cause of death and complications. Ann Surg 2002; 235: 363-72. PubMed
- Petrella LA, Sambol SP, Cheknis A, et al. Decreased cure and increased recurrence rates for Clostridium difficile infection caused by the epidemic c. difficile BI strain. Clin Infect Dis 2012; 55: 351-7. PubMed
- Hensgens MP, Goorhuis A, Dekkers OM, Kuijper EJ. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67: 742-8. PubMed
- Ziegler A. Behandlung der Antibiotika-assoziierten Diarrhö. Deutsche Apotheker Zeitung 2008, Nr. 40, S. 58, 02.10.2008. www.deutsche-apotheker-zeitung.de
- Brown KA, Khanafer N, Daneman N, Fisman DN. Antibiotics and the risk of community-associated Clostridium difficile infection (CDI): a meta-analysis. Antimicrob Agents Chemother 2013. doi:10.1128/AAC.02176-12 DOI
- Deshpande A, Pasupuleti V, Thota P, et al. Community-associated Clostridium difficile infection and antibiotics: a meta-analysis. J Antimicrob Chemother 2013. pmid: 23620467 PubMed
- Stevens V, Dumyati G, Fine LS, et al. Cumulative antibiotic exposures over time and the risk of clostridium difficile infection. Clin Infect Dis 2011; 53: 42-8. PubMed
- Fischer A et al. Infektionen mit Clostridium difficile – neue Therapiemöglichkeiten, CMExtra, 02.05.2015. cme.mgo-fachverlage.de
- Kwok CS, Arthur AK, Anibueze CI, et al. Risk of Clostridium difficile infection with acid suppressing drugs and antibiotics: Meta-analysis. Am J Gastroenterol 2012; doi: 10.1038/ajg.2012.108. DOI
- Linsky A, Gupta K, Lawler EV, Fonda JR, Hermos JA. Proton pump inhibitors and risk for recurrent Clostridium difficile infection. Arch Intern Med 2010; 170: 772-8. PubMed
- Howell MD, Novack V, Grgurich P. Iatrogenic gastric acid suppression and the risk of nosocomial clostridium difficile infection. Arch Intern Med 2010; 170: 784-90. PubMed
- Miller M, Gravel D, Mulvey M, et al. Health care-associated Clostridium difficile infection in Canada: patient age and infecting strain type are highly predictive of severe outcome and mortality. Clin Infect Dis. 2010;50(2):194–201. www.ncbi.nlm.nih.gov
- Zacharioudakis IM, Zervou FN, Pliakos EE, et al. Colonization with toxinogenic C. difficile upon hospital admission, and risk of infection: A systematic review and meta-analysis. Am J Gastroenterol 2015 Mar; 110:381. PMID: 25732416 PubMed
- Im GY, Modayil RJ, Lin CT, et al. The appendix may protect against Clostridium difficile recurrence. Clin Gastroenterol Hepatol 2011; 9: 1072-7. PubMed
- Chia J-H, Wu T-S, Wu T-S, et al. Clostridium innocuum is a vancomycin-resistant pathogen that may cause antibiotic-associated diarrhea. Clin Microbiol Infect 2018 Feb 17; pii: S1198-743X(18)30188-5: Epub ahead of print. pmid:29458157 PubMed
- Wanahita A, Goldsmith EA, Marino BJ, Musher DM. Clostridium difficile infection in patients with unexplained leukocytosis. Am J Med. 2003;115(7):543–546. www.ncbi.nlm.nih.gov
- Lieberknecht, S., Vehreschild, M.J.G.T. Update Clostridioides-difficile-Infektion. Gastroenterologe 15, 168–177 (2020). doi.org
- O`Horo JC, Jones A, Sternke M, et al. Molecular Techniques for Diagnosis of Clostridium difficile Infection: Systematic Review and Meta-analysis. . Mayo Clin Proc 2012; 87: 643-51. PubMed
- Ash L, Baker ME, O'Malley CM Jr et al.: Colonic abnormalities on CT in adult hospitalized patients with Clostridium difficile colitis: prevalence and significance of findings. American Journal of Radiology 2006; 186: 1393–400. www.ncbi.nlm.nih.gov
- Wenisch JM, Schmid D, Kuo HW, et al. Prospective observational study comparing three different treatment regimes in patients with Clostridium difficile infection. Antimicrob Agents Chemother 2012; 56: 1974-8. PubMed
- Der Arzneimittelbrief. Erkrankungen durch Clostridium difficile - Epidemiologie, Therapie, Kosten. Jahrgang 51, Nr. 9, Berlin, September 2017 www.der-arzneimittelbrief.de
- Drekonja D, Reich J, Gezahegn S, et al. Fecal microbiotica transplantation for Clostridium difficile infection: A systematic review. Ann Intern Med 2015; 162: 630-8. doi:10.7326/M14-2693 DOI
- Kleger A, Schnell J, Essig A, Case report: Fecal transplant in refractory clostridium difficile colitis. Dtsch Arztebl Int 2013; 110(7): 108–15. www.aerzteblatt.de
- Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol. 2014 ;48:693-702. doi: 10.1097/MCG.0000000000000046. journals.lww.com
- Kelly CR, Yen EF, Grinspan AM, et al. Fecal Microbiota Transplant is Highly Effective in Real-World Practice: Initial Results from the FMT National Registry. Gastroenerology 2020. doi:10.1053/j.gastro.2020.09.038. www.gastrojournal.org
- Lee CH, Steiner T, Petrof EO, et al. Frozen vs Fresh Fecal Microbiota Transplantation and clinical resolution of diarrhea in patients with recurrent clostridium difficile infection: A randomized clinical trial. JAMA 315; 142-9: 10.1001/jama.2015.18098. doi:10.1001/jama.2015.18098 DOI
- Kao D, Roach B, Solva M, et al. Effect of Oral Capsule– vs Colonoscopy-Delivered Fecal Microbiota Transplantation on Recurrent Clostridium difficile Infection A Randomized Clinical Trial. JAMA 2017 Nov 28; 318(20): 1985-1993. pmid:29183074 PubMed
- van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent clostridium difficile. N Engl J Med 2013; 368:407-15. PubMed
- Butler M, Olson A, Drekonja D, et al. Early Diagnosis, Prevention, and Treatment of Clostridium difficile: Update Internet. Rockville (MD): Agency for Healthcare Research and Quality (US); 2016 Mar. (Comparative Effectiveness Reviews, No. 172.) Available from: http://www.ncbi.nlm.nih.gov/books/NBK361173/ www.ncbi.nlm.nih.gov
- Andreas Stallmach et all.. Fäkaler Mikrobiota-Transfer. Deutsches Ärzteblatt 2020; 117: 31-8. doi:10.3238/arztebl.2020.0031 DOI
- Lowy I, Molrine DC, Leav BA, et al. Treatment with monclonal antibodies against Clostridium difficile toxins. N Engl J Med 2010; 362: 197-205. New England Journal of Medicine
- Pharmazeutische Zeitung online Nachrichten 1.2017 www.pharmazeutische-zeitung.de
- Carling P, Fung T, Killion A, Terrin N, Barza M. Favorable impact of a multidisciplinary antibiotic management program conducted during 7 years. Infect Control Hosp Epidemiol 2003; 24: 699-706. PubMed
- Oughton MT, Loo VG, Dendukuri N, et al. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol 2009; 30: 939-44. PubMed
- Stone SP, Fuller C, Savage J, et al. Evaluation of the national Cleanyourhands campaign to reduce Staphylococcus aureus bacteraemia and Clostridium difficile infection in hospitals in England and Wales by improved hand hygiene: four year, prospective, ecological, interrupted time series study. BMJ 2012; 344: e3005. BMJ (DOI)
- Hüttemann D. Die unbeachtete Pandemie Impfen gegen resistente Bakterien, Pharmazeutische Zeitung, 03.03.2020. www.pharmazeutische-zeitung.de
- Gao XW, Mubasher M, Fang CY, Reifer C, Miller LE. Dose-response efficacy of a proprietary probiotic formula of Lactobacillus acidophilus CL1285 and Lactobacillus casei LBC80R for antibiotic-associated diarrhea and Clostridium difficile-associated diarrhea prophylaxis in adult patients. Am J Gastroenterol 2010; 105: 1636. PubMed
- Allen SJ, Wareham K, Wang D, et al. Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difficile diarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 2013. doi: 10.1016/S0140-6736(13)61218-0 DOI
- Johnston BC, Goldenberg JZ, Vandvik PO, et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews 2011; 11: CD004827. pubmed.ncbi.nlm.nih.gov
- Goldenberg JZ, Ma SSY, Saxton JD, Martzen MR, Vandvik PO, Thorlund K, Guyatt GH, Johnston BC. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database of Systematic Reviews 2013, Issue 5. Art. No.: CD006095. pubmed.ncbi.nlm.nih.gov
- Bennack E. Antibiotikainduzierte Diarrhö Von lästig bis lebensbedrohlich. Pharmazeutische Zeitung online 19/2016. Zugriff 07.01.2018 www.pharmazeutische-zeitung.de
- Pepin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ 2004; 171: 466-72. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Kristine Scheibel, Dr. med., Fachärztin für Allgemeinmedizin, Norderney
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).