Allgemeine Informationen
Definition
- Die Definition der idiopathischen Lungenfibrose (übliche Abkürzung auch im deutschen Sprachraum IPF = Idiopathic Pulmonary Fibrosis) umfasst folgende Kriterien:1-2
- spezifische Form einer chronischen, progredienten, nicht reversiblen, fibrosierenden interstitiellen Pneumonie unbekannter Ursache
- Tritt überwiegend bei älteren Patient*innen auf.
- Begrenzung auf die Lungen
- radiologisches und/oder histologisches Muster einer UIP (Usual Interstitial Pneumonia)
- Andere Formen einer interstitiellen Pneumonie müssen ausgeschlossen sein.2
Häufigkeit
- Seltene Erkrankung
- aber häufigste Form der idiopathischen interstitiellen Pneumonien3
- In Europa jährliche Inzidenz 3–9/100.000 mit zunehmender Tendenz4
- Prävalenz zwischen 30 und 60/100.0005
- Manifestation überwiegend jenseits des 50. Lebensjahrs3
- Verteilung Männer zu Frauen > 2:19
- Mehrzahl der Patient*innen mit Raucheranamnese2
Ätiologie und Pathogenese
Ätiologie
- Die Ätiologie der IPF ist definitionsgemäß unbekannt.5
- Familiäre Häufung bei bis zu 11 % der Krankheitsfälle2
Pathogenese
- Das Verständnis der Pathogenese der IPF hat sich in den vergangenen Jahren geändert: Statt von einer chronisch-inflammatorischen geht man nun eher von einer chronisch-fibrosierenden Erkrankung mit komplexen Mechanismen aus.6
- Aktuell werden folgende pathogenetische Mechanismen angenommen:11
- Ausgangspunkt ist ein vermehrter Untergang von Alveolarepithelzellen.
- anschließend fehlgeleitete Wundheilung mit überschießender, anhaltender Proliferation von Bindegewebe und Narbenbildung
- Als finaler Schritt des fehlgeleiteten Wundheilungsprozesses entstehen mit Bronchialepithel ausgekleidete Honigwabenzysten.
- Die Veränderungen führen zu progredienter Atemnot und Verschlechterung der Lungenfunktion.12
- Dabei können 4 Verlaufsformen unterschieden werden:9
- rasch progredient
- mit akuten Exazerbationen
- mäßig progredient
- langsam progredient.
- Krankheitsmanifestation und Verlauf werden wahrscheinlich auch bei sporadischen Fällen erheblich durch die genetische Veranlagung beeinflusst.13
Prädisponierende Faktoren
- Rauchen ist der einzige zweifelsfrei nachgewiesene exogene Risikofaktor.14
- Weitere mögliche Risikofaktoren sind:4-5
- chronische virale Infektionen (z. B. Hepatitis, EBV)
- Exposition gegenüber Metallstäuben
- gastroösophagealer Reflux
- Genetische Polymorphismen und Mutationen werden mit IPF in Zusammenhang gebracht.2
ICPC-2
- R99 Atemwegserkrankung IKA
ICD-10
- J84.1 Idiopathische Lungenfibrose
Diagnostik
- Bis zur Diagnosestellung einer Lungenfibrose vergehen nach den ersten Symptomen im Mittel etwa 2 Jahre.15
Diagnostische Kriterien
- Zur Diagnosestellung werden die Kriterien 1 und 2 oder 1 und 3 vorausgesetzt:2
- Ausschluss einer interstitiellen Lungenerkrankung bekannter Ursache (z. B. durch Kollagenosen/andere Systemerkrankungen, Exposition gegenüber inhalativen Noxen, Medikamenten, etc.)
- Vorhandensein eines UIP-Musters (UIP = Usual Interstitial Pneumonia) im HRCT (High Resolution CT)
- spezifische Kombinationen von HRCT und Histologie.
- Die Diagnosestellung der IPF sollte im Rahmen einer multidisziplinären Diskussion (MDD) erfolgen unter Beteiligung von Pneumolog*in, Radiolog*in sowie evtl. Patholog*in und Rheumatolog*in.2,4,16
Differenzialdiagnosen
- Die IPF sollte auch wegen der Unterschiede in Therapie und Prognose gegen Differenzialdiagnosen abgegrenzt werden.17
- Krankheiten mit histologischem und/oder radiologischem UIP-Muster
- kollagenoseassoziierte Lungenfibrose (inkl. rheumatoide Arthritis)
- Pneumokoniosen, vor allem asbestinduzierte Lungenfibrose
- medikamenten- oder strahleninduzierte Lungenfibrose
- chronische Verlaufsform (Grad III) der exogen-allergischen Alveolitis
- seltene Ursachen
- Lungenfibrose bei Dyskeratosis congenita
- Lungenfibrose bei Hermansky-Pudlak-Syndrom
- Krankheiten mit histologischem und/oder radiologischem UIP-Muster
Anamnese
- Symptome
- Atemnot
- Bei Belastung/in Ruhe?
- Seit wann?
- Schleichender Beginn?
- Langsame/rasche Progredienz?
- trockener Reizhusten
- Verstärkung unter Belastung?
- Häufige Atemwegsinfekte?
- Allgemeinsymptome: Abgeschlagenheit, Müdigkeit, Gewichtsverlust?
- Ein- und Durchschlafstörungen, Tagesmüdigkeit?
- Schlafstörungen und schlafbezogene Atmungsstörungen sind sehr häufig bei IPF-Patient*innen.18
- Atemnot
- Medikamente (zu medikamentösen Auslösern von respiratorischen Erkrankungen siehe auch pneumotox.com)
- Rauchen?
- Sonstige häusliche oder berufliche Exposition gegenüber inhalativen Noxen?
- Kollagenose/sonstige Autoimmunerkrankung?
- Allergien?
- Familienanamnese positiv für IPF?
Klinische Untersuchung
- Inspektion7,19
- Trommelschlegelfinger (ca. 20 %)
- Uhrglasnägel (ca. 50–70 %)
- in fortgeschrittenen Fällen: Ruhedyspnoe, Zyanose, Zeichen der Rechtsherzbelastung
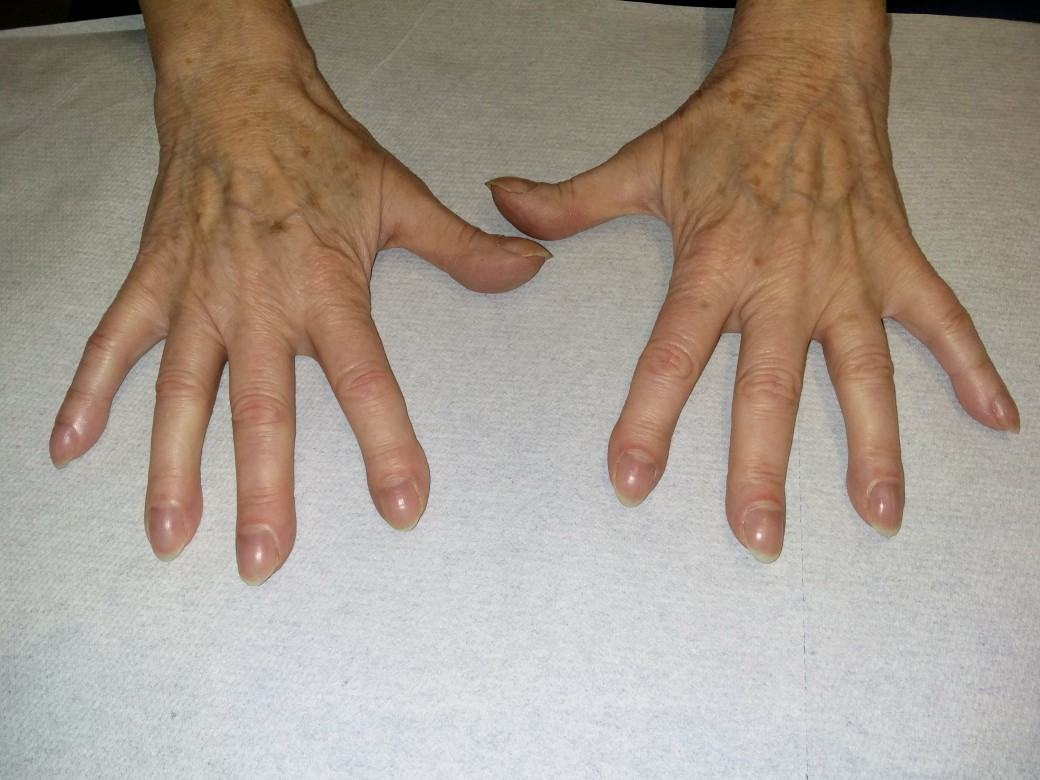 Trommelschlegelfinger
Trommelschlegelfinger
- Auskultation
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- Keine spezifische Labordiagnostik
- Zum Ausschluss/Nachweis einer Kollagenose kann ein Screening durchgeführt werden:1-2
- BSG, CRP, ANA, Rheumafaktor, Anti-CCP, ANCA
- (ANA und Rheumafaktor können bei IPF schwach positiv sein.)
- BSG, CRP, ANA, Rheumafaktor, Anti-CCP, ANCA
- Evtl. NT-proBNP bei V. a. pulmonale Hypertonie/Rechtsherzinsuffizienz
Röntgen-Thorax
- Interstitielle Zeichnungsvermehrung
- differenzierte Beurteilung durch Rö-Thorax aber nicht möglich3
- Rö-Thorax kann insbesondere in den Anfangsstadien unauffällig sein.20
Erfassung von Komorbiditäten
- Komorbiditäten sollten bei IPF-Patient*innen erfasst werden wegen Auswirkungen auf:3,21
- Symptomatik
- Lebensqualität
- Verlauf
- Prognose.
- Zu den häufigsten bzw. relevantesten Komorbiditäten gehören:21
- pulmonale Hypertonie
- COPD/Lungenemphysem
- Bronchialkarzinom
- gastrointestinale Refluxkrankheit (GERD)
- KHK
- Weitere häufige Komorbiditäten sind:21
- Diabetes
- (obstruktive) Schlafapnoe
- arterielle Hypertonie und andere kardiovaskuläre Erkrankungen
- Depressionen
- Die Überlebenszeit ist um über die Hälfte reduziert bei mehr als 4 Komorbiditäten.21
Diagnostik bei Spezialist*innen
Hochauflösendes Thorax-CT (HRCT)
- HRCT ist das entscheidende Bildgebungsverfahren.16
- Bei allen Patient*innen mit Verdacht auf IPF soll ein volumetrisches CT in High-Resolution-Technik ohne Röntgenkontrastmittel durchgeführt werden.2
- Nachweis des Befundmusters einer UIP (Usual Interstitial Pneumonia) ist ein diagnostisches Kriterium für eine IPF.
- Ein UIP-Muster kann aber auch bei anderen interstitiellen Erkrankungen vorliegen und ist somit nicht pathognomonisch für IPF.3
- Kriterien des UIP-Musters4,7
- retikuläre Verdichtungen vor allem subpleural und basal
- Traktionsbronchiektasien
- Honigwabenmuster
- zystisch erscheinende, luftgefüllte Areale, typischer Durchmesser 3–10 mm (bis zu 25 mm)17
- Die Kriterien des UIP-Musters können in unterschiedlichem Ausmaß erfüllt sein, die radiologische Befundung soll unter Verwendung der HRCT-Diagnosekategorien erfolgen:2,4
- definitive UIP
- wahrscheinliche UIP
- unbestimmt
- alternative Diagnose.
- Bei sicherem UIP-Muster in der HRCT sollte zur Vermeidung von Komplikationen auf eine Lungenbiopsie verzichtet werden.1-2
Lungenbiopsie
- Bei Patient*innen ohne sicheres UIP-Muster im HRCT kann ergänzend eine Lungenbiopsie durchgeführt werden.2
- Die transbronchiale Kryobiopsie hat mittlerweile die chirurgische Lungenbiopsie weitgehend abgelöst.22
- Die Risiken der Biopsie können den Nutzen insbesondere bei schweren Lungenfunktionsstörungen oder Komorbiditäten überwiegen.17
Bronchoalveoläre Lavage (BAL)
- Bei Patient*innen ohne eindeutiges UIP-Muster im HRCT wird eine bronchoalveoläre Lavage (BAL) empfohlen.1-2
- Die BAL hilft u. a. in der Abgrenzung gegen eine exogen-allergische Alveolitis mit Lymphozytose in der BAL.7
Lungenfunktionsprüfung
- Nachweis und Quantifizierung einer restriktiven Ventilationsstörung und Gasaustauschstörung durch Spirometrie, Bodyplethysmografie und Bestimmung der Diffusionskapazität
- Eine normale oder nur gering veränderte Lungenfunktionsprüfung schließt eine IPF im Frühstadium aber nicht aus.3,7
6-Minuten-Gehtest
- Beurteilung der Leistungsfähigkeit
- Prognostische Bedeutung3
- Ggf. Indikationsstellung zur O2-Therapie3
Echokardiografie
- Bei V. a. pulmonale Hypertonie/Rechtsherzinsuffizienz
Polysomnografie
- Schlafstörungen und schlafbezogene Atmungsstörungen treten sehr häufig bei IPF-Patient*innen auf. Eine Schlafdiagnostik kann daher in das diagnostische Management einbezogen werden.18
Labor
- Serologisches Screening bei allen Patient*innen mit neu identifizierter interstitieller Lungenerkrankung, auch wenn keine anderen Zeichen oder Symptome einer Kollagenose/Systemerkrankung vorliegen:2
- BSG/CRP
- Rheumafaktor
- ACCP (Antikörper gegen zyklisch-zitrullinierte Peptide)
- ANA
- ANCA
- Weitere serologische Diagnostik von Fall zu Fall (z. B. hinsichtlich Myositis, Sjögren-Syndrom, Sklerodermie)2
Genetische Untersuchung
- Gentests im Rahmen der normalen klinischen Diagnostik sind derzeit nicht empfohlen.2
Indikationen zur Überweisung
- Bei Verdacht auf die Erkrankung Überweisung an eine pneumologische Praxis
Therapie
Therapieziele
- Krankheitsaktivität dämpfen.
- Überleben verlängern.
Allgemeines zur Therapie
- Bestandteile der Therapie sind:
- nichtmedikamentöse Maßnahmen5,23
- Rauchstopp
- Gewichtskontrolle
- körperliche Aktivität
- Infektionsprävention (Impfung gegen Influenza und Pneumokokken)
- O2-Langzeittherapie bei einem paO2 < 55 mm Hg (paO2 < 60 mmHg bei pulmonaler Hypertonie oder Cor pulmonale)
- nichtinvasive Beatmung
- pneumologische Rehabilitation
- medikamentöse antifibrotische Therapie
- Lungentransplantation als einzige kurative Behandlungsoption10
- nichtmedikamentöse Maßnahmen5,23
Medikamentöse Therapie
- Vor der Zulassung der Antifibrotika wurden unterschiedliche Therapieansätze verfolgt (u. a. Immunsuppressiva, Endothelinantagonisten, Phosphodiesterasehemmer, Acetylcystein).23,25-29
- Diese werden mittlerweile nicht mehr empfohlen.23-24
- Die medikamentöse Therapie beruht zurzeit auf 2 antifibrotisch wirksamen Substanzen, Pirfenidon und Nintedanib.24
- einzige Substanzen mit Positivempfehlung in der aktuellen deutschen IPF-Leitlinie30
- Pirfenidon
- Wirkung durch Regulation profibrotischer und proinflammatorischer Zytokinkaskaden24
- Verlangsamung des Krankheitsprozesses in klinischen Studien31-32
- Eine gepoolte Analyse von 3 Studien zeigte eine signifikante Reduktion der Gesamtmortalität in der Pirfenidon-Gruppe versus Placebo.33-34
- Nebenwirkungen meist gut kontrollierbar und reversibel5
- gastrointestinal: Übelkeit und Erbrechen, Diarrhö, Dyspepsie, Gewichtsverlust, Leberwertanstieg, selten schwere Leberschäden35
- dermatologisch: Ausschlag, Phototoxizität
- Laut eines Rote-Hand-Briefs vom Oktober 2020 müssen vor Behandlungsbeginn Transaminasen und Bilirubinspiegel gemessen und in den ersten 6 Monaten einmal monatlich korrigiert werden. Dosisanpassung bei erheblichem Transaminasenanstieg oder Absetzen der Behandlung.
- Nintedanib
- intrazellulärer Tyrosinkinaseinhibitor
- Wirkung durch Hemmung der Signaltransduktion verschiedener Wachstumsfaktoren (Vascular Endothelial Growth Factor [VEGF], Fibroblast Growth Factor [FGF], Platelet Derived Growth Factor [PDGF])24
- Verlangsamt im Vergleich zu Placebo den Erkrankungsprozess und verlängert den Zeitraum bis zur ersten Exazerbation.36-38
- Nebenwirkungen meist mild bis moderat und gut kontrollierbar: Diarrhö, Übelkeit, Erbrechen, Appetitlosigkeit, Gewichtsverlust, Anstieg der Leberwerte5
- Vorsicht bei Patient*innen mit erhöhtem kardiovaskulärem Risiko!5
- Bei symptomatischen Patient*innen wird eine antifibrotische Behandlung ab dem Zeitpunkt der Diagnose empfohlen.24
- Bei guter Verträglichkeit sollte die antifibrotische Therapie zeitlich unbegrenzt, ggf. bis zur Lungentransplantation verabreicht werden.24
- Ein Wechsel zwischen den beiden antifibrotischen Medikamenten ist bei nichtkontrollierbaren Nebenwirkungen und/oder fehlender Wirksamkeit möglich.30
- Eine kombinierte Nintedanib-Pirfenidon-Therapie wird gegenwärtig nicht empfohlen.30
Leitlinie: Medikamentöse Therapie der idiopathischen Lungenfibrose – Update 201724
- Folgende Medikamente werden zur Behandlung der IPF empfohlen:
- Nindetanib (A/1a)
- Pirfenidon (A/1a).
- Folgende Medikamente werden nicht zur Behandlung der IPF empfohlen:
- „Triple Therapie“ (Prednisolon, Azathioprin, Acetylcystein) (A/1b)
- Acetylcystein-Monotherapie (B/2b)
- Antikoagulation mit Vitamin-K-Antagonisten (A/1b)
- Imatinib (A/1b)
- Ambrisentan (A/1b)
- duale Endothelinrezeptor-Antagonisten-1 (Bosentan, Macitentan) (A/1b)
- Phosphodiesterase-5-Inhibitor Sildenafil (B/2b)
- antazide Therapie als IPF-Therapie ohne Hinweis auf Reflux (C/4).
Verlauf, Komplikationen und Prognose
Komplikationen
- Akute Exazerbationen der IPF
- Lungenemphysem
- Pneumothorax
- kumulative Inzidenz von 8,5 %, 12,5 % bzw. 17,7 % nach 1, 2 und 3 Jahren39
- Pulmonale Hypertonie
- bei bis zu 1/3 der Patient*innen schwere pulmonale Hypertonie39
- Lungenkarzinom
- Inzidenz 5–48 %, Risiko für Lungenkarzinom steigt nach Diagnose mit zunehmender Krankheitsdauer an.21
- Pneumonie
- Komplikationen im Rahmen einer Lungenbiopsie (u. a. Blutung, Pneumothorax)
Verlauf und Prognose
- Der klinische Verlauf ist variabel und nicht sicher vorhersagbar.21
- Mehrere mögliche Spontanverläufe:
- stabiler Verlauf
- langsame, gleichmäßige Progression (Mehrheit der Patient*innen)
- rasche Progression
- unvorhersehbare akute Verschlechterung durch Komplikation wie Pneumonie oder aus unbekanntem Grund.
- Unterschiedliche Verläufe möglicherweise bedingt durch komplexes Zusammenspiel von Geschlecht, Alter, genetischen und Umweltfaktoren6
- Progression kann durch Bestimmung des Lungenvolumens (FVC, forcierte exspiratorische Vitalkapazität) eingeschätzt werden.7
- stabile Patient*innen mit Schwankungen < 5 %
- Abfall der FVC um 5–10 % in 6–12 Monaten deutet auf prognostisch relevante Progression hin.
- Abfall der FVC > 10 % in 6 Monaten ist mit stark erhöhter Mortalität verbunden.
- Pneumologische Rehabilitation verbessert körperliche Belastbarkeit, Lebensqualität und Symptome.39-40
- Insgesamt schlechte Prognose, mittleres Überleben nach Diagnosestellung: 3–5 Jahre5,10,41
- Häufigkeit von Exazerbationen ca. 5–15 % pro Jahr mit hoher Mortalität7
- mittlere Lebenserwartung 3–4 Monate nach akuter Exazerbation4
- Komorbiditäten mit ungünstigem Einfluss auf die Prognose, die Anzahl der Komorbiditäten korreliert mit der Prognose.21
- Konsequente Behandlung von Komorbiditäten führt möglicherweise zu einer Verbesserung der Prognose.21
- Familiäre Formen der IPF weisen häufig eine langsamere Progredienz auf.11
Verlaufskontrolle
- Regelmäßige Verlaufskontrollen üblicherweise in 3- bis 4-monatigen Intervallen2
- Wichtige Parameter für die Verlaufsbeurteilung sind:2
- Lebensqualität
- Belastbarkeit (6-Minuten-Gehtest)
- Lungenfunktion (Spirometrie/Bodyplathysmografie)
- Diffusionskapazität
- Bildgebung (HRCT).
- Eine periodische Vorstellung bei niedergelassenen Pneumolog*innen sowie einem Zentrum für interstitielle Lungenerkrankungen ist sinnvoll.2
Patienteninformationen
Patienteninformationen in Deximed
Weitere Informationen
- Siehe Artikel Beurteilung der Fahreignung.
Illustrationen

Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)

Lungenfibrose, Röntgen

Lungenfibrose, CT
Quellen
Leitlinien
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Diagnostik der Idiopathischen Lungenfibrose. AWMF-Leitlinie Nr. 020-016. S2k, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Idiopathische Lungenfibrose – Update zur medikamentösen Therapie. AWMF-Nr. 020-016. Stand 2017. www.pneumologie.de
- American Thoracic Society, European Respiratory Society, Japanese Respiratory Society, Latin American Thoracic Society. Diagnosis of Idiopathic Pulmonary Fibrosis. Stand 2018. www.atsjournals.org
Literatur
- Raghu G, Remy-Jardin M, Myers J, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198: e44-e68. doi:https10.1164/rccm.201807-1255ST www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Diagnostik der Idiopathischen Lungenfibrose. AWMF-Leitlinie Nr. 020-016. S2k, Stand 2019. www.awmf.org
- Kreuter M, Warth A, Heußel C. Diagnostik Idiopathische Lungenfibrose. PneumoNews 2016; 8: 38-46. doi:10.1007/s15033-016-0534-3 DOI
- Hamer O, Rehbock B, Schaefer-Prokop C. Idiopathische pulmonale Fibrose - Radiologische Diagnose unter Berücksichtigung der aktuellen Leitlinie. Radiologe 2020;60:549-562. doi:10.1007/s00117-020-00675-5 DOI
- Markart P, Drakopanagiotakis F, Derugin N, et al. Idiopathische Lungenfibrose. PneumoNews 2019;11: 28-34. www.springermedizin.de
- Schäfer S, Funke-Chambour M, Berezowska S. Idiopathische Lungenfibrose – Epidemiologie, Ursachen und klinischer Verlauf. Pathologe 2020; 41: 46-51. doi:10.1007/s00292-019-00747-x DOI
- Behr J. The diagnosis and treatment of idiopathic pulmonary fibrosis. Dtsch Arztebl Int 2015; 110: 875-881. doi:10.3238/arztebl.2013.0875 www.aerzteblatt.de
- Raghu G, Weycker D, Edelsberg J, et al. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006; 174: 810-6. PubMed
- Loddenkemper R, Costabel U. Die idiopathische Lungenfibrose. Pneumologe 2013; 10: 79–80. doi:10.1007/s10405-012-0610-2 DOI
- King Jr TE, Pardo A, Selman M. Idiopathic pulmonary fibrosis. Seminar. Lancet 2011; 378: 1949-61. PubMed
- Prasse A, Müller-Quernheim J. Grundlagen, Epidemiologie und Pathogenese der idiopathischen Lungenfibrose. Pneumologe 2013; 10: 81-88. doi:10.1007/s10405-012-0605-z DOI
- Gross TJ, Hunninghake GW. Idiopathic pulmonary fibrosis. N Engl J Med 2001; 345: 517-25. PubMed
- Ruwisch J, Prasse A. Pathogenese der idiopathischen Lungenfibrose aus dem Blickwinkel der Genetik. Pneumologe 2020; 17: 153-161. www.springermedizin.de
- Lungenfibrose: Risikofaktoren. Lungeninformationsdienst, letzte Aktualisierung 27.08.18. Zugriff 20.01.20. www.lungeninformationsdienst.de
- Lungenfibrose: Symptome. Lungeninformationsdienst, letzte Aktualisierung 22.08.18. Zugriff 22.01.20. www.lungeninformationsdienst.de
- Koschel D. Diagnose der idiopathischen Lungenfibrose – die neuen Leitlinien. Pneumologe 2020; 17: 162-168. doi:10.1007/s10405-020-00315-8 DOI
- Kreuter M, Warth A, Wenz H, et al. Idiopathische Lungenfibrose - Diagnostik und Differenzialdiagnose. Pneumologe 2013; 10: 89-97. doi:10.1007/s10405-012-0606-y DOI
- Rasche K, Leidag M, Orth M. Schlaf und idiopathische Lungenfibrose (IPF). Somnologie 2020; 24: 11-15. doi:10.1007/s11818-020-00241-0 DOI
- Raghu G, Mageto YN, Lockhart D, Schmidt RA, Wood DE, Godwin JD. The accuracy of the clinical diagnosis of new-onset idiopathic pulmonary fibrosis and other interstitial lung disease: a prospective study. Chest 1999; 116: 1168-74. PubMed
- Hostettler K. Idiopathische Lungenfibrose. Schweiz Med Forum 2017; 17: 1115-1123. doi:10.4414/smf.2017.03158 DOI
- Polke M, Kreuter M. Bedeutung von Komorbiditäten bei der idiopathischen Lungenfibrose. Pneumologe 2020;17:169-176. doi:10.1007/s10405-019-00294-5 DOI
- Costabel U, Behr J. Idiopathische Lungenfibrose. Pneumologe 2020; 17: 151-152. doi:10.1007/s10405-020-00317-6 DOI
- Dartsch R, Fink L, Breithecker A, et al. Chronisch-fibrosierende Lungenerkrankungen - Die idiopathische pulmonale Fibrose im Spiegel ihrer Differenzialdiagnosen. Internist 2019; 60: 345-361. doi:10.1007/s00108-019-0571-1 DOI
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Idiopathische Lungenfibrose – Update zur medikamentösen Therapie. Pneumologie 2017; 71: 460-474. doi:10.1055/s-0043-115504 DOI
- Hunninghake GW. Antioxidant therapy for idiopathic pulmonary fibrosis. N Engl J Med 2005; 353: 2285-7. PubMed
- Bajwa EK, Ayas NT, Schulzer M, Mak E, Ryu JH, Malhotra A. Interferon-gamma1b therapy in idiopathic pulmonary fibrosis: a meta-analysis. Chest 2005; 128: 203-06. www.ncbi.nlm.nih.gov
- Zisman DA, Schwartz M, Anstrom KJ, et al. A controlled trial of sildenafil in advanced idiopathic pulmonary fibrosis. N Engl J Med 2010; 363: 620-8. PubMed
- Horton MR, Santopietro V, Mathew L, et al. Thalidomide for the treatment of cough in idiopathic pulmonary fibrosis: a randomized trial. Ann Intern Med 2012; 157: 398-406. www.ncbi.nlm.nih.gov
- Raghu G, Anstrom KJ, King TE, et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012; 366: 1968-77. New England Journal of Medicine
- Markart P, Drakopanagiotakis F, Wygrecka M. Antifibrotische Therapie der idiopathischen pulmonalen Fibrose. Pneumologe 2020; 17: 177-185. doi:10.1007/s10405-019-00296-3 DOI
- Noble PW, Albera C, Bradford WZ, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011; 377: 1760-9. PubMed
- King TE, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402582 DOI
- Markart P, Günther A. Gepoolte Analyse und Metaanalyse - Pirfenidon verbessert das Überleben bei idiopathischer Lungenfibrose. PneumoNews 2017; 9: 20-22. doi:10.1007/s15033-017-0692-y DOI
- Nathan S, Albera C, Bradford W et al. Effect of pirfenidone on mortality: pooled analyses and meta-analyses of clinical trials in idiopathic pulmonary fibrosis. Lancet Respir Med 2017; 5: 33-41. doi:10.1016/S2213-2600(16)30326-5 DOI
- arznei-telegramm: Schwere hepatische Störwirkungen unter Pirfenidon (Esbriet). arznei-telegramm 2020; Jg 51, Nr. 4. www.arznei-telegramm.de
- Jäger-Becker D. Update zur idiopathischen Lungenfibrose. MMW Fortschritte der Medizin 2019; 3: 64. doi:10.1007/s15006-019-0189-1 DOI
- Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011; 365: 1079-87. New England Journal of Medicine
- Richeldi L, du Bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonar fibrosis. N Engl J Med 2014. doi:10.1056/NEJMoa1402584 DOI
- Gläser S, Glöckl R, Bonella F. Therapie von Komplikationen und nichtpharmakologisches Management der idiopathischen pulmonalen Fibrose. Pneumologe 2020; 17: 186-196. doi:10.1007/s10405-020-00313-w link.springer.com
- Cheng L, Tan B, Yin Y, et al. Short- and long-term effects of pulmonary rehabilitation for idiopathic pulmonary fibrosis: a systematic review and meta-analysis. Clin Rehabil. 2018. PMID: 29843523 www.ncbi.nlm.nih.gov
- Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011; 183: 431-40. PubMed
- Formen der Lungenfibrose. Lungeninformationsdienst, letzte Aktualisierung 28.08.18. Zugriff 21.01.20. www.lungeninformationsdienst.de
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).