Allgemeine Informationen
Definition
- Aseptische Osteonekrose des Femurkopfes im Kindesalter, die innerhalb von etwa 2–4 Jahren selbstheilend abläuft, jedoch als unterschiedlich schwer ausgeprägte präarthrotische Deformität eine irreversible Schädigung des Hüftgelenks verursachen kann.1
- Synonyme: M. Perthes, Coxa plana
- Es gibt mehrere Klassifikationssysteme, u. a.:
- radiologische Stadieneinteilung nach Waldenström
- Einteilung nach der lateralen Epiphysenhöhe nach Herring als prognostischer Faktor.
- Die Krankheit wurde erstmals im Jahre 1910 von Legg, Calvé und Perthes unabhängig voneinander beschrieben.
Klassifikation nach Herring
- Höhe des lateralen Drittels des Femurkopfes (durch Nekrose abnehmend)
- Herring A: laterale Säule der Epiphyse nicht höhengemindert
- Herring B: laterale Säule der Epiphyse um < 50 % höhengemindert
- Subtyp B/C: laterale Säule um 50 % höhengemindert
- Herring C: laterale Säule der Epiphyse um > 50 % höhengemindert
- Die Prognose bei Herring A wird allgemein als günstig, die bei Herring B als nicht vorhersagbar und die bei Herring C als ungünstig angesehen.2
Häufigkeit
- Die Erkrankung ist mit einer Häufigkeit von 10,8:100.000 Kindern eine relativ häufige Hüfterkrankung im Kindesalter.3
- Sie tritt häufiger bei Jungen auf, im Verhältnis 4–5:1.2
- Es besteht eine Häufung im 5. und 6. Lebensjahr.2
- Bei 10 % der Kinder ist auch das kontralaterale Bein betroffen.4
- Das Prädilektionsalter beträgt 3‒12 Jahre.5
Anatomie
- Der Hüftkopf ist sphärisch und mit Gelenkknorpel bedeckt.
- Die Fovea ist eine ovale, nicht ganz zentrierte Vertiefung, die zur Befestigung für das Ligamentum teres femoris (das runde Ligament) dient.
- Das Caput femoris wird durch einen vaskulären Ring an der Basis des Oberschenkelhalses aus Ästen der lateralen und medialen Circumflexa-Arterien versorgt. Die oberen und unteren Glutea-Arterien tragen in geringerem Umfang zur Versorgung bei.
- Die Arterie im Ligamentum teres femoris ist bei Kindern für 1/3 der Durchblutung des Hüftkopfes verantwortlich, während sie bei Erwachsenen nur wenig zur Versorgung beiträgt.
Ätiologie und Pathogenese
- Durch eine Minderdurchblutung des Femurkopfes kommt es zu einer aseptischen, avaskulären Nekrose.6
- Die Ursache ist unbekannt, scheint aber multifaktoriell zu sein.
- Folgende Faktoren können zu einer Minderdurchblutung beitragen:1
- erhöhte Blutviskosität bei z. B. gestörter Thrombolyse
- rezidivierende Knocheninfarkte
- Gefäßanomalien
- Skelettretardierung mit verspäteter Ossifikation
- Der Blutfluss in den epiphysären Gefäßen wird durch das Körpergewicht bei ausbleibender Verknöcherung reduziert.
- erhöhte Blutviskosität bei z. B. gestörter Thrombolyse
Pathophysiologie
- Eine unzureichende Blutversorgung des Caput femoris führt zu einer Osteonekrose.
- Wenn das Caput femoris bei dieser selbstlimitierenden Erkrankung im Verlauf wieder revaskularisiert wird, erfolgt zunächst eine Resorption des nekrotischen Knochens, bevor neuer Knochen den alten ersetzt. Während dieses Prozesses besteht das Risiko, dass das Caput femoris abflacht oder vollständig kollabiert.
- Wie gut die Reparatur gelingt, hängt vom Alter des Kindes ab (je jünger desto besser) sowie von einer ggf. gleichzeitigen Infektion, der Gelenkkongruenz und anderen mechanischen und physiologischen Faktoren.
- Die Therapie zielt darauf ab, diese Faktoren zu optimieren.
- Ergebnis und Verlauf des Reparaturprozesses mit Revaskularisierung und Wiederaufbau des Caput femoris variieren.
- Bei einigen Patient*innen wird das Caput femoris beinahe vollständig wiederhergestellt, doch bei den meisten verbleibt es abgeflacht.
- Der Grad der Gelenkkongruenz nach Beendigung des Reparaturprozesses ist der wichtigste Prädiktor für die zukünftige Entwicklung von Arthrose.
- Für den typischen stadienartigen Verlauf existiert die Einteilung nach Waldenström:7
- Stadium I: Initialstadium
- Stadium II: Kondensationsstadium
- Stadium III: Fragmentationsstadium
- Stadium IV: Reparationsstadium
- Stadium V: Endstadium.
Prädisponierende Faktoren
- Trauma mit Gefäßverletzung
- Es werden verschiedene Umweltfaktoren diskutiert, die bei einer genetischen Prädisposition das Erkrankungsrisiko erhöhen bzw. die Prognose negativ beeinflussen können:8
- niedriges Geburtsgewicht
- Übergewicht im Kindesalter
- geringer sozialer Status9-10
- Passivrauchen9-11
- Gerinnungsstörung.12
ICPC-2
- L94 Osteochondrose
ICD-10
- M91 Juvenile Osteochondrose der Hüfte und des Beckens
- M91.1 Juvenile Osteochondrose des Femurkopfes (Perthes-Legg-Calvé-Krankheit)
- M 91.2 Coxa plana (Hüftdeformierung durch vorangegangene juvenile Osteochondrose)
Diagnostik
Diagnostische Kriterien
- Belastungsabhängige Hüftschmerzen im Kindesalter, die oft aufs Kniegelenk projiziert werden.
- Jeder unklare Knie- und Hüftbefund im Prädilektionsalter ist verdächtig und abklärungsbedürftig.1
- Bei V. a. M. Perthes Röntgen-Beckenübersicht und Aufnahme nach Lauenstein13
- in Frühphase oft negativ, dann MRT hilfreich
Differenzialdiagnosen
- Cave: Begleitsymptome wie Malaise, Fieber, Gewichtsverlust oder Anämie sollten an eine Systemerkrankung denken lassen!14
- Seröse Koxitis
- Gelenkergussrückbildung nach wenigen Tagen
- Hüftgelenksdysplasie
- Juvenile rheumatoide Arthritis
- Bakterielle Arthritis
- Epiphysiolysis capitis femoris
- Osteomyelitis
- Neoplasma
- M. Meyer (multiple epiphysäre Dysplasie)1
- symmetrische radiologische Veränderungen
- MRT-Befund negativ
Anamnese
- Patient*innen sind in der Regel zwischen 4 und 10 Jahren alt. Es besteht eine Häufung im 5. und 6. Lebensjahr.
- Die Erkrankung beginnt häufig vage mit kurzfristigen, vorübergehenden Episoden des Hinkens und wenigen bis keinen Schmerzen. Diese Episoden treten vor allem nach Beanspruchung auf und nehmen mit der Zeit zu.
- Nach und nach wird das Hinken deutlicher, die Patient*innen klagen über Schmerzen im Knie, in der Leiste oder auf der Vorder-/Außenseite des Oberschenkels.
- Das Bewegungsausmaß der Hüfte kann abnehmen.
- Häufig dauern die Beschwerden einige Wochen an, bevor eine ärztliche Konsultation erfolgt.
Klinische Untersuchung
- Der Abschnitt basiert auf dieser Referenz.2
- Inspektion – Beurteilung von:
- Konstitution (übergewichtig?)
- Gangbild (Schonhinken, später Verkürzungshinken)
- Muskelatrophien
- Palpation
- Leistendruckschmerz
- Beckenfehlstellung (anatomische oder funktionelle Beinlängendifferenz)
- Funktionsprüfung
- Gelenkbeweglichkeit nach Neutral-Null-Methode
- Bewegungseinschränkung, -schmerz (Innenrotation und Abduktion zuerst eingeschränkt)
- positives Viererzeichen
- Patient*in in Rückenlage
- Der Knöchel des zu untersuchenden Beins wird auf dem kontralateralen Oberschenkel abgelegt.
- Von oben ähnelt diese Beinhaltung einer Vier.
- Bei Druck auf das Kniegelenk des gebeugten Beins (dadurch forcierte Außenrotation und Abduktion) wird Schmerz ausgelöst.
- Trendelenburg-Zeichen
- Absinken des Beckens auf der erkrankten Seite im Einbeinstand aufgrund von Insuffizienz/Atrophie der Abduktoren
- Cave: Stets Untersuchung beider Seiten, da bei 10 % der Kinder auch das kontralaterale Bein betroffen ist!
Ergänzende Untersuchungen in der Hausarztpraxis
Diagnostik bei Spezialist*innen
- Röntgen gehört zur Standarddiagnostik
- Röntgen-Beckenübersicht und Aufnahme nach Lauenstein 13
- Sie zeigen verschiedene röntgenologische Stadien. Die ersten Veränderungen sind nach 6–8 Wochen im Nativröntgen sichtbar.
- Davor zeigen sich die Röntgenbilder häufig normal. Alternativ kann eine unspezifische Zunahme der Gelenkflüssigkeit mit leichtverbreitertem Gelenkspalt zu sehen sein.15-16
- In der Anfangsphase zeigt sich im Vergleich zur gesunden Seite eine unregelmäßige Epiphysenfuge und dünne Metaphyse. Relativ schnell kommt es zu einer subchrondralen Aufhellung.
- Im Kondensationsstadium ist ein sklerotisches Caput zu sehen.
- Im Fragmentationsstadium ist ein scholliger Zerfall sichtbar.
- Erst im Reparationsstadium, bei dem es zu einer sukzessiven Knochenneubildung kommt, erhält man allmählich einen Eindruck vom Grad der Deformität des Caput.
- MRT
- Weist eine höhere Sensitivität als Röntgen im Frühstadium auf und ist außerdem beim Follow-up der verschiedenen Stadien genauer.
- Liefert nützliche Informationen über Position, Form und Größe des Hüftkopfes und des umgebenden Weichgewebes.
- Eine MRT erfordert bei kleineren Kindern meist eine Sedierung oder Narkose.
- Hüft-Sonografie
- Differenzialdiagnostik zur Coxitis fugax
- Verdächtig ist eine länger als 2 Wochen persistierende Ergussbildung.1
Indikationen zur Überweisung
- Bei jedem begründeten Verdacht auf die Erkrankung, auch wenn die Röntgendiagnostik in der frühen Phase negativ ist, sollte eine Überweisung zur Orthopädie erfolgen.
Checkliste zur Überweisung
Calvé-Legg-Perthes-Krankheit
Zweck der ÜberweisungDiagnostikWahl der Behandlung
AnamneseBeginn: wann und wie? Trauma? Überbelastung? Entwicklung?Beschreiben Sie die Beschwerden. Schmerzlokalisierung. Fieber oder allgemeines Krankheitsgefühl? Schmerzen? Ruheschmerz? Nachtschmerz? Startschmerzen? Gehprobleme?Termingerechte Geburt? Geburtsgewicht
Klinische UntersuchungAllgemeinzustandBeschreiben Sie den Gang/das Hinken des Kindes. Beckenschiefstand?Notieren Sie die passive Beweglichkeit in allen Ebenen.
Ergänzende Untersuchungen
Therapie
Therapieziele
- Therapieziele sind Schmerzfreiheit und normale Funktion des Hüftgelenks während der floriden Krankheitsstadien sowie ein sphärisches, kongruentes und zentriertes Gelenk ohne Präarthrose am Ende des Reparationsstadiums.1
Allgemeines zur Therapie
- Die optimale Behandlung der Calvé-Legg-Perthes-Krankheit wird noch diskutiert.
- Grundprinzip ist die Containment-Therapie (Zentrierung des Hüftkopfs in der Pfanne).1
- Sie stützt sich auf die Erkenntnis, dass die Pfanne einen formativen Reiz auf das Wachstum des Femurkopfes und umgekehrt auch der Hüftkopf einen formativen Reiz für die Pfanne darstellt.
- Der Behandlungsalgorithmus richtet sich nach dem Lebensalter, der Beweglichkeit, der radiologischen Schweregradeinteilung nach Herring sowie nach Vorliegen von Kopfrisikozeichen (Head-at-Risk-Signs).3
- < 6 Jahre
- milde Form, Herring A, B, gute Beweglichkeit → konservative Therapie
- schwere Form, Herring B/C, C, schlechte Beweglichkeit → intertrochantäre Osteotomie (ITO)/Salter-Osteotomie
- 6–10 Jahre
- Containment erhalten, Herring A, B, gute Beweglichkeit → konservative Therapie
- Containmentverlust, Herring B/C, C, schlechte Beweglichkeit → ITO/Salter-Osteotomie
- > 10 Jahre
- Containment erhalten, aber Coxa vara et magna → Trochanterapophyseodese/valgisierende ITO/Schenkelhalsverlängerung
- Containmentverlust, kurze Pfanne, Coxa magna → Dreifach-Becken-Osteotomie /Trochenterversetzung/Schenkelhalsverlängerung
Konservative Therapie
- Der Abschnitt basiert auf dieser Referenz.1
- Nur im Initialstadium
- Bisphosphonate zur Hemmung des Knochenabbaus und vasoaktive Prostazyklinanaloga als durchblutungsfördernde Medikation
- Cave: Die Sicherheit und Wirksamkeit dieser Substanzen ist im Kindesalter nicht erwiesen. Es handelt sich um einen Off-Label-Use!
- Die Anwendung dieser medikamentösen Therapie sollte daher auf spezialisierte Zentren beschränkt bleiben.17
- Bisphosphonate zur Hemmung des Knochenabbaus und vasoaktive Prostazyklinanaloga als durchblutungsfördernde Medikation
- Ab Kondensationsstadium
- Verbesserung der Beweglichkeit des Hüftgelenks durch regelmäßige Bewegung ohne Belastung, wie Physiotherapie, Schwimmen, Radfahren und kontrolliertes Muskeltraining
- Reduktion der vertikalen Kräfte auf das Gelenk durch Teilentlastung und Stopp sportlicher Aktivitäten, die mit einer repetitiven Stoßbelastung des Gelenks einhergehen, wie Rennen, Hüpfen, Springen etc.
- symptomatische Schmerztherapie mithilfe der Gabe von Analgetika, Antiphlogistika und Extensionsbehandlung
- Für entlastende Orthesen und Gipsruhigstellungen konnte keine Wirkung nachgewiesen werden.
- Stattdessen kann durch Immobilisation in Orthese ein erhöhter intraartikulärer Druck entstehen.
Empfehlungen für Patient*innen
- Eine Entlastung des erkrankten Beines ist wichtig, insbesondere bei Schmerzen.
- Es ist wichtig, dass das Kind regelmäßig physiotherapeutische Therapie erhält, damit die Mobilität kontrolliert und erhalten werden kann.
- Bei der Entlastung sollte das Kind eine Position einnehmen, in der der Femur abduziert und nach innen rotiert ist, sodass das Caput femoris gut innerhalb des runden Teils des Azetabulums gehalten wird.
Operation
- Metaanalysen kommen zu dem Schluss, dass eine operative Behandlung bei Patient*innen ab 6 Jahren eher zu einem sphärischen, kongruenten Caput femoris führen kann als nichtoperative Verfahren.18-19
Prävention
- Um der Entwicklung einer späteren Arthrose entgegenzuwirken, sollten die Patient*innen vor unnötig hohen Belastungen geschont und dahingehend beraten werden, keinen Beruf mit viel Arbeit im Gehen oder Stehen und schwerem Heben zu ergreifen.
Verlauf, Komplikationen und Prognose
Verlauf
- Die Nekrose und Rekonstruktion des Caput femoris dauert über einen Zeitraum von 2‒4 Jahren an. Dann klingt die Krankheit mit verschieden ausgeprägten Restdeformitäten ab.
- Die Krankheit durchläuft dabei typischerweise die 5 Stadien nach Waldenström:
- Initialstadium
- Kondensationsstadium
- Fragmentationsstadium
- Reparationsstadium
- Endstadium.
Komplikationen
- Sekundäre Coxarthrose
- Intraartikuläre freie Gelenkkörper
Prognose
- Die kurz- und mittelfristige Prognose (10‒20 Jahre) ist bei den meisten Kindern gut.
- Prädiktoren5
- Bei einem frühen Beginn der Erkrankung ist die Prognose besser (vor dem 6. Lebensjahr). Außerdem ist sie gut bei einer Nekrose, die weniger als 50 % der lateralen Epiphyse des Caput femoris (Herring A und B) betrifft.
- Bei Mädchen ist die Prognose etwas schlechter als bei Jungen.
- Langzeitprognose
Verlaufskontrolle
- Die Verantwortung für eine Behandlung in der aktiven Phase ist Aufgabe von Spezialist*innen.
- In den frühen aktiven Stadien wird eine ambulante Kontrolluntersuchung alle 3 Monate, nach Abheilung und Ende der Plastizität des Femurkopfes alle 6–12 Monate bis zum Wachstumsabschluss empfohlen.1
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Oberschenkel, Hüfte und Becken

Hüftgelenk
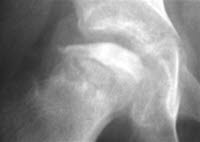
Calvé-Legg-Perthes-Krankheit, Röntgen
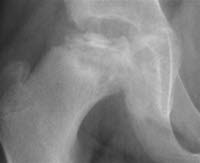
Calvé-Legg-Perthes-Krankheit, Röntgen
Quellen
Leitlinien
- Gesellschaft für Pädiatrische Radiologie e.V. (GPR). Bewegungseinschränkung bei Kindern – Bildgebende Diagnostik. AWMF-Leitlinie Nr. 064-008. S1, Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e. V. (DGKJ). Muskuloskelettale Schmerzen bei Kindern und Jugendlichen – Ein Algorithmus zur differenzialdiagnostischen Abklärung eines häufigen Leitsymptoms in der Kinder- und Jugendmedizin. AWMF-Leitlinie Nr. 027-073. S2k, Stand 2020. www.awmf.org
Literatur
- Strobel WM. Diagnostik und Therapie des Morbus Perthes. Monatsschrift Kinderheilkunde 2020; 168: 363-75. link.springer.com
- Deutschen Gesellschaft für Orthopädie und Orthopädische Chirurgie und Berufsverband der Ärzte für Orthopädie, Morbus Perthes, AWMF-Leitlinien-Register Nr. 033/047, Stand 16.10.2010. www.leitliniensekretariat.de
- Nelitz M., Lippacher S., Krauspe R., et al.. Morbus Perthes Diagnostische und therapeutische Prinzipien. Deutsches Ärzteblatt 2009; 106 (31-32): 517-23. doi:10.3238/arztebl.2009.0517 DOI
- Guille JT, Lipton GE, Tsirikos AI, Bowen JR. Bilateral Legg-Calvé-Perthes disease: presentation and outcome. J Pediatr Orthop 2002; 22: 458-63. PubMed
- Wiig O, Terjesen T, Svenningsen S, et al. The epidemiology and aetiology of Perthes’ disease in Norway. A nationwide study of 425 patients. J Bone Joint Surg Br 2006; 88: 1217-23. PubMed
- Harris GD. Legg-Calve-Perthes disease. Medscape, last updated Feb 06, 2020. emedicine.medscape.com
- Waldenström H. Coxa plana, Osteochondritis deformans coxae. Zentralbl Chir 1920; 47: 5395. PubMed
- Pavone V, Chisari E, Vescio A, et al. Aetiology of Legg-Calvé-Perthes disease: a systematic review. World J Orthop 2019; 10(3): 145-65. www.ncbi.nlm.nih.gov
- Perry DC, Bruce CE, Pope D, et al. Perthes' disease of the hip: socioeconomic inequalities and the urban environment. Arch Dis Child 2012;97:1053-1057. PubMed
- Gordon JE, Schoenecker PL, Osland JD, et al. Smoking and socio-economic status in the etiology and severity of Legg-Calvé-Perthes' disease. J Pediatr Orthop B 2004;13:367-370. PubMed
- Bahmanyar S, Montgomery SM, Weiss RJ, et al. Maternal smoking during pregnancy and other prenatal and perinatal factors and the risk of Legg-Calvé-Perthes disease. Pediatrics 2008;122:459-464. europepmc.org
- Szepesi K, Posan E, Harsfalvi J, et al. The most severe forms of Perthes' disease associated with the homozygous Factor V Leiden mutation. J Bone Joint Surg Br 2004;86:426-429. PubMed
- Gesellschaft für Pädiatrische Radiologie e.V. (GPR). Bewegungseinschränkung bei Kindern - Bildgebende Diagnostik. AWMF-Leitlinie Nr. 064-008. Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin e.V. (DGKJ). Muskuloskelettale Schmerzen bei Kindern und Jugendlichen – Ein Algorithmus zur differenzialdiagnostischen Abklärung eines häufigen Leitsymptoms in der Kinder- und Jugendmedizin. AWMF-Leitlinie 027-073. Stand 2020. www.awmf.org
- Herring JA, Kim HT, Browne R. Legg-Calve-Perthes disease. Part II: Prospective multicenter study of the effect of treatment on outcome. J Bone Joint Surg Am 2004; 86: 2121-34. PubMed
- Herring JA, Kim HT, Browne R. Legg-Calve-Perthes disease. Part I: Classification of radiographs with use of the modified lateral pillar and Stulberg classifications. J Bone Joint Surg Am 2004; 86: 2103-20. PubMed
- Rauch F, Schönau E, Glorieux FH. Bisphosphonate. Monatsschrift Kinderheilkunde 2012; 148(4): 334-41. link.springer.com
- Nguyen NA, Klein G, Dogbey G, et al. Operative versus nonoperative treatments for Legg-Calvé-Perthes disease: a meta-analysis. J Pediatr Orthop 2012;32:697-705. PubMed
- Saran N, Varghese R, Mulpuri K. Do femoral or salter innominate osteotomies improve femoral head sphericity in Legg-Calvé-Perthes disease? A meta-analysis. Clin Orthop Relat Res 2012;470:2383-2393. PubMed
- Heesakkers N, van Kempen R, Feith R, Hendriks J, Schreurs W. The long-term prognosis of Legg-Calvé-Perthes disease: a historical prospective study with a median follow-up of forty one years. Int Orthop. 2014 Nov 19. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).