Allgemeine Informationen
Definition
- Ein Karzinoid-Syndrom ist ein klinischer Symptomenkomplex infolge von Serotoninausscheidung durch neuroendokrine Tumoren (NET) und/oder deren Metastasen
- Kardinalsymptome sind:1-2
- Diarrhö (ca. 80 %)
- Hautrötung („Flush“) (ca. 50–80 %)
- vor allem Gesicht und Stamm.
- weitere mögliche Symptome:
- abdominelle Krämpfe
- Dyspnoe
- Bronchospasmus
- Symptome einer Rechtsherzinsuffizienz
- Palpitationen
- Pellagra (durch Niacinmangel).
- Kardinalsymptome sind:1-2
Häufigkeit
- Inzidenz
- Alter
- mittleres Alter bei Diagnose ca. 60–65 Jahre2
- Geschlecht
- keine eindeutige Geschlechterhäufung1
- Ethnischer Hintergrund
- Im Vergleich zu Patient*innen mit europäischer Abstammung sind NET bei afrikanischer Abstammung häufiger, bei asiatischer Abstammung seltener.2
Ätiologie und Pathogenese
- NET sind eine heterogene Gruppe von Tumoren, die in allen Organen vorkommen können.5
- Vorkommen am häufigsten im Gastrointestinaltrakt (61 %) und bronchopulmonal (27 %)6
- Häufigste Lokalisationen im Gastrointestinaltrakt sind:
- Dünndarm (31 %)
- Rektum (26 %)
- Kolon (18 %)
- Pankreas (12 %)
- Magen (9 %) und
- Appendix (6 %).6
- Häufigste Lokalisationen im Gastrointestinaltrakt sind:
- Charakterisiert werden sie durch den immunhistologischen Nachweis neuroendokriner Marker (Chromogranin A, Synaptophysin).7
- Morphologische Dichotomie der NET in:
- gut differenzierte, langsam wachsende neuroendokrine Tumoren (NET G1, NET G2, NET G3)
- schlecht differenzierte, schnell wachsende neuroendokrine Karzinome (NEC G3).5
- Alle NET haben grundsätzlich malignes Potenzial.8
- Ca. 80 % der NET in Dünndarm oder Pankreas sind maligne, hingegen nur ca. 15 % im Magen, Appendix oder Rektum.7
- Abhängig von einer etwaigen Hormonproduktion werden NET unterschieden in:
- funktionell inaktive NET
- funktionell aktive NET.
- Etwa 20 % der gastrointestinalen NET sind funktionell aktiv.5
- Je nach produziertem Hormon können verschiedene Leitsymptome/-syndrome entstehen, u. a. Karzinoid-Syndrom, rezidivierende Ulzera, Hypoglykämie, Diabetes mellitus, Hypokaliämie.8
- Das Karzinoid-Syndrom wird am häufigsten verursacht durch hormonproduzierende Metastasen von NET aus Jejunum, Ileum, Appendix und proximalem Kolon.9
- Karzinoid-Syndrom bei ca. 20–30 % der Patient*innen mit metastasierten NET des Dünndarms2
- überwiegend bei Patient*innen mit Lebermetastasen (95 %), in selteneren Fällen auch retroperitoneale oder ovarielle Metastasen (5 %)2
- bei Karzinoiden der Lunge Karzinoid-Syndrom auch ohne Lebermetastasen möglich10
- Karzinoid-Syndrom verursacht durch Ausschüttung von:9
- Serotonin
- normalerweise Umwandlung von 99 % des Tryptophans in der Nahrung in Niacin, < 1 % in Serotonin4
- bei Karzinoid-Syndrom erhöhte Serotoninproduktion und evtl. Niacinmangel
- Tachykinine
- Bradykinin
- Prostaglandine
- Histamin.
- Serotonin
- Von Lebermetastasen direkte Abgabe von Serotonin u. a. ins zentralvenöse System und dadurch systemische Ausbreitung und Wirkung
- Vasodilatation
- Stimulation der glatten Muskulatur
- erhöhte gastrointestinale Motilität
- Bronchokonstriktion
- im Verlauf evtl. Rechtsherzinsuffizienz durch Endokardfibrose mit Trikuspidalklappeninsuffizienz/Pulmonalklappenstenose (Hedinger-Syndrom)
- Keine Symptomatik durch Abgabe von Serotonin und anderen Substanzen aus gastrointestinalem Primärtumor ins portalvenöse System, da Inaktivierung in Leber (First-pass-Effekt)
Prädisponierende Faktoren
- Auftreten in den meisten Fällen vermutlich sporadisch
- Positive Familienanamnese bei 1 % der Patient*innen4
- Bei einigen Patient*innen spielt möglicherweise das MEN-1-Gen (MEN = multiple endokrine Neoplasie) ein Rolle.4
ICPC-2
- T99 Endo./metab./ernäh. Erkrank., andere
ICD-10
- E34 Sonstige endokrine Störungen
- E34.0 Karzinoid-Syndrom
Diagnostik
Diagnostische Kriterien
- Diagnose beruht auf:
- klinischer Symptomatik
- Labortests
- bildgebenden Verfahren
- histologischem Nachweis eines NET.
Differenzialdiagnosen
- Flush anderer Ursache
- gutartige Hautrötung
- Beschwerden im Klimakterium
- Phäochromozytom
- medulläres Schilddrüsenkarzinom
- Diarrhö anderer Ursache
- infektiöse Gastroenteritis
- chronisch-entzündliche Darmerkrankung
- infektiöse Kolitis
- Missbrauch von Abführmitteln
- Rosazea
- Teleangiektasien
- Zirrhose oder Morbus Osler
- Medikamentennebenwirkung oder Drogenmissbrauch
- Mastozytose
- Rechtsseitige Herzinsuffizienz
- Stauung aufgrund von Linksherzinsuffizienz
- Lungenerkrankung (LE, Emphysem etc.)
- Bronchokonstriktion
Anamnese
- Flush (Rötung), Hitzewallung
- Auftreten bei ca. 50–80 % der Fälle1-2
- vor allem im Bereich von Gesicht und Oberkörper10
- Dauer initial eher kurz (Minuten), im weiteren Verlauf zunehmend bis zu Stunden11
- spontanes Auftreten oder Provokation durch:1
- Alkohol
- tyraminhaltige Nahrungsmittel (z. B. Käse)
- körperliche oder psychische Belastung.
- Diarrhö
- Auftreten bei ca. 80 % der Fälle2
- Stuhlgang in der Regel wässrig und ohne Blutbeimengung
- Bauchschmerzen, -krämpfe (10–34 %)5
- Asthmatische Beschwerden (4–18 %)5
- Leistungsschwäche/Beinödeme bei Rechtsherzinsuffizienz (ca. 25–50 %)2,12
- Palpitationen
Klinische Untersuchung
- Im Anfall
- Flush
- Bronchokonstriktion
- Teleangiektasien
- Zeichen der Rechtsherzinsuffizienz
- Selten tastbare abdominelle Raumforderung bei fortgeschrittenem Primärtumor, Hepatomegalie bei ausgeprägten Lebermetastasen
Ergänzende Untersuchung in der Hausarztpraxis
Sonografie
- Nachweis von Lebermetastasen2
Diagnostik bei Spezialist*innen
Labor
- Bei konkretem V. a. NET sollten Chromogranin A (CgA) und 5-Hydroxyindolessigsäure (5-HIES) bestimmt werden.2
Chromogranin A (CgA) im Serum
- Marker für NET
- Differenzialdiagnose erhöhter CgA-Werte2
- Einnahme von Protonenpumpenhemmern
- 10–14 Tage vor Bestimmung absetzen.14
- chronisch atrophische Gastritis
- Niereninsuffizienz
- Leberzirrhose
- Herzinsuffizienz
- andere CgA-sezernierende Tumoren
- hepatozelluläres Karzinom
- medulläres Schilddrüsenkarzinom
- u. a.
- Einnahme von Protonenpumpenhemmern
5-Hydroxyindolessigsäure (5-HIES) im 24-Stunden-Urin
- 5-HIES ist ein Abbauprodukt von Serotonin
- Bestimmung von 5-HIES im 24-Stunden-Urin ist neben CgA wichtigster Laborparameter für Nachweis und Verlaufskontrolle eines fortgeschrittenen hormonaktiven NET des Dünndarms.14
- Wertigkeit bei der Diagnostik des Karzinoid-Syndroms
- Sensitivität 100 %2
- Spezifität 85–90 %
- 3 Tage vor der Urinsammelperiode sollen pausiert werden:
- bestimmte Nahrungsmittel (z. B. Tomaten, Bananen, Walnüsse u. a.)
- Genussmittel (Alkohol, Nikotin, Koffein)
- bestimmte Medikamente (z. B. Paracetamol, ASS, L-Dopa, u. a.).
- Bestimmung von Serumserotonin nicht empfohlen2
- weniger sensitiv und spezifisch als 5-HIES
Bildgebende Verfahren
- CT, MRI2
- Für die Primärdiagnostik von abdominellen NET oder Metastasen soll eine Schnittbildgebung mittels CT oder MRT durchgeführt werden.14
- Die Untersuchungen sollen kontrastmittelverstärkt erfolgen.14
- Sonderformen sind CT/MR-Enterografie/Enteroklysma (Distension des Darms mit Wasser-Mannitol-Mischung zur besseren Beurteilbarkeit).14
- Nuklearmedizinische Verfahren
- Kontrastverstärkter Ultraschall (CEUS)
- Option als initiale Suchmethode für Primärtumoren oder Lebermetastasen (kräftige Kontrastmittelaufnahme)6
- Kapselendoskopie
- genaue Wertigkeit noch unklar
- empfohlen bei Patient*innen mit metastasierten NET und unklarem Primärtumor2
- Koloskopie
- bei Verdacht auf Tumor im terminalen Ileum2
- Echokadiografie9,13
- evtl. Nachweis einer Rechtsherzinsuffizienz durch serotoninbedingte Endokardfibrose (Hedinger-Syndrom)
- häufig signifikante Trikuspidalklappeninsuffizienz, evtl. Pulmonalklappenstenose
- Eine transthorakale Echokardiografie sollte bei allen Patient*innen mit einem Karzinoid-Syndrom im Rahmen der Primärdiagnostik durchgeführt werden.14
- evtl. Nachweis einer Rechtsherzinsuffizienz durch serotoninbedingte Endokardfibrose (Hedinger-Syndrom)
Histologie
- Histopathologische Bestätigung der Verdachtsdiagnose obligatorisch2
- üblicherweise durch ultraschallgesteuerte Leberbiopsie
- alternativ chirurgische Biopsie
Indikationen zur Überweisung
- Bei Verdacht auf Karzinoid-Syndrom
Checkliste zur Überweisung
Karzinoid-Syndrom
Anamnese und Befund
- Flush?
- Durchfall?
- Weitere Symptome/Befunde: abdominelle Krämpfe, asthmatische Beschwerden, Zeichen der Rechtsherzinsuffizienz, Palpitationen?
Sonografie
- V. a. Lebermetastasen
Therapie
Therapieziele
- Kurativer Ansatz
- im Einzelfall möglich bei günstiger Verteilung der Metastasen12
- Symptomkontrolle
- Verbesserung der Lebensqualität
Allgemeines zur Therapie
- Vor Therapieeinleitung Besprechung in der multidisziplinären Tumorkonferenz empfohlen wegen:12
- Heterogenität der NET
- Komplexität der Erkrankung
- zahlreichen Therapieoptionen.
- Somatostatinanaloga gehören zur Erstlinientherapie, auch wegen ihrer guten Verträglichkeit.14
- Alle Therapiemaßnahmen im Bereich der Leber erfordern eine Vorbehandlung mit Somatostatinanaloga.12
- Bei einem primären NET im Jejunum/Ileum sollte der Primärtumor unabhängig vom Tumorstadium operativ entfernt werden.
- Chirurgie und lokoregionale/ablative Therapie sollten bei Diagnosestellung und im Verlauf erwogen werden.12
- Verkleinerungsresektion bei Patient*innen mit dominierendem Leberbefall zur besseren Symptomkontrolle auch empfohlen, wenn Tumorlast weniger als 90 % reduziert werden kann.12
Medikamentöse Therapie
- Somatostatinanaloga (SSA) sollen in der Erstlinientherapie des Karzinoidsyndroms eingesetzt werden.14
- Verringerung der oft schweren hormonell bedingten Symptomatik (Flush, Diarrhö, Bronchospasmus)14-15
-
- Begrenzung des Tumorwachstums
- Interferon-Alpha
- Serotoninsynthesehemmer
- Telotristatethyl kann bei SSA-refraktärer Diarrhö additiv eingesetzt werden.14
- Targeted Therapy
- Wirkstoffe: Everolimus, Sunitinib
- Zweit- oder Drittlinientherapie nach Versagen von SSA und/oder Interferon-Alpha12
- Zytostatika
Operative Therapie
- Einzige potenziell kurative Behandlungsmethode bei NET
- Auch Reduktion der hepatischen Tumorlast (= „Debulking") kann eine günstige Wirkung haben.14
- Verbesserung von Lebensqualität und Überleben1
Lebertransplantation
- Option bei wenigen hochselektierten Patient*innen12
- z. B. bei jungen Menschen ohne Ansprechen auf die medikamentöse Therapie
Interventionelle/nuklearmedizinische Therapien
- Die Wahl der Methode beruht auf der individuellen Situation der betroffenen Person und der örtlichen Expertise.12
- Anwendung zur Verhinderung einer Karzinoid-Krise (nach SSA-Therapie)12
- Verschiedene Methoden:12,14
- Transarterielle Embolisation (= TAE)
- Transarterielle Chemoembolisation (= TACE)
- Radiofrequenzablation (= RFA)
- Selektive interne Radiotherapie (SIRT)
- Einbringen radioaktiver Mikrospären in die metastasenversorgenden Gefäße
- Peptid-Radio-Rezeptor-Therapie (PRRT)
- Verabreichung radioaktiv markierter Somatostatinanaloga
Verlauf, Komplikationen und Prognose
Komplikationen
- Rechtsherzinsuffizienz durch Endokardfibrose (Hedinger-Syndrom)9
- Mesenteriale und peritoneale Fibrose9
- Niacin-Mangel9
- klinisch Pellagra
- Karzinoid-Krise
- potenziell lebensbedrohliche Komplikationen4
- schwere Diarrhö
- schwere Flush-Symptomatik
- Dehydratation
- Hypotension
- Arrhythmien
- Bronchokonstriktion
- Bewusstlosigkeit
- Kann spontan auftreten oder Auslösung durch u. a.:
- Palpation des Abdomens
- Tumormanipulation während OP
- Anästhetikagabe
- interventionelle Lebermetastasentherapie.
- potenziell lebensbedrohliche Komplikationen4
Verlauf und Prognose
- Kurative Resektion von Primärtumor und Metastasen im Einzelfall möglich12
- Lebensqualität abhängig vom Erfolg der Symptomkontrolle
- Unter Standardtherapie mit SSA Symptomkontrolle von Monaten bis zu mehreren Jahren möglich16
- Verlust der Symptomkontrolle unter Therapie mündet in ein „refraktäres Karzinoid-Syndrom".16
- 5-Jahres-Überlebensrate bei kompletter Entfernung eines kleinen NET: 90 %1
- Bezogen auf den Primärtumor Prognose von NET abhängig von Histologie, Größe, Lokalisation, Invasivität, residuellen Befunden nach Resektion und Metastasierung
- 5-Jahres-Überlebensrate bei Metastasierung: ca. 20–30 %1
- Verbesserte Überlebensraten bei metastasierter Erkrankung konnte vor allem nach Einführung der SSA erzielt werden.17
Verlaufskontrolle
- Alle 3–6 Monate
- Somatostatinrezeptor-Szintigrafie nach 18–24 Monaten, sofern nicht schon früher V. a. Progress
Patienteninformationen
Deutsche Krebsgesellschaft
Selbsthilfegruppen
Illustrationen
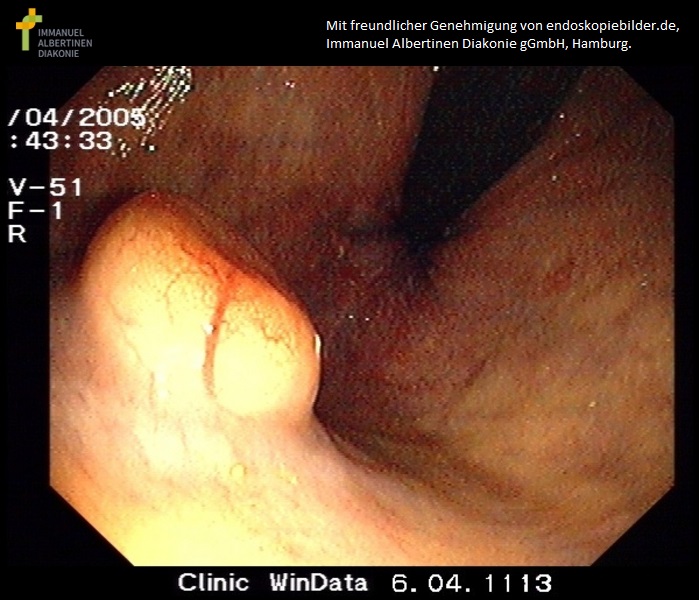
Karzinoid im Rektum (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Neuroendokrine Tumore. AWMF-Leitlinie Nr. 021-026. S2k, Stand 2018. www.awmf.org
- European Neuroendocrine Tumor Society. Consensus Guidelines Update for Neuroendocrine Neoplasms of the Jejunum and Ileum, Stand 2016. www.enets.org
- European Neuroendocrine Tumor Society. Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site, Stand 2016. www.enets.org
Literatur
- Ha J, Tan W. Gastrointestinal Carcinoid Tumours: A Review. J Gastroint Dig Syst 2012; 2: 1-7. doi:10.4172/2161-069X.1000107 DOI
- Niederle B, Pape U, Costa F, et al. ENETS Consensus Guidelines Update for Neuroendocrine Neoplasms of the Jejunum and Ileum. Neuroendocrinology 2016; 103: 125-138. doi:10.1159/000443170 DOI
- Kunz P. Carcinoid and Neuroendocrine Tumors: Building on Success. J Clin Oncol 2015; 33: 1855-1863. doi:10.1200/JCO.2014.60.2532 DOI
- Zuetenhorst J, Taal B. Metastatic Carcinoid Tumors: A Clinical Review. The Oncologist 2005; 10: 123-131. doi:10.1634/theoncologist.10-2-123 DOI
- Scherübl H, Raue F, Frank-Raue K. Neuroendokrine Tumoren - Klassifikation, Klinik und Bildgebung. Radiologe 2019; 59: 952-960. doi:10.1007/s00117-019-0574-x DOI
- Schwarze V, Marschner C, Grosu S, et al. Moderne sonographische Bildgebung bei neuroendokrinen Tumoren des Abdomens. Radiologe 2019; 59: 1002-1009. doi:10.1007/s00117-019-00586-0 DOI
- Rayes N, Denecke T. Gastroenteropankreatische neuroendokrine Tumoren. Gastroenterologe 2021; 16: 469-479. doi:10.1007/s11377-021-00576-6 DOI
- Juchems M. Neuroendokrine Tumoren des Abdomens. Radiologe 2018; 58: 36-44. doi:10.1007/s00117-017-0332-x DOI
- Mota J, Guimarães Sousa L, Riechelmann R. Complications from carcinoid syndrome: review of the current evidence. Ecancermedicalscience 2016; 10: 662. doi:10.3332/ecancer.2016.662 DOI
- Winter K, Auernhammer C, Todica A. Karzinoide der Lunge und im Abdomen. Radiologe 2019; 59: 968–974. doi:10.1007/s00117-019-00597-x DOI
- Tebbi C. Carcinoid tumor. Medscape, updated Feb 12, 2019. emedicine.medscape.com
- Pavel M, O’Toole D, Costa F, et al. ENETS Consensus Guidelines update for the management of distant metastatic disease of intestinal, pancreatic, bronchial neuroendocrine neoplasms (NEN) and NEN of unknown primary site. Neuroendocrinology 2016; 103: 172-185. doi:10.1159/000443167 DOI
- Weihs W. Echokardiographie aktuell: Kardiale Beteiligung bei Systemerkrankungen – Karzinoid. Austrian Journal of Cardiology 2010; 17: 234-237. www.kup.at
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Neuroendokrine Tumore. AWMF-Nr. 021-026. Stand 2018. www.awmf.org
- Modlin IM, Pavel M, Kidd M, Gustafsson BI. Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacol Ther 2010; 31: 169-88. www.ncbi.nlm.nih.gov
- Riechelmann R, Pereira A, Rego J, et al. Refractory carcinoid syndrome: a review of treatment options. Ther Adv Med Oncol 2017; 9: 127-137. www.ncbi.nlm.nih.gov
- Yao JC, Hassan M, Phan A, et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26: 3063-72. www.ncbi.nlm.nih.gov
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).