Allgemeine Informationen
Definition
- Synonyme
- M. Osler-Weber-Rendu
- hereditäre hämorrhagische Teleangiektasie (HHT)1
- Autosomal-dominant vererbte Erkrankung der Blutgefäße, die zu Dysplasien führt.
- Neigung zu Schleimhautblutungen in Nase, Magen-Darm-Trakt, Lunge oder Harnwegen2-4
- Diagnosestellung anhand der 4 Curaçao-Kriterien:5
- Epistaxis
- Teleangiektasien
- Organläsionen
- positive Familienanamnese.
- In der Regel gute Prognose6
- bei arteriovenösen Malformationen in Lunge, Leber oder Gehirn erhöhte Mortalität7
Häufigkeit
- Unterschiedliche Prävalenz in der Welt
- Wahrscheinlich sehr hohe Dunkelziffer bei nur milder Symptomatik
- Keine geschlechtsspezifischen Unterschiede9
- Erstmanifestation häufig im jungen Erwachsenenalter
Ätiologie und Pathogenese
- Systemerkrankung mit diffuser Angiodysplasie, gekennzeichnet durch Teleangiektasien und Blutungsneigung10
- Autosomal-dominanter Erbgang mit erheblichen phänotypischen Unterschieden
- Bisher sind 2 Gene bekannt:11
- HHT Typ 1 (HHT1): bei Mutationen von Endoglin auf Chromosom 9q34
- HHT Typ 2 (HHT2): bei Mutationen von ALK-1 (Activin Receptor Like Kinase 1) auf Chromosom 12q31
- Bei vielen Patienten keine Mutation dieser Gene, sodass noch andere Genloci verantwortlich sein müssen.12
- Klinische Penetranz 97 %6
- Homozygote Variante letal
Pathophysiologie
- Entstehung von Teleangiektasien und Aneurysmata in abgegrenzten Bereichen
- Nicht betroffene Gebiete zeigen eine normale Gefäßarchitektur.
- Vermutlich führt ein initialer Gefäßschaden gefolgt von unzureichender Reparatur zu den typischen Läsionen in Form von Gefäßektasien.13
- Der Gendefekt führt zu einer gestörten Bildung von Proteinen, die zur Endothel-Reparatur nötig sind.14
- Die Blutungsneigung entsteht aufgrund von lokalen Schwachstellen in der Gefäßwand.
- Arteriovenöse Malformationen (AVM)
Gefäßmalformationen des Gehirns
- In cMRT bei initialer Diagnostik 23 % der Patienten mit zerebralen Gefäßfehlbildungen17
- venöse Angiome, kavernöse Angiome und arteriovenöse Malformationen, häufig multipel3
- Gefährlich sind vor allem Aneurysmata (Subarachnoidalblutung).18
Gefäßmalformationen der Lunge
- Bei pulmonalen arteriovenösen Fisteln besteht die Gefahr von Embolien im Gehirn.18-19
- Kleine venöse Thromben entstehen häufig unter physiologischen Umständen, werden aber vom Kapillarnetz in der Lunge aufgefangen.
- Bei einer arteriovenösen Fistel kann ein Embolus ungehindert von der Lungenarterie in die Lungenvene gelangen, das Kapillarnetz umgehen und in die Hirnarterien gelangen.
- Die Folge sind Infarkt oder transitorische ischämische Attacke (TIA).
- Eine arteriovenöse Malformation ist auch selbst als Entstehungsort eines Thrombus prädestiniert.
- Ebenso ist ein Gehirnabszess mit oder ohne Meningitis möglich.20
- Infektiöses Material aus den Alveolen gelangt über die arteriovenöse Fistel in die Hirngefäße.
Prädisponierende Faktoren
- Positive Familienanamnese
ICPC-2
- B79 Angeborene Anomalie Blut/Lymphsystem
- K73 Angeborene Anomalie Herz/Gefäßsystem
ICD-10
- I78 Krankheiten der Kapillaren
- I78.0 Hereditäre hämorrhagische Teleangiektasie
Diagnostik
Diagnostische Kriterien
- Diagnosestellung anhand der Curaçao-Kriterien:
- Epistaxis: spontan und rezidivierend
- Teleangiektasien: multipel an charakteristischen Stellen wie Lippen, Mundhöhle, Finger, Nase
- Organläsionen: z. B. Teleangiektasien im Magen-Darm-Trakt oder arteriovenöse Malformationen in Lunge, Leber, Hirn, Rückenmark
- Familienanamnese: mindestens ein Verwandter 1. Grades mit HHT
Differenzialdiagnosen
- Andere Formen der Teleangiektasien
- CREST-Syndrom
- benigne hereditäre Teleangiektasie
- Louis-Bar-Syndrom (Ataxia teleangiectatica)
- Blutungen ohne begleitende Teleangiektasien
Anamnese
- Bei der Mehrheit der Patienten treten die ersten Symptome im Schulalter auf.
- 75 % der Patienten haben mit etwa 25 Jahren Symptome.
- Nahezu 100 % sind symptomatisch zwischen 40. und 50. Lebensjahr.22-23
- Häufigstes Symptom bei Kindern Nasenbluten, vor allem nachts verdächtig10
- Meist 1 Jahr nach dem 1. auffälligen Nasenbluten Auftreten von Teleangiektasien3
- vor allem Gesicht, Lippen, Zunge, Nasenlöcher, Hände und Füße
- meist multipel
- Teleangiektasien können aufgrund ihres Aussehens zu psychischen Belastungen führen.
- Selten große Blutungen, aber bei rezidivierenden kleinen Blutungen chronische Anämie
- Müdigkeit und Leistungsminderung
- Große Gefäßmalformationen in der Lunge können zu Dyspnoe und erhöhter Müdigkeit führen.
- Migräne
- Bis zu 50 % der Patienten haben Migräne mit Aura.24
Klinische Untersuchung
- Teleangiektasien = irreversibel erweiterte Kapillaren
- typischerweise < 5 mm
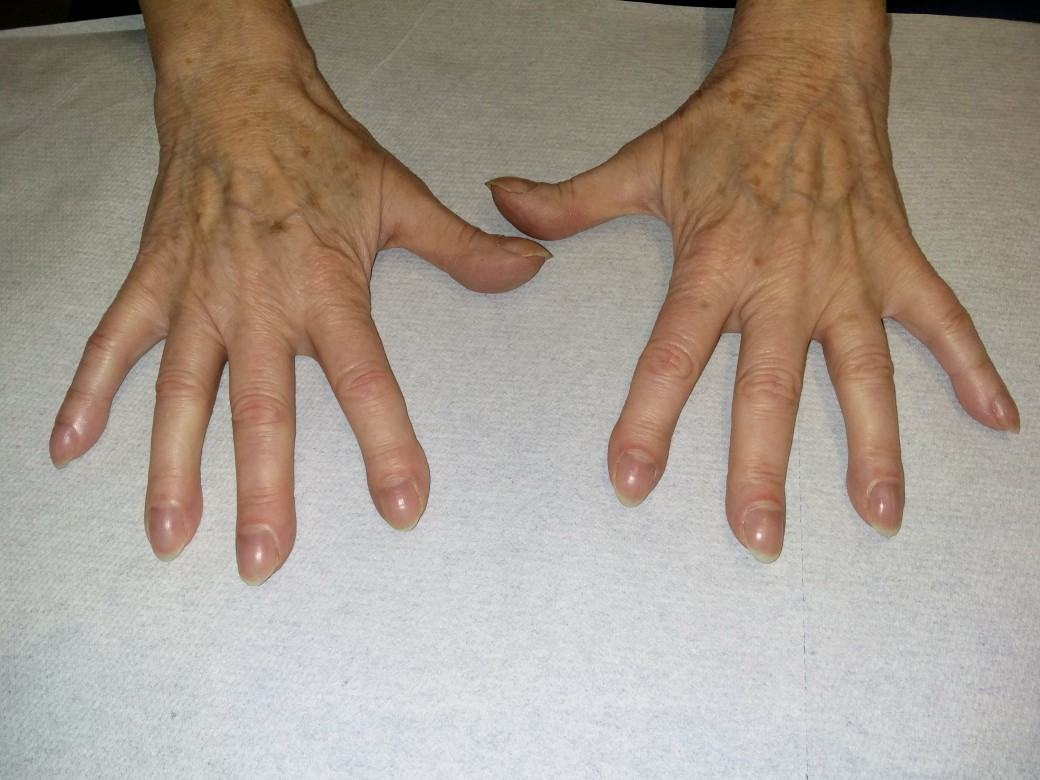 Trommelschlegelfinger
Trommelschlegelfinger - mit Glasspatel wegdrückbar
- Befinden sich direkt unter der Haut oder in der Schleimhaut des Magen-Darm-Traktes, der Atem- oder Harnwege.
- Farbe hellrot bis violett
- vor allem fazial, an Händen und Füßen
 Teleangiektasien bei M. Osler
Teleangiektasien bei M. Osler
- typischerweise < 5 mm
- Hinweise auf Anämie, wie Blässe oder Dyspnoe?
- Zyanose, Trommelschlegelfinger und Polyzythämie
- bei pulmonalen Gefäßmalformationen mit Shunts
Ergänzende Untersuchungen in der Hausarztpraxis
- Hb und Eisenstatus
Diagnostik beim Spezialisten
- Die weitere Diagnostik ist abhängig vom Schweregrad der Erkrankung.
- Da die Patienten häufig sehr jung sind, sollte ein besonderes Augenmerk auf die Strahlenbelastung gelegt werden.
- Screening-Empfehlungen bei gesicherter oder Verdachtsdiagnose25
- Screening auf pulmonale AVM
- „Bubble“-Echokardiografie
- Test zum Nachweis eines Shunts mit Spritzen von Kochsalzgemisch mit winzigen Bläschen
- bei positivem Befund CT Thorax empfohlen
- „Bubble“-Echokardiografie
- Screening auf zerebrale AVM
- cMRT bei jedem Patienten
- Screening auf hepatische AVM
- Duplex-Sonografie
- Sollten alle Screeningmaßnahmen unauffällig sein, Wiederholung in 5 Jahren
- Genetische Untersuchung
- Mutation bei 80 % der Patienten, entweder im Endoglin- oder im Alk1-Gen
- Gastrointestinale Beteiligung
- ab dem 35. Lebensjahr mindestens 1 x/Jahr Hb-Bestimmung
- Falls die Höhe des Hb nicht passend zur Stärke des Nasenblutens, wird eine endoskopische Untersuchung des GI-Trakts auf okkulte Blutungen empfohlen.
Indikationen zur Überweisung
- Bei Verdacht auf oder gesicherter Diagnose einer HHT Überweisung zum initialen Screening
Therapie
Therapieziele
- Über das Krankheitsbild informieren.
- nur symptomatische Therapie möglich
- Evtl. eine Anämie korrigieren.
- Evtl. chirurgischer Eingriff, um ernste Komplikationen zu verhindern.
Allgemeines zur Therapie
- Bei vielen Betroffenen ist keine Behandlung nötig.
- Eine blutungsbedingte Anämie ist häufig; einige Patienten benötigen eine Eisensubstitution und/oder Bluttransfusionen.
- Bei pulmonalen AVM besteht ein Risiko für bleibende neurologische Ausfällen als Folge paradoxer Embolien und bei kraniellen AVM besteht das Risiko von Blutungen, was einer frühen Diagnose und Intervention bedarf.3
- In seltenen, aber schwerwiegenden Fällen kann ein chirurgischer Eingriff erforderlich werden.
Medikamentöse Therapie
- Tranexamsäure
- Inhibiert Fibrinolyse.
- Zulassung in Deutschland für rezidivierende Epistaxis bei M. Osler
Operative Therapie
Epistaxis
- Prävention durch befeuchtende Nasensalben
- Wird auf die übliche Weise mit Kompression behandelt, evtl. Tamponade, evtl. Elektrokoagulation, evtl. Laserablation.
- in schweren Fällen Dermoplastik (Ersatz der Nasenschleimhaut durch Mundschleimhaut) oder kompletter Verschluss der Nasenhaupthöhle nach Young
Teleangiektasien
- Bei rezidivierenden Blutungen oder stigmatisierender Wirkung laserchirurgische Therapie
Größere Gefäßmalformationen
- Die Indikation zum Eingriff ist abhängig von der Lokalisation und Größe der Malformation.
- Therapie der Wahl ist in der Regel Katheterembolisation.
- im Gastrointestinaltrakt vorzugsweise medikamentöse Therapie (Östrogene und Gestagene)
Gefäßmalformationen in der Leber
- Konservative medikamentöse Therapie einer möglichen portalen Hypertension oder High-Output-Herzinsuffizienz
- Chirurgische Therapie mit hoher Komplikationsrate
- Gefäßembolisation: u. a. Leberinfarzierung
- Lebertransplantation: u. a. Organabstoßung
Weitere Problemstellungen
- Schwangerschaft
- Antikoagulationsbehandlung
- Diese Behandlung führt fast immer zu stärkeren und häufigeren Nasen- und gastrointestinalen Blutungen.
- genaue Nutzen-Risiko-Abwägung nötig
- M. Osler ist keine absolute Kontraindikation für eine orale Antikoagulation.
- Antibiotika-Prophylaxe
- Wird bei allen Patienten mit pulmonaler arteriovenöser Malformation empfohlen aufgrund des Risikos für paradoxe Embolien und zerebrale Abszesse.
- indiziert vor allen Eingriffen mit potenzieller Bakteriämie, vor allem bei zahnmedizinischen Eingriffen26
- Empfehlung entsprechend den aktuellen Empfehlungen zur Prophylaxe der infektiösen Endokarditis: Amoxicillin + Clavulansäure, bei Penicillin-Allergie Clindamycin26
- Wird bei allen Patienten mit pulmonaler arteriovenöser Malformation empfohlen aufgrund des Risikos für paradoxe Embolien und zerebrale Abszesse.
- Sportliche Aktivitäten
- Patienten mit HHT können Sport treiben wie alle anderen auch, vom Tauchen wird allerdings wegen des Risikos für Epistaxis abgeraten.
Verlauf, Komplikationen und Prognose
Verlauf
- Die Blutungsneigung nimmt häufig mit dem Alter zu. Das gilt für Epistaxis und für Blutungen aus anderen Organsystemen.3
- 1/3 der Patienten sind in ihren täglichen Aufgaben durch die Symptome eingeschränkt.13
Komplikationen
- Blutungen
- Hirnabszesse
- Schlaganfall
- High-Output-Herzinsuffizienz bei Lebershunt
- Pulmonale Hypertonie
Prognose
- Ohne Screening und Behandlung ist die Lebenserwartung im Median um 3–7 Jahre verkürzt.25
- Mit Screening und adäquater Behandlung normale Lebenserwartung25
Patienteninformationen
Patienteninformationen in Deximed
Weitere Informationen
- Patienteninformation des ÄZQ: Morbus Osler
- Morbus Osler Selbsthilfe
Illustrationen


Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)

Typische Teleangiektasien bei einem Patienten mit M. Osler (Quelle: Wikimedia).

Teleangiektasien bei M. Osler (Quelle: Sand M, Sand D, Thrandorf C. Cutaneous lesions of the nose. Head Face Med 2010).
Quellen
Literatur
- Pasche B, Wollstein AC, Zoll B, Folz B. Rendu-Osler-Weber-Syndrom: Klinik, Genetik und Therapie der hereditären hämorrhagischen Teleangiektasie. Dtsch Arztebl 2003; 100(8): A-490 / B-421 / C-398. www.aerzteblatt.de
- Horn MA, Hugaas KA, Salvesen R. Oslers sykdom - en risikofaktor for hjerneinfarkt. Tidsskr Nor Lægeforen 2003; 123: 2435-6. PubMed
- Shovlin C, Ganesan V. Hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome). UpToDate, last updated Oct 08, 2014. UpToDate
- Fuchizaki U, Miyamori H, Kitagawa S, Kaneko S, Kobayashi K. Hereditary haemorrhagic telangiectasia (Rendu-Osler- Wber disease). Lancet 2003; 362: 1490-4. PubMed
- Shovlin CL, Guttmacher AE, Buscarini E, et al: Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu- Osler-Weber syndrome). Am J Med Genet 2000 Mar 6; 91(1): 66-7. PubMed
- Lessnau KD. Osler-Weber-Rendu Disease (Hereditary Hemorrhagic Telangiectasia). Medscape, last updated Mar 26, 2018. emedicine.medscape.com
- Giordano P, Lenato GM, Suppressa P, et al. Hereditary hemorrhagic telangiectasia: arteriovenous malformations in children. J Pediatr Health CareOrthop B 2013; 163(1): 179-86. www.ncbi.nlm.nih.gov
- Westermann CJ, Rosina AF, De Vries V, et al. The prevalence and manifestations of hereditary hemorrhagic telangiectasia in the Afro-Caribbean population of the Netherlands Antilles: a family screening. Am J Med Genet A 2003; 116(4): 324-8. www.ncbi.nlm.nih.gov
- Kumar V, Abbas AK, Aster JC. Robbins and Cotran Pathologic Basis of Disease, 9th edition. Philadelphia: Elsevier Saunders, 2015.
- Shovlin CL, Guttmacher AE, Buscarini E, Faughnan ME, Hyland RH, Westermann CJJ et al. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome). Am J Med Genet 2000; 91: 66 - 7. PubMed
- Letteboer TG, Mager JJ, Snijder RJ et al. Genotype-phenotype relationship in hereditary haemorrhagic telangiectasia. J Med Genet 2006; 43: 371-7. PubMed
- Richards-Yutz J, Grant K, Chao EC, et al. Update on molecular diagnosis of hereditary hemorrhagic telangiectasia. Hum Genet 2010; 128(1): 61-77. www.ncbi.nlm.nih.gov
- Kjeldsen AD, Andersen PE, Mathiesen P. Udredning og behandling af morbus Osler. Ugeskr Læger 2011; 173: 490. portal.findresearcher.sdu.dk
- Govani FS, Shovlin CL. Hereditary haemorrhagic telangiectasia: a clinical and scientific review. Eur J Hum Genet 2009; 17: 860-71. PubMed
- van Gent MW, Post MC, Snijder RJ, et al. Real prevalence of pulmonary right-to-left shunt according to genotype in patients with hereditary hemorrhagic telangiectasia: a transthoracic contrast echocardiography study. Chest 2010; 138:833. PubMed
- McDonald JE, Miller FJ, Hallam SE, et al. Clinical manifestations in a large hereditary hemorrhagic telangiectasia (HHT) type 2 kindred. Am J Med Genet 2000; 93:320. PubMed
- Fulbright RK, Chaloupka JC, Putman CM, Sze GK, Merriam MM, Lee GK et al. MR of hereditary hemorrhagic telangiectasia: prevalence and spectrum of cerebrovascular malformations. Am J Neuroradiol 1998; 19: 477 - 84. PubMed
- Román G, Fisher M, Perl DP, Poser CM. Neurological manifestations of hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber disease): report of 2 cases and review of the literature. Ann Neurol 1978; 4: 130 - 44. PubMed
- Pick A, Deschamps C, Stanson AW. Pulmonary arteriovenous fistula: presentation, diagnosis and treatment. World J Surg 1999; 23: 1118 - 22. PubMed
- Dong SL, Reynolds SF, Steiner IP. Brain abscess in patients with hereditary hemorrhagic telangiectasia: case report and literature review. J Emerg Med 2001; 20: 247 - 51. PubMed
- Shovlin CL, Jackson JE, Bamford KB, et al. Primary determinants of ischaemic stroke/brain abscess risks are independent of severity of pulmonary arteriovenous malformations in hereditary haemorrhagic telangiectasia. Thorax 2008; 63:259. PubMed
- Faughnan ME, Palda VA, Garcia-Tsao G et al. International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia. J Med Genet 2009, 29. juni (Epub ahead of print). www.ncbi.nlm.nih.gov
- Kjeldsen AD, Vase P, Green A. Hereditary haemorrhagic telangiectasia: a population-based study of prevalence and mortality in Danish patients. J Intern Med 1999; 245: 31-9. PubMed
- Steele JS, Nath PU, Burn J, Porteous MEM. An association between migrainous aura and hereditary haemorrhagic telangiectasia. Headache 1993; 33: 145 - 8. PubMed
- Kroon S, Snijder RJ, Faughnan ME, et al. Systematic screening in hereditary hemorrhagic telangiectasia: a review. Curr Opin Pulm Med 2018; 24(3): 260-8. www.ncbi.nlm.nih.gov
- Shovlin C, Bamford K, Wray D. Post-NICE 2008: Antibiotic prophylaxis prior to dental procedures for patients with pulmonary arteriovenous malformations (PAVMs) and hereditary haemorrhagic telangiectasia.. Br Dent J 2008; 205(10): 531-3. www.ncbi.nlm.nih.gov
Autoren
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Anders Waage, overlege og professor, Hematologisk avdeling, St. Olavs Hospital, og Norges teknisk-naturvitenskapelige universitet, Trondheim