Allgemeine Informationen
Definition
- Thymome sind epitheliale Tumoren, die sich wahrscheinlich von epithelialen Stammzellen des Thymus ableiten.1
- Thymome sind die häufigsten primären Tumoren im vorderen oberen Mediastinum.2-4
- Man unterscheidet benigne und maligne Thymome sowie Thymuskarzinome.5
- Seit 2016 werden fast alle Thymomtypen als maligne Tumoren eingestuft.
- Ausnahmen bilden das mikronoduläre Thymom mit lymphoidem Stroma, das mikroskopische Thymom und das Fibrolipoadenom.
- Thymuskarzinome machen etwa 1/5 aller Thymustumoren aus. Im Gegensatz zu den Thymomen zeigen sie keine organtypische Morphologie mehr auf, besitzen ein aggressiveres Verhalten und haben eine wesentlich schlechtere Prognose.6
- Seit 2016 werden fast alle Thymomtypen als maligne Tumoren eingestuft.
- Thymome sind in über 40 % der Fälle mit paraneoplastischen Syndromen assoziiert, in 90 % ist dies die Myasthenia gravis.7
WHO-Klassifikation
- Die Einteilung der Thymome erfolgt anhand der WHO-Klassifikation nach histologischen Kriterien. Sie korreliert mit Invasivität, Lokalrezidivrate und krankheitsfreiem Überleben:1,8
- Typ-A-Thymom, einschließlich der atypischen Variante
- Weisen meist niedrige Tumorstadien auf.
- Meist gekapselt und gut umschrieben.
- Atypische Typ-A-Thymome stellen eine aggressive Variante dar.
- Eine klinische Besonderheit ist die seltene Assoziation mit einer Myasthenia gravis.
- Die 10-Jahres-Überlebensrate liegt bei Typ-A-Thymomen ohne atypische Variante bei 80–100 %.
- Typ-AB-Thymom
- Wachsen meist nicht infiltrativ und sind gut umschrieben.
- Assoziation mit Myasthenia gravis in 20–40 % der Fälle, auch andere Autoimmunerkrankungen sind häufig.
- Die 10-Jahres-Überlebensrate liegt bei über 80 %.
- Typ-B1-Thymom
- Eine Myasthenia gravis kommt in 30–50 % der Fälle vor, andere Autoimmunerkrankungen sind selten (5 %).
- oft groß (> 10 cm) und gut umschrieben
- Die 10- und 20-Jahres-Überlebensraten liegen bei 85–100 %.
- Typ-B2-Thymom
- Wachsen meist infiltrativ.
- Eine Myasthenia gravis kommt in 50 % der Fälle vor, andere Autoimmunerkrankungen sind selten (5 %).
- Pleuraergüsse und Einflussstauungen sind häufiger als bei A-, AB- und B1-Thymomen.
- Die Rezidivraten liegt auch nach kompletter Resektion im Stadium II und III bei 32 bzw. 41 %.
- Die 10-Jahres-Überlebensraten erreichen 70–90 %.
- Typ-B3-Thymom
- Wachsen oft infiltrativ.
- Eine Myasthenia gravis kommt in 40 % der Fälle vor, andere Paraneoplasien sind selten.
- Die 10-Jahres-Überlebensrate liegt bei 50–70 %.
- mikronoduläres Thymom mit lymphoidem Stroma
- Paraneoplastische Phänomene, speziell eine Myasthenia gravis, kommen praktisch nicht vor.
- In 95 % der Fälle stellen sie Zufallsbefunde dar.
- Benigner Tumor, da Metastasen, Rezidive und Todesfälle nicht bekannt sind.
- metaplastisches Thymom
- keine Assoziation zu Autoimmunerkrankungen
- Rezidive sind selten, nur ein tumorbedingter Todesfall ist bislang bekannt (2016).
- andere seltene Thymome
- mikroskopisches Thymom, sklerosierendes Thymom, Lipofibroadenom
- meist klinisch nicht relevant und benigne
- Typ-A-Thymom, einschließlich der atypischen Variante
Häufigkeit
- Thymome sind selten. Pro Jahr erkranken ca. 0,2–0,4 von 100.000 Einw.5
- Ein Thymom ist die häufigste Neoplasie im vorderen Mediastinum und umfasst 20–25 % aller mediastinalen Tumoren und 50 % aller vorderen mediastinalen Raumforderungen.8
- Alter und Geschlecht1,9
- Tritt in der Regel im Alter zwischen 30 und 70 Jahren auf, das Durchschnittsalter beträgt 50 Jahre.
- Thymome kommen selten bei Kindern und Jugendlichen vor, hier überwiegen Thymuskarzinome.
- Es bestehen keine geschlechtsspezifischen Unterschiede.
Thymus
- Der Abschnitt basiert auf diesen Referenzen.5,10
- Der Thymus (Brustdrüse) ist ein lymphathisches Organ im vorderen Teil des Mediastinums.
- direkt hinter dem Sternum
- vor den großen Blutgefäßen Aorta, Truncus pulmonalis, V. cava superior, Vv. brachiocephalicae und dem Perikard.
- Die Drüse erstreckt sich lateral bis zum Nervus phrenicus.
- Der Thymus setzt sich vor allem aus Epithelzellen und Lymphozyten zusammen und besteht aus Mark und Rinde.
- Im Kindesalter ist der Thymus für die Entwicklung und Reifung von T-Lymphozyten verantwortlich.
- In der Pubertät bildet er sich langsam zurück.
- Beim Erwachsenen liegt nur noch ein Thymusrestkörper vor, der hauptsächlich aus Fett besteht und dessen Thymusanteile gering sind.
- Immunologie
- Vorläuferzellen der T-Lymphozyten gebildet aus lymphoiden Stammzellen wandern aus dem Knochenmark in den Thymus und reifen dort zu T-Lymphozyten heran.
- Die meisten dieser T-Lymphozyten werden durch Selektionsvorgänge zerstört. Dies schützt den Körper vor Autoaggression der T-Lymphozyten gegen die eigenen Körperzellen und erzeugt eine Selbsttoleranz.
- Fehler dieser negativen Selektion können Autoimmunerkrankungen (z. B. Myasthenia gravis) auslösen.
Ätiologie und Pathogenese
- Die Ätiologie der Thymomentstehung ist weitestgehend unklar, familiäre oder syndromale Fälle sind selten.1
- Thymome treten häufig mit Autoimmunerkrankungen auf.5,9
- z. B. Myasthenia gravis, Erythrozytenaplasie, systemischer Lupus erythematodes, Polymyositis, Sjögren-Syndrom und Hypogammaglobulinämie
Pathologie1
- Die meisten Thymome weisen eine thymusähnliche Differenzierung auf. Es kommt je nach histologischem Typ zu einer unterschiedlich starken intratumorösen Thymopoese mit Vorkommen unreifer T-Zellen.
- Dies ist Grundlage der häufigen thymomassoziierten Autoimmunerkrankungen, besonders der Myasthenia gravis.
- Thymome zeigen in 20–50 % der Fälle mehr als ein histologisches Muster. Die histologische Diagnose erfolgt nach der WHO-Klassifikation (s. o.), wobei die quantitativ führende Thymomkomponente zuerst genannt wird.
- z. B. WHO-Typ-B2-Thymom (60 %) neben Anteilen eines B1- (30 %) und B3-Thymoms (10 %)
- Thymuskarzinome zeigen keine thymusähnliche Differenzierung auf und lösen daher nur selten Autoimmunphänomene aus.
- Das Stadium von Thymomen wird nach der Masaoka-Koga-Klassifikation (s. u.) angegeben.
- Es spiegelt die Besonderheit von Thymomen wider, häufig pleural (Stadium IVa), aber selten (1–3 %) lymphogen und hämatogen zu metastasieren (Stadium IVb).
- Bei Thymuskarzinomen sind Lymphknoten- und Fernmetastasen hingegen häufig (30 %).
- Eine weitere Stadieneinteilung kann nach der TNM-Klassifikation erfolgen.12
ICPC-2
- B74 Maligne Bluterkrankung andere
- B75 Benigne/unspezifische Blutneubildung
ICD-10
- C37 Bösartige Neubildung des Thymus
- D15 Gutartige Neubildung sonstiger und nicht näher bezeichneter intrathorakaler Organe
- D15.0 Thymus
- D38 Neubildung unsicheren oder unbekannten Verhaltens des Mittelohres, der Atmungsorgane und der intrathorakalen Organe
- D38.4 Thymus
Diagnostik
Diagnostische Kriterien
- Typische radiologische Befunde in Röntgen und CT
Differenzialdiagnosen
- Der Abschnitt basiert auf dieser Referenz.13
- Thymushyperplasien: nicht neoplastische Vergrößerung des Thymus unterschiedlicher Ursache
- Kann reaktiv nach Beenden einer (Radio-)Chemotherapie, Immunsuppression oder schweren Erkrankungen als Zeichen einer Erholung des Immunsystems entstehen.
- Kann Folge einer Autoimmunerkrankung sein.
- Kann in Form einer echten Thymushyperplasie mit unbekannter Ätiologie auftreten.
- Lymphome
- Hodgkin-Lymphome (häufig), T-lymphoblastischen Lymphome oder mediastinale B-Zell-Lymphome
- reaktive Lymphadenitiden (z. B. bei Tuberkulose)
- metastatische Lymphadenopathie
- Keimzelltumor
- Häufig bei Säuglingen; der Tumor hat große zystische Bereiche, Fett und Verkalkungen.
- Retrosternale Struma
- Hat meist Verbindung mit der Schilddrüse.
- Herztumoren, Tumoren, die von der Lunge oder des Ösophagus ausgehen.
- Kongenitale Zysten
Anamnese
- Erwachsene sind meist asymptomatisch, aber fast 2/3 der betroffenen Kinder weisen Symptome auf.9
- Die Diagnose wird bei ca. 40 % der erwachsenen Patient*innen zufällig durch den Nachweis einer mediastinalen Raumforderung im Thoraxröntgen gestellt.8
- Bei Größenzunahme des Tumors zeigen sich Kompressionssymptome:5
- Husten
- Druckgefühl retrosternal
- Dyspnoe durch Kompression der Trachea
- Schluckbeschwerden durch Beeinträchtigung des Ösophagus
- Heiserkeit durch Irritation des Nervus recurrens.
- Symptome, die auf begleitende Krankheiten wie Myasthenia gravis hinweisen, können ebenfalls bestehen.
- z. B. Diplopie, Lidheberschwäche, Schluck- und Sprechstörungen, Muskelschwäche
Klinische Untersuchung
- Der Befund ist davon abhängig, wie weit der Zustand fortgeschritten ist.
- Im frühen Stadium besteht ein normaler klinischer Status, später können Zeichen einer oberen Einflussstauung und/oder kardiorespiratorische Symptome vorliegen.
- Eine Phrenicusparese und das superiore Vena-cava-Syndrom sind eher mit einem Thymuskarzinom assoziiert.9
Ergänzende Untersuchungen in der Hausarztpraxis
- Labordiagnostik – zum Auschluss Differenzialdiagnosen/Autoimmunerkrankungen
- z. B. großes Blutbild, CRP, BSG, Schilddrüsenparameter
Diagnostik bei Spezialist*innen
- Röntgen
-
Die Diagnose kann auf der Grundlage eines Röntgenthorax, das häufig ein verbreitertes Mediastinum und eine Verdichtung im retrosternalen, vorderen mediastinalen Raum zeigt, gestellt werden.14
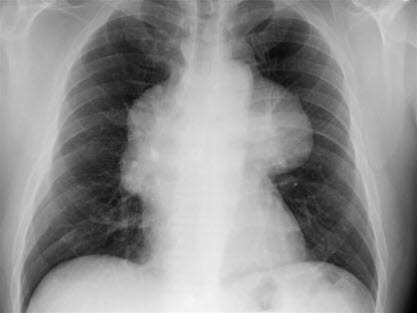 Thymom
Thymom - Die Läsion stellt sich als glatte Verdichtung in der oberen Hälfte des Thorax dar und liegt über dem oberen Teil des Herzschattens am Übergang zwischen Herz und den großen Gefäßen.
- Die Verdichtung wird in der Regel in eine der Thoraxhälften projiziert.
-
- CT12,15
- Goldstandard für die Beurteilung von Thymomen und Thymuskarzinomen
- Dient dazu zwischen invasiven und nichtinvasiven Thymomen zu unterscheiden, die Ausbreitung des Tumors präoperativ zu beurteilen sowie lokales Einwachsen, thorakale Metastasen und Fernmetastasen nachzuweisen.
- Ggf. wird es auch zur Unterstützung der CT-gesteuerten Biopsieentnahme eingesetzt.
- Die CT mit Kontrastmittel wird bevorzugt, um den Zusammenhang zwischen Thymom und den umgebenden vaskulären Strukturen zu zeigen.
- MRT12
- Eine etwaige Umgebungsinfiltration kann hier manchmal leichter beurteilt werden.
- Insgesamt können jedoch – nach bisheriger Datenlage – weder CT noch MRT eine frühe mediastinale und pleurale Infiltration aufdecken.
- Nuklearmedizin16
- Bislang ist die PET-CT kein Standard.
- Es kann in einigen Fällen genutzt werden, um Thymome von Lymphomen und Thymuskarzinomen abzugrenzen.
- Auch kann es zum Aufschluss einer kompletten Tumorresektion eingesetzt werden oder zur Abklärung einer Therapieoption mit Somatostatin nach erfolgloser Zweit- oder Drittlinienchemotherapie durchgeführt werden (Somatostatinrezeptorszintigrafie).
- Biopsie und Histologie12
- Die Biopsie ist keine Routinediagostik.
- Sie dient der differenzialdiagnostischen Abgrenzung.
- Biopsat und/oder der entfernte Tumor zeigen typische histologische Eigenschaften (siehe WHO-Klassifikation) und ermöglichen das Staging im Hinblick auf eine mögliche adjuvante Behandlung.
Indikation zur Klinikeinweisung
- Bei Verdacht auf die Erkrankung
Therapie
Therapieziele
- Kurativ bei benignen Formen und frühem Stadium
- Symptomatisch und lebensverlängernd bei fortgeschrittenen Stadien
Allgemeines zur Therapie
- Die komplette chirurgische Tumorresektion stellt die Basis für
eine erfolgreiche Therapie dar und sollte nach Möglichkeit stadienabhängig nach der Masaoka-Koga-Klassifikation erfolgen. - Patient*innen mit fortgeschrittenen Stadien profitieren von einem
multimodalen Therapiekonzept. - Die Therapie wird im Allgemeinen in interdisziplinärer Besprechung in Tumorkonferenzen festgelegt.
Masaoka-Koga-Klassifikation12,17
- Stadium I
- eingekapselter Tumor ohne Zeichen makroskopischer oder mikroskopischer Infiltration
- Therapie
- erweiterte Thymektomie mit Thymomektomie (R0-Resektion) inklusive angrenzendem Fettgewebe
- Stadium IIa
- mikroskopische Invasion durch die Kapsel
- Therapie
- erweiterte Thymektomie
- Stadium IIb
- makroskopische Invasion ins mediastinale Fettgewebe oder Tumoradhäsionen an Pleura oder Perikard ohne Durchbruch
- Therapie
- erweiterte Thymektomie
- ggf. postoperativer Radiotherapie bei WHO B2–3, Thymuskarzinomen (TK) oder R1/2
- Stadium III
- Invasion des Tumors in die Nachbarorgane (Perikard, große Blutgefäße, Lunge)
- Therapie
- resektabel: Operation
- nichtresektabel: Biopsie, neoadjuvante Chemotherapie (alternativ in Studien nach positiver PET-CT Somatostatingabe), bei partieller Remission Operation, postoperativ Radiotherapie bei WHO B2–3, TK, R1/2, im Einzelfall adjuvante Chemotherapie
- Stadium IVa
- pleurale oder perikardiale Metastasierung
- Therapie
- resektabel: Operation
- nichtresektabel: Biopsie, Induktionschemotherapie, ggf. Somatostatingabe (Downstaging), bei Remission Operation, in spezialisierten Zentren ggf. intraoperativ hypertherme intrathorakale Chemotherapie (HITHOC), ggf. adjuvante oder alleinige Chemotherapie; ggf. Radiotherapie (WHO B2–3, TK, R1/2)
- Stadium IVb
- lymphatische oder hämatogene Metastasierung
- Therapie
- Chemotherapie, ggf. Radiotherapie; ggf. palliative Tumorresektion
- Therapie beim Tumorrezidiv18
- resektabel: Operation
- nichtresektabel: Chemo-Radiatio, ggf. neoadjuvant
- Sofern erneut eine komplette Resektion erreicht werden kann, liegt die 10-Jahres-Überlebensrate bei 50–70% und gleicht damit der
Überlebensrate nach initialer Operation.
- Sofern erneut eine komplette Resektion erreicht werden kann, liegt die 10-Jahres-Überlebensrate bei 50–70% und gleicht damit der
Medikamentöse Therapie
- Der Abschnitt basiert auf dieser Referenz.12
- Die Chemotherapie kann bei der Behandlung eines invasiven oder metastatischen Thymoms und bei unvollständig reseziertem oder nichtresektablem Tumor infrage kommen.
- Aktuelle Schemata basieren auf Cisplatin-basierten Kombinations-Chemotherapien.
- zumeist PAC (Cisplatin, Doxorubicin, Cyclophosphamid)
- alternativ Cisplatin-/Etoposid-basierte Therapie
- In fortgeschrittenen Stadien kommen im Rahmen klinischer Studien auch Medikamente aus der Gruppe der targeted therapy zum Einsatz.
- z. B. der Immun-Checkpoint-Inhibitor Pembrolizumab oder der mTOR-Inhibitor Everolimus
- z. B. im Falle eines positiven Somatostatinrezeptorennachweises
in der Octreotid-/Tektrotydszintigraphie systemische Therapie mit Octreotid und Prednisolon
- Im Stadium IVa wird seit einigen Jahren in spezialisierten Zentren eine zusätzliche intraoperative Chemotherapie (HITHOC) mit geringerer systemischer Toxizität durchgeführt.
- Durch die Hyperthermie können Effektivität und Eindringtiefe der Chemotherapeutika erhöht und synergistische antineoplastische Effekte durch Aktivierung der Apoptose erreicht werden.
Operative Therapie
- Der Abschnitt basiert auf diesen Referenzen.8,12
- Die komplette chirurgische Tumorresektion bildet die Basis für eine erfolgreiche Behandlung und gilt als entscheidender prognostischer Überlebensfaktor.
- Zumeist erfolgt die Operation offen durch komplette Sternotomie, bei gut abgekapselten und nicht zu großen Prozessen (bis ca. 6 cm) kann auch die minimalinvasive Technik (Video-assisted Thoracoscopic Surgery [VATS]) gewählt werden.
- Nach Möglichkeit erfolgt die erweiterte Thymektomie mit Thymomektomie (R0-Resektion) inklusive angrenzendem Fettgewebe.
- Ab Stadium III wird eine ausgedehntere Operation mit En-bloc-Resektion des Primärtumors mit allen infiltrierten Strukturen mit ggf. Gefäßersatz und Zwerchfellraffung bei Verletzung des Nervus phrenicus durchgeführt.
- Zur Resektion pleuraler Tumoranteile erfolgt zumeist eine radikale Pleurektomie/Dekortikation mit Erhalt der Lunge.
- Die chirurgische Exzision ermöglicht die Feststellung der histologischen Eigenschaften und des Stadiums des Tumors, durch die der Bedarf an adjuvanter Behandlung bestimmt wird.
Bestrahlung
- Der Abschnitt basiert auf dieser Referenz.12
- Das strahlentherapeutische Zielvolumen umfasst im Regelfall das Tumorbett ohne regionäre Lymphknoten – außer bei eindeutigem Befall.
- Vor allem beim Thymuskarzinom konnte in allen Stadien durch eine adjuvante Strahlentherapie eine Verbesserung des Überlebens gezeigt werden.
Verlauf, Komplikationen und Prognose
Verlauf
- Der Abschnitt basiert auf dieser Referenz.18
- Die Rezidivrate des Thymoms liegt im Stadium I bei weniger als 4 %, im Stadium II bei 20 % und im Stadium IVa bei 50 %.
- In Bezug auf die Histologie beträgt die Rezidivrate beim Thymom Typ A 5 % und beim Typ B3 15 %.
Komplikationen
- Invasion in die nahe gelegenen Organe und Metastasierung
- Durch Bestrahlung ausgelöste Perikarditis, Pneumonitis oder Lungenfibrose
- Tumorrezidiv
Prognose
- Der Abschnitt basiert auf dieser Referenz.18
- Mittlerweile wird sowohl für Patient*innen mit frühen als auch mit fortgeschrittenen Thymomen ein gutes Langzeitüberleben erreicht.
- Thymuskarzinome hingegen haben eine schlechte bis extrem schlechte Überlebensprognose.
- Prognostische Faktoren für das Überleben und das Rezidivrisiko sind vor allem:
- das Stadium (Masaoka-Koga-Klassifikation)
- die Radikalität der Resektion
- der histologische WHO-Subtyp.
Verlaufskontrolle
- Der Abschnitt basiert auf dieser Referenz.18
- Nach der Primärbehandlung eines Thymoms kann ein Rezidiv nach 10–20 Jahren auftreten.
- Deshalb müssen Patient*innen wahrscheinlich für den Rest ihres Lebens nachkontrolliert werden.12
- Die ersten 5 Jahre postoperativ wird jährlich eine CT empfohlen.
- bis zum 11. Jahr abwechselnd jährlich eine CT und ein Röntgenbild
- danach jährlich ein Röntgenbild
- Für Thymome mit erhöhtem Rezidivrisiko, z. B. bei inkompletter Resektion, wird eine CT alle 6 Monate postoperativ empfohlen.
- Bei jüngeren Patient*innen sollte als Methode alternativ eine MRT erwogen werden.
- Eine PET-CT sollte hingegen nur bei spezieller Fragestellung veranlasst werden.
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Thymom: Verbreiterung des Mediastinums im oberen Teil und perihilär beidseits
Quellen
Leitlinien
- Deutsche Gesellschaft für Neurologie. Myasthenia gravis und Lambert-Eaton-Syndrom, Diagnostik und Therapie. AWMF-Leitlinie Nr. 030-087. S2k, Stand 2014. www.awmf.org
Literatur
- Marx A, Weis CA, Ströbel P. Thymome. Der Pathologe 2016; 5: 412–424. link.springer.com
- Duwe BV, Sterman DH, Musani AI. Tumors of the mediastinum. Chest 2005; 128: 2893-909. PubMed
- Evans KJ. Thymoma. eMedicine, Nov 04, 2014. www.emedicine.com. emedicine.medscape.com
- Detterbeck FC, Parsons AM. Thymic tumors. Ann Thorac Surg 2004; 77: 1860-9. PubMed
- Deutsche Krebsgesellschaft. Thymom. Onko-Internetportal. Stand März 2014. www.krebsgesellschaft.de
- Jungraithmayr Wolfgang et al. Diagnose und Therapie des Thymuskarzinoms. Swiss Medical Forum 2016; 16(47): 1019-1025. doi:https://doi.org/10.4414/smf.2016.02777 pdfs.semanticscholar.org
- Schmidt H et al. Polyneuropathie als einziges paraneoplastisches Syndrom bei malignem Thymom. Der Nervenarzt 2003; 74: 888–891. link.springer.com
- K. Ammann, M. Möschel, E. Wenzl. Thymom und Thymuskarzinom: Eine Übersicht. Interdisziplinäre Onkologie 2013; 5: 53-57. www.kup.at
- Suster S. Thymom, orpha.net, Stand 2011. www.orpha.net
- Deetjen, Speckmann, Hescheler. Physiologie. München, Jena: Elsevier Urban & Fischer, 2005.
- Deutsche Gesellschaft für Neurologie. Myasthenia gravis und Lambert-Eaton-Syndrom, Diagnostik und Therapie. AWMF-Leitlinie Nr. 030-087, Stand 2014. www.awmf.org
- Ried M. et al. Therapie von Thymomen und Thymuskarzinomen. best practice onkologie 2017; 12: 206-214. doi:https://doi.org/10.1007/s11654-017- 0037-7. www.springermedizin.de
- Weis CA et al. Echte Thymushyperplasie: Differenzialdiagnose der Thymusvergrößerung bei Säuglingen und Kindern. Der pathologe 2017. doi:10.1007/s00292-017-0283-z DOI
- Rosado-de-Christenson ML, Galobardes J, Moran CA. Thymoma: radiologic-pathologic correlation. Radiographics 1992; 12: 151-68. PubMed
- Maher MM, Shepard JA. Imaging of thymoma. Semin Thorac Cardiovasc Surg 2005; 17: 12-9. PubMed
- Santana L, Givica A, Camacho C. Best cases from the AFIP: thymoma. Radiographics 2002; 22: 95-102. pubs.rsna.org
- Fang W, Chen W, Chen G, Jiang Y. Surgical management of thymic epithelial tumors: a retrospective review of 204 cases. Ann Thorac Surg 2005; 80: 2002-7. PubMed
- Jungraithmayra W et al. Das Thymom, SWISS MEDICAL FORUM – SCHWEIZERISCHES MEDIZIN-FORUM 2016;16(45):961–968. www.thorax.usz.ch
Autor*innen
- Kristine Scheibel, Dr. med., Fachärztin für Allgemeinmedizin, Norderney
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).