Allgemeine Informationen
Definition
- Seronegative (rheumafaktornegative) Arthritis, die mit einer Psoriasis assoziiert ist und zum Formenkreis der Spondyloarthritiden gehört.1
- Charakteristisch sind:1
- typisches Gelenkbefallsmuster (Endgelenks- und Strahlbefall, meist asymmetrische Oligo- oder Polyarthritis, Befall der Enthesen, auch Stammskelettbefall)
- radiologisches Nebeneinander von destruktiven und produktiven knöchernen Veränderungen.
Häufigkeit
- Die Prävalenz in der deutschen Gesamtbevölkerung beträgt etwa 0,2–1,4 %.2
- Bis zu 30 % der Psoriasis-Patient*innen weisen eine Psoriasisarthritis (PsA) auf oder entwickeln sie im Verlauf.3
- Bei ca. 80 % der Patient*innen treten die Hauterscheinungen vor der PsA auf, bei jeweils 10 % nach der PsA oder gleichzeitig.3
- Bestimmte Erscheinungsbilder der Psoriasis sind mit einer höheren Wahrscheinlichkeit für eine PsA verbunden, z. B. Nageldystrophie, Kopfhautläsionen oder interglutäaler/perianaler Befall.4
- Krankheitsbeginn am häufigsten zwischen dem 30. und dem 55. Lebensjahr5
- Männer und Frauen sind etwa gleich häufig betroffen.5
- Es besteht eine familiäre Häufung.5-6
Ätiologie und Pathogenese
- Die Ätiologie ist ungeklärt.
- Die PsA gilt als multifaktorielle und multigenetische Erkrankung.7
- Die Entstehung der PsA wird beeinflusst durch:8
- genetische Polymorphismen
- pathologische Zytokineffekte
- Zusammenspiel zwischen angeborenem und erworbenem Immunsystem
- mechanische Reize.
- Der Anstoß zur Erkrankung erfolgt – auf Basis einer genetischen Disposition – durch einen Stressfaktor wie Infektion oder mechanische Gelenkbelastung, z. B. schwere manuelle Arbeit.9-10
- Hierdurch Auftreten des sog. tiefen Köbner-Phänomens (entsprechend dem Köbner-Phänomen der Haut) mit Entstehung einer Entzündung der Enthesen (Ansatzpunkte von Sehnen und Bändern am Knochen)9
- Die Enthesitis gilt als Übergangsstadium von der Haut- zur Gelenkerkrankung.9
- Der autoinflammatorische Prozess wird durch Aktivierung von Prostaglandin E2 und die Freisetzung von Zytokinen aufrechterhalten.10
- Pathogenetisch sind vor allem TNF-alpha, IL-23 und IL 17 von Bedeutung und sind daher auch Ansatzpunkte für medikamentöse Therapien.11-12
- Schlussendlich führt die lokale Entzündung zu Knochenumbauten und Knochenneubildung10
- Diese erosiven und osteoproliferativen Umbauvorgänge sind für die PsA charakteristisch.10
- Die PsA wird den Spondyloarthritiden zugeordnet, obwohl nur ein Teil der Patient*innen eine Achsenskelettbeteiligung aufweist.13
Klinische Manifestation
- Heterogenes Krankheitsbild mit zahlreichen klinischen Erscheinungsbildern
- Dadurch nicht selten erst relative späte Diagnosestellung3
- Wesentliche klinische Manifestationen sind:3,14
- periphere Arthritis (Oligo-/Polyarthritis, auch Monarthritis)
- Enthesitis
- Daktylitis
- entzündliche Beteiligung des Achsenskeletts
- unterschiedliche Lokalisationen und Ausprägungen eines psoriatischen Haut- und Nagelbefalls
- Augen- oder Darmbeteiligung bei einem Teil der Patient*innen.
Prädisponierende Faktoren
- Genetische Faktoren, es besteht eine familiäre Häufung.5-6
- Exogene Faktoren, die eine PsA triggern können:1
- Infektionen
- Sportverletzungen
- häufiges schweres Heben
- Impfen (Rötelnimpfung)
- Rauchen.
ICPC-2
- L88 Rheumatoide Arthritis
ICD-10
- M07 Arthritis psoriatica und Arthritiden bei gastrointestinalen Grundkrankheiten
- M07.2 Spondylitis psoriatica
- M07.3 Sonstige psoriatische Arthritiden
Diagnostik
Diagnostische Kriterien
- Zumeist werden die CASPAR-Kriterien („Classification Criteria for Psoriatic Arthritis") verwendet.15
- Im Übrigen sollte eine chronische Arthritis bei Psoriasis-Patient*innen als PsA betrachtet werden, sofern es keine klaren Hinweise auf eine andere Erkrankung gibt.17
- Andererseits sind für die Diagnose einer PsA Hautsymptome nicht zwingend erforderlich.18
CASPAR-Kriterien1,15,19
- Obligate Kriterien
- Schmerz, Schwellung und/oder Steifigkeit in einem oder mehreren Gelenken
- entzündliche Veränderungen im Bereich von Gelenken, Wirbelsäule, Sehnen oder Sehnenansätzen (Enthesen)
- Zusätzliche mindestens 3 Punkte aus den folgenden Kriterien:
- aktuell vorhandene Psoriasis (2 Punkte)
- Eigenanamnese einer Psoriasis, falls aktuell nicht vorhanden (1 Punkt)
- Familienanamnese (1. oder 2. Grades) einer Psoriasis, falls aktuell oder in der Eigenanamnese nicht vorhanden (1 Punkt)
- psoriatische Nageldystrophie (1 Punkt)
- negativer Rheumafaktor (1 Punkt)
- Daktylitis, aktuell vorliegend (1 Punkt)
- Eigenanamnese einer Daktylitis (1 Punkt)
- Bildgebung: Nachweis typischer gelenknaher osteoproliferative Veränderungen an Händen oder Füßen (1 Punkt).
Differenzialdiagnosen
- Rheumatoide Arthritis
- Axiale Spondylarthritiden einschließlich Spondylitis ankylosans
- Reaktive Arthritis
- SAPHO-Syndrom
- Arthritis bei chronisch-entzündlichen Darmerkrankungen
- Septische Arthritis
- Gicht
- Hand- und Fingergelenkspolyarthrose
- Aktivierte Arthrose großer Gelenke
Anamnese – typische Symptome
- Der gesamte Abschnitt basiert auf dieser Referenz.19
- Gelenkbeschwerden (Schwellung, Rötung, Morgensteifigkeit, Druckschmerzhaftigkeit)
- Beteiligung von großen und kleinen Gelenken
- häufig asymmetrische Verteilung
- zu Beginn häufig oligoartikulär, auch Monarthritis möglich
- im weiteren Verlauf evtl. Entwicklung zu Polyarthritis
- Befall von Finger- und/oder Zehengelenken, vor allem der distalen Interphalangealgelenke (DIP)
- Befall im Strahl (Daktylitis)
- Im Vergleich zu anderen Arthritiden sind häufiger Sternocostal- und Kiefergelenk betroffen.
- Schmerzen im Bereich von Sehnenansätzen
- Achillessehne, Plantarfaszie, muskuloskelettale Ansätze an Becken, Patella und Klavikula
- Tiefsitzende Rückenschmerzen, gebessert durch Bewegung
- Psoriasis der Haut, Nagelpsoriasis
- Positive Familienanamnese
- Frage nach Komorbiditäten:
- Sehstörung (Iritis)
- Darmbeschwerden (chronisch-entzündliche Darmerkrankung).
Screening-Fragen zur Frühdiagnose einer PsA bei Psoriasis-Patient*innen in der Hausarztpraxis
- Siehe auch Artikel Psoriasis.
- Eine verspätete Diagnose einer PsA kann zu irreversiblen Schäden führen, bereits 2 Jahre nach Beginn weist ca. die Hälfte der Patient*innen erosiv-proliferative Veränderungen auf.20
- Daher sollten auch Hausärz*innen (und Orthopäd*innen), bei denen häufig die Erstvorstellung bei Gelenkbeschwerden erfolgt, in ein Frühscreening eingebunden sein.20
- Neben komplexen englischsprachigen Fragebögen existiert ein einfacher und validierter deutschsprachiger Screening-Fragebogen, der German Psoriasis Arthritis Diagnostic Questionnaire (GEPARD), der bereits im Wartebereich der Praxis beantwortet werden kann.21
GEPARD-Screeningfragen21
- Haben Sie schon einmal Gelenkschmerzen gehabt, die mit einer Schwellung eines Gelenkes einhergingen?
- War bei Ihnen schon einmal ein ganzer Finger oder Zeh dick?
- Haben Sie schon einmal Gelenkschmerzen gehabt, die mit einer Rötung eines Gelenkes einhergingen?
- Fühlten sich schon mal Ihre Gelenke nach dem Aufwachen morgens steif an? Wenn ja, wie lange?
- Haben Sie schon einmal daran gedacht, dass Sie an einer Gelenkerkrankung leiden könnten?
- Haben Sie schon einmal ärztliche Hilfe wegen Gelenkbeschwerden gesucht?
- Wurde bei Ihnen jemals die Diagnose Arthritis gestellt?
- Haben Sie schon einmal Medikamente zur Behandlung von Gelenkschmerzen eingenommen?
- Litten Sie schon einmal an mindestens 3 Tagen der Woche an Rücken- oder Gesäßschmerzen?
- Wenn ja, waren oder sind diese Rücken- oder Gesäßschmerzen in den frühen Morgenstunden am schlimmsten?
- Bessern sich diese bei Bewegung?
- Dauern diese in Ruhe an?
- Gehen diese mit einer Steifigkeit am Morgen einher?
- Wenn Sie eine der Fragen mit ja beantwortet haben, seit wann haben Sie diese Beschwerden? (> 1 Woche/1 Monat/3 Monate/6 Monate/1 Jahre/3 Jahre/5 Jahre)
- Bei ≥ 4 positiven Antworten besteht V. a. auf eine Psoriasisarthritis (Sensitivität 89 %, Spezifität 69 %).21
Klinische Untersuchung
- Die körperliche Untersuchung umfasst:1,19,22
- die Beurteilung von Gelenken und Sehnen/Sehnenansätzen
- die Erfassung extraskeletaler Veränderungen.
- Gelenke, Sehnen/Sehnenansätze (Enthesien)
- Schwellung
- Rötung
- Überwärmung
- Druckschmerzhaftigkeit
- Anzahl und Lokalisation der betroffenen Gelenke
- Befallsmuster
- häufig asymmetrisch
- Typisch ist ein Befall der distalen (DIP) Interphalangealgelenke (DIP) von Fingern und/oder Zehen, auch die proximalen Interphalangealgelenk (PIP) können betroffen sein.
- Daktylitis: Entzündung/Ödem im Strahl eines ganzen Fingers („Wurstfinger") oder einer Zehe (ca. 30 % der Patient*innen)23
- Arthritis mutilans (ca. 5 %): destruierende Veränderungen mit teleskopartig veränderten Fingern und/oder Zehen
- Enthesitis (Entzündung der Sehnenansätze) am häufigsten im Bereich von dorsalem und plantarem Kalkaneus, Patella, Trochanter major, Klavikula, Sitzbeinhöcker
- Eine Enthesitis ist klinisch schwierig zu objektivieren, hierfür bedarf es meistens zusätzlicher Bildgebung (MRT, Ultraschall).20
- Untersuchung der Wirbelsäulenbeweglichkeit bei V. a. axiale Beteiligung
- Extraartikuläre Manifestationen
- Haut
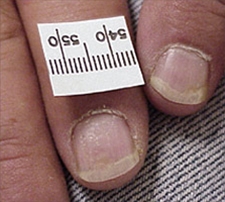 Tüpfelnägel bei Psoriasis
Tüpfelnägel bei Psoriasis - Nägel24
- Einsenkungen („Tüpfelnägel“)
- Verdickungen
- Ölflecke
- Onycholyse
- Auge1
- Konjunktivitis (12–20 %), Iritis (5–18 %)
- Haut
Klinische Einteilung der Psoriasisarthritis
- Am gebräuchlichsten ist die Klassifikation nach Moll und Wright, es werden 5 Typen unterschieden:22,25
- Arthritis der distalen Interphalangealgelenke von Händen und Füßen
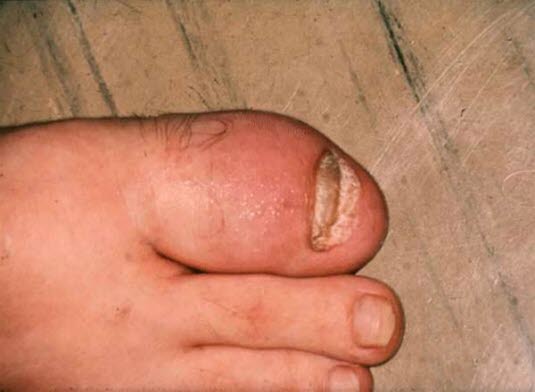 Psoriasisarthritis
Psoriasisarthritis- evtl. in Kombination mit anderen Lokalisationen
- Asymmetrische Oligoarthritis
- Häufige Form der Psoriasisarthritis, die kleine und große Gelenke befallen kann.
- Typisch ist auch die Daktylitis mit wurstförmigen Fingern und Zehen.
- Symmetrische Polyarthritis
- Ähnelt der rheumatoiden Arthritis, die Patient*innen sind jedoch seronegativ.
- Arthritis mutilans
- schwere, destruierende Veränderungen einzelner Finger oder Zehen
- Ankylosierende Spondylitis mit und ohne periphere Arthritis, HLA-B27-assoziiert
- Auch eine Beteiligung der Halswirbelsäule ist möglich.
- Verläufe, die dieser Einteilung klar zuzuordnen sind, sind allerdings eher selten.14
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- Es existieren keine spezifischen Laborparameter zur Diagnose einer PsA.1
- keine spezifischen Antikörper
- keine HLA-Assoziationen
- BSG und CRP können erhöht sein (BSG-Erhöhung bei ca. der Hälfte, CRP-Erhöhung bei weniger als der Hälfte der Patient*innen).19
- Die Werte variieren je nach Krankheitsaktivität.
- Rheumafaktor und ACPA sind meist negativ, dienen aber der differenzialdiagnostischen Abklärung.19
- in ca. 10 % der Fälle niedrigtitrige RF/ACPA nachweisbar14
- HLA-B27-Bestimmung bei vermuteter Beteiligung des Achsenskeletts
- Harnsäure zum Ausschluss einer Gichtarthritis
- PsA kann allerdings von Hyperurikämie begleitet sein.19
- Antinukleäre Antikörper (ANA) in der Regel nicht nachweisbar
Diagnostik bei Spezialist*innen
Konventionelles Röntgen
- Konventionelles Röntgen der Extremitäten ist in der Routinediagnostik unverzichtbar.26
- Prognostische Bedeutung vor allem am Anfang der Erkrankung bezüglich des weiteren radiologischen Verlaufs26
- Durchführung abhängig von der Symptomatik in folgenden Bereichen:19
- periphere Gelenke im Bereich Finger, Hände, Handgelenke, Zehen, Vorfüße
- Wirbelsäule, Becken (v. a. Sakroiliakalgelenke)
- Halswirbelsäule.
- Wichtigstes Merkmal ist die Kombination von osteodestruktiven und osteoproliferativen Veränderungen.26
- häufig im Bereich der Kapsel oder des Sehnenansatzes von Gelenken26
- Weitere mögliche Befunde sind:19
- ausgeprägte, langstreckige Osteolysen (Pencil-in-cup-Deformität)
- Teleskopfinger/-zehen
- Ankylosen, Acroosteolysen
- (einseitige) Sakroiliitis
- atlantookzipitale Subluxation.
Ultraschall
- Ist insbesondere in der Frühdiagnostik von entzündlichen Gelenk- und Sehnenveränderungen der PsA von Bedeutung.26
- Darstellung von Synovitis, Gelenkerguss, Tenosynovitis, Tendinitis, Enthesitis und oberflächlich lokalisierten Erosionen am Knochen19
CT
- Zur Beurteilung peripherer Gelenke im Allgemeinen nicht zu empfehlen19
- Vor allem zur Erfassung von Veränderungen des Achsenskeletts, Diagnose von Tumoren und Frakturen19
MRT
- Hochauflösende Darstellung intraossärer, artikulärer oder periartikulärer Strukturen bei der PsA26
- Einsatz der MRT bei:26
- Frage nach subklinischer Entzündung oder sehr früher muskuloskeletaer Manifestation
- Diagnostik typischer Prädilektionsstellen einer Enthesitis wie z. B. Achillessehne.
- Strahlungsfrei, gut geeignet zur Verlaufsbeurteilung des Therapieerfolgs26
Indikationen zur Überweisung
- Bei Verdacht auf eine Psoriasisarthritis Überweisung an eine rheumatologische Praxis zur Bestätigung der Diagnose und Planung der Behandlung
Checkliste zur Überweisung
Psoriasisarthritis
- Zweck der Überweisung
- Ergänzende Diagnostik? Therapieplanung
- Anamnese
- Schmerzen, Schwellung von Gelenken?
- Morgensteifigkeit, Besserung bei Bewegung?
- bisherige Medikation
- Klinische Untersuchung
- entzündliche/destruierende Gelenkveränderungen
- Anzahl und Verteilung der betroffenen Gelenke
- Daktylitis?
- Verminderte Beweglichkeit der Wirbelsäule?
- Extraartikuläre Manifestationen?
- Ergänzende Untersuchungen
- Labor: CRP, BSG, Rheumafaktor, ACPA, Harnsäure
- Bildgebung: Röntgen
- Labor: CRP, BSG, Rheumafaktor, ACPA, Harnsäure
Therapie
Therapieziele
- Ziel der Therapie ist die Optimierung der Lebensqualität durch:27
- Symptomkontrolle
- Vermeidung struktureller Schäden
- Normalisierung der Gelenkfunktion
- Ermöglichung sozialer Partizipation.
Allgemeines zur Therapie
- Die Therapieentscheidung sollte im Sinne der partizipativen Entscheidungsfindung zwischen Patient*innen und Ärzt*innen getroffen werden.27
- Die Behandlung sollte im Sinne eines „Treat-to-Target"-Ansatzes erfolgen mit den Zielen:28
- Remission (Abwesenheit aller Krankheitsanzeichen)
- MDA (= Minimal Disease Activity), falls Remission nicht möglich; MDA ist definiert als Erreichen von mindestens 5 der folgenden Kriterien:
- ≤ 1 druckschmerzhaftes Gelenk
- ≤ 1 geschwollenes Gelenk
- erscheinungsfreie oder nahezu erscheinungsfreie Haut
- ≤ 1 druckschmerzhafte Sehnenansatzstelle
- Patientenselbsteinschätzung für Schmerz VAS ≤ 15/100
- Patientenselbsteinschätzung der globalen Krankheitsaktivität VAS ≤ 20/100
- Funktionskapazität im Health Assessment Questionnaire (HAQ) ≤ 0,5
Spezielle Therapie
- Die EULAR-Empfehlungen (European League Against Rheumatism) enthalten einen schrittweisen Therapiealgorithmus in Anlehnung an die Therapie der rheumatoiden Arthritis.27
- Bislang ist noch keine nationale Leitlinie zur Behandlung der PsA verfügbar.28-29
- Als Erstlinientherapie werden nichtsteroidale Antiheumatika (NSAR) empfohlen.27
- Ein Einsatz zur symptomatischen Behandlung ist bereits vor Diagnosesicherung möglich.28
- Intraartikuläre Glukokortikoidinjektionen können als Ergänzung zu NSAR erwogen werden, eine systemische Glukokortikoidgabe spielt in der Behandlung der PsA im Allgemeinen keine Rolle.28
- Nach gesicherter Diagnose und bei anhaltender Symptomatik Einsatz von DMARD (Disease Modifying Antirheumatic Drugs)
- DMARD können eingeteilt werden in:28
- konventionelle systemische DMARD (csDMARD)
- Methotrexat
- Leflunomid
- Sulfasalazin
- Ciclosporin
- biologische DMARD (bDMARD)
- TNF-alpha-Inhibitoren (Etanercept, Infliximab, Adalimumab, Golimumab, Certolizumab)
- IL-12/23-Inhibitor (Ustekinumab)
- IL-17-Inhibitoren (Secukinumab, Ixekizumab)
- Targeted-Synthetic-DMARD (tsDMARD)
- PDE4-Inhibitor (Apremilast)
- JAK-Inhibitor (Tofacitinib).
- konventionelle systemische DMARD (csDMARD)
EULAR-Therapiealgorithmus27
Phase 1
- NSAR als Basisbehandlung
- Individuell evtl. Ergänzung der Behandlung mit örtlichen Glukokortikoidinjektionen
- Zielerreichung (Remission oder MAD = Minimal Disease Activity) innerhalb 4 Wochen (bei Mono-/Oligo-/Polyarthritis) bzw. 12 Wochen (bei Enthesitis, axialer Erkrankung)
- Sofern keine Zielerreichung
- Beginn Phase 2 (Mono-/Oligo-/Polyarthritis)
- Beginn Phase 3 (Enthesitis, axiale Erkrankung)
Phase 2
- Therapiebeginn mit MTX
- Leflunomid oder Sulfasalazin als Alternativen
- Verbesserung innerhalb von 3 Monaten, Zielerreichung (Remission oder MAD) innerhalb von 6 Monaten
- Sofern keine Zielerreichung, Beginn mit Phase 3
Phase 3
- Therapiebeginn mit bDMARD
- Mono-/Oligo-/Polyarthritis und/oder Enthesitis
- TNF-alpha-Inhibitor – oder –
- IL-12/23-Inhibitor – oder –
- IL-17-Inhibitor
- Axiale Erkrankung
- TNF-alpha-Inhibitor – oder –
- IL-17-Inhibitor
- Mono-/Oligo-/Polyarthritis und/oder Enthesitis
- Verbesserung innerhalb von 3 Monaten, Zielerreichung (Remission oder MAD) innerhalb von 6 Monaten
- Sofern keine Zielerreichung, Beginn mit Phase 4
Phase 4
- Mono-/Oligo-/Polyarthritis und/oder Enthesitis
- Wechsel zu anderem bDMARD – oder zu –
- PDE4-Inhibitor – oder zu –
- JAK-Inhibitor
- Axiale Erkrankung
- Wechsel zu anderem bDMARD (TNF-alpha-Inhibitor oder IL-17-Inhibitor)
Medikamente
NSAR
- Mittel der 1. Wahl zur Linderung der muskuloskeletalen Symptome27
- Keine wesentlichen Unterschiede verschiedener NSAR in der Wirkung27
- Das Nutzen-Risiko-Verhältnis muss beachtet werden, insbesondere bei den häufigen kardiovaskulären Komorbiditäten.28
- Die Therapie kann unter hausärztlicher Betreuung durchgeführt werden.
Glukokortikoide
- Lokale Injektion von Glukokortikoiden empfehlenswert bei Patient*innen mit aktiver Mono- oder Oligoarthritis, Daktylitis mit Enthesitis oder Tendosynovitis30
- Eine systemische Gabe sollte allenfalls mit Vorsicht in der niedrigst wirksamen Dosen und für einen kurzen Zeitraum erfolgen.27
DMARD (Disease Modifying Antirheumatic Drugs)
csDMARD (konventionelle systemische DMARD)
- Methotraxat
- Methotrexat ist das in der Therapie der PsA am häufigsten eingesetzte csDMARD.31
- Zur Langzeiteffektivität gibt es allerdings keine eindeutigen Studiendaten.32
- gute Effektivität bei der kutanen Psoriasis31
- Es ist unklar, ob die Kombination von MTX mit einer Biologikabehandlung einen positiven Effekt hat.31
- Bei dauerhafter Anwendung sind regelmäßige Kontrollen der Leberwerte empfohlen.33
- Leflunomid
- Sulfasalazin
- gut untersuchtes Reservemedikament31
- mäßige Wirksamkeit auf betroffene Gelenke
- keine Wirkung auf den Hautbefall
- Ciclosporin
- Wirkung belegt, wird vor allem aufgrund der Nephrotoxizität kaum noch verwendet.31
bDMARD (biologische DMARD)
- TNF-alpha-Inhibitoren
- Die Wirksamkeit ist in zahlreichen Studien belegt.34
- Wirksam sowohl bei PsA (einschließlich axialen Befalls) als auch bei Hautveränderungen
- 5 TNF-alpha-Inhibitoren sind zur Therapie der PsA zugelassen:
- IL-12/23-Inhibitor
- IL-17-Inhibitoren
- Secukinumab weist unter den Therapeutika, die für die Behandlung von PsA und ankylosierender Spondylitis zugelassen sind, die stärkste Wirkung auf die kutane Psoriasis auf.31
- Ixekizumab zeigt neben der Wirkung auf PsA einschließlich axialer Manifestation ebenfalls eine hohe Effektivität bei Hauteffloreszenzen.31
- AkdÄ und GBA sehen bei Psoriasisarthritis keinen oder nur einen geringen Zusatznutzen von Ixekizumab.39-40
- Früher wurde TNF-Alpha-Antagonisten gegenüber anderen bDMARD der Vorzug gegeben, inzwischen scheint dies nicht mehr zwingend geboten.30
- Die unterschiedliche Effektivität der verschiedenen bDMARD auf extraskelatale Manifestationen (Psoriasis, Uveitis, chronisch-entzündliche Darmerkrankung) sollte bei der Indikationsstellung beachtet werden.41
- Die Behandlung mit bDMARD kann als Monotherapie oder in Kombination mit einem csDMARD durchgeführt werden.30
ts-DMARD (Targeted Synthetic DMARD)
- PDE4-Inhibitor
- Apremilast ist wirksam sowohl bei kutanem als auch muskuloskeletalem Befall, Stellenwert vor allem in der Behandlung der moderaten PsA nach csDMARD-Versagen.31
- JAK-Inhibitor
- Tofacitinib ist eine Therapieoption nach TNF-Versagen, für die Behandlung der PsA nur in Kombination mit csDMARD zugelassen.
- laut arznei-telegramm erhöhtes Krebsrisiko, Thromboembolierisiko und vermehrt kardiovaskuläre Ereignisse sowie erhöhte Mortalität unter Tofacitinib42
- Hierzu gibt es einen Rote-Hand-Brief.
Leitlinie: Behandlung von Psoriasis-Patient*innen mit Psoriasisarthritis30
- Es wird empfohlen, die Diagnosestellung und Therapieauswahl bei einer Psoriasisarthritis interdisziplinär in Kooperation mit Rheumatolog*in durchzuführen, wann immer dies erforderlich ist.
- Bei Patient*innen mit einer mittelschweren bis schweren Psoriasis und einer trotz des Einsatzes von NSAR/Coxiben oder ggf. Glukokortikoid-Injektionen aktiven peripheren Gelenkbeteiligung (PsA), und/oder bei einer potenziell schlechteren Prognose aufgrund von Polyarthritiden, erhöhten Entzündungsmarkern und erosiven Veränderungen sowie extraartikulären, enthesitischen muskuloskelettalen Manifestationen wird eine frühzeitige Einleitung der Therapie mit einem konventionellen synthetischen DMARD (MTX) empfohlen, um ein Voranschreiten der Erkrankung und eine erosive Zerstörung der Gelenke zu verhindern.
- Es wird empfohlen, synthetischen Monotherapie-DMARD (MTX) zur Behandlung einer axialen Beteiligung oder einer Enthesitis nicht einzusetzen, da diese bei diesen Patient*innen nicht ausreichend wirksam zu sein scheinen.
- Es wird empfohlen, bei nach mindestens einer synthetischen DMARD- Behandlung unzureichend ansprechenden Patient*innen mit mittel-schwerer bis schwerer Psoriasis und einer aktiven Gelenkbeteiligung (PsA), biologische DMARD als Monotherapie oder in Kombination mit synthetischen DMARD anzuwenden.
- Es wird empfohlen, bei der Auswahl eines bDMARD für Patient*innen mit einer mittel-schweren bis schweren Psoriasis und einer aktiven Gelenkbeteiligung (PsA), Aspekte der Wirksamkeit in Bezug auf Haut und Gelenke, Komorbidität, Praktikabilität und Sicherheit zu berücksichtigen.
Verlauf, Komplikationen und Prognose
Komplikationen
- Erhöhtes Risiko für:
Verlauf und Prognose
- Die Psoriasisarthritis zeichnet sich durch einen sehr variablen Verlauf aus.
- Milder Verlauf mit Mono-/Oligoarthritis und Phasen spontaner Remission möglich1
- In der überwiegenden Zahl der Fälle chronisch-progredienter Verlauf mit Notwendigkeit zur frühen und konsequenten Therapie1
- Z. T. werden radiologische Veränderungen vor klinischen Manifestationen entdeckt.47
- Die Hälfte der Betroffenen mit mindestens einer erosiven Veränderung nach 2 Jahren19
- Bis zu 20 % der PsA-Patient*innen mit schwerem, gelenkdestruierendem Verlauf19
- Prädiktoren eines ungünstigen Verlaufs sind:1,19
- Patient*innen mit hohen CRP-Werten scheinen besonders von TNF-alpha-Inhibitoren zu profitieren.48
Verlaufskontrolle
- Regelmäßige hausärztliche Verlaufskontrollen mit Beurteilung von Krankheitsaktivität und Erreichen des Therapieziels
- Bei Bedarf ergänzende fachrheumatologische Kontrollen, insbesondere unter Therapie mit bDMARD und tsDMARD
Patienteninformationen
Patienteninformationen in Deximed
Weitere Informationen
- Deutsche Rheumaliga: Biologika/Biosimilars
Illustrationen


Psoriasisarthritis

Tüpfelnägel bei Psoriasis
Quellen
Leitlinien
- Deutsche Gesellschaft für Rheumatologie. Axiale Spondyloarthritis inklusive Morbus Bechterew und Frühformen. AWMF-Leitlinie Nr. 060-003. S3, Stand 2018. www.awmf.org
- Deutsche Dermatologische Gesellschaft. Therapie der Psoriasis vulgaris. AWMF-Nr. 013-001. S3, Stand 2021. www.awmf.org
- European League Against Rheumatism (EULAR). Recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. www.ard.bmj.com
Literatur
- Märker-Hermann E. Arthritis psoriatica. e.Medpedia. Zugriff 19.07.20. www.springermedizin.de
- Braun J, Schwarting A, Hammel L, et al. Versorgungssituation von Patienten mit ankylosierender Spondylitis und Psoriasisarthritis in Deutschland. Z Rheumatol 2019; 78: 372–381. doi:10.1007/s00393-019-0619-6 DOI
- Behrens F, Thaçi D, Wollenhaupt J, et al. Psoriasisarthritis - Übersicht medikamentöser Therapieoptionen und Anwendungsbesonderheiten. Hautarzt 2017; 68: 153–169. doi:10.1007/s00105-016-3925-9 DOI
- Wilson FC, Icen M, Crowson CS, et al. Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study. Arthritis Rheum 2009; 61: 233-9. pmid:19177544 PubMed
- Boehncke WH, Friedrich M, Kaltwasser JP, et al. Psoriatic arthritis – an interdisciplinary challenge. Dtsch Arztebl 2006; 103(21): 1455-61. www.aerzteblatt.de
- Fitzgerald O, Winchester R. Psoriatic arthritis: from pathogenesis to therapy. Arthritis Res Ther 2009; 11: 214. pmid:19232079 PubMed
- Märker-Hermann E. Neues zu Pathogenese, Klinik und Management der Psoriasisarthritis. Z Rheumatol 2013; 72: 756–757. doi:10.1007/s00393-013-1185-y DOI
- Hueber A, Manger B. Neues zur Pathogenese der Psoriasisarthritis. Z Rheumatol 2013; 72: 758-763. doi:10.1007/s00393-013-1186-x DOI
- Kathmann W. EULAR 2018 - Verständnis der Pathophysiologie hilft bei der individuellen Therapie der PsA. rheuma plus 2018; 17: 148. doi:10.1007/s12688- 018-0203-1. www.springermedizin.de
- Simon D, ·Kampylafka E, Hueber A. Neue molekulare Mechanismen in der Pathophysiologie der Psoriasisarthritis. Z Rheumatol 2018; 77: 776–782. doi:10.1007/s00393-018-0503-9 DOI
- Belasco J, Wei N. Psoriatic Arthritis: What is Happening at the Joint?. Rheumatol Ther 2019; 6: 305-315. doi:10.1007/s40744-019-0159-1 DOI
- Barnas J, Ritchlin C. Etiology and Pathogenesis of Psoriatic Arthritis. Rheumatic Disease Clinics of North America 2015; 41: 643-663. doi:10.1016/j.rdc.2015.07.006 www.researchgate.net
- Braun J. Axiale Spondyloarthritis und Psoriasisarthritis. Z Rheumatol 2020; 79: 1-4. doi:10.1007/s00393-020-00753-y DOI
- Gerdes S, Mrowietz U, Wagner U. Differenzialdiagnostisches Spektrum der Psoriasis versus Psoriasisarthritis an Haut und Gelenken. Z Rheumatol 2017; 76: 484–494. doi:10.1007/s00393-017-0340-2 DOI
- Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54: 2665-73. pmid:16871531 PubMed
- D'Angelo S, Mennillo GA, Cutro MS, et al. Sensitivity of the classification of psoriatic arthritis criteria in early psoriatic arthritis. J Rheumatol 2009; 36: 368-70. pmid:19208566 PubMed
- EBM-Flash. Psoriasis-Arthritis (Psoriasis arthropathica). Swiss Med Forum 2019; 19: 306. doi:10.4414/smf.2019.08265 DOI
- Radtke M, Reich K, Beikert F, et al. Psoriasisarthritis - eine interdisziplinäre Herausforderung. Hautarzt 2011; 62: 779–792. doi:10.1007/s00105-011-2243-5 DOI
- Philipp S. Wege zur sicheren Diagnose der Psoriasisarthritis - Klinische Erscheinungsformen und diagnostische Möglichkeiten. hautnah dermatologie 2012; 28: 292-298. doi:10.1007/s15012-012-0205-y DOI
- Härle P. Screening und Frühdiagnostik der Psoriasisarthritis . Z Rheumatol 2013; 72: 764–770. doi:10.1007/s00393-013-1187-9 DOI
- Härle P, Hartung W, Lehmann P, et al. GEPARD-Patientenfragebogen. Z Rheumatol 2010: 157–163. doi:10.1007/s00393-009-0462-2 DOI
- Schöffel D. Psoriasisarthritis: Manifestationsformen, Diagnose und Therapie. Orthopädie & Rheuma 2012; 15: 21-26. www.springermedizin.de
- Brockbank JE, Stein M, Schentag CT, Gladman DD. Dactylitis in psoriatic arthritis: a marker for disease severity?. Ann Rheum Dis 2005; 64: 188. pmid:15271771 PubMed
- Cassell SE, Bieber JD, Rich P, et al. The modified Nail Psoriasis Severity Index: validation of an instrument to assess psoriatic nail involvement in patients with psoriatic arthritis. J Rheumatol 2007; 34: 123. pmid:17216680 PubMed
- Moll J, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973; 3: 55-78. doi:10.1016/0049-0172(73)90035-8. pubmed.ncbi.nlm.nih.gov
- Baraliakos X, Kleyer A, Simon D, et al. Bildgebung bei der Psoriasisarthritis und Aspekte der röntgenologischen Progression. Z Rheumatol 2020; 79: 40-52. doi:10.1007/s00393-019-00735-9 DOI
- Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020; 79: 700-712. www.eular.org
- Köhm M, Behrens F. Internationale Empfehlungen -Therapie der Psoriasisarthritis. hautnah dermatologie 2020; 36: 44-49. doi:10.1007/s15012-020-4032-2 DOI
- Köhm M, Behrens F. Psoriasisarthritis Aktuelle therapeutische Standards. Z Rheumatol 2017; 76: 495–503. doi:10.1007/s00393-017-0334-0 DOI
- Deutsche Dermatologische Gesellschaft. Therapie der Psoriasis vulgaris. AWMF-Nr. 013-001. Stand 2021. www.awmf.org
- Köhm M, Behrens F. Therapie der Psoriasisarthritis - Gibt es eine Differenzialindikation?. Z Rheumatol 2020; 79: 23-32. doi:http10.1007/s00393-019-00709-x link.springer.com
- Wilsdon TD, Whittle SL, Thynne TRJ, Mangoni AA. Methotrexate for psoriatic arthritis. Cochrane Database of Systematic Reviews 2019, Issue 1. Art. No.: CD012722. DOI: 10.1002/14651858.CD012722.pub2. www.cochranelibrary.com
- Lindsay K, Fraser AD, Layton A, et al. Liver fibrosis in patients with psoriasis and psoriathic arthritis on long-term, high cumulative dose methotrexate therapy. Rheumatology 2009-e:pub. pubmed.ncbi.nlm.nih.gov
- Saad AA, Symmons DP, Noyce PR, Ashcroft DM. Risks and benefits of tumor necrosis factor-alpha inhibitors in the management of psoriatic arthritis: systematic review and metaanalysis of randomized controlled trials. J Rheumatol 2008; 35: 883. pubmed.ncbi.nlm.nih.gov
- Mease PJ, Gladman DD, Ritchlin CT, Ruderman EM, Steinfeld SD et al. Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: results of a double-blind, randomized, placebo-controlled trial. Arthrtis Rheum 2005 Oct;52(10):3279-89. PubMed
- Antoni C, Krueger GG, de Vlam K, Birbara C, Beutler A et al. Infliximab improves signs and symptoms of psoriatic arthritis: results of the IMPACT 2 trial. Ann Rheum Dis 2005 Aug;64(8):1150-7. PubMed
- Mease PJ, Fleischmann R, Deodhar AA, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase 3 double-blind randomised placebo-controlled study (RAPID-PsA). Ann Rheum Dis 2013 Oct 16. pubmed.ncbi.nlm.nih.gov
- van der Heijde D, Fleischmann R, Wollenhaupt J, et al. Effect of different imputation approaches on the evaluation of radiographic progression in patients with psoriatic arthritis: results of the RAPID-PsA 24-week phase III double-blind randomised placebo-controlled study of certolizumab pegol. Ann Rheum Dis 2014; 73: 233-7. pmid:23942869 PubMed
- Gemeinsamer Bundesausschuss (GBA): Beschluss zum Wirkstoff Ixekizumab (neues Anwendungsgebiet: Psoriasis-Arthritis). Arzneimittel-Richtlinie/Anlage XII: Ixekizumab (neues Anwendungsgebiet: Psoriasis-Arthritis) Stand 16.8.2018 www.g-ba.de
- Arzneimittelkommision der Deutschen Ärzteschaft (AkdÄ). Stellungnahme der AkdÄ zur Nutzenbewertung von Ixekizumab. 9.7.2018 www.akdae.de
- Deutsche Gesellschaft für Rheumatologie. Axiale Spondyloarthritis inklusive Morbus Bechterew und Frühformen. AWMF-Leitlinie Nr. 060-003, Stand 2018. www.awmf.org
- arznei-telegramm. ERHÖHTES KREBSRISIKO UNTER JAK-HEMMER TOFACITINIB (XELJANZ). a-t 2021; 52: 15-6. www.arznei-telegramm.de
- Ogdie A, Yu Y, Haynes K, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis 2015; 74: 326-32. pmid:25351522 PubMed
- Charlton R, Green A, Shaddick G, et al. Risk of uveitis and inflammatory bowel disease in people with psoriatic arthritis: a population-based cohort study. Ann Rheum Dis 2018 Feb; 77(2): 277-280. pmid:29092855 PubMed
- Li X, Andersen KM, Chang H-Y, et al. Comparative risk of serious infections among real-world users of biologics for psoriasis or psoriatic arthritis. Ann Rheum Dis 2019. pmid:31672774. www.ncbi.nlm.nih.gov
- Guldberg-Møller J, Cordtz RL, Kristensen LE, et al. Incidence and time trends of joint surgery in patients with psoriatic arthritis: a register-based time series and cohort study from Denmark. Ann Rheum Dis 2019;78: 1517-1523. pmid:31300461. www.ncbi.nlm.nih.gov
- Siannis F, Farewell VT, Cook RJ, Schentag CT, Gladman DD. Clinical and radiological damage in psoriatic arthritis. Ann Rheum Dis 2006; 65: 478. pmid:16126794 PubMed
- Glintborg B, Østergaard M, Dreyer L, et al. Treatment response, drug survival, and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factorαtherapy: results from the nationwide Danish DANBIO registry. Arthritis Rheum 2011; 63: 382. pmid:21279995 PubMed
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).