Allgemeine Informationen
Definition
- Seltene mesenchymale Tumoren, die von der Submukosa des Gastrointestinaltrakts ausgehen.
- Mutationen des KIT- oder PDGFRA-Gens führen zu einer Aktivierung von Rezeptor-Tyrosinkinasen und folglich zu erhöhter Zellproliferation.
- Je nach Tumoreigenschaften reicht das Spektrum von Tumoren ohne maligne Eigenschaften bis zu fortgeschrittenen fernmetastasierten Verläufen. Grundsätzlich wird bei allen GIST eine potenzielle Malignität vermutet.1
Häufigkeit
- Geschätzte Inzidenz in Deutschland: 1.500 Neuerkrankungen pro Jahr2
- Weltweit wird die Inzidenz auf 10–15 pro 1 Mio. Einw. geschätzt.3
- In der Regel treten GIST im Alter von 55–65 Jahren auf. Neuerkrankungen im Alter unter 40 Jahren sind selten.3
- Lokalisation: am häufigsten im Magen (60 %) und Dünndarm (30 %), seltener im Dick- und Mastdarm, sehr selten in der Speiseröhre4
Ätiologie und Pathogenese
- GIST stellen eine eigene Gruppe von Tumoren mit spezifischen histologischen, immunphänotypischen und molekulargenetischen Eigenschaften dar, die sie von leiomyomatösen Tumoren unterscheiden.
- Makroskopie
- typischerweise nodulärer Tumor in der Wand eines gastrointestinalen Hohlorgans
- Der Tumor kann sehr groß werden (bis zu 10 cm und mehr).
- Mikroskopie
- hinsichtlich der Zellmorphologie Klassifizierung in Spindelzelltyp (70 %), Epitheloidzelltyp (20 %) oder gemischtzelliger Typ (10 %); heterogene Morphologie, Abgrenzung zu leiomyomatösen Tumoren erschwert5
- Malignitätsgrad
Immunhistochemie und Genotypisierung
- Ist für die Diagnose von GIST von entscheidender Bedeutung.
- Die Zellen eines GIST weisen in der Regel einen Epidermiswachstumsfaktor-Rezeptor mit Tyrosinkinaseaktivität auf (auch als c-Kit bezeichnet), der durch immunhistochemische Färbung auf CD117 nachweisbar ist.8
- Alternativ können die Marker CD34 oder DOG1 positiv sein (Immunihistochemie).9
- In der Mehrzahl der Fälle liegt eine Mutation des KIT oder PDGFRA Gens zugrunde.
- Bei leiomyomatösen Tumoren ist die immunhistochemische Untersuchung auf c-Kit negativ und auf Aktin und/oder Desmin stark positiv; bei GIST werden Letztere dagegen negativ getestet.
- Des Weiteren spielt die Mutationsanalyse des KIT und PDGFRA Gens eine Rolle zur Beurteilung der Sensibilität des Tumors auf Imatinib sowie zur Prognoseabschätzung.9
ICPC-2
- D77 Bösartige Neubild. Verdauungstrakt
- D78 Neubildung Verdauungsorgan NNB
ICD-10
- C16 Bösartige Neubildung des Magens
- C17 Bösartige Neubildung des Dünndarmes
- C18 Bösartige Neubildung des Kolons
Diagnostik
Diagnostische Kriterien
- Der Verdacht ergibt sich bei einem endoskopischen oder bildgebenden Befund eines submukösen, runden, scharf begrenzten Tumors des Gastrointestinaltraktes.
- Die Diagnosestellung erfolgt mittels histologischer, immunhistochemischer und molekularbiologischer Untersuchung einer Gewebeprobe aus dem Tumor.
- Die Diagnose GIST wird gestellt, wenn das histologische Bild für einen GIST spricht und
- das KIT Protein (CD117), CD34 oder DOG1 positiv sind oder
- bei negativen Markern die Mutationsanalyse des KIT oder PDGFRA-Gens positiv ist.9
Differenzialdiagnosen
- Karzinoid
- Kolorektales Karzinom
- Magenkarzinom
- Liposarkom
- Malignes Melanom
- Lymphom
- Leiomyom
- Leiomyosarkom
Anamnese
- Je nach Lokalisation und Größe des Tumors unterschiedliche klinische Zeichen
- Laut einer Studie zur Erfassung von Patient*innen mit GIST wurden folgende Symptome festgestellt:
- Bauchschmerzen 36 %
- Blutung 28 %
- palpabler Tumor 11%
- akutes Abdomen 5 %
- asymptomatisch 19 %.4
- Je nach Lokalisation Hämatemesis (Magen, Dünndarm) oder Hämatochezie/Stuhlveränderungen (Dick- oder Mastdarm)
- Immer häufiger asymptomatische Patient*innen/Zufallsbefunde
- Selten: Obstruktion, Ileus, Perforation
Klinische Untersuchung
- Je nach Lokalisation und Größe des Tumors unterschiedlich
Ergänzende Untersuchungen in der Hausarztpraxis
- Keine bestimmten
Diagnostik bei Spezialist*innen
- Ziel der Untersuchung: Lokalisierung vorliegender GIST, Beurteilung der lokalen Ausbreitung/Invasion und Feststellung evtl. Fernmetastasen
- Methoden
- Gastroskopie: submuköser Knoten, bei fortgeschrittenen Tumoren ggf. mit Ulzeration
- Endosonografie: bestes Mittel zur differenzialdiagnostischen Abgrenzung und im Falle sehr kleiner Tumoren Beobachtung5
- Bildgebung: CT mit Kontrastmittel oder MRT
- radiologische Charakteristik
-
- Kleine GIST zeigen sich als kleine, scharf begrenzte, intramurale Verdichtungen, manchmal mit darüber liegender Ulzeration.
- Größere, maligne GIST zeigen sich als komplexe Verdichtungen mit nekrotischen Zonen, da der Tumor schneller als seine Blutversorgung wächst.
Diagnostisches Vorgehen
- Bei knotigen submukösen Tumoren kleiner 2 cm: Endosonografie
- Bei v. a. GIST histologische Sicherung anbieten oder wegen geringem Progressionsrisiko Beobachtung.
- dazu Kontrollen zunächst nach 3 Monaten, dann alle 6 Monate, bei Wachstum: Feinnadelpunktion/Exzision
- Bei Tumoren größer 2 cm: Feinnadelpunktion und/oder Exzision10
Indikationen zur Krankenhauseinweisung
- Bei Verdacht auf den beschriebenen Tumor
- Seltene Erkrankung: Einweisung in eine Klinik mit entsprechender Expertise und interdisziplinärer Tumorbehandlung
Therapie
Therapieziele
- Je nach Tumorstadium Genesung, Verlangsamung des Krankheitsverlaufs oder Palliation
Allgemeines zur Therapie
- Resektable Tumoren können einer operativen Therapie zugeführt werden.
- Verzögerung der Progression durch medikamentöse Behandlung mit Tyrosinkinaseinhibitoren
- Malignitätsgrad
- Häufig schwer zu bestimmen.
- Für die Prognose sind vor allem die Größe und mitotische Aktivität sowie die Lokalisation des Tumors entscheidend.6
- Da kein bestimmtes Wachstumsmuster prognostizierbar und das maligne Potenzial erheblich ist, lautet die internationale Empfehlung auf Resektion aller GIST.
Operative Therapie
- Kurativer Therapieansatz
- Ziel ist komplette Resektion des Tumors im Gesunden (R0).
- Eine Resektion des zugehörigen Lymphabflussgebietes ist wegen der geringen Gefahr der lymphatischen Metastasierung nicht erforderlich.
- Eine intraoperative Tumorruptur ist unbedingt zu vermeiden, da sie mit praktisch 100-prozentiger Rezidivrate einhergeht und so die Prognose erheblich verschlechtert.
- Bei Tumoren kleiner als 5 cm kann eine laparoskopische Resektion erfolgen, bei Tumoren größer als 5 cm offen-chirurgisch, da erhöhte Rupturgefahr.9-11
Medikamentöse Therapie
Tyrosinkinaseinhibitoren
- Standardpräparat: Imatinib
- Blockiert die Tyrosinkinase KIT (c-Kit).
- Indiziert bei:
- neoadjuvanter Therapie zum Erreichen einer Resektabilität für 6–12 Monate
- adjuvanter Therapie bei resezierten Tumoren mit hohem Rezidivrisiko
- Rezidiv eines GIST
- palliativer Therapie.
- Die empfohlene Initialdosis beträgt je nach Mutationsstatus 400–800 mg pro Tag.
- Voraussetzung: Imatinib-sensible Mutation
- Ein Teil der Patient*innen entwickelt im Laufe der Therapie eine Resistenz gegen Imatinib.
- Bei Resistenz gegen Imatinib: Sunitinib oder Regorafenib
- In fortgeschrittener Situation: lebenslange Einnahme
- Wichtig für die Betroffenen!
- Notwendigkeit guter Compliance: bei Unterbrechung und niedrigen Plasmaspiegeln deutliche Verschlechterung der Prognose
- Interaktion mit vielen Medikamenten und Nahrungsmitteln10
- häufigste NW: Myelosuppression, Erhöhung der Leberenzyme, periphere Ödeme
Verlauf, Komplikationen und Prognose
Prognose
- Abhängig von Tumorgröße, Mitoseindex, Lokalisation, Molekulargenetik und stattgehabter Ruptur
- 5 Jahre nach chirurgischer Therapie waren 59,9 % der Patient*innen ohne nachweisbaren Tumor
- Nach 10 Jahren immer noch wenige Rezidive; insofern sollte die Nachsorge länger als 10 Jahre fortgeführt werden.12-13
Patienteninformationen
Illustrationen
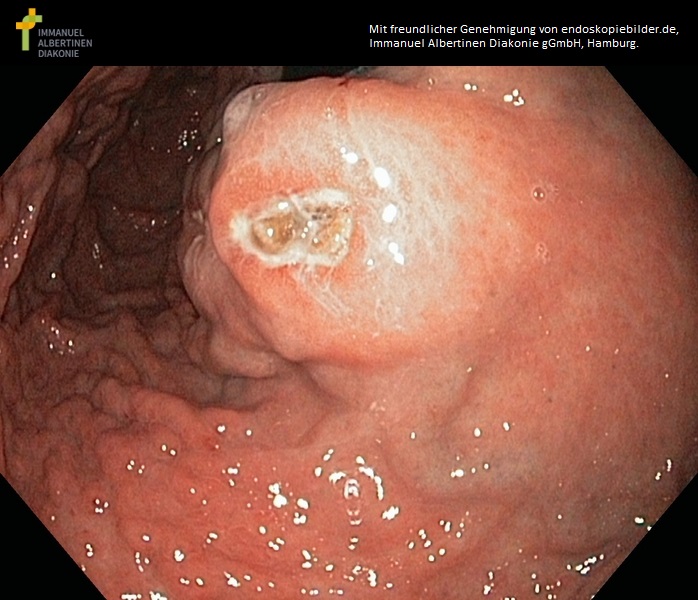
GIST im Corpus ventriculi (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
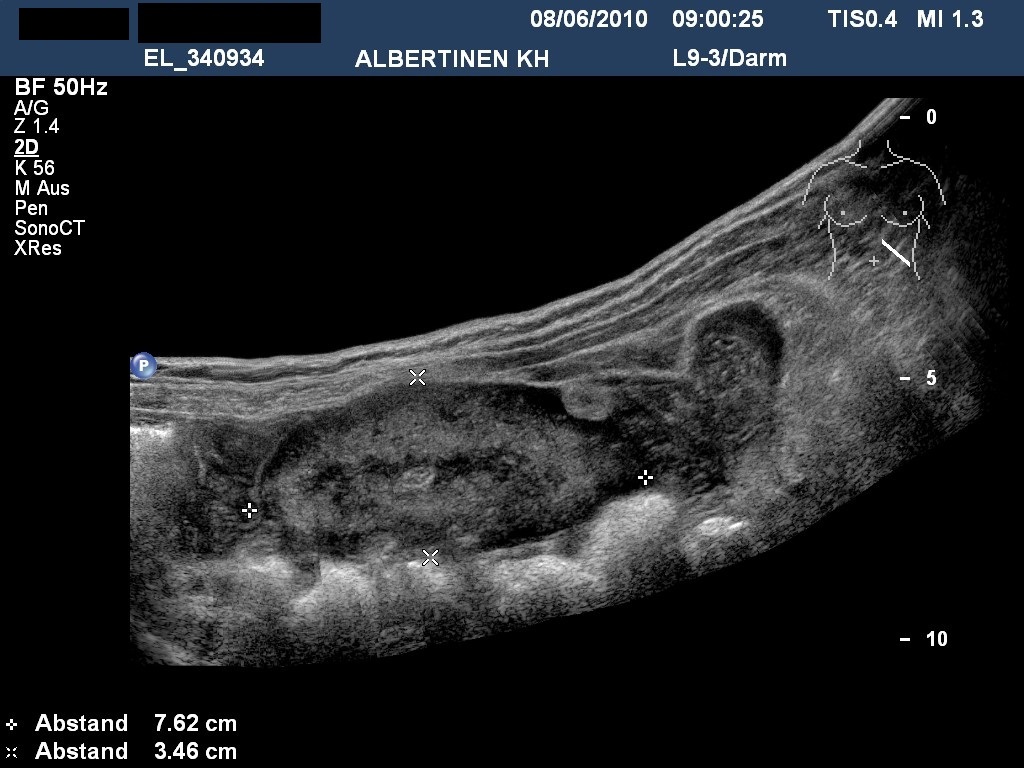
Sonongrafie: GIST im Dünndarm (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e.V., Hamburg)
Quellen
Literatur
- Huang HY, Li CF, Huang WW, et al. A modification of NIH consensus criteria to better distinguish the highly lethal subset of primary localized gastrointestinal stromal tumors: a subdivision of the original high-risk group on the basis of outcome. Surgery 2007; 141: 748. pubmed.ncbi.nlm.nih.gov
- Deutsche Krebsgesellschaft. GIST (Gastrointestinale Stromatumoren). Berlin. Zugriff 10.8.2021. www.krebsgesellschaft.de
- Søreide K, Sandvik OM, Søreide JA, Giljaca V, Jureckova A, Bulusu VR . Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies.. Cancer Epidemiol 2016; 40: 39-46. pmid:26618334 www.sciencedirect.com
- Caterino S, LLorenzon L, Petrucciani N ,Iannicelli E, Pilozzi E, Romiti A, Cavallini M, Ziparo V. Gastrointestinal stromal tumors: correlation between symptoms at presentation, tumor location and prognostic factors in 47 consecutive patients. World J Surg Oncol. 2011; 9: 13. pmid: 21284869 PubMed
- Akahoshi K, Oya M, Koga T, Shiratsuchi Y. Current clinical management of gastrointestinal stromal tumor. World J Gastroenterol. 2018; 24(26): 2806-2817. pmid:30018476 PubMed
- Miettinen M, Lasota J. Gastrointestinal stromal tumors: pathology and prognosis at different sites. Semin Diagn Pathol . 2006; 23(2): 70-83. pmid:17193820 PubMed
- Wittekind C. TNM Klassifikation maligner Tumoren. Weinheim: Wiley-VCH, 2020. www.wiley-vch.de
- Becker H, Ghadimi BM. Allgemein- und Viszeralchirurgie II, spezielle operative Techniken. München: Elsevier GmbH, 2015.
- Nishida T, Blay JY, Hirota S, Kitagawa Y, Kang YK. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer. 2016;19:3-14. PubMed
- Casali PG, Abecassis N, et al. Gastrointestinal Stromal Tumours: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): 68-78. www.esmo.org
- von Mehren M et al. NCCN Guidelines Insights: Soft Tissue Sarcoma, Version 1.2021. J Natl Compr Canc Netw . 2020; 12(18): 1604-1612. pmid:33285515 PubMed
- Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol 2008; 39(10): 1411-9. pmid:18774375 PubMed
- Joensuu H, Martin-Broto J, Nishida T, Reichardt P, Schöffski P, Maki RG.. Follow-up strategies for patients with gastrointestinal stromal tumour treated with or without adjuvant imatinib after surgery. . Eur J Cancer. 2015; 51: 1611–1617. pmid:26022432 PubMed
Autor*innen
- Franziska Jorda, Dr. med., Viszeralchirurgin, Ärztin in Weiterbildung Allgemeinmedizin, Kaufbeuren
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).