Zusammenfassung
- Definition:Ein maligner Tumor des Magens. In 95 % der Fälle handelt es sich dabei um ein Adenokarzinom.
- Häufigkeit:2016 erkrankten 5.840 Frauen und 9.300 Männer in Deutschland.
- Symptome:Häufig erst im fortgeschrittenen Stadium symptomatisch mit Dysphagie, Erbrechen, Inappetenz oder Gewichtsverlust.
- Befunde:Zeichen einer Anämie, Kachexie, ggf. epigastrischer Druckschmerz.
- Diagnostik:Biopsie und histopathologische Sicherung durch Magenspiegelung.
- Therapie:Stadienadaptierte Behandlung, operative Resektion einzig kurative Option.
Allgemeine Informationen
Definition
- Maligner Tumor des Magens
- Entstehung im proximalen (subkardial), mittleren Drittel (Fundus und Corpus) sowie distalen Teil (Antrum) des Magens möglich1
- im subkardialen Anteil fließender Übergang zu den Tumoren des gastroösophagealen Übergangs (AEG-Tumor Siewert III)
- Karzinome des Magens und ösophagogastralen Übergangs gehören weltweit zu den häufigsten tumorbedingten Todesursachen.2
- Tumor lange asymptomatisch
- Diagnose oft erst im fortgeschrittenen und inoperablen Zustand
- Die Tumoren werden je nach Grad der Infiltration und Ausbreitung in Stadien unterteilt.
- Ein endoskopisches Screening der Gesamtbevölkerung zum Nachweis von Magenkarzinomen wird in Deutschland von der Leitlinie nicht empfohlen.2
- insgesamt zu geringe Inzidenz
TNM-Klassifikation3
- Siehe Tabelle Magenkarzinom, TNM-Klassifikation.
Stadiengruppierung3-4
- Siehe Tabelle Magenkarzinom, Stadiengruppierung nach FIGO.
Häufigkeit
- Inzidenz in Deutschland
- 2016 erkrankten 5.840 Frauen (mittl. Erkrankungsalter 76 Jahre) und 9.300 Männer (mittl. Erkrankungsalter 72 Jahre) an Magenkrebs.5
- Mortalität2
- Das Magenkarzinom liegt in Deutschland bei Frauen auf Rang 6 und bei Männern auf Rang 5 der häufigsten Todesursachen durch Krebs.
- Weltweiter Trend5
- seit Jahrzehnten stetiger Rückgang der Inzidenz und Mortalität in den Industrienationen
- Histopathologischer Typ
- Bei 95 % der Tumoren handelt es sich um Adenokarzinome, der Rest wird durch neuroendokrine Tumoren sowie gastrointestinale Stromatumoren verursacht.5
Ätiologie und Pathogenese
- Die Abfolge bis zur Entwicklung eines Adenokarzinoms ist vermutlich: Atrophie – Metaplasie – Dysplasie – Neoplasie.6-7
- Ursache für die Entwicklung eines Magenkarzinoms können Infektion, Lebensstil und/oder genetische Faktoren sein.8
- Bedeutendster Risikofaktor ist eine Infektion mit Helicobacter pylori.
- Dabei besteht ein 3-fach erhöhtes Magenkarzinomrisiko.9-10
- Das Risiko eines Kardiakarzinoms ist dagegen erniedrigt (OR = 0,3).11
- Bei 87,8 % der Patient*innen mit Magenfrühkarzinom liegt eine Infektion mit dem Helicobacter pylori vor.12
- Der Nachweis des Antigens CagA/VacA bei Helicobacter-pylori-Stämmen ist häufig assoziiert mit einer chronischen Gastritis, Dysplasien und einem Magenkarzinom, jedoch nicht mit präkanzerosen Läsionen.13-15
- Lebensstil
- Rauchen, Alkoholkonsum, hoher BMI oder eine durch Übergewicht assoziierte Refluxerkrankung sind für über 70 % der Magenkarzinomfälle verantwortlich.16-17
- Ernährung
- Protonenpumpenhemmer
- Keine klinischen Hinweise, dass Protonenpumpenhemmer das Risiko für ein Magenkarzinom erhöhen.2
- Gastroösophageale Refluxerkrankung
- Assoziation mit Adenokarzinom des gastroösophagealen Übergangs wahrscheinlich2
- Genetische Faktoren
- Verwandte 1. Grades von Erkrankten haben ein 2- bis 3-fach höheres Risiko als die Allgemeinbevölkerung.2
- hereditäres diffuses Magenkarzinom (Mutation CDH1-Gen): bei ca. 1 % aller Magenkarzinome2,18
- Genträger*innen sollte eine prophylaktische Gastrektomie ab dem 20. Lebensjahr angeboten werden.2
- HNPCC (Lynch-Syndrom): um 2–9 % erhöhtes Risiko für ein Magenkarzinom2,19
- Ab dem 35. Lebensjahr sollte zusätzlich zur Koloskopie regelmäßig eine ÖGD durchgeführt werden.2
- Peutz-Jeghers-Syndrom (PJS): um 29 % erhöhtes Risiko für ein Magenkarzinom20-22
- Blutgruppe A1
Histologische Arten: Unterteilung nach Lokalisation
- Karzinome, die sich im Radius von 5 cm ober- und unterhalb der Kardia befinden, bezeichnet man als Karzinome des gastroösophagealen Übergangs (Adenocarcinoma of the Esophagogastric Junction, AEG). Diese werden in 3 Typen unterteilt:2
- AEG I: distales Ösophaguskarzinom
- AEG II: Kardiakarzinom
- AEG III: subkardiales Karzinom/Funduskarzinom.
Histologische Arten: Unterteilung nach Histologie
- Adenokarzinome machen 95 % aller Magenkarzinome aus.5
- WHO-Klassifikation
- papilllärer, tubulärer oder muzinöser Typ oder Siegelringelzellkarzinom23-24
- Laurén-Klassifikation
- Fortgeschrittene Magenkarzinome werden makroskopisch nach Borrmann nach den verschiedenen Formen der Invasion unterteilt:21-22
- Typ I: polypös-exophytisch
- Typ II: ulzeriert mit Randwall
- Typ III: flächenhaft ulzeriert
- Typ IV: diffus infiltrierend.
- Seltenere Magenkarzinome (insgesamt etwa 5 %)5 sind kleinzellige Karzinome, gastrointestinale Stromatumoren, neuroendokrine Tumoren, Leiomyosarkome und Lymphome.24,25
- Die HER2-Testung (Human Epidermal Grothfactor 2) wird bei Patient*innen mit fortgeschrittenem Magenkarzinom und bei Erwägung einer gezielten Behandlung empfohlen.26
Prädisponierende Faktoren
- Helicobacter pylori
- Hohes Alter, männliches Geschlecht, Rauchen, Alkoholkonsum
- Familiäre Belastung
- Vorangegangene Magenoperationen (Billroth-II-resezierte Patienten)
- Hoher Verzehr salziger Lebensmittel27-28
- Hoher Verzehr von Lebensmittel mit einem hohen Anteil an tierischen Bestandteilen2
- Niedriger sozioökonomischer Status
- Perniziöse Anämie
- Übergewicht
ICPC-2
- D74 Bösartige Neubildung Magen
ICD-10
- C16 Bösartige Neubildung des Magens
- C16.0 Kardia
- C16.1 Fundus ventriculi
- C16.2 Corpus ventriculi
- C16.3 Antrum pyloricum
- C16.4 Pylorus
- C16.5 Kleine Kurvatur des Magens, nicht näher bezeichnet
- C16.6 Große Kurvatur des Magens, nicht näher bezeichnet
- C16.8 Magen, mehrere Teilbereiche überlappend
- C16.9 Magen, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
Leitlinie: Primärdiagnostik2
- Patient*innen mit einem oder mehreren der folgenden Alarmsymptome sollen zu einer frühzeitigen ÖGD mit Entnahme von Biopsien überwiesen werden:
- Dysphagie
- rezidivierendes Erbrechen
- Inappetenz
- unklarer Gewichtsverlust
- gastrointestinale Blutung
- unklare Eisenmangelanämie.
Differenzialdiagnosen
- Ulkuskrankheit
- Dyspepsie
- Achalasie
- Gastritis
- Morbus Ménétrier
- Hyperplasie der Magenschleimhaut
- MALT-Lymphom
- Sonstige Malignome
Anamnese
- Die Symptome sind vage und variieren je nach Lokalisation des Tumors. Bis zu 80 % der Patient*innen befinden sich zu Beginn der Erkrankung in einer langen asymptomatischen Phase.2
- Im späteren Verlauf treten die oben unter diagnostische Kriterien genannten Symptome auf.
- Ulzeröse Läsionen können zu einer akuten gastrointestinalen Blutung und daraus resultierender Hämatemesis oder Meläna führen.
- Eine Obstruktion des Pylorus führt zu Erbrechen nach den Mahlzeiten.
- Eine Obstruktion im unteren Teil der Speiseröhre kann zu einer zunehmenden Dysphagie führen.
Klinische Untersuchung
- Körperliche Untersuchung
- Zeichen für Anämie oder Kachexie?
- Epigastrischer Druckschmerz?
- Tastbar vergrößerte Lymphknoten?
- Virchow-Lymphknoten in der linken Supraklavikulargrube
- letzter Lymphknoten im Verlauf des Ductus thoracicus, häufig vergrößert bei intraabdominellen Tumoren
- In der Regel kein spezifischer klinischer Befund
Ergänzende Untersuchungen in der Hausarztpraxis
- Keine weiteren Untersuchungen erforderlich
Diagnostik bei Spezialist*innen
Endoskopie 2
- Es werden Biopsien aus allen verdächtigen Läsionen empfohlen.
Staging2
- Eine Fernmetastasierung soll mittels Sonografie, CT-Thorax und CT-Abdomen inklusive Becken ausgeschlossen werden.
- Sonografie
- Abdomensonografie
- 1. bildgebendes Verfahren zur Detektion von Lebermetastasen
- Sonografie des Halses
- bei Karzinomen des ösophagogastralen Übergangs zur Detektion von Lymphknotenmetastasen
- Beim Magenkarzinom kann sie bei klinischem Verdacht auf Lymphknotenmetastasen erfolgen.
- Abdomensonografie
- Orale Endosonografie
- Messung der Eindringtiefe des Tumors und zur Untersuchung von lokalen Lymphknoten
- Knochenszintigrafie
- nur bei entsprechender klinischer Symptomatik
- PET-CT
- nicht empfohlen
- Laparoskopie
- zum Ausschluss von Leber- und Peritonealmetastasen in fortgeschrittenen Stadien (cT3, cT4)
- Durch das laparoskopische Staging sind 92 % der fortgeschrittenen Magenkarzinome nachweisbar.29
Screening
- Ein bevölkerungsbezogenes endoskopisches Screening zur Früherkennung eines Magenkarzinoms empfiehlt die deutsche S3-Leitlinie nicht.2
- Ein serologisches Screening der asymptomatischen Bevölkerung auf H. pylori, EBV sowie pathologische Serumpepsinogene soll nicht durchgeführt werden.2
Indikationen zur Überweisung
- Überweisung zur ÖGD bei unter Diagnostische Kriterien genannten Symptomen
Therapie
Therapieziele
- Im Frühstadium kurative Therapie
- Wenn das nicht möglich ist, dann Palliation mit:
- Verlängerung der Lebenszeit
- Verbesserung der Lebensqualität
- Linderung der Symptome
- größtmöglicher Reduzierung von Nebenwirkungen.
Allgemeines zur Therapie
- Multidisziplinäre Therapieplanung durch qualifiziertes Tumorboard1
- Aussprechen einer stadienadaptierten Therapieempfehlung
- Wenn immer möglich, Behandlung im Rahmen klinischer Studien1
- Alle zur Therapie folgenden Empfehlungen beziehen sich auf die aktuelle S3-Leitlinie2 und werden nicht jedes Mal referenziert.
Operative Therapie
- Standardtherapie für alle potenziell resektablen Magenkarzinome
- Ziel der kurativen Chirurgie des Magenkarzinoms ist die vollständige Entfernung des Tumors und der regionären Lymphknoten mit histologisch bestätigt tumorfreien proximalen, distalen und zirkumferentiellen Resektionsrändern (R0).
Frühkarzinom
- Endoskopische En-bloc-Resektion möglich bei:
- intraepithelialen Neoplasien (sog. Dysplasien) jeglicher Größe sowie Magenfrühkarzinomen, die alle 4 folgenden Kriterien erfüllen:
- < 2 cm Durchmesser
- nicht ulzeriert
- Mukosakarzinom
- intestinaler Typ bzw. histologischer Differenzierungsgrad gut oder mäßig (G1/G2).
- intraepithelialen Neoplasien (sog. Dysplasien) jeglicher Größe sowie Magenfrühkarzinomen, die alle 4 folgenden Kriterien erfüllen:
- Patienten, die mit endoskopischer Resektion behandelt wurden, sollen eine endoskopische Überwachung in der onkologischen Nachsorge erhalten.
Lokal fortgeschrittene Erkrankung
- Bei der Mehrheit der Patient*innen, die in Deutschland erstdiagnostiziert werden, ist die Erkrankung lokal fortgeschritten.
- Bei einer lokal fortgeschrittenen, aber potenziell kurativ resektablen Erkrankung (Stadium IB–III) besteht die Standardbehandlung in der zusätzlichen prä- und postoperativen Chemotherapie.
Resektion oder Gastrektomie
- Das Resektionsausmaß wird bestimmt durch Tumorlokalisation, TNM-Kategorien und histologischen Typ (intestinaler versus diffuser Typ nach Laurén-Klassifikation).
- proximaler Sicherheitsabstand am Magen von 5 cm (intestinaler Typ n. Laurén) bzw. 8 cm (diffuser Typ n. Laurén)
- Laparoskopische oder offene Resektion onkologisch gleichwertig
Palliative Operation
- In Ausnahmefällen besteht eine Indikation zu einer palliativen Operation.
Lymphadenektomie
- Bei einem kurativen Eingriff erfolgt eine modifizierte D2-Lymphknotendissektion (Kompartiment I und II).
- Für einen pN0-Status müssen mindestens 16 regionäre Lymphknoten histologisch untersucht werden und frei von Tumorzellen sein.
Unvollständige Resektion
- Zunächst die Möglichkeit einer kurativen Nachresektion prüfen.
- Falls Nachresektion nicht möglich, kann eine postoperative Radiochemotherapie nach Konsens in der interdisziplinären Tumorkonferenz durchgeführt werden.
Rekonstruktion
- Einen allgemein anerkannten Standard zur Rekonstruktion nach Gastrektomie oder subtotaler distaler Magenresektion gibt es derzeit nicht.
- Weltweit wird die ausgeschaltete Roux-Schlinge bevorzugt verwendet.
Rezidiv
- Beim isolierten Lokalrezidiv kann eine erneute Operation durchgeführt werden.
Metastasen
- Im Einzelfall können erst intraoperativ entdeckte limitierte Metastasen, wenn R0 resektabel, reseziert werden.
Chemotherapie
Perioperative Chemotherapie
- In den Stadien IB–III indiziert
- Aktuell bietet das FLOT-Schema (5-Fluorouracil/Folinsäure/ Oxaliplatin/Docetaxel) die längste progressionsfreie Überlebenszeit und Gesamtüberlebenszeit.
Neoadjuvante Chemotherapie
- Ziel ist es, den Tumor präoperativ zu verkleinern und eine bessere Resektabilität zu erreichen.
- Ein Restaging zur Bewertung der Response soll mittels CT und ÖGD nach Abschluss der präoperativen Therapie durchgeführt werden.
- Im Falle eines lokalen Tumorprogresses unter neoadjuvanter Therapie sollte diese abgebrochen und eine frühzeitige Operation durchgeführt werden.
Adjuvante Chemotherapie
- Nach präoperativer Chemotherapie und anschließender Operation soll über die postoperative Chemotherapie interdisziplinär entschieden werden.
- In diese Entscheidung sollen Regressionsgrad, klinisches Ansprechen, Verträglichkeit der Chemotherapie und Allgemeinzustand einfließen.
Palliative Chemotherapie
- Patient*innen in gutem Allgemeinzustand (ECOG 0–1, Eastern Co-operative Oncology Group: 1 – keine Aktivitätseinschränkung oder 2 – Einschränkung bei körperlicher Anstrengung) soll eine systemische Chemotherapie angeboten werden.
- Therapieziel ist die Verbesserung des Überlebens und der Erhalt der Lebensqualität.
- Ein erhöhtes Alter stellt keine Kontraindikation dar.
- Indiziert bei lokal fortgeschrittener inoperabler oder metastasierter Erkrankung.
- Die Therapie sollte so früh wie möglich nach Diagnosestellung eingeleitet werden.
- Unter laufender palliativer Chemotherapie sollte alle 6–12 Wochen eine klinische Re-Evaluation und geeignete Bildgebung erfolgen, um negative Entwicklungen der Erkrankung rechtzeitig zu erkennen und Patient*innen nicht unnötig lange unwirksamen Therapien auszusetzen bzw. die Chance auf wirksamere Therapien zu ermöglichen.
- Vor dem Einsatz einer palliativen medikamentösen Tumortherapie soll der HER-2-Status (Human Epidermal Grothfactor 2) als positiver prädiktiver Faktor für eine Therapie mit Trastuzumab bestimmt werden.
- Standard-Chemotherapie im palliativen Setting ist eine Doublet-Chemotherapie auf der Basis von Platin und einem Fluoropyrimidin.
- abhängig vom Her2/neu-Status ggf. plus Trastuzumab
Zweitlinien-Chemotherapie
- Bei gutem Allgemeinzustand der Patient*innen ist eine Zweitlinien-Chemotherapie indiziert. Das Behandlungsschema orientiert sich an der jeweiligen Vortherapie.
Definitive Radiochemotherapie
- Bei funktioneller Inoperabilität der Patient*innen oder Irresektabilität eines lokal begrenzten Adenokarzinom des Magens oder ösophagogastralen Übergangs kann eine definitive Radiochemotherapie durchgeführt werden.
Leitlinie: Komplementäre Therapie2
- Eine Misteltherapie kann bei Patient*innen mit Karzinomen des Magens bzw. ösophagogastralen Übergangs mit dem Ziel der Verbesserung der Lebensqualität, nicht aber der Lebensverlängerung angewendet werden.
- Chinesische Kräutermischungen sollten bei Magenkarzinomen nicht angewendet werden.
- Probiotika können bei Diarrhö eingesetzt werden. Aufgrund von vereinzelten Sepsisfällen unter Chemotherapie/Immunsuppression sollte die Indikation jedoch streng geregelt werden.
- Akupunktur kann zur Linderung krebsbedingter Schmerzen in einem multimodalen Programm angewendet werden.
- Achtsamkeitsbasierte Verfahren/Mind-Body-Medizin können komplementär zur Verbesserung der Lebensqualität und der Linderung von Ängsten und Stress eingesetzt werden.
Leitlinie: Empfehlungen für Patient*innen2
- Der Ernährungsstatus soll bei allen Tumorpatient*innen, beginnend mit der Diagnosestellung, bei jeder stationären Aufnahme und ambulantem Patientenkontakt beurteilt werden, um Interventionen frühzeitig einleiten zu können.
- Eine Bewegungstherapie sollte allen Patient*innen angeboten werden.
- Betroffene sollten im gesamten Krankheits- und Behandlungsverlauf Zugang zu Informationen orientiert am jeweiligen Bedürfnis haben.
- Die psychoonkologische Versorgung durch angemessene professionelle Unterstützung soll im gesamten Krankheitsverlauf integraler Bestandteil der onkologischen Diagnostik, Therapie und Nachsorge sein.
Weitere palliative Behandlungsmethoden
- Symptomatische Tumorstenose
- Therapiemöglichkeiten: Stenteinlage, Anlage einer Gastroenterostomie, jejunale Ernährungsfistel oder palliative Bestrahlung
- In Ausnahmefälle kann eine palliative Magenteilresektion erforderlich sein.
- Tumorblutung
- Je nach Blutungslokalisation und -stärke kann eine angiografische Embolisation oder palliative Resektion erwogen werden.
- Im Falle einer chronischen Sickerblutung kann eine palliative Radiotherapie erfolgen.
Artikel zur palliativen Symptombekämpfung
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Maligne Obstruktion
- Mundtrockenheit
- Kachexie und Dehydrierung
- Atembeschwerden
- Depression
- Angst
- Delirium
Nachsorge
- Diese Referenz bezieht sich auf den gesamten Abschnitt.2
- Die strukturierte Nachsorge umfasst die klinische Kontrolle, endoskopische Kontrolle und Kontrolle mittels Bildgebung.
- Die Intervalle sollten in den ersten 2 Jahren zumindest halbjährlich und danach bis zum 5. Jahr jährlich betragen.
- Nach einer Gastrektomie soll eine regelmäßige parenterale Vitamin-B12-Substitution lebenslang durchgeführt werden.
- Eine Substitution mit Pankreasenzymen soll bei Patient*innen mit Fettstühlen erfolgen.
Prävention
Leitlinie: Indikationen für H.-pylori-Eradikation zur Magenkarzinomprävention2
- Die H.-pylori-Eradikation mit dem Ziel der Magenkarzinom-Prävention sollte bei den folgenden Risikopersonen durchgeführt werden:
- Risikogastritis (Pangastritis oder korpusdominante Gastritis)
- erstgradig Verwandte von Magenkarzinom-Patienten
- frühere Magenneoplasien (Magenadenom, MALT-Lymphom).
- Eine fakultative Indikation ist eine ausgedehnte Atrophie oder intestinale Metaplasie.
- ASS oder NSAR sollen nicht mit der Indikation der Prophylaxe eines Magenkarzinoms angewendet werden.2
- Lebensstil
- Reduktion der im Abschnitt Ätiologie genannten Risikofaktoren, u. a.:
- Rauchstopp
- regelmäßige körperliche Aktivität
- Gewichtsabnahme bei Übergewicht
- Verzicht auf Produkte mit tierischen Inhaltsstoffen oder hohem Salzgehalt.
- Reduktion der im Abschnitt Ätiologie genannten Risikofaktoren, u. a.:
Verlauf, Komplikationen und Prognose
Komplikationen
- Unterernährung
- Obstruktion
- Stenose am gastroösophagealen Übergang
- Magenausgangsstenose
- Blutungen
- Perforation
- Dünndarmobstruktion
- Reflux
- Früh- oder Spätdumpingsyndrome nach Magen-OP
- Aszites
Prognose
- Die Prognose bei Vorliegen eines Magenkarzinoms ist abhängig von der Tumorlokalisation, der lokalen Tiefeninfiltration, der Gefäßinvasion, der Tumorzelldissoziation an der Invasionsfront, dem Lymphknotenbefall und dem Vorhandensein von Fernmetastasen. Insgesamt ist sie ungünstig.2
- Patienten im Stadium II–III haben trotz kurativer Resektion ein schlechtes 5-Jahres-Überleben und ein hohes Risiko für ein Rezidiv oder Metastasen.2
- Die Zahl der Todesfälle in Deutschland lag 2016 bei 5.370 Männern und 3.861 Frauen.5
- Für Frauen werden aktuell relative 5-Jahres-Überlebensraten um 34 %, für Männer um 32 % ermittelt.5
- Die Prognose ist beim histologisch diffusen Typ ungünstiger als beim intestinalen Typ. Muzinöse Adenokarzinome und Siegelringelzellkarzinome haben eine besonders schlechte Prognose.30-32
- Ein Lymphknotenbefall sowie Metastasen, insbesondere Leber- und Knochenmetastasen oder eine Peritonealkarzinose, verschlechtern die Prognose.33-35
Patienteninformationen
Patienteninformationen in Deximed
Lindernde Behandlung bei fortgeschrittener Krebserkrankung
- Palliativmedizin
- Angsttherapie bei Krebs
- Schmerzbehandlung
- Übelkeit und Erbrechen
- Verstopfung
- Mundtrockenheit
- Atembeschwerden
- Gewichtsverlust und Kachexie
- Depression
- Delirium
Illustrationen
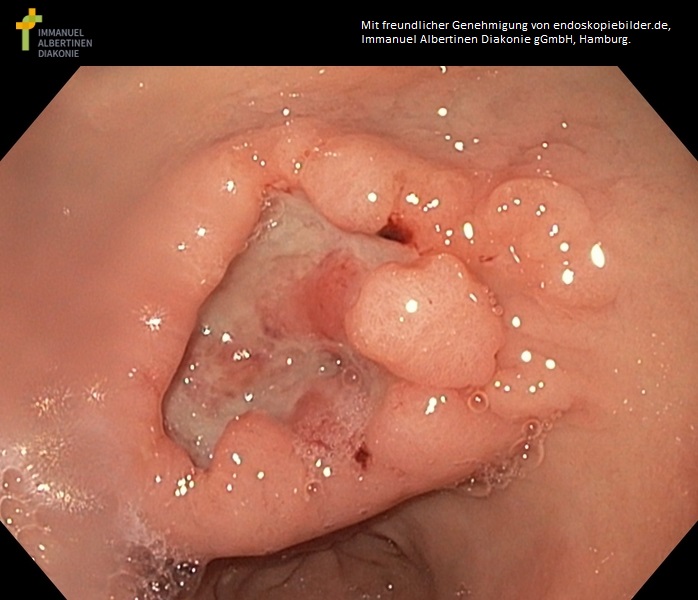
Ulzeröses Antrum-Karzinom (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Magen, Übersicht

Sonografie: Echoarme irreguläre Magenwandverdickung durch Karzinom im Antrum (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e. V. (DGVS). Magenkarzinom – Diagnostik und Therapie der Adenokarzinome des Magens und ösophagogastralen Übergangs. AWMF-Nr. 032-009-OL. S3, Stand 2019. www.awmf.org
Literatur
- Onkopedia. Magenkarzinom. Stand Dezember 2018. www.onkopedia.com
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten e.V. (DGVS). Magenkarzinom - Diagnostik und Therapie der Adenokarzinome des Magens und ösophagogastralen Übergangs. AWMF-Nr. 032-009-OL. S3, Stand 2019. www.awmf.org
- Wittekind C. TNM: Klassifikation maligner Tumoren. 7. Auflage. : Wiley-VCH Verlag GmbH & Co. KGaA, 2010.
- American Joint Committee on Cancer (AJCC). Cancer Staging Manual. 7 ed.. : Springer, 2010.
- RKI. Zentrum für Krebsregisterdaten. Krebs in Deutschland für 2015/2016. www.krebsdaten.de
- Kuipers EJ. Review article: Exploring the link between Helicobacter pylori and gastric cancer. Aliment Pharmacol Ther 1999; 13 (suppl 1): 3-11. www.ncbi.nlm.nih.gov
- Schaffalitzky de Muckadell OB. Ulcus pepticum og cancer ventriculi - infektionssygdomme fremkaldt af Helicobacter pylori?. Ugeskr Læger 2002; 164, nr. 50: portal.findresearcher.sdu.dk
- Robert Koch-Institut, Gesellschaft der epidemiologischen Krebsregister in Deutschland e. V. Krebs in Deutschland 2011/2012.. 10. Ausgabe. Berlin: Robert Koch-Institut, 2015. www.krebsdaten.de
- Wu I-C, Wu D-C, Yu F-J, Wang J-Y, Kuo C-H, Yang S-F, Wang C-L, Wu M-T.. Association between Helicobacter pylori seropositivity and digestive tract cancers. World J.Gastroenterol 2009; 15(43): 5465-71. pmid:19916178 PubMed
- Cavaleiro-Pinto M, Peleteiro B, Lunet N, Barros H.. Helicobacter pylori infection and gastric cardia cancer: systematic review and meta-analysis. Cancer Causes Control 2011; 22(3): 375-87. pmid:21184266 PubMed
- Kamangar F, Dawsey SM, Blaser MJ, Perez-Perez GI, Pietinen P, Newschaffer CJ, Abnet CC, Albanes D, Virtamo J, Taylor PR.. Opposing risks of gastric cardia and noncardia gastric adenocarcinomas associated with Helicobacter pylori seropositivity. J.Natl.Cancer Inst. 2006; 98(20): 1445-52. pmid:17047193 PubMed
- Wang C, Yuan Y, Hunt RH.. The association between Helicobacter pylori infection and early gastric cancer: a meta-analysis. Am J Gastroenterol 2007; 102(8): 1789-98. pmid:17521398 PubMed
- Palli D, Masala G, Del Giudice G, Plebani M, Basso D, Berti D, Numans ME, Ceroti M, Peeters PHM, Bueno de Mesquita HB, et al.. CagA+ Helicobacter pylori infection and gastric cancer risk in the EPIC-EURGAST study. Int.J.Cancer 2007; 120(4): 859-67. pmid:17131317 PubMed
- Plummer M, van Doorn LJ, Franceschi S, Kleter B, Canzian F, Vivas J, Lopez G, Colin D, Munoz N, Kato I.. Helicobacter pylori cytotoxin-associated genotype and gastric precancerous lesions. J.Natl.Cancer Inst. 2007; 99(17): 1328-34. pmid:17728213 PubMed
- Suriani R, Colozza M, Cardesi E, Mazzucco D, Marino M, Grosso S, Sanseverinati S, Venturini I, Borghi A, Zeneroli ML.. CagA and VacA Helicobacter pylori antibodies in gastric cancer. Can.J.Gastroenterol 208; 22(3): 255-8. pmid:18354754 PubMed
- Olsen CM, Pandeya N, Green AC, Webb PM, Whiteman DC. Population attributable fractions of adenocarcinoma of the esophagus and gastroesophageal junction. Am.J.Epidemiol 2011; 174(5): 582-90. pmid:21719746 PubMed
- Gonzalez CA, Lopez-Carrillo L. Helicobacter pylori, nutrition and smoking interactions: Their impact in gastric carcinogenesis. Scand J Gastroenterol 2010; 45(1): 6-14. pmid:20030576 PubMed
- Sharma RR, London MJ, Magenta LL, Posner MC, Roggin KK. Preemptive Surgery for premalignant foregut lesions. J.Gastrointest.Surg 2009; 13(10): 1874-87. pmid:19513795 PubMed
- Watson P, Vasen HFA, Mecklin JP, Bernstein I, Aarnio M, Jarvinen HJ, Myrhoj T, Sunde L, Wijnen JT, Lynch HT. The risk of extra-colonic, extra-endometrial cancer in the Lynch syndrome. Int.J.Cancer 2008; 123(2): 444-9. pmid:18398828 PubMed
- van Lier MGF, Wagner A, Mathus-Vliegen EMH, Kuipers EJ, Steyerberg EW, van Leerdam ME. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations. Am J Gastroenterol 2010; 105(6): 1258-64. pmid:20051941 PubMed
- Siewert, J.R., Rothmund, M. Schumpelick, V. Praxis der Viszeralchirurgie. Onkologische Chirurgie. Heidelberg: Springer, 2010.
- Tumorzentrum München. Manual Gastrointestinale Tumoren. München: Zuckschwerdt Verlag, 2013. www.tumorzentrum-muenchen.de
- Koch HK, Wittekind C. Anleitung zur pathologisch-anatomischen Diagnostik des Magenkarzinoms. Version 1.0. Berufsverband Deutscher Pathologen e.V. www.pathologie-dgp.de
- Hamilton SR, Aaltonen LA. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press, 2000.
- Okines A, Verheij M, Allum W, Cunningham D, Cervantes A. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann.Oncol. 2010 2010; 21 Suppl 5: v50-v54. pmid:20555102 PubMed
- Bartley AN, Washington MK, Colasacco C et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol 2017 Feb; 35(4): 446-464. pmid:28129524 PubMed
- Ge S, Feng X, Shen L, Wei Z, Zhu Q, Sun J. Association between habitual dietary salt intake and risk of gastric cancer: A systematic review of observational studies. Gastroenterol.Res.Pract. 2012. pmid:23125851 PubMed
- D'Elia L, Rossi G, Ippolito R, Cappuccio FP, Strazzullo P. Habitual salt intake and risk of gastric cancer: a meta-analysis of prospective studies. Clin Nutr 2012; Aug;31(4): 489-98. pmid:22296873 PubMed
- Burke EC, Karpeh MS, Conlon KC, Brennan MF. Laparoscopy in the management of gastric adenocarcinoma. Ann Surg 1997; 225: 262-77. PubMed
- Gold JS, Al Natour RH, Saund MS, Yoon C, Sharma AM, Huang Q, Boosalis VA, Whang EE. Population-based outcome of stage IA-IIA resected gastric adenocarcinoma: Who should get adjuvant treatment?. Ann.Surg.Oncol 2013; 20(7): 2304-10. pmid:23344580 PubMed
- Liu L, Wang ZW, Ji J, Zhang JN, Yan M, Zhang J, Liu BY, Zhu ZG, Yu YY. A cohort study and meta-analysis between histopathological classification and prognosis of gastric carcinoma. Anticancer Agents Med.Chem 2013; 13(2): 227-34. pmid:22934699 PubMed
- Matsubara J, Shimada Y, Kato K, Nagai Y, Iwasa S, Nakajima TE, Hamaguchi T, Yamada Y, Takagi S, Kobayashi K, et al. Phase II study of bolus 5-fluorouracil and leucovorin combined with weekly paclitaxel as first-line therapy for advanced gastric cancer. Oncology 2011; 81(5-6): 291-7. www.ncbi.nlm.nih.gov
- Park SH, Cho MS, Kim YS, Hong J, Nam E, Park J, Cho EK, Shin DB, Lee JH, Lee WK. Self-reported health-related quality of life predicts survival for patients with advanced gastric cancer treated with first-line chemotherapy. Qual.Life Res 2008; 17(2): 207-14. www.ncbi.nlm.nih.gov
- Chau I, Norman AR, Cunningham D, Waters JS, Oates J, Ross PJ. Multivariate prognostic factor analysis in locally advanced and metastatic esophago-gastric cancer--pooled analysis from three multicenter, randomized, controlled trials using individual patient data. J.Clin.Oncol 2004; 22(12): 2395-403. www.ncbi.nlm.nih.gov
- McGuill MJ, Byrne P, Ravi N, Reynolds J. The prognostic impact of occult lymph node metastasis in cancer of the esophagus or esophago-gastric junction: systematic review and meta-analysis. Dis Esophagus 2008; 21(3): 236-40. PubMed
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Jutta Hübner, PD Dr. med., Fachärztin für Innere Medizin, Hämatologie und Internistische Onkologie, Deutsche Krebsgesellschaft, Berlin
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).