Zusammenfassung
- Definition:Bei Krebs im Nierengewebe (Renal Cell Carcinoma, RCC) handelt es sich beinahe immer um ein Adenokarzinom. Die Ätiologie ist nicht bekannt.
- Häufigkeit:Inzidenz liegt bei ca. 10/100.000, unter ihnen doppelt so viele Männer wie Frauen. Im Jahr 2016 lag das mittlere Erkrankungsalter von Frauen bei 68, von Männern bei 72 Jahren.
- Symptome:Die Krankheit ist symptomarm, und häufig erfolgt der Nachweis zufällig infolge der Untersuchung anderer Krankheiten.
- Befunde:Eine klinische Untersuchung zeigt meist einen Normalbefund, die Triade aus Flankenschmerz, Hämaturie und Raumforderung kommt nur bei 10‒15 % der Patient*innen vor.
- Diagnostik:Ultraschall und/oder Angio-CT sind bildgebende Untersuchungen der Wahl.
- Therapie:Eine Operation stellt die einzige kurative Behandlungsmethode dar, aber ein Nierenzellkarzinom ist oft schon so weit fortgeschritten, dass eine operative Therape keine Heilung mehr erzielt. Lebensverlängernd kann dann die systemische Therapie mit molekular zielgerichteten Substanzen sein.
Allgemeine Informationen
Definition
- Das Nierenzellkarzinom (RCC) macht ca. 80–90 % aller Nierentumoren aus.1-2
- > 95 % der Fälle haben ein Adenokarzinom.
- In etwa der Hälfte aller Fälle wird der Tumor zufällig bei einer radiologischen Untersuchung entdeckt.1
- Zum Diagnosezeitpunkt haben bereits ca. 25 % der Betroffenen Metastasen. 1/3 der Patient*innen, bei denen eine Resektion der lokalisierten Erkrankung durchgeführt wurde, erleiden ein Rezidiv.
- Wilms-Tumor, Sarkom und andere seltene Formen werden an dieser Stelle nicht behandelt.
UICC-Stadien3
- Die TNM-Klassifikation für die Stadieneinteilung des Nierenzellkarzinoms wird sowohl in klinischen als auch in Forschungszusammenhängen verwendet. Das TNM-System wurde mehrmals überarbeitet. Die nachfolgenden Informationen basieren auf der Version von 2010 (Stadieneinteilung nach UICC).
- Stadium T I
- Tumor ≤ 7 cm in größter Ausdehnung, innerhalb der Nierenkapsel
- Untergruppe A: Tumor < 4 cm innerhalb der Nierenkapsel
- Untergruppe B: Tumor > 4 cm innerhalb der Nierenkapsel
- Stadium T II
- Tumor > 7 cm in größter Ausdehnung, innerhalb der Nierenkapsel
- Untergruppe A: Tumor 7-10 cm innerhalb der Nierenkapsel
- Untergruppe B: Tumor > 10 cm innerhalb der Nierenkapsel
- Stadium T III
- Wachstum mit Durchbrechen der Nierenkapsel oder makroskopische Infiltration der großen Venen (Venenäste mit Muskulatur)
- Untergruppe A: Infiltration von Nebenniere oder perirenaler Fettkapsel (inkl. Hilusfett), aber nicht der Gerota-Faszie
- Untergruppe B: Infiltration von Nierenvenen oder Hohlvene unterhalb des Zwerchfells
- Untergruppe C: Infiltration der Hohlvene oberhalb des Zwerchfells
- Stadium T IV
- Tumorausdehnung durch die Gerota-Faszie
- N0: kein Anhalt für Befall der benachbarten Lymphknoten
- N1: Metastase in einem benachbarten Lymphknoten
- N2: Metastase in mehreren benachbarten Lymphknoten
- M0: kein Anhalt für Fernmetastasen
- M1: Fernmetastasen
Häufigkeit
- Inzidenz4
- Die Anzahl der Neuerkrankungen lag 2016 bei etwa 14.640.
- altersstandardisierte Inzidenz
- Frauen 7,5/100.000
- Männer 15,7/100.000
- Geschlecht und Alter
- Zum Diagnosezeitpunkt weisen ca. 25 % der Betroffenen Fernmetastasen auf, meist in der Lunge, im Skelett oder in Lymphknoten, seltener im Gehirn, in der Leber, im Spinalkanal, im Darm oder in den Hoden.2,6-7
- Mehrere neuere Studien deuten darauf hin, dass es einen leichten Anstieg in der Inzidenz des Nierenzellkarzinoms gibt. Es wird angenommen, dass der jährliche Anstieg weltweit und europaweit bei ca. 2 % liegt.8
- Altersbereinigt ist die Inzidenz allerdings langsam rückläufig. Die Zunahme der Fallzahlen erklärt sich durch den demografischen Wandel.4
- Die zunehmende Verwendung moderner bildgebender Untersuchungsverfahren hat dazu geführt, dass mehr Fälle von Nierenkrebs zufällig entdeckt wurden. Diese Tumoren sind meist kleiner und niedriggradiger.9
Ätiologie und Pathogenese
- Unbekannt
- Nierenzellkarzinome entstehen im Nierenepithel, meist in den proximalen Tubuli. Die Tumoren sind stark vaskularisiert, wahrscheinlich aufgrund der erhöhten Produktion des vaskulären endothelialen Wachstumsfaktors.
- Für die Wahl der Therapie sind Zelltyp und histologische Muster nicht von Bedeutung.
Tumorarten
- Es handelt es sich bei 80‒90 % der Nierentumoren um ein klarzelliges Nierenzellkarzinom.
- Wahrscheinlich sind Defekte im VHL-Gen verantwortlich für 60 % dieser Nierenkrebsfälle.10
- Sie können Teil des Von-Hippel-Lindau-Syndroms sein.
- Papilläres Nierenzellkarzinom
- Onkozytom oder chromophobes Nierenzellkarzinom
- Ein Onkozytom ist eine eher benigne Variante und findet sich in 4 % aller Nephrektomien, die bei Verdacht auf ein Nierenzellkarzinom durchgeführt werden.
- Die chromophobe Variante des Nierenzellkarzinoms macht 4 % aller Nierenzellkarzinome aus und kann einen benignen Verlauf haben, wenn frühzeitig chirurgisch eingegriffen wird.14-15
- Nierenzellkarzinom, das aus den Sammelrohren entstanden ist.
- Es macht weniger als 1 % aller Nierenzellkarzinome aus und ist typischerweise ein aggressiver Tumor.
- Das Nierenzellkarzinom ist vom Nierenbeckenkarzinom zu unterscheiden.
- Ein Nierenbeckenkarzinom entwickelt sich im Urothel und nicht in den Nierenzellen.
- Biologisch ist das Nierenbeckenkarzinom mit dem Blasenkarzinom vergleichbar.
Disponierende Faktoren
- Zigarettenrauchen verdoppelt das Risiko und ist bei Diagnosezeitpunkt mit einem fortgeschritteneren Stadium assoziiert.16
- Übergewicht
- Hypertonie
- Selten Erbkrankheiten
- Berufliche Belastung mit Halogenkohlenwasserstoffen (siehe Artikel Berufskrankheiten und Arbeitsunfälle)
ICPC-2
- U75 Bösartige Neubildung der Niere
ICD-10
- C64 Bösartige Neubildung der Niere, ausgenommen Nierenbecken17
Diagnostik
Diagnostische Kriterien
- Es gibt in einigen Fällen Symptome und Befunde, die auf die Erkrankung hinweisen:
- Hämaturie
- Flankenschmerz
- Anämie und
- erhöhte BSG.
- Diagnose durch bildgebende Diagnostik wie Ultraschall und Angio-CT
Differenzialdiagnosen
- Solide Läsionen in der Niere gelten als Nierenkrebs, bis das Gegenteil bewiesen ist.
Anamnese
- Häufig zufälliger Befund bei Urinuntersuchung oder Ultraschalluntersuchung des Bauchraums
- Die Erkrankung ist lange Zeit symptomlos, die Symptome sind unspezifisch und können sich als ungewöhnliche Syndrome äußern.
- Lokalsymptome: makroskopische Hämaturie (30–40 %), Bauchschmerzen (ca. 50 %), Flankenschmerz (20–40 %)
- paraneoplastische Symptome (5–10 %): Fieber, BSG > 100, Polyzythämie, ektopische Hormonproduktion, Metastasensymptome (25–40 %): verminderter Allgemeinzustand, Husten, Skelettschmerzen, Kopfschmerzen, Gewichtsverlust, Anämie
Klinische Untersuchung
- Die klinische Untersuchung ist meist unauffällig.
- Der Tumor kann selten palpiert werden.
- Die Triade Flankenschmerz, Hämaturie und Raumforderung tritt nur bei 10‒15 % der Fälle auf.
- Allgemeinzustand?
- Funktionseinschränkungen?
Ergänzende Untersuchungen in der Hausarztpraxis
- Urinuntersuchung: Hämaturie ist der häufigste wegweisende Befund.
- Einzelne Bluttests wie Blutsenkungsreaktion, CRP, Serumkalzium, Hämoglobin und alkalische Phosphatase sind von prognostischer Bedeutung.
Diagnostik bei Spezialist*innen
- Ultraschall
- Zeigt einen soliden expansiven Prozess.
- Angio-CT (oder MRT)
- Eignen sich am besten für die diagnostische Untersuchung.
- Liefern die beste Darstellung des Tumors und Information in Bezug auf die Stadieneinteilung: regionale Lymphknoten, Infiltration der Nierenvene, Lebermetastasen.
- Skelettszintigrafie und Röntgenthorax/CT-Thorax
- Wird durchgeführt, um nach Metastasen zu suchen.
- Eine Nadelbiopsie wird zur Untersuchung von Nierentumoren selten eingesetzt.
- Die Methode ist dann besonders sinnvoll, wenn man einen chirurgischen Eingriff vermeiden möchte (z. B. bei Verdacht auf ein Onkozytom), und wenn die betroffene Person nur noch eine funktionstüchtige Niere hat.
Indikationen zur Überweisung
- Überweisung zur Urologie
- Bildgebung der Niere zeigt Raumforderung.
- Hämaturie (s. u.)
Verdacht auf Nierenkarzinom
- Ein klinischer Verdacht besteht bei folgenden Symptomen, einzeln oder in Kombination:
- Blut im Urin
- Im ersten Schritt Blasenkrebs ausschließen.
- Ist auch bei Nierenkrebs das Hauptsymptom.
- Schmerzen in den Flanken
- palpable Raumforderung in der Flanke.
- Blut im Urin
Risikogruppen
- Rauchen
- Übergewicht
- Exposition gegenüber organischen Lösungsmitteln
- 2 % der Betroffenen weisen eine erbliche Disposition auf.
Therapie
Therapieziele
- Heilung19-20
- Palliation
Allgemeines zur Therapie
- Eine Operation ist die einzige kurative Behandlung des Nierenzellkarzinoms.
- Die Primärbehandlung bei einem lokalisierten Nierenkarzinom ist eine Nephrektomie, diese kann bei bis zu 90 % der Fälle kurativ sein.1
- Die 5-Jahres-Überlebensrate beträgt bei Männern 76 % und bei Frauen 77 %.4
Therapie einer lokalisierten Erkrankung
Radikale Nephrektomie
- Eine Operation ist die einzige kurative Behandlung des Nierenzellkarzinoms.
- Lokal begrenzte T1/2-Tumoren können zunehmend nierenerhaltend operiert werden. Die offene Nierenteilresektion stellt die Standardtherapie dar. Allerdings werden immer häufiger minimalinvasive Operationstechniken eingesetzt.
- Wenn eine nierenerhaltende Therapie nicht möglich ist, sollte die Nephrektomie minimalinvasiv durchgeführt werden.21
- Bei einer traditionellen radikalen Nephrektomie erfolgt eine Entfernung der gesamten Niere inkl. Gerota-Faszie, Nebenniere und regionalen Lymphknoten.22
- In der Literatur findet sich kein Nachweis dafür, dass ein bestimmter chirurgischer Zugang sich besser eignet als ein anderer. Offen-chirurgische transabdominale, offen-chirurgische retroperitoneale und laparoskopische Techniken scheinen im Hinblick auf die Überlebensrate zu vergleichbar guten Ergebnissen zu führen.23
- Eine routinemäßige Adrenalektomie ist nicht notwendig, es sei denn, es liegen Tumoren im oberen Nierenpol vor, oder es handelt sich um große Tumoren.
- Eine Lymphknotenexzision sollte bei perihilärem Gewebe vorgenommen werden. Eine erweiterte Lymphadenektomie ist nicht erforderlich, wenn kein klinischer oder radiologischer Verdacht auf Lymphknotenmetastasen vorliegt.24
- Überlebensrate abhängig vom Tumorstadium
- Eine italienische Studie schloss 702 Personen ein, die in den Jahren 1976‒2000 wegen eines Nierenzellkarzinoms behandelt wurden. Etwa 2/3 davon waren radikal nephrektomiert worden. Die 5-Jahres-Überlebensrate betrug bei Stadium pT1a 97,4 %, bei T1b 92,5% und bei pT2 89,3%.25
- Näheres zur Überlebensprognose beim Nierenzellkarzinom siehe Abschnitt Prognose.
- Tumorthromben treten in 4‒10 % der Fälle auf. Bei 90 % davon liegt das höchste Niveau des Thrombus unterhalb des Zwerchfells. 50 % der Fälle mit einem nachgewiesenen Tumorthrombus haben Lymphknotenmetastasen und/oder Fernmetastasen.
- Bei Patient*innen mit Tumorthrombus wird eine radikale Nephrektomie in Kombination mit mehreren Spezialeingriffen (Gefäßchirurgie/Leberchirurgie) durchgeführt.
- T4-Tumoren: Infiltration in Nachbarorgane: Die Prognose ist ungünstig, und ein chirurgischer Eingriff soll individuell beurteilt werden.
Komplikationen bei Nephrektomie
- Postoperative Komplikationen sind nach radikaler Nephrektomie in 15‒30 % der Fälle beschrieben.26
- Nach partieller Nephrektomie liegt die Gesamtkomplikationsrate bei 20‒25 %.27
- Reoperationen kommen bei 0–3 % der Operationen vor.
- Die häufigsten intraoperativen Komplikationen sind Milzverletzungen und Blutungen.
- Blutungen stammen meist aus der Nebennierenvene, pathologischen Kollateralgefäßen zum Tumor oder aus Lumbalvenen.
- Schwere einschließlich transfusionspflichtiger Blutungen werden bei radikaler Nephrektomie in 1‒2 % der Fälle berichtet.2,27
- Die Transfusionsraten bei partieller Nephrektomie korrelieren negativ mit der Erfahrung der Operierenden. Je nach Studie wurden in bis zu 50 % der Fälle Transfusionen verabreicht.27
- Die häufigsten nichtchirurgischen postoperativen Komplikationen sind Darmparalysen, Wundinfektionen und Lungenentzündungen.
- Die perioperative Mortalität liegt laut einer in 2003 publizierten isländischen Studie bei 2‒3 % und zeigte keine Veränderung über den 30-tägigen Beobachtungszeitraum.28
- Die Komplikationshäufigkeit bei Operationen von T3b‒c-Tumoren beträgt laut einer in 2003 publizierten US-amerikanischen Studie 20‒30 %, die 30-Tages-Mortalitätsrate 2‒8 %.29
Tumordestruierende Verfahren
- Der Einsatz von Kryoablation, Radiofrequenzablation und hochfokussiertem Ultraschall (HIFU) sollte nur im Rahmen von prospektiven Studien erfolgen.
Adjuvante Therapie
- Studien zu adjuvanten Impfstoffen, z. B. mit bestrahlten Krebszellen, konnten keinen therapeutischen Nutzen nachweisen.2,30
- Eine adjuvante Therapie mit Zytokinen steigert die Überlebensrate nicht.
Therapie einer metastasierenden Erkrankung
- Zum Diagnosezeitpunkt weisen bis zu 30 % der Betroffenen Metastasen auf.
- Die mittlere krebsspezifische Überlebensrate beträgt dann 7 Monate, und die 5-Jahres-Überlebensrate liegt bei 0–20 %.31
- 80 % der Metastasen sind multifokal. Meist ist die Lunge das Metastaseorgan, und zusammen mit dem Skelett stellt sie die häufigste Lokalisation solitärer Metastasen dar.
- Die früher eingesetzten Immuntherapeutika Interferon und Interleukin verlängerten das Überleben im Median ca. 1 und 1,5 Jahre.
- Eine deutliche Verlängerung der medianen Überlebenszeit brachte die Einführung von VGEF-Inhibitoren und mTOR-Inhibitoren (s. u.).
Chirurgie bei einer primär metastasierenden Erkrankung
- Eine zytoreduktive Nephrektomie ist nur palliativ.
- Eine zytoreduktive Nephrektomie vor einer Immuntherapie mit Interferon verlängert die Überlebensrate signifikant im Vergleich zu einer bloßen Immuntherapie.
- Ob das auch auf die mittlerweile als Standardtherapie verwendeten zielgerichteten Substanzen zutrifft, ist unklar.
- Eine zytoreduktive Nephrektomie kommt nur bei gutem Allgemeinzustand der behandelten Person infrage.
- Eine vollständige operative Entfernung der Metastasen trägt zu einer günstigeren Prognose bei.32
- Ob eine lokale Therapie der Metastasen infrage kommt, hängt von der Zahl der Metastasen und befallenen Organe sowie vom Zeitpunkt der Metastasierung ab.2
Bestrahlung bei metastasierter Erkrankung
- Kann für eine erhebliche Schmerzlinderung bei Metastasen im Weichteilgewebe, Skelett oder Gehirn sorgen.
Pharmakotherapie im fortgeschrittenen oder metastasierten Stadium
- Angiogenese-hemmende Medikamente
- VEGF-Rezeptor-Tyrosinkinase-Inhibitoren (TKI), z. B.:
- Axitinib
- Sunitinib
- Pazopanib
- Cabozantinib
- Lenvatinib
- Tivozanib.
- VEGF-blockierende Antikörper, z. B.:
- Bevacizumab.
- mTOR-Inhibitoren, z. B.:
- Temsirolimus
- Everolimus.
- Angiogenesehemmer verzögern die Progression/verlängern die Lebensdauer bei Patient*innen mit guter oder intermediärer Prognose.33-34
- Entwicklung von Sequenz- bzw. Kombinationstherapien mit mTOR- und VGEF-Inhibitoren
- Vor der Behandlung ist eine zytoreduktive Nephrektomie in Betracht zu ziehen.
- VEGF-Rezeptor-Tyrosinkinase-Inhibitoren (TKI), z. B.:
- Immuntherapie
- Zytokine
- Interferon-alpha und Interleukin-2 haben Gesamtansprechraten von 8‒26 % mit einer kompletten Remission bei 27 % der Fälle gezeigt.
- Die Langzeitansprechrate ist schlecht mit einer durchschnittlichen Zeit bis zur Progression von 10 Monaten.
- Es ist nicht nachgewiesen, dass ein Kombiregime von Interferon-alpha und Interleukin-2 höhere Ansprechraten ergibt.
- Viele Betroffene vertragen die Behandlung aufgrund der Nebenwirkungen nicht.
- Bei Interleukin-2 treten Nebenwirkungen häufiger auf.
- Vor der Behandlung ist eine zytoreduktive Nephrektomie in Betracht zu ziehen.
- Die Zytokintherapie hat seit Einführung von Angiogenesehemmern und Immuncheckpoint-Inhibitoren nur noch einen geringen Stellenwert und sollte an spezialisierten Zentren erfolgen.2
- Beim metastasierten klarzelligen Nierenzellkarzinom soll eine alleinige Zytokintherapie basierend auf subkutanem IL-2 und/oder IFN nicht durchgeführt werden (IIa/A).2
- Immuncheckpoint-Inhibitoren
- Geben die Tumorzelle zum Angriff durch T-Zellen frei.
- Der gegen den PD-1-Rezeptor gerichtete, monoklonale Antikörper Nivolumab hat sich in der Zweitlinientherapie im Vergleich zu Everolimus als wirksamer hinsichtlich des Gesamtüberlebens und als besser verträglich erwiesen.35
- In einem RCT verbesserte die Kombination aus Nivolumab und Ipilimumab das Gesamtüberleben im Vergleich zu Sunitinib in der Erstlinienbehandlung.36
- weitere Substanzen mit Wirksamkeitsnachweisen: Pembrolizumab, Avelumab
- Näheres zur Indikation siehe den folgenden Leitlinienkasten.
- Zytokine
- Chemotherapie
- Das Nierenzellkarzinom spricht in der Regel nicht auf konventionelle Zytostatika an.
- Beim metastasierten klarzelligen Nierenzellkarzinom soll eine palliative Chemotherapie nicht durchgeführt werden (Ia/A).2
- Eine Hormonbehandlung zeigt keine Wirkung.
Leitlinie: Zielgerichtete Therapie des fortgeschrittenen oder metastasierten klarzelligen Nierenzellkarzinoms2
- Erstlinientherapie
- Das IMDC-Risiko (günstige, intermediäre oder schlechte Prognose) und patientenindividuelle Faktoren sollen berücksichtigt werden.
- bei allen Risikogruppen
- Die Kombination Pembrolizumab plus Axitinib soll gegeben werden (Ic/A).
- Die Kombination Avelumab plus Axitinib sollte gegeben werden (Ic/B).
- bei intermediärem oder hohem Risiko
- Die Kombination Pembrolizumab plus Axitinib oder die Kombination Ipilimumab plus Nivolumab soll gegeben werden (Ic/A).
- bei hohem Risiko
- Wenn eine Checkpointinhibitor-basierte Kombinationstherapie nicht durchgeführt werden kann, sollte Cabozantinib oder Sunitinib angeboten werden (Ib‒c/B).
- bei intermediärem Risiko
- Wenn eine Checkpointinhibitor-basierte Kombinationstherapie nicht durchgeführt werden kann, sollte Cabozantinib, Pazopanib, Sunitinib oder Tivozanib angeboten werden (Ia‒c/B).
- bei niedrigem Risiko
- Wenn eine Checkpointinhibitor-basierte Kombinationstherapie nicht durchgeführt werden kann, sollen Bevacizumab + INF, Pazopanib, Sunitinib oder Tivozanib verwendet werden (Ia/A).
- Zweitlinientherapie
- Nach Versagen einer alleinigen VEGF-basierten Therapie soll die Folgetherapie aus Nivolumab oder Cabozantinib bestehen (Ic/A).
- Eine spezifische Sequenz der Substanzen kann nicht empfohlen werden.
- Nach Versagen eines alleinigen VEGF-Inhibitors sollte die Kombination aus Lenvatinib und Everolimus eingesetzt werden (Ic/B).
- Wenn nach Versagen einer VEGF/R-Therapie keine Standardempfehlung umgesetzt werden kann, kann alternativ die Behandlung mit einem anderen TKI erfolgen (Ib/C).
- Nach Versagen eines mTOR-Inhibitors sollte die Folgetherapie mittels eines Tyrosinkinaseinhibitors (TKI)
oder Nivolumab erfolgen (II/B). - Patient*innen, die eine Therapie mit einem Checkpoint-Inhibitor erhalten, sollen auch nach Therapieende auf immunvermittelte Nebenwirkungen kontrolliert werden. Treten Immuntherapie-assoziierte Nebenwirkungen auf, sollen diese umgehend therapiert werden (IV/A).
- Nach Versagen einer alleinigen VEGF-basierten Therapie soll die Folgetherapie aus Nivolumab oder Cabozantinib bestehen (Ic/A).
- Terminale Niereninsuffizienz
- Eine terminale Niereninsuffizienz und/oder Hämodialyse ist keine Kontraindikation gegen eine Systemtherapie mit TKI, Checkpoint- oder mTOR-Inhibitoren.
Sekundärbehandlung
- Neue Methoden im Erprobungsstadium
- weitere molekular zielgerichtete Verfahren
- Eine Stammzellentransplantation zeigte widersprüchliche Ergebnisse.37-38
- Tumorimpfstoffe
- Antigenbehandlung
Palliative Behandlung
- Schmerzen
- Übelkeit und Erbrechen
- Verstopfung
- Orale Beschwerden
- Mangelernährung und Dehydratation
- Dyspnoe
- Depression
- Angst
- Delir
- Maligne gastrointestinale Obstruktionen
Verlauf, Komplikationen und Prognose
Verlauf
- Zunächst nur symptomarmer Verlauf, oft über einen längeren Zeitraum
- Zum Diagnosezeitpunkt weisen ca. 25 % der Patient*innen Fernmetastasen auf, meist in der Lunge oder im Skelett.
- Fernmetastasen können noch mehr als 10 Jahre nach einer Nephrektomie bei einer lokalisierten Erkrankung auftreten.
- Der klinische Verlauf von einem metastasierenden Nierenkarzinom variiert sehr und ist individuellen Fall meist nicht vorhersagbar.
Komplikationen
- Metastasen (Lunge, Skelett – Achtung: pathologische Frakturen!)
Prognose
Überlebens- und Sterblichkeitsrate
- Die relative 5-Jahres-Überlebensrate liegt bei Männern bei ca. 76 % und bei Frauen bei 77 %.4
- Absolute 5-Jahres-Überlebensrate nach Krankheitsstadium
- Männer
- gesamt 61,3 %
- lokal begrenzter Tumor 85,5 %
- regionale Ausbreitung 52,9 %
- Fernmetastasen 8,7 %
- Frauen
- gesamt 66,9 %
- lokal begrenzter Tumor 86,9 %
- regionale Ausbreitung 46,3 %
- Fernmetastasen 12,6 %
- Männer
Prädiktoren für eine schlechte Prognose
- Metastatisches Nierenzellkarzinom39-40
- schlechter Allgemeinzustand
- hoher LDH-Wert
- niedriger Hb-Wert
- hohes korrigiertes Serumkalzium
Verlaufskontrolle
Nachsorge nach Rezidivrisiko
- Alle Patient*innen mit niedrigem Rezidivrisiko erhalten im ersten Halbjahr zunächst alle 3 Monate klinische Untersuchungen und Laborwertkontrollen. Dann vergrößert sich das Intervall auf halbjährliche und später jährliche Intervalle innerhalb von 5 Jahren nach der Therapie. Eine Abdomensonografie erfolgt in Abständen von 3, 6, 12, 18, 36 und 60 Monaten, eine CT-Thorax in den Monaten 12, 24 und 48, eine CT des Abdomens standardmäßig nach 24 und 48 Monaten.2
- Bei mittlerem und hohem Rezidivrisiko werden die bildgebenden Verfahren noch häufiger und über einen Zeitraum von 9 Jahren durchgeführt.2
Patienteninformationen
Patienteninformationen in Deximed
Linderungsbehandlung bei fortgeschrittener Krebserkrankung
- Palliativmedizin
- Angstbehandlung
- Übelkeit und Erbrechen
- Verstopfung
- Mundtrockenheit
- Atembeschwerden
- Gewichtsverlust bei Krebs
- Depression
- Delir
Weitere Informationen
- Deutsches Krebsforschungszentrum: Schmerzen bei Krebs
Illustrationen
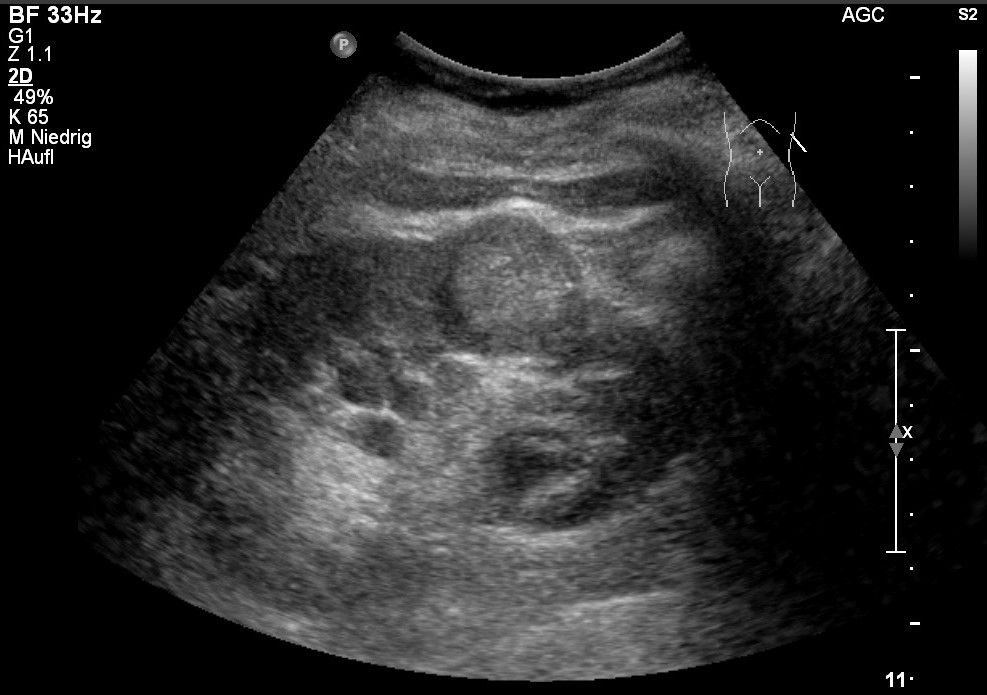
Sonografie: Nierenzellkarzinom; echoreiche Raumforderung mit echoärmerem Saum und Konturüberschreitung (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Quellen
Leitlinien
- Deutsche Gesellschaft für Urologie. Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms. AWMF-Leitlinie Nr. 043-017OL. S3, Stand 2020. www.awmf.org
- European Society of Medical Oncology. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Stand 2019. www.esmo.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL. S3, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL. S3, Stand 2019. www.awmf.org
Literatur
- Pessoa R, Kim S. Renal cell carcinoma. BMJ Best Practice; last reviewed: 12 Dec 2020, last updated 14 Oct 2020 bestpractice.bmj.com
- Deutsche Gesellschaft für Urologie. Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms. AWMF-Leitlinie Nr. 043-017OL, S3, Stand 2020. www.awmf.org
- Brierley JD, Gospodarowicz MK, Wittekind C (Hrsg.). TNM Classification of Malignant Tumours, 8th Edition. Hoboken, NJ, USA: Wiley-Blackwell 2016. www.wiley.com
- Robert Koch Institut. Zentrum für Krebsregisterdaten. Nierenkrebs. Stand: 17.12.2019, Zugriff 22.12.2020 www.krebsdaten.de
- McLaughlin JK, Lipworth L. Epidemiologic aspects of renal cell cancer. Semin Oncol 2000; 27: 115-123. PubMed
- Universitätsklinikum Ulm. Nierenzellkarzinom. Stand 2020, Zugriff 22.12.2020 www.uniklinik-ulm.de
- van der Poel HG, Roukema JA, Horenblas S, van Geel AN, Debruyne FM. Metastasectomy in renal cell carcinoma: A multicenter retrospective analysis. Eur Urol. 1999;35(3):197-203. doi: 10.1159/000019849. PMID: 10072620. PubMed
- European Association of Urology. Guidelines on Renal Cell Carcinoma. Ljungberg B, Albiges L, Bensalah A. et al. EAU; 2017 uroweb.org
- Beisland C, Medby PC, Beisland HO. Renal cell carcinoma: gender difference in incidental detection and cancer-specific survival. Scand J Urol Nephrol 2002;36(6):414 PubMed
- Kim WY, Kaelin WG. Role of VHL gene mutation in human cancer. J Clin Oncol 2004; 22: 4991-5004. PubMed
- Beck SD, Patel MI, Snyder ME, et al. Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma. Ann Surg Oncol 2004; 11: 71-7. PubMed
- Gunawan B, von Heydebreck A, Fritsch T, et al. Cytogenetic and morphologic typing of 58 papillary renal cell carcinomas: evidence for a cytogenetic evolution of type 2 from type 1 tumors. Cancer Res 2003; 63: 6200-5. PubMed
- Lubensky IA, Schmidt L, Zhuang Z, et al. Hereditary and sporadic papillary renal carcinomas with c-met mutations share a distinct morphological phenotype. Am J Pathol 1999; 155: 517-26. PubMed
- Cheville JC, Lohse CM, Zincke H, Weaver AL, Blute ML. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27: 612-24. PubMed
- Peyromaure M, Misrai V, Thiounn N, et al. Chromophobe renal cell carcinoma: analysis of 61 cases. Cancer 2004; 100: 1406-10. PubMed
- Cumberbatch MG, Rota M, Catto JW, La Vecchia C. The Role of Tobacco Smoke in Bladder and Kidney Carcinogenesis: A Comparison of Exposures and Meta-analysis of Incidence and Mortality Risks. Eur Urol 2016 Sep; 70(3): 458-66. pmid:26149669 PubMed
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2021. Stand 18.09.2020; letzter Zugriff 22.12.2020 www.dimdi.de
- European Society of Medical Oncology. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Stand 2019. www.esmo.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL, S3, Stand 2014 (abgelaufen). www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin.Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL, S3, Stand 2019. www.awmf.org
- MacLennan S, Imamura M, Lapitan MC, et al. Systematic review of oncological outcomes following surgical management of localized renal cell carcer. Eur Urol 2012; 61:972-93. pubmed.ncbi.nlm.nih.gov
- Robson CJ, Churchil BM, Anderson W. Results of radical nephrectomy for renal cell carcinoma. J Urol 1969; 101(3): 297. PubMed
- Wille AH, Roigas J, DeGer S et al. Laparoscopic radical nephrectomy: techniques, results and oncological outcome in 125 consecutive cases. Eur Urol 2004 Apr;45(4):483. PubMed
- Blute ML, Leibovich BC, Cheville JC et al. A protocol for performing extended lymph node dissection using primary tumor pathological features for patients treated with radical nephrectomy for clear cell renal cell carcinoma. J Urol 2004 Aug;172(2):465. PubMed
- Ficarra V, Novara G, Galfano A, et al. Application of TNM, 2002 version, in localized renal cell carcinoma: is it able to predict different cancer-specific survival probability? Urology 2004 Jun;63(6):1050. PubMed
- Stephenson AJ, Hakimi AA, Snyder ME et al. Complications of radical and partial nephrectomy in a large contemporary cohort. J Urol 2004 Jan;171:130. PubMed
- Kunath F, Schmidt S, Krabbe LM, Miernik A, Dahm P, Cleves A, Walther M, Kroeger N. Partial nephrectomy versus radical nephrectomy for clinical localised renal masses. Cochrane Database Syst Rev. 2017 May 9;5(5):CD012045. pubmed.ncbi.nlm.nih.gov
- Thoroddsen A, Gudbjartsson T, Jonsson E, et al. Operative mortality after nephrectomy for renal cell carcinoma. Scand J Urol Nephrol 2003 Nov;37:507. PubMed
- Bissada NK, Yakout HH, Babanouri Aet al. Long-term experience with management of renal cell carcinoma involving the inferior vena cava. Urology 2003 Jan;61:89. PubMed
- Jocham D, Richter A, Hoffmann L et al. Adjuvant autologous renal tumor vaccine and risk of tumor progressionin patents with renal-cell carcinoma after radical nephrectomy:phase III, randomized controlled trial. Lancet 2004 Feb 21; 363:594. PubMed
- Leibovich BC, Han KR, Pantuck AJ et al. Scoring algorithm to predict survival after nephrectomy and immunotherapy in patients with metastatic renal cell carcinoma.Cancer 2003 Dec 15; 98:2566. PubMed
- Swanson DA. Surgery for metastases of renal cell carcinoma. Scand J Surg 2004; 93:150. PubMed
- Motzer RJ. Renal cell carcinoma: a priority malignancy for development and study of novel therapies. J Clin Oncol 2003; 21: 1193-4. PubMed
- Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356: 125-134. PubMed
- Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373:1803-13. PMID: 1510665 PubMed
- Powles T, Albiges L, Staehler M et al. Updated European Association of Urology Guidelines Recommendations for the Treatment of First-line Metastatic Clear Cell Renal Cancer. Eur Urol 2017 Dec 7. pmid:29223605 PubMed
- Childs R, Chernoff A, Contentin N, et al. Regression of metastatic renal-cell carcinoma after nonmyeloablative allogeneic peripheral-blood stem-cell transplantation. N Engl J Med 2000; 343: 750-8. New England Journal of Medicine
- Srinivasan R, Barrett J, Childs R. Allogeneic stem cell transplantation as immunotherapy for nonhematological cancers. Semin Oncol 2004; 31: 47-55. pubmed.ncbi.nlm.nih.gov
- Motzer RJ, Mazumdar M, Bacik J, Berg W, Amsterdam A, Ferrara J. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17: 2530-40. PubMed
- Motzer RJ, Bacik J, Schwartz LH, et al. Prognostic factors for survival in previously treated patients with metastatic renal cell carcinoma. J Clin Oncol 2004; 22: 454-63. PubMed
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Dirk Nonhoff, Dr. med., Facharzt für Allgemeinmedizin, Köln
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).