Zusammenfassung
- Definition:Der systemische Lupus erythematodes (SLE) ist eine chronische, in Schüben verlaufende Autoimmunerkrankung. Es können praktisch alle Organe in unterschiedlichem Schweregrad betroffen sein. Klinisches Bild, Verlauf und Prognose sind ausgesprochen variabel.
- Prävalenz:Sie beträgt in Deutschland etwa 40/100.000, das Verhältnis Frauen zu Männer liegt etwa bei 9:1.
- Symptome:Die Erkrankung kann alle Organsysteme betreffen. Neben Allgemeinsymptomen wie Abgeschlagenheit und Fieber betrifft die Symptomatik vor allem Gelenke, Haut, Nieren und zentrales Nervensystem.
- Befunde:Neben den Veränderungen im Bereich der betroffenen Organsysteme werden hämatologische (Anämie, Leukozytopenie, Thrombozytopenie) und immunologische (verschiedene Autoantikörper) Befunde erhoben.
- Diagnostik:Anhand eines Klassifikationssystems, das klinische, hämatologische und immunologische Kriterien umfasst.
- Therapie:Allgemeinmaßnahmen wie Sonnenschutz und Impfschutz. Medikamentös mit Antimalariamitteln, Glukokortikoiden, Immunsuppressiva und Biologika.
Allgemeine Informationen
Definition
- Der systemische Lupus erythematodes (SLE) ist eine chronische, in Schüben verlaufende Autoimmunerkrankung.1
- Es können praktisch alle Organe in unterschiedlichem Schweregrad betroffen sein.
- Klinisches Bild, Verlauf und Prognose sind ausgesprochen variabel.
Problemstellung für Hausärzt*innen
- Insbesondere in der Frühphase der Erkrankung ist die Einordnung der komplexen Symptomatik häufig schwierig.2
- keine einzelnen pathognomonischen Befunde, Diagnosestellung daher durch eine Kombination aus klinischen und Laborkriterien3
- Gefahr der Konsultation verschiedener Fachdisziplinen durch die Patient*innen aufgrund einzelner Symptome2
- Erstellung vielfältiger Differenzialdiagnosen2
- Daher eher zunehmende Bedeutung der Primärversorger*innen in einem fragmentierten Gesundheitssystem4
- Rolle der Hausärzt*innen5-6
- möglichst frühe (Verdachts-)Diagnose
- Behandlung und Verlaufskontrolle bei leichter Erkrankung
- Erkennung von Warnzeichen und Komplikationen mit Überweisung an Rheumatologie
- begleitende Verlaufskontrolle/Behandlung in Zusammenarbeit mit Rheumatolog*innen bei Patient*innen mit mäßiger bis schwerer Erkrankung
Häufigkeit
- Prävalenz
- Prävalenz in Deutschland ca. 40 pro 100.000 Einw.2
- Geschlechtsverteilung
- Frauen zu Männern ca. 9:17
- Vor allem Frauen im gebärfähigen Alter sind betroffen.
- Ethnische Unterschiede
- häufiger bei Menschen afroamerikanischer und hispanischer Herkunft8-9
- Manifestationsalter
- Auftreten in allen Altersstufen möglich, häufigste Manifestation zwischen 15. und 35. Lebensjahr10
- Kinder
Ätiologie und Pathogenese
Ätiologie
- Die Ätiologie des SLE ist unbekannt.
Pathogenese
- Die genauen pathogenetischen Mechanismen der Erkrankung sind immer noch unklar.13
- Chronische Autoimmunerkrankung, die nahezu alle Organe und Gewebe betreffen kann.
- Umweltfaktoren in Kombination mit genetischer Prädisposition führen zu einer Aufhebung der immunologischen Toleranz gegen körpereigene Antigene.13
- Eine Immunreaktion gegen Antigene des Zellkerns ist charakteristisch für SLE.14
- Produktion von Autoantikörpern durch autoreaktive Lymphozyten15
- Zirkulierende Autoantikörper lösen gemeinsam mit Komplementfaktoren, autoreaktiven T-Zellen und Zytokinen über eine Immunkomplexreaktion eine lokale und/oder systemische Entzündung aus10
- Autoantikörper können bereits Jahre vor Ausbruch der Erkrankung vorliegen, sodass wahrscheinlich eine multifaktorielle Pathogenese vorliegt.7,16
Prädisponierende Faktoren
- Zahlreiche genetische Faktoren spielen bei der Krankheitsentstehung eine Rolle.17
- gehäuftes familiäres Auftreten18
- Sonnenempfindliche Haut
- UV-Strahlung kann die Erkrankung auslösen bzw. verschlechtern.19-20
- Erhöhte Östrogen- und erniedrigte Testosteronspiegel tragen zur veränderten Immunantwort bei.14
- gehäuft bei oraler Kontrazeption und Hormonersatztherapie4
- Schwangerschaft kann zum Aufflammen der Erkrankung führen.21
- Tendenziell erhöhtes Risiko für Raucher*innen20
- Uneinheitliche Daten u. a. für Lösungsmittel, Pestizide, Schwermetalle, Luftverunreinigungen, Impfungen, Infektionen als prädisponierende Faktoren4
- Alkoholkonsum verringert das Erkrankungsrisiko.20
ICPC-2
- L88 Rheumatoide Arthritis/Rheuma
- L99 Andere Muskuloskelet. Erkrankung
ICD-10
- M32 Systemischer Lupus erythematodes (SLE)
- M32.0 Arzneimittelinduzierter systemischer Lupus erythematodes
- M32.1 Systemischer Lupus erythematodes mit Beteiligung von Organen oder Organsystemen
- M32.8 Sonstige Formen des systemischen Lupus erythematodes
- M32.9 Systemischer Lupus erythematodes, nicht näher bezeichnet
Diagnostik
Neue EULAR/ACR-Klassifikationskriterien
- 2019 Einführung neuer Klassifikations-Kriterien von EULAR (European League Against Rheumatism) und ACR (American College of Rheumatology)22
- Neben dem primären Zweck der Klassifizierung für Studien sollen die neuen Kriterien auch eine frühere Diagnose eines SLE erleichtern.23
- Die neuen EULAR/ACR-Kriterien weisen im Vergleich zu früheren Klassifikationen eine verbesserte Genauigkeit bei der Erkennung eines SLE auf.
- EULAR/ACR (2019): Sensitivität 98 %, Spezifität 96 %22
- SLICC-Klassifikation (2012): Sensitivität 97 %, Spezifität 90 %24
- ACR-Klassifikation (1982, revidiert 1997): Sensitivität 85 %, Spezifität 95 %25
- Die einzelnen Kriterien werden dabei im Unterschied zu den bisherigen Klassifikationen unterschiedlich stark gewichtet.
- Beispiel: Eine histologisch festgestellte Nierenentzündung wird stärker gewichtet als ein nicht erklärtes Fieber.24
Eingangskriterium positive antinukleäre Antikörper (ANA)
- Voraussetzung für eine mögliche Klassifikation als SLE ist ein erhöhter ANA-Titer > 1:80.
- Praktisch alle Patient*innen mit SLE haben erhöhte ANA-Titer.
- Allerdings gibt es einen ANA-Nachweis auch bei vielen gesunden Personen.
Klinische Domänen und Kriterien
- Allgemeinsymptome
- Fieber (2 Punkte)
- Haut
- nicht-vernarbende Alopezie (2 Punkte)
- orale Ulzerationen (2 Punkte)
- subakuter kutaner oder diskoider Lupus (4 Punkte)
- akuter kutaner Lupus (6 Punkte)
- Arthritis
- Synovitis in mindestens 2 Gelenken oder Druckschmerz in mindestens 2 Gelenken oder Morgensteifigkeit > 30 min (6 Punkte)
- Neurologie
- Delir (2 Punkte)
- Psychose (3 Punkte)
- Krampfanfälle (5 Punkte)
- Serositis
- Pleura- oder Perikarderguss (5 Punkte)
- akute Perikarditis (6 Punkte)
- Hämatologie
- Leukopenie (3 Punkte)
- Thrombopenie (4 Punkte)
- Autoimmunhämolyse (4 Punkte)
- Niere
- Proteinurie > 0,5 g/24 h (4 Punkte)
- Lupus-Nephritis-Klasse II oder V (Histologie) (8 Punkte)
- Lupus-Nephritis-Klasse III oder IV (Histologie) (10 Punkte)
Immunologische Domäne und Kriterien
- Antiphospholipid-AK
- Anti-Cardiolipin-IgG > 40 GPL oder Anti-Beta2GP1-IgG > 40 E oder Nachweis Lupusantikoagulanz (2 Punkte)
- Komplementproteine
- niedriges C3 oder niedriges C4 (3 Punkte)
- niedriges C3 und niedriges C4 (4 Punkte)
- Hochspezifische AK
- Anti-dsDNA-AK (6 Punkte)
- Anti-Sm-AK (6 Punkte)
Beurteilung
- Für die Klassifikation als SLE müssen mindestens 10 Punkte erzielt werden (zusätzlich zum Eingangskriterium erhöhter ANA-Titer).
- Wichtig bei der Beurteilung
- Kriterien dürfen nur gezählt werden, wenn es dafür keine bessere Erklärung gibt.
- Der einmalige Nachweis eines Kriteriums ist ausreichend.
- Der Zeitpunkt des Nachweises eines Kriteriums muss nicht gleichzeitig zum Nachweis eines anderen Kriteriums liegen.
- Für die Klassifikation als SLE ist der Nachweis mindestens eines Kriteriums aus einer klinischen Domäne notwendig.
- Wenn Patient*innen positiv für mehr als ein Kriterium einer Domäne sind, wird nur das Kriterium mit der höchsten Punktzahl gewertet.
Differenzialdiagnosen
- Autoimmunerkrankungen
- Nephrologische Erkrankungen
- Neurologische Erkrankungen
- Psychiatrische Erkrankungen
- Chronisches Erschöpfungssyndrom
- Fibromyalgie
- Hämatologische Krankheiten
- Hauterkrankungen
- Infektionen
Vom SLE abzugrenzende Formen des Lupus erythematodes
- Kutaner Lupus erythematodes (CLE)26
- Im Gegensatz zum SLE ist der kutane Lupus erythematodes primär auf die Haut begrenzt.
- Einteilung des CLE in 4 Untertypen:
- akuter kutaner Lupus erythematodes (ACLE)
- subakuter kutaner Lupus erythematodes (SCLE)
- chronisch kutaner Lupus erythematodes (CCLE) mit 3 Unterformen:
- diskoider Lupus erythematodes (DLE; häufigste Form des CCLE)
- Lupus erythematodes profundus (LEP)
- Chilblain Lupus erythematodes (CHLE).
- intermittierend kutaner Lupus erythematodes (ICLE).
- Übergang des kutanen Lupus erythematodes in einen SLE27
- ACLE häufig
- SCLE ca. 10–15 %
- DLE < 5 %
- Die übrigen Untertypen sind sehr selten.
- Medikamenteninduzierter Lupus erythematodes
- Lupusähnliche Erkrankung, die Wochen bis Jahre nach Beginn einer Medikation auftritt.28
- Männer und Frauen sind gleich häufig betroffen.29
- Meistens 1 oder mehrere Symptome wie:29
- Arthralgie ca. 90 % (häufig einziges Symptom)
- Myalgie ca. 50 %
- Hautausschlag ca. 25 % (erythematöse Effloreszenzen, typischerweise an sonnenexponierten Stellen)
- Lymphknotenschwellung < 25 %
- Fieber
- Müdigkeit.
- Eine Beteiligung von ZNS und Nieren ist selten.
- Es gibt zahlreiche auslösende Medikamente:29-30
- Hydralazin
- Procainamid
- Chinidin
- Isoniazid
- Diltiazem
- Minocyklin
- Carbamazepin
- TNF-Alpha-Blocker
- Interferon-Alpha
- u. a.
- Rückbildung der Symptome innerhalb von Tagen bis Monaten nach dem Absetzen der auslösenden Medikamente
- Neonataler Lupus31
- Auslösung durch plazentare Passage von Antikörpern (Anti-Ro/SSA, Anti-LA/SSB) schwangerer Lupus-Patientinnen32
- Nur 1–2 % der Kinder von Müttern mit positiven Antikörpern entwickeln einen neonatalen Lupus.33
- klinisches Bild
- Hautausschlag (Entwicklung in den Tagen bis Wochen nach der Geburt)
- Anämie/Leukozytopenie/Thrombozytopenie
- Veränderungen der Leberwerte
- AV-Blockierungen (bis zu AV-Block III)
- Rückbildung innerhalb der ersten Lebenswochen bis -monate
- Auslösung durch plazentare Passage von Antikörpern (Anti-Ro/SSA, Anti-LA/SSB) schwangerer Lupus-Patientinnen32
Anamnese
- Allgemein gilt:
- Die Symptomatik ist individuell sehr unterschiedlich.
- Es gibt viele unspezifische Symptome, die auch bei anderen Erkrankungen vorkommen.
- Auch der Krankheitsbeginn ist von plötzlich bis schleichend sehr variabel.
- Schwere Organstörungen zu Beginn sind selten.
- Mögliche Symptome24-25
- Allgemeinsymptome
- Fatigue: Müdigkeit, Erschöpfung, Schwäche
- eines der häufigsten Probleme im klinischen Alltag10
- Fieber
- Unter Lupus-assoziiertem Fieber leiden 36–86 % der SLE- Patient*innen.34
- Gewichtsverlust
- Fatigue: Müdigkeit, Erschöpfung, Schwäche
- neuropsychiatrische Symptome
- Kopfschmerzen
- Krampfanfälle
- Parästhesien
- Depression
- kognitive Störungen
- Haut
- rötliche, runde Effloreszenzen
- Schmetterlingserythem (über Nasenrücken und Wangen)
- Photosensibilität
- Haarausfall
- Lymphknoten
- Vergrößerung
- Gelenke
- Arthralgien
- Schwellungen
- Muskulatur
- Myalgien
- Nieren
- Thorakale Beschwerden
- Mund
- orale Schleimhautläsionen
- Mundtrockenheit
- Magen-Darmtrakt
- Augen
- Blut
- Blässe
- Blutungsneigung
- Infektanfälligkeit
- Gefäße
- Symptome eines Raynaud-Syndroms
- Allgemeinsymptome
Klinische Untersuchung
- Merke: Es gibt keine spezifischen Muster der Organbeteiligung beim SLE!4
- Haut
- am häufigsten Veränderungen des akuten kutanen Lupus erythematodes (ACLE)2
- Schmetterlingserythem: symmetrische Rötung an Nase und Wangen
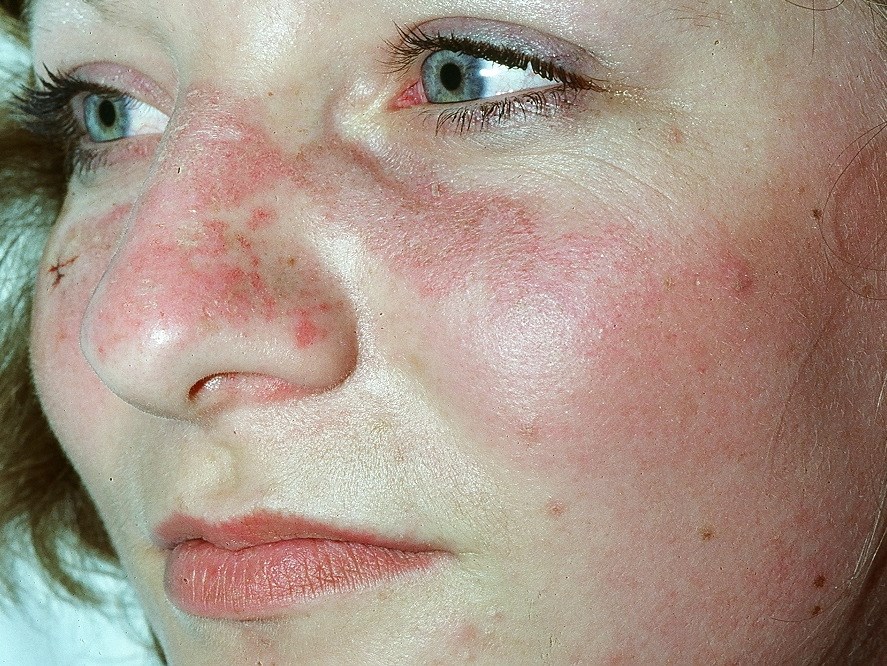 Schmetterlingserythem bei SLE
Schmetterlingserythem bei SLE - generalisiertes, makulopapulöses Exanthem
- Schmetterlingserythem: symmetrische Rötung an Nase und Wangen
- am zweithäufigsten Veränderungen des diskoiden Lupus erythematodes2
- entzündliche erythematöse Plaques mit follikulären Hyperkeratosen und Vernarbung
- Haarausfall
- allgemeine Blässe (bei Anämie)
- Raynaud-Phänomen an den Händen
- Schleimhaut
- orale Erosionen/Ulzerationen
- Gelenke
- Zeichen der Arthritis: Rötung, Schwellung, Druckschmerz, Funktionseinschränkung
- evtl. Gelenkdeformationen, v. a. der Fingergelenke: Jaccoud-Arthropathie2
- häufig symmetrisch und polyartikulär25
- Prädilektion für kleinere Gelenke25
- häufig MCP- und PIP-Gelenke (ähnlich der rheumatoiden Arthritis)
- Zeichen der Arthritis: Rötung, Schwellung, Druckschmerz, Funktionseinschränkung
- Zentrales Nervensystem
- Paresen, Sensibilitätsstörungen, Koordinationsstörungen, Sehstörungen, Hirnnervenausfälle
- Zeichen einer peripheren Neuropathie
- Lymphknoten
- Augen
- Rötung
- Pleura
- pleuritisches Reiben
- gedämpfter Klopfschall, abgeschwächtes Atemgeräusch bei Pleuraerguss
- Perikard
- perikarditisches Reiben
Häufigkeit von Symptomen/Befunden zu Erkrankungsbeginn und im weiteren Verlauf
- Erstvorstellung in der Hausarztpraxis häufig mit leichteren Beschwerden der Gelenke und der Haut4
- Vom praktischen Standpunkt aus sollte vor allem bei jungen Frauen mit Arthritis/Arthralgie an einen SLE gedacht werden, da dies häufig die Erstmanifestation darstellt.4
- Häufigkeit von Symptomen/Befunden bei Erkrankungsbeginn30
- Arthritiden, Arthralgien: 50 %
- Hautbefall: 20 %
- Serositis: 5 %
- Fieber: 5 %
- Zunächst muss eine Infektion ausgeschlossen werden, SLE als Ursache des Fiebers stellt eine Ausschlussdiagnose dar.34
- Müdigkeit: 5 %
- Nephritis: 5 %
- Lymphknotenvergrößerung: 5 %
- Häufigkeit von Symptomen/Befunden im weiteren Verlauf2
- Arthralgien/Myalgien: 90 %
- Hautveränderungen: 75 %
- Nierenbeteiligung: 50 %
- Pleuritis: 40–60 %
- ZNS-Manifestationen: 15–50 %
Ergänzende Untersuchungen in der Hausarztpraxis
Screeninglabor bei klinischem Verdacht auf SLE2
- Differenzialblutbild
- Anämie, Leukopenie, Thrombozytopenie charakteristisch bei SLE
- BSG
- erhöhte BSG charakteristisch bei SLE
- CRP
- in der Regel normal bis leicht erhöht
- Kreatinin, eGFR
- Urinstatus inkl. Sediment
- Antinukleäre Antikörper (ANA) (HEp-2 Zelltest mit Angabe des Fluoreszenzmusters)
-
- Gemäß der neuen EULAR/ACR-Kriterien sind positive ANA Voraussetzung für eine Klassifikation als SLE!
Weiterführende Diagnostik bei pathologischem Screeninglabor2
- Weitere ANA-Differenzierung (vor allem Anti-Sm, Anti-Ro/SSA, Anti-La/SSB, Anti-U1RNP-Antikörper)
- Anti-Sm spezifisch für SLE, Prävalenz 14–40 %
- Anti-dsDNA-Antikörper
- spezifisch für SLE, Prävalenz 70–98 %
- Komplement C3, C4
- Antiphospholipid-Antikörper
- 24-Stunden-Sammelurin (bei Eiweiß im Urinstatus), alternativ: Protein/Kreatinin-Ratio im Spoturin (siehe auch Artikel Proteinurie)
- Untersuchung auf dysmorphe Erythrozyten im Urinsediment
- Leberenzyme, LDH
- CK bei Muskelbeschwerden
Diagnostik bei Spezialist*innen
- Eine weitere Diagnostik bei Spezialist*innen ist abhängig von einer Organbeteiligung.2
- Haut/Mundschleimhaut
- Biopsie: Histologie, ggf. Immunfluoreszenz
- Gelenke
- konventionelles Röntgen
- Arthrosonografie
- Magnetresonanztomografie (MRT)
- Muskel
- Elektromyografie
- MRT
- Muskelbiopsie
- Niere
- Sonografie
- Nierenbiopsie
- Lunge
- Röntgenthorax
- hochauflösende Computertomografie des Thorax (HR-CT)
- Lungenfunktionsdiagnostik mit Messung der Diffusionskapazität
- bronchoalveoläre Lavage
- Herz
- Echokardiografie
- Myokardszintigrafie
- kardiales MRT
- Herzkatheteruntersuchung
- Auge
- Fundoskopie/spezielle Untersuchungen unter Antimalariamitteln
- zentrales und peripheres Nervensystem
- Elektroenzephalografie (EEG)
- MRT
- CT
- Liquordiagnostik
- transkranieller Doppler
- Angiografie
- neuropsychiatrische Untersuchung
- Messung der Nervenleitgeschwindigkeit
- Haut/Mundschleimhaut
Indikationen zur Überweisung
- Bei klinischem und laborchemischem V. a. SLE: Überweisung an Rheumatologie für Bestätigung/Ausschluss der Diagnose
- Derzeit ist allerdings kein verlässlicher und validierter Algorithmus zur Beurteilung der Dringlichkeit einer fachrheumatologischen Abklärung verfügbar.4
- Sofern Anamnese und Untersuchung keinen eindeutigen Hinweis auf klinische Manifestation eines SLE ergeben und laborchemisch nur ein geringer ANA-Anstieg auffällig ist:4
- Eine primäre Verlaufskontrolle in der Hausarztpraxis ist sinnvoll nach einer Aufklärung über die Warnsymptome.
- Bei manifestem SLE: Behandlung und Nachsorge in enger Zusammenarbeit mit Rheumatolog*innen, Internist*innen, Neurolog*innen und Dermatolog*innen. Bei Schwangeren sollten zudem Gynäkolog*innen eingebunden sein.
Therapie
Therapieziele
Übergeordnete Therapieziele35-37
- Sicherung des langfristigen Überlebens
- Verhinderung von Organschäden
- Optimierung der gesundheitsbezogenen Lebensqualität
Treat-to-Target-Strategie (T2T)
- Ähnlich wie bei der rheumatoiden Arthritis geht auch beim SLE die Entwicklung in Richtung einer „Treat-to-target (T2T)"-Strategie, aufgrund der Komplexität der Erkrankung ist der T2T-Ansatz beim SLE aber schwieriger umzusetzen.36-38
- Um die übergeordneten Therapieziele zu verwirklichen, sollten folgende unmittelbaren Therapieziele angestrebt werden:36-38
- Remission
- Zustand niedriger Krankheitsaktivität, falls Remission nicht erzielbar
- Aktivitätsbeurteilung anhand eines validierten Lupus-Aktivitätsindex (z. B. SLEDAI) und/oder organspezifischer Marker
- Gleichzeitig aber Ziel einer möglichst niedrigen Glukokortikoiddosis, um Nebenwirkungen/Komplikationen der Kortikoidtherapie zu vermeiden.
Allgemeines zur Therapie
- In den vergangenen Jahren Veröffentlichung diverser Leitlinien zur Behandlung des SLE35-36,39-42
- allerdings nur relativ wenig wissenschaftliche Evidenz durch randomisierte Studien2
- Therapie beruht auf:
- Allgemeinmaßnahmen
- medikamentöser Therapie
- NSAR
- Antimalariamittel
- Kortikoide
- Immunsuppressiva (Cyclophosphamid, Methothrexat, Azathioprin, Ciclosporin, Mycophenolat)
- Biologika (Belumimab, Rituximab)
- Die Behandlung sollte gemäß dem Prinzip der partizipativen Entscheidungsfindung festgelegt werden.23
Allgemeinmaßnahmen, die bei SLE-Patient*innen empfohlen werden
- Lichtschutz
- Rauchstopp
- Gewichtskontrolle
- Körperliche Aktivität
- Physikalische Therapie
- Impfungen
Lichtschutz
Rauchstopp
- Studiendaten nicht konsistent, die meisten Studien weisen auf eine Reduktion des SLE-Risikos durch Nikotinverzicht hin.4
- Verminderung der Wirksamkeit von Antimalariamitteln durch Rauchen2
Gewichtskontrolle
- Wahrscheinlich günstig für die Langzeitprognose39
Körperliche Aktivität
- Günstige Wirkung auf:
Physikalische Therapie
- Örtliche Kälteanwendungen bei Gelenkschmerzen und -entzündungen44
- Krankengymnastische Übungen zur Förderung der Gelenkbeweglichkeit44
- Atemtherapie zur Verbesserung der Thoraxbeweglichkeit und Minderung der Infektionsgefahr44
Impfungen
- Auffrischung des Impfschutzes der Patient*innen bei der Erstkonsultation, einschließlich Pneumokokkenimpfung
- Lebendimpfstoffe sind kontraindiziert unter immunsuppressiver Behandlung (einschl. Prednisolon-Dosen > 20 mg/d).4
- Lebendimpfungen sollten daher vor Beginn einer Immunsuppression durchgeführt werden (z. B. Rötelnimpfung für Schutz in späterer Schwangerschaft)23
- Jährliche Grippeschutzimpfung
Medikamentöse Therapie
NSAR
- Können für einen begrenzten Zeitraum bei Patient*innen mit geringem Risiko für NSAR-assoziierte Komplikationen eingesetzt werden.39
- Einsatz vor allem bei Arthralgien, Myalgien, Serositiden, Kopfschmerzen
Antimalariamittel
- Bei allen Patient*innen mit SLE ist eine Therapie mit Hydroxychloroquin empfohlen (sofern keine Kontraindikation)!35
- Therapieadhärenz kann durch Blutspiegelbestimmung kontrolliert werden, dies sollte aber in Abstimmung mit den Patient*innen erfolgen.23
- Wirkung vor allem auf Arthralgien, Hautveränderungen, Haarausfall, Ulzerationen7
- Langfristiger Nutzen45
- Verhinderung von Schüben
- Verbesserung des Langzeitüberlebens
- Schutz vor irreversiblen Organschäden
- Verringerung des Thrombose- und Osteoporoserisikos
- Hauptnebenwirkungen: Retinopathie, Verdauungsbeschwerden, Ausschlag, Myalgien, Kopfschmerzen
- Interaktionen: Protonenpumpenblocker können die Wirksamkeit von Hydroxychloroquin herabsetzen.2
- wichtig auch bei einer Begleitmedikation mit NSAR
Glukokortikoide
- Topische Therapie
- Systemische Glukokortikoide
- wirksam bei praktisch allen SLE-Manifestationen
- Ziel ist ein möglichst kurzfristiger Einsatz bis zur Wirkung der Antimalariamittel.2
- Der Einsatz sollte weitgehend auf Akutbehandlungen (Schübe) eingeschränkt werden.23
- Bei längerfristig notwendiger Gabe sollte die Dosis auf maximal 5 (bis 7,5) mg/d beschränkt und im Verlauf möglichst ausgeschlichen werden.35-38
Immunsuppressiva
- Immunsuppressiva sollen eingesetzt werden35,23
- bei unzureichendem Therapieerfolg mit Hydroxychloroquin (alleine oder mit Glukokortikoiden).
- wenn die Glukokortokoiddosis bei längerfristiger Gabe nicht in einen akzeptablen Bereich von maximal 5 (bis 7,5) mg/d reduziert werden kann.
- zur initialen Behandlung schwerer Verläufe mit drohender Organschädigung.
- Empfohlene Substanzen sind:35
- Methotrexat47
- Azathioprin
- Mycophenolat
- Cyclosporin (v. a. bei hämatologischer Beteiligung).
- Cyclophosphamid soll eingesetzt werden bei schwerem, organ- oder lebensbedrohendem SLE sowie als „Rescue-Therapie" bei Versagen anderer Immunsuppressiva.35
Biologika
Belimumab
- Belimumab ist ein monoklonaler Antikörper gegen das B-Lymphozyten-Stimulator-Protein BLyS.48-49
- Derzeit einziges zugelassenes Biologikum für die Behandlung des SLE23
- Einsatz empfohlen als Zusatztherapie bei Patient*innen mit klinisch und serologisch aktivem SLE trotz einer individuell angepassten Standardtherapie (Hydroxychloroquin und Glukokortikoide ohne oder mit Immunsuppressiva)35,50
- Signifikanter Effekt auch auf Fatigue10
- Bei Lupusnephritis und/oder ZNS-Beteiligung nicht empfohlen50-51
- Applikation i. v., seit 2017 auch s. c.23
- Nebenwirkung: erhöhtes Risiko für Depression und Suizidalität (Rote-Hand-Brief vom 27.03.19)
Rituximab
- Wirksamkeit bei schweren Fällen in Fallberichten und Real-Life-Kohorten, allerdings primärer Endpunkt in Zulassungsstudie verfehlt52
- Option (off label) bei schwerer, organbedrohender Erkrankung refraktär gegen Immunsuppressiva35,40-41
Weitere Therapien
- Plasmapherese
- Immunglobuline (IVIG)
- bei schwerer Thrombozytopenie35
Optimierte Grundversorgung – BASIC
- Ein einfaches Konzept, das die wichtigsten Maßnahmen zur Immunmodulation sowie Prävention von Komorbiditäten umfasst, ist das sog. BASIC-Schema:23,37
- Bone: Knochenschutz durch Vitamin-D-Gabe (20.000 IU/Woche bei erniedrigtem 25OH-VitD)
- Antimalariamittel: Hydroxychloroquin (200 mg/d, sofern keine Kontraindikationen)
- Sonnenschutz: Lichtschutzfaktor 50+
- Impfungen: Standard + Influenza/Pneumokokken
- Cardiovaskuläres Risiko: Risikofaktoren identifizieren und modifizieren.
- Zudem sollten Patient*innen mit Proteinurie einen ACE-Hemmer oder Angiotensin-Antagonisten erhalten.23,37
Spezielle Probleme
Lupus-Nephritis
- Klinisch manifeste Nierenbeteiligung bei ca. 50 % der Patient*innen41,55
- histologische Nierenveränderungen bei nahezu allen Betroffenen55
- Indikationsstellung zur Nierenbiopsie bei Hinweis auf Nierenbeteiligung, insbesondere:56-57
- Proteinurie von ≥ 0,5 g/d (bzw. Protein-Kreatinin-Ratio ≥ 500 mg/g) – und/oder –
- anderweitig unerklärter Abfall der eGFR.
- Indikation zur immunsuppressiven Therapie sollte auf der Basis des Ergebnisses einer Nierenbiopsie erfolgen.56
- Zur Induktionstherapie können Mycophenolat, Cyclophosphamid und Tacrolimus (in Kombination mit Glukokortikoiden) verwendet werden, zur Erhaltungstherapie auch Azathioprin.5657,59-60
- Rituximab Option bei refraktärer Erkrankung56
- Hydroxychloroquin als Basismedikation bei allen Patient*innen mit Lupus-Nephritis empfohlen56
Erkrankung des zentralen Nervensystems
- ZNS-Beteiligung bei 15–50 % der Patient*innen55
- Klinisch sehr variabel und daher häufig schwierig zu diagnostizieren.
- häufigere Manifestationen: zerebrovaskuläre Erkrankung, Krampfanfälle40
- seltenere Manifestationen: schwere kognitive Dysfunktionen, schwere Depression, akute Verwirrtheitszustände, periphere Neuropathie40
- seltene Manifestationen: Psychosen, Myelitis, Chorea, aseptische Meningitis40
- Die diagnostischen Maßnahmen sind abhängig von der klinischen Manifestation: EEG, elektrophysiologische Untersuchung, Lumbalpunktion, neuropsychologische Tests, MRT.40
- Therapie
- Kortikosteroide und Immunsuppressiva zur Behandlung des entzündlichen Prozesses
- Thromboyztenaggregationshemmung/Antikoagulation bei zerebrovaskulären Thrombosen
- symptomatische Therapie mit z. B. antiepileptischen Medikamenten, Antidepressiva
Antiphospholipid-Syndrom
- Eine der wichtigsten Ursachen für erworbene Hyperkoagulabilität in der Bevölkerung55
- charakterisiert durch venöse, arterielle und mikrovaskuläre Thrombosen61
- In mehr als 50 % der Fälle isoliertes Syndrom, aber auch sekundär bei anderer autoimmuner Grunderkrankung
- 20–30 % der Patient*innen mit SLE weisen anhaltend erhöhte Antiphospholipid-AK auf.61
- Klinische Erscheinungsbilder sind u. a.:53
- Schwangerschaftskomplikationen (Fehlgeburten, Präeklampsie)
- ZNS: Sinusvenenthrombose, Schlaganfall/TIA
- Herz/Lunge: Myokardinfarkt, Lungenarterienembolie
- Auge: Thrombose der Netzhautarterien/-venen
- gastrointestinal: Mesenterialischämie, Lebervenenthrombose, Milzinfarkt
- Niere: Nierenarterien-/Venenthrombose
- endokrinologisch: Nebenniereninfarkt
- Haut: digitale Gangrän.
- Primärprävention
- niedrigdosiertes ASS empfohlen bei SLE-Patient*innen mit Antiphospholipid-AK, insbesondere bei Hochrisikoprofil53
- Sekundärprävention
- dauerhafte orale Antikoagulation mit INR 2–3, nach arterieller Thrombose evtl. in Kombination mit ASS53
- keine NOAK zur Antikoagulation53
- dauerhafte orale Antikoagulation mit INR 2–3, nach arterieller Thrombose evtl. in Kombination mit ASS53
Schwangerschaft und Kontrazeption
Beratung vor der Schwangerschaft
- Alle Frauen mit SLE sollten über die Chancen für eine gut verlaufende Schwangerschaft und Möglichkeiten der Krankheitskontrolle, aber auch über Risiken und Komplikationen beraten werden.42
- Da der SLE keine eigentliche Erbkrankheit ist, sind Kinder von SLE-Patientinnen in der Regel gesund.
- Allerdings kann ein (reversibler) neonataler Lupus auftreten.
Fertilität
- Die Fertilität per se ist vermutlich durch den SLE nicht vermindert.42
- Einschränkungen der Fertilität können sich ergeben durch Einnahme von Immunsuppressiva, insbesondere Cyclophosphamid.42
Risikobeurteilung
- Schwangerschaften bei SLE sind Risikoschwangerschaften und bedürfen einer sorgfältigen Planung und Überwachung, verlaufen unter diesen Voraussetzungen dann aber häufig normal.
- Komplikationen nur in geringem Umfang bei Frauen mit stabiler leichter Erkrankung62
- Vor einer Schwangerschaft sollte die Erkrankung mindestens 6 Monate in Remission sein.44,63
- Risikofaktoren für Komplikationen in der Schwangerschaft42
- aktive Erkrankung/Schub
- Lupus-Nephritis
- Antiphospholipid-AK
- Hypertonie
- Glukokortikoidtherapie mit Erhaltungsdosis ≥ 10–20 mg/d Prednisolonäquivalent
- Risiken für die Mutter
- Eine Schwangerschaft kann die Krankheitsaktivität erhöhen, überwiegend aber nur leicht.39
- Risiko für Präeklampsie ist etwa 3-fach erhöht (insbesondere bei Lupusnephritis und Antiphospholipidantikörpern).64
- erhöhtes Thromboserisiko
- vor allem im Puerperium
- Risiken für das Kind
- Fehl- und Frühgeburten etwa doppelt so häufig wie bei gesunden Frauen44
- Wachstumshemmung
Therapie
- Die Therapie mit Hydroxychloroquin sollte fortgeführt werden.2
- niedrigere Krankheitsaktivität und weniger Schübe
- Auch in der Stillzeit kann Hydroxychloroquin gegeben werden.
- Der positive Effekt von Hydroxychloroquin auf Schubrate, Verlauf der Schwangerschaft und das Risiko eines kongenitalen AV-Blocks sollte den Patientinnen bekannt sein.64
- Glukokortikoide, Azathioprin, Ciclosporin A und Tacrolimus können zur Vermeidung oder Behandlung von Schüben verabreicht werden.42
Blutverdünnung bei Schwangerschaft mit Antiphospholipid-AK53
- Mit AK-Hochrisikoprofil, ohne anamnestische Schwangerschaftskomplikationen oder Thrombosen (venös/arteriell): Prophylaxe mit ASS empfohlen
- Nach Schwangerschaftskomplikationen, anamnestisch ohne Thrombosen (venös/arteriell): ASS plus Heparin in prophylaktischer Dosis
- Thrombosen (venös/arteriell) in der Anamnese: ASS plus Heparin in therapeutischer Dosierung
Kontrazeption
- Frauen mit SLE sollten über Möglichkeiten zur Kontrazeption beraten werden unter Berücksichtigung von Krankheitsaktivität und Thromboserisiko.42
- IUP können bei allen SLE-Patientinnen (ohne oder mit Antiphospholipid-AK) angewendet werden.42
- Bei stabiler/inaktiver Erkrankung und negativen Antiphospholipid-AK können Östrogen-/Gestagenpräparate erwogen werden.42,65
- Bei Frauen mit Antiphospholipid-AK muss das Risiko sorgfältig abgewogen werden, ggf. Verwendung von Gestagenpräparaten.42,66
Kardiovaskuläres Risiko
- Patient*innen mit SLE haben ein höheres Risiko für eine vorzeitige Atherosklerose.
- endothelialer und vaskulärer Schaden durch langdauernde entzündliche Aktivität7
- Das kardiovaskuläre Risiko ist 2-fach erhöht.2,67
- Während sich hochdosierte Glukokortikoide ungünstig auf das kardiovaskuläre Risikoprofil auswirken, wirken niedrigdosierte Glukokortikoide möglicherweise günstig auf die Atheroskleroseentwicklung.7,68
Verlauf, Komplikationen und Prognose
Komplikationen
- Erhöhtes Risiko für Komorbiditäten durch die Erkrankung selbst und/oder die Behandlung39
- Infektionen (Harnwegsinfektionen, andere Infektionen)
- Atherosklerose
- Hypertonie
- Dyslipidämie
- Diabetes mellitus
- Osteoporose
- Osteonekrose
- Malignome (besonders Non-Hodgkin-Lymphome)
- Verteilung von Komplikationen im zeitlichen Verlauf2
- in den ersten Jahren vor allem bakterielle Infektionen als Folge von Krankheitsaktivität und hohen Glukokortikoiddosen
- nach über 5-jähriger Krankheitsdauer überwiegend kardiovaskuläre Komplikationen2
Verlauf und Prognose
- Verlauf meist in Schüben
- zwischen den Schüben Phasen von Monaten bis Jahren mit geringer Aktivität44
- Interindividuell große Unterschiede im Krankheitsverlauf
- Spannbreite von nur leichten Symptomen mit schneller Remission bis hin zu fatalen Verläufen mit Organversagen und Tod
- Kein signifikanter Unterschied im klinischen Erscheinungsbild bei Frauen und Männern13
- bei Männern stärkere Krankheitsaktivität zum Zeitpunkt der Diagnose13
- Mit zunehmendem Alter im Allgemeinen milderer Krankheitsverlauf44
- Schübe seltener und schwächer
- Häufigkeit von Schäden in Follow-up-Studie nach 7 Jahren69
- 61 % klinisch nachweisbare Organschäden
- 21 % neuropsychiatrische Schäden
- 19 % Schäden des Bewegungsapparates
- 16 % Nierenschäden
- Durch die heutige Medikation haben sich die Kurz- und Langzeitprognose des SLE verbessert.2
- SLE-Patient*innen haben immer noch eine höhere Mortalität im Vergleich zur Normalpopulation, aber mit optimaler Behandlung heute liegt die 5-Jahres-Überlebensrate bei über 95 %.70
- Lebensqualität: 50–80 % der Patient*innen geben Fatigue als ein Hauptsymptom an.71
- Schmerzen und Depression während des Krankheitsverlaufs sind prädiktiv für die Entwicklung einer Fatigue.72
- Umgekehrt wirkt soziale Unterstützung protektiv.72
Verlaufskontrolle
- Die Kontrolluntersuchung ist abhängig vom Krankheitsverlauf.2
- generell alle 3–6 Monate, bei Lupus-Nephritis initial alle 2–4 Wochen in den ersten 2–4 Monaten
- Die Verlaufskontrolle sollte umfassen:2
- Anamnese (u. a. neue Symptome, Komedikation, Infektionen)
- körperliche Untersuchung
- Erfassen der Krankheitsaktivität mit einem standardisierten Score (z. B. SLEDAI)
- Labor
-
- Blutsenkungsgeschwindigkeit
- CRP (bei Verdacht auf Infektion oder Pleuritis)
- Blutbild, Differenzialblutbild
- Kreatinin
- Leberwerte
- Urinstatus, Protein/Kreatinin-Ratio
- Komplement C3, C4
- Anti-dsDNA-AK: Der intraindividuelle Verlauf gibt den Hinweis auf die Aktivität.
-
- Anstieg der Anti-dsDNA-Antikörper häufig schon mehrere Monate vor einem Schub, parallel zum Abfall von Komplement
- Höhe des ANA-Titers korreliert hingegen nicht mit der Aktivität des SLE!
- Augenkonsil bei Hydroxychloroquin und Chloroquin: sofern keine Risikofaktoren vorliegen, Untersuchung vor Therapiebeginn, nach 5 Jahren und dann jährlich35
- ggf. ergänzend apparative Diagnostik
- Eine regelmäßige Kommunikation des Verlaufs zwischen Hausärzt*innen und Rheumatolog*innen ist wünschenswert.73
Patienteninformationen
Patienteninformationen in Deximed
Patientenorganisationen
Illustrationen

Systemischer Lupus erythematodes
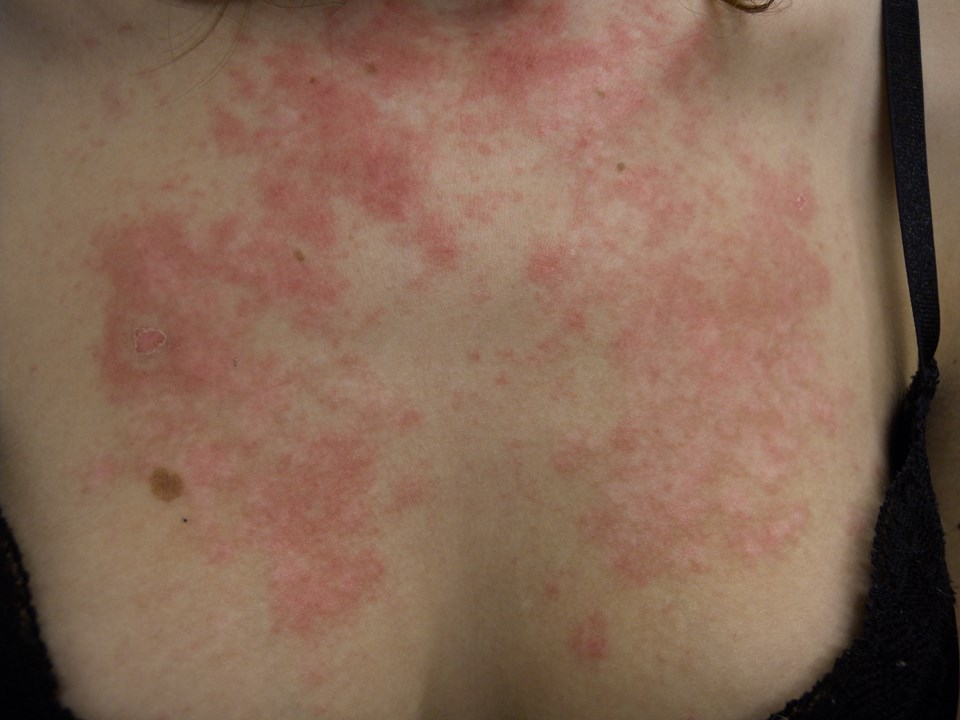
Systemischer Lupus erythematodes
Quellen
Leitlinien
- European League Against Rheumatism (EULAR). Update of the EULAR recommendations for the management of systemic lupus erythematosus. Stand 2019. www.eular.org
- European League Against Rheumatism (EULAR). Recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations. Stand 2010. www.eular.org
- European League Against Rheumatism (EULAR). Update of the recommendations for the management of lupus nephritis. Stand 2019. www.ard.bmj.com
- European League Against Rheumatism (EULAR). Recommendations for women's health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Stand 2017. www.eular.org
- T2T/SLE Working Group. Treat-to-target in systemic lupus erythematosus: recommendations from an international task force. Stand 2014. www.ard.bmj.com
Literatur
- Tsokos GC. Systemic lupus erythematosus. N Engl J Med 2011; 365: 2110-21. pmid:22129255. PubMed
- Kuhn A, Bonsmann G, Anders H-J, Herzer P, Tenbrock K, Schneider M. The Diagnosis and Treatment of Systemic Lupus Erythematosus. Dtsch Arztebl Int. 2015 Jun 19;112(25):423-32. www.ncbi.nlm.nih.gov
- Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997;40:1725. www.ncbi.nlm.nih.gov
- Gergianaki I, Bertsias G. Systemic Lupus Erythematosus in Primary Care: An Update and Practical Messages for the General Practitioner. Front Med (Lausanne) 2018; 5:161. www.ncbi.nlm.nih.gov
- Lam N, Ghetu M, Bieniek M. Systemic Lupus Erythematosus: Primary Care Approach to Diagnosis and Management. Am Fam Physician 2016; 94: 284- 294. www.aafp.org
- American College of Rheumatology Ad Hoc Committee on Systemic Lupus Erythematosus Guidelines. Guidelines for referral and management of systemic lupus erythematosus in adults. Arthritis Rheum. 1999; 42(9):1785-1796. www.ncbi.nlm.nih.gov
- D'Cruz DP. Systemic lupus erythematosus. BMJ 2006; 332: 890-4. PubMed
- Rees F, Doherty M, Grainge M, et al. The worldwide incidence and prevalence of systemic lupus erythematosus: a systematic review of epidemiological studies.. Rheumatology 2017; 56: 1945-1961. doi:10.1093/rheumatology/kex260 DOI
- Bartels C. Systemic Lupus Erythematosus (SLE). Medscpae, Updated: Nov 14, 2017. Zugriff 28.10.17. emedicine.medscape.com
- Schwarting A (Deutsche Gesellschaft für Innere Medizin). Systemischer Lupus erythematodes. e.Medpedia, Zugriff 15.08.20. www.springermedizin.de
- Groot N, Graeff N, Avcin T, et al. European evidence-based recommendations for diagnosis and treatment of childhood-onset systemic lupus erythematosus: the SHARE initiative. Ann Rheum Dis 2017 Nov; 76(11): 1788-1796. pmid:28630236 PubMed
- Tenbrock K, Horneff G. Systemischer Lupus erythematodes. Leitlinie der Gesellschaft für Kinder- und Jugendrheumatologie der Deutschen Gesellschaft für Kinder- und Jugendmedizin. AWMF-Nr. 027-061. Stand 2013. docplayer.org
- La Paglia G, Leone M, Lepri G, et al. One year in review 2017: systemic lupus erythematosus. Clin Exp Rheumatol 2017; 35: 551-561. pmid:28721860 PubMed
- Mok C, Lau S. Pathogenesis of systemic lupus erythematosus. J Clin Pathol 2003; 56: 481-490. www.ncbi.nlm.nih.gov
- Choi J, Kim S, Craft J. The Pathogenesis of Systemic Lupus Erythematosus – An Update. Curr Opin Immunol 2012; 24: 651-657. www.ncbi.nlm.nih.gov
- Arbuckle M, McClain M, Rubertone M, et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med 2003; 349: 1526-33. PubMed
- Ramos P, Brown E, Langefeld C. Genetic Factors Predisposing to Systemic Lupus Erythematosus and Lupus Nephritis. Semin Nephrol 2010; 30: 164-176. www.ncbi.nlm.nih.gov
- Moser, KL, Kelly, JA, Lessard CJ, Harley JB. Recent insights into the genetic basis of systemic lupus erythematosus. Genes Immun 2009; 10: 373-9. doi:10.1038/gene.2009.39 DOI
- Lehmann P, Homey B. Clinic and pathophysiology of photosensitivity in lupus erythematosus. Autoimmun Rev 2009; 8: 456-61. pmid:19167524 PubMed
- Bengtsson A, Rylander L, Hagmar L, et al. Risk factors for developing systemic lupus erythematosus: a case-control study in southern Sweden.. Rheumatology (Oxford) 2002; 41: 563-571. pmid:12011382 PubMed
- Doria A, Cutolo M, Ghirardello A, et al. Steroid hormones and disease activity during pregnancy in systemic lupus erythematosus. Arthritis Rheum 2002; 47: 202-9. pmid:11954015 PubMed
- Aringer M, Costenbader K, Daikh D, et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis & Rheumatology 2019; 71: 1400-1412. doi:10.1002/art.40930 DOI
- Mucke J, Fischer-Betz R, Schneider M. State of the Art: systemischer Lupus erythematodes. Z Rheumatol 2019; 78: 500-510. doi:10.1007/s00393-019-0633-8 DOI
- Neue Klassifikationskriterien für Lupus erythematodes Aerzteblatt.de, Freitag 07. September 2018. Zugriff 01.11.2018. www.aerzteblatt.de
- Vu Lam N-C, Ghetu MV, Bieniek ML. Systemic lupus erythematosus: Primary care approach to diagnosis and management. Am Fam Physician 2016 Aug 15; 94(4): 284-94. pmid:27548593 PubMed
- Okon LG, Werth VP. Cutaneous Lupus Erythematosus: Diagnosis and treatment. Best Pract Res Clin Rheumatol 2013; 27: 391-404. pmid:24238695 PubMed
- Unholzer A. Kutaner Lupus erythematodes: Symptome. Apotheken-Umschau online, aktualisiert am 05.01.17. Zugriff 02.11.18. www.apotheken-umschau.de
- Rubin RL. Drug-induced lupus. Expert Opin Drug Saf 2015; 14: 361-78. pmid:25554102 PubMed
- Kauffman C. Drug-induced lupus erythematosus. Medscape, updated: Jul 10, 2018. Zugriff 02.11.18. emedicine.medscape.com
- Rheumaliga Schweiz. Systemischer Lupus erythematosus. Zugriff 01.11.18. www.rheumaliga.ch
- Gluhovschi C, Gluhovschi G, Petrica L, et al. Pregnancy Associated with Systemic Lupus Erythematosus: Immune Tolerance in Pregnancy and Its Deficiency in Systemic Lupus Erythematosus--An Immunological Dilemma. J Immunol Res 2015. pmid:26090485 PubMed
- Hon K, Leung H. Neonatal Lupus Erythematosus. Autoimmune Diseases 2012; 2012: 1-6. www.ncbi.nlm.nih.gov
- Femia A. Neonatal and Pediatric Lupus Erythematosus. Medscape, updated: Jun 08, 2016. Zugriff 03.11.2018. emedicine.medscape.com
- Lorenz H, Pieterse L, Rüter T , et al. Fieber bei systemischem Lupus erythematodes: Krankheitsschub oder Infektion?. Z Rheumatol 2020; 79: 325-331. doi:10.1007/s00393-020-00773-8 DOI
- Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019;78:736–745. ard.bmj.com
- van Vollenhoven R, Mosca M, Bertsias G, et al. Treat-to-target in systemic lupus erythematosus: recommendations from an international task force. Ann Rheum Dis 2014; 73: 958-967. doi:10.1136/annrheumdis-2013-205139 DOI
- Mucke J, Düsing C, Chehab G, et al. Treat-to-Target beim systemischen Lupus erythematodes. Z Rheumatol 2020; 79: 351-358. doi:10.1007/s00393-020-00771-w DOI
- Aringer M, Leuchten N, Schneider M. Treat-to-Target bei systemischem Lupus erythematodes. Kompass Autoimmun 2020; 2: 45-51. doi:10.1159/000507644 DOI
- Bertsias G, Ioannidis J, Boletis J, et al. EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2008; 67: 195-205. doi:10.1136/ard.2007.070367 DOI
- Bertsias G, Ioannidis J, Aringer M, et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations. Ann Rheum Dis 2010; 69: 2074-2082. doi:10.1136/ard.2010.130476 DOI
- Bertsias G, Tektonidou M, Amoura Z, et al. Joint European League Against Rheumatism and European Renal Association–European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of adult and paediatric lupus nephritis. Ann Rheum Dis 2012; 71: 1771-1782. doi:10.1136/annrheumdis-2012-201940 DOI
- Andreoli L, Bertsias G, Agmon-Levin N, et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017; 76: 476-485. doi:10.1136/annrheumdis-2016-209770 DOI
- Carvalho MR, Sato EI, Tebexreni AS, Heidecher RT, Schenkman S, Neto TL. Effects of supervised cardiovascular training program on exercise tolerance, aerobic capacity, and quality of life in patients with systemic lupus erythematosus. Arthritis Rheum 2005; 53: 838-44. PubMed
- Berufsverband Deutscher Rheumatologen. Systemischer Lupus erythematodes. Zugriff 01.11.18. www.bdrh.de
- Ruiz-Irastorza G, Ramos-Casals M, Brito-Zeron P, Khamashta MA. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis 2010; 69: 20-8. PubMed
- Hannah J, Casian A, D'Cruz D. Tacrolimus use in lupus nephritis: A systematic review and meta-analysis. Autoimmun Rev 2015. pmid:26427983 PubMed
- Sakthiswary R, Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus. 2014 Mar;23(3):225-35. doi: 10.1177/0961203313519159. DOI
- Navarra SV, Guzmán RM, Gallacher AE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011; 377: 721-31. PubMed
- Furie R, Petri M, Zamani O, et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum 2011; 63: 3918-30. PubMed
- Deutsche Gesellschaft für Rheumatologie. Empfehlungen zum Einsatz von Belimumab beim Systemischen Lupus erythematodes. Zugriff 19.08.20. dgrh.de
- Srivastava A. Belimumab in Systemic Lupus Erythematosus. Indian J Dermatol 2016; 61: 550-553. www.e-ijd.org
- Hoyer B. Neue Therapien beim systemischen Lupus erythematodes. Z Rheumatol 2020; 79: 342-350. doi:10.1007/s00393-020-00788-1 DOI
- Lettau M, Schrezenmeier E, Specker C, et al. Lupus und Thrombophilie - Antiphospholipidsyndrom. Z Rheumatol 2020; 79: 332-341. doi:10.1007/s00393-020-00786-3 DOI
- Boser M, Kielstein J. Rolle von Plasmapherese und Immunadsorption in der Rescue-Therapie rheumatologischer Erkrankungen. Z Rheumatol 2016; 75: 964–972. doi:10.1007/s00393-016-0219-7 DOI
- Fischer-Betz R, Herzer P, Schneider M. Systemischer Lupus erythematodes. Dtsch Med Wochenschr 2005; 130: 2451-2458. doi:10.1055/s-2005-918589 DOI
- Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal Association– European Dialysis and Transplant Association (EULAR/ ERA–EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020;79:713–723. ard.bmj.com
- Muangchan C, van Vollenhoven RF, Bernatsky SR, et al. Treatment algorithms in systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2015. pmid:25777803 PubMed
- Weening J, D’Agati V, Schwartz M, et al. The Classification of Glomerulonephritis in Systemic Lupus Erythematosus Revisited. Kidney Int 2004; 65: 521–530. www.ncbi.nlm.nih.gov
- Henderson L, Masson P, Craig JC, Flanc RS, Roberts MA, Strippoli GFM, Webster AC. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews 2012, Issue 12. Art. No.: CD002922. DOI: 10.1002/14651858.CD002922.pub3. pubmed.ncbi.nlm.nih.gov
- Tunnicliffe DJ, Palmer SC, Henderson L, et al. Immunosuppressive treatment for proliferative lupus nephritis. Cochrane Database of Systematic Reviews 2018, Issue 6. Art. No.: CD002922. DOI: 10.1002/14651858.CD002922.pub4 DOI
- Garcia D, Erkan D. Diagnosis and Management of the Antiphospholipid Syndrome. N Engl J Med 2018; 378: 2010-2021. doi:10.1056/NEJMra1705454 DOI
- Buyon JP, Kim MY, Guerra MM, et al. Predictors of Pregnancy Outcomes in Patients With Lupus: A Cohort Study. Ann Intern Med 2015; 163: 153-63. pmid:26098843 PubMed
- Stojan G, Baer AN. Flares of systemic lupus erythematosus during pregnancy and the puerperium: prevention, diagnosis and management. Expert Rev Clin Immunol 2012; 8: 439-53. pmid:22882219 PubMed
- Fischer-Betz R, Haase I. Schwangerschaft bei Lupus erythematodes – ein Update. Z Rheumatol 2020; 79: 359-366. doi:10.1007/s00393-020-00772-9 DOI
- Petri M, Kim MY, Kalunian KC, et al.; OC-SELENA Trial. Combined oral contraceptives in women with systemic lupus erythematosus. N Engl J Med 2005; 353: 2550-8. New England Journal of Medicine
- ACOG Committee on Practice Bulletins-Gynecology. ACOG practice bulletin. No. 73: Use of hormonal contraception in women with coexisting medical conditions. Obstet Gynecol 2006; 107: 1453-72. PubMed
- Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum. (2013) 43:77–95. doi:10.1016/j.semarthrit.2012.12.002 DOI
- El-Magadmi M, Bodill H, Ahmad Y, Durrington PN, Mackness M, Walker M, et al. Systemic lupus erythematosus: an independent risk factor for endothelial dysfunction in women. Circulation 2004; 110: 399-404. PubMed
- Rivest C, Lew RA, Welsing PM, Sangha O, Wright EA, Roberts WN, et al. Association between clinical factors, socioeconomic status, and organ damage in recent onset systemic lupus erythematosus. J Rheumatol 2000;27:680-4. PubMed
- Yurkovich M, Vostretsova K, Chen W, Aviña-Zubieta JA. Overall and cause-specific mortality in patients with systemic lupus erythematosus: a meta-analysis of observational studies. Arthritis Care Res (Hoboken) 2014; 66: 608-16. pmid:24106157 PubMed
- Ahn G, Ramsey-Goldman R.. Fatigue in systemic lupus erythematosus. Int J Clin Rheumtol 2012; 7: 217-227. www.ncbi.nlm.nih.gov
- Jump RL, Robinson ME, Armstrong AE, Barnes EV, Kilbourn KM, Richards HB. Fatigue in systemic lupus erythematosus: contributions of disease activity, pain, depression, and perceived social support. J Rheumatol 2005; 32: 1699-705. PubMed
- Wallace D. Improving the prognosis of SLE without prescribing lupus drugs and the primary care paradox. Lupus 2008. doi:10.1177/0961203307086267 DOI
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Die ursprüngliche Version dieses Artikel basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).