Prüfungsrelevant für die Facharztprüfung Allgemeinmedizin1
Allgemeine Informationen
Definition
- Die International Association for the Study of Pain definiert Schmerz als „unangenehme sensorische und emotionale Empfindung, die mit einer tatsächlichen oder potenziellen Gewebeschädigung einhergeht oder wie eine solche Schädigung beschrieben wird“.
- Schmerzerleben setzt Bewusstsein und Aufmerksamkeit voraus und ist nie frei von emotionaler Tönung.
Biopsychosoziales Schmerzmodell
- Schmerz entsteht durch das Zusammenwirken biologischer und psychosozialer Faktoren.2 Dazu zählen z. B.:
- Nozizeption
- Aktivierung peripherer sensorischer Nerven durch eine Gewebeschädigung
- lokale und systemische metabolische Faktoren, z. B. auf der Ebene von:
- Entzündungsmediatoren
- Stresshormonen
- Immunsystem
- Endorphinsystem
- Endocannabinoidsystem.
- Schmerzmodulation im ZNS (Gate Control) durch:
- emotionale Faktoren
- Schmerzerwartung und -bewertung
- Konditionierung (Schmerzgedächtnis).
- Nozizeption
- Emotionale Faktoren können das Schmerzerleben auf zentralnervöser Ebene verstärken oder dominieren, z. B. Angst, Depression.
Akuter Schmerz2
- Ist eine fast tägliche Erfahrung.
- Dauert Sekunden bis einige Wochen.
- Ist in der Regel an erkennbare Auslöser, wie aversive und schädigende äußere Reize oder endogene Prozesse (z. B. Gelenküberdehnung, Entzündung), gekoppelt.
- Die Beendigung des exogenen Reizes oder das Abklingen der endogenen Störung geht einher mit dem Abklingen des Schmerzes.
Chronischer Schmerz2
- Hält länger an als die normale Remissionszeit der zugrunde liegenden Erkrankung.
- „Normale Remissionszeit“ ist nicht einheitlich definiert.
- Keine erkennbare Kopplung an Auslöser
- Erkennbare Schädigungen stehen in keiner proportionalen Beziehung zum erlebten Schmerz.
- Der Schmerz scheint sich im Laufe der Chronifizierung zu einer eigenständigen Krankheit zu entwickeln.
- Zeitliches Kriterium
- Chronischen Schmerz als Schmerz zu definieren, der länger als 3–6 Monate anhält, hat sich inzwischen weitgehend durchgesetzt.
Häufigkeit
Chronische Schmerzen3
- Prävalenz in Deutschland: ca. 17 %
- Die Prävalenz variiert je nach Ursache und Definition.
- Etwa jede 5. Person, die eine hausärztlichen Praxis aufsucht, leidet unter chronischen Schmerzen, meist in mehreren Körperregionen.4
- Besonders häufig sind chronische
- Schulterschmerzen und Nackenschmerzen (33–45 %)
- Rückenschmerzen (Lebenszeitprävalenz 27 %)
- davon etwa 13 % mit vorwiegend neuropathischem Anteil
- Gelenkschmerzen (19–28 %)
- Neuropathische Schmerzen machen etwa 7 % aller chronischen Schmerzerkrankungen aus.
- Ca. 13 % aller Patient*innen mit Diabetes mellitus haben Schmerzen infolge einer diabetischen Neuropathie.
- Ausgedehnte chronische Schmerzen liegen bei ca. 8 % der Bevölkerung vor. Näheres dazu in den Artikeln Fibromyalgie und Somatoforme Körperbeschwerden
Weitere häufige Schmerzsyndrome3
- Kopfschmerzen
- Bauchschmerzen
- Zahn- und Kieferschmerzen
- Halsschmerzen
- Schmerzen bei Malignomen
Schmerzarten
- Einteilung nach Pathomechanismen
- Je nach dominierender Schmerzform und der zugrunde liegenden Erkrankung oder Verletzung können sich die erforderlichen therapeutischen Maßnahmen stark unterscheiden.
- Folgende 3 Schmerzarten können entweder einzeln oder kombiniert auftreten:
- nozizeptiv: somatisch, viszeral
- neuropathisch
- somatoform.
Nozizeptive Schmerzen5
- Mechanische, chemische oder thermische Gewebeschädigung führt zu einer direkten Erregung der freien Nervenenden (Schmerzrezeptoren, Nozizeptoren).
- Die daraufhin freigesetzten Entzündungsmediatoren und Neuropeptide führen zu einer lokalen Hyperalgesie.
- Somatischer Schmerz
- Stammt aus Nozizeptoren in Haut, Bindegewebe, Muskulatur, Periost.
- Schmerzqualität: dumpf, bohrend, ziehend, stechend
- meist gut lokalisierbar
- Viszeraler Schmerz
- Stammt aus Nozizeptoren in Peritoneum, Muskulatur innerer Organe, Herz.
- Entsteht häufig durch Kompression, Dehnung, Infiltration.
- Schmerzqualität: dumpf, drückend, krampfartig
- eher schlecht lokalisierbar
- häufig Projektion auf Dermatome (übertragener Schmerz)
Neuropathische Schmerzen5
- Durch eine Schädigung peripherer oder zentraler neuronaler Strukturen kommt es zu einer gestörten Weiterleitung oder spontanen Entstehung von Schmerzreizen.
- Schmerzqualität: brennend, einschießend, „wie Stromstöße", ziehend, eher heller Charakter
- Begleitempfindungen: Dysasthesien, Parästhesien, Hyp- oder Hyperästhesien, Allodynie
- Formen
- periphere Neuropathien an peripheren Nerven, als Mono- oder Polyneuropathie, z. B.:
- Neuralgie: territorialer Schmerz im Versorgungsgebiet eines oder mehrerer Nerven oder eines Plexus, z. B.:
- Nervenkompressions-Schmerz, z. B.:
- Karpaltunnelsyndrom
- Radikulopathie, z. B. bei lumbalen Bandscheibenschäden
- zentral bedingte neuropathische Schmerzen, z. B. bei:
- Rückenmarksverletzungen oder -erkrankungen
- multipler Sklerose
- Parkinson-Syndrom.
- Deafferenzierungs- und Phantomschmerz
- durch vollständige oder teilweise Unterbrechung der Nervenleitung, z. B. Amputation
- überwiegend zentralvenöse Pathogenese mit pathologischen Umbauvorgängen auf spinaler und zerebraler Ebene (Neuroplastizität)
- Eine Deafferenzierungskomponente kann auch in anderen Schmerzformen enthalten sein, z. B. bei einer Radikulopathie mit partiellem Ausfall von Nervenfasern.
- komplexes regionales Schmerzsyndrom (CRPS): Neuropathie mit vorrangig vegetativer Begleitsymptomatik, z. B. nach Verletzungen
- Typ I ohne Läsion des Nervensystems
- Typ II mit Schädigung des Nervensystems (Kausalgie)
Noziplastische oder somatoforme Schmerzen
- Weitgehende Überschneidung der Konzepte „noziplastische“, „somatoforme“, „funktionelle“ oder „idiopathische“ Schmerzen.
- Noziplastischer Schmerz nach der Definition der IASP von 2017: „Schmerz, der aus einer veränderten Nozizeption hervorgeht, ohne eindeutigen Nachweis einer bestehenden oder drohenden und periphere Nozizeptoren aktivierenden Gewebeschädigung und ohne Nachweis einer schmerzverursachenden Erkrankung oder Schädigung des somatosensorischen Systems.“6
- Somatoform heißt, dass sich keine organische Ursache der Beschwerden finden lässt.
- Je mehr Schmerzorte beteiligt sind und je häufiger sie wechseln, desto höher ist die Wahrscheinlichkeit für einen hohen Anteil psychosozialer Faktoren bei der Schmerzentstehung.7
- Eine somatoforme Schmerzerkrankung ist ein eigenständiges Krankheitsbild, eine Unterform der somatoformen Störung.
- Patient*innen mit somatoformer Schmerzerkrankung stehen meist unter einem hohen Leidensdruck.
- Schmerzen können auch als dominierendes Symptom einer anderen psychischen Störung auftreten, z. B.:
- Die Schmerzwahrnehmung und -filterung im Gehirn – auch bei eindeutig nozizeptiver oder neuropathischer Schmerzursache – wird immer auch durch emotionale und kognitive Prozesse beeinflusst.2
- Die grobe klassifikatorische Trennung zwischen organisch und somatoform (noziplastisch) bedingten Schmerzen kann daher nur pragmatisch begründet werden.
- Bei allen Schmerzpatient*innen ist eine integrale, biopsychosoziale Sicht notwendig.
- Komplexe psychoneurologische Interaktionen spielen eine entscheidende Rolle bei der Schmerzchronifizierung.2
Diagnostische Schwierigkeiten
- Patient*innen, die über Schmerzen berichten, haben in aller Regel Schmerzen.
- Selten werden Schmerzen vorgetäuscht oder selbst induziert.
- etwa bei einem Münchhausen-Syndrom
- Aggraviert von den Patient*innen dargestellte Schmerzen, etwa bei einem Rentenbegehren, sind oft besonders schwer von Schmerzen hoher Intensität zu unterscheiden.
- Nicht alle Patient*innen, die Schmerzen haben, berichten darüber.
- Fehleinschätzungen sind z. B. bei beeinträchtigter Kognition und verbaler Kommunikation möglich, etwa infolge einer Demenz.
- Nonverbal können sich Schmerz und andere unangenehme Empfindungen, wie Angst, Hunger oder Übelkeit, ähnlich äußern.
- Bei Patient*innen mit Demenz können Schmerzen Verhaltensstörungen und psychische Symptome auslösen oder verstärken. Der Schmerz als zugrunde liegende Ursache wird dabei oft übersehen.
- Näheres dazu im Artikel Schmerzbewertung und -behandlung bei Demenz
- Verschiedene Schmerzursachen und Schmerzarten – nozizeptiv, neuropathisch, noziplastisch/somatoform – brauchen jeweils unterschiedliche Therapieansätze.
- Eine möglichst sorgfältige diagnostische Abklärung ist daher entscheidend für den Therapieerfolg.
ICPC-2
- A01 Schmerz generalisiert/mehrere Stellen
- N81 Verletzung Nervensystem, andere
- N94 Periphere Neuritis/Neuropathie
ICD-10
- Nach ICD-10-GM Version 20218
- F45.0 Somatisierungsstörung
- F45.4 Anhaltende Schmerzstörung
- F45.40 Anhaltende somatoforme Schmerzstörung
- F45.41 Chronische Schmerzstörung mit somatischen und psychischen Faktoren
- F45.4 Anhaltende Schmerzstörung
- R52 Schmerz, anderenorts nicht klassifiziert
- R52.0 Akuter Schmerz
- R52.1 Chronischer unbeeinflussbarer Schmerz
- R52.2 Sonstiger chronischer Schmerz
- R52.9 Schmerz, nicht näher bezeichnet
- G50–G59 Krankheiten von Nerven, Nervenwurzeln und Nervenplexus
- G60–G64 Polyneuropathien und sonstige Krankheiten des peripheren Nervensystems
- F45.0 Somatisierungsstörung
Differenzialdiagnosen
- Schmerzen sind immer als potenzielles Warnsignal vor abwendbaren Gefahren zu deuten4, z. B.:
- Malignität
- Entzündungsprozess
- Fraktur
- Infektion
- Nervenkompression
- Medikamentenüberdosierung.
Diagnostisches Vorgehen
- Der gesamte Abschnitt basiert auf diesen Referenzen.2,5
- Mehrfachuntersuchungen vermeiden: Vorbefunde einholen.
- Bei wiederkehrendem und lang anhaltendem Schmerz: Diagnostik interdisziplinär abstimmen.
- Grundlage der Diagnostik und der Zuordnung eines bestimmten Schmerztyps zu einem Schmerzmechanismus ist die umfangreiche Erhebung der Anamnese.
- Diese ist wichtiger als die körperliche Untersuchung und sehr viel wichtiger als apparative Zusatzuntersuchungen.
- Der von den Patient*innen empfundene Schmerz, dessen Charakter und Intensität korrelieren oft nicht mit dem Ausmaß der klinisch und apparativ befundeten Organschäden.
- Vorschnelle organmedizinische Kausaldiagnosen vermeiden.
- Sie können Patient*innen mit somatoformen Schmerzerkrankungen in ihrer Abwehrhaltung gegenüber psychosozialen Therapieansätzen bestärken und psychophysiologische Chronifizierungsmechanismen begünstigen.
Anamnese
- Der gesamte Abschnitt basiert auf dieser Referenz.5
Allgemeines
- Patient*in während des Gesprächs beobachten.
- Körperhaltung
- Passen Bewegungen, Mimik und Gestik zur Schmerzschilderung?
- Verändern sich Symptome in Momenten emotionaler Anspannung?
- Bei welchen Fragen kommt es zu emotionaler Bewegung?
- Wie schwingungsfähig ist die Patient*innen bei der Beschreibung negativer und positiver Erfahrungen?
Beschreibung der Schmerzen
Schmerzlokalisation
- Genaue Lokalisation und Ausstrahlung zeigen lassen.
- Evtl. in ein Körperschema einzeichnen lassen.
- An welcher Stelle sind die Schmerzen am schlimmsten?
- Neuralgien können in der Regel von den Betroffenen sehr exakt lokalisiert werden.
- Beim zentralen Thalamusschmerz wird entweder ein Körperquadrant oder eine Körperhälfte als schmerzhaft empfunden.
- Bei Wurzelkompressionssyndromen kommt es zur typischen Ausstrahlung in die Dermatome des Armes oder Beines.
- Es ist nicht immer das ganze Dermatom betroffen.
- Ausstrahlung kann z. B. nur bis in die Wade reichen.
- Überschreitungen der Dermatomgrenzen sprechen aber in der Regel für eine pseudoradikuläre Ausstrahlung, z. B. Piriformis-Reizsyndrom oder Arthrose der Wirbelgelenke.
- Beim CRPS (komplexes radikuläres Schmerzsyndrom) imponiert eine akrale Betonung der Symptome unabhängig vom Ort der primären Läsion.
- Bei sympathisch vermittelten Schmerzen kann der Schmerz eine ganze Extremität oder einen Körperquadranten erfassen.
- Schmerzen unterschiedlicher und wechselnder Lokalisation
- meistens somatoforme Schmerzerkrankung oder Depression
- gelegentlich Polyneuropathie oder Neuro-Borreliose
- Diffuse Multilokalisation des Schmerzes (Pananalgesie) ist ein charakteristisches Zeichen einer Chronifizierung.
Belastungsabhängig?
- Claudicatio intermittens bei PAVK: Schmerzlinderung beim Stehenbleiben („Schaufensterkrankheit“)
- Claudicatio spinalis bei Spinalstenose: Schmerzlinderung beim Setzen und bei Anteflexion
- Unspezifische Rückenschmerzen verbessern sich meist in Ruhe.
Schmerzdauer
- Intermittierender Schmerz
- Dauerschmerz?
- Kombination?
- Zahl der schmerzfreien Tage pro Monat?
- vor allem bei Kopfschmerzen ein entscheidendes Kriterium
- Bei typischer Neuralgie, z. B. des Trigeminus: nur Sekundenbruchteile dauernde Schmerzattacken (Tic Doloreux)
- Neurogene Läsionen: meist Dauerschmerz mit oder ohne
zusätzliche Attacken
Tageszeit
- Schmerzen im Rahmen entzündlicher und muskulärer Erkrankungen sind nachts häufig weniger quälend als am Tag (Entlastung).
- Bei neurogenen Schmerzen ist es umgekehrt.
- Nächtliche Schmerzmaxima im Bereich der Wirbelsäule können auch auf Tumoren oder Metastasen hinweisen.
Schmerzbeginn und -entwicklung
- Plötzlicher oder schleichender Beginn?
- Plötzliche oder allmähliche Verschlimmerung im Laufe der Jahre?
- Seit wann ist der Schmerz so stark wie jetzt?
- Allmähliche oder plötzliche Veränderungen der Schmerzqualität oder -lokalisation im Verlauf der Erkrankung?
- Eine plötzliche Veränderung der Schmerzqualität oder -Ausstrahlung kann ein Alarmzeichen für eine neu eingetretene, möglicherweise gefährliche Schmerzursache sein, z. B. Hirntumor, intrakranielle Blutung, Bandscheibenvorfall, lokale Infektionen, paraneoplastische Schmerzen.
- Neuralgien und Wurzelkompressionen
- meist plötzlich einsetzender, intensiver Schmerz
- Nichtspezifische Rückenschmerzen
- Nehmen meist allmählich und in Schüben zu.
- Schmerzbeginn liegt oft viele Jahre zurück und kann nach langjähriger Analgetikaeinnahme meist nicht mehr genau eruiert werden.
- Neurogene Schmerzen und Schmerzen im Rahmen einer Rücken- oder Tumorerkrankung
- Nehmen meist im Laufe der Zeit zu.
- Schubförmiger Verlauf mit allmählicher Verstärkung der Symptome – charakteristisch für Systemerkrankungen, z. B.:
- Kollagenosen
- Osteoporose.
- Frühere (Spontan-)Remissionen?
- wichtig zur Bewertung von Therapieerfolgen
Schmerzqualität
- Neuropathische Schmerzen, z. B.:
- einschießend
- heiß
- brennend
- empfindlich bei Berührung.
- Pochend-pulsierend, z. B.:
- Migräne
- entzündliche Schmerzen (z. B. Arthritis).
- Kribbelnde Par- oder Dysästhesien, z. B.:
- Polyneuritiden
- Polyneuropathien.
- Evozierbare Schmerzen: Schmerz schon bei leichter Berührung oder thermischen Reizen
- typisch für Post-Zoster-Neuralgie oder posttraumatische Neuralgie
Schmerzintensität
- Bekannter Schmerz als Vergleichsgröße, z. B. nach Zahnextraktion oder akuter Verletzung
- Numerische, visuelle oder verbale Analogskala von 0 bis 10
- Die Art der Skalierung ist zweitrangig.
- Auch eine grobe Einteilung von 0 = kein Schmerz bis 3 = sehr starker Schmerz hat sich in vielen Situationen bewährt.
Begleitsymptome
- Belastungsabhängig?
- Schmerzabhängig?
- Zeitlicher Zusammenhang mit Medikamenteneinnahme?
- Hinweise auf eine Systemerkrankung?
- internistisch (z. B. rheumatisch, Kollagenose)
- onkologisch (paraneoplastisch bedingte Schmerzen?)
- neurologisch (z. B. multiple Sklerose)
- psychisch (z. B. Depression)
- Können die Zuordnung der Schmerzen zu lokalisierbaren Läsionen erleichtern.
- Affektionen der Nervenwurzeln
- Reflexausfälle
- sensible Störungen
- Paresen
- Migräne
- Übelkeit und Erbrechen
- Lichtscheu
- Lärmempfindlichkeit
- Cluster-Kopfschmerz
- einseitige Ptose
- Lakrimation
- Rhinorrhö
- CRPS
- livide Verfärbungen der Haut
- Schwellung
- Kraftverlust
- charakteristische Störungen der Koordination
- Polyneuropathie
- verminderte Oberflächensensibilität
- Abnahme des Vibrationsempfindens
- Muskuläre und vertebragene Schmerzen
- Schon- und Ausweichhaltung mit speziellen Störungen der Statik: ISG-Blockierung bei kontralateraler Schulteraffektion
- Läsionsferne Symptome durch komplex gestörte Bewegungsabläufe
- z. B. Epicondylitis radialis durch die Benutzung von inadäquaten Unterarmgehstützen
- Allgemeine und vegetative Begleitsymptome
- Übelkeit, Erbrechen (Migräne)
- Schlafstörungen (z. B. Polyneuropathie, Tumorschmerz)
- Appetitlosigkeit (z. B. Malignomerkrankungen)
Vor- oder begleitende Erkrankungen
- Erkrankungen, die Schmerzen bedingen oder deren Verlauf beeinflussen können, sind z. B.:
- Diabetes mellitus
- Polyneuropathien
- maligne Erkrankungen
- endokrine Erkrankungen, z. B. Schilddrüsenfunktionsstörungen
- metabolische Erkrankungen, z. B. Dyslipidämie
- Autoimmunerkrankungen, z. B. rheumatoide Arthritis, Psoriasisarthritis, Kollagenosen
- Erkrankungen und Organinsuffizienzen sind bei der medikamentösen Therapie zu berücksichtigen als Kontraindikationen, oder weil sie eine Dosisanpassung oder prophylaktische Maßnahmen erforderlich machen. Zu den relevanten Erkrankungen und Funktionsstörungen zählen z. B.:
- Niereninsuffizienz
- Leberfunktionsstörungen
- Asthma
- Glaukom
- Prostatahyperplasie
- Obstipation
- Alkoholabhängigkeit oder andere Suchterkrankungen
Vorbehandlungen
- Alle bisher durchgeführten medikamentösen und nichtmedikamentösen Therapien und Reha-Maßnahmen erfragen.
- Erfolg oder Misserfolg?
- Medikamentenanamnese bei Patient*innen mit chronifizierten Schmerzen und häufigem Therapieversagen
- Welche anderen Medikamente wurden gleichzeitig genommen? (z. B. zur Schlafverbesserung, Beruhigung, Angst- oder Depressionstherapie)
Informationen zu den Patient*innen
Biografie und Beruf
- Grundsätzliches zur Biografie, persönlichen und beruflichen Entwicklung
- Soziale Auswirkungen der Erkrankung auf die Beziehung zu nahestehenden Personen.
- Positive Folgen der Krankheit?
- Aktivitäten in Beruf und Freizeit, die wegen der Erkrankung nicht mehr ausgeführt werden.
- Auswirkungen auf die berufliche und finanzielle Situation
- Vorzeitige Berentung?
- Gründe?
- AU, wie lange schon?
- Zahl der Fehltage wegen Schmerzen in den letzten 6 Monaten?
- Berufliche Tätigkeitsmerkmale
- körperliche und psychische Belastung
- Gefahren am Arbeitsplatz (z. B. durch Maschinen, Fahrzeuge)
- Arbeitsplatzprognose? (z. B. unbefristeter Arbeitsvertrag)
- Könnten die Patient*innen auch mit körperlichen Einschränkungen weiter beschäftigt werden?
- Bisherige Rehabilitations- und Wiedereingliederungsmaßnahmen: Erfolg oder Misserfolg?
- Arbeitslos: Wie lange schon, aus welchen Gründen?
- Laufende Renten- oder Entschädigungsverfahren?
- Schadenersatz nach Unfall?
- Rechtsstreit mit Vorbehandler*innen?
- Zusatzversicherungen, z. B. Arbeitsunfähigkeitsversicherung?
- Wurden die Patient*innen von dritter Seite in das Rentenverfahren gedrängt?
Krankheitskonzept und Heilungserwartung der Patient*innen
- „Was glauben Sie selbst: Was ist die Ursache Ihrer Schmerzen?“
- „Welchen Einfluss messen Sie körperlichen Belastungen zu?“
- „Welchen Einfluss messen Sie psychischen Belastungen zu?“
- Mithilfe welcher Quellen haben sich die Patient*innen ihre Meinung gebildet?
- Über die Verlässlichkeit verschiedener Quellen (z. B. Internet) aufklären.
- Unrealistisch hohe Heilungserwartungen korrelieren mit ungünstigeren Prognosen.
Standardisierte Fragebögen
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Können die Anamnese bei Schmerzpatient*innen ergänzen.
- Die folgenden Instrumente wurden für unterschiedliche diagnostische Schwerpunkte validiert und haben sich in der Praxis durchgesetzt:
- Pain Disability Index (PID)
- Strukturiertes Interview zum chronischen Schmerz (SICS)
- Online verfügbar unter www.hogrefe.com (Seite 68–73 des Dokuments)
- Schmerztagebuch über 1 Woche – Dokumentation von:
- Intensität (numerische Ratingskala: 1–10)
- Dauer
- Medikamente
- Aktivitäten
- Stimmung
- Beeinträchtigung.
- Ggf. ausführlichere manualisierte Testverfahren (Überweisung Schmerztherapie, Schmerzpsychotherapie).
Klinische Untersuchung
Leitlinie: Chronischer Schmerz4
- Spezifische Angaben zur klinischen Untersuchung siehe die Artikel zur jeweiligen schmerzverursachenden Erkrankung.
- Körperliche Untersuchung
- orientiert an Beschwerden einschließlich Begleitsymptomen (s. o.) und Voruntersuchungen
- Besonders zur diagnostischen Differenzierung zwischen nozizeptiven und neuropathischen Schmerzen ist je nach betroffenem Abschnitt des Nervensystems eine orientierende oder ausführlichere neurologische Untersuchung erforderlich.
- Sensibilitätsprüfungen (Berührung, Temperatur, Vibration)
- Reflexe
- Motorik (Kraft, Koordination)
- Hirnnervenfunktionen
- Verhaltensbeobachtung (z. B. Vermeidungsverhalten)
- Funktionstests (z. B. Bewegungsprüfung) zur Erhebung von Ausgangswerten für die Verlaufskontrolle
Ergänzende Untersuchungen
Labor
- Je nach zugrunde liegender Erkrankung; Näheres siehe die entsprechenden Artikel.
Bildgebung
Leitlinie: Bildgebung in der Diagnostik chronischer Schmerzen4
- Ist nicht regelhaft notwendig, sondern z. B. bei Verdacht auf:
- abwendbare gefährliche Verläufe (s. o.)
- eine Erkrankung, die u. U. einer invasiven Therapie bedarf, z. B. ein maligner Tumor.
- einen Krankheitsprozess im Gehirn oder Rückenmark.
Maßnahmen und Empfehlungen
Diagnostik bei Spezialist*innen
- Neurophysiologische Untersuchung
- Durch positiven Befund kann eine Neuropathie bewiesen werden.
- Ein negativer Befund schließt diese jedoch nicht aus.
- Hautbiopsie
- zur Früherkennung einer Nervenschädigung bei bestimmten neurologischen Erkrankungen, z. B. Small-Fiber-Neuropathie (Näheres siehe Artikel Periphere Neuropathien)
- bei positivem Befund evtl. auch zur Verlaufskontrolle
Indikationen zur Überweisung
- Bei Verdacht auf eine zugrunde liegende Systemerkrankung – Überweisung z. B. an:
- Neurolog*in
- Endokrinolog*in
- Rheumatolog*in
- Diabetolog*in
- Orthopäd*in.
- Wenn eine klare Differenzierung zwischen neuropathischen und nozizeptiven Schmerzen aufgrund des klinischen Bildes nicht gelingt (Neurologie).
- Bei fortgeschrittener Chronifizierung: Behandlung im interdisziplinären Team2
- verschiedene medizinische Fachrichtungen, z. B. Anästhesie und Neurologie
- Spezialist*in für psychische Erkrankungen
- ggf. Physiotherapeut*in
- evtl. Ergotherapeut*in
- Ggf. zur invasiven Diagnostik oder Therapie
Checkliste zur Überweisung
Schmerzen
- Zweck der Überweisung
- Diagnosesicherung?
- Therapie?
- Planung des weiteren Vorgehens im interdisziplinären Team?
- Anamnese
- Dauer und Verlauf? Progression?
- Lokalisation, Qualität und Intensität der Schmerzen?
- Ausstrahlung?
- Veränderung unter Belastung oder mit der Tageszeit?
- Begleitsymptome?
- Belastungsabhängig?
- Schmerzabhängig?
- Zeitlicher Zusammenhang mit Medikamenteneinnahme?
- Hinweise auf eine Systemerkrankung: onkologisch, neurologisch, endokrinologisch, rheumatisch, psychisch?
- Begleit- und Vorerkrankungen, somatisch und psychisch
- Vorbehandlungen
- medikamentös
- nichtmedikamentös
- Reha- und Wiedereingliederungsmaßnahmen
- biografische und berufliche Situation
- Auswirkungen der Schmerzerkrankung
- Renten- oder Entschädigungsverfahren?
- Perspektive?
-
- Ähnliche Beschwerden bei anderen Familienmitgliedern?
- evtl. mithilfe standardisierter Fragebögen erhobene Score-Werte
- Klinische Untersuchung
- Allgemeinzustand?
- neurologischer Status?
- Ergänzende Untersuchungen
- evtl. Bildgebung
- bei Verdacht auf Systemerkrankung
- entsprechende Laborbefunde
- ggf. weitere Befunde apparativer Untersuchungen
Indikationen zur Krankenhauseinweisung
- Vital bedrohliche Situation (Trauma, akute Dekompensation einer Organerkrankung)
- Bei chronischen Schmerzen zur Intensivierung von der:
- interdisziplinären Behandlung
- multimodalen Therapie
- Rehabilitation.
Therapeutische Grundprinzipien
- Der gesamte Abschnitt basiert auf diesen Referenzen.2,5
- Primär an Schmerzursache und -mechanismus orientiert (s. o.)
- Spezifischere Informationen zur Schmerztherapie siehe die entsprechenden Artikel zur schmerzverursachenden Grunderkrankung, z. B.:
- Neuropathische Schmerzen sprechen auf andere Therapieprinzipien an als nozizeptive Schmerzen; Näheres dazu im Artikel Neuropathische Schmerzen.
- Auch somatoforme Schmerzen erfordern eine andere Herangehensweise als nozizeptive Schmerzen.
- Siehe den Artikel Somatoforme Körperbeschwerden.
- Die meisten der folgenden Informationen beziehen sich auf Schmerzen mit überwiegend nozizeptivem Anteil.
- Alter und Komorbidität beachten.
- Bei älteren Menschen und Demenzkranken sind alters- und erkrankungsbedingte Besonderheiten zu berücksichtigen; Näheres dazu im Artikel Schmerzbewertung und Schmerzbehandlung bei Demenz.
- Oft ist eine Kombination von nichtmedikamentösen und medikamentösen Ansätzen angezeigt.
- Besonders bei chronischen Schmerzen: Möglichkeiten nichtmedikamentöser Maßnahmen ausschöpfen, bevor Medikamente verordnet werden.
- Bei akuten Schmerzen können als erste Maßnahme Medikamente erforderlich sein, um eine schnelle Schmerzlinderung zu erreichen.
- Eine aktive Beteiligung der Patient*innen fördert wichtige psychische Resilienzfaktoren.
- Eigenständigkeit
- Selbstwirksamkeitserfahrungen
Therapeutisches Vorgehen
Leitlinie: Therapiemanagement chronischer Schmerz4,9
- Individueller Behandlungsplan
- Ziele formulieren, gemeinsam mit den Patient*innen.
- Schmerzlinderung, z. B. 30 % Verbesserung auf der Analogskala
- Lebensqualität
- Funktion
- Stimmung
- Teilhabe am sozialen Leben, privat und beruflich
- Reduktion des Analgetikakonsums
- partizipative Entscheidungsfindung
- Mit den Patient*innen den möglichen Nutzen und Schaden einer Therapie, z. B. mit Opioiden, im Vergleich zu anderen medikamentösen Therapieoptionen sowie zu nichtmedikamentösen Behandlungsoptionen besprechen.
- Ziele formulieren, gemeinsam mit den Patient*innen.
- Strukturierte Patientenführung
- regelmäßige Termine zur Verlaufskontrolle und ggf. Therapieanpassung
Nichtmedikamentöse Verfahren
- Der gesamte Abschnitt basiert auf diesen Referenzen.2,5
- Aktivierende Maßnahmen, z. B. Gymnastik, Yoga, Pilates, Schwimmen
- Ggf. Funktionstraining: Physiotherapie, Ergotherapie
- Entlastende und ermutigende Gespräche
- Psychotherapie (z. B. Verhaltenstherapie, Hypnotherapie, Körperpsychotherapie, Tanz-/Musik-/Kunsttherapie)
- Entspannung und Stressreduktion (z. B. Muskelrelaxation nach Jacobson, autogenes Training, Mediation)
- Physikalische Therapien
- Kälte
- Wärme
- Bäder
- Reizbehandlungen (z. B. Akupunktur/Akupressur, Moxa, Reflexzonenmassage, Schröpfen, Blutegel)
- Massage und manuelle Therapie
- Radonanwendungen10
- Wirksamkeit am besten belegt bei entzündlichen und degenerativen Gelenkerkrankungen
- Elektro- und Magnettherapien
- Hinweise auf schmerztherapeutische Wirksamkeit, aber keine Beweise aus kontrollierten Studien
- Galvanisation (z. B. Stangerbäder)
- Iontophorese (z. B. mit Lokalanästhetika oder NSAR)
- Niederfrequenzströme (z. B. diadynamisch, TENS, invasive Elektrostimulationsverfahren)
- dynamische Magnetfeldtherapien
- Ernährung
- Übergewicht und Adipositas vermeiden/reduzieren.
- Einzige Maßnahme, die nachweislich den Verlauf der Arthrose positiv beeinflusst.
- Bekannte Migräneauslöser nicht komplett vermeiden, sondern sich schrittweise an kleine Mengen gewöhnen. Beispiele für Auslöser: Rotwein, Hartkäse, Bananen, Nitrat, Glutamat
- Übergewicht und Adipositas vermeiden/reduzieren.
- Weitere Maßnahmen
- Selbsthilfegruppen
- Rehabilitationsmaßnahmen: ambulant, (teil-)stationär
- Vermittlung sozialrechtliche Beratung (Rentenansprüche, Finanzhilfen etc.)
Pharmakotherapie
- Kriterien für die Arzneimittelauswahl:
- Schmerzursache
- Schmerzintensität
- Risiken
- Interaktionen
- Alter der behandelten Person berücksichtigen.
- Organfunktionseinschränkungen und Veränderungen im Metabolismus können besonders bei älteren Patient*innen zu veränderter Wirksamkeit und Verträglichkeit von Analgetika führen.
- Ggf. Nieren- und Leberfunktion prüfen.
- Individuelle Dosistitration
- Start low, go slow!
- Davon nur abweichen, wenn eine sofortige Schmerzlinderung bei sehr starken akuten Schmerzen notwendig ist.
- Regelmäßige Überwachung möglicher Nebenwirkungen
- Absetzversuch, wenn die Schmerzursache nicht mehr vorhanden ist.
- Opioide ausschleichend absetzen.
- Ausgangsdosis um 10 % pro Tag reduzieren.
- Das gilt auch für andere Analgetika nach längerer Behandlung.
- Opioide ausschleichend absetzen.
- Besonders bei anhaltenden Schmerzen:
- Retardierte Arzneiformen bevorzugen.
- Bedarfsmedikation
- schnell resorbierbare, kurz wirksame Präparate nur zum Abfangen akuter und starker Schmerzen und während der Eindosierungsphase
- evtl. zur Vermeidung schmerzbedingter Bewegungseinschränkungen, z. B. vor der Krankengymnastik oder dem Umlagern
- Wurde sie regelmäßig gebraucht, sollte sie nach Möglichkeit über eine Intensivierung der Dauertherapie wieder reduziert werden.
- Hohes Abhängigkeitspotenzial nichtretardierter Opioide beachten.
Nozizeptive Schmerzen
- WHO-Stufenschema
- Nicht-Opioide
- niedrigpotente Opioide
- hochpotente Opioide (mit Koanalgetika, vor allem bei neuropathischen Schmerzen)
- Sofern sie ausreichend wirksam sind, haben die meisten Medikamente der Stufe 1 Vorteile, z. B. hinsichtlich zentralnervöser Nebenwirkungen, aber je nach individuellem Risikoprofil können auch primär Opioide sinnvoll sein.5
- ei gleicher Wirksamkeit ist die nebenwirkungsärmere Therapie vorzuziehen.
- Man wird z. B. bei einer gastrointestinalen Blutungsanamnese schon von Beginn anstatt eines Antiphlogistikums ein Opioid bevorzugen, auch dann, wenn z. B. die Intensität oder Ätiologie der Schmerzen primär für die Gabe eines NSAR spricht.
Neuropathische Schmerzen
- 1. Wahl: Antikonvulsiva, Antidepressiva
- 2. Wahl: Lidocain- oder Capsaicin-Pflaster
- 3. Wahl: lang wirksame Opioide, Botulinumtoxin-Injektionen
Somatoforme (noziplastische) Schmerzen
- Ggf. Antidepressiva
- Keine Opioide!
- Das gilt generell für Schmerzen, die Symptom psychischer Störungen sind, z. B. somatoforme Schmerzstörung.
- Näheres siehe Artikel Somatoforme Körperbeschwerden.
Nichtopioide5
Paracetamol
- Bei leichten bis mittelschweren Schmerzen ohne entzündliche Genese
- Bei Patient*innen mit erhöhtem Ulkus- und Blutungsrisiko verträglicher als NSAR
- Nur zur kurzfristigen Behandlung geeignet
- Überdosierung vermeiden.
- häufigste Ursache für Arzneimittelintoxikationen
- Kritisch bei:
- Leber- und Nierenfunktionsstörungen
- Mangelernährung
- Dehydratation
- Alkoholabusus.
NSAR einschließlich COX-2-Hemmer und Acetylsalicylsäure
- Besonders bei entzündlicher Schmerzkomponente nur zur kurzfristgen Behandlung geeignet
- möglichst nicht länger als 7 Tage
- maximal 4 Wochen
- Niedrig dosieren, ggf. in Kombination mit anderen Schmerzmitteln.
- Wahrscheinlich die häufigste Ursache für Arzneimittel-Folgeerkrankungen
- Kritisch bei:
- erhöhtem kardiovaskulärem Risiko
- Gerinnungsstörungen
- eingeschränkter Nieren- oder Leberfunktion
- gastrointestinalen Ulzera.
- Leicht unterschiedliches Risikoprofil bei den einzelnen Substanzen11
- Das Herzinfarktrisiko scheint unter Diclofenac deutlich höher zu sein als unter Ibuprofen oder Naproxen.
- Das gastointestinale Risiko scheint unter Ibuprofen geringer zu sein als unter anderen klassischen NSAR.
- PPI reduzieren das Risiko für Magen-, nicht aber für Darmblutungen.
- Ab einer eGFR < 30 ml/min oder einem Serumkreatininwert > 2,5 mg/dl sollten weder NSAR noch COX-2-Hemmer verordnet werden.
- COX-2-Hemmer
- Celecoxib, Parecoxib, Etoricoxib
- Die zum Zeitpunkt der Entwicklung dieser Medikamente gehegte Hoffnung, sie seien grundsätzlich magen- oder darmfreundlicher als klassische NSAR, hat sich nicht in vollem Umfang erfüllt.
- Das Gesamtrisiko schwerwiegender Nebenwirkungen ist nicht niedriger als bei klassischen NSAR.
Metamizol5,12-13
- analgetische, antipyretische und spasmolytische, aber kaum antiphlogistische Wirkung
- Indikation
- Akute starke Schmerzen, die mit anderen Mitteln nicht verringert werden können.
- bislang kein Wirksamkeitsnachweis bei chronischen Schmerzen
- Außerhalb des zugelassenen Indikationsbereichs ist das Nutzen-/Risikoverhältnis negativ.
- Potenziell letale Nebenwirkungen
- Die Verordnungszahlen in Deutschland lagen im Jahr 1990 unter 20 Mio. Tagesdosen und stiegen bis 2012 auf über 140 Mio. an.
- Im selben Zeitraum stiegen die gemeldeten Agranulozytosefälle von etwa 10 auf über 50.
- 23,6 % der Agranulozytosen verliefen tödlich.
- Blutbild vor und innerhalb der ersten 7 Tage nach Beginn einer Metamizoltherapie
- Wiederholung: alle 1–3 Monate
- Aufklärung der behandelten Person und ggf. der Angehörigen und Pflegekräfte über Agranulozytose-Warnzeichen (sofort in ärztliche Behandlung begeben!):13
- Fieber
- Halsschmerzen
- entzündliche Schleimhautveränderungen.
- Vorsicht bei intravenöser Applikation
- Sehr langsam injizieren oder besser als Kurzinfusion über 30–45 min unter Blutdrucküberwachung.
- Die intramuskuläre Injektion (auch im Notfalldienst) ist obsolet.
Opioide5,9
- Sind vor allem für die Behandlung starker bis sehr starker Schmerzen geeignet.
- länger als 3 Monate nur nach primärem Ansprechen
- Nutzen und Schaden einer Therapie mit opioidhaltigen Analgetika im Vergleich zu anderen medikamentösen und nichtmedikamentösen Behandlungsoptionen mit den Patient*innen besprechen.
- Reevaluation bei Wirkungsabnahme:
- Krankheitsprogression?
- Toleranzentwicklung?
- Opioidbedingte Hyperalgesie?
- Fehlgebrauch, Missbrauch oder Substanzabhängigkeit?
- Ab einer bestimmten Dosis niedrig potenter Opioide nimmt durch weitere Dosiserhöhung nicht die analgetische Wirksamkeit weiter zu, sondern nur noch die Nebenwirkungen.
- Eine niedrige Dosis eines hochpotenten Opioids kann besser verträglich sein als eine hohe, vergleichbar analgetisch wirksame Dosis eines niedrigpotenten Opioids.
- Eine Kombination von niedrigpotenten (WHO Stufe 2) mit hochpotenten (WHO Stufe 3) Opioiden ist pharmakologisch nicht sinnvoll.
- Ist eine Bedarfsmedikation mit einem Opioid erforderlich, dann sollte dafür das Medikament gewählt werden, das bereits als Basismedikation eingesetzt wird.
- ggf. Änderung der Basismedikation
- Ist eine Bedarfsmedikation mit einem Opioid erforderlich, dann sollte dafür das Medikament gewählt werden, das bereits als Basismedikation eingesetzt wird.
- Bei der Auswahl eines opioidhaltigen Analgetikums und seiner Applikation berücksichtigen:
- Begleiterkrankungen
- Kontraindikationen für transdermale Systeme oder eine orale Einnahme
- Nebenwirkungsprofil des Opioids
- Präferenzen der behandelten Person.
Therapie nach Zeitplan
- Therapie nach einem festen Zeitplan, orientiert an der Wirkdauer des verwendeten Präparats
- Außer wenn starke Schmerzen schnell gelindert werden sollen, mit niedriger Startdosis beginnen.
- bei älteren und multimorbiden Patient*innen evtl. nur 25–50 % der üblichen Startdosis
- In Anpassung an die Schmerzsituation ggf. auftitrieren.
- Die notwendige Dosierung wird nur durch den Effekt und die Verträglichkeit aus Betroffenensicht bestimmt.
- 120 mg/d orales Morphinäquivalent nur in Ausnahmefällen überschreiten. Vorher prüfen: Indikation, andere Therapieoptionen, möglicher Missbrauch!
Beendigung eines Therapieversuches
- Die Therapie mit opioidhaltigen Analgetika sollte schrittweise beendet werden, wenn in der Einstellungsphase von maximal 12 Wochen
- die individuellen Therapieziele aus Sicht der betroffenen und/oder der behandelnden Person nicht erreicht werden oder
- wenn nicht ausreichend therapierbare oder nicht tolerierbare Nebenwirkungen auftreten.
Beendigung einer Therapie > 12 Wochen
- Die Therapie mit opioidhaltigen Analgetika sollte schrittweise beendet werden, wenn
- die individuellen Therapieziele nicht mehr erreicht werden.
- aus Sicht der betroffenen und/oder der behandelnden Person nicht ausreichend therapierbare oder nicht tolerierbare Nebenwirkungen auftreten.
- die individuellen Therapieziele durch andere medizinische Maßnahmen erreicht sind.
- die Patient*innen die rezeptierten opioidhaltigen Analgetika trotz Mitbehandlung durch Suchtspezialist*innen missbräuchlich verwenden.
Medikamentenpause
- Nach 6 Monaten Medikamentenpause erwägen.
- nach primärem Ansprechen
- Dosisreduktion und/oder Auslassversuch
Opioidrotation (Wechsel zu einem anderen Opioid)?
- Mögliche Indikationen
- inadäquate Analgesie
- opioidinduzierte Obstipation
- opioidinduzierte Hyperalgesie
- therapieresistente/r Übelkeit, Erbrechen, Müdigkeit, Harnverhalt, Juckreiz, Verwirrtheit, Halluzinationen sowie bei Hautreaktion auf Pflaster (TTS –transdermales therapeutisches System)
- Medikamenteninteraktionen oder Veränderungen der Leber- und/oder Nierenfunktion
- Siehe auch Umrechnungstabelle (Praxiswerkzeug Opioidrotation) der Leitlinie Langzeitanwendung von Opioiden bei chronischen nicht-tumorbedingten Schmerzen (LONTS).9
Opioidinduzierte Obstipation9,15
- Basismaßnahmen
- Anpassung des Ernährungs- und Trinkverhaltens
- reichlich körperliche Aktivität
- Laxanzienprophylaxe, ggf. über die gesamte Therapiedauer
- Opioidrotation?
- Änderung der Darreichungsform?
- Laxanzienklassen
- osmotisch wirksam: Macrogol als 1. Wahl
- antiresorptiv und sekretorisch, z. B. Natriumpicosulfat, Bisacodyl, Sennapräparate
- Kombination mit Opioid-Antagonist: z. B. Fixkombination Oxycodon und Naloxon max. 2 x 40 mg/20 mg pro Tag (Naloxon kann in höheren als den zugelassenen Dosierungen den analgetischen Effekt abschwächen)
- peripher wirksame Opioidantagonisten (PAMORA): Methylnaltrexon, Naldemedin, Naloxegol
- Näheres siehe Artikel Obstipation.
- Bei unzureichendem Ansprechen: Wechsel der Wirkstoffklasse oder Kombination von Laxanzien mit unterschiedlichem Wirkmechanismus
Übelkeit und Erbrechen
- Medikamentöse Prophylaxe von Anfang an
- Nach etwa 2–4 Wochen Indikation für Antiemese prüfen.
- Antiemetikaklassen9
- Antihistaminika, z. B. Diphenhydramin bis zu 50 mg alle 8 Stunden
- Neuroleptika, z. B. Haloperidol 0,2–1,0 mg oral alle 8 Stunden oder Levomepromazin 1–5 mg oral (Tropfen) alle 12 Stunden
- Prokinetika, z. B. Metoclopramid: 10 mg oral alle 4–6 Stunden (keine Daten zum Nutzen-Risiko-Verhältnis verfügbar; Stand März 2017) oder Domperidon 10 mg alle 8–12 Stunden (Domperidon wirkt nur auf die opioidinduzierte Magenentleerungsstörung, nicht auf die zentralnervös induzierte Übelkeit; cave: Verlängerung der QTc-Zeit mit Risiko Torsade de Pointes!).
- Setrone, z. B. Ondansetron 4–8 mg oral alle 12 Stunden
Atemdepression und Bronchospasmus
- Können durch folgende Maßnahmen vermieden werden:
Weitere Nebenwirkungen
- Blasenentleerungsstörungen
- Müdigkeit, Benommenheit, erhöhtes Sturzrisiko
- Verlangsamung kognitiver Funktionen
- Schlafstörungen (meist aber schlaffördernde Wirkung)
- Albträume
- Depression
- Sexuelle Funktionsstörungen
- Endrokrine Störungen
- Selten Verwirrtheitszustände, psychotische Symptome.
Psychische Auffälligkeiten
- Bei opioidassoziierten psychischen Auffälligkeiten erwägen:
- Dosisreduktion
- Opioidrotation
- Schrittweise absetzen.
Abhängigkeit
- Alle Opioide können zu körperlicher Abhängigkeit und Toleranzentwicklung führen.
Opioid-Kontraindikationen9
- Somatoforme Störungen
- Fibromyalgie
- Weitere somatoforme/funktionelle Erkrankungen, z. B. Reizdarmsyndrom
- Chronische Pankreatitis
- chronisch entzündliche Darmerkrankungen
- Weitere psychischen Störungen, vor allem bei hoher Krankheitsschwere oder wenn chronischer Schmerz das Leitsymptom ist.
- primäre Kopfschmerzerkrankungen wie:
- Suchterkrankungen, schädlicher Gebrauch
- Weitergabe von Medikamenten an unberechtigte Personen
- Unkontrollierte Medikamenteneinnahmen
- Fehlende Bereitschaft oder Unfähigkeit zur Einhaltung des Behandlungsplans
Entzugssyndrome
- Um Entzugssymptome zu vermeiden:
- Nicht abrupt absetzen, sondern langsam ausschleichen.
- „End of Dose Failure“ durch zu lange Dosierungsintervalle vermeiden.
- Retardierte Präparate bevorzugen.
- Nichtretardierte Opioide nur im Rahmen der Aufdosierungsphase und in Situationen, in denen eine schnelle Linderung akuter, starker Schmerzen nicht mit anderen Mitteln erreicht werden kann.
- Sehr schnell resorbierbare bukkale oder transnasale Applikationen sind ausschließlich bei Tumordurchbruchschmerzen vertretbar und außerhalb dieser Indikation nicht zugelassen.
Bei Toleranzentwicklung
- Ggf. Dosiserhöhung, Opioidwechsel oder suchtmedizinisch begleiteter Opioidentzug
Bei opioidinduzierter Hyperalgesie
- Schrittweise Opioidreduktion und/oder suchtmedizinisch begleiteter Opioidentzug
Transdermale Applikation5
- Nur indiziert, wenn eine stabile Schmerzsituation mit wenigen Schwankungen der Schmerzintensität besteht.
- Die transdermale Applikation ist im Prinzip eine parenterale Anwendung und erfordert eine entsprechend hohe Wachsamkeit hinsichtlich der Arzneimittelsicherheit.
- Auch nach Entfernen des Pflasters können erhöhte Serumkonzentrationen für 24–48 Stunden persistieren.
- Zusätzlich zu den opioidtypischen Nebenwirkungen können Hautreaktionen auftreten.
Weitere Substanzen
- Andere zentral wirksame Substanzen, z. B. Hypnotika und Tranquilizer
- Vor Beginn einer Opioidtherapie reduzieren oder absetzen.
Cannabinoide
- Wirkstoffe aus Cannabis sativa (Hanf)
- Δ9-Tetrahydrocannabinol (THC)
- Cannabidiol (CBD)16
- Laut einer Metaanalyse sprechen Studien moderater Qualität für die Wirksamkeit von Cannabinoiden bei chronischen Schmerzen.17
- In der Neufassung 2020 des von der BKK Mobil Oil unterstützten, an der Universität Bremen erarbeiteten Cannabis-Reports18 werden chronische Schmerzen wie bereits in der Vorversion von 2018 unter die denkbaren Indikationen für den Einsatz von Cannabinoiden gezählt. Einschränkend wird dort jedoch auf die umfassende Synthese klinischer Daten hingewiesen, aufgrund derer die im November 2019 publizierte britischen NICE-Leitlinie NG144Cannabinoide19 vom Einsatz der Cannabinoide zur Behandlung chronischer Schmerzen abrät, ausgenommen CBD im Rahmen klinischer Studien.
- Eine Metaanalyse der US-amerikanischen Fachgesellschaft für Neurologie (American Academy of Neurology, AAN)20 sowie weiterer systematische Metaanalysen kontrollierter Studien21-22 zeigen eine moderate, aber signifikante Schmerzreduktion
- unter Δ9-THC, teilweise in Kombination mit CBD, bei Patient*innen mit:
- zentralem Schmerz bei multipler Sklerose
- HIV-assoziierter sensorischer Neuropathie
- neuropathischen Schmerzen aufgrund anderer Nervenschädigungen.
- unter einem synthetischen Cannabinoid bei einem gemischten Kollektiv chronisch neuropathischer Schmerzpatient*innen.
- unter Δ9-THC, teilweise in Kombination mit CBD, bei Patient*innen mit:
- Zwei Studien bei Patient*innen mit diabetischer Neuropathie zeigten keinen signifikanten Unterschied zwischen den analgetischen Effekten von Δ9-THC/CBD und Placebo.23-24
- Welchen Stellenwert Cannabinoide in der Behandlung neuropathischer Schmerzen haben, ist kontrovers.
- Die Deutsche Gesellschaft für Neurologie kam in der zuletzt 2019 aktualisierten Version ihrer S2k-Leitlinie zur nicht interventionellen Therapie neuropathischer Schmerzen zu folgenden Schlussfolgerungen:25
- „Cannabinoide können zur Therapie neuropathischer
Schmerzen jeglicher Ursache nicht empfohlen werden, da ihr Effekt eher gering ausgeprägt ist und die Nebenwirkungsrate hoch ist." - „Nur in Einzelfällen kann bei Versagen anderer Schmerztherapien der Einsatz von Cannabinoiden als Off-Label-Therapie im Rahmen eines multimodalen Schmerztherapiekonzepts erwogen werden.“
- „Cannabinoide können zur Therapie neuropathischer
- Die Zeitschrift arznei-telegramm bewertet die Datenlage zur Wirksamkeit von Cannabinoiden bei chronischen einschließlich neuropathischer Schmerzen weniger positiv als die Autor*innen der oben zitierten Studien26 (Stand Oktober 2017).
- Die Deutsche Gesellschaft für Neurologie kam in der zuletzt 2019 aktualisierten Version ihrer S2k-Leitlinie zur nicht interventionellen Therapie neuropathischer Schmerzen zu folgenden Schlussfolgerungen:25
- In einer 2018 publizierten Meta-Metaanalyse waren 23 systematischen Metaanalysen zu Cannabinoiden in der Schmerztherapie berücksichtigt.27
- Insgesamt kamen die Autor*innen zu folgendem Schluss: „Es ist unsicher, ob Cannabinoide schmerzlindernd wirken und wenn überhaupt, dann auf neuropathische Schmerzen und wahrscheinlich mit geringem Nutzen."
- Näheres siehe Artikel Cannabinoid-haltige Arzneimittel.
Kombinationen
- NSAR + Paracetamol bei akuten Schmerzen28
- niedrig dosierte Komponenten als nebenwirkungsärmere Alternative zur jeweiligen höher dosierten Monotherapie
- z. B. Ibuprofen 200 mg + Paracetamol 500 mg
- Nicht länger als 3 Tage anwenden (Cave Nebenwirkungsverstärkung).
- Nichtopioid + Opioid
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Bedeutung psychosozialer Faktoren
- Aktive Bewältigungsstrategien
- Zu großzügige Krankschreibungen können schaden, indem sie Vermeidungsverhalten und Passivität verstärken.
- Beides kann die Chronifizierung der Schmerzen begünstigen.
- ggf. Gespräche mit den Angehörigen
- Wer Schmerzpatient*innen Arbeit abnimmt, fördert die Chronifizierung der Schmerzen.
- Zu großzügige Krankschreibungen können schaden, indem sie Vermeidungsverhalten und Passivität verstärken.
- Realistische Therapieziele definieren.
- Fahr- und Arbeitssicherheit mit Opioiden
- dokumentierte Aufklärung über Verkehrs- und arbeitsplatzrelevante Aspekte der Therapie vor Beginn einer Behandlung mit opioidhaltigen Analgetika
- Während der Dosisfindungsphase und bei Dosisänderungen nicht Auto fahren.
- Ähnliches gilt für berufliche Tätigkeiten mit unklarem oder erhöhten Gefährdungspotenzial.
- ggf. Rücksprache mit den zuständigen Arbeitsmediziner*innen/Betriebsärzt*innen
- Sozialmedizinische Beratungsangebote vermitteln.
- Örtliche Selbsthilfegruppen
Patienteninformationen in Deximed
- Schmerzen und Schmerztherapie
- Rückenschmerzen, akute
- Rückenschmerzen im Lendenbereich
- Ischiassyndrom, Bandscheibenvorfall
- Gelenkschmerzen in einem Gelenk
- Gelenkschmerzen in mehreren Gelenken
- Kopfschmerzen
- Unterleibsschmerzen, chronische bei Frauen
- Akute Flankenschmerzen
Ratgeber und Selbsthilfe
Ratgeber Schmerztherapie
- Bißwanger-Heim T: Schmerztherapie – Was tun, wenn der Schmerz nicht nachlässt? Berlin: Stiftung Warentest 2012
Patientenleitlinie
Fachgesellschaft
Patientenselbsthilfe
Illustrationen
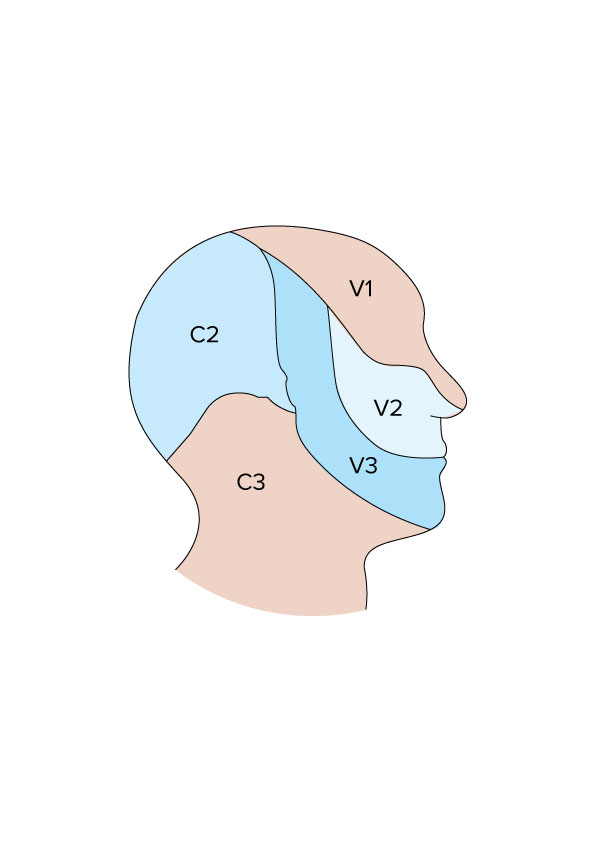
Kopf, Innervation
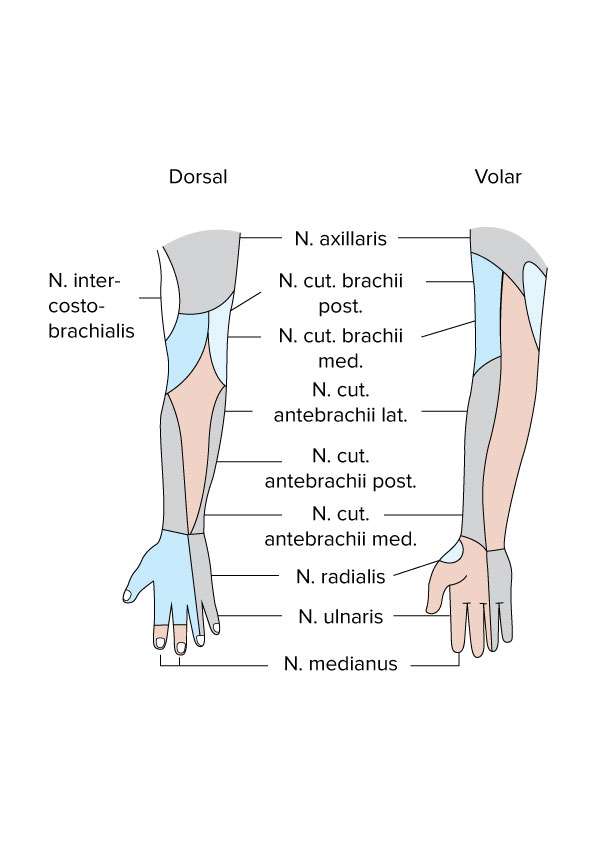
Arme, Innervation
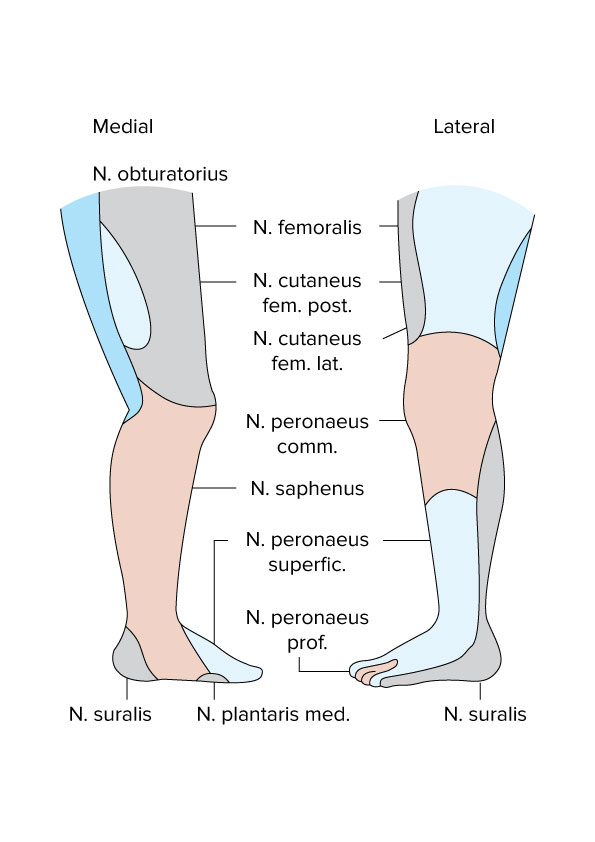
Beine, Innervation
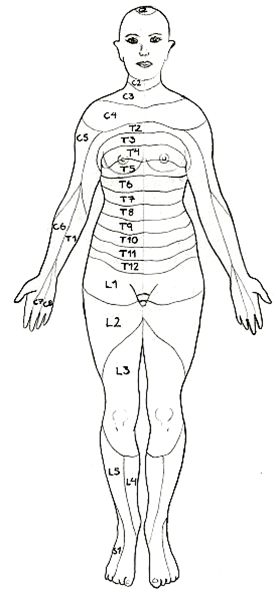
Dermatome, frontal
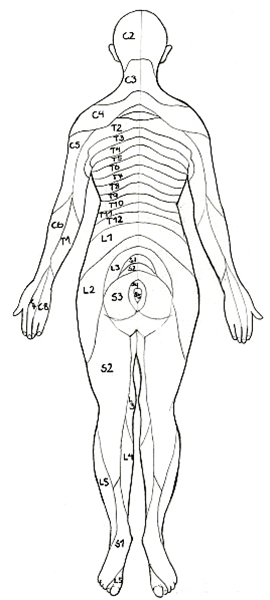
Dermatome, dorsal
Quellen
Leitlinien
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Chronischer Schmerz. AWMF-Leitlinie Nr. 053-036. S1, Stand 2013 (abgelaufen). www.awmf.org
- Deutsche Schmerzgesellschaft. Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS). AWMF-Leitlinie Nr. 145-003. S3, Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Neurologie. Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen. AWMF-Leitlinie Nr. 030-114. S2k, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin. Behandlung akuter perioperativer und posttraumatischer Schmerzen. AWMF-Leitlinie Nr. 001–025KF. S3, Konsultationsfassung vom 10.9.2021. www.awmf.org
Literatur
- Lohnstein M, Eras J, Hammerbacher C. Der Prüfungsguide Allgemeinmedizin - Aktualisierte und erweiterte 3. Auflage. Augsburg: Wißner-Verlag, 2018.
- Kröner-Herwig B, Frettlöh J, Klinger R, Nilges P (Hrsg) Schmerzpsychotherapie. Grundlagen – Diagnostik – Krankheitsbilder – Behandlung. Berlin, Heidelberg, New York, Tokio: Springer 2011
- Wolff R, Clar C, Lerch C, Kleijnen J. Epidemiologie von nicht tumorbedingten chronischen Schmerzen in Deutschland. Schmerz 2011; 25:26-44. PMID: 21336883 PubMed
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). S1-Leitlinie Chronischer Schmerz. AWMF-Leitlinie Nr. 053-036, Stand 2013 (abgelaufen). www.awmf.org
- Maier C, Bingel U, Diener HC, (Hrsg.): Schmerzmedizin: interdisziplinäre Diagnose- und Behandlungsstrategien. München: Elsevier, Urban & Fischer 2017.
- Aydede M, Shriver A. Recently introduced definition of "nociplastic pain" by the International Association for the Study of Pain needs better formulation. Pain 2018;159(6):1176-77. PubMed
- Häuser W, Pfingsten M: Chronische Schmerzen am Beispiel Rückenschmerz und Fibromyalgiesyndrom. In: Rief W, Henningsen P (Hrsg.): Psychosomatik und Verhaltensmedizin. Stuttgart: Schattauer 2015; S. 531-547.
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2021. Stand 18.09.2020 (letzter Zugriff 09.12.2021). www.dimdi.de
- Deutsche Schmerzgesellschaft. Langzeitanwendung von Opioiden bei nicht tumorbedingten Schmerzen (LONTS). AWMF-Leitlinie Nr. 145-003, Stand 2020. www.awmf.org
- Verhagen AP, Bierma‐Zeinstra SMA, Boers M et al. Balneotherapy (or spa therapy) for rheumatoid arthritis. Cochrane Database of Systematic Reviews 2015; 4: CD000518. DOI: 10.1002/14651858.CD000518.pub2. pubmed.ncbi.nlm.nih.gov
- Arzneimittelkommission der deutschen Ärzteschaft. UAW–News International - Nichtsteroidale Antirheumatika (NSAR) im Vergleich: Risiko von Komplikationen im oberen Gastrointestinaltrakt, Herzinfarkt und Schlaganfall. Deutsches Ärzteblatt 2013; 110:A1447 www.akdae.de
- Stammschulte T, Ludwig WD, Mühlbauer B et al. Metamizole (dipyrone)-associated agranulocytosis. An analysis of German spontaneous reports 1990-2012. Eur J Clin Pharmacol 2015; 71: 1129-38. PMID: 26169297 PubMed
- Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ). Agranulozytose nach Einnahme von Metamizol. Drug Safety Mail 2017-37. 15.11.2017 www.akdae.de
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Rote-Hand-Brief zu Metamizol: Risiko für arzneimittelbedingten Leberschaden. Risikoinformation 15.12.2020 www.bfarm.de
- Deutsche Gesellschaft für Schmerztherapie (DGS). PraxisLeitlinie Opioidinduzierte Obstipation. Stand 2019 (Zugriff 19.06.2019). www.researchgate.net
- Russo E, Guy GW. A tale of two cannabinoids: the therapeutic rationale for combining tetrahydrocannabinol and cannabidiol. Med Hypotheses. 2006;66(2):234-46. PMID: 16209908 PubMed
- Whiting PF, Wolff RF, Deshpande S et al. Cannabinoids for Medical Use: A Systematic Review and Meta-analysis. JAMA 2015; 313(24):2456-73. PMID: 26103030 PubMed
- Glaeske G, Muth L (Hrsg.): Cannabis-Report 2020. Bremen 2021. www.socium.uni-bremen.de
- National Institute for Health and Care Excellence. Cannabis-based medicinal products. NICE guideline. 11 November 2019. www.nice.org.uk
- Koppel, BS, Brust JC, Fife T et al. Systematic review: Efficacy and safety of medical marijuana in selected neurologic disorders: Report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2014; 82:1556–1563. PMID: 24778283 PubMed
- Nugent SM, Morasco BJ, O'Neil ME et al. The Effects of Cannabis Among Adults With Chronic Pain and an Overview of General Harms: A Systematic Review. Ann Intern Med 2017; 167: 319-331. PMID: 28806817 PubMed
- Petzke F, Enax-Krumova EK, Häuser W. Verträglichkeit und Sicherheit von Cannabinoiden bei neuropathischen Schmerzsyndromen. Eine systematische Übersichtsarbeit von randomisierten, kontrollierten Studien. Schmerz 2016; 30: 62-88. PMID: 26830780 PubMed
- Selvarajah D, Gandhi R, Emery CJ et al. Randomized placebo-controlled double-blind clinical trial of cannabis-based medicinal product (Sativex) in painful diabetic neuropathy: depression is a major confounding factor. Diabetes Care. 2010;33:128-30. PMID: 19808912 PubMed
- GW Pharmaceuticals: ClinicalTrials.gov; Stand Juli 2012; letzter Zugriff 21.10.2017 clinicaltrials.gov
- Deutsche Gesellschaft für Neurologie. Diagnose und nicht interventionelle Therapie neuropathischer Schmerzen. AWMF-Leitlinie Nr. 030-114, Klasse S2k, Stand 2019. www.awmf.org
- Cannabis auf Rezept? a-t 2017; 48: 91-2 www.arznei-telegramm.de
- Allan GM, Finley CR, Ton J et al. Systematic review of systematic reviews for medical cannabinoids. Pain, nausea and vomiting, spasticity, and harms. Canadian Family Physician 2018, 64 (2): e78-e94. www.cfp.ca
- Deutsche Gesellschaft für Anästhesiologie und Intensivmedizin. Behandlung akuter perioperativer und posttraumatischer Schmerzen. AWMF-Leitlinie 001–025KF, S3, Konsultationsfassung vom 10.9.2021. www.awmf.org
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Marlies Karsch-Völk, Dr. med., Fachärztin für Allgemeinmedizin, München