Zusammenfassung
- Definition:Fernmetastasen von Primärtumoren im Gehirn, seltener auch im Subarachnoidalraum (Meningeosis neoplastica) oder im Rückenmark.
- Häufigkeit:ZNS-Metastasen bei etwa 20–40 % der Tumorerkrankungen im Krankheitsverlauf. Die häufigsten Primärtumoren sind Mamma- und Bronchialkarzinome sowie maligne Melanome (kumulativ 67–80 %).
- Symptome:Symptome sind abhängig von der Größe und Lokalisation der Hirnmetastasen, z. T. auch asymptomatisch. Häufig Kopfschmerzen, epileptische Anfälle, motorische und sensible Defizite, Sehstörungen sowie Sprach- oder Sprechstörungen.
- Befunde:Klinisch-neurologische Untersuchung mit Nachweis fokaler neurologischer Defizite oder Hirndruckzeichen. Allgemeine körperliche Untersuchung kann Hinweise auf den Primärtumor liefern.
- Diagnostik:Zentrale Bedeutung hat die zerebrale Bildgebung mittels MRT mit Kontrastmittel. Weitere Diagnostik umfasst histopathologische und molekulargenetische Diagnostik, Labor- und Liquordiagnostik, Primärtumorsuche.
- Therapie:Individuelle interdisziplinäre und partizipative Therapieentscheidungen sind abhängig von der primären Tumorerkrankung. Die Therapieansätze umfassen operative Resektion, Radiochirurgie, Strahlentherapie und medikamentöse Tumortherapie (Chemotherapie, zielgerichtete Substanzen, Immuntherapie). Weiterhin kommen supportive und häufig palliative Behandlungsansätze zum Einsatz.
Allgemeine Informationen
Definition
- ZNS-Metastasen entstehen durch hämatogene Streuung (Metastasierung) von Primärtumoren in das Gehirn oder seltener in das Rückenmark (spinale Metastasen) bzw. den Subarachnoidalraum (Meningeosis neoplastica).1-4
- Historisch vornehmlich als eigene Krankheitsentität betrachtet, erfolgt die Beurteilung heute eher im Rahmen der jeweiligen Primärtumorerkrankung mit individualisiertem Risikoprofil.3
Einteilung nach Anzahl2,4
- Einzelne Hirnmetastase
- solitäre Metastase: einzelne Hirnmetastase; keine weiteren Metastasen
- singuläre Metastase: einzelne Hirnmetastase; weitere Metastasen in anderen Organen
- Multiple Hirnmetastasen
Häufigkeit
- Hirnmetastasen
- Hirnmetastasen in 20–40 % der Fälle bei Malignomen1,3-5
- Metastasen sind bei Erwachsenen etwa 10-fach häufiger als primäre Hirntumoren.6
- die häufigsten Primärtumoren (67–80 % der Fälle):3,7
- bei Männern das Bronchialkarzinom
- bei Frauen das Mammakarzinom
- bei beiden Geschlechtern gefolgt vom malignen Melanom
- Spinale Metastasen
- Inzidenz von 3–10/100.000 Einw. pro Jahr2
- Meningeosis neoplastica
Ätiologie und Pathogenese
Ätiologie
- Häufigkeit der Primärtumoren bei Hirnmetastasen:2,4,7
- Bronchialkarzinom (50 %)
- Mammakarzinom (15–20 %)
- malignes Melanom (5–10 %)
- Nierenzellkarzinom (5–10 %)
- unbekannt (5–20 %)
- CUP-Syndrom (Cancer of Unknown Primary)
- Risiko für Hirnmetastasen abhängig von Primärtumoren2
- 40 % bei kleinzelligem Bronchialkarzinom und malignem Melanom
- 30 % bei nichtkleinzelligem Bronchialkarzinom
- 20 % bei Mamma- und Nierenzellkarzinom
- 2–5 % bei malignen Lymphomen
- Lokalisation von Hirnmetastasen3
- Großhirnhemisphären (80 %)
- Kleinhirn (15 %)
- Hirnstamm (< 5 %)
- Spinale Metastasen4
- Liegen in den meisten Fällen extradural.
- Dies führt bei 5–14 % zu einer Rückenmarkskompression.
- Meningeosis neoplastica4,7
- Bezeichnet eine diffuse Metastasierung in den Subarachnoidalraum.
- bei etwa 10 % der malignen Erkrankungen, üblicherweise im fortgeschrittenen Krankheitsverlauf
- Kann zu einem Hydrocephalus malresorptivus führen.
- Oft treten weitere Metastasen auf, die mit schlechter/infauster Prognose assoziiert sind.
- Genetische Variabilität zum Primärtumor und zu den extrakraniellen Metastasen
- Die Hirnmetastasen zeigten in molekulargenetischen Untersuchungen häufig (53 %) genetische Alterationen, die nicht im Primärtumor nachweisbar waren.3
- ggf. Suszeptibilität für Immuntherapien (z. B. EGFR oder HER2 Inhibitoren)
- Die Hirnmetastasen zeigten in molekulargenetischen Untersuchungen häufig (53 %) genetische Alterationen, die nicht im Primärtumor nachweisbar waren.3
Pathophysiologie
- Direkte Schädigung des umgebenden Hirngewebes
- durch direkte Infiltration malignen Tumorwachstums
- Verursacht Ausfälle abhängig von der Lokalisation, z. B. fokale Ausfälle (Paresen, Sensibilitätsstörungen) oder epileptische Anfälle (15‒20 %).
- Erhöhter intrakranieller Druck
- Verdrängungseffekte durch Tumorwachstum, durch ein Gewebsödem um den Tumor (perifokales Ödem) oder aufgrund eines obstruktiven Hydrozephalus
- Symptome u. a. Kopfschmerzen, Übelkeit, Erbrechen, Müdigkeit und Abgeschlagenheit
- klinische Zeichen: Stauungspapille oder Hirnnervenausfälle
Prädisponierende Faktoren
- Primäre, maligne Tumorerkrankung
- Inzidenz von Hirnmetastasen bei Diagnosestellung einer metastasierten Krebserkrankung:3
- metastasiertes malignes Melanom: 25 %
- metastasiertes Bronchialkarzinom: 25 %
- metastasiertes Nierenzellkarzinom: 10 %
- metastasiertes Mammakarzinom: 7 %
- metastasierte Kopf-/Hals-Tumoren: 5 %
- metastasierte gastrointestinale Tumoren: 2 %
ICPC-2
- N74 Bösartige Neubildung Nervensystem
ICD-10
- C79 Sekundäre bösartige Neubildung an sonstigen und nicht näher bezeichneten Lokalisationen
- C79.3 Sekundäre bösartige Neubildung des Gehirns und der Hirnhäute
Diagnostik
Diagnostische Kriterien
- Die Symptomatik variiert je nach Lokalisation und Größe der ZNS-Metastasten, z. T. asymptomatisch.
- Bildmorphologischer (v. a. MRT) Nachweis einer oder mehrerer Raumforderungen mit oder ohne bekannte maligne Erkrankung
- Histopathologische Diagnostik zur Klassifikation der Tumorentität
Differenzialdiagnosen
- Primäre Hirntumoren
- Multiple Sklerose (MS)
- Hirnabszess
- Meningitis
- Enzephalitis
Anamnese
Beschwerden2-4
- Die Symptomatik ist abhängig von Größe, Lokalisation und Anzahl der Metastasen.4
- oft auch asymptomatische Metastasen bei Nachweis im Rahmen der Staging-Untersuchungen von Tumorerkrankungen3
- Zeitlicher Verlauf
- progredienter Verlauf, meist über Wochen bis Monate
- Symptome von Hirnmetastasen3-4
- Kopfschmerz (50 %)
- Hemisymptomatik (50 %)
- Paresen
- Sensibilitätsstörungen
- neuropsychiatrische Symptome (30 %)
- Gedächtnisstörungen
- Wesensveränderungen
- Verwirrtheit
- Halluzinationen
- epileptische Anfälle (10–25 %)
- Sprach- und Sprechstörungen (Aphasie, Dysarthrie)
- Hirndruckzeichen
- Kopfschmerz, Übelkeit, Erbrechen, Bewusstseinsstörung
- Hirnnervenparesen
- Symptome von soliden spinalen Metastasen4
- Rückenschmerzen
- Symptome eines (progredienten) Querschnittsyndroms
- Symptome einer Meningeosis neoplastica4
- Übelkeit und Erbrechen
- Kopf-, Nacken- und Rückenschmerzen
- Hirnnervenparesen
- neurologische Störungen aufgrund spinaler Läsionen
- radikuläre Schmerzen
- Sensibilitätsstörungen und Paresen
- Blasen- und Mastdarmstörungen
Klinische Untersuchung
Allgemeine körperliche Untersuchung
- Klinische Zeichen des Primärtumors (extrazerebrale Tumormanifestation?)4
- Beurteilung des Allgemeinzustands
- z. B. Karnofsky-Index oder ECOG (siehe Deutsche Hirntumorhilfe)
Neurologische Untersuchung
- Fokale Defizite und Hirnnervenausfälle
- Zeichen einer Hirndruckerhöhung4
- Kopfschmerz, Übelkeit, Erbrechen, Bewusstseinsstörung
- ggf. Augenspiegelung (Ophthalmoskopie)
- Nachweis einer Stauungspapille (15‒20 %)
- Neuropsychiatrischer Befund
- Affekt, Stimmung, Orientiertheit, Merkfähigkeit
Ergänzende Untersuchungen in der Hausarztpraxis
- Abhängig von der zugrunde liegenden Tumorerkrankung
Diagnostik bei Spezialist*innen
Bildgebende Untersuchungen
- Magnetresonanztomografie (MRT) des Gehirns mit Kontrastmittel (Gadolinium)1,3-4
- v. a. T1-gewichtete Sequenz vor und nach Kontrastmittel
- Untersuchung der Wahl (sensitivstes Untersuchungsverfahren)2-4
- Anzahl, Größe und Verteilung von ZNS-Läsionen sowie Differenzialdiagnostik
- CT nur bei Kontraindikationen für die MRT
- CT4
- geringere Sensitivität als MRT, untergeordnete Rolle
Labordiagnostik
- Tumormarker
Histopathologische Untersuchungen
- Histopathologische Klassifikation des Tumors durch stereotaktische Biopsie oder offene Operation4
- bei unklarem Primärtumor und zur Differenzierung hirneigener Tumoren
- Je länger die Diagnose eines Primärtumors zurückliegt, desto eher ist eine histologische Sicherung empfehlenswert.4
- Bei bis zu 10 % der Fälle sind es letztlich keine Metastasen, sondern andere Prozesse (z. B. primäre Hirntumoren oder Entzündung).
- weniger empfohlen bei multiplen Metastasen und charakteristischer Bildgebung
Fakultative, weiterführende Diagnostik4
- Tumorsuche bei unbekanntem Primärtumor
- Staging-Untersuchungen bei Erstdiagnose einer Krebserkrankung
- CT der Schädelbasis bei V. a. Knocheninfiltration
- MRT der Wirbelsäule bei V. a. spinale Metastasen
- Liquoruntersuchung und Druckmessung bei V. a. Meningeosis neoplastica
- allgemeine Liquordiagnostik (Zellzahl, Zytologie, Albumin, IgG, IgG-Index, Glukose, Laktat)
- spezifische Liquordiagnostik (Immunzytochemie, Durchflusszytometrie, PCR, FISH)
- PET-Untersuchung zur Unterscheidung zwischen (Rezidiv-)Metastase und Strahlennekrose nach Radiochirurgie
Indikationen zur Überweisung
- Bei Verdacht auf Hirnmetastasen
Therapie
Therapieziele
- Symptome lindern.
- Progression verzögern.
- Tumorfreiheit bei kurativem Ansatz
Allgemeines zur Therapie
- Interdisziplinäre Therapiestrategien nach Möglichkeit an spezialisierten Zentren in Abstimmung mit den behandelnden Hausärzt*innen4
- oft kein kurativer Therapieansatz bei Diagnosestellung4
- Wesentliche Therapiemodalitäten
- operative Resektion
- Radiochirurgie
- fraktionierte Strahlentherapie
- medikamentöse Tumortherapie
- supportive Therapie
- symptomatische Steroidbehandlung
- antikonvulsive Therapie
- palliative Therapie
- Die Wahl des Therapieansatzes ist individuell und abhängig von multiplen Faktoren.4
- Patient*in: Alter, Allgemeinzustand (z. B. Karnofsky-Index)
- Hirnmetastasen: Größe, Anzahl, Lokalisation, Primärtumor
- primäre Tumorerkrankung und molekulargenetisches Profil
- weitere Komorbiditäten
- Meningeosis neoplastica
Operative Therapie
Operative Resektion
- Die operative Resektion ist ein effektives und etabliertes Behandlungsverfahren von soliden Hirnmetastasen.3-4,6,8
- Voraussetzung ist die Zugänglichkeit für einen neurochirurgischen Eingriff.
- bei singulären oder solitären Metastasen der alleinigen Ganzhirnbestrahlung bezüglich des Überlebens überlegen1,4
- meist En-bloc-Resektion in Kombination mit verschiedenen intraoperativen Verfahren3
- z. B. Neuronavigation/Brain Mapping, laserinduzierte interstitielle Thermotherapie (LITT), fokussierter Ultraschall
- ggf. mit anschließender Ganzhirnbestrahlung
- Die Resektion erlaubt eine histologische Diagnosesicherung.
- Eine operative Resektion ist empfohlen bei4
- singulären oder solitären Metastasen
- gutem Allgemeinzustand
- geringen neurologischen Defiziten
- keinen oder stabilen (> 3 Monate) extrakraniellen Tumormanifestationen
- Metastasen strahlenresistenter Tumoren
- unbekanntem Primärtumor
- einer neuroradiologisch nicht sicher als Metastase einzuordnender Läsion
- operativ gut zugänglichen Läsionen
- raumfordernder (Durchmesser > 3 cm) oder symptomatischer Metastase, v. a. bei
- Hirndrucksymptomatik
- geringem Risiko schwerer neurologischer Defizite durch die Operation
- infratentoriellen Metastasen mit drohendem Verschlusshydrozephalus oder Hirnstammkompression.
- Auch bei Patient*innen mit 2 oder 3 Metastasen kann die Operation indiziert sein.4,9
- alternativ Kombination aus Resektion einer großen Metastase mit Radiochirurgie kleinerer Läsionen
- Keine Resektion empfohlen bei Metastasen von kleinzelligem Bronchialkarzinome, Germinom oder Lymphom
- Spinale Metastasen4
- Insbesondere bei neurologischen Defiziten operative Dekompression zu erwägen.
- bei Wirbelkörpermetastasierung ggf. Wirbelkörperersatz und Stabilisierungsoperationen
Liquorshunt
- Im Falle einer Liquorzirkulationsstörung durch den Tumor mit Hydrozephalus operative Anlage einer Liquordrainage (z. B. EVD, ventrikuloperitonealer Shunt)4
Strahlentherapie
Stereotaktische Radiochirurgie
- Perkutane stereotaktische Applikation einzelner hoher Strahlendosen1,3-4
- Radiochirurgische Behandlung empfohlen bei:1,4
- 1–4 Hirnmetastasen
- keinen oder stabilen (> 3 Monate) extrakraniellen Tumormanifestationen
- kleiner, tief gelegener Läsion
- operativ nicht gut zugänglichen Läsionen, z. B. Hirnstamm
- geringem raumforderndem Effekt der Metastase (Durchmesser < 3 cm)
- Rezidivmetastasen nach Ganzhirnbestrahlung oder nach Operation
Ganzhirnbestrahlung
- Primäre, adjuvante oder prophylaktische Strahlentherapie des gesamten Gehirns und der Leptomeningen1,3-4,10-11
- Primäre Therapieoption, falls Operation oder Radiochirurgie nicht empfohlen sind.1,3
- Verbesserung des medianen Überlebens von 2 auf 3–6 Monate4,6
- Verbesserung der neurologischen Symptomatik und der Lebensqualität
- Bestimmte Primärtumoren sind strahlensensitiver als andere (z. B. Mammakarzinom, Bronchialkarzinom).6
- nach Cochrane-Review empfohlene Strahlendosis von 30 Gy in 10 Fraktionen3,11
- Reduktion neurokognitiver Defizite durch Memantine und Aussparung des Hippokampus1
- Primäre, fraktionierte Strahlentherapie (Ganzhirnbestrahlung) empfohlen bei4
- multiplen Hirnmetastasen, insbesondere bei weniger Chemotherapie-sensitiven Tumoren
- 1–4 Hirnmetastasen, nicht für Operation oder Radiochirurgie infrage kommend
- solitären und singulären Metastasen bei inoperabler Lokalisation oder allgemeiner Inoperabilität oder progredienten extrazerebralen Metastasen, ggf. in Kombination mit der Radiochirurgie
- Lebenserwartung > 3 Monate.
- Prophylaktische Ganzhirnbestrahlung bei kleinzelligem Bronchialkarzinom mit kurativem Ansatz4
Medikamentöse (Tumor-)Therapie
- Einsatz systemischer Tumortherapien, die sich gegen den Primärtumor richten und den etablierten Protokollen folgen.4
- klassische Chemotherapie oder molekular zielgerichtete Substanzen („Targeted Therapies“)
- Voraussetzung ist in der Regel die (histologische) Sicherung des Primärtumors.
- Eine primäre medikamentöse Tumortherapie kann Ansprechraten wie bei anderen Organmetastasen aufweisen.4
- z. B. bei Brustkrebs (bis zu 50 % Therapieansprechen)
Chemotherapie
- Klassische systemische Chemotherapie
- Die Wirksamkeit ist vermutlich limitiert aufgrund der Blut-Liquor-Schrankengängigkeit der Pharmaka.3-4,15
- eher untergeordnete Rolle in der Therapie von Hirnmetastasen aufgrund begrenzter Wirksamkeit in klinischen Studien3
- meist in therapierefraktären oder palliativen Therapiesituationen
- z. B. Carboplatin- oder Cisplatin-basierte Therapie mit lebensverlängernder Intention bei kleinzelligem Lungenkarzinom (Stadium „Extensive Disease“)
- Intrathekale Chemotherapie bei Meningeosis neoplastica2,4
- zugelassene Chemotherapeutika: Methotrexat (MTX), Ara-C und Thiotriethylenephosphoramid (Thiotepa)4
- Methotrexat gilt als Mittel der Wahl.
- Applikation über intraventrikuläres Reservoir besser als wiederholte Lumbalpunktionen
- Ziel: Liquorsanierung innerhalb von 2 Wochen (kein Nachweis zuvor nachgewiesener Tumorzellen)
- zugelassene Chemotherapeutika: Methotrexat (MTX), Ara-C und Thiotriethylenephosphoramid (Thiotepa)4
Zielgerichtete Substanzen und Immuntherapie
- Molekular zielgerichtete Substanzen („Targeted Therapies“)3-4
- z. T. deutliche Verbesserung des Überlebens in bestimmten Subgruppen, z. B.:3
- NSCLC: EGFR-Mutation oder ALK-Translokation
- Mammakarzinom: HER2-positiv
- malignes Melanom: BRAF-V600-Mutation
- Der Einsatz ist abhängig vom molekulargenetischen Profil des Primärtumors.
- z. T. deutliche Verbesserung des Überlebens in bestimmten Subgruppen, z. B.:3
- Immuntherapien1,3-4
- Therapie mit Immun-Checkpoint-Inhibitoren, z. B. CTLA-4-Inhibitoren oder PD-1-Inhibitoren bei NSCLC mit Expression von PD-1
Supportive Therapie
Kortikosteroide
- Kortikosteroide sind wirksam in der Reduktion des perifokalen Ödems und in der Senkung des erhöhten intrakraniellen Drucks.1,3-4
- Die Behandlung mit Kortikosteroiden kann die Diagnose (Biopsie) eines zerebralen Lymphoms erschweren.
Antiepileptika
- Therapie von symptomatischen epileptischen Krampfanfällen3-4
- häufig Behandlung über die komplette Überlebenszeit
- prophylaktische Behandlung ohne epileptische Anfälle nicht empfohlen
- bei längerer Anfallsfreiheit und definitiver Therapie ggf. ausschleichendes Absetzen
- Empfohlene Substanzen4
- Levetiracetam
- Lamotrigin
- Gabapentin
Palliative, symptomatische Behandlung
- Unterstützung bei Beschwerdelinderung und Begleitung des Sterbeprozesses
- Siehe auch palliative Behandlung bei:
Verlauf, Komplikationen und Prognose
Verlauf
- Die Symptome sind in der Regel langsam progredient.
- Ausnahme: Einblutung einer Metastase
Komplikationen
- Operation
- Infektionen
- Blutungen
- Parenchymschäden mit neurologischen Funktionseinschränkungen
- Epilepsie
- Radiochirurgie
- Strahlennekrose (Radionekrose)
- wichtigste Komplikation
- nach 2 Jahren klinisch symptomatische Strahlennekrose bei bis zu 11 %
- Strahlennekrose (Radionekrose)
- Ganzhirnbestrahlung13
Prognose
- Die Prognose ist variabel in Abhängigkeit des Primärtumors.3-4
- Hirnmetastasen
- Spinale Metastasen
- Bronchialkarzinom: mediane Überlebenszeit ca. 3 Monate2
- Mammakarzinom, Prostatakarzinom: mediane Überlebenszeit > 1 Jahr2
- Meningeosis neoplastica
- Die Überlebenszeit kann durch eine Therapie verbessert werden.4
- unter supportiver Therapie mediane Überlebenszeit von 2 Monaten
- nach Ganzhirnbestrahlung mediane Überlebenszeit von 3–6 Monaten
- Überlebenszeitverlängerung um 6–9 Monate durch Operation und Ganzhirnbestrahlung gegenüber alleiniger Ganzhirnbestrahlung
Prognostische Klassifikationen
- Es existieren verschiedene Klassifikationen zur Abschätzung der Prognose.3
- GPA-Score („Graded Prognostic Assessment“) mit den Faktoren:
- Alter
- Allgemeinzustand (Karnofsky-Index)
- Zahl der Hirnmetastasen
- Vorhandensein extrakranieller Metastasen
- zuletzt Erweiterung des Scores durch Primärtumoren (DS-GPA)
- Prognostische Faktoren
- Faktoren, die mit einer besseren Prognose assoziiert sind:4
- Remission oder Kontrolle der systemischen Tumorerkrankung
- langes Zeitintervall zwischen Diagnose des Primärtumors und der Hirnmetastasen
- singuläre Hirnmetastase
- guter Allgemeinzustand und niedriges Alter
- bestimmte Primärtumoren: z. B. Keimzelltumor oder Mammakarzinom
- Faktoren, die mit einer besseren Prognose assoziiert sind:4
Verlaufskontrolle
Empfehlungen zur Nachsorge4
- Interdisziplinärer Ansatz
- Definition eines zentralen Ansprechpartners
- Aufgabenverteilung zwischen den Fachdisziplinen
- Bildgebende Untersuchungen
- MRT- oder CT-Untersuchungen individualisiert nach Klinik oder alle 3 Monate
- Medikamentöse (Dauer-)Therapie
- Regelmäßig Indikation zur Steroid- und Antikonvulsivabehandlung prüfen.
- Klinische Verlaufsbeurteilung
- klinisch-neurologische Beurteilung
- psychosoziale und ggf. neuropsychologische und psychiatrische Beurteilung
- Cave: hypophysäre/hypothalamische Insuffizienz nach Strahlentherapie!
- Prüfung weiteren Bedarfs
- Rehabilitationsmaßnahmen
- interdisziplinäre, individuelle, an Einschränkungen angepasste Rehabilitationsmaßnahmen
- psychoonkologische Betreuung
- Hilfsmittel (Rollator, Rollstuhl)
- ggf. Anbindung an palliative Versorgungsstrukturen
Rezidivbehandlung4
- Vorgehen wird individualisiert und in Abhängigkeit vom Allgemeinzustand und der Primärtherapie geplant.
- Erneute Resektion, medikamentöse Therapie, Radiochirurgie oder Ganzhirnbestrahlung möglich
Patienteninformationen
Patientenorganisationen
- Deutsche Hirntumorhilfe: hirntumorhilfe.de
Weitere Informationen
- Deutsche Krebsgesellschaft (DKG): Hirnmetastasen
- Deutsche Krebshilfe: Strahlentherapie
Abbildungen

Gehirn
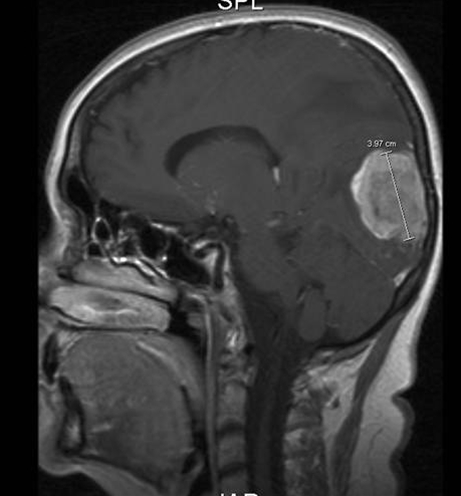
Hirnmetastase bei Mammakarzinom, Sagittalebene
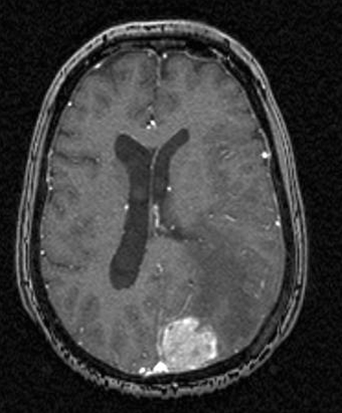
Hirnmetastase bei Mammakarzinom, Transversalebene
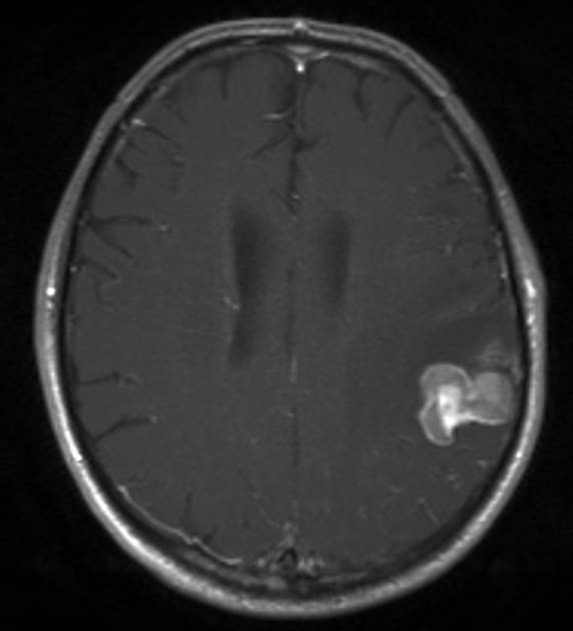
Hirnmetastase bei Nierenzellkarzinom, Transversalebene
Quellen
Leitlinien
- American Society of Clinical Oncology (ASCO), American Society for Radiation Oncology (ASTRO), Society for Neuro-Oncology (SNO). Guideline on Treatment of Brain Metastases. Stand 2021. www.astro.org
Literatur
- American Society of Clinical Oncology (ASCO), American Society for Radiation Oncology (ASTRO), Society for Neuro-Oncology (SNO). Guideline on Treatment of Brain Metastases. Stand 2021. doi.org
- Herrlinger U, Zentner J, Schnell O, Grosu A, Pagenstecher A. Metastasen. In: Hufschmidt A, Rauer S, Glocker F, ed. Neurologie compact. 9., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2022. eref.thieme.de
- Suh JH, Kotecha R, Chao ST, Ahluwalia MS, Sahgal A, Chang EL. Current approaches to the management of brain metastases. Nat Rev Clin Oncol. 2020;17(5):279-299. doi.org
- Deutsche Gesellschaft für Neurologie. Hirnmetastasen und Meningeosis neoplastica. AWMF-Leitlinie Nr. 030-060, Stand 2014 (abgelaufen). www.awmf.org
- Lu-Emerson C, Eichler AF.Brain metastases. Continuum (Minneap Minn). 2012 Apr;18(2):295-311. PMID:22810128 PubMed
- Lin X, DeAngelis LM. Treatment of Brain Metastases. J Clin Oncol. 2015 Oct 20;33(30):3475-84. doi: 10.1200/JCO.2015.60.9503 Epub 2015 Aug 17. Review. PubMed PMID: 26282648 www.ncbi.nlm.nih.gov
- Heinrich Mattle, Marco Mumenthaler. Kurzlehrbuch Neurologie, 4. Auflage. Thieme, 2015.
- Kalkanis SN, Kondziolka D, Gaspar LE, Burri SH, Asher AL, Cobbs CS, Ammirati M, Robinson PD, Andrews DW, Loeffler JS, McDermott M, Mehta MP, Mikkelsen T, Olson JJ, Paleologos NA, Patchell RA, Ryken TC, Linskey ME. The role of surgical resection in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010 Jan;96(1):33-43. doi: 10.1007/s11060-009-0061-8 Epub 2009 Dec 4. Review. PubMed PMID: 19960230 www.ncbi.nlm.nih.gov
- Olson JJ, Kalkanis SN, Ryken TC. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guidelines for the Treatment of Adults With Metastatic Brain Tumors: Executive Summary. Neurosurgery. 2019;84(3):550-552. doi:10.1093/neuros/nyy540 doi.org
- Soon YY, Tham IWK, Lim KH, Koh WY, Lu JJ. Surgery or radiosurgery plus whole brain radiotherapy versus surgery or radiosurgery alone for brain metastases. Cochrane Database of Systematic Reviews 2014; Issue 3. Art: No.: CD009454. pmid:24585087 PubMed
- Tsao MN, Xu W, Wong RK, Lloyd N, Laperriere N, Sahgal A, Rakovitch E, Chow E. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases. Cochrane Database Syst Rev. 2018 Jan 25;1:CD003869. doi: 10.1002/14651858.CD003869.pub4 Review. PubMed PMID: 29365347 www.ncbi.nlm.nih.gov
- Linskey ME, Andrews DW, Asher AL et al. The role of stereotactic radiosurgery in the management of patients with newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol 2010;96:45–68. PMID:19960227 doi.org
- Gießelmann, Kathrin. Hirnmetastasen: Stereotaktische Radiatio besser als Standardtherapie. Dtsch Arztebl 2017; 114: (33-34). www.aerzteblatt.de
- Siegmund-Schultze, Nicola. Strahlentherapie bei Hirnmetastasen: Primäre Radiochirurgie alleine ist bei wenigen Metastasen die beste Option. Dtsch Arztebl 2016; 113(40): A-1761 / B-1484 / C-1476. www.aerzteblatt.de
- Mehta MP, Paleologos NA, Mikkelsen T, et al. The role of chemotherapy in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010 Jan;96(1):71-83. Epub 2009 Dec 4. Review.PMID:19960229 PubMed
Autor*innen
- Jonas Klaus, Arzt in Weiterbildung Neurologie, Hamburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).