Zusammenfassung
- Definition:Schleimhautschäden im Bereich von Magen (Ulcus ventriculi) oder Zwölffingerdarm (Ulcus duodeni), die bis in die Submukosa reichen und einen Diameter von > 5 mm aufweisen. Häufigste Ursachen sind eine Infektion durch Helicobacter pylori und Einnahme von nichtsteroidalen Antirheumatika (NSAR).
- Häufigkeit:Lebenszeitprävalenz ca. 5–10 %.
- Symptome:Variierende Symptome mit geringer Sensitivität und Spezifität: epigastrischer Schmerz, Völlegefühl, Übelkeit. Häufig nächtliche Beschwerden.
- Klinische Befunde:Keine spezifischen klinischen Befunde.
- Diagnostik:Diagnosestellung durch Gastroskopie. Nachweis einer Helicobacter-pylori-Infektionen durch invasive oder nichtinvasive Tests.
- Therapie:Eradikation einer H.-pylori-Infektion. Gabe von Protonenpumpeninhibitoren (PPI), möglichst Beenden einer NSAR-Therapie. Prophylaktische PPI-Gabe bei bestimmten medikamentösen Therapien.
Allgemeine Informationen
Definition
- Schleimhautschäden im Bereich von Magen (Ulcus ventriculi) oder Zwölffingerdarm (Ulcus duodeni), die
- bis in die Submukosa reichen.
- einen Diameter von > 5 mm aufweisen.1-2
Häufigkeit
- Prävalenz
- Lebenszeitprävalenz ca. 5–10 %3
- Inzidenz
- Alter und Lokalisierung
- Häufigkeit der Ulkuskrankheit (und einer H.-pylori-Infektion) nimmt mit dem Alter zu.6
- Geschlecht
- Verhältnis Frauen zu Männern ca. 1:16
Ätiologie und Pathogenese
- Die sog. peptischen Ulzera resultieren aus einem Missverhältnis zwischen:7
- schädigenden Faktoren
- Salzsäure
- Pepsin
- H.-pylori-Infektion
- nichtsteroidale Antirheumatika (NSAR)/ASS
- biliärer Reflux
- Schutzmechanismen
- Schleim
- Prostaglandine
- Bikarbonat
- gute Durchblutung der Schleimhaut.
- schädigenden Faktoren
- Wichtigste ätiologische Faktoren sind:
- H.-pylori-Infektion
- Einnahme von NSAR und/oder ASS9-10
- Seltenere Ursachen sind:101,11-12
- entzündliche Erkrankungen
- eosinophile Gastroenteritis
- Morbus Crohn
- Morbus Behçet
- Sarkoidose
- Vaskulitiden
- idiopathisch
- Infektionen
- Ischämien oder Nekrosen
- kürzlich durchgeführte Interventionen wie transarterielle Chemoembolisation (TACE), perkutane Strahlentherapie oder Radioembolisation (SIRT), Coiling (am Magen oder Duodenum)
- Crack-Kokain-Abusus, Amphetamin-Abusus
- medikamenteninduziert oder -assoziiert
- SSRI
- Biphosphonate, Kalium
- Sirolimus, Mycophenolat
- Chemotherapie (z. B. 5-FU oder MTX)
- Spironolakton
- neuroendokrine Tumoren bzw. mediatorinduziert
- Gastrinome (inkl. MEN-1)
- systemische Mastozytose
- Basophilie bei myeloproliferativen Erkrankungen
- Obstruktion
- Duodenalstenose, z. B. bei Pankreas anulare
- postoperativ
- Magenresektion
- Magen-Bypass
- schwere Erkrankungen („Stressulzera“)
- z. B. bei ARDS, Schock, Sepsis, Polytrauma, Verbrennungen
- Leber-/Nierenversagen
- andauernde mechanische Beatmung
- Tumorinfiltration
- z. B. bei Pankreaskarzinom
Prädisponierende Faktoren
- Prädisponierende Faktoren sind:106-7
- zunehmendes Alter (> 60 Jahre)
- Medikamente: NSAR, ASS
- Rauchen
- St. n. Ulkuskrankheit
- positive Familienanamnese auf Ulkuskrankheit
- niedriger sozioökonomischer Status
- psychosoziale Belastung, Depression
- schwere Grunderkrankung, Operationen, intensivmedizinische Behandlung
ICD 10
- K25 Ulcus ventriculi
- K25.0 Ulcus ventriculi: Akut, mit Blutung
- K25.1 Ulcus ventriculi: Akut, mit Perforation
- K25.2 Ulcus ventriculi: Akut, mit Blutung und Perforation
- K25.3 Ulcus ventriculi: Akut, ohne Blutung oder Perforation
- K25.4 Ulcus ventriculi: Chronisch oder nicht näher bezeichnet, mit Blutung
- K25.5 Ulcus ventriculi: Chronisch oder nicht näher bezeichnet, mit Perforation
- K25.6 Ulcus ventriculi: Chronisch oder nicht näher bezeichnet, mit Blutung und Perforation
- K25.7 Ulcus ventriculi: Chronisch, ohne Blutung oder Perforation
- K25.9 Ulcus ventriculi: Weder als akut noch als chronisch bezeichnet, ohne Blutung oder Perforation
- K26 Ulcus duodeni
- K26.0 Ulcus duodeni: Akut, mit Blutung
- K26.1 Ulcus duodeni: Akut, mit Perforation
- K26.2 Ulcus duodeni: Akut, mit Blutung und Perforation
- K26.3 Ulcus duodeni: Akut, ohne Blutung oder Perforation
- K26.4 Ulcus duodeni: Chronisch oder nicht näher bezeichnet, mit Blutung
- K26.5 Ulcus duodeni: Chronisch oder nicht näher bezeichnet, mit Perforation
- K26.6 Ulcus duodeni: Chronisch oder nicht näher bezeichnet, mit Blutung und Perforation
- K26.7 Ulcus duodeni: Chronisch, ohne Blutung oder Perforation
- K26.9 Ulcus duodeni: Weder als akut noch als chronisch bezeichnet, ohne Blutung oder Perforation
- K27 Ulcus pepticum, Lokalisation nicht näher bezeichnet
- K27.0 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Akut, mit Blutung
- K27.1 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Akut, mit Perforation
- K27.2 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Akut, mit Blutung und Perforation
- K27.3 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Akut, ohne Blutung oder Perforation
- K27.4 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Chronisch oder nicht näher bezeichnet, mit Blutung
- K27.5 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Chronisch oder nicht näher bezeichnet, mit Perforation
- K27.6 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Chronisch oder nicht näher bezeichnet, mit Blutung und Perforation
- K27.7 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Chronisch, ohne Blutung oder Perforation
- K27.9 Ulcus pepticum, Lokalisation nicht näher bezeichnet: Weder als akut noch als chronisch bezeichnet, ohne Blutung oder Perforation
Diagnostik
Diagnostische Kriterien
- Die Diagnosestellung einer Ulkuskrankheit erfolgt durch Endoskopie.
Differenzialdiagnosen
- Funktionelle Dyspepsie
- Gastroösophageale Refluxerkrankung
- Gastritis
- Magenkarzinom
- Gallensteinleiden
- Pankreaserkrankung
- Perikarditis
- CCS, ACS
Anamnese
- Geringe Sensitivität und Spezifität der Symptomatik4
- Mögliche Symptome4
- epigastrischer Schmerz
- Völlegefühl
- Blähung
- Übelkeit
- Abhängigkeit der Beschwerden von Mahlzeiten
- Nüchternschmerz, Besserung nach Mahlzeit (Duodenalulkus)1
- Beschwerden kurz nach einer Mahlzeit (Magenulkus)1
- Nächtliche Beschwerden6
- 50–80 % der Fälle mit Duodenalulkus
- 30–40 % der Fälle mit Magenulkus
- Bei starker Blutung Teerstuhl
- Gewichtsverlust (Malignom)
- Risikofaktoren
- Medikation: NSAR, ASS
- Rauchen
- Familienanamnese auf Ulkuskrankheit
- Systemerkrankungen
Klinische Untersuchung
- Häufig keine Befunde zu erheben.
- Druckschmerz bei epigastrischer Palpation
- Blässe bei blutungsbedingter Anämie
- Abwehrspannung bei Perforation
Ergänzende Untersuchungen in der Hausarztpraxis
Allgemeines Labor
- Blutbild (Anämie?)
- Ggf. Eisenstatus
- Evtl. Stuhltest auf okkultes Blut
Nichtinvasive Tests auf H. pylori
- Zu Details der Diagnostik siehe Artikel Helicobacter-pylori-Infektion.
- Im Rahmen der hausärztlichen Diagnostik können nichtinvasive Tests auf H. pylori eingesetzt werden, die invasiven Verfahren setzen eine Gastroskopie voraus.
- Eingeschränkte Kostenerstattung: Zwar sind die nichtinvasiven Tests sowohl für die Erstdiagnostik auf H. pylori als auch zur Beurteilung des Eradikationserfolges einsetzbar, allerdings werden Harnstoff-Atemtest und Stuhl-Antigennachweis nur zur Kontrolle des Eradikationserfolges erstattet oder zum Ausschluss einer Reinfektion bei gesicherter Erkrankung.13
- Info laut KBV: Die Gebührenordnungsposition 32706 ist grundsätzlich nur berechnungsfähig zur Erfolgskontrolle nach Eradikationstherapie einer Helicobacter-pylori-Infektion (frühestens 4 Wochen nach Ende der Therapie) oder zum Ausschluss einer Reinfektion bei einer gastroduodenoskopisch gesicherten Ulcus-duodeni-Erkrankung oder bei Kindern mit begründetem Verdacht auf eine Ulkus-Erkrankung.
- Eingeschränkte Kostenerstattung: Zwar sind die nichtinvasiven Tests sowohl für die Erstdiagnostik auf H. pylori als auch zur Beurteilung des Eradikationserfolges einsetzbar, allerdings werden Harnstoff-Atemtest und Stuhl-Antigennachweis nur zur Kontrolle des Eradikationserfolges erstattet oder zum Ausschluss einer Reinfektion bei gesicherter Erkrankung.13
- Für eine zuverlässige H.-pylori-Diagnostik (dies gilt für nichtinvasive und invasive Tests) sollten folgende Zeiträume eingehalten werden:10
- 2 Wochen nach Ende einer Behandlung mit Protonenpumpen-Inhibitoren (PPI)
- 4 Wochen nach Eradikation oder sonstiger antibiotischer Therapie.
- Siehe auch Tabelle Sensitivität und Spezifität der verschiedenen Nachweismethoden von H. pylori.
Harnstoff-Atemtest
- Orale Aufnahme von mit Kohlenstoffisotopen (13C oder 14C) markiertem Harnstoff
- Rasche Aufspaltung durch die Urease von H. pylori in Ammoniak und isotopenmarkiertes CO2, das über die Ausatemluft gemessen wird.14
- Sensitivität 85–95 %, Spezifität 85–95 %10
Stuhl-Antigentest
- Nachweis von Helicobacter-Antigen im Stuhl unter Verwendung monoklonaler Antikörper16-17
- Sensitivität 85–95 %, Spezifität 85–95 %10
Serologie
- Unterscheiden nicht zwischen einer aktuellen und einer früheren, inzwischen aber eradizierten Infektion.10
- Im klinischen Alltag wenig sinnvoll, Anwendung vor allem in epidemiologischen Studien13
Diagnostik bei Spezialist*innen
Ösophago-Gastro-Duodenoskopie (ÖGD)
- Goldstandard der Diagnostik7
Invasive Tests auf H. pylori
- Die Gastroskopie ermöglicht die Durchführung invasiver Tests auf H. pylori.
- Bei peptischem Ulcus ventriculi oder duodeni soll auf H. pylori getestet werden.10
- Alle invasiven Verfahren basieren auf der Untersuchung von Gewebebiopsien.1
- Weitere Informationen siehe auch Artikel Helicobacter pylori.
Urease-Schnelltest
- Schneller, unkomplizierter und kostengünstigster Bedside-Test1
- Sensitivität 90–95 %, Spezifität 90–95 %10
PCR
- Molekulargenetische Diagnostik mittels Polymerase-Chain-Reaction (PCR)1
- Sensitivität 90–95 %, Spezifität 90–95 %10
Histologie
- Neben Nachweis von H. pylori kann durch eine histologische Untersuchung von Gewebe eine chronische Gastritis nachgewiesen und die Benignität eines Ulkus geklärt werden.
- Sensitivität 80–98 %, Spezifität 90–98 %10
Kultur
- In der Praxis nur im Zusammenhang mit Resistenzbestimmung von Bedeutung18
- Sensitivität 70–90 %, Spezifität 100 %10
Laboruntersuchungen
- Gastrin bei V. a. Zollinger-Ellison-Syndrom (multiple oder refraktäre Ulzera, Diarrhö, Familiengeschichte auf multiple endokrine Neoplasie (MEN I)7
CT/MRT
- Bei V. a. auf eine maligne Erkrankung
Therapie
Therapieziele
- Ausheilung des Ulkus
- Eradikation einer H.-pylori-Infektion: signifikanter Rückgang von Inzidenz und Mortalität gastroduodenaler Ulkuserkrankungen durch Eradikation, außerdem Beitrag zur Prävention des Magenkarzinoms10
- Symptomlinderung
Allgemeines zur Therapie
- Die Behandlung beruht auf:
- Allgemeinmaßnahmen
- medikamentöser Therapie
- im Einzelfall interventionelle/operative Therapie von Komplikationen.
Allgemeinmaßnahmen
- Eine Behandlung mit NSAR sollte – wenn möglich – vermieden oder reduziert werden.
- Rauchstopp
- Keine spezielle Schonkost, entscheidend ist die individuelle Verträglichkeit von Speisen.19
- Berücksichtigung psychosomatischer Aspekte, ggf. Intervention1
- Stress, psychosoziale Belastung
- Angsterkrankungen, Depression.
H.-pylori-positive Ulkuskrankheit
- Zu Details der Eradikationstherapie siehe auch Artikel Helicobacter pylori.
Allgemeines zur Eradikation
- Der Nachweis von H. pylori bei Ulcus ventriculi oder duodeni ist eine absolute Therapieindikation.20
- Bis vor Kurzem war die clarithromycinbasierte Tripel-Therapie weltweit Standard, durch Resistenzen verminderte Wirksamkeit.20
- in Deutschland ca. 11 % primäre Clarythromycinresistenz mit steigender Tendenz21
- Risikofaktoren für eine primäre Clarithromycinresistenz20
- Herkunft aus Süd- oder Osteuropa
- frühere Behandlung mit Makrolidantibiotika
- Da die Einnahme von Makroliden häufig nicht sicher eruierbar ist, kann die häufige Einnahme von Antibiotika pragmatisch als indirektes Indiz hierfür gewertet werden.13
- Die prätherapeutische Resistenzlage ist von großer Relevanz, die Wahl des Therapieschemas sollte die Wahrscheinlichkeit einer möglichen Antibiotikaresistenz berücksichtigen.10
- Allerdings unzureichende Daten zur lokalen Resistenzlage für Deutschland, daher wird die Clarithromycin-basierte Triple-Therapie neuerdings nicht mehr zur Erstlinientherapie empfohlen.10
Therapeutischer Algorithmus
Erstlinientherapie
- Da in Deutschland die Resistenzraten für Clarithromycin auf > 10 % angestiegen sind, wird die bismuthaltige Quadrupel-Therapie bevorzugt als Erstlinientherapie für mindestens 10 Tage eingesetzt.10
Resistenzprüfung
- Nach erfolgloser primärer Vierfach-Therapie sollte eine Resistenztestung erfolgen.10
Zweitlinientherapie
- Die Zweitlinientherapie soll unter Berücksichtigung der Resistenztestung über 14 Tage erfolgen mit:10
- Standard-Tripel-Therapie oder
- Fluorochinolon-haltigen Tripel-Therapie.
Drittlinientherapie
- Nach Versagen einer Zweitlinientherapie sollen weitere Therapieversuche nur durch Spezialist*innen erfolgen.10
- abnehmende antibiotische Therapieoptionen nach fehlgeschlagener resistenzadaptierter Zweitlinientherapie
Begleitmaßnahmen
- Der Erfolg einer medikamentösen Eradikation kann unterstützt werden durch:13
- sorgfältige Aufklärung
- Motivation zur Therapietreue
- Einnahme der Medikamente vor den Mahlzeiten
- Milderung von Antibiotika-Nebenwirkungen durch Probiotika22
- Rauchstopp.
Therapieprotokolle10,13,20-21
- Bei allen Protokollen können folgende PPI 2 x tgl. verabreicht werden: Omeprazol 20 mg, Pantoprazol 40 mg, Esomeprazol 20 mg, Lansoprazol 30 mg, Rabeprazol 20 mg.
Bismut-Quadrupel-Therapie – 10 Tage
- PPI 1–0–1
- Bismut-Kalium-Salz 140 mg 3–3–3–3
- Tetracyclin 125 mg 3–3–3–3
- Metronidazol 125 mg 3–3–3–3
Standard-Tripel-Therapie (französisch) – 14 Tage
- PPI 1–0–1
- Clarithromycin 500 mg 1–0–1
- Amoxicillin 1.000 mg 1–0–1
Standard-Tripel-Therapie (italienisch) – 14 Tage
- PPI 1–0–1
- Clarithromycin 250–500 mg 1–0–1
- Metronidazol 400–500 mg 1–0–1
Fluorchinolon-Tripel-Therapie – 10 Tage
- PPI 1–0–1
- Levofloxacin 500 mg oder Moxifloxacin 400 mg 1–0–0
- Zu Nebenwirkungen und Anwendungsbeschränkungen von Fluorchinolonen siehe auch Rote-Hand-Brief.23
- Amoxicillin 1.000 mg 1–0–1
H.-pylori-negative Ulkuskrankheit
- Eine NSAR-Therapie ist die häufigste Ursache für eine H.-pylori-negative Ulkuskrankheit und sollte möglichst beendet werden.4
- Medikamentöse Behandlung mit PPI für 4–8 Wochen4,7
- Nach Langzeiteinnahme von PPI ist ein Säurerebound mit Refluxbeschwerden nach dem Absetzen möglich, daher ist eine allmähliche Reduktion sinnvoll.24-25
Präventiver Magenschutz
- Bei einigen medikamentösen Therapien oder klinischen Konstellationen ist ein präventiver Magenschutz indiziert.
- Bei der Indikationsstellung ist zu berücksichtige, ob Risikofaktoren (andere als H. pylori) für das Auftreten gastroduodenaler Ulzera bzw. Risikofaktoren für Ulkusblutungen/-komplikationen vorliegen.10
Risikofaktoren für gastroduodenale Ulzera
- Alter > 60 Jahre
- Ulkusanamnese
- Medikamente: NSAR, ASS
- Andere Risikofaktoren: schwere Begleiterkrankungen, schwere psychosoziale Belastungen, Rauchen
Risikofaktoren für Ulkusblutungen/-komplikationen
- Alter > 60 Jahre
- Ulkusanamnese
- Medikamente: NSAR, ASS, SSRI, P2Y12-Inhibtoren, Antikoagulanzien (Vit-K-Antagonisten, NOAK, Heparine), systemische Kortikosteroide
- Andere Risikofaktoren: schwere Begleiterkrankungen
PPI-Prophylaxe der H.-pylori-negativen Ulkuskrankheit10
- Wenn eine Therapie mit NSAR begonnen wird, soll gleichzeitig eine prophylaktische Therapie mit einem PPI durchgeführt werden, sofern ein weiterer Risikofaktor für das Auftreten eines gastroduodenalen Ulkus und/oder einer Ulkuskomplikationvorliegt. Wenn nur der Risikofaktor Alter (> 60 Jahre) und sonst kein Risikofaktor vorliegt, ist eine Prophylaxe nicht erforderlich.
- Wenn unter einer Dauertherapie mit NSAR ein gastroduodenales Ulkus und/oder eine obere gastrointestinale Ulkusblutung auftritt, sollte das NSAR bis zur Abheilung der Läsionen abgesetzt werden, und anschließend sollte im Falle einer erneuten Gabe eine dauerhafte PPI-Prophylaxe erfolgen.
- Nach Auftreten einer Ulkuskomplikation soll eine Dauerprophylaxe mit einem PPI immer dann erfolgen, wenn die NSAR-Medikation fortgesetzt wird. Dies gilt auch, wenn eine begleitende H.-pylori-Infektion erfolgreich behandelt wurde.
- Wenn eine Monotherapie mit ASS, einem P2Y12-Inhibitor, DOAK oder VKA durchgeführt wird, sollte eine PPI-Prophylaxe erfolgen, sofern mindestens ein weiterer Risikofaktor für das Auftreten eines gastroduodenalen Ulkus und/oder einer Ulkuskomplikation vorliegt. Wenn nur der Risikofaktor Alter (> 60 Jahre) und sonst kein Risikofaktor vorliegt, ist eine Prophylaxe nicht erforderlich.
- Nach Auftreten einer Ulkuskomplikation unter Thrombozytenaggregationshemmung und/oder Antikoagulation soll bei H.-pylori-negativen Patient*innen sowie auch nach erfolgreicher Eradikationstherapie bei zuvor H.-pylori-positiven Patient*innen eine Dauerprophylaxe mit einem PPI erfolgen, wenn die Thrombozytenaggregationshemmung und/oder Antikoagulation fortgesetzt wird.
- Tritt unter einer Monotherapie mit einem P2Y12-Inhibitor eine gastroduodenale Ulkusblutung auf, kann in Ergänzung zu einer dauerhaften PPI-Prophylaxe eine Umstellung auf ASS erwogen werden, wenn dies aus kardiovaskulärer Sicht vertretbar ist.
- Wenn unter einer Monotherapie mit ASS, einem P2Y12-Inhibitor, DOAK oder VKA eine obere gastroduodenale Ulkusblutung eintritt, sollte bei Therapiefortführung eine dauerhafte PPI-Prophylaxe erfolgen. Im Falle einer gastroduodenalen Ulkusblutung unter einer Dauertherapie mit ASS sollte keine Umstellung auf eine Monotherapie mit einem P2Y12-Inhibitor erfolgen.
- Im Falle einer gleichzeitigen Therapie mit zwei gerinnungsaktiven Substanzen soll eine Prophylaxe mit einem PPI erfolgen.
- Wenn unter einer Therapie mit systemischen Kortikosteroiden ein gastroduodenales Ulkus und/oder eine Ulkuskomplikation (z. B. Blutung) auftreten, sollte neben dem Ausschluss einer Infektion mit H. pylori nach Möglichkeit ein Wechsel auf ein anderes Medikament zusätzlich zu einer PPI-Therapie erfolgen. Ist dies nicht möglich, sollte die niedrigst mögliche Steroiddosis gegeben werden und eine PPI-Propylaxe erfolgen.
- Wenn eine Therapie mit SSRI durchgeführt wird, sollte eine PPI-Prophylaxe erfolgen, sofern in der Vorgeschichte ein Ulkus und/oder einer Ulkuskomplikation aufgetreten ist oder eine Komedikation mit einem NSAR, einem Coxib oder einem P2Y12 vorliegt. Wenn eine Komedikation mit einem Antikoagulans (DOAK oder VKA) vorliegt, kann eine PPI-Prophylaxe erfolgen.
Interventionelle und operative Therapie
Interventionelle Therapie
- Eine interventionelle Therapie erfolgt überwiegend im Rahmen einer Blutung, seltener zur Behandlung von Magenausgangs- oder Duodenalstenosen.
- Ca. die Hälfte der OGI-Blutungen wird durch peptische Ulzera verursacht.1
- In der Mehrzahl der Fälle kann eine Blutung endoskopisch gestillt werden.26
Operation
- Indikationen zur Operation sind:26
- interventionell nicht stillbare Blutung
- Perforation
- Malignom
- Magenausgangsstenose.
Verlauf, Komplikationen und Prognose
Komplikationen
- Blutung
- Die Ulkuskrankheit ist die häufigste Ursache für eine OGI-Blutung.27
- Perforation
- Magenausgangsstenose
- H. Pylori erhöht das Risiko für Magenkarzinom und MALT-Lymphom.
- Siehe auch den Artikel Komplikationen bei Magengeschwüren.
Verlauf und Prognose
- Bei kausaler Behandlung sehr gute Prognose6
- Ohne Behandlung einer zugrunde liegenden H.-pylori-Infektion kommt es in 60–90 % der Fälle zu Rezidiven.6
Verlaufskontrolle
- Nach Eradikationstherapie sollte immer eine Erfolgskontrolle durchgeführt werden (unabhängig von der Indikation zur Eradikation).10
- Durchführung frühestens 4 Wochen nach einer Eradikationsbehandlung bzw. 2 Wochen nach Absetzen einer PPI-Therapie10
- Nichtinvasiv kann die Erfolgskontrolle durchgeführt werden durch:
- 13C-Harnstoff-Atemtest – oder -
- Antigen-Stuhltest.
- Bei Vorliegen eines Magenulkus soll nach 4–8 Wochen eine endoskopisch-bioptische Kontrolle durchgeführt werden (bei unvollständiger Abheilung erneut Biopsien zum Malignitätsausschluss).10
- Eine endoskopische Verlaufskontrolle duodenaler Ulzera ist nicht empfohlen, kann aber im Einzelfall beim komplizierten Ulcus duodeni erwogen werden.10
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
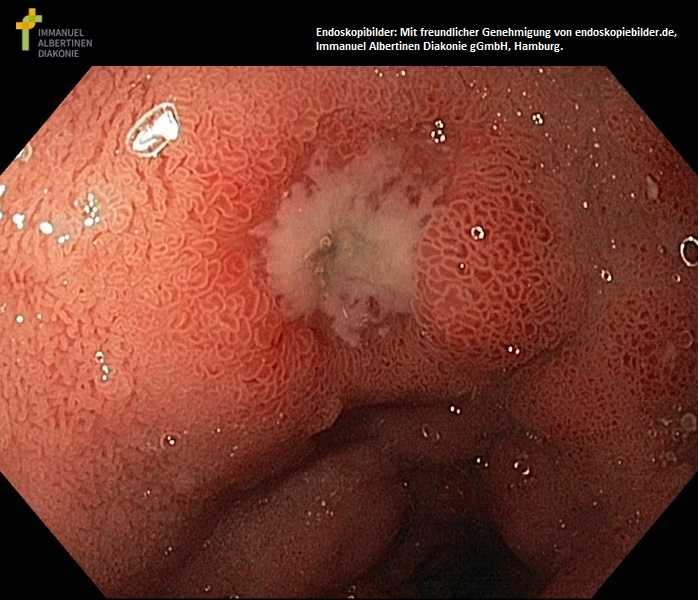
Ulus duodeni mit ödematöser Schleimhaut (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
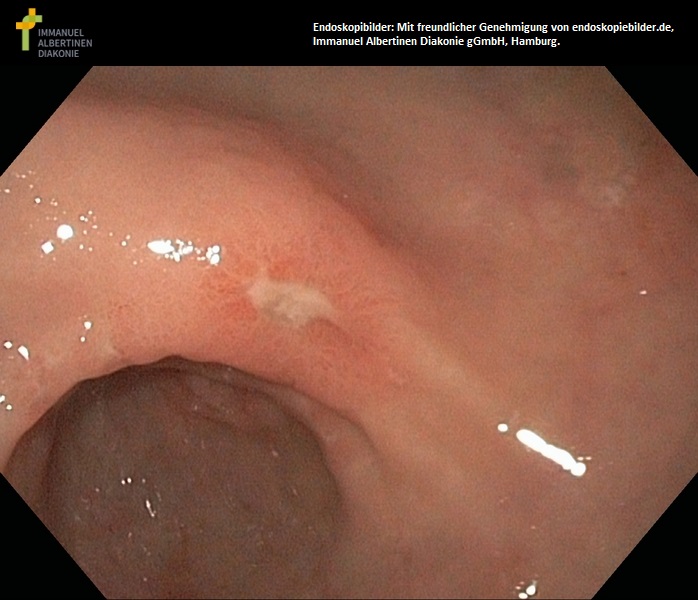
Antrum-Ulkus (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Magen- und Duodenalulkus
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Helicobacter pylori und gastroduodenale Ulkuskrankheit. AWMF-Leitlinie Nr. 021-001. S2k, Stand 2022. www.awmf.org
Literatur
- Robert Koch-Institut (RKI). Gastritis, Magen- und Zwölffingerdarmgeschwüre. Gesundheitsberichterstattung des Bundes Heft 55, 2013. www.rki.de
- Malfertheiner P. Peptic ulcer disease. Lancet 2009; 374: 1449-1461. doi:10.1016/S0140-6736(09)60938-7 DOI
- Lanas A, Chan FKL. Peptic ulcer disease. Lancet 2017; 390: 613–624. www.ncbi.nlm.nih.gov
- Dovjak P. Ulcus duodeni, Ulcus ventriculi und Helicobacter pylori. Z Gerontol Geriat 2017; 50: 159-169. doi:10.1007/s00391-017-1190-x DOI
- Sung J, Kuipers E, El-Serag H. Systematic review: the global incidence and prevalence of peptic ulcer disease. Aliment Pharmacol Ther 2009; 29: 938-46. doi:10.1111/j.1365-2036.2009.03960.x DOI
- Anand B. Peptic Ulcer Disease. Medscape, updated Apr 26, 2021. Zugriff 28.12.21. emedicine.medscape.com
- Peptic ulcer disease. BMJ Best Practice, last updated Dec 11, 2020, Zugriff 28.12.21. bestpractice.bmj.com
- Fashner J, Gitu A. Diagnosis and Treatment of Peptic Ulcer Disease and H. pylori Infection. Am Fam Physician 2015; 91: 236-242. www.aafp.org
- Mössner J. Nebenwirkungen von nichtsteroidalen Antiphlogistika (NSAR) im Gastrointestinaltrakt. eMedpedia. Zugriff 03.01.22 www.springermedizin.de
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Helicobacter pylori und gastroduodenale Ulkuskrankheit. AWMF-Leitlinie Nr. 021-001. S2k, Stand 2022. register.awmf.org
- Malfertheiner P, Schulz C (DGIM). Helicobacter-pylori-assoziierte Erkrankungen. eMedpedia, Zugriff 29.12.21 www.springermedizin.de
- Charpignon C, Lesgourgues B, Pariente A et al. Peptic ulcer disease: one in five is related to neither Helicobacter pylori nor aspirin/NSAID intake. Aliment Pharmacol Ther 2013; 38: 946–54. www.ncbi.nlm.nih.gov
- Fischbach W. Aktuelle Diagnostik und Therapie der Helicobacter-pylori-Infektion. GastroNews 2019; 06: 28-34. doi:10.1007/s15036-019-0484-9 DOI
- Keller J, Franke A, Storr M, et al. Klinisch relevante Atemtests in der gastroenterologischen Diagnostik – Empfehlungen der Deutschen Gesellschaft für Neurogastroenterologie und Motilität sowie der Deutschen Gesellschaft für Verdauungs- und Stoffwechselerkrankungen. Z Gastroenterol 2005; 43: 1071-1090. doi:10.1055/s-2005-858479 DOI
- Best L, Takwoingi Y, Siddique S, et al. Non‐invasive diagnostic tests for Helicobacter pylori infection. Cochrane Database of Systematic Reviews 2018; 3: CD012080. doi:10.1002%2F14651858.CD012080.pub2 Cochrane (DOI)
- Gisbert JP, Pajares JM. Diagnosis of Helicobacter pylori infection by stool antigen determination: A systematic review. Am J Gastroenterol 2001; 96: 2829-38. PubMed
- Calvet X, Ramirez-Lázaro MJ, Montserrat A, et al. Comparative accuracy of 3 monoclonal stool tests for diagnosis of Helicobacter pylori infection among patients with dyspepsia. Clin Infect Dis 2010; 50: 323-8. PubMed
- Fischbach W. Helicobacter Pylori-Infektion: Wann testen und wie therapieren? Dtsch Arztebl 2016 2016; 113: 4-6. doi:10.3238/PersInfek.2016.05.27.01 DOI
- Internisten im Netz: Magen-/Darmgeschwür. Zugriff 03.01.22. www.internisten-im-netz.de
- Wagner S. Neue Empfehlungen in der H.-pylori-Leitlinie. MMW - Fortschritte der Medizin 2018; 19: 61-62. doi:10.1007/s15006-018-1090-z DOI
- Fischbach W, Malfertheiner P. Helicobacter pylori infection—when to eradicate, how to diagnose and treat. Dtsch Arztebl Int 2018; 115: 429-436. doi:10.3238/arztebl.2018.0429 DOI
- McFarland L, Huang Y, Wang L, et al. Systematic review and meta-analysis: Multi-strain probiotics as adjunct therapy for Helicobacter pylori eradication and prevention of adverse events. United European Gastroenterol J 2016; 4: 546-561. www.ncbi.nlm.nih.gov
- Bundesinstitut für Arzneimitel und Medizinprodukte.Rote-Hand-Brief zu Fluorchinolon-Antibiotika: Schwerwiegende und anhaltende, die Lebensqualität beeinträchtigende und möglicherweise irreversible Nebenwirkungen. Zugriff 02.01.22. www.bfarm.de
- Gross M, Aksoy J, op den Winkel P. Wann ist der Einsatz von PPI sinnvoll? MMW - Fortschrite der Medizin 2020; 162: 58-63. www.springermedizin.de
- Kim J, Blackett J, Jodorkovsky D. Strategies for Effective Discontinuation of Proton Pump Inhibitors. Curr Gastroenterol Rep 2018; 20: 27. doi:10.1007/s11894-018-0632-y DOI
- Behrman SW. Management of complicated peptic ulcer disease. Arch Surg 2005; 140: 201-8. PubMed
- Götz M. Gastrointestinale Blutungen. Gastroenterologe 2018; 13: 379-390. doi:10.1007/s11377-018-0285-2 DOI
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Guido Schmiemann, Dr. med., Facharzt für Allgemeinmedizin, Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).