Zusammenfassung
- Definition:Entzündung der Leber, die durch das Hepatitis-A-Virus (HAV) verursacht wird. HAV ist ein RNA-Virus aus der Familie der Picornaviren. Die Übertragung erfolgt fäkal-oral.
- Häufigkeit:Jährliche Inzidenz in Deutschland ca. 1,3 Erkrankungen pro 100.000 Einw.
- Symptome:Prodromalphase mit grippeähnlichen Beschwerden. Anschließend Ikterus, Oberbauchbeschwerden, Juckreiz, dunkler Urin, entfärbter Stuhl. Dauer der ikterischen Phase wenige Tage bis mehrere Wochen. Bei Kleinkindern oft asymptomatisch oder milder Verlauf. Mit zunehmendem Alter oder vorgeschädigter Leber häufiger schwerere Verläufe bis zur fulminanten Hepatitis.
- Befunde:Ikterus, Hepatomegalie, teilweise Splenomegalie.
- Diagnostik:Labor:Erhöhung von Bilirubin und Transaminasen. Definitive Diagnose der akuten Infektion durch Nachweis von Anti-HAV-IgM.
- Therapie:Symptomatisch, eine spezifische Therapie steht nicht zur Verfügung. Abgesehen von seltenen letalen Verläufen (fulminante Hepatitis A) heilt die Erkrankung regelhaft aus, keine chronischen Verläufe. Postexpositionsprophylaxe von Kontaktpersonen durch Impfung und evtl. Immunglobulingabe.
Allgemeine Informationen
Definition
- Die Hepatitis A ist eine Entzündung der Leber, die durch das Hepatitis-A-Virus (HAV) verursacht wird.
Häufigkeit
- HAV-Infektionen können sporadisch, endemisch oder epidemisch auftreten.1
- Weltweit sehr häufige Erkrankung, 2005 ca. 126 Mio. Erkrankungen und 35.000 Todesfälle2
- In Europa liegt die Zahl der gemeldeten Fälle jährlich bei ca. 2,5/100.000 Einw.4
- Abnahme der Inzidenz in den beiden letzten Dekaden
- In Deutschland gab es im Jahr 2019 873 übermittelte Fälle.5
- jährliche Inzidenz ca. 1,1/100.000 Einw.5
- ca. 40–50 % der Fälle durch „Reisehepatitis"1
- In Ländern mit niedrigem Risiko für Infektion durch Nahrungsmittel/Wasser spielen Ausbrüche unter Männern, die Sex mit Männern haben (MSM) und Drogenabhängigen eine relevante Rolle.6
- Kinder und Adoleszente mit Migrationshintergrund mit erhöhter Infektionsrate, auch wenn sie in Deutschland geboren sind.7
- Männer sind etwas häufiger als Frauen betroffen (Inzidenz 1,1 vs. 1,0/100.000).5
- Kommt in allen Altersstufen vor, höchste altersspezifische Inzidenz bei Männern zwischen 25 und 29 Jahren.5
- Inzidenz im Kindesalter vermutlich unterschätzt, da insbesondere Kleinkinder nicht oder nur leicht erkranken.
- Saisonaler Verlauf mit Anstieg im September bis November5
- Reflektiert die erhöhte Reiseaktivität im Sommer/Herbst (verzögertes Auftreten durch Inkubationszeit).
- keine Todesfälle im Jahr 20195
- 6 Todesfälle in 2018: 3 Männer und 3 Frauen im Alter von 50–93 Jahren8
Ätiologie und Pathogenese
Ätiologie
- Krankheitsursache ist eine Infektion mit dem Hepatitis-A-Virus (HAV).
- Klassifikation des Hepatitis-A-Virus9-10
- einzelsträngiges RNA-Virus ohne Hüllmembran
- Familie Picornaviren
- Genus Hepatovirus
- Sehr widerstandsfähiges Virus, charakteristisch sind:1
- ausgeprägte Umweltstabilität
- hohe Thermostabilität
- hohe Desinfektionsmittelresistenz.
Übertragungsweg
- Der Mensch ist Hauptwirt und einzig relevantes Reservoir von HAV.1
- Übertragung ganz überwiegend fäkal-oral durch Kontakt- oder Schmierinfektion1
- enge Kontakte wie innerhalb des Haushalts oder im Kindergarten
- kontaminierte Lebensmittel (vor allem Meeresfrüchte, Gemüse/Salat)
- kontaminiertes Trinkwasser
- In den vergangenen Jahren mehrfach Ausbrüche bei Männern, die Sex mit Männern haben (MSM)11-12
- Eine Übertragung durch Blut oder Blutprodukte ist selten, aber möglich.13
- Die Seropositivität bei Drogenabhängigen im Vergleich zur Allgemeinbevölkerung ist deutlich erhöht.14
- Ursachen: Infektion oral und parenteral möglich, schlechte Lebensbedingungen, höhere Wahrscheinlichkeit eines Gefängnisaufenthaltes
Dauer der Ansteckungsfähigkeit1
- Höchste Ansteckungsfähigkeit 1–2 Wochen vor sowie in den ersten Tagen nach Auftreten des Ikterus oder der Transaminasenerhöhung
- Wahrscheinlich besteht bei den meisten Erkrankten 1 Woche nach Symptombeginn keine Ansteckungsfähigkeit mehr.
- Bei infizierten Säuglingen allerdings ist eine Ausscheidung des Virus im Stuhl über mehrere Wochen möglich.
Pathogenese und klinischer Verlauf1,15-19
- Nach Aufnahme in den Darm Penetration der Mukosa und Weitertransport über das Pfortadersystem in die Leber
- Rezeptorenvermittelter Eintritt in die Hepatozyten
- Replikation des Virus findet vermutlich nahezu ausschließlich in den Hepatozyten statt.
- Das HAV selbst ist nicht zytopathisch.
- Der Zellschaden wird durch Immunmechanismen verursacht.
- Leberzellnekrosen vor allem in den zentrilobulären Arealen, portale Infiltration durch Entzündungszellen
- Freisetzung der Viren in die Gallengänge und Ausscheidung über den Stuhl
- Die Inkubationszeit beträgt im Mittel etwa 4 Wochen (15–50 Tage)
- Mögliche Verläufe der Infektion
- inapparent (asymptomatisch ohne Erhöhung der Leberenzyme)
- subklinisch (asymptomatisch mit Anstieg der Leberenzyme)
- anikterisch (symptomatisch ohne Ikterus)
- ikterisch
- Vor allem bei Kindern häufig asymptomatische Verläufe
- Prodromalphase
- unspezifische gastrointestinale Beschwerden
- allgemeines Krankheitsgefühl
- evtl. erhöhte Temperatur
- Ikterische Phase (einige Tage bis mehrere Wochen)
- Genesungsphase (2–4 Wochen) mit Normalisierung von Befinden und Laborwerten, Ausheilung
- Bei bis zu 10 % der Fälle protrahierte Verläufe (bis zu mehreren Monaten) mit komplikationsloser Ausheilung
- Bei 0,01–0,1 % der Erkrankungen fulminante Hepatitis mit häufig letalem Verlauf
- Zunahme der Häufigkeit mit dem Alter
- vor allem bei vorgeschädigter Leber (z. B. durch Hepatitis B oder C)
- Nach einer Infektion besteht eine lebenslange Immunität.
Prädisponierende Faktoren
- Reisen in Gebiete mit endemischer Hepatitis A
- Niedriger sozioökonomischer Status (z. B. beengte Wohnverhältnisse)
- Migrationshintergrund
- Männer, die Sex mit Männern haben.
- Drogenabhängigkeit
ICPC-2
- D72 Virushepatitis akut
ICD-10
- Nach ICD-10-GM Version 202120
- B15 Akute Virushepatitis A
- B15.0 Virushepatitis A mit Coma hepaticum
- B15.9 Virushepatitis A ohne Coma hepaticum
- B19 Nicht näher bezeichnete Virushepatitis
- B15 Akute Virushepatitis A
Diagnostik
Diagnostische Kriterien
- Verdachtsdiagnose durch Anamnese und klinische Untersuchung
- Eine Diagnose und Abgrenzung zu anderen Hepatitiden ist ohne Laboruntersuchung nicht möglich.21
- Labor
Differenzialdiagnosen
- Andere Virushepatitiden
- Medikamenteninduzierte Hepatitis
- z. B. Paracetamol, Antiepileptika, Isoniazid, orale Kontrazeptiva, Rifampicin, Sulfonamide
- Toxische Hepatitis
- z. B. durch Alkohol oder Tetrachlorkohlenstoff
- Autoimmunerkrankungen
- Bakterielle Infektionen
- Budd-Chiari-Syndrom
- Morbus Wilson
Anamnese
- Allgemeinsymptome
- Krankheitsgefühl
- Müdigkeit, Kraftlosigkeit
- Appetitlosigkeit
- Übelkeit, Erbrechen
- Muskel-, Gliederschmerzen
- Abdominelle Beschwerden
- Druckgefühl/Schmerzen im Oberbauch
- Durchfall
- Gelbfärbung der Augäpfel/der Haut
- Dunkler Urin
- Entfärbter Stuhl
- Juckreiz
- Prädisponierende Faktoren
- Reise in Endemiegebiet
- niedriger sozioökonomischer Status
- Migrationshintergrund
- Männer, die Sex mit Männern haben.
- i. v. Drogenkonsum
- Ausbruch im Umfeld
Klinische Untersuchung
- Ikterus
- Hepatomegalie
- Splenomegalie (25 %)1
- Flüchtige scarlatiniforme Exantheme1
Ergänzende Untersuchungen in der Hausarztpraxis
Labor – Blut
- Klinische Chemie
- Serologie – HAV-Antikörper
- Anti-HAV-IgM
- Anti-HAV-IgG
Labor – Urin und Stuhl
- Urobilinogen, Bilirubin (Teststreifen)
- Stuhldiagnostik im Allgemeinen nicht erforderlich
- Nachweis von HAV-Antigen (ELISA) oder HAV-RNA (PCR)
Konsiliarlabor
- Spezielle fachliche Beratung und diagnostische Leistungen zu infektiologischen Fragestellungen erhältlich über Nationale Referenzzentren und Konsiliarlabore des RKI22
- Aktuelles Konsiliarlabor für Hepatitis A ist das Institut für Klinische Mikrobiologie und Hygiene der Universität Regensburg

Verlaufskurve Hepatitis A
Sonografie
- Keine spezifischen Veränderungen bei akuter Hepatitis
- Evtl. Hepatomegalie, echoärmere Textur
Meldepflicht
- Gemäß § 6 Abs. 1 Nr. 1 IfSG bzw. § 7 Abs. 1 IfSG namentliche Meldung an das Gesundheitsamt1
- Krankheitsverdacht
- Erkrankung
- Tod
- Direkter oder indirekter Nachweis von Hepatitis-A-Virus, soweit er auf eine akute Infektion hinweist.
Indikationen zur Krankenhauseinweisung
- Bei den meisten Patient*innen mit Hepatitis A ist keine Krankenhauseinweisung notwendig.1
- Einweisung erforderlich bei:
Therapie
Therapieziele
- Symptome lindern.
- Intensivmedizinische Stabilisierung bei seltener fulminanter Hepatitis
Allgemeines zur Therapie
- In den allermeisten Fällen selbstlimitierende Erkrankung23
- Hepatitis A wird nicht spezifisch antiviral behandelt.23
- Unterstützende Maßnahmen1
- Bettruhe (in Abhängigkeit vom individuellen Befinden)
- Behandlung von Allgemeinsymptomen: Erbrechen, grippeähnliche Symptome
- keine spezielle Diät: kohlenhydratreiche, fettarme Kost
- absolute Alkoholkarenz
- Vermeidung lebertoxischer Medikamente wie z. B. Paracetamol
- Sorgfältige Hand- und Toilettenhygiene
Maßnahmen nach Erkrankungsbeginn bzw. Exposition
- Die wichtigsten Empfehlungen des Robert Koch-Instituts sind im RKI-Ratgeber Hepatitis A aufgeführt.1
Empfehlungen für Patient*innen
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Isolierung für 1 Woche nach Auftreten des Ikterus (bzw. 2 Wochen nach den ersten klinischen Symptomen)
- Standardhygieneregeln einhalten.
- Während der Erkrankung kein Aufenthalt/keine Tätigkeit im Bereich von Gemeinschaftseinrichtungen oder im Bereich der Lebensmittelverarbeitung
- Aufenthalt bzw. Tätigkeit in der Regel frühestens 2 Wochen nach Auftreten der ersten klinischen Symptome bzw. 1 Woche nach Auftreten des Ikterus möglich.
- Einschränkungen gelten, bis nach ärztlichem Urteil eine Weiterverbreitung nicht mehr zu befürchten ist.
Empfehlungen für Kontaktpersonen, Postexpositionsprophylaxe
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Information von Kontaktpersonen über Übertragungswege, Symptome und Präventionsmaßnahmen
- Frühestmöglich postexpositionelle Schutzimpfung (2-Dosen-Schema)
- Der Impfschutz tritt im Allgemeinen nach 12–15 Tagen nach der 1. Impfdosis ein.
- Bei Patient*innen, für die eine Infektion ein besonders hohes Risiko darstellt, kann zeitgleich zur ersten Aktivimpfung eine passive Immunisierung mit Immunglobulinpräparat durchgeführt werden.24
- Werden Immunglobuline innerhalb von 2 Wochen nach Exposition verabreicht, sinkt das Risiko für eine symptomatische Infektion um 70–90 %.25
- Geimpfte sollten informiert werden, dass weder die aktive noch die passive postexpositionelle Immunisierung die Erkrankung in allen Fällen verhindert.
- Ausschluss von Gemeinschaftseinrichtungen
- für mindestens 2 Wochen nach einer postexpositionellen Impfung
- bei sonstigen Kontaktpersonen 4 Wochen nach dem letzten Kontakt zu einer infektiösen Person
- Bei bereits bestehendem Impfschutz sowie nach bereits durchgemachter Erkrankung ist die Isolierung von Kontaktpersonen nicht erforderlich.
Maßnahmen bei Ausbrüchen
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Möglichst schnelle Identifizierung der Ursache des Ausbruchs und Sanierung der Infektionsquelle
- häufig kontaminierte Lebensmittel, Trinkwasser
- Riegelimpfungen: Impfung von Personen im Umfeld eines Ausbruchs (Impfstoff mit 2-Dosenschema)
- Bei besonders gefährdeten Personen evtl. passive Immunisierung durch Gabe von Immunglobulinen
- bis spätestens 14 Tage nach Exposition
Primärprävention durch Impfung
- Der gesamte Abschnitt basiert auf diesen Referenzen.1,24,26
- Hepatitis A ist durch Impfung nahezu immer zu verhindern.23
- Die serologische Vortestung auf Anti-HAV ist nur bei den Personen sinnvoll, die länger in Endemiegebieten gelebt haben oder in Familien aus Endemiegebieten aufgewachsen sind oder vor 1950 geboren wurden.24
- Gemäß den Empfehlungen des Robert Koch-Instituts sollten folgende Personen geimpft werden.1,24
Reiseimpfung
- Reisende in Gebiete mit hoher Hepatitis-A-Prävalenz
- tropische Regionen
- Mittelmeerraum
- Osteuropa
Indikationsimpfung
- Personen
- mit einem Sexualverhalten mit erhöhtem Expositionsrisiko, z. B. MSM
- mit substitutionspflichtiger Hämophilie
- mit i. v. Drogenkonsum
- in psychiatrischen Einrichtungen oder vergleichbaren Fürsorgeeinrichtungen für Menschen mit zerebralen Schädigungen oder Verhaltensauffälligkeiten
- mit chronischen Leberkrankheit einschließlich chronischer Krankheiten mit Leberbeteiligung.
Impfung bei erhöhtem beruflichem Risiko
- Personen mit einem erhöhten beruflichen Risiko
- Gesundheitsdienst
- Laboratorien (z. B. Stuhluntersuchungen)
- Kindertagesstätten, Pflegeeinrichtungen u. Ä.
- psychiatrische Einrichtungen oder vergleichbare Fürsorgeeinrichtungen für Menschen mit zerebralen Schädigungen oder Verhaltensauffälligkeiten
- Kanalisations- und Klärwerksarbeiter*innen
Impfstoff
- Informationen über alle zugelassenen HAV-Impfstoffe erhalten Sie beim Paul-Ehrlich-Institut (Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel).
- Angaben der Hersteller beachten.
- Impfstoffe sind z. T. für Kinder ab 2 Jahren zugelassen, z. T. erst für Heranwachsende ab 15–18 Jahren.
- Schützende Antikörper entstehen 12–15 Tage nach der 1. Impfdosis.1
- Im weiteren Verlauf sind Antikörper bei mindestens 95 % der Geimpften nachweisbar.1
- Aufgrund der langen Inkubationszeit ist eine Impfung auch kurz vor Reiseantritt noch sinnvoll.1
- Bei Kombinationsimpfstoffen Hepatitis A/B tritt der Schutz erst nach der 2. Impfdosis ein!1
- Immunität nach Grundimmunisierung (2 Dosen bei monovalentem Impfstoff, bei Kombinationsimpfstoff Hepatitis A/B 3 Dosen) mindestens 10 Jahre1
- Bei Immunkompetenten wird eine Auffrischimpfung nicht als notwendig erachtet.
- Modellierungen sprechen dafür, dass schützende Antikörper für mindestens 25 Jahre nach erfolgter Grundimmunisierung persistieren.26
- Siehe auch TrainAMed Impfen (Uni Freiburg).
Verlauf, Komplikationen und Prognose
Komplikationen
- Selten extrahepatische Manifestationen21
- Vaskulitis
- Arthritis
- Pankreatitis
- Thrombozytopenie
- Guillain-Barré-Syndrom
- hämolytische Anämie
- Perikarditis
- akutes Nierenversagen
Verlauf und Prognose
- Dauer der ikterischen Phase wenige Tagen bis mehrere Wochen1
- Bei ca. 10 % der Patient*innen treten protrahierte Verläufe von mehreren Monaten auf.
- Genesungsphase 2–4 Wochen1
- Fulminante Hepatitis A in 0,01–0,1 %1
- Keine chronische Hepatitis, keine chronische Virusausscheidung21
- Die Infektion hinterlässt eine lebenslange Immunität.1
Anerkennung als Berufskrankheit
- Tritt Hepatitis A im Zusammenhang mit der beruflichen Tätigkeit auf, kann diese Erkrankung als Berufskrankheit anerkannt werden.28
- Zuständig hierfür sind die gesetzlichen Unfallversicherungsträger.
- Der Verdacht auf eine Berufskrankheit muss dort gemeldet werden (Meldebogen29).
- Es wird eine ausführliche Arbeits- und Gefährdungsanamnese erhoben, und ein Gutachten entscheidet über die Anerkennung als Berufskrankheit.
- Dann können bestimmte Maßnahmen auf Kosten der GUV durchgeführt werden:
- spezielle therapeutische Maßnahmen
- Minderung der Erwerbsfähigkeit bis zur Zahlung einer Rente.30
Patienteninformationen
Patienteninformationen in Deximed
CME-Punkte
Video
- TrainAMed Impfen (Universität Freiburg)
Illustrationen
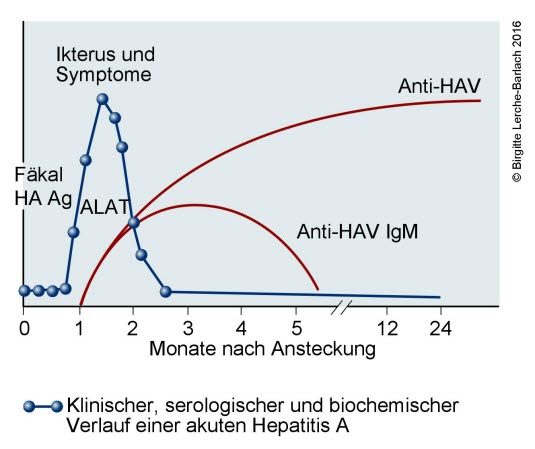
Hepatitis A Verlaufskurve
Quellen
Ratgeber
- Robert Koch-Institut. RKI-Ratgeber Hepatitis A. Stand 2019. www.rki.de
Literatur
- Robert Koch-Institut. RKI-Ratgeber Hepatitis A. Stand 2019. www.rki.de
- World Health Organization (WHO). Weekly epidemiological record 13 July 2012. www.who.int
- Jablonka A, Solbach P, Happle C, et al. Hohe Hepatitis-A-Immunitätsrate bei Flüchtlingen in Deutschland. Med Klin Intensivmed Notfmed 2017; 112: 347–351. link.springer.com
- Gossner C, Severi E, Danielsson N, et al. Changing hepatitis A epidemiology in the European Union: new challenges and opportunities. Euro Surveill 2015; 20: pii=21101. doi:10.2807/1560-7917.ES2015.20.16.21101 DOI
- Robert-Koch-Institut. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2019, Berlin 2020 www.rki.de
- World Health Organization (WHO). Hepatitis A - key facts. Zugriff 09.10.20. www.who.int
- Michaelis K, Poethko-Müller C, Kuhnert R, et al. Hepatitis A virus infections, immunisations and demographic determinants in children and adolescents, Germany. Scientific Reports 2018; 8: 16696. www.nature.com
- Robert Koch-Institut. Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2018. www.rki.de
- Jeong S, Lee H. Hepatitis A: Clinical Manifestations and Management. Intervirology 2010; 53: 15–19. www.karger.com
- Cuthbert JA. Hepatitis A: old and new. Clin Microbiol Rev 2001; 14: 38-58. PubMed
- Deutsche Gesellschaft für Tropenmedizin, Reisemedizin und Globale Gesundheit. Empfehlungen Reiseimpfungen - Hepatitis A. Zugriff 09.10.20. dtg.org
- European Centre for Disease Prevention and Control (ECDC). Rapid risk assessment: Hepatitis A outbreak in the EU/EEA mostly affecting men who have sex with men, 3rd update, 28 June 2017. www.ecdc.europa.eu
- Berufsverband Deutscher Internisten - Internisten im Netz. Hepatitis A - was ist das? Zugriff 10.10.20. www.internisten-im-netz.de
- Lugoboni F, Pajusco B, Albiero A, et al. Hepatitis A virus among drug users and the role of vaccination: a review. Front Psychiatry 2012; 2: 1-9. doi:10.3389/fpsyt.2011.00079 DOI
- Leung A, Kellner J, Davies H. Hepatitis A: A Preventable Threat. Advances in Therapy 2005; 22: 578-586. link.springer.com
- Lemon S, Ott J, Van Damme P, et al. Type A viral hepatitis: A summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J Hepatol 2018; 68: 167-184. www.journal-of-hepatology.eu
- Gilroy R. Hepatitis A. Medscape, updated May 08, 2019. Zugriff 08.10.20. emedicine.medscape.com
- Kemmer NM, Miskovsky EP. Hepatitis A. Infect Dis Clin North Am 2000; 14: 605-15. PubMed
- Yong H, Son R. Hepatitis A virus – a general overview. Int Food Res J 2009; 16: 455-467. www.ifrj.upm.edu.my
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI): ICD-10-GM Version 2021. Stand 18.09.2020 (letzter Zugriff 23.06.2021). www.dimdi.de
- Matheny SC, Kingery JE. Hepatitis A. Am Fam Physician 2012; 86: 1027-34. PubMed
- Robert Koch-Institut. Gesamtliste der Nationalen Referenzzentren und Konsiliarlabore. Aktuelle Berufungsperiode (2020-2021). Stand 2020. www.rki.de
- Cornberg M, Manns M. Hepatitis A, B, C, D, E: Trotz gleicher Namen viele Unterschiede. Dtsch Arztebl 2015; 112: 4-8. doi:10.3238/PersInfek.2015.06.05.01 DOI
- Ständige Impfkommission. Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut. Epid Bull 34, 2020. www.rki.de
- Bianco E, DeMasi S, Mele A, Jefferson T. Effectiveness of immune globulins in preventing infectious hepatitis and hepatitis A: a systematic review. Dig Liver Dis 2004; 36: 834-42. PubMed
- Kling K, Bogdan C, Ledig T et al. Empfehlungen der Ständigen Impfkommission (STIKO) zu Reiseimpfungen. Epid Bull 2021; 14: 1–182 www.rki.de
- Koenig K, Shastry S, Burns M. Hepatitis A Virus: Essential Knowledge and a Novel Identify-Isolate-Inform Tool for Frontline Healthcare Providers. West J Emerg Med 2017; 18: 1000–1007. doi:10.5811/westjem.2017.10.35983 DOI
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). Dortmund. Dokumente zu den einzelnen Berufskrankheiten. Zugriff 13.10.20. www.baua.de
- DGUV Formtexte für Ärzte: Ärztliche Anzeige bei Verdacht auf eine Berufskrankheit. www.dguv.de
- Mehrtens, G. Valentin, H. Schönberger, A. Arbeitsunfall und Berufskrankheit : rechtliche und medizinische Grundlagen für Gutachter, Sozialverwaltung S.878ff. Berlin: Erich Schmidt Verlag 9: Auflage, 2017.
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).