Zusammenfassung
- Definition:Zöliakie ist eine genetisch bedingte, chronisch-entzündliche Autoimmunerkrankung des Darms, die sich beim Konsum von glutenhaltigen Nahrungsmitteln manifestiert. Dabei werden die Darmzotten der Dünndarmschleimhaut geschädigt.
- Häufigkeit:0,3 % der europäischen Bevölkerung leiden an Zöliakie, aber die Anzahl der Patient*innen mit einer nicht diagnostizierten Zöliakie ist wahrscheinlich höher. Die Zöliakie kann im Säuglings- und Kleinkindalter das 1. Mal auftreten, kann aber in jedem Alter diagnostiziert werden.
- Symptome:Die meisten Betroffenen mit Zöliakie sind symptomfrei (5 von 6), aber gastrointestinale Symptome und Symptome aufgrund von Malabsorption (z. B. Wachstumsverzögerung und Anämie) können auftreten.
- Befunde:Meist liegt kein klinischer Befund vor. Es können Anzeichen einer Malabsorption, einer Maldigestion (wie Wachstumsverzögerung) oder Dermatitis herpetiformis Duhring (Hautmanifestation bei Zöliakie) festgestellt werden.
- Diagnostik:Serologische Tests auf Antikörper gegen Transglutaminase. Für die Diagnose ist meist eine Dünndarmbiopsie notwendig.
- Therapie:Lebenslange glutenfreie Ernährung.
Allgemeine Informationen
Definition
- Zöliakie
- Die Bezeichnung „einheimische Sprue“ sollte nicht mehr verwendet werden.2
Klinische Manifestationen1-2
- Klassische Zöliakie (10–20 % aller Fälle)
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie in Kombination mit klinischen Symptomen:
- Beginn im frühen Kleinkindalter (1. –3. Lebensjahr) nach Einführung glutenhaltiger Kost
- voluminöse übelriechende Diarrhö, Fettstühle, Flatulenz
- Zeichen der Malabsorption: Gewichtsverlust, Gedeihstörung
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie in Kombination mit klinischen Symptomen:
- Symptomatische Zöliakie
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie in Kombination mit klinischen Symptomen:
- unspezifische gastrointestinale oder extraintestinale Symptome
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie in Kombination mit klinischen Symptomen:
- Subklinische Zöliakie
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie
- symptomfrei
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie
- Potenzielle Zöliakie
- Nachweis von Antikörpern und HLA-DG2/DQ8, negative Histologie
- Progression zur Zöliakie möglich
- transiente Erhöhung der Antikörper möglich
- Refraktäre Zöliakie (weniger als 1 % der Zöliakie-Patient*innen)3
- Nachweis von Antikörpern und HLA-DG2/DQ8, positive Histologie mit Erkrankungsrezidiv bzw. primärem Versagen einer glutenfreien Ernährung über 12 Monate
- Betrifft typischerweise erwachsene Patient*innen.
Häufigkeit
- Die Prävalenz liegt in Deutschland bei ca. 1:250.1
- BMJ BestPractice nennt eine Prävalenz von 0,7–1,4:100 für Europa und die USA.3
- Erstmanifestation in jedem Alter möglich, gehäuft im frühen Kindesalter und in der 4.–5. Lebensdekade1
- Frauen sind etwas häufiger betroffen.3
- 20 % der Patient*innen sind asymptomatisch.3
- Es ist immer noch mit einer hohen Zahl von erkrankten, aber nicht diagnostizierten Personen zu rechnen.2
- Personen mit einer/einem an Zöliakie Verwandten 1. Grades haben ein Zöliakie-Risiko von 7 %.3
Ätiologie und Pathogenese
Autoimmunerkrankung
- Die Erkrankung wird durch eine Autoimmunreaktion verursacht.
- Wird der Dünndarm antigenen Komponenten in Weizen, Gerste und Roggen (Gluten und Gliadin) ausgesetzt, werden Antikörper gegen Gluten und seine Komponenten gebildet.1
- Es entstehen Autoantikörper gegen Gewebstransglutaminase.
- Gluten ist ein Speichereiweiß, das aus unterschiedlichen Proteinen besteht. Diese Proteine sind für die Backeigenschaften des Mehls wichtig.
- Die immunologische Reaktion führt zu einer Abflachung der mukosalen Oberfläche des Dünndarms mit Zottenatrophie, Kryptenhyperplasie und lymphozytärer Infiltration des Epithels und der Lamina propria.1,3
- Wird der Dünndarm antigenen Komponenten in Weizen, Gerste und Roggen (Gluten und Gliadin) ausgesetzt, werden Antikörper gegen Gluten und seine Komponenten gebildet.1
Genetik
- Krankheitsassoziiert sind HLA-Antigene HLA-DQ2 und HLA-DQ8.2
- 30–40 % der Bevölkerung exprimieren HLA-DQ2 oder -DQ8, aber nur 2–3 % davon erkranken an Zöliakie.
- HLA-Risiko-Antigene sind notwendig, aber alleine nicht ausreichend für die Entstehung einer Zöliakie.
- Ein Fehlen der Risiko-Allele schließt Zöliakie weitgehend aus.
- höchstes Risiko bei Personen mit Homozytogie für DQ2 (Zöliakie bei jeder 3. betroffenen Person)
- Bei 98–99 % der Betroffenen findet man HLA-DQ2 mit oder ohne -DQ8 oder nur -DQ8.
Weitere Ursachen
- Die weiteren Faktoren, die zu einem Verlust der immunologischen Toleranz gegenüber Gluten führen, sind nicht bekannt.3
- Diskutiert werden:3
- Zeitpunkt der erstmaligen Glutenexposition
- höhere aufgenommene Glutenmenge in den ersten 5 Lebensjahren
- Gastrointestinale Infektionen, die zu einer Gluten-Antigen-Mimikry führen oder zu einer direkt geschädigten intestinalen Epithelbarriere.
- Veränderung des Darmmikrobioms.
Klinische Folgen
- Malabsorption1
- durch eine verminderte Darmoberfläche
- Maldigestion1
- aufgrund der verminderten epithelialen Enzymaktivität
Prädisponierende Faktoren
- Vererbung (s. o.)
- Erkrankungen/Konstellationen, die bei einer Zöliakie gehäuft auftreten und/oder mit einem erhöhten Risiko für Zöliakie einhergehen und bei denen ggf. eine Zöliakie-Diagnostik veranlasst werden sollte:1-2
- Diagnose einer Zöliakie bei Verwandten 1. (auch 2.) Grades
- genetische Syndrome
- Autoimmunerkrankungen
- Typ-1-Diabetes
- autoimmune Lebererkrankungen
- primär sklerosierende Cholangitis,
- primäre biliäre Cholangitis (PBC),
- Autoimmunhepatitis (AIH)
- Hashimoto-Thyreoiditis, M. Basedow
- Addison-Syndrom
- Kollagenosen
- Hauterkrankungen
- gastroenterologische Erkrankungen
- mikroskopische Kolitis
- Reizdarmsyndrom
- chronische Pankreatitis
- Laktoseintoleranz
- Neurologie/Psychiatrie
- Pulmologie
ICPC-2
- D99 Erkrankung Verdauungsyst., andere
ICD-10
- K90 Intestinale Malabsorption
- K90.0 Zöliakie
Diagnostik
Diagnostische Kriterien
- Es gibt kein klinisches Bild (z. B. Adipositas, Obstipation etc.), das per se eine Zöliakie ausschließt.2
- Daher sollte eine Zöliakie bei einer Vielzahl von Symptomen, Erkrankungen und Befunden erwogen werden.
- Die Diagnose einer Zöliakie ist gesichert, wenn2
- zöliakiespezifische Autoantikörper positiv sind und
- die Histopathologie von Duodenalbiopsien Kryptenhyperplasie, partielle oder totale Zottenatrophie bestätigt oder
- alle Kriterien für die Zöliakie-Diagnose ohne Biopsien erfüllt sind.
- tTG-IgA (bei Kindern gleich oder) über dem Zehnfachen des Grenzwertes
- bei Erwachsenen zusätzlich Nachweis von Endomysium-IgA.
- Voraussetzung für die Zuverlässigkeit der serologischen und histopathologischen Zöliakie-Diagnostik ist eine regelmäßige und ausreichende Zufuhr von Gluten.2
- Bei V. a. Zöliakie soll vor Einleitung einer Diagnostik (Serologie, Endoskopie) die Glutenzufuhr in der Ernährung der Patient*innen anamnestisch erhoben und dokumentiert werden.
- Wurde eine glutenfreie oder glutenreduzierte Kost bereits begonnen, kann eine sichere Diagnose erst nach Glutenbelastung gestellt werden.
- Bei unspezifischen Symptomen wie Müdigkeit, Leistungsschwäche, Appetitlosigkeit, aber auch bei Verhaltensauffälligkeiten oder Depression im Erwachsenenalter sollte auch an eine Zöliakie gedacht werden.1
- Weitere Symptome, Konstellationen und Krankheitsbilder, bei denen die Leitlinie eine differenzialdiagnostische Erwägung von Zöliakie und ggf. weitere Diagnostik empfiehlt, sind im Abschnitt Prädisponierende Faktoren und in Tabelle 1.2 der Leitlinie zu finden.
Differenzialdiagnosen
- Der folgende Abschnitt basiert, sofern nicht anders angegeben, auf dieser Referenz.3
- IBS (Reizdarmsyndrom)
- Die Prävalenz von Zöliakie ist bei Kindern, die die Kriterien für IBS erfüllen, 4-mal höher als bei Kindern mit Bauchschmerzen, aber ohne IBS.4
- Ein Screening auf Zöliakie ist bei Patient*innen mit IBS sinnvoll.2
- Colitis ulcerosa
- Morbus Crohn
- Mikroskopische Kolitis
- Giardiasis
- Tropische Sprue
- Chronische Pankreatitis
- Nahrungsmittelallergie und -unverträglichkeit
- Milcheiweißallergie
- Laktoseintoleranz
- Fruktosemalabsorption
- Bakterielle Dünndarm-Fehlbesiedelung
- Medikamenteninduzierte Enteropathie (z. B. durch Olmesartan, NSAR)
- Nicht-Zöliakie-Nicht-Weizenallergie-Weizensensitivität2
- Bei der Weizensensitivität ohne Vorliegen einer Zöliakie handelt es sich um ein eigenständiges klinisches Krankheitsbild.
Anamnese
- Die klinischen Symptome und der Schweregrad des Krankheitsbildes können sehr variabel sein.2
- Kein klinisches Bild, wie z. B. Adipositas oder Obstipation, kann eine Zöliakie ausschließen.
- Stichwort: „Chamäleon der Gastroenterologie“
- Zöliakie kann ohne gastrointestinale Symptome auftreten.2
- Nach Ernährung und bereits begonnener glutenarmer oder glutenfreier Diät fragen.2
- Sog. klassische Symptome, z. B. abdominelle Beschwerden wie Dyspepsie, Flatulenz oder Wechsel der Stuhlgewohnheiten, treten vor allem im frühen Kindesalter und insgesamt nur bei einer Minderheit der Patient*innen auf.2
- Symptome einer Zöliakie unterscheiden sich bei den unterschiedlichen Formen der Zöliakie erheblich.2
- klassische Zöliakie: Zeichen der Malabsorption
- meistens im frühen Kleinkindalter mit Symptomen und Zeichen der Malabsorption wie chronischen Durchfällen, voluminösen, z. T. fettglänzenden, übelriechenden Stühlen, Eiweißmangelödemen und vor allem einer Gedeihstörung
- Die volle Ausprägung des Krankheitsbilds beim Kleinkind umfasst ein aufgetriebenes Abdomen, voluminöse übelriechende dyspeptische Diarrhöen, Wachstumsretardierung, Muskelhypotrophie, Anorexie und eine Veränderung des Verhaltens.
- symptomatische Zöliakie: unspezifische gastrointestinale oder extraintestinale Symptome
- unspezifische gastrointestinale Beschwerden, wie chronische Obstipation, Blähungen, ausladendes Abdomen und Bauchschmerzen, Dyspepsie oder Wechsel der Stuhlgewohnheiten
- evtl. auch Schlaflosigkeit, Müdigkeit, Leistungsminderung, Depressionen oder Obstipation
- subklinische Zöliakie: ohne klinische Symptome, aber auffällige Laborwerte oder klinische Besserung unter Diät (z. B. verbesserte Leistungsfähigkeit)
- potenzielle Zöliakie: keine oder wenig spezifische Symptome oder Zeichen
- refraktäre Zöliakie (nur bei Erwachsenen): Zeichen der Malabsorption und Zottenatrophie trotz glutenfreier Diät über 12 Monate
- klassische Zöliakie: Zeichen der Malabsorption
- Symptome einer Zöliakie außerhalb des Gastrointestinaltraktes, siehe Abschnitt Prädisponierende Faktoren.1-2
Klinische Untersuchung
- Ein klinischer Befund liegt nur selten vor.
- Größe, Gewicht
- niedriger BMI, evtl. Ödeme
- Cave: ca. 28 % der Betroffenen sind übergewichtig, 11 % adipös!2
- Bei Kindern kann die Wachstumskurve auf eine Gedeihstörung hinweisen, und es kann Anzeichen einer Mangelernährung wie starker Gewichtsverlust und Blähbauch (75 %) geben.
- niedriger BMI, evtl. Ödeme
- Sowohl bei Kindern als auch bei Erwachsenen können verschiedene Haut- und Schleimhautveränderungen auftreten.
- z. B. Dermatitis herpetiformis Duhring (siehe dort)
Ergänzende Untersuchungen
- Für die Diagnostik ist entscheidend, dass sie unter glutenhaltiger Ernährung erfolgt, da sich alle Werte bei glutenfreier Diät normalisieren.
- Antikörper gegen Gewebstransglutaminase (tTG-Ak) werden zur Diagnose einer vermuteten Zöliakie herangezogen (siehe Leitlinienkasten).
- Serum-IgA zum Ausschluss eines IgA-Mangels
- Schnelltests, Speichel-, und Stuhlantikörpertests sollen nicht verwendet werden.2
- Weitere Untersuchungen werden für die Differenzialdiagnose oder die Feststellung von Komplikationen aufgrund der Zöliakie durchgeführt.2
- Blutbild, Ferritin, Folsäure, Vitamin B12, Vitamin D (25-OH-Cholecalciferol), Ca, PTH, Nüchternglukose, TSH, Transaminasen GOT, GPT
- ggf. weitere Diagnostik bei V. a. Begleiterkrankung
Serologie
- Risiko für falsch negative Tests2
- In folgenden Situationen ist mit falsch negativen Testergebnissen zu rechnen:
- angeborene oder erworbene Immundefekte
- Eiweißverlust über Darm, Niere oder Haut mit Hypoproteinämie und
- unter glutenreduzierter oder glutenfreier Ernährung.
Leitlinie: Empfohlene Diagnostik2
Serologie
- Die Diagnostik sollte unter glutenhaltiger Ernährung erfolgen.
- Als ersten Schritt in der diagnostischen Abklärung einer Zöliakie bei Personen mit intestinalen oder extraintestinalen Symptomen/klinischen Zeichen oder genetischen Risikokonstellationen (siehe Abschnitt Prädisponierende Faktoren) sollte die Serologie unter glutenhaltiger Kost durchgeführt werden.
- Autoantikörper gegen Gewebstransglutaminase 2 (tTG-IgA synonym: TG-2 oder TGA) und Endomysium (EMA) der Klasse IgA zeigen die höchste Spezifität für die serologische Zöliakie-Diagnostik („zöliakiespezifische Autoantikörper“).
- Die Bestimmung von zöliakiespezifischen Autoantikörpern erlaubt ein Screening auf Zöliakie bei symptomatischen und asymptomatischen Patient*innen. („Screening“ bedeutet hier eine Untersuchung bei den o. g. Symptom- und Befundkonstellationen ohne Diagnosesicherung durch Biopsie, Anm. d. Red.)
- Bei klinischem Verdacht auf Zöliakie
- IgA-Antikörper gegen Gewebstransglutaminase (tTG-IgA-Ak)
- Gesamt-IgA im Serum
- Bei erniedrigtem Gesamt-IgA im Serum und negativem tTG-IgA sollen IgG-Antikörper gegen
- Gewebs-Transglutaminase (tTG-IgG)
- Endomysium (EMA-IgG) oder
- deamidierte Gliadinpeptide (dGP-IgG) bestimmt werden.
- Bei Patient*innen mit IgA-Mangel und positivem IgG-basiertem Test sollen unabhängig vom Alter und von der Konzentration (Titerhöhe) der Antikörper im IgG-basierten Test zur Sicherung der Zöliakie-Diagnose Duodenalbiopsien durchgeführt werden.
- Tests zur Bestimmung von Antikörpern gegen
- deaminierte Gliadinpeptide (dGP-IgG und dGP-IgA)
- Endomysium (EMA-IgA und EMA-IgG)
- Gewebstransglutaminase der Klasse IgG (tTG-IgG) und
- unzureichend validierte Epitop-spezifische tTG-Tests sollen allein oder in Kombination mit tTG-IgA in der initialen Diagnostik nicht eingesetzt werden.
- Die hier genannten Tests sollen auch nicht bei Personen mit normalem Gesamt-IgA und initial negativem tTG-IgA-Ergebnis eingesetzt werden.
- Die folgenden Tests sind zur Diagnostik der Zöliakie nicht geeignet und sollen nicht verwendet werden:
- Antikörper gegen natives Gliadin (AGA) oder Weizenkeim-Agglutinin (WGA)
- Bestimmung von Zonulin im Serum oder Stuhl
- zöliakiespezifische Antikörper im Speichel und Stuhl
- Blut-Schnelltests.
Umgang mit Befunden
- Unabhängig davon, ob die Zöliakie-Diagnose mit oder ohne Histopathologie gestellt wurde, sollten alle diagnosesichernden Ergebnisse (Serologie und Histopathologie) mit Datum der Untersuchung in einem Dokument zusammengefasst und den Patient*innen ausgehändigt werden (z. B. Zöliakie-Pass oder Arztbrief).
Genetische Untersuchung auf HLA-Risikogene
- Die Bestimmung von HLA-Risikogenotypen und abgeleiteten -phänotypen ist zur Sicherung einer Zöliakie-Diagnose nicht notwendig und soll dafür auch nicht erfolgen.
- In besonderen Situationen kann ihre Bestimmung wegen ihres hohen negativen Vorhersagewertes zum weitgehenden Ausschluss einer Zöliakie eingesetzt werden:
- Geschwisterkinder und Kinder von Zöliakie-Betroffenen oder Kinder mit erhöhten genetischen Risiken (Down-Syndrom, Turner-Syndrom, Williams-Beuren-Syndrom)
- Patient*innen mit zöliakieverdächtigen Schleimhautläsionen (Marsh 1 bis Marsh 3), die unter glutenhaltiger Ernährung keine Zöliakie-spezifischen Antikörper haben.
- Patient*innen, die ohne sichere Zöliakie-Diagnose (Serologie, Histopathologie) wegen Beschwerden vor Monaten eine GFD begonnen haben.
- Zum sicheren Ausschluss einer Zöliakie sollen Verfahren zum Einsatz kommen, die die Genotypen erfassen, die für die Risikophänotypen DQ2.5, DQ8 und DQ2.2 kodieren.
- Nach dem Gendiagnostik-Gesetz werden Leistungen zur Risikoabschätzung nicht von den gesetzlichen Krankenkassen übernommen.
Verlaufskontrolle
- Bei Zöliakie-Betroffenen ohne IgA-Mangel soll ausschließlich tTG-IgA zur Verlaufskontrolle bestimmt werden.
- Bei Patient*innen mit IgA-Mangel soll ein IgG-basierter Test (EMA, tTG-IgA, dGP) verwendet werden.
- Die erste serologische Kontrolle sollte 6 Monate nach Beginn der Diät erfolgen und dann alle 6 Monate, bis das Ergebnis unter dem Grenzwert liegt.
- Einmal jährlich, bei sehr stabilem Verlauf im Erwachsenenalter auch alle 2 Jahre, sollte eine serologische Kontrolle erfolgen.
- Bei Wiederauftreten von zöliakieverdächtigen Symptomen soll unabhängig von anderer Diagnostik (z. B. Duodenalbiopsie) auch eine serologische Kontrolle erfolgen.
Diagnosestellung ohne Biopsie
- Bei Kindern und Jugendlichen unter 18 Jahren mit tTG-IgA-Konzentration gleich oder über dem 10-fachen des Grenzwertes soll nach vorheriger Aufklärung eine Zöliakie-Diagnose ohne Biopsien als Option angeboten werden.
- Die Aufklärung über das Für und Wider einer Diagnose ohne Biopsien soll durch Kindergastroenterologen*innen erfolgen.
- Entscheiden sich Eltern/Betroffene nach dem Gespräch für die Diagnosestellung ohne Biopsien, soll zur Diagnosesicherung in einer zweiten Blutprobe EMA-IgA bestimmt und positiv sein.
- In allen anderen Fällen sollen zur Diagnosesicherung Duodenalbiopsien entnommen werden.
- Erwachsenen mit tTG-IgA-Konzentration über dem 10-fachen Wert des Grenzwertes, mit Kontraindikation zur oberen Endoskopie mit Biopsieentnahmen (z. B. Patient*innen mit Gerinnungsstörung) sollte eine Zöliakie-Diagnose ohne Biopsie angeboten werden, wenn EMA-IgA in einer zweiten Blutprobe nachgewiesen wurde.
Endoskopie und Biopsie
- Zur Primärdiagnostik der Zöliakie soll bei Erwachsenen eine Ösophago-Gastro-Duodenoskopie mit Histologiegewinnung erfolgen, sofern keine Kontraindikationen vorliegen.
- Zur Primärdiagnostik der Zöliakie soll bei Kindern und Jugendlichen eine Histologiegewinnung mittels Ösophago-Gastro-Duodenoskopie erfolgen, sofern nicht die o. g. Kriterien für eine Diagnosestellung ohne Biopsie erfüllt sind.
- Eine erneute Entnahme von Dünndarmbiopsien und ihre histologische Beurteilung soll zur Verlaufsdiagnostik einer Zöliakie nur dann durchgeführt werden, wenn trotz abfallender Serologie und Diätkontrolle innerhalb von 12 Monaten kein klinisches Ansprechen zu beobachten ist, bei Verschlechterung auch früher, oder wenn es nach initialem Ansprechen zum Wiederauftreten von Zöliakie-Symptomen kommt.
Häufigkeit der tTG-IgA-Antikörper-Bestimmung bei verschiedenen Indikationen
- Der folgende Abschnitt basiert auf dieser Referenz.2
- Genetisches Risiko ohne klinische Symptome (bekannter oder bekannter HLA-Genotyp DQ2 und/oder DQ8, z. B. Zöliakie bei Verwandten 1. Grades, Trisomie 21)
- mehrmalige Serologie bei:
- Kindern > 1 bis < 7 Jahre: 1 x/Jahr
- Kindern 7 bis < 18 Jahre: 1 x/2–3 Jahre
- einmalige Serologie bei:
- Erwachsenen (mindestens)
- Frauen vor geplanter Schwangerschaft.
- mehrmalige Serologie bei:
Indikationen zur Überweisung
- Überweisung zur Ösophago-Gastro-Duodenoskopie zur Biopsie (Ausnahmen siehe Leitlinienkasten)
- Laut Leitlinie soll die Diagnose durch (Kinder-)Gastroenterolog*innen oder Ärzt*innen mit „besonderen Kenntnissen zur Zöliakie“ vermittelt werden (ohne genauere Definition, was besondere Kenntnisse sind, Anm. d. Red.).2
- Die Patient*innen sollten eine Ernährungsberaterin/einen Ernährungsberater aufsuchen.
- Zöliakie-Patient*innen, die trotz glutenfreier Ernährung Beschwerden haben, sollen an Spezialist*innen überwiesen werden.
- Kinder mit Zöliakie sollen von Kindergastroenterolog*innen behandelt werden.
Therapie
Therapieziele
- Pathologische Veränderungen und Funktionsstörungen der Darmschleimhaut verbessern.
- Beschwerden bessern.
- Komplikationen wie Osteoporose und Lymphome usw. vorbeugen.
Allgemeines zur Therapie
- Die einzige anerkannte Therapie der Zöliakie ist eine lebenslange glutenfreie Ernährung.3
- Diese Diät sollte nicht begonnen werden, bevor eine definitive, am besten histologisch bestätigte, Diagnose vorliegt.
- Bei einer glutenfreien Diät kann es zu einer geringeren Ballaststoffaufnahme, zum Mangel an Vitaminen und Mikronährstoffen sowie zu einer höheren Aufnahme von Kalorien, Kohlenhydraten und gesättigten Fettsäuren kommen.3
Leitlinie: Therapie2
Glutenfreie Diät
- Symptomatische Personen aller Altersgruppen mit gesicherter Zöliakie sollen unabhängig von möglichen Begleiterkrankungen mit einer glutenfreien Diät behandelt werden.
- Asymptomatische Kinder und Jugendliche mit gesicherter Zöliakie sollen unabhängig von möglichen Begleiterkrankungen mit einer glutenfreien Diät behandelt werden.
- Asymptomatische Erwachsene mit gesicherter Zöliakie sollen unabhängig von möglichen Begleiterkrankungen (z. B. Typ-1-Diabetes, Schilddrüsenerkrankungen) mit einer GFD behandelt werden. Die Vor- und Nachteile einer GFD sollen den Betroffenen dargelegt werden.
- Die GFD soll bei gesicherter Diagnose Zöliakie lebenslang strikt eingehalten werden. Ziel ist es, dass die Glutenmenge bei < 10 mg pro Tag liegt.
- Eine potenzielle Zöliakie stellt keine Indikation zur GFD dar.
Vermeidung von Kontaminationen
- Bei der Durchführung der GFD im Alltag sollen mögliche Kontaminationen vermieden bzw. stark eingeschränkt werden.
- Es sollen nur glutenfreie Getreide/Pseudogetreide/Hülsenfrüchte und Erzeugnisse daraus mit dem Symbol der durchgestrichenen Ähre, der Aufschrift „glutenfrei“ oder anhand der aktuellen Aufstellung glutenfreier Lebensmittel der Deutschen Zöliakie-Gesellschaft e. V. (DZG e. V.) empfohlen werden, da andere Produkte ein erhöhtes Risiko für eine unbeabsichtigte Kontamination aufweisen.
Ernährungstherapie
- Patient*innen sollen zeitnah nach gesicherter Diagnose einer Zöliakie eine individuelle prozessgeleitete Ernährungstherapie durch eine Ernährungsfachkraft erhalten. Die Ernährungstherapie sollte regelmäßig wiederholt werden.
- Die Ernährungstherapie für die genannten Indikationen ist derzeit keine Kassenleistung, kann aber von den behandelnden Ärzt*innen empfohlen werden. Es empfiehlt sich, vor einer Terminvereinbarung Rücksprache mit der Krankenkasse zu halten und eine stellenweise mögliche Bezuschussung zu erfragen.
- Es muss eine Zuweisung über eine Notwendigkeitsbescheinigung einer Ernährungstherapie der Ärztin/des Arztes erfolgen.
- Eine Ernährungstherapie soll mögliche Risiken einer GFD insbesondere in Bezug auf Nährstoffverteilung und schädliche Inhaltsstoffe berücksichtigen.
Laktosereduzierte Diät
- Eine laktosereduzierte/-arme Diät soll nur empfohlen werden, wenn Beschwerden nach dem Verzehr von laktosehaltigen Lebensmitteln auftreten. Die Enteropathie-assoziierte sekundäre Laktoseunverträglichkeit ist in der Regel transient.
Mangelerscheinungen
- Bei Malnutrition oder klinisch relevantem Mangel an Mikronährstoffen soll eine adäquate altersspezifische Nährstoff-, Vitamin- und Mineralstoffzufuhr und/oder eine Substitution mit Vitaminen/Mineralstoffen durchgeführt werden.
Selbsthilfe
- Betroffenen sollte nach der Diagnosestellung der Kontakt zu einer Selbsthilfegruppe vermittelt werden, da regelmäßige Gruppentreffen den Erfahrungsaustausch fördern und entscheidend zur Compliance und Lebensqualität beitragen.
Empfehlungen für Patient*innen
- Ausschlussdiät
- Bei einem Verdacht auf Zöliakie sollte mit einer glutenfreien Ernährung nicht vor der gastroenterologischen Untersuchung begonnen werden.1
- Glutenfreie Ernährung2
- Siehe Artikel Gluten- und Weizenunverträglichkeit.
- Folgende glutenhaltige Getreide und daraus hergestellte Erzeugnisse sind nicht erlaubt und müssen laut Lebensmittelinformationsverordnung VO (EU) Nr. 1169/2011 gekennzeichnet werden:2
- Weizen (Hart- und Weichweizen, Khorasan-Weizen/ Kamut®)
- Roggen
- Gerste
- Dinkel
- Grünkern
- Triticale (Kreuzung aus Hartweizen und Roggen)
- Tritordeum (Kreuzung aus Hartweizen und Wildgerste)
- Emmer
- Urkorn
- Einkorn oder Kreuzungen und Hybridstämme davon
- handelsüblicher Hafer
- Glutenfrei gekennzeichnete/r Hafer/Haferprodukte können bei GFD verzehrt werden, wenn unter dem Verzehr keine Symptome auftreten.
- Handelsübliche, nicht als glutenfrei gekennzeichnete Haferprodukte sollen nicht von Zöliakie-Betroffenen verzehrt werden.
- Folgende nicht kontaminierte glutenfreie Getreide sind erlaubt:2
- Hirse/Teff
- Mais
- Reis/Wildreis
- Hafer (s. o.).
- Folgende nicht kontaminierte glutenfreie Gewächse/Mehlpflanzen/Pseudogetreide sind erlaubt:2
- Amaranth (Kiwicha)
- Buchweizen
- Chiasamen
- Erdmandeln
- Hanf
- Hülsenfrüchte
- Kartoffelmehl/Kartoffelstärke
- Kastanie
- Kichererbsen
- Kochbanane
- Kokosmehl
- Leinsamen
- Lupinen
- Maniok
- Nussmehle
- Quinoa
- Soja
- Tapioka
- Traubenkernmehl.
- Die Hauptrisiken beim Verzehr glutenfreier Getreide/Pseudogetreide und anderer Lebensmittel sind Kontaminationen im Ernte-, Herstellungs-, Verarbeitung,- Verpackungs- und Lagerungsprozess.2
- Nahrungsmittel, die Gluten enthalten können:1
- Bouillon, Fertigsoßen/-suppen, Fleisch-/Gemüsekonserven, Imbissprodukte (Hamburger), Fleischsoßen, Wurstwaren
- Eiscreme, Fruchtjoghurt, Kondensmilch, Pralinen
- Instantkaffee/-tee, Schokoladen-/Kakaogetränke
- Ketchup, Salatdressings, Senf, Streichkäse, Tomatensoße/-mark.
- Eine glutenfreie Diät durchzuhalten ist schwierig. Es kann zu Diätfehlern kommen.3
Medikamentöse Therapie/Nahrungsergänzung
- Bei Malnutrition oder klinisch relevantem Mangel an Mikronährstoffen sollte eine adäquate Nährstoffzufuhr und/oder eine Substitution mit Vitaminen oder Spurenelementen durchgeführt werden.2
- bei Eisenmangelanämie: Eisensubstitution
- bei verminderter Knochendichte oder erhöhtem Parathormon: Vitamin D und Kalzium
- Es kann auch ein Mangel an Folsäure, der Vitamine A, B12 und/oder B6 , Kupfer, Zink und/oder Carnitin vorliegen.
- Die Substitution richtet sich dabei jeweils nach dem im Blut nachgewiesenen Mangel. Eine pauschale Substitution ist nicht zielführend.
- Es dürfen nur glutenfreie Präparate eingenommen werden.
- Siehe Positivliste der Deutschen Zöliakie Gesellschaft.
- Eine Substitution von Pankreasenzymen kann in der Anfangsphase sinnvoll sein und kann bei einzelnen Patient*innen mit persistierender Pankreasinsuffizienz dauerhaft indiziert sein.1
Andere Therapieoptionen
- Alternative Therapieoptionen anstelle der glutenfreien Diät sollen außerhalb klinischer Studien nicht durchgeführt werden.2
Prävention
- Medikamente zur Primärprävention einer Zöliakie sollen nicht empfohlen werden.2
- Verwandte 1. Grades sollten bereits früh getestet werden.3
- Säuglingsalter
- Gluten kann entsprechend den Ernährungsempfehlungen in die Beikost von Säuglingen ab Beginn des 5. Lebensmonats eingeführt werden.2
- Es gibt aus guten klinischen Studien keinen Hinweis dafür, dass Stillen oder der Zeitpunkt des Beginns einer Ernährung mit Gluten das Zöliakie-Risiko bei Kindern mit positiver Familienanamnese beeinflussen.
- Die Impfempfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut gelten auch für Zöliakie-Betroffene.2
- Es sollte zusätzlich eine Pneumokokken-Impfung durchgeführt werden.
Verlauf, Komplikationen und Prognose
Verlauf
- Der gesamte Abschnitt basiert auf diesen Referenzen.1-2
- Die meisten Betroffenen sprechen schnell auf die glutenfreie Ernährung an, wodurch den meisten Komplikationen vorgebeugt werden kann.
- Eine erneute Dünndarmbiopsie sollte dann durchgeführt werden, wenn trotz Einhaltung der glutenfreien Diät kein klinisches Ansprechen zu beobachten ist.2
Komplikationen
- Bei Diarrhö über mehr als 4 Wochen und Gewichtsabnahme, evtl. mit Temperaturerhöhung und B-Symptomatik mit Leistungsminderung, Müdigkeit und Nachtschweiß trotz korrekter Diät soll an komplizierte Formen bzw. Komplikationen einer Zöliakie gedacht werden.1-2
- refraktäre Zöliakie
- Enteropathie-assoziiertes T-Zell-Lymphom
- ulzerative Jejunitis
- Adenokarzinom des Dünndarms
- Refraktäre Zöliakie1
- Prüfung der Verdachtsdiagnose nach wenigen Wochen konsequenter Diät ohne klinische Besserung
- selten, bei 1–2 % der Zöliakie-Fälle, allerdings bei 10–18 % der therapieresistenten Fälle2
- Typ I spricht häufig auf Budesonid oder eine systemische Immunsuppression an.
- Typ II kann übergehen in ein T-Zell-Lymphom, eine ulzerative Jejunitis oder eine kollagene Zöliakie.
- Budesonid ist deutlich weniger wirksam, oft sind Zytostatika erforderlich, ggf. autologe Stammzelltransplantation, Fünf-Jahres-Überlebensrate unter 60 %.
- Zöliakie-Krise2
- sehr selten
- Akute lebensbedrohliche Erkrankung, die eine intensivmedizinische Behandlung erfordert.
- massive Diarrhö, Eiweißmangel, Elektrolytentgleisung, Hypotension
- überwiegend Kinder betroffen, seltener auch Erwachsene
- Malignomrisiko2
- Ein initial nach der Diagnose erhöhtes Malignomrisiko für diverse Karzinome scheint sich unter einer glutenfreien Diät dem der Normalbevölkerung anzupassen.
- Das Risiko für Non-Hodgkin-Lymphome und Enteropathie-assoziierte T-Zelllymphome wird unter glutenfreier Diät reduziert, bleibt aber erhöht.
- Enteropathie-assoziiertes T-Zell-Lymphom
- hochmaligne
- Therapien, die zum Einsatz kommen können: Budesonid, Ernährungstherapie, Resektion des Tumors, Chemotherapie, autologe Stammzelltransplantation.
- Ulzerative Jejunitis2
- selten, schlechte Prognose mit reduzierter Lebenserwartung
- Therapien, die zum Einsatz kommen können: Budesonid, Ernährungstherapie, Cladibrin, Chemotherapie, autologe Stammzelltransplantation.
- Verminderte Fertilität
- Wachstumsverzögerung
- Autoimmunerkrankungen
- Treten gehäuft bei einer Zöliakie auf und werden oftmals vor der Zöliakie diagnostiziert.
- z. B. Typ-1-Diabetes, Hashimoto-Thyreoditis, Autoimmunhepatitis, Kollagenosen (Sjögren-Syndrom, systemischer Lupus erythematodes), Addison-Syndrom2
- Osteoporose
- Bei vielen Patient*innen mit einer unbehandelten Zöliakie kommt es zu Störungen im Kalziumhaushalt.
- Vitamin-D-Mangel bzw. sekundärer Hyperparathyreoidismus treten häufig auf.
- Bei Patient*innen mit unbehandelter Zöliakie kommt es häufiger zu Osteopenie und Osteoporose.
- Polyneuropathie
- Patient*innen mit Zöliakie haben ein erhöhtes Polyneuropathie-Risiko.5
- Pankreatitis3
- Zöliakie kann sich als rezidivierende akute Pankreatitis manifestieren oder durch eine chronische Pankreatitis verkompliziert werden.
- Beide Komplikationen sind selten.
- Erhöhtes Risiko für eine Pneumokokken-Infektion und ein verringertes Ansprechen auf eine Hepatitis-B-Impfung (Non-Responder).3
Prognose
- Bei adäquater Therapie3
- Durch eine glutenfreie Ernährung sind die meisten Patient*innen (90 %) beschwerdefrei.
- Bei den 10 % der Betroffenen mit weiter bestehenden Symptomen sind eine fortgesetzte Glutenexposition, Laktoseintoleranz, Obstipation oder ein Reizdarmsyndrom ursächlich.
- Bei weniger als 1 % der Betroffenen entwickelt sich eine refraktäre Zöliakie.
- Ohne oder mit nicht zufriedenstellender Therapie6
- Es besteht ein erhöhtes Risiko für Karzinome im Magen-Darm-Trakt, insbesondere in Form von Lymphomen.
- Die Sterblichkeit ist um den Faktor 1,9–3,8 erhöht.
- Mortalität
- Laut einer großen schwedischen Populationsstudie ist das Sterblichkeitsrisiko bei Zöliakie-Betroffenen gegenüber der übrigen Bevölkerung immer noch geringgradig erhöht, obwohl die Diagnostik und der Zugang zu glutenfreien Lebensmitteln in den letzten Jahren deutlich verbessert wurden.7
- In der Studie wurden allerdings keine individuellen Daten zur korrekten Einhaltung einer glutenfreien Diät erhoben.
- Laut einer großen schwedischen Populationsstudie ist das Sterblichkeitsrisiko bei Zöliakie-Betroffenen gegenüber der übrigen Bevölkerung immer noch geringgradig erhöht, obwohl die Diagnostik und der Zugang zu glutenfreien Lebensmitteln in den letzten Jahren deutlich verbessert wurden.7
Verlaufskontrolle
Patienteninformationen
Patienteninformationen in Deximed
Patientenverbände
Illustrationen
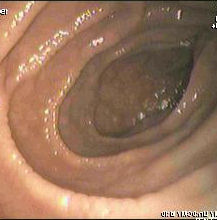
Endoskopiebild des Duodenums eines Patienten mit Zöliakie (Quelle: Wikipedia)

Symbol für glutenfreie Nahrungsmittel (Quelle: Wikipedia)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Zöliakie. AWMF-Leitlinie Nr. 021-021. S2k, Stand 2021. www.awmf.org
Literatur
- Rosien U. Therapie aktuell - Zöliakie. Arzneimittelkommission der deutschen Ärzteschaft. Arzneiverordnung in der Praxis. Band 45, Heft 2, April 2018 www.akdae.de
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. S2k-Leitlinie Zöliakie. AWMF-Leitlinie Nr. 021-021, Stand 2021 www.awmf.org
- BMJBestPractice. Coeliac disease. Stand 28.10.2022 (letzter Zugriff am 28.11.2022). bestpractice.bmj.com
- Cristofori F, Fontana C, Magista A, et al. Increased prevalence of celiac disease among pediatric patients with irritable bowel syndrome. A 6-year prospective chort study. JAMA Pediatr 2014. doi:10.1001/jamapediatrics.2013.4984 DOI
- Thawani SP, Brannagan TH, Lebwohl B, et al. Risk of neuropathy among 28 232 patients with biopsy-verified Celiac disease. JAMA Neurology 2015; 72(7): 806-811. doi:10.1001/jamaneurol.2015.0475 DOI
- Pekki H, Kurppa K, Mäki M, et al. Predictors and significance of incomplete mucosal recovery in celiac disease after 1 year on a gluten-free diet. Am J Gastroenterol. 2015;110(7):1078-1085. PubMed
- Lebwohl B, Green PHR, Söderling J, Roelstraete B, Ludvigsson JF. Association Between Celiac Disease and Mortality Risk in a Swedish Population. JAMA. 2020;323(13):1277–1285. doi:10.1001/jama.2020.1943. jamanetwork.com
Autor*innen
- Marlies Karsch-Völk, Dr. med., Fachärztin für Allgemeinmedizin, München
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).