Zusammenfassung
- Definition:Diskrete Schleimhauttumoren, die in das Darmlumen ragen. Nur die adenomatösen Polypen (vom Drüsengewebe ausgehend) haben malignes Potenzial.
- Häufigkeit:Altersabhängig; 30–40 % der über 60-Jährigen.
- Symptome:Meistens symptomlos, evtl. analer Blut- oder Schleimabgang, Diarrhö, Anämie- und selten Obstruktionszeichen.
- Befunde:Körperliche Untersuchung meist unauffällig; bei Blutung evtl. Anämiezeichen.
- Diagnostik:Hb, Ferritin, Elektrolyte, Gerinnung, Koloskopie, evtl. fäkaler Okkultes-Blut-Test (iFOBT). Bei Verdacht auf familiäre adenomatöse Polyposis (FAP) ggf. genetische Beratung und Gentest.
- Therapie: Endoskopische Resektion und histologische Untersuchung; bei gesicherter FAP: Proktokolektomie.
Allgemeine Informationen
Definition
- Als Polypen bezeichnet man jegliche Art von Ausstülpungen der Darmmukosa in das Darmlumen von Kolon oder Rektum.1
- Nur die vom Drüsengewebe ausgehenden (adenomatösen) Polypen haben malignes Potenzial.1
- Die meisten Adenokarzinome des Kolons entwickeln sich wahrscheinlich aus Adenomen (Adenom-Karzinomsequenz).
Häufigkeit
- Prävalenz und Inzidenz
- Alter
- Polypen treten relativ selten vor dem 50. Lebensjahr auf.
- Die Nachweisrate fortgeschrittener Adenome bei 40- bis 49-Jährigen (3,5 %) deutlich niedriger als bei über 50-Jährigen.3
- Ihre Prävalenz steigt mit dem Alter an.
- Polypen treten relativ selten vor dem 50. Lebensjahr auf.
- Geschlecht
- Frauen haben seltener Polypen als Männer (ca. 1:2), entsprechend dem Verhältnis beim Kolonkarzinom.3
Ätiologie und Pathogenese
- Polypen treten in der Regel sporadisch auf, können aber auch in Form einer familiären Polyposis erblich sein.
- Erbliche Formen
- hereditäres nonpolypöses kolorektales Karzinom (HNPCC, Lynch-Syndrom): Amsterdam-Kriterien zur klinischen Diagnose3
- mindestens 3 Familienmitglieder mit HNPCC-assoziierten Karzinomen (Kolon/Rektum, Endometrium, Dünndarm, Urothel [Ureter/Nierenbecken])
- mindestens zwei aufeinanderfolgende Generationen betroffen
- ein Familienmitglied erstgradig verwandt mit den beiden anderen
- ein Erkrankter zum Zeitpunkt der Diagnose jünger als 50 Jahre
- Ausschluss einer familiären adenomatösen Polyposis
- Weitere Informationen zur familiären adenomatösen Polyposis (FAP, Polyposis coli) siehe Abschnitt Familiäre adenomatöse Polyposis.
- hereditäres nonpolypöses kolorektales Karzinom (HNPCC, Lynch-Syndrom): Amsterdam-Kriterien zur klinischen Diagnose3
- Entwicklung kolorektaler Karzinome in einem kontinuierlichen Prozess von normaler Mukosa via Adenom zum Karzinom1
- Nur ein kleiner Teil der Adenome entwickelt sich zum Karzinom.
- Das Malignitätspotenzial eines Polypen korreliert u. a. mit seiner Größe, den villösen Eigenschaften und dem Dysplasiegrad.1
Histologische Einteilung1
- Konventionelle Adenome
- Dysplasiegrad
- High Grade
- Low Grade
- Villös/tubulär
- tubulär (am häufigsten)
- tubulovillös (> 25 % villöse Anteile)
- villös (> 75 % villöse Anteile)
- Dysplasiegrad
- Serratierte Adenome
- hyperplastische Polypen (werden als nicht präkanzerös angesehen)
- sessile serratierte Polypen
- mit Dysplasie
- ohne Dysplasie
- traditionelle serratierte Adenome
- Adenome, die ≥ 10 mm groß sind oder hochgradige Dysplasien oder villöse Elemente enthalten, gelten als fortgeschrittene Adenome.
- Die Wahrscheinlichkeit zur Entwicklung in ein kolorektales Karzinom ist wesentlich höher.
- Polypen anderer Histologie
- Machen 2–3 % aus.4
- Dabei handelt es sich z. B. um:
- Hamartome
- neuroendokrine Tumoren (Karzinoide)
- entzündliche Polypen
- juvenile Polypen
- submukosale Tumoren wie Lipome oder Leiomyome
Familiäre adenomatöse Polyposis (FAP, Polyposis coli)
- Es kommen Hunderte bis mehrere Tausend kleine und große adenomatöse Polypen im Kolon vor.
- Die Krankheit wird autosomal-dominant vererbt mit hoher Penetranz.
- Bei nachgewiesener FAP ist eine Proktokolektomie indiziert, wenn möglich nach Abschluss der Pubertät.3
- Polypen an anderen Stellen3
- Patient*innen mit FAP haben häufig auch Polypen im Duodenum und etwas seltener im Magen.
- Im Magen handelt es sich in der Regel um Fundusdrüsenpolypen, die benigne sind und kein malignes Potenzial haben; seltener Adenome.
- Im Duodenum kommen immer Adenome vor; meist periampulläre Adenome.
Malignitätsrisiko
- Höchstens 10 % aller Adenome entwickeln sich zu einem Karzinom.
- Ein Polyp durchläuft die Phasen Initiierung, Wachstum und maligne Transformation.
- Die Entwicklung wird durch genetische Faktoren und Umweltfaktoren beeinflusst.
- Näheres zu den Risikofaktoren finden Sie im Artikel Kolorektales Karzinom.
- Das Risiko für High-Grade-Dysplasien steigt mit der Größe der Polypen:1
- < 10 mm: < 1 %
- 10–14 mm: 18 %
- 15–19 mm: 32 %
- 20–25 mm: 42 %
- > 25 mm: 75 %
- Endoskopische Morphologie5
- erhöhtes Malignitätsrisiko bei:
- Polypen mit irregulärer oder destruierter Oberfläche (Pit-Pattern-Typ VI oder VN nach Kudo)
- Paris-Klassifikation 0–IIc (Flat-depressed)
- Paris-Klassifikation 0–IIc in Kombination mit 0–IIa (Flat-elevated)
- nichtgranulärer Laterally-Spreading-Type Polyp (LST-NG)
- granulärer LST (LST-G) mit einem dominanten Knoten, unregelmäßiger Oberfläche, Farbe und Gefäßzeichnung (NICE NBI Typ III)
- verdickten und unregelmäßigen Kapillaren (Sano Capillary Pattern Typ III)
- erhöhtes Malignitätsrisiko bei:
- Wachstumsgeschwindigkeit
- Die Transformation von einem Adenom zu Karzinom dauert in der Mehrzahl der Fälle mehrere Jahre.1
Prädisponierende Faktoren
- Höheres Lebensalter
- Männliches Geschlecht
- Eigenanamnese von Polypen
- Akromegalie
- Positive Familienanamnese: Kolonpolypen oder Kolonkarzinom bei Verwandten 1. Grades 1
ICPC-2
- D78 Neubild. Verdauungssyst., benign/n.s.
- D99 Erkrankung Verdauungsyst., andere
ICD-10
- D12 Gutartige Neubildung des Kolons, des Rektums, des Analkanals und des Anus
- D12.2 Colon ascendens
- D12.3 Colon transversum
- D12.4 Colon descendens
- D12.5 Colon sigmoideum
- D12.6 Kolon, nicht näher bezeichnet
- D12.7 Rektosigmoid, Übergang
- D12.8 Rektum
- D12.9 Analkanal und Anus
- K63 Sonstige Krankheiten des Darmes
- K63.5 Polyp des Kolons
Diagnostik
Diagnostische Kriterien
- Nachweis der Polypen mittels Koloskopie (Goldstandard), Sigmoidoskopie, CT- oder MR-Kolonografie (virtuelle Koloskopie)
- Beim Nachweis eines Polypen ist immer eine vollständige Koloskopie erforderlich, um evtl. weitere Adenome zu entdecken.
- Alle Polypen sollten abgetragen und histologisch untersucht werden.
Differenzialdiagnosen
Anamnese
- Die meisten Kolonpolypen sind symptomfrei und werden zufällig entdeckt.
- Mögliche Symptome1
- Erfragen von Risikofaktoren, v. a. Familienanamnese
Diagnostik in der Hausarztpraxis
- Da Polypen im Regelfall als Zufallsbefunde bei einer präventiven oder diagnostischen Koloskopie gefunden werden, gibt es keine spezifische Diagnostik in der Hausarztpraxis.
- Der Beratung und Aufklärung zur Vorsorge-Koloskopie kommt eine hohe Bedeutung zu, siehe Artikel Kolorektales Karzinom.
- Bei geplanter Koloskopie ggf. Blutbild mit Thrombozyten und INR
- Der fäkale Okkultes-Blut-Test (iFOBT) ist nicht geeignet zur Diagnostik von Polypen.
- Zum Stellenwert des iFOBT beim Darmkrebs-Screening siehe Artikel Kolorektales Karzinom.
Diagnostik bei Spezialist*innen
- Koloskopie
- Die komplette qualitätsgesicherte Koloskopie besitzt die höchste Sensitivität und Spezifität für das Auffinden von Karzinomen und Adenomen und sollte daher als Standardverfahren für die KRK-Vorsorge/-Früherkennung eingesetzt werden (IIIb/B).3
- Die Koloskopie ist zum Nachweis von Polypen besser geeignet als die Röntgen-Doppelkontrast-Darstellung oder die CT-Kolonografie.6-7
- Mit der konventionellen Koloskopie werden 90 % der Polypen unter 8 mm und mehr als 98 % der größeren Polypen entdeckt.
- Noch höhere Detektionsraten werden mit der Chromoendoskopie erreicht (Ia).8
- Dabei wird während der Endoskopie eine Farblösung an die Darmwand gesprüht, um deren Oberflächenstruktur besser sichtbar zu machen.
- Es ist allerdings bisher nicht geklärt, ob die Erkennung höherer Raten vorwiegend kleiner Veränderungen den Patient*innen nutzen und den erhöhten Zeitaufwand der direkten Chromoendoskopie rechtfertigen.
- Ggf. Einsatz bei Patient*innen mit einer chronisch entzündlichen Darmerkrankung und HNPCC zur besseren Erkennung von neoplastischen Läsionen (Ib/C).3
- Makroskopisch ist keine Unterscheidung von benignen und neoplastischen Polypen möglich.
- Alle nachgewiesenen Polypen sollen, wenn möglich, entfernt werden.
- Biopsie nur bei schwer zugänglichen Polypen, Polypen mit Malignitätsverdacht oder hohem Komplikationsrisiko
- Sigmoidoskopie
- in Deutschland wenig verbreitet
- Eine qualitätsgesicherte Sigmoidoskopie sollte Personen, die die Koloskopie als Vorsorge-/Früherkennungsmaßnahme ablehnen, angeboten werden (IIb/B).3
- Etwa 30–50 % aller Kolonadenome können mithilfe eines flexiblen Sigmoidoskops entdeckt werden.
- Bei positivem FOBT/FIT-Test, bei Tumorverdacht oder sigmoidoskopischem Nachweis eines neoplastischen Polypen soll eine vollständige Koloskopie durchgeführt werden (IIb/A).3
- Wird ein High-Risk-Adenom entdeckt, besteht ein erhöhtes Risiko für weitere Adenome oder ein Karzinom im proximalen Kolon (10 %).
- CT-Kolonografie (CTC)
- Wegen der Strahlenbelastung kann in Deutschland die Untersuchung als Früherkennungs- /Vorsorgemethode aufgrund der Strahlenschutzverordnung (StrlSchV §80) bei vorhandenen Alternativmethoden nicht durchgeführt werden.3
- Patient*innen, bei denen eine Koloskopie aus technischen Gründen nur inkomplett durchgeführt werden konnte, sollte eine Wiederholung der Koloskopie z. B. unter stationären Bedingungen oder die CTC als Alternative zur Beurteilung des restlichen Kolons angeboten werden.3
- Die Röntgen-Doppelkontrastuntersuchung des Dickdarms ist heute obsolet, da sie der CT- oder MR-Kolonografie unterlegen ist.3,9
- Näheres zur Karzinomdiagnostik finden Sie im Artikel Kolorektales Karzinom.
Familiäre adenomatöse Polyposis (FAP, Polyposis coli)
Leitlinie: Kolonkarzinom-Screening bei FAP3
- Allen Familienmitgliedern wird ab dem 10. Lebensjahr im Anschluss an eine humangenetische Beratung eine prädiktive genetische Diagnostik empfohlen.
- Familienmitglieder, bei denen die Mutation bestätigt oder nicht ausgeschlossen wurde, sollten ab dem 10. Lebensjahr jährlich rektosigmoidoskopiert werden.
- Bei Nachweis von Adenomen sollte jährlich eine vollständige Koloskopie erfolgen.
- Finden sich keine Polypen, erfolgt die Koloskopie erstmals im Alter von 15 Jahren und ab dem 20. Lebensjahr jährlich.
- Bei nachgewiesener FAP ist eine Proktokolektomie indiziert, wenn möglich nach Abschluss der Pubertät.
Polypen an anderen Stellen
- Patient*innen mit FAP haben häufig Polypen im Duodenum, etwas weniger im Magen.
- Im Magen handelt es sich in der Regel um Fundusdrüsenpolypen, die benigne sind und kein malignes Potenzial haben; seltener Adenome.
- Im Duodenum kommen immer Adenome vor; meist periampulläre Adenome.
- Auch kleine Polypen sollten biopsiert werden, bei großer Anzahl nur ausgewählte.
- Die Abtragung erfolgt mittels endoskopischer Schlingenresektion; evtl. mittels Lasertherapie, deren Wirksamkeit jedoch nicht sicher belegt ist.
- Eine regelmäßige Ösophago-Gastro-Duodenoskopie wird spätestens ab dem 25. bis 30. Lebensjahr empfohlen; bei unauffälligem Befund im Drei-Jahres-Abstand, kürzere Intervalle je nach Befund.
Indikationen zur Überweisung
- Bei Verdacht auf FAP sollte eine fachärztliche Mitbetreuung erfolgen.
- Überweisung zur Vorsorgekoloskopie in die Gastroenterologie, Männer ab 50 Jahren, Frauen ab 55 Jahren
- Bei unklarer Anämie, peranalem Blutabgang oder Stuhlunregelmäßigkeiten ebenfalls Überweisung zur Koloskopie
Therapie
Therapieziele
- Karzinomentstehung verhindern.
- Maligne Polypen vollständig entfernen.
- Polypen-freien Darm erreichen.3
Endoskopische Resektion
- Alle nachgewiesenen Polypen sollen abgetragen und histologisch untersucht werden (Ic/A).1,3
- Das Entfernen von High-Risk-Polypen reduziert das Auftreten von Kolonkarzinomen.10
- Die Polypektomie kann bei multiplen Polypen ggf. mehrzeitig erfolgen.3
Polypektomie
- Kleine Polypen unter 3–4 mm
- Diese können mit einer großen Biopsiezange bei Entnahme einer oder mehrerer Biopsieproben vollständig entfernt werden, evtl. auch mittels kleiner Schlinge oder durch Abreiben.
- Polypen > 5 mm
- Um eine repräsentative histologische Aussage zu erhalten und zur definitiven Therapie sollen diese vollständig durch Schlingenektomie entfernt werden.3
- Bei großen, stielförmigen Polypen kann zuvor eine verdünnte Adrenalinlösung in den Stiel injiziert oder ein sog. Endo-Loop (Drahtschlinge, die um die Polypenbasis geschlungen wird) verwendet werden, um das Blutungs- und Perforationsrisiko zu senken.11
- Breitbasige Rektumpolypen > 2 cm3
- Diese können meist mit der konventionellen Schlingenresektion, bei breitbasigen Polypen auch Abtragung in mehreren Portionen nach vorheriger Unterspritzung (endoskopische Mukosaresektion) entfernt werden.
- Reserveverfahren3
- endoskopische Submukosadissektion (höhere Komplikationsrate)
- endoskopische Vollwandresektion
- transanale Abtragung
- Rendezvousverfahren
- Beurteilung der Radikalität
- Die visuelle Beurteilung der Resektionsradikalität bedarf immer einer histologischen Bestätigung.
- Das gesamte Präparat wird in die Pathologie geschickt, wobei die Resektionsfläche deutlich gekennzeichnet wird.
- Komplikationen
- Blutungen
- Perforationen
Prävention
Ernährung
- Ballaststoffe
- Zur Risikosenkung eines kolorektalen Karzinoms sollte die Ballaststoffaufnahme möglichst 30 g pro Tag betragen (IIa/B).3
- Hinweise, dass Ballaststoffe auch das Rezidivrisiko für kolorektale Adenome reduzieren könnte, bedürfen der Überprüfung in geeigneten Studien.12
- Alkohol
- Zur Reduktion des Risikos eines kolorektalen Karzinoms sollte der Alkoholkonsum limitiert werden (IIa/B).3
- Rotes oder verarbeitetes Fleisch
- Sollte nur in geringen Mengen (nicht täglich) konsumiert werden (IIa/B).3
- „Five a day“
- Trotz der nicht eindeutigen Datenlage zur Prävention sollten reichlich Obst und Gemüse konsumiert werden (5 Portionen am Tag).3
Medikamentöse Prophylaxe
- Eine medikamentöse Sekundärprophylaxe nach Polypektomie sollte derzeit außerhalb von Studien nicht erfolgen (Ib/B).3
- Mikronährstoffe
- Es gibt derzeit keine gesicherten Daten zur wirksamen Prävention des kolorektalen Karzinoms durch Mikronährstoffe.3
- NSAR oder Salicylate
- Rezidivrate unter der täglichen Einnahme von niedrig dosierter Acetylsalicylsäure (81 mg) bei Adenom- und Karzinompatienten niedriger als unter Placebo.
- Die Einnahme von NSAR ist mit einer verminderten Inzidenz kolorektaler Karzinome assoziiert.
- Aufgrund des geringen Effektes und der medikamentös bedingten Risiken kann jedoch eine Einnahme von ASS, klassischen NSAR oder COX-2-Hemmern zur Senkung des Adenom- und Karzinomrisikos derzeit nicht empfohlen werden.3
Screening
- Es gibt kein empfohlenes Screening speziell auf Adenome. Es gelten die Empfehlungen für das Darmkrebs-Screening.
- Näheres dazu im Artikel Kolorektales Karzinom
- In Deutschland haben alle gesetzlich Versicherten ab dem 50. Lebensjahr Anspruch auf den FOBT. Ab 50 Jahren haben Männer Anspruch auf eine Koloskopie und Frauen ab dem 55. Lebensjahr.13
Leitlinie: Darmkrebs-Screening via Koloskopie3,13
- Mit der Darmkrebs-Vorsorge/-Früherkennung für die asymptomatische Bevölkerung sollte ab dem Alter von 50 Jahren begonnen werden.
- Es ist vorgesehen, dass die gesetzlichen Krankenversicherungen ihre Versicherten im Alter von 50, 55, 60 und 65 Jahren schriftlich zur Untersuchung einladen.
- Eine obere Altersbegrenzung für die Darmkrebsvorsorge/-früherkennung kann bei steigender Lebenserwartung nicht gegeben werden. Hier ist eine individuelle Entscheidung unter Berücksichtigung der Begleiterkrankungen angezeigt.
Koloskopiescreening
- Die Richtlinien des Gemeinsamen Bundesausschusses über die Früherkennung von Krebserkrankungen sehen ein allgemeines Koloskopie-Screening für alle Männer ab dem 50. Lebensjahr und für alle Frauen ab dem 55. Lebensjahr vor.
- Männer im Alter zwischen 50 und 54 Jahren können zwischen einem Test auf okkultes Blut und einer Koloskopie wählen.
- Versicherte haben ab diesem Zeitpunkt Anspruch auf insgesamt 2 Koloskopien zur Früherkennung.
- Die zweiten Koloskopie kann frühestens 10 Jahre nach Durchführung der ersten Koloskopie beansprucht werden.
- Jede ab dem Alter von 65 Jahren durchgeführte Koloskopie zählt als zweite Koloskopie.
- Verwandte 1. Grades von Patient*innen, bei denen ein Adenom oder Kolonkarzinom vor dem 50. Lebensjahr nachgewiesen wurde, sollten 10 Jahre vor dem Lebensalter zum Zeitpunkt des Adenom- bzw. Karzinomnachweises koloskopiert werden.
- bei Verwandten von Patient*innen mit kolorektalem Karzinom spätestens im Alter von 40–45 Jahren
- Bei unauffälligem Befund sollte die Koloskopie mindestens alle 10 Jahre wiederholt werden.
- Nachkontrollen aller Patient*innen mit einem Adenom über 1 cm, multiplen oder villösen Adenomen
- Laut Berechnungen könnten damit 70 % aller distalen Karzinome bis zum 75. Lebensjahr und 50 % bis zum 75.–80. Lebensjahr verhindert werden.
Verlauf, Komplikationen und Prognose
Verlauf
- In der hausärztlichen Verantwortung liegt meist die Befundbesprechung, wenn der histologische Befund vorliegt, und es notwendig ist, das weitere Vorgehen – evtl. in Absprache mit den gastroenterologischen Kolleg*innen – festzulegen.
- Zu den Kontrollintervallen siehe Verlaufskontrolle.
Komplikationen
- Kolorektales Karzinom
- Ulzerationen mit Blutungen
Prognose
- Ein nur kleiner Teil der Kolonpolypen entwickelt sich zu einem Kolonkarzinom.
- Risiko für High-Grade-Dysplasien siehe Malignitätsrisiko
- Familiäre adenomatöse Polyposis
- Regelmäßige Kontrollen und Interventionen verringern das Risiko für ein Kolonkarzinom auf ca. 3 %.
- Regelmäßige Kontrollen und Interventionen verringern das Risiko für ein Kolonkarzinom auf ca. 3 %.
Verlaufskontrolle
Leitlinie: Sporadische Polypen3
- Patient*innen mit
- kleinen einzelnen nicht neoplastischen Polypen, die endoskopisch entfernt wurden: Bei diesen sollte keine endoskopischen Nachsorge erfolgen (IIIb/B).
- Es genügen die üblichen Vorsorgekoloskopien alle 10 Jahre.
- mit 1 oder 2 Adenomen < 1 cm ohne höhergradige intraepitheliale Neoplasie (HGIEN): Bei diesen Patient*innen sollte eine Kontrollkoloskopie nach 5–10 Jahren erfolgen (IIb/B).
- Werden bei dieser Kontrollkoloskopie wiederum keine oder nur 1–2 Adenome < 10 mm ohne überwiegend villöse Histologie oder HGIEN gefunden, sollte die nächste Kontrollkoloskopie nach 10 Jahren erfolgen.
- 3–4 Adenomen oder einem Adenom, das 1 cm oder größer ist oder einem Adenom mit überwiegend villöser Histologie oder HGIEN: Hier sollte die erste Kontrollkoloskopie nach 3 Jahren erfolgen (Ib/B).
- 1 Adenom mit hochgradiger intraepithelialer Neoplasie und histologisch vollständiger Abtragung: Hier sollte nach 3 Jahren koloskopiert werden (Ib/B).
- histologisch nicht bestätigter vollständiger Abtragung von Adenomen > 5 mm: Hier sollte auch bei makroskopisch kompletter Abtragung eine Kontrolle nach 6 Monaten erfolgen (V/B).
- Nachweis von ≥ 5 Adenomen jeder Größe: Das Kontrollintervall sollte < 3 Jahre betragen (V/B).
- großen Adenomen, die in Piecemeal-Technik abgetragen wurden: Eine kurzfristige Kontrolle der Abtragungsstelle soll nach 2–6 Monaten erfolgen (IIIb/A).
- kleinen einzelnen nicht neoplastischen Polypen, die endoskopisch entfernt wurden: Bei diesen sollte keine endoskopischen Nachsorge erfolgen (IIIb/B).
- Nach unauffälliger Kontrollendoskopie sind weitere Kontrollen in 5-jährigen Abständen angezeigt (IV/B).
- Nach kompletter Abtragung eines traditionellen serratierten Adenoms oder eines sessilen serratierten Adenoms sollte die Nachsorge analog zu klassischen Adenomen erfolgen.
- Multiple Polypen und erbliche Faktoren können kürzere Kontrollintervalle notwendig machen.
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
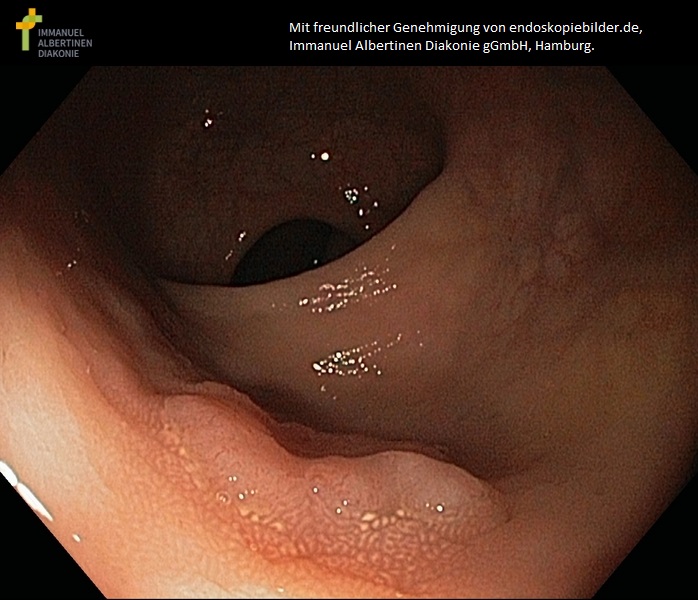
Breitbasiges Kolonadenom (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)

Zwei gestielte Kolonpolypen (Adenome) (mit freundlicher Genehmigung von endoskopiebilder.de, Immanuel Albertinen Diakonie gGmbH, Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroentrologie, Verdauungs- und Stoffwechselkrankheiten. Kolorektales Karzinom. AWMF-Leitlinie Nr. 021-0070L. S3, Stand 2017 (abgelaufen). www.awmf.org
- Rutter MD, Chattree A, Barbour JA et al. British Society of Gastroenterology/Association of Coloproctologists of Great Britain and Ireland guidelines for the management of large non-pedunculated colorectal polyps. Gut 2015; 64: 1847-73. gut.bmj.com
Literatur
- Pring T, Gould E, Malietzis G, et al. Colorectal polyps. BMJ Best Practice, Last reviewed: 3 Apr 2023, Last updated: 18 Nov 2022. bestpractice.bmj.com
- Giacosa A, Frascio F, Munizzi F. Epidemiology of colorectal polyps. Tech Coloproctol. 2004 Dec;8 Suppl 2:s243-7. PMID: 15666099 PubMed
- Deutsche Gesellschaft für Gastroentrologie, Verdauungs- und Stoffwechselkrankheiten. S3-Leitlinie Kolorektales Karzinom. AWMF-Leitlinie Nr. 021-007OL, Stand 2017. www.awmf.org
- Gondal G, Grotmol T, Hofstad B, et al. The Norwegian Colorectal Cancer Prevention (NORCCAP) screening study: baseline findings and implementations for clinical work-up in age groups 50 - 64 years. Scand J Gastroenterol 2003; 38: 635-42. PubMed
- Rutter MD, Chattree A, Barbour JA, et al. British Society of Gastroenterology/Association of Coloproctologists of Great Britain and Ireland guidelines for the management of large non-pedunculated colorectal polyps. Gut 2015; 64: 1847-73. PMID: 26104751 PubMed
- Rockey DC, Paulson E, Niedzwiecki D, et al. Analysis of air contrast barium enema, computed tomographic colonography, and colonoscopy: prospective comparison. Lancet 2005; 365: 305-11. PubMed
- Rosman AS, Korsten MA. Meta-analysis comparing CT colonography, air contrast barium enema, and colonoscopy. Am J Med 2007; 120: 203-10. PubMed
- Brown SR, Baraza W, Din S, Riley S. Chromoscopy versus conventional endoscopy for the detection of polyps in the colon and rectum. Cochrane Database Syst Rev 2016; 4:CD006439. PMID: 27056645. PubMed
- Rosman AS, Korsten MA. Meta-analysis comparing CT colonography, air contrast barium enema, and colonoscopy. Am J Med 2007; 120: 203-10. PubMed
- Zauber AG, Winawer SJ, O`Brien MJ, et al. Colonoscopic polypectomy and long-trem prevention of colorectal-cancer deaths. N Engl J Med 2012; 366: 687-96. New England Journal of Medicine
- Dobrowolski S, Dobosz M, Babicki A, et al. Prophylactic submucosal saline-adrenaline injection in colonoscopic polypectomy: prospective randomized study. Surg Endosc 2004; 18: 990-3. PubMed
- Yao Y, Suo T, Andersson R, et al. Dietary fibre for the prevention of recurrent colorectal adenomas and carcinomas. Cochrane Database Syst Rev 2017;1:CD003430. PMID: 28064440 PubMed
- Gemeinsamer Bundesausschuss: Richtlinie für organisierte Krebsfrüherkennungsprogramme (Erstfassung und Programm zur Früherkennung von Darmkrebs) und Änderung der Krebsfrüherkennungs-Richtlinie, vom 19. Juli 2018. Inkrafttreten 19.10.2018. BAnz AT 18.10.2018 B3. www.g-ba.de
Autor*innen
- Franziska Jorda, Dr. med., Fachärztin für Allgemeinmedizin und für Viszeralchirurgie, Kaufbeuren
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).