Zusammenfassung
- Definition:Etwa 90 % aller malignen Lungentumoren sind Bronchialkarzinome (Lungenkarzinome). Histologisch unterscheidet man kleinzellige und nichtkleinzellige Karzinome. Rauchen ist der am häufigsten beteiligte Risikofaktor.
- Häufigkeit:Das Bronchialkarzinom ist bei Männern die häufigste und bei Frauen die dritthäufigste Ursache krebsbedingter Todesfälle.
- Symptome:Frühe Symptome sind Husten und Hämoptyse, später können Brustschmerzen, Schweratmigkeit, Lungenentzündung, Müdigkeit, Schwäche und Gewichtsverlust auftreten.
- Befunde:Klinische Befunde variieren oder können ganz fehlen.
- Diagnostik:Der Röntgenbefund kann einen starken diagnostischen Verdacht wecken, die Histologie liefert die endgültige Bestätigung und die Bestimmung des betreffenden Karzinomtyps.
- Therapie:Nur 25 % der Patient*innen sind operabel. Chemotherapie und Strahlentherapie haben eine begrenzte Wirkung. Bei einem kleinen Teil der Patient*innen liegen genetische Subtypen vor, die auf eine molekular zielgerichtete Therapie gut ansprechen.
Allgemeine Informationen
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-5
Definition
- Das Bronchialkarzinom ist der mit Abstand häufigste von der Lunge ausgehende maligne Tumor.
- Durch den Einfluss der internationalen Nomenklatur wird auch in Deutschland der Begriff „Lungenkarzinom“ (engl. Lung Cancer) immer gebräuchlicher.
- Histologisch unterscheidet man zwischen 4 großen Gruppen:
- Plattenepithelkarzinom (30–40 %)
- Adenokarzinom (25–30 %)
- großzelliges Karzinom (< 10 %)
- kleinzelliges Karzinom (15–20 %).
- Das kleinzellige Bronchialkarzinom ist eine besonders aggressive Art von Lungenkrebs mit Tendenz zu früher Streuung.
TNM-Klassifikation
- Der gesamte Abschnitt basiert auf diesen Referenzen.1,4-5
- T (Tumor)
- Tis: Carcinoma in situ
- T1: größter Durchmesser < 3 cm, umgeben von Lungengewebe oder viszeraler Pleura, Hauptbronchus nicht beteiligt
- T1a(mi): minimal invasives Adenokarzinom (Adenokarzinom mit lepidischem Wachstumsmuster < 3 cm in der größten Ausdehnung mit einem soliden Anteil < 5 mm Durchmesser)
- T1a: größter Durchmesser < 1 cm
- T1b: größter Durchmesser > 1 cm, aber < 2 cm
- T1c: größter Durchmesser > 2 cm, aber < 3 cm
- T2: größter Durchmesser > 3 cm, aber < 5 cm – oder –
- Infiltration des Hauptbronchus unabhängig vom Abstand von der Carina, aber ohne direkte Invasion der Carina – oder –
- Infiltration der viszeralen Pleura – oder –
- tumorbedingte partielle Atelektase oder obstruktive Pneumonie, die bis in den Hilus reichen, Teile der Lunge oder die gesamte Lunge umfassen
- T2a: größter Durchmesser > 3 cm, aber < 4 cm
- T2b: größter Durchmesser > 4 cm, aber < 5 cm
- T3: größter Durchmesser > 5 cm, aber < 7 cm – oder –
- Infiltration von Thoraxwand (inklusive parietale Pleura und Superior Sulcus), N. phrenicus oder parietales Perikard – oder –
- zusätzlicher Tumorknoten im selben Lungenlappen wie der Primärtumor
- T4: größter Durchmesser > 7 cm – oder –
- mit direkter Infiltration von Diaphragma, Mediastinum, Herz, großen Gefäßen, Trachea, N. laryngeus recurrens, Ösophagus, Wirbelkörper oder Carina – oder –
- zusätzlicher Tumorknoten in einem anderen ipsilateralen Lungenlappen
- N (Lymphknoten)
- N0: keine Lymphknotenmetastase(n)
- N1: Metastase(n) in ipsilateralen, peribronchialen und/oder ipsilateralen hilären Lymphknoten und/oder intrapulmonalen Lymphknoten oder direkte Invasion dieser Lymphknoten
- N2: Metastase(n) in ipsilateralen mediastinalen und/oder subkarinalen Lymphknoten
- N3: Metastase(n) in kontralateralen mediastinalen, kontralateralen hilären, ipsi- oder kontralateral tief zervikalen, supraklavikulären Lymphknoten
- M (Metastase)
- M0: keine Fernmetastase(n)
- M1: Fernmetastase(n)
- M1a:
- separate(r) Tumorknoten in einem kontralateralen Lungenlappen – oder –
- Pleura mit knotigem Befall – oder –
- maligner Pleuraerguss – oder –
- maligner Perikarderguss
- M1b: solitäre Fernmetastase(n) in einem solitären extrathorakalen Organ
- M1c: mehrere Fernmetastasen in einem oder mehreren Organen
Stadieneinteilung
- Stadium 0: Tis N0 M0
- Stadium IA1:
- T1a (mi) N0 M0 – oder –
- T1a N0 M0
- Stadium IA2: T1b N0 M0
- Stadium IA3: T1c N0 M0
- Stadium IB: T2a N0 M0
- Stadium IIA: T2b N0 M0
- Stadium IIB:
-
- T1a-c N1 M0 – oder –
- T2a,b N1 M0 – oder –
- T3 N0 M0
- Stadium IIIA:
- T1a-c N2 M0 – oder –
- T2a,b N2 M0 – oder –
- T3 N1 M0 – oder –
- T4 N0 M0 – oder –
- T4 N1 M0
- Stadium IIIB:
- T1a-c N3 M0 – oder –
- T2a,b N3 M0 – oder –
- T3 N2 M0 – oder –
- T4 N2 M0
- Stadium IIIC:
- T3 N3 M0
- T4 N3 M0
- Stadium IVA: jedes T, jedes N, M1a oder M1b
- Stadium IVB: jedes T, jedes N, M1c
Häufigkeit
- In Deutschland ist das Bronchialkarzinom bei Männern die häufigste und bei Frauen die dritthäufigste Ursache krebsbedingter Todesfälle.
- Die Inzidenz beträgt bei Männern 65 und bei Frauen 21/100.000/Jahr.
- Der Altersgipfel liegt bei 75–80 Jahren.
- Parallel zum Zigarettenkonsum ist die Inzidenz bei Frauen seit einigen Jahrzehnten angestiegen. Bei Männern stagniert sie oder ist leicht rückläufig.
Ätiologie und Pathogenese
- Zigarettenrauchen
- Ist bei Männern und Frauen der wichtigste bekannte Risikofaktor für die Entstehung von Lungenkrebs.
- 80–90 % aller Betroffenen haben in der Vergangenheit geraucht.
- Zigaretten mit geringerem Teergehalt reduzieren das Lungenkrebsrisiko nicht.
- Andere Formen des Rauchens
- sind mit ebenfalls mit einem erhöhten Risiko für Lungenkrebs und andere Krebsarten verbunden (z. B. Pfeiferauchen und Zigarrenrauchen); das Zigarettenrauchen stellt jedoch das höchste Risiko dar.
- Umwelteinflüsse und berufliche Expositionen, die das Risiko erhöhen können:
- Feinstaub, etwa in Dieselmotorabgasen
- Eine erhöhte Radonbelastung in Gebäuden kann zu einer lokalen Häufung von Lungenkrebsfällen führen. Laut einer Studie in Großbritannien gingen 3,3 % der Todesfälle aufgrund von Lungenkrebs eine erhöhte Radonbelastung voraus. Über die lokale Radonbelastung informiert das Bundesamt für Strahlenschutz.
- ionisierende Strahlung
- Asbest
- Schwermetalle wie Chromate, Arsen und Nickel
- polyzyklische Kohlenwasserstoffe, etwa in Ruß und Teer
Histologische Einteilung
- Der histologische Typ ist für die Therapieplanung und Prognose relevant. Dabei werden kleinzellige und nicht-kleinzellige Karzinome unterschieden:
- kleinzelliges Karzinom
- nicht-kleinzelliges Karzinom
- Adenokarzinom
- Plattenepithelkarzinom
- großzelliges Karzinom
- Kleinzelliges Bronchialkarzinom
- 15–20 % aller Bronchialkarzinome
- in der Regel schnell wachsend
- bei Nichtraucher*innen selten
- meist in den zentralen Atemwegen (Hauptbronchus und Trachea) lokalisiert mit früher lokoregionärer Ausbreitung ins Mediastinum
- oft frühe extrathorakale Metastasierung
- häufig paraneoplastisches Syndrom
- Auch wenn der Tumor gut auf Chemotherapie anspricht, ist ein kleinzelliges Bronchialkarzinom zum Zeitpunkt der Diagnose oft bereits fortgeschritten und die Prognose ungünstig.
- Adenokarzinom
- 25–30 % aller Bronchialkarzinome
- histologisch heterogen
- meist periphere Lungenanteile betroffen
- frühe Metastasierung
- häufig mit Vorerkrankung der Lunge
- Plattenepithelkarzinom
- 30–40 % aller Bronchialkarzinome
- meist endobronchial in den zentralen Atemwegen lokalisiert
- oft mit Hämoptyse, postobstruktiver Pneumonie oder lobärem Kollaps
- metastasiert meist erst spät im Krankheitsverlauf
- Großzelliges Karzinom
- weniger als 10 % aller Bronchialkarzinome
- schlecht differenziert
- große periphere Tumoren
- frühe Metastasierung
Prädisponierende Faktoren
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Zigarettenrauchen
- 9 von 10 Frauen und 8 von 10 Männern mit Lungenkrebs waren in der Vergangenheit Zigarettenraucher*innen.
- Etwa 10 % aller Lungenkrebsfälle betreffen Nichtraucher*innen.
- Epidemiologischen Studien zufolge geht auch Passivrauchen mit einem erhöhten Risiko für Lungenkrebs einher.
- Berufliche Exposition
- Asbest ist der häufigste berufliche Risikofaktor. Eine asbestexponierte Person hat ein 6-mal so hohes Risiko für Lungenkrebs wie eine nichtexponierte. Bei Raucher*innen, die auch gegenüber Asbest exponiert waren, ist das Risiko um das 60-Fache erhöht.
- Exposition gegenüber Staub, Gasen, Chemikalien etc. (z. B. Arsen, Chrom, Nickel, Vinylchlorid und ionisierender Strahlung)
- Radonbelastung in Gebäuden
- Feinstaub aus Dieselmotorabgasen geht von allen Luftschadstoffen mit dem höchsten Lungenkrebsrisiko einher.
- Chronische obstruktive Lungenerkrankung, idiopathische Lungenfibrose, Tuberkulose
- Infektionen mit bestimmten Viren gehen mit einem erhöhten Lungenkrebsrisiko einher.
- Für das humane Papilloma Virus (HPV) ist dieser Zusammenhang in Asien und Afrika besonders ausgeprägt, scheint aber auch in Europa eine Rolle zu spielen.
- Infektionen mit dem Eppstein-Barr-Virus (EBV) sind mit einem erhöhten Risiko für großzellige lymphoepitheliale Karzinome assoziiert.
- Bei HIV-Infizierten steht das erhöhte Lungenkrebsrisiko vermutlich mit dem besonders hohen Anteil von Raucher*innen in Zusammenhang.
- Genetische Faktoren scheinen eine gewisse Rolle zu spielen, sind aber noch unzureichend erforscht. Bei Raucher*innen dominieren andere genetische Subtypen von Bronchialkarzinomen als bei Nichtraucher*innen.
ICPC-2
- R84 Bösartige Neubildung Lunge / Bronchus
ICD-10
- C34 Bösartige Neubildung der Bronchien und der Lunge6
- C34.0 Hauptbronchus
- C34.1 Oberlappen (-Bronchus)
- C34.2 Mittellappen (-Bronchus)
- C34.3 Unterlappen (-Bronchus)
- C34.8 Bronchus und Lunge, mehrere Teilbereiche überlappend
- C34.9 Bronchus oder Lunge, nicht näher bezeichnet
Diagnostik
Leitlinie: Früherkennung des Lungenkarzinoms1
Jährliche CT bei erhöhtem Risiko
- Definition Risikoperson
- Alter 50–75 Jahre – und –
- ≥15 Zigaretten/d für mindestens 30 Jahre – oder –
- ≥10 Zigaretten/d für mindestens 20 Jahre – und – ≤10-jährige Nikotinkarenz
- Asymptomatische Risikopersonen (s. o.) profitieren von einem strukturierten Lungenkarzinom-Früherkennungsprogramm mittels jährlicher Low-Dose-CT-Untersuchungen.
- Die genauen Rahmenbedingungen sind noch durch das Bundesumweltministerium, den Gemeinsamen Bundesausschuss und evtl. weitere Fachkreise festzulegen. Mit der konkreten Umsetzung eines entsprechenden Früherkennungsprogramms ist frühestens im Lauf des Jahres 2024 zu rechnen (Stand April 2023).
Nicht infrage kommende Verfahren
- Bei asymptomatischen Risikopersonen für ein Lungenkarzinom soll ein Screening mittels folgender Methoden nicht erfolgen:
- Thoraxübersichtsaufnahmen – und/oder –
- Sputum-Zytologie – und/oder –
- Bronchoskopie – und/oder –
- Biomarkern, z. B.:
- klassische Tumormarker
- Liquid Biopsies
- Atemgas-Exhalat-Analysen
Diagnostisches Vorgehen
- Der Röntgenbefund kann einen starken diagnostischen Verdacht begründen.
- Thorakale Raumforderungen werden nicht selten als Zufallsbefund im konventionellen Röntgen oder CT von Thorax oder Abdomen festgestellt.
- Diagnosesicherung und Bestimmung des Karzinomtyps erfolgen in der Histologie, ggf. flankiert von molekularpathologischen Untersuchungen.
- Weitere Untersuchungen sind notwendig, um das Stadium der Krebserkrankung (TNM-Klassifikation) zu ermitteln und evtl. Begleiterkrankungen zu erkennen.
Differenzialdiagnosen
- Tuberkulose
- Sarkoidose
- Pneumonie
- Andere von Lunge oder Pleura ausgehende Tumoren
- Karzinoide
- Mesotheliome
- Sarkome
- Blastome
- Lungenmetastasen einer anderen Tumorerkrankung
Anamnese
- Vielraucher*in (> 15 Zigaretten täglich)?
- Berufliche Belastung mit Asbest, Schwermetallen, polyzyklischen Kohlenwasserstoffen, ionisierender Strahlung, Dieselabgasen (z. B. LKW-Fahrer*in) oder anderen Kanzerogenen?
- Wohnung in einer stark radonbelasteten Region?
- Andere prädisponierende Faktoren?
- Frühe Symptome
- Atemwegsymptome über 6 Wochen?
- Husten (65 %), Verschlimmerung des Raucherhustens?
- Hämoptyse (35 %)
- wiederholte Atemwegsinfektionen mit Bronchitiden
- Oft erst später:
- Thoraxschmerzen (50 %)
- Schweratmigkeit (60 %)
- Heiserkeit
- Pneumonie
- Müdigkeit
- Gewichtsverlust
Klinische Untersuchung
- Klinische Befunde variieren oder können ganz fehlen.
- Zentrale Tumoren können zu Atelektasen und poststenotischer Pneumonie mit Atemnebengeräuschen führen.
- Periphere Tumoren ergeben in der Regel keine klinischen Befunde.
- Invasion in die Pleura führt zum Pleuraerguss.
- Bei ca. 20 % der Patient*innen
- Lymphadenopathie (Hals/Fossa supraclavicularis)
- Hepatomegalie
- obere Einflussstauung mit Stokeskragen
- Trommelschlegelfinger
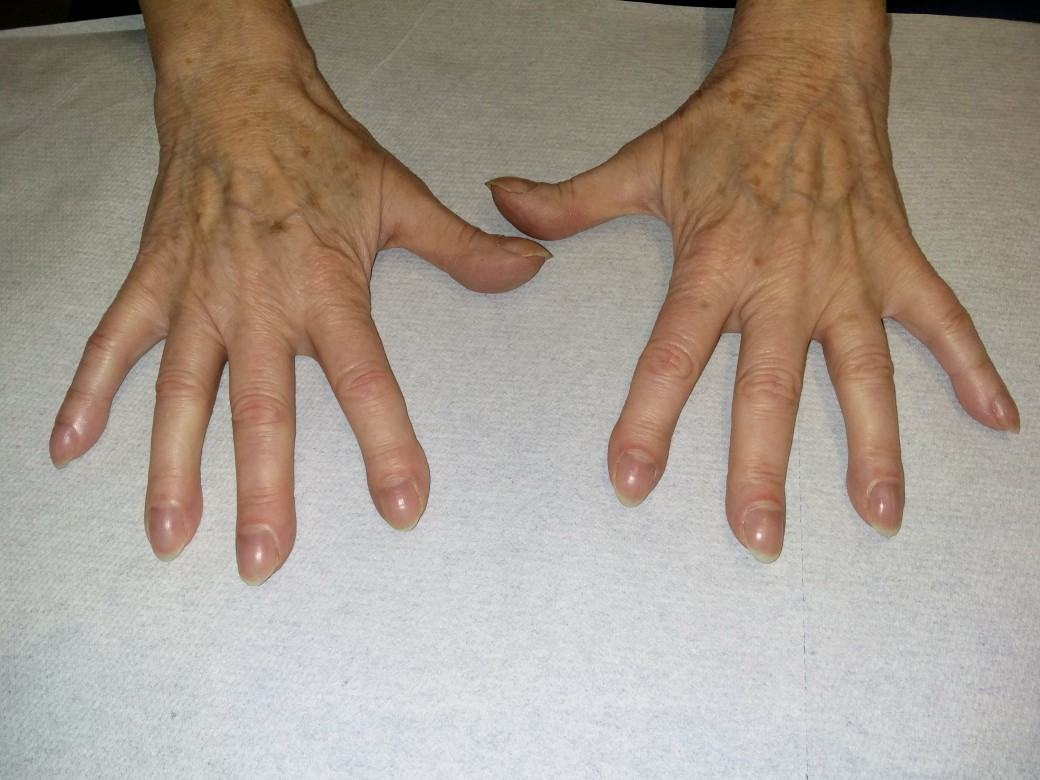 Trommelschlegelfinger
Trommelschlegelfinger
- Hirnmetastasen können erste Manifestation sein und sich durch folgende Symptome äußern:7
- Kopfschmerzen
- Übelkeit und Erbrechen
- Hemiparese
- Gesichtsfeldausfälle
- andere fokale neurologische Ausfälle
- epileptische Anfälle
- Verwirrtheit
- Persönlichkeitsveränderungen
- Bewusstseinstrübungen
- Selten (< 5 %)
- Horner-Syndrom infolge eines von der Lungenspitze ausgehenden Pancoast-Tumors
- Atembehinderung infolge einer Parese des N. laryngeus recurrens
- Hautmetastasen
Symptome und Anzeichen intrathorakaler Tumorausbreitung
- 40 % aller Patient*innen zeigen schon im Rahmen der Erstmanifestation Symptome und Anzeichen intrathorakaler Tumorausbreitung, entweder durch invasives regionales Tumorwachstum oder lymphogene Metastasierung.
- Heiserkeit als Folge einer Affektion des Nervus laryngeus recurrens
- Lähmung des Zwerchfells aufgrund einer Affektion des Nervus phrenicus
- Atembeschwerden
- Zwerchfellhochstand links (Röntgen-Thorax)
- Lungenspitzen-Karzinom (Pancoast-Tumor) mit Affektion von Sympathikusganglien und Plexus brachialis
- Horner-Syndrom
- neuropathischer Schulter-Arm-Schmerz
- Sensibilitätsstörungen, Paresen und Muskelatrophien an Unterarm und Hand
- Anhaltende pleuritische Schmerzen durch Tumorinvasion in die Brustwand
- Pleuraerguss
- behinderte Atmung
- Auskultation: abgeschwächtes Atemgeräusch
- Klopfschall-Dämpfung
- Schluckstörungen durch Tumorinvasion oder -kompression der Speiseröhre
- Obstruktion der Vena cava superior
- venöse Stauung an Hals und Oberkörper einschließlich Schultern und Armen
- Gesichtsschwellung
- Plethora
- Perikardiale Tumorinvasionen sind Autopsien zufolge häufig, treten aber nur selten klinisch in Erscheinung, als Perikarderguss oder -tamponade.
Symptome und Anzeichen extrathorakaler Tumorausbreitung
- Fast 1/3 aller Patient*innen mit Lungenkrebs zeigen Symptome und Anzeichen von extrathorakaler Tumorausbreitung.
- Typische metastatische Lokalisationen
- Knochen
- Leber
- Nebennieren
- Lymphknoten
- Gehirn
- Rückenmark
- Unspezifische Symptome
- Schwäche/Fatigue
- Gewichtsverlust
- Knochenmetastasen (meist in langen Röhrenknochen oder Rückenwirbeln)
- Schmerzen
- Frakturen
- Palpable Lymphknoten und insbesondere supraklavikuläre Lymphadenopathie deuten auf Metastasen hin.
- Bei 10 % aller Patient*innen bilden sich Hirnmetastasen. Lungenkrebs ist somit die am häufigsten ins Gehirn metastasierende Tumorerkrankung.7 Folgende Symptome können darauf hindeuten:
- Kopfschmerzen
- Übelkeit und Erbrechen
- Hemiparese
- Gesichtsfeldausfälle
- andere fokale neurologische Ausfälle
- epileptische Anfälle
- Verwirrtheit, Persönlichkeitsveränderungen, Bewusstseinstrübungen.7
- Trotz häufiger Leberbeteiligung: Transaminasenanstieg eher selten
Paraneoplastische Syndrome
- Extrapulmonale Dysfunktion von Organen ohne direkten Bezug zu Primärtumor oder Metastasen
- Freisetzung bioaktiver Stoffe oder Autoantikörper, die vom Tumor selbst oder als Reaktion auf den Tumor gebildet werden.
- Ca. 10 % aller Patient*innen mit Lungenkrebs sind betroffen.
- Erstes Auftreten vor, gleichzeitig mit oder nach dem Zeitpunkt der Diagnose
- Je nach betroffenem Organsystem verschiedene Arten von Syndromen:3
- endokrin
- metabolisch
- autoimmun (z. B. Kollagenosen)
- neuromuskulär (z. B. autonome periphere Neuropathien)
- ossär
- kardiovaskulär
- hämatologisch
- kutan (z. B. Dermatomyositis)
- renal
- Die Behandlung dieser assoziierten Syndrome hat häufig einen entscheidenden Einfluss auf das Befinden der Patient*innen.
Ergänzende Untersuchungen in der Hausarztpraxis
- Der gesamte Abschnitt basiert auf diesen Referenzen.2-3
- Blutbild, Differenzialblutbild
- Elektrolyte (Na, K, und ggf. Ca und P)
- Nierenparameter (Kreatinin, Harnstoff)
- Leberparameter (GOT, GPT, Gamma-GT, AP, Bilirubin)
- LDH
- Gerinnung (Quick/INR, PTT)
- Harnsäure
- Evtl. Tumormarker
- Neuronenspezifische Enolase (NSE) kann bei einem kleinzelligen Bronchialkarzinom erhöht sein.
- CEA kann bei einem Adenokarzinom erhöht sein.
Diagnostik bei Spezialist*innen
Röntgen-Thorax
- Konventionelle Röntgenaufnahmen des Thorax sind wenig sensitiv und spezifisch bei der Detektion eines Bronchialkarzinoms.
- Kann im frühen Stadium unauffällig sein – insbesondere bei zentral gelegenen Tumoren.
CT mit Kontrastmittel – Thorax und Oberbauch
- Bei der Erkennung früher Stadien höhere Sensitivität als konventionelles Röntgen
MRT mit Kontrastmittel
- Bei speziellen Fragestellungen, z. B. Verdacht auf solitäre Lebermetastasen, Hirn- oder Knochenmetastasen (kranielle MRT)
Früherkennungsprogramm
- Niedrig dosierte Spiral-CT
- Vorteil: Auch kleine periphere Tumore können vor der Metastasierung erkannt werden.
- Nachteil: hohe Strahlenbelastung
- Implementierung in Deutschland
- Nach Einschätzung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG) überwiegt der Nutzen des Low-Dose-CT-Screenings bei gegenwärtigen oder ehemaligen starken Raucher*innen den potenziellen strahlenbedingten Schaden.8
- Die Rahmenbedingungen für ein nationales Lungenkarzinom-Früherkennungsprogramm werden derzeit durch den gemeinsamen Bundesausschuss (G-BA) in Absprache mit dem Bundesamt für Strahlenschutz (BfS) und den einschlägigen medizinischen Fachgesellschaften erarbeitet (Stand April 2023).
- Näheres siehe auch Leitlinienkasten Früherkennung des Lungenkarzinoms.
Untersuchungen im Krankenhaus
- Labor
- Hb
- Differenzialblutbild
- Entzündungsparameter (BSG, CRP)
- LDH
- Kreatinin
- Elektrolyte (Na, K, und ggf. Ca und P)
- Kalzium
- Albumin
- GPT (ALAT)
- Gamma-GT
- AP
- Bilirubin
- NSE
- ProGRP
- bei Bestätigung der Lungenkrebsdiagnose ggf. weitere Tumormarker und spezifische Parameter zur Diagnostik paraneoplastischer Syndrome
- Spirometrie
- Ist obligatorisch für alle Patient*innen, die wegen der Diagnose Bronchialkarzinom operiert werden sollen.
- Klinische Zeichen für paraneoplastische Syndrome, z. B.:
- Syndrom der inadäquaten ADH-Sekretion (SIADH, Schwartz-Bartter-Syndrom)
- erhöhte ACTH-Produktion
- Hyperkalzämie
- verschiedene neurologische Manifestationen
- Hautläsionen
- Die Fitness/das Funktionsniveau der Patient*innen ist entscheidend für die Therapieplanung.
Bildgebung
- Röntgen-Thorax mit Schnittbildern (falls verfügbar)
- häufige Befunde beim Bronchialkarzinom
- periphere Verdichtung oder Rundschatten
- Atelektasen
- vergrößerter Hilus
- verbreitertes Mediastinum
- Pleuraerguss
- bei zentralen Tumoren oft keine Auffälligkeiten
- Bei weiter bestehendem klinischem Verdacht sollte auch bei unauffälligem Röntgen-Thorax eine CT von Thorax und oberem Abdomen durchgeführt werden.
- häufige Befunde beim Bronchialkarzinom
- CT mit Kontrastmittel – Thorax und oberes Abdomen
- Beurteilung von Lungenparenchym, Mediastinum und Pleura
- bei vergrößerten Lymphknoten (kurzer Durchmesser > 1 cm) im Mediastinum: weitere Abklärung vor OP
- im oberen Abdomen: Beurteilung von Leber und Nebennieren
- notwendig für Staging und Behandlungsplanung
- MRT mit Kontrastmittel – Thorax und Abdomen
- Nur wenn CT nicht durchführbar ist, etwa wenn die Patient*innen die Zustimmung verweigern.
- Die MRT des Thorax ist als Routineuntersuchung zur Stadienbestimmung beim Bronchialkarzinom nicht zu empfehlen, hat jedoch einen gewissen Wert bei der topografischen Abgrenzung einer möglichen Affektion des Plexus brachialis oder der Wirbelsäule oder bei Verdacht auf Tumorinvasion in das Mediastinum.
- Schädel-MRT (evtl. CT)
- MRT: Mittel der 1. Wahl zur Diagnostik von Hirnmetastasen
- CT: nur wenn MRT nicht durchführbar
- PET-CT (Positronen-Emissions-Tomografie plus CT)
- In der PET signalgebend ist die gesteigerte Glukoseaufnahme der Krebszellen.
- Ist bei kurativem Therapieansatz für die Ausbreitungsdiagnostik vorteilhaft, vorausgesetzt dass es dadurch nicht zu erheblichen Therapieverzögerungen kommt.
- Erlaubt frühe und genaue Diagnosen und damit längeres Überleben.
- Ein Nutzwert für die Verlaufsdiagnostik ist nicht belegt.
- Evtl. Skelettszintigrafie
- bei Skelettschmerzen, erhöhtem AP-Wert oder Hyperkalzämie
- Evtl. Oberbauchsonografie
Pathologische Anatomie
- In 40–60 % aller Fälle sichert die Zytologie des Sputums die Diagnose.
- Bei ungefähr der Hälfte der Tumorpatient*innen mit Pleuraexsudat verifiziert die Zytologie des Pleurapunktats die Diagnose.
- Histologische Klassifikation
- Adenokarzinom
- Plattenepithelkarzinom
- großzelliges Karzinom
- adenosquamöses Karzinom
- kleinzelliges Karzinom
- Karzinoidtumor
- Karzinome vom Speicheldrüsentyp
- sarkomatoides Karzinom
- Mesotheliom
- Metastasen einer anderen Entität
- Molekulare Diagnostik
- Mittlerweile sind eine Reihe genetischer Faktoren bekannt, die im Tumorgewebe bestimmt werden können und hinsichtlich der Prognose und des Ansprechens auf molekular zielgerichtete Therapien von großer Bedeutung sind.
- Dazu zählen u. a.:
- EGFR-Mutationen
- BRAF V600-Mutationen
- KRAS-Mutationen
- ALK-Fusionen
- ROS1-Fusionen
- RET-Fusionen
- NTRK1–3-Fusionen
- PDL-1-Expression
Invasive Diagnostik
- Fiberbronchoskopie
- Ermöglicht die Diagnosesicherung bei 60–90 % der zentralen, aber nur bei ca. 10 % der peripheren Tumoren.
- angezeigt bei bildgebendem Verdacht und zugänglichem Tumor
- Bei allen Patient*innen mit peripherem Lungeninfiltrat, um
- einen Tumor der Bronchialschleimhaut auszuschließen.
- eine Bronchiallavage und eine Bürstenbiopsie im relevanten Segment vorzunehmen.
- eine Stadieneinteilung mithilfe von transbronchialer Nadelaspirationsbiopsie aus den regionalen Lymphknoten zu ermöglichen.
- Die Untersuchung erfolgt unter örtlicher Betäubung, ggf. ambulant.
- Perkutane Lungenbiopsie
- Die transthorakale Nadelaspirationsbiopsie wird bei peripher liegenden Tumoren unter örtlicher Betäubung und Röntgendurchleuchtung angewendet.
- Erlaubt die Diagnosesicherung in 60–80 % der Fälle.
- 10 % falsch negative Befunde
- bei unspezifischem benignem Befund: Thorakoskopie oder Minithorakotomie
- häufige Komplikation (25–30 %): Pneumothorax
- Pleurapunktion bei Pleuraerguss
- Das Punktat wird zytologisch untersucht.
- Ein maligner Pleuraerguss tritt meist erst in fortgeschrittenen Krankheitsstadien auf und schließt chirurgische Eingriffe und Strahlenbehandlungen mit kurativer Intention in der Regel aus.
- Ist die Zytologie nicht eindeutig, können Thorakoskopie oder Pleurabiopsie erforderlich werden.
- Pleurabiopsie
- Erfolgt unter Röntgendurchleuchtung und örtlicher Betäubung.
- Thorakoskopie
- Erfolgt entweder unter Regional- oder Allgemeinanästhesie.
- Die Pleuradrainage kann bei Malignität zur Pleurodese verwendet werden.
- Mediastinoskopie
- zur histologischen N-Klassifikation der Lymphknoten im vorderen Mediastinum
- unter Vollnarkose
- Ultraschallgeführt werden via Ösophagus aus den Lymphknoten im Mediastinum Biopsien entnommen.
- Zugang entweder suprasternal oder links parasternal
- Kann angewendet werden, wenn die vergrößerten Lymphknoten für andere Methoden der Biopsiegewinnung nicht erreichbar sind, weil sie z. B. im aortopulmonalen Fenster lokalisiert sind.
- Andere Methoden zur Biopsiegewinnung
- Können zur Diagnostik von Fernmetastase notwendig werden, z. B. aus peripheren Lymphknoten, Haut, Knochen, Nebennieren und anderen Organen.
- Eine Bildgebung des oberen Abdomens zum Metastasenscreening und Knochenmarkuntersuchungen sind deshalb Standardverfahren bei der Stadieneinteilung von kleinzelligen Karzinomen.
Probenahme für eine morphologische Diagnostik
Präoperative Untersuchung der Lungenfunktion
- Bedeutsame postoperative Komplikationen betreffen meist die Atemfunktion.
- Wichtigste präoperative Untersuchung: Spirometrie
- Wenn das forcierte exspiratorische Volumen (FEV1) und die Diffusionskapazität bei über 60 % des zu erwartenden Normalwerts liegen, kann eine Pneumonektomie durchgeführt werden.
- Wenn die Werte unter 60 % liegen, wird eine selektive Lungenfunktionsuntersuchung mit Perfusionsszintigrafie durchgeführt.
- Die Messung der maximalen Sauerstoffaufnahme unter Belastung ist ebenfalls aussagekräftig.
Indikationen zur Überweisung
- Bei Verdacht auf Bronchialkarzinom oder eine andere Tumorerkrankung
Therapie
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-3
Therapieziele
- Palliation
- Heilung bei ca. 10 % der Patient*innen
Allgemeines zur Therapie
- Chirurgische Resektion, Strahlenbehandlung und Chemotherapie – entweder einzeln oder in Kombination – sind mögliche Behandlungen beim Bronchialkarzinom.
- Entscheidend für die Art und Abfolge der Therapien:
- Ausbreitungsgrad der Krankheit (Stadium)
- Tumorbiologie einschließlich histologischer und molekularer Eigenschaften
- Allgemeinzustand der Patient*innen
- Komorbidität
- Etwa 25 % aller Patient*innen sind operabel.
- Chemotherapie und Strahlentherapie sind meist begrenzt wirksam.
Kleinzelliges Bronchialkarzinom (SCLC)1-2,7
- Ein kleinzelliges Bronchialkarzinom (SCLC) hat zum Diagnosezeitpunkt häufiger bereits metastasiert als andere Bronchialkarzinom-Typen. Zum Diagnosezeitpunkt haben ungefähr 35 % eine auf den initialen Hemithorax begrenzte Erkrankung (Limited Disease) und 65 % eine darüber hinaus gehende Erkrankung (Extensive Disease). Das SCLC wird immer – unabhängig vom Stadium der Erkrankung bei der Diagnose – als systemische Erkrankung betrachtet.
- Strahlenbehandlung und Zytostatika zeigen in der Regel einen Effekt.
- Neben folgenden stadienorientierten Empfehlungen sind weitere Faktoren für die Therapieentscheidung maßgeblich, u. a. Alter, Fitness und Präferenzen der erkrankten Person:
- Stadium I-IIA
- Resektion des Primärtumors (wenn OP nicht infrage kommt, Vorgehen wie in Stadium IIB–III)
- 4 Zyklen Cisplatin/Etoposid
- ggf. gefolgt von einer prophylaktischen Schädelbestrahlung
- Stadium IIB–III
- simultane Radiochemotherapie
- gefolgt von einer prophylaktischen Schädelbestrahlung
- Stadium IV
- Zytostatika + Immuncheckpoint-Inhibition: 4–6 Zyklen Carboplatin/Etoposid, in Kombination mit einem PD-L1-Antikörper (Atezolizumab oder Durvalumab)
- Danach Erhaltungstherapie mit PD-L1-Antikörper
- Bei Hirnmetastasen ggf. nur Chemotherapie und Schädelbestrahlung
- Stadium I-IIA
Nicht-kleinzelliges Bronchialkarzinom (NSCLC)1,3,7
- Ungefähr 70 % aller Patient*innen mit NSCLC werden in einem Erkrankungsstadium diagnostiziert, in dem eine kurative Behandlung nicht möglich ist – entweder weil bereits Stadium IV erreicht ist (40 %) oder weil – in früheren Stadien – ungünstige prognostische Faktoren vorliegen (30 %).
- Chirurgie
- Eine möglichst vollständige chirurgische Resektion des Tumorgewebes ist die wichtigste kurative Behandlung.
- Allerdings sind nur 25 % der Patient*innen zum Zeitpunkt der Primäruntersuchung operabel.
- Davon kann nur die Hälfte mittels Thorakotomie radikal operiert werden.
- Chemotherapie
- Ist allein meist nicht kurativ.
- Eine postoperative Cisplatin-basierte Behandlung verlängert das Überleben.
- Kombinationen von zwei Zytostatika sind der Monotherapie überlegen. Dreifachkombinationen verlängern nicht die Überlebensdauer und führen stattdessen zu erhöhter Toxizität.
- Molekular zielgerichtete Therapien
- Tyrosinkinase-Inhibitoren
- in Stadien IB–IIIA bei bestimmten EGFR-aktivierenden Mutationen (del 19, L858R): Osimertinib
- Weitere ggf. infrage kommende Substanzen siehe unten.
- Immuncheckpoint-Blockade mit PD1-Inhibitoren
- bei PD-L1-Expression auf Tumorzellen ≥ 50 % in den Stadien IIA–IIIA bei EGFR/ALK Wildtyp: Atezolizumab
- Weitere ggf. infrage kommende Substanzen siehe unten.
- ebenfalls unter bestimmten Umständen indiziert (Näheres s. u.)
- gegen Wachstumsfaktorrezeptoren gerichtete Antikörper
- Angiogenesehemmer
- Tyrosinkinase-Inhibitoren
- Strahlentherapie
- kurative Intention bei ausgewählten Patient*innen
- palliativer Effekt auf die meisten Lungenkrebs-bedingten Symptome
- Kommt auch bei Patient*innen mit inoperablem Tumor oder Rezidiv nach einer Operation infrage.
- Strahlenbehandlung zusätzlich zur Chemotherapie im primär inoperablen Stadium III verlängert das Überleben im Vergleich zur Strahlenbehandlung allein.
- Die Auswirkungen auf die Lebensqualität sind unklar.
Medikamentöse Therapie
- Eine Kombinationschemotherapie bei kleinzelligem Karzinom verlängert die Lebenszeit.
- Bei nicht-kleinzelligem Bronchialkarzinom kann mit neueren Regimen in 20–30 % der Fälle vorübergehend eine subjektive oder objektive Besserung erreicht werden.
- Molekular zielgerichtete Therapien haben mittlerweile einen hohen Stellenwert, besonders bei Nachweis onkogener Mutationen, z. B. in den Genen EGFR, EML4-ALK, ROS1 und BRAF V600.
Kleinzelliges Bronchialkarzinom (SCLC)
- Die am häufigsten angewendeten Zytostatikakombinationen
- 1. Wahl: Cisplatin/Etoposid
- Anthrazyklinhaltige Regime, etwa mit Doxorubicin oder Epirubicin in Kombination mit Cyclophosphamid/Vincristin oder Etoposid, sind zwar eine mögliche Alternative zur platinhaltigen Kombination, werden jedoch wegen der Kardiotoxizität der Anthrazykline in der Erstlinientherapie deutlich seltener eingesetzt. Eine Strahlentherapie verstärkt die Kardiotoxizität zusätzlich.
- Ein objektives Ansprechen liegt bei 80–95 % der Patient*innen vor.
- Eine perorale Behandlung mit Etoposid kommt zuweilen bei Patient*innen mit ausgedehnter Erkrankung zur Anwendung.
- Immuntherapie (PD-1 Checkpointblockade)
- In Phase-II-Studien wurden Hinweise auf eine Wirksamkeit von PD-1-Antikörpern bei SCLC gefunden.
- Kontrollierte Studien zu verschiedenen Monotherapien und Kombinationen werden zurzeit durchgeführt.
- Bislang ist noch kein PD-1-Antikörper zur Therapie des SCLC zugelassen.
- Die Anwendung beim SCLC ist bislang nur im Rahmen eines individuellen Therapieversuchs (off label) oder im Rahmen von Studien möglich (Stand Juli 2017).
- Vorläufige positive Ergebnisse gibt es z. B. zu folgenden PD-1-Antikörpern und Kombinationen:
- Pembrolizumab
- Nivolumab
- Kombination aus Nivolumab und dem CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4)-Antikörper Ipilimumab
- Weitere molekular zielgerichtete Therapieansätze
- Rovalpituzumab-Tesirine
- Konjugat aus einem Antikörper gegen Delta-Like-Protein3 (DLL-3) und einem Zytostatikum
- In Phase-II-Studien erreichte etwa 1/3 der Patient*innen unter der Therapie eine Remission, etwa ein weiteres Drittel eine progressionsfreie Stabilisierung der Erkrankung.
- Das Medikament ist derzeit nicht zugelassen und wird in weiteren Studien geprüft.
- Antiangiogenetisch wirkende Substanzen konnten in den bisherigen Studien keinen Vorteil hinsichtlich des Gesamtüberlebens erzielen und sind daher weder in Erst- noch in Zweitlinie indiziert.
- Weitere negative Phase-II-Studien liegen zu mTOR-Inhibitoren, HDAC-Inhibitoren und BCL-2 Antisense-Substanzen vor.
- Rovalpituzumab-Tesirine
Nicht-kleinzelliges Bronchialkarzinom (NSCLC)
- Mit der Erstlinien-Chemotherapie wird bei 20–30 % der Patient*innen eine Remission erreicht.
- Moderate Verlängerung des Gesamtüberlebens
- Eine adjuvante postoperative Chemotherapie kann die Überlebenszeit verlängern, auch dann noch, wenn sie erst spät (7–18 Wochen nach der OP) eingesetzt wird.9
- Systemische Therapien
- Chemotherapie
- Zweifachkombination ist Standard.
- meist Kombinationen mit Cisplatin
- Weitere infrage kommende Zytostatika sind u. a. Taxane, Gemcitabin, Pemetrexed oder Vinorelbin.
- Molekular zielgerichtete Medikamente sind bei ausgewählten Indikationen zugelassen.
- Crizotinib (Kinaseinhibitor von ROS1, ALK und MET)
- Brigatinib (Kinaseinhibitor von ROS1, ALK, IGF-1R und EGFR)
- Entrectinib (Kinaseinhibitor von ROS1, ALK, TRKA, TRKB und TRKC)
- Lorlatinib (Kinaseinhibitor von ROS1 und ALK)
- Larotrectinib (Kinaseinhibitor von TRKA, TRKB und TRKC)
- Pralsetinib (Inhibitor der RET-Kinase)
- Selpercatinib (Kinaseinhibitor von RET, VEGFR1 und VEGFR3)
- MET-Kinaseinhibitoren: Capmatinib, Tepotinib
- ALK-Kinaseinhibitoren: Ceritinib, Alecitinib
- EGFR-Tyrosinkinase-Inhibitoren: Afatinib, Dacomitinib, Erlotinib, Osimertinib
- MEK1/2-Kinaseinhibitor Trametinib + BRAF-Kinaseinhibitor Dabrafenib1
- Immuntherapie mit Anti-PD-1 Antikörper: Nivolumab, Pembrolizumab, Atezolizumab1
- Nintedanib (Polykinaseinhibitor, hemmt unter anderem VEGFR und FGFR) + Docetaxel
- Ramucirumab (VEGFR2-Inhibitor) + Docetaxel
- Bevacizumab (antiangiogenetisch wirksamer Antikörper) + platinhaltige Chemotherapiekombination
- Amivantamab (Inhibition von EGFR und c-Met)
- Sotorasib (Inhibition von KRASG12C)
- Antikörper-Wirkstoff-Konjugat
- Trastuzumab-Deruxtecan (HER2-Antikörper Trastuzumab, gebunden an den zytostatisch wirksamen Topoisomerase I-Inhibitor Deruxtecan)
- Chemotherapie
Strahlentherapie
- Kann Husten, Hämoptyse, Dyspnoe wegen Bronchialobstruktion und metastasenbedingte Knochenschmerzen lindern.
- Bei symptomatischen Hirnmetastasen werden zusätzlich Kortikosteroide zur Reduktion des perifokalen Ödems verabreicht.
- Prophylaktische Hirnbestrahlung für Patient*innen mit kleinzelligem Bronchialkarzinom und kompletter Remission nach Radiochemotherapie1-2,7
Chirurgie
- Der gesamte Abschnitt basiert auf diesen Referenzen.1-3
- Der Umfang der notwendigen Resektion hängt von der Ausbreitung des Tumorgewebes ab und ist vor Beginn der Operation nie mit Sicherheit vorhersehbar.
- Lobektomie
- Ist das bevorzugte Verfahren, wenn der Tumor auf einen einzelnen Lappen begrenzt ist.
- Der postoperative Verlauf ist meistens unkompliziert, die 30-Tage-Mortalität liegt unter 2 %.
- Pneumonektomie
- Ist nur selten indiziert.
- bei zentraler Tumorlokalisation
- Aufgrund des größeren Lungenparenchymverlustes und der Rechtsherzbelastung ist die Letalität 2- bis 3-mal höher als nach Lobektomie.
- Evtl. zusätzliche Resektion von Perikard, Thoraxwand oder Zwerchfell bei Invasion in diese Strukturen
- Sleeve-Lobektomie
- Lobektomie mit gleichzeitiger Resektion eines Haupt- oder Lappenbronchusabschnitts
- Bei zentralen Oberlappentumoren kann man damit in ausgewählten Fällen die Resektion des Unterlappens vermeiden.
- Wedge-Resektion
- Bezeichnet kleinere Eingriffe wie segmentäre und subsegmentäre Keilresektion; lässt sich bei kleineren Tumoren bei Patient*innen mit begrenzter Lungenfunktion anwenden.
- Extensive Resektionen bei N2- und T3-Erkrankungen
- Sind nur in ausgewählten Fällen indiziert.
- Carina-Resektion
- Pneumonektomie mit gleichzeitigem Entfernen der Carina sowie eines begrenzten Teils des gegenüberliegenden Hauptbronchus und der Trachea
- Wird in seltenen Fällen bei Carina-nahen und als N0 oder N1 klassifizierten Tumoren durchgeführt.
- Palliative Chirurgie
- Kann Patient*innen angeboten werden, die inoperabel sind oder ein Rezidiv bekommen haben.
- Zugang in der Regel bronchoskopisch
- bei Tumorinvasion oder Kompression von Hauptbronchus, Trachea oder Ösophagus
- intraluminale Stentanlage
- Abtragen der Tumormasse mit Laser oder Kryotherapie
Beratung in der Hausarztpraxis
Leitlinie: Patientenaufklärung1
- Patientenzentrierte Kommunikation
- Die Art der Vermittlung von Informationen und der Aufklärung der Patient*innen soll nach folgenden Grundprinzipien einer patientenzentrierten Kommunikation, die eine partizipative Entscheidungsfindung ermöglicht, erfolgen (Ib/A):
- Ausdruck von Empathie und aktives Zuhören
- direktes und einfühlsames Ansprechen schwieriger Themen
- wenn möglich, Vermeidung von medizinischem Fachvokabular, ggf. Erklärung von Fachbegriffen
- Strategien, um das Verständnis zu verbessern (Wiederholung, Zusammenfassung wichtiger Informationen, Nutzung von Grafiken u. Ä.).
- Ermutigung, Fragen zu stellen.
- Erlaubnis und Ermutigung, Gefühle auszudrücken.
- Weiterführende Hilfe anbieten.
- Die kommunikativen Kompetenzen der aufklärenden Ärzt*innen lassen sich durch die Teilnahme an einem strukturierten Kommunikationstraining verbessern.
- Die Art der Vermittlung von Informationen und der Aufklärung der Patient*innen soll nach folgenden Grundprinzipien einer patientenzentrierten Kommunikation, die eine partizipative Entscheidungsfindung ermöglicht, erfolgen (Ib/A):
- Diagnosemitteilung
- Die Aufklärung über die Krankheit und deren Verlauf soll primär über die behandelnden Ärzt*innen erfolgen.
- Bei der Auseinandersetzung mit den Informationen sollen die Patient*innen durch alle an der Behandlung beteiligten Berufsgruppen unterstützt werden.
- Dazu soll der Stand des Aufklärungsprozesses nachvollziehbar dokumentiert werden.
- Vor der Informationsübermittlung soll erfragt werden, mit welchem Wissen, mit welchen Vorstellungen, Hoffnungen und Befürchtungen im Zusammenhang mit seiner Erkrankung die betroffene Person in das Gespräch geht.
- Informationen sollen schrittweise übermittelt werden mit regelmäßiger Rückversicherung, ob und inwieweit die Patient*innen diese verstanden haben. Hierbei sollen die Betroffenen ausdrücklich zu Fragen ermutigt werden.
- Angehörige sollen in ihrer Rolle als Unterstützer*innen und Mitbetroffene wahrgenommen und gewürdigt werden.
- Sie sollen nach ihren Bedürfnissen gefragt und bei Bedarf zum Annehmen von Unterstützungsangeboten ermutigt werden.
- Vorausschauende Versorgungsplanung (Advance Care Planning, ACP)
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung sollen das Angebot einer ACP erhalten.
- Gegenstand der Gespräche soll dabei sein:
- Umfang und Grenzen der Behandlung im Fall (erkrankungs-)typischer sowie häufiger und möglicher Szenarien und Komplikationen
- individuelle Präferenzen hinsichtlich der Versorgung in der letzten Lebensphase, des Betreuungs- und Sterbeortes sowie ggf. der Bestattung
- Benennung von Vorsorgebevollmächtigten oder Vorschlag einer Betreuer*in
- Thematisieren von Tod und Sterben
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung soll frühzeitig und bei Krankheitsprogress die ausdrückliche Bereitschaft vermittelt werden, über das Sterben an der Erkrankung zu sprechen.
- Dabei sollten auch Worte wie „Sterben“ und „Tod“ von den an der Behandlung Beteiligten in einfühlsamer und situativ angemessener Weise ausgesprochen werden.
- Der Äußerung eines Sterbe-/Todeswunsches eines Menschen mit einer nicht heilbaren Krebserkrankung soll mit Empathie und Gesprächsbereitschaft begegnet werden.
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung soll frühzeitig und bei Krankheitsprogress die ausdrückliche Bereitschaft vermittelt werden, über das Sterben an der Erkrankung zu sprechen.
- Unterstützende Gespräche
- Um den individuellen Hilfebedarf einzuschätzen und lokale Angebote zu vermitteln, sind Informationen zu folgenden Bereichen einzuholen:
- Wohnsituation
- soziale Einbindung (Familie, Freund*innen, Nachbar*innen)
- berufliche Situation
- verfügbare Pflegedienste
- Beratung zu sozialen und versicherungsrechtlichen Fragen nicht nur während der aktiven Erkrankung, sondern auch in der Rekonvaleszenzphase
Palliative Behandlung
Leitlinie: Palliativmedizinische Versorgung1
- Patient*innen mit einer nicht heilbaren Lungenkarzinomerkrankung sollen nach Diagnosestellung frühzeitig das Angebot einer Integration von Palliativberatung und -versorgung erhalten (IIb/A).
- Das Angebot zur Integration von Palliativberatung und -versorgung bei Patient*innen mit einer nicht-heilbaren Lungenkarzinomerkrankung sollte frühzeitig (innerhalb der ersten 2 Monate) nach Diagnosestellung erfolgen (IIb/B).
- Die palliative Versorgung sollte durch palliativmedizinische qualifizierte Fachkräfte in allen palliativmedizinisch relevanten Dimensionen (physische, psychische, soziale und spirituelle Bedürfnisse) erfolgen und dokumentiert werden (IIb/B).
- Im Rahmen der Palliativberatung und -versorgung von Patient*innen mit nicht-heilbarer Lungenkarzinomerkrankung sollten folgende Aufgaben bewältigt werden (IIb/B):
- regelmäßiges Einschätzen physischer, psychosozialer und spiritueller Belastungen und Behandlung der entsprechenden Symptome
- Beratung und Koordination von Hilfestellungen
- aktive Initiierung von Gesprächen über Vorausverfügungen mit Blick auf mögliche Komplikationen und auf Aspekte des Lebensendes
- Wahrnehmung von Belastungen in der Familie und bei Freund*innen mit Angebot der Unterstützung
- Beratungen und Vermittlung hospizlicher, pflegerischer und anderer Versorgungsangebote
- In Studien wurden die positiven Effekte der frühzeitigen Palliativberatung und -versorgung dann erzielt, wenn
- die Kontakte wenigstens in monatlichen Abständen – und –
- nach einem Primärkontakt drei Folgekontakte erfolgten.
- Strukturierte Palliativversorgung sollte in Entscheidungsprozesse bei Patient*innen mit einer nicht-heilbaren Lungenkarzinomerkrankung integriert werden (z. B. durch Beteiligung an interdisziplinäre Tumorkonferenzen oder durch einen palliativmedizinischen Konsildienst).
- Schmerzen
- Übelkeit und Erbrechen
- Obstipation
- Maligne gastrointestinale Obstruktion
- Orale Beschwerden
- Mangelernährung und Dehydratation
- Dyspnoe
- Depression
- Angst
- Delir
Prävention
- Warnung vor dem Rauchen
- Tipps für den Rauchstopp
- Mit dem Rauchen aufzuhören, reduziert das Lungenkrebsrisiko erheblich.
- Wer im Alter von 45–50 Jahren mit dem Rauchen aufhört, verringert laut Berechnungen sein Risiko um 90 %.10
- Sogar noch in frühen Lungenkrebsstadien kann ein Rauchstopp die Prognose verbessern.
- Berufliche Exposition gegenüber ionisierender Strahlung und kanzerogenen Stoffen vermeiden.
- Bauliche Schutzmaßnahmen in Regionen mit erhöhter Radonbelastung
- Körperliche Aktivität
- Reichlich Obst und Gemüse
- Nahrungsergänzungsmittel wie Vitamine A, C, E oder Selen haben Metaanalysen zufolge keinen vorbeugenden Effekt gegenüber Lungenkrebs.10
Verlauf, Komplikationen und Prognose
- Sofern nicht anders gekennzeichnet, basiert der gesamte Abschnitt auf diesen Referenzen.1-3
Verlauf
- Symptomatischer Lungenkrebs ist zum Diagnosezeitpunkt in der Regel bereits fortgeschritten und inoperabel.
- Zum Diagnosezeitpunkt besteht bei 10–15 % eine lokalisierte Erkrankung. Von diesen sterben 50 % nach 5 Jahren, auch wenn die Operation potenziell kurativ war.
- Über die Hälfte hat zum Diagnosezeitpunkt Fernmetastasen.
Kleinzelliges Karzinom
- Zentral lokalisiert
- Verursacht eine Kompression der Bronchien.
- Häufig bereits zum Diagnosezeitpunkt metastasiert
Plattenepithelkarzinom
- Meist in den zentralen Bronchien lokalisiert
- Das Karzinom wächst intraluminal und lässt sich deshalb früh durch eine zytologische Untersuchung des Sputums nachweisen.
- Streuung in regionale Lymphknoten
Adenokarzinom und großzelliges Karzinom
- Haben annähernd den gleichen klinischen Verlauf.
- Peripher in der Lunge
- Fernmetastasen häufig
Anerkennung als Berufskrankheit
- Tritt ein Bronchialkarzinom im Zusammenhang mit der beruflichen Tätigkeit auf, kann diese Erkrankung als Berufskrankheit anerkannt werden.11
- Zuständig hierfür sind die gesetzlichen Unfallversicherungsträger.
- Bei Verdacht auf eine Berufskrankheit besteht Meldepflicht (Meldebogen12).
- Es wird eine ausführliche Arbeits- und Gefährdungsanamnese erhoben, und ein Gutachten entscheidet über die Anerkennung als Berufskrankheit.
- Dann können bestimmte Maßnahmen auf Kosten der GUV durchgeführt werden:
- spezielle therapeutische Maßnahmen
- Einstellung der gefährdenden Tätigkeit
- Minderung der Erwerbsfähigkeit bis zur Zahlung einer Rente13
- Manchmal muss die Tätigkeit erst vollständig aufgegeben werden, damit die Anerkennung als Berufskrankheit erfolgen kann.
Komplikationen
- Metastasen: häufig in Leber, Gehirn, Knochen, Herz, Abdomen, Haut
- Maligner Pleuraerguss
- Vena-cava-superior-Syndrom
- Parese des Nervus phrenicus
- Parese des Nervus recurrens
- Bronchus- oder Trachealstenose
- Ösophagusstenose
- Ateminsuffizienz
- Rechtsherzinsuffizienz
- Schlaganfall
Prognose
- Bei den meisten Langzeitüberlebenden war der Tumor primär reseziert worden. Die Vollständigkeit der Resektion scheint für Stadium Ia–IIb der wichtigste Prognosefaktor zu sein.1
- Nach einer chirurgischen Behandlung beträgt die 5-Jahres-Überlebensrate für Männer ca. 40 % und für Frauen > 50 %.
- Mehr als die Hälfte aller Patient*innen mit Lungenkrebs sterben innerhalb eines Jahres nach Diagnosestellung. Die durchschnittliche Überlebenszeit liegt bei 10–12 Monaten, die 5-Jahres-Überlebensrate unter 20 %.
- Die 5-Jahres-Überlebensrate bei kurativer Resektion des Plattenepithelkarzinoms beträgt 35–40 %, bei Adenokarzinom und großzelligem Karzinom 25 %.
- In einzelnen genetischen Subgruppen können mit molekular zielgerichteten Therapien deutlich höhere Ansprech- und Überlebensraten erzielt werden. Bei EGFR-mutierten Tumoren – etwa 12 % aller Bronchialkarzinome – liegt die mittlere Überlebenszeit bei etwa 3 Jahren.
- Faktoren, die die Prognose beeinflussen:
- Stadium zum Diagnosezeitpunkt
- allgemeiner Gesundheitszustand der Patient*innen
- Alter der Betroffenen
- histologische, molekulare und genetische Eigenschaften des Tumors
- Proliferationsrate des Tumors
- Art und Intensität der Therapie
Diagnosezeitpunkt
- Die Prognose ist stadienabhängig. Lungenkrebs wird oft erst in einem fortgeschrittenen Stadium erkannt. Durch eine frühere Erkennung und Behandlung könnte man Morbidität und Mortalität reduzieren.
Bedeutung des Rauchens
- 9 von 10 Lungenkrebspatient*innen sind Raucher*innen oder ehemalige Raucher*innen.
- Nach einem Rauchstopp geht das durchschnittliche Risiko zwar zurück, bleibt aber immer über dem Niveau von Personen, die nie geraucht haben.
- Langzeitüberlebende Lungenkrebspatient*innen mit positiver Raucheranamnese haben weiterhin ein erhöhtes Krebsrisiko.
- Zwischen Rauchen und dem Lungenkrebsrisiko besteht eine Dosis-Wirkungs-Beziehung.
- Das Risiko steigt mit der Anzahl gerauchter Zigaretten und Raucherjahre, mit dem Grad der Nikotinabhängigkeit (tiefere Inhalation), mit dem Teer- und Nikotingehalt des inhalierten Rauchs.
- Selbstgedrehte Zigaretten ohne Filter bedeuten ein verdoppeltes Risiko im Vergleich zu Filterzigaretten.
- Männer mit einem Verbrauch von > 40 Zigaretten am Tag haben ein doppelt so hohes Risiko im Vergleich zu Männern mit einem Verbrauch von 20 Zigaretten am Tag.
- Männer, die vor ihrem vollendeten 15. Lebensjahr mit dem Rauchen beginnen, haben ein 4-mal höheres Risiko als Männer, die erst nach dem vollendeten 25. Lebensjahr mit dem Rauchen anfangen.
- Rauchende Frauen haben ein höheres Lungenkrebsrisiko als rauchende Männer.
Verlaufskontrolle
- Behandlung und Nachsorge erfolgen unter der Regie eines auf Lungentumoren spezialisierten Zentrums, evtl. in Zusammenarbeit mit der Hausärzt*in.
Aufgaben der Hausärzt*innen
- Nebenwirkungen von Chemo- und Strahlentherapie behandeln, sowohl in der aktiven Behandlungsphase als auch bei Spätfolgen (Strahlenschäden, Stoffwechselstörungen, Parästhesien, Fatigue, muskuloskelettale Beschwerden etc.).
- Kontrolluntersuchungen auf Rezidive und auf Spätfolgen der Erkrankung und Therapie weiterführen.
- Hämatologische Parameter während der Zytostatika-Behandlung in Absprache mit dem behandelnden Zentrum überwachen.
Unter aktiver Behandlung
- Erstes Gespräch nach Entlassung aus dem Krankenhaus
- Gehen Sie zusammen mit den Patient*innen die Epikrise durch, überzeugen Sie sich, dass diese den Inhalt verstanden haben, legen Sie einen Plan für Kontrolluntersuchungen und Blutentnahmen zwischen evtl. Zytostatika-Zyklen fest und erklären Sie die Warnsymptome, bei denen die Patient*innen sofort mit Ihnen oder dem behandelnden Zentrum in Kontakt treten sollten.
- Infektions- und Leukozytenüberwachung
- Leukozyten erreichen meist 7–14 Tage nach einem Zyklus ihren Tiefpunkt.
- Sind die Leukozyten zu niedrig für den nächsten Zyklus, dann besprechen Sie mit der Klinik das weitere Vorgehen.
- Wenn Patient*innen zwischen zwei Chemotherapie-Zyklen Fieber entwickeln, dann behandeln Sie sie so, als hätten sie eine Sepsis, und weisen Sie sie unverzüglich in die Klinik ein. Das gilt für eine Körpertemperatur über 38,5 °C in einer Messung oder über 38,0 °C in zwei Messungen mit zwei Stunden Abstand.
- Patient*innen mit Fieber, kombiniert mit Leukozyten unter 1 oder Neutrophilen unter 0,5, müssen grundsätzlich ins Krankenhaus eingewiesen und wie bei Sepsis behandelt werden.
- Erhöhtes Risiko für thromboembolische Ereignisse bei Krebspatient*innen
- körperliche Aktivität
- Beine hochlegen.
- Kompressionstrümpfe
- ggf. Prophylaxe mit standarddosiertem niedermolekularem Heparin (Enoxaparin oder Dalteparin mit sehr geringem Risiko für Blutungskomplikationen)
- Fortlaufende Anpassung der Schmerztherapie
- Nebenwirkungen der Therapie behandeln, wie z. B.:
- Übelkeit
- neuropathische Schmerzen
- Fatigue
- Diarrhö
- Hautausschläge und Strahlenschäden der Haut
- Schleimhautulzera
- Inkontinenz und sexuelle Funktionsstörungen
Nach Abschluss der Behandlung im Krankenhaus
- Richten Sie das Hauptaugenmerk auf das Erkennen behandlungsbezogener Nebenwirkungen und auf die Frühdiagnostik von Rezidiven.
- Pneumokokken-Vakzine nach einem Jahr und danach alle 5 Jahre je nach messbarem Serum-Antikörper-Titer
- Influenza-Impfung nach den aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut (RKI).
- Routinemäßige Röntgenuntersuchungen sind in der Hausarztpraxis nicht indiziert; das gilt auch für routinemäßige Blutproben, außer bei laufender Chemotherapie.
Fatigue
- Schwere, anhaltende Erschöpfung mit Unwohlsein, dem Gefühl von Kraftlosigkeit und schneller Ermüdbarkeit
- Keine oder unzureichende Linderung durch Ausruhen oder Schlaf
- Tritt bei Krebspatient*innen sehr häufig auf, besonders während und nach einer Strahlen- oder Zytostatika-Therapie.
- Von allen behandlungsbezogenen Beschwerden wird die Fatigue von Krebspatient*innen am belastendsten erlebt.
- Ein leichtes Trainingsprogramm begünstigt möglicherweise die berufliche Rehabilitation.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Es ist nie zu spät, mit dem Rauchen aufzuhören.
- Rauchen erhöht das Risiko für die Entwicklung eines neuen Lungenkrebses oder einer anderen Krebserkrankung.
- Es gibt Hinweise darauf, dass bestimmte Behandlungsformen, z. B. Strahlentherapie, bei Raucher*innen möglicherweise eine geringere Wirkung haben als bei Nichtraucher*innen.
Patienteninformationen in Deximed
Weitere Informationen
- Deutsche Krebshilfe: Strahlentherapie
Illustrationen

Trommelschlegelfinger (mit freundlicher Genehmigung von Dr. med. Erich Ramstöck)

Normale Lunge und Bronchien

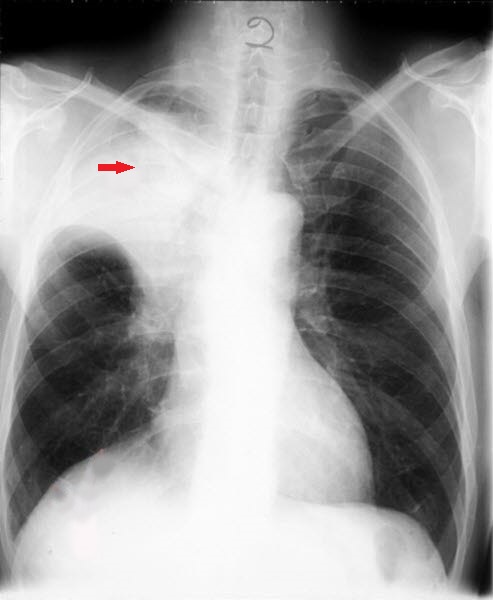
Lungenkrebs, Röntgen
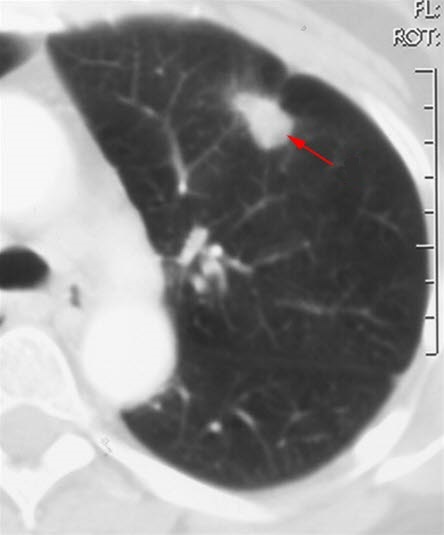
Lungenkrebs (CT)
Kleinzelliges anaplastisches Karzinom, Röntgen
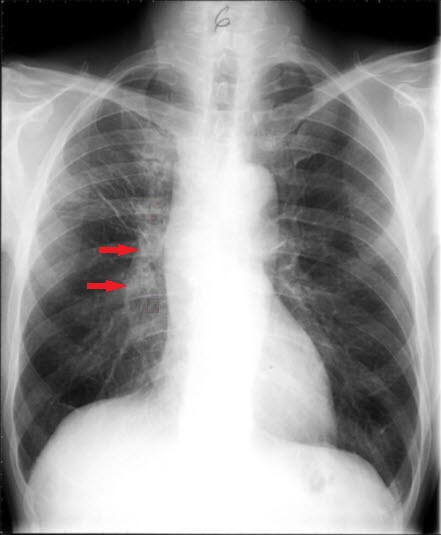
Kleinzelliges anaplastisches Karzinom, nach Behandlung, Röntgen
Quellen
Leitlinien
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP), Deutsche Krebsgesellschaft (DKG). Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. AWMF-Leitlinie Nr. 020-007OL. S3, Stand 2022. www.awmf.org
Literatur
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP), Deutsche Krebsgesellschaft (DKG). Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms. AWMF-Leitlinie Nr. 020-007OL S3, Stand 2022. www.awmf.org
- Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO). Lungenkarzinom, kleinzellig (SCLC) - Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen. Stand Januar 2023. www.onkopedia.com
- Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO). Lungenkarzinom, nicht-kleinzellig (NSCLC) - Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen. Stand November 2022. www.onkopedia.com
- Travis WD, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol, 2015. 10: 1243-60. PMID: 26291008 PubMed
- Wittekind C. TNM: Klassifikation maligner Tumoren. 2017: Wiley.
- Deutsches Institut für Medizinische Dokumentation und Information (DIMDI). ICD-10-GM Version 2023, Stand 06.12.2022. www.dimdi.de
- Deutsche Gesellschaft für Neurologie (DGN). Hirnmetastasen und Meningeosis neoplastica. AWMF-Leitlinie Nr. 030-060, Klasse S2k, Stand 2014 (abgelaufen). dgn.org
- Lungenkrebsscreening mittels Niedrigdosis-Computertomografie. Auftrag: S19-02. Version: 10, Stand: 19102020. IQWiG-Berichte – Nr. 982. 2020 www.iqwig.de
- Salazar MC, Rosen JE, Wang Z, et al. Association of Delayed Adjuvant Chemotherapy With Survival After Lung Cancer Surgery. JAMA Oncol 2017 May 1; 3(5): 610-619. pmid:28056112 PubMed
- Cortes-Jofre M, Rueda JR, Asenjo-Lobos C, et al. Drugs for preventing lung cancer in healthy people. Cochrane Database Syst Rev 2020; 3: CD002141. www.cochranelibrary.com
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). Dortmund. Merkblätter und wissenschaftliche Begründungen zu den Berufskrankheiten der Anlage 1 zur Berufskrankheiten-Verordnung (BKV), zuletzt aktualisiert durch die Dritte Verordnung zur Änderung der Berufskrankheiten-Verordnung vom 22. Dezember 2014. Zugriff 24.1.2017. www.baua.de
- DGVU Formtexte für Ärzte: Ärztliche Anzeige bei Verdacht auf eine Berufskrankheit. www.dguv.de
- Mehrtens G, Valentin H, Schönberger A. Arbeitsunfall und Berufskrankheit: rechtliche und medizinische Grundlagen für Gutachter, Sozialverwaltung S.878ff. Berlin: Erich Schmidt Verlag 9: Auflage, 2017.
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).