Zusammenfassung
- Definition:Über Süßgewässer verbreitete Wurmerkrankung, bei der die Larve die Haut der Menschen penetriert und Eier im Gewebe ablegt.
- Häufigkeit:In den Tropen weit verbreitet mit über 200 Mio. Betroffenen, in Deutschland nur sporadisch bei Migrant*innen oder Tourist*innen.
- Symptome:Im Akutstadium Dermatitis an Eintrittsstelle und Fieber, später Organkomplikationen durch immunvermittelte Entzündungsreaktion auf die im Gewebe abgelegten Eier.
- Befunde:Hepatosplenomegalie, Lymphadenopathie, systemische Entzündungsreaktion mit Fieber und Abgeschlagenheit.
- Diagnostik:Goldstandard Ei-Nachweis im Urin oder Stuhl, zudem Serologie auf Antikörper.
- Therapie:Medikamentöse Therapie mit Praziquantel im chronischen Stadium, im akuten Stadium symptomatische Therapie in einem tropenmedizinischen Zentrum.
Allgemeine Informationen
Definition
- Die Schistosomiasis ist eine durch Trematoden (Saugwürmer, Egel) verursachte Wurmerkrankung.1
- Synonyme: Bilharziose, Schneckenfieber
- Die Infektion erfolgt durch Kontakt mit den Zerkarien (Larven) in warmen Süßwassergewässern.
- Endemiegebiete in weiten Teilen Afrikas, östliches Brasilien, Venezuela, Yemen, Irak, Syrien, China, Laos, Kambodscha, Philippinen, Sulawesi2
- Es gibt ein akutes und ein chronisches Stadium.2
- akutes Stadium (Katayama-Syndrom)
- systemische fieberhafte Erkrankung mit Zerkariendermatitis
- chronisches Stadium
- fibrotische Organveränderungen und Granulombildung durch immunvermittelte Reaktion auf die Eier im Gewebe
- akutes Stadium (Katayama-Syndrom)
- Entdeckt wurde die Bilharziose 1851 von dem deutschen Chirurgen Theodor Bilharz, der in Kairo lebte und arbeitete.3
Häufigkeit
- Die Schistosomiasis stellt weltweit ein erhebliches Problem dar.
- Neben 200 Mio. infizierten Menschen4 sind Schätzungen zufolge 800 Mio. Menschen infektionsgefährdet.5
- Jedes Jahr führt die Erkrankung bei 20 Mio. Menschen zu schweren Organkomplikationen bis hin zum Tod.3
- Nach WHO-Schätzungen sind 52 Staaten betroffen.6
- Die meisten Infizierten gehören zur Altersgruppe 10–19 Jahre.3
Epidemiologie1
- Schistosoma mansoni
- Erreger der intestinalen und hepatischen Schistosomiasis
- Kommt in ganz Afrika, Südamerika, in der Karibik und im Nahen Osten vor.
- Schistosoma haematobium
- Erreger der urogenitalen Schistosomiasis
- Kommt im Nahen Osten und im südlich der Sahara gelegenen Afrika vor.
- Schistosoma japonicum
- Erreger der asiatischen Darmbilharziose
- Kommt in China, auf den Philippinen und in Teilen Indonesiens vor, vereinzelt auch in Japan.
- Schistosoma intercalatum und Schistosoma mekongi können ebenfalls den Menschen befallen, sind jedoch seltener.
Ätiologie und Pathogenese
- Die Infektion von Menschen erfolgt, indem das im Süßwasser lebende Larvenstadium (Zerkarien) der Schistosomen die Haut der Menschen penetriert.1
- Eine kongenitale Infektion ist wahrscheinlich ebenfalls möglich.3

Lebenszyklus des Pärchenegels (Quelle: Centers for Disease Control and Prevention)
Lebenszyklus im menschlichen Körper
- Adulte Pärchenegel leben in den Venenplexus des Darms (Schistosoma mansoni und Schistosoma japonicum) oder in der Blase (Schistosoma haematobium) des Menschen.
- Ihre Eier werden mit Kot oder Urin ausgeschieden.
- Bei Kontakt mit Wasser schlüpfen daraus die Wimpernlarven.
- Die Wimpernlarven befallen Wasserschnecken und entwickeln sich in ihnen zu Zerkarien weiter.
- Die Zerkarien werden von der Schnecke ausgeschieden und schwimmen im Wasser, in dem sie bis zu 72 Stunden überleben. Infektionstüchtig sind sie bis zu 36 Stunden lang.4
- Eine Schnecke kann über mehrere Monate Tausende von Zerkarien pro Tag ausscheiden.
- Zerkarien können die Haut von Menschen penetrieren.
- Je länger sich Menschen im Wasser aufhalten, desto höher ist das Infektionsrisiko.
- Nach der Penetration gelangen die Zerkarien mit dem Blutstrom in die Leber, wo sie sich zur Geschlechtsreife entwickeln.
- Nach weiteren 4–6 Wochen paaren sich die adulten Würmer und siedeln sich in den Venenplexus der Blasen- oder Darmwand an, wo die Weibchen ihre Eier ablegen. Die Weibchen produzieren jeden Tag Hunderte bis Tausende von Eiern.
- Mit den Eiern geschieht Folgendes:
- Ein Teil der mit einem Stachel versehenen Eier gelangt in den Darm oder in die Blase und wird mit dem Stuhl oder Urin ausgeschieden.
- Ein Teil der Eier bleibt an der Darm- oder Blasenwand haften.
- Wieder andere Eier gelangen über den Blutkreislauf in die Leber, Lunge oder andere Strukturen.
Pathogenese
- Die Symptome stellen in 1. Linie immunvermittelte Reaktionen dar.
- Antigene der Eier regen lokale T-Zellen zur Bildung von Granulomen an, wodurch ausgeprägte fibrotische Gewebeveränderungen ausgelöst werden.1
- Je nach Schwere der Infektion variieren die Symptome und Gewebeschäden.
Prädisponierende Faktoren
- Aufenthalte in kontaminiertem Wasser, z. B. beim Baden/Schwimmen, Waschen, Angeln
- Das Infektionsrisiko steigt mit zunehmender Dauer des Wasserkontakts.
ICPC-2
- D96 Würmer/andere Parasiten
ICD-10
- B65 Schistosomiasis [Bilharziose]
- B65.0 Schistosomiasis durch Schistosoma haematobium [Blasenbilharziose]
- B65.1 Schistosomiasis durch Schistosoma mansoni [Darmbilharziose]
- B65.2 Schistosomiasis durch Schistosoma japonicum
- B65.3 Zerkariendermatitis
- B65.8 Sonstige Formen der Schistosomiasis
- B65.9 Schistosomiasis, nicht näher bezeichnet
Diagnostik
Leitlinie: Indikationen für Diagnostik auf Schistosomiasis2
- Bei zurückliegendem Aufenthalt in einem Schistosomiasis-Endemiegebiet und nachfolgenden Symptomen/Befunden oder Süßwasserkontakt in Endemiegebieten sollte eine Diagnostik durchgeführt werden.
- Falls Aufenthalt < 3 Monate zurückliegend:
- Falls Aufenthalt > 3 Monate zurückliegend:
- unspezifisch
- unklare Eosinophilie, unklares Erschöpfungssyndrom, unklare mikrozytäre Anämie
- gastrointestinale Symptome
- u. a. chronische Diarrhöen, Leberfibrose, portale Hypertension
- urogenitale Symptome
- u. a. Hämaturie, Dysurie, Hämospermie, Harnleiterstenose
- bei Frauen: Blutungen, häufige Aborte, Extrauteringraviditäten, Sterilität, Dyspareunie, ektope Schwangerschaft
- kardiopulmonale Symptome
- Lungenfibrose, Cor pulmonale, pulmonale Vaskulitis
- neurologische Symptome
- u. a. Myelitis, Radikulopathie, Meningoenzephalitis
- unspezifisch
Differenzialdiagnosen
Intestinale Schistosomiasis
- Frühstadium
- Amöbenruhr
- Befall mit Shigella dysenteriae
- Typhus abdominalis
- Malaria
- Spätere Stadien
- viszerale Leishmaniose
- „normale“ Darmpolypen
- chronisch entzündliche Darmerkrankungen
- Hepatitis
Schistosomiasis in der Blase
- Karzinome des Urogenitaltrakts
- Bakterielle Infektionen des Urogenitaltrakts, z. B. Tuberkulose
- Steinerkrankungen
Anamnese
- Kontakt mit Süßwasser in Endemie-Gebieten oder anderen Infizierten
- Bei 50–60 % der Patient*innen verläuft die Infektion symptomatisch.3
Zerkariendermatitis
- Nach dem Eindringen von Zerkarien können lokal auf der Haut Quaddeln, Juckreiz, Erytheme oder Petechien auftreten und bis zu 5 Tage andauern.7
- Die auch als Badedermatitis bezeichnete Form hat einen milden Verlauf.8
- Die Badedermatitis wird von Schistosomen verursacht, die Wasservögel als Wirte haben, im menschlichen Körper nicht zur Geschlechtsreife gelangen und daher keine systemischen Symptome hervorrufen.
Akute Schistosomiasis (Katayama-Syndrom)
- Die Erkrankung stellt im Wesentlichen eine allergische Reaktion dar.
- Die Inkubationszeit beträgt 2–7 Wochen.
- Die Erkrankung bricht plötzlich mit Fieber, Krankheitsgefühl, Urtikaria, Diarrhö (ggf. blutig), Myalgie, Reizhusten, Leukozytose und ausgeprägter Eosinophilie aus.
- Das Katayama-Syndrom tritt häufig bei Tourist*innen und anderen Personen auf, die dem Erreger nur vorübergehend ausgesetzt waren.7,9
Chronische Schistosomiasis
-
Manifestiert sich zwischen 6 Monaten und mehreren Jahren nach der Infektion.
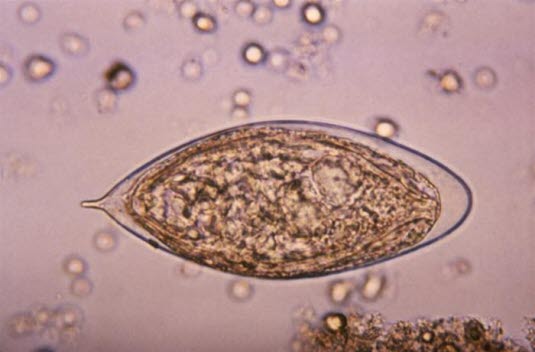
 Ei des Erregers Schistosoma mansoni
Ei des Erregers Schistosoma mansoni - Ansammlung von Eiern im Gewebe nach Abwanderung in die Blase und den Verdauungstrakt oder nach Ausbreitung in Leber, Milz, die Lungen oder das Zentralnervensystem
- Die Eier sondern proteolytische Enzyme ab, die typische eosinophile und granulomatöse Entzündungsreaktionen auslösen und im weiteren Verlauf zu fibrotischen Veränderungen führen.10
- Bei intestinaler Schistosomiasis
- u. a. Diarrhö, Bauchschmerzen, Störungen der Darmtätigkeit, Hämatochezie
- Bei Schistosomiasis der Blase
- Schistosomiasis der Leber
- Stellt eine Mischform aus früher entzündlicher und später fibrotischer Lebererkrankung dar.11
- u. a. Hepatomegalie, Leberfibrose, portale Hypertension
- Pulmonale Schistosomiasis
- Neuroschistosomiasis
- u. a. Myelitis, Meningoenzephalitis
- Befällt in erster Linie die Lunge und kann bronchiale Symptome hervorrufen.
- Weitere Formen sind die urogenitale Schistosomiasis und die Neuroschistosomiasis.
- Genitale Schistosomiasis
- Infektion mit S. haematobium führt häufig zu Beteiligung des Genitaltrakts.
- Der Befall der Eileiter führt häufig zu einem narbigen Verschluss mit einer erhöhten Neigung zu extrauterinen Schwangerschaften oder zu Infertilität.4
Klinische Untersuchung
- Mögliche klinische Befunde bei akuter Schistosomiasis sind generalisierte Lymphknotenschwellungen, Fieber, Hautausschlag.
- Häufig findet man sowohl bei der akuten als auch chronischen Form eine Hepatosplenomegalie.
Leitlinie: Obligate Diagnostik2
- Bei symptomatischen Patient*innen sollten eine serologische Untersuchung und parasitologische Untersuchungen auf Schistosomen-Eier in Stuhl bzw. Urin erfolgen.
- Urin bei Herkunft aus S.-haematobium-Endemiegebieten, Stuhl bei Herkunft aus S.-mansoni- oder S.-japonicum-Endemiegebiet
- Serologie (Nachweis spezifischer Antikörper)
- Einsendung von ca. 2 ml Serum an ein in der Schistosomiasis-Immundiagnostik ausgewiesenes Laboratorium
- Ei-Nachweis im Stuhl
- Einsendung von 3 konsekutiven Stuhlproben in Konservierungsflüssigkeit an ein für den mikroskopischen Ei-Nachweis ausgewiesenes Labor
- Ei-Nachweis im Urin
- möglichst schnelle Einsendung von 3 konsekutiven Sammelurinen (Gesamturin zwischen 10.00 und 14.00 Uhr) an ein für den mikroskopischen Ei-Nachweis ausgewiesenes Labor
- Zusätzliche Diagnostik bei vermuteter (Serologie positiv) oder nachgewiesener (Ei-Nachweis positiv) Infektion
- Blutbild plus Differenzialblutbild, Lebertransaminasen, Gamma-GT, Bilirubin, alkalische Phosphatase, Urinstatus und Sediment, Kreatinin, Gesamteiweiß und Elektrophorese
- Sonografie des Abdomens
- Wegweisend sind die typische Reiseanamnese mit Kontakt mit Binnengewässern und der klinische Befund.
- Goldstandard ist die mikroskopische Untersuchung von Urin und Stuhl auf Eier (ggf. sind mehrere Tests erforderlich).12-13
- Bei beschwerdefreien Tropenrückkehrer*innen sollte eine Screening-Untersuchung durchgeführt werden.2
- Bei Personen, die in Schistosomiasis-Gebieten Süßwasserkontakt gehabt haben, oder wenn bei Mitreisenden eine Schistosomiasis nachgewiesen wurde.
- Bei Personen, die sich längere Zeit in Schistosomiasis-Gebieten aufgehalten haben (z. B. bei Arbeitsaufenthalten), auch wenn ein Süßwasserkontakt nicht erinnerlich ist.
- Die Screening-Untersuchung sollte mindestens 3 Monate nach der letzten möglichen Exposition erfolgen.
- Bei Screening-Untersuchungen ist die serologische Untersuchung ausreichend, es sollten hierbei aber immer 2 unterschiedliche serologische Tests zum Einsatz kommen.
- Beratung und Spezialdiagnostik ist z. B. im Nationalen Referenzzentrum (NRZ) für tropische Infektionserreger am Bernhard-Nocht-Institut für Tropenmedizin, Hamburg, verfügbar.
- Keine krankheits- oder erregerspezifische Meldepflicht nach dem IfSG4
Ergänzende Untersuchungen, ggf. bei Spezialist*in

Ei des Erregers Schistosoma japonicum
- Der Abschnitt basiert auf dieser Referenz.2
- Bei nachgewiesener Infektion mit S. mansoni, S. intercalatum, S. mekongi oder S. japonicum und Herkunft der Patient*innen aus einem Endemiegebiet:
- Koloskopie
- Hepatitis B- und C-Serologie.
- Bei nachgewiesener Infektion mit S. haemotobium:
- Sonografie des Abdomens und Urogenitaltrakts
- bei Frauen
-
- gynäkologische Untersuchung (zum Ausschluss einer Genitalbilharziose mit Ulzerationen und papillomatösen Wucherungen der Genitalschleimhaut)
- bei Männern
- bei Symptomatik einer Prostatitis: PSA.
Therapie
Indikationen zur Überweisung/Klinikeinweisung
- Behandlung und Diagnostik bei Schistosomiasis in Zusammenarbeit mit Tropenmediziner*innen
- Beim Katayama-Syndrom Überweisung an ein tropenmedizinisches Zentrum
- Bei V. a. zerebrale Schistosomiasis: Klinikeinweisung
- Bei jedem Nachweis einer S.-haematobium-Infektion: gynäkologische Überweisung
- Bei urogenitalen Komplikationen: urologische Überweisung
Therapieziele
- Genesung
- Eliminierung des Parasiten
Allgemeines zur Therapie
- Eine medikamentöse Behandlung führt bei den meisten Patient*innen zum Erfolg.
- Praziquantel für sämtliche Formen der Schistosomiasis, Dosierung abhängig von Erregertyp2
- Beim Katayama-Syndrom ist nur eine symptomatische Therapie in einem tropenmedizinischen Zentrum möglich.2
- Ergänzend können chirurgische Maßnahmen erforderlich sein.
Medikamentöse Therapie
Leitlinie: Therapie2
- Katayama-Syndrom: symptomatische Therapie in tropenmedizinischem Zentrum
- Praziquantel wirkt nur unzureichend auf juvenile Schistosomen.
- Medikament der Wahl bei chronischer Form ist immer Praziquantel, Dosierung abhängig von Erreger.
- S.-haematobium- oder S.-mansoni-Infektion (und der Doppelinfektion)
- 40 mg/kg Körpergewicht pro Tag über 3 Tage
- S.-intercalatum-, S.-mekongi-, S.-guineensis- oder S-japonicum-Infektion
- 60 mg/kg Körpergewicht pro Tag über 3 Tage
- Vermutete Infektion ohne Ei-Nachweis
- Wenn die Infektion nicht in Ost- oder Südostasien erworben wurde, ist davon auszugehen, dass wahrscheinlich eine S.-haematobium- oder S.-mansoni-Infektion vorliegt.
- daher 40 mg/kg Körpergewicht pro Tag über 3 Tage
- Geringe Nebenwirkungen von Praziquantel: Schwindel, Benommenheit, Fieber, gastrointestinale Beschwerden, selten urtikarielle Hautreaktionen2
- Kontraindikationen: keine, bei schweren Leberfunktionsstörungen Behandlung nur über 1 Tag2
- Interaktionen: Gleichzeitige Gabe von Cimetidin kann Plasma-Konzentrationen erhöhen, gleichzeitige Gabe von Chloroquin kann die Bioverfügbarkeit herabsetzen.
- Bei zerebraler Schistosomiasis (Myeloradikulitis, Enzephalitis) sind Kortikoide, sowie ggf. auch Antikonvulsiva indiziert.2
Weitere Therapien
- Chirurgische Eingriffe sind in 1. Linie bei Komplikationen indiziert, z. B.:
- Ureterstenose: Resektion fibrotischer Strukturen
- Pseudopolypen in Darm oder Harnblase: Resektion
- Ösophagusvarizen bei Leberfibrose: unselektive Betablocker, ggf. Ligatur, Skleorosierung oder transjugulärer intrahepatischer portosystemischer Shunt (TIPS)
Leitlinie: Verlaufskontrollen2
- Bei parasitologischen Kontrolluntersuchungen ist zu berücksichtigen, dass avitale (abgestorbene) Eier langfristig im Gewebe verbleiben und auch noch über einen längeren Zeitraum über Stuhl und/oder Urin ausgeschieden werden können. Die Beurteilung der Vitalität der Eier ist daher bedeutsam. Eier sterben innerhalb von 3 Monaten nach ihrer Ablage ab. Der Nachweis vitaler Eier zu einem späteren Zeitpunkt beweist daher ein Therapieversagen oder eine Reinfektion.
- Infektionen mit Ei-Nachweis von S. haematobium
- nach 6, 12 und 24 Monaten
- Urinstatus
- 3 x Sammelurin auf Schistosomen-Eier
- Kontrolle pathologischer Vorbefunde in den bildgebenden Verfahren
- nach 12 und 24 Monaten
- serologische Untersuchung auf spezifische Antikörper (möglichst im selben Labor, um die Ergebnisse besser vergleichen zu können)
- Interpretation
- Bei fehlendem Ei-Nachweis bei den 3 Folgeuntersuchungen und bei abfallenden oder negativen Antikörpern nach 12 und 24 Monaten: Infektion gilt als ausgeheilt.
- falls weiter Ei-Nachweis oder fehlender Abfall der Antikörper: Wiederholung der Therapie mit Praziquantel
- nach 6, 12 und 24 Monaten
- Infektionen mit Ei-Nachweis von S. japonicum, S. mansoni, S. intercalatum, oder S. mekongi
- nach 6, 12 und 24 Monaten
- 3-malige Stuhluntersuchung auf Schistosomen-Eier
- Kontrolle pathologischer Vorbefunde in den bildgebenden Verfahren
- nach 12 und 24 Monaten
- serologische Untersuchung auf spezifische Antikörper (möglichst im selben Labor, um die Ergebnisse besser vergleichen zu können)
- Interpretation
- Bei fehlendem Ei-Nachweis bei den 3 Folgeuntersuchungen und bei abfallenden oder negativen Antikörpern nach 12 und 24 Monaten: Infektion gilt als ausgeheilt.
- falls weiter Ei-Nachweis oder fehlender Abfall der Antikörper: Wiederholung der Therapie mit Praziquantel
- nach 6, 12 und 24 Monaten
Prävention
- Impfstoffe stehen bislang nicht zur Verfügung, befinden sich aber in der Entwicklung.
- Vermeidung von Baden in betroffenen Gewässern. Bei unvermeidbarem Wasserkontakt Schutzkleidung tragen (Stiefel, Handschuhe).
- Vermeidung von Wasserlassen und Stuhlgang an Gewässern, in denen gebadet oder gewaschen wird. Aufstellung von Latrinen und Erläuterung ihrer Benutzung.
- Am größten Binnensee Chinas konnte das Vorkommen der Erkrankung innerhalb von 2 Jahren um 75 % gesenkt werden, indem u. a. den Reisbauern Gummistiefel zur Verfügung gestellt wurden, sodass sie nicht mehr barfuß durch das verunreinigte Wasser gehen mussten.14
Verlauf, Komplikationen und Prognose
Komplikationen
- Der Abschnitt basiert auf dieser Referenz.3
- Bei Kindern Wachstumshemmung
- Gastrointestinale Blutung
- Nierenversagen
- Pyelonephritis
- Hämaturie
- Karzinome der Leber, Harnblase und Gallenblase
- Pulmonale Hypertonie
- Cor pulmonale
- Paresen, Myelitis
- Infertilität
- Anämie
- Portale Hypertension, Leberzirrhose
- Extrauteringravidität
- Erhöhtes Risiko für sexuell übertragbare Erkrankungen
- Läsionen in Genitalschleimhaut bei S. haematobium
Verlauf
Katayama-Syndrom
- Die meisten Patient*innen erholen sich nach 2–10 Wochen spontan.
- Manchmal kommt es jedoch zu einem schwereren und länger anhaltenden Verlauf mit Gewichtsverlust, Dyspnoe, Diarrhö, diffusen Bauchschmerzen, Hepatosplenomegalie und großflächigen Hautausschlägen.12
Chronische Infektion
- Chronische Symptome einer Infektion des Verdauungstrakts oder der Blase treten bei Touristen in endemischen Regionen kaum auf, da hierfür eine Exposition über einen längeren Zeitraum erforderlich ist (meist über Jahre).
- Die Menge der Eier in Körper bestimmt das Risiko für die Entwicklung von Organkomplikationen.3
- 4–8 % der Patient*innen mit unbehandelter Infektion mit S. mansoni, S. japonicum, oder S. mekongi entwickeln gastrointestinale Komplikationen.15
- Von den Patient*innen mit gastrointestinalen Komplikationen entwickeln 7,7 % eine pulmonale Hypertonie, weltweit etwa 270.000 Betroffene.15
- Co-Infektionen mit Hepatitis B oder C und S. mansoni zeigen häufig einen rapiden Progress der Lebererkrankung.3
- 2–4 % der Patient*innen mit unbehandelter Infektion mit S. japonicum entwickeln ZNS-Komplikationen (Eier kleiner als bei den anderen Formen).16
Prognose
- Bei früher Diagnose und adäquater Therapie werden 95–100 % der Patient*innen geheilt.17
- Auch Patient*innen mit renalen, hepatischen oder zerebralen Läsionen zeigen unter Therapie in der Regel eine gute Prognose.18
- Eine schlechte Prognose haben Patient*innen, bei denen bereits eine pulmonale oder portale Hypertension oder ein Cor pulmonale vorliegen.3
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Lebenszyklus des Pärchenegels (Quelle: Centers for Disease Control and Prevention)
Ei des Erregers Schistosoma mansoni (Quelle: Centers for Disease Control and Prevention)
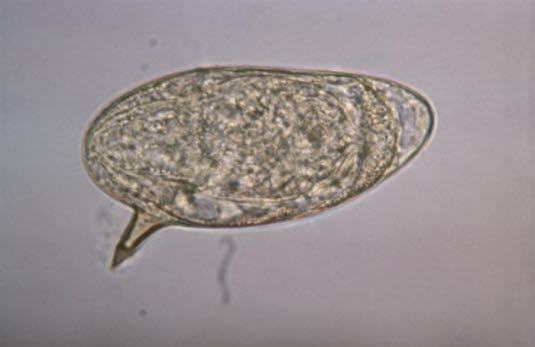
Eier des Erregers Schistosoma haematobium (Quelle: Centers for Disease Control and Prevention)
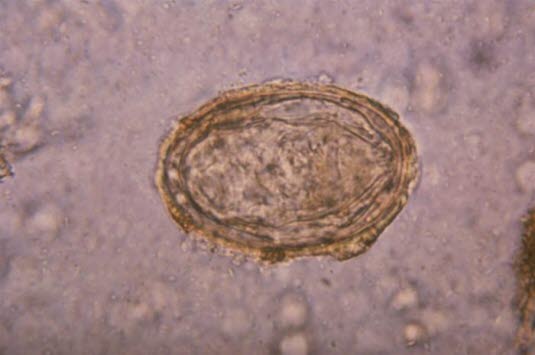
Ei des Erregers Schistosoma japonicum (Quelle: Centers for Disease Control and Prevention)
Quellen
Leitlinie
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e. V. Schistosomiasis (Bilharziose), Diagnose und Therapie. AWMF-Leitlinie Nr. 042-005. S1, Stand 2017. www.awmf.org
Literatur
- Chuah C, Gobert GN, Latif B, et al. Schistosomiasis in Malaysia: A Review. Acta Trop 2019; 190: 137-43. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V. Schistosomiasis (Bilharziose), Diagnose und Therapie. AWMF-Leitlinie Nr. 042-005. Stand 2017. www.awmf.org
- Ahmed SH, Bronze MS. Schistosomiasis. Medscape, last updated Sep 20, 2018 emedicine.medscape.com
- Robert-Koch-Institut. Schistosomiasis (Bilharziose). Steckbriefe seltener und importierter Infektionskrankheiten. Stand 2016. www.rki.de
- Steinmann P, Keiser J, Bos R, et al. Schistosomiasis and water resources development: systematic review, meta-analysis, and estimates of people at risk. Lancet Infect Dis 2006; 6: 411-25. PubMed
- Statistisches Bundesamt. G7 in Zahlen. 2015. www.destatis.de
- Bottieau E, Clerinx J, De Vega MR, et al. Imported Katayama fever: clinical and biological features at presentation and during treatment. J Infect 2006; 52: 339-45. PubMed
- Horak P and Kolarova L. Molluscan and vertebrate immune responses to bird schistosomes. Parasite Immunol 2005; 27: 247-55. PubMed
- Hatz C. Schistosomiasis: an underestimated problem in industrialised countries? J Travel Med 2005; 12: 1-2. PubMed
- Cheever AW, Hoffmann KF and Wynn TA. Immunopathology of schistosomiasis mansoni in mice and men. Immunol Today 2000; 21: 465-6. PubMed
- Abath FGC, Morais CNL, Montenegro CEL, Wynn TA and Montenegro SML. Immunopathogenic mechanisms in schistosomiasis: what can be learnt from human studies? Trends Parasitol 2006; 22: 85-91. PubMed
- Colley DG, Bustinduy AL, Secor WE, et al. Human schistosomiasis. Lancet. 2014 Jun 28;383(9936):2253-64. www.ncbi.nlm.nih.gov
- Ochodo EA, Gopalakrishna G, Spek B, Reitsma JB, van Lieshout L, Polman K et al.. Circulating antigen tests and urine reagent strips for diagnosis of active schistosomiasis in endemic areas. Cochrane Database of Systematic Reviews 2015, Issue 3. www.ncbi.nlm.nih.gov
- Wang L-D, Chen H-G, Guo J-G. A strategy to control transmission of schistosoma japonicum in China. N Engl J Med 2009; 360: 121-8. New England Journal of Medicine
- Lapa M, Dias B, Jardim C, Fernandes CJ, Dourado PM, Figueiredo M. Cardiopulmonary manifestations of hepatosplenic schistosomiasis. Circulation. 2009 Mar 24. 119(11):1518-23. www.ncbi.nlm.nih.gov
- Walker M, Zunt JR. Parasitic central nervous system infections in immunocompromised hosts.. Clin Infect Dis 2005; 40(7): 1005-15. www.ncbi.nlm.nih.gov
- Gray DJ, Ross AG, Li Y-S, et al. Diagnosis and management of schistosomiasis. Clinical review. BMJ 2011; 342: d2651. BMJ (DOI)
- Vennervald BJ, Dunne DW. Morbidity in schistosomiasis: an update.. Curr Opin Infect Dis 2004; 17(5): 439-47. www.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).