Zusammenfassung
- Definition:Das Cushing-Syndrom ist definiert als pathologischer, endogener Hyperkortisolismus. Unterschieden werden: 1. ACTH-abhängige Form – autonome ACTH-Produktion mit sekundär erhöhtem Kortisolspiegel (M. Cushing, ca. 80 %), 2. ACTH-unabhängige Form – autonome Kortisolproduktion der Nebennierenrinde (ca. 20 %).
- Häufigkeit:Jährliche Inzidenz ca. 0,2–5,0/1 Mio., Frauen zu Männern ca. 3:1.
- Symptome:Gewichtszunahme, Fatigue, Muskelschwäche, Depression.
- Befunde:Rotes gerundetes Gesicht, Stiernacken, Stammfettsucht, Hirsutismus, Striae, arterielle Hypertonie.
- Diagnostik:Bei klinischem Verdacht Screening mit Dexamethason-Hemmtest, Kortisol im 24-Stunden-Urin oder Kortisol im Speichel. Erst nach Diagnosestellung erfolgt weitere Labordiagnostik und Bildgebung zur Lokalisation.
- Therapie:Primäre Therapieoption ist die operative Entfernung eines hormonproduzierenden Tumors. Medikamentöse Therapie bei inoperablen Patient*innen zur Krankheitskontrolle.
Allgemeine Informationen
Definition
- Cushing-Syndrom ist definiert als pathologischer, endogener Hyperkortisolismus durch:1-2
- ACTH-abhängige Form: autonome ACTH-Produktion mit sekundär erhöhtem Kortisolspiegel (M. Cushing, ca. 80 %)
- ACTH-unabhängige Form: autonome Kortisolproduktion der Nebennierenrinde (ca. 20 %).
- Abzugrenzen ist das deutlich häufigere iatrogene Cushing-Syndrom durch exogene Zufuhr von Glukokortikoiden zu therapeutischen Zwecken.2
Häufigkeit
- Das endogene Cushing-Syndrom ist eine seltene Erkrankung.
- Inzidenz
- ca. 0,2–5,0 pro 1 Mio. Personen/Jahr2
- Geschlecht
- Frauen zu Männern ca. 3:13
- Alter
Ätiologie
ACTH-abhängige Form (80 %)
- Mikroadenome des Hypophysenvorderlappens verursachen ca. 85–90 % der ACTH-abhängigen Fälle.2-3
- Selten durch Tumoren mit ektoper ACTH-Produktion (kleinzellige Bronchialkarzinome, Karzinoide)3
- Sehr selten: hypothalamische Überfunktion, ektope CRH-Sekretion
ACTH-unabhängige Form (20 %)
- Am häufigsten durch unilaterales kortisolproduzierendes Nebennierenadenom2
- Seltener sind:2
- bilaterale makronoduläre oder mikronoduläre Nebennierenhyperplasie
- kortisolproduzierendes Nebennierenkarzinom.
Pathogenese
- Durch exzessive ACTH-Stimulation oder autonome Produktion in der Nebenniere kommt es zum permanenten Kortisolüberschuss.
- Die normale Variation des Kortisolspiegels im Tagesverlauf ist aufgehoben.5
- Die CRH-Produktion im Hypothalamus wird durch negatives Feedback inhibiert, während eine autonome ACTH-Produktion der Hypophyse kaum inhibiert wird.5
- Symptome und Komorbiditäten sind mit dem metabolischen Syndrom sowie der katabolen Stoffwechsellage bei Patient*innen mit Cushing-Syndrom assoziiert.2
ICPC-2
- T99 Endo./metab./ernäh. Erkrank., andere
ICD-10
- E24 Cushing-Syndrom
- E24.0 Hypophysäres Cushing-Syndrom
- E24.1 Nelson-Tumor
- E24.2 Arzneimittelinduziertes Cushing-Syndrom
- E24.3 Ektopisches ACTH-Syndrom
- E24.4 Alkoholinduziertes Pseudo-Cushing-Syndrom
- E24.8 Sonstiges Cushing-Syndrom
- E24.9 Cushing-Syndrom, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Klinischer V. a. auf die Erkrankung
- Sicherung der Diagnose durch laborchemische Tests
- Bildgebung (erst nach biochemischer Sicherung der Diagnose)2
Differenzialdiagnosen
- Wichtigste Differenzialdiagnose des Cushing-Syndroms ist das metabolische Syndrom mit Adipositas, arterieller Hypertonie und Typ-2-Diabetes.3
- Es gibt eine Vielzahl an Differenzialdiagnosen zu den einzelnen Symptomen des Cushing-Syndroms.2
Funktioneller Hyperkortisolismus
- Eine Reihe von Erkrankungen und Umständen kann zu erhöhten Plasma-Kortisolspiegeln führen, ohne dass ein endogenes Cushing-Syndrom besteht (funktioneller Hyperkortisolismus).6
- Physischer Stress
- intensive sportliche Belastung
- Operationen, Trauma
- Malnutrition
- Schwangerschaft
- Mentaler Stress
- Drogen, Alkohol, Entzug
- schwere Depression
- Anorexia nervosa
- Hospitalisationen
- Metabolische Abnormalitäten
- schlecht kontrollierter Diabetes mellitus
- schwere Adipositas, viszerale Adipositas
- hypothalamische Amenorrhö
- polyzystisches Ovarialsyndrom
- erhöhtes kortisolbindendes Globulin
Anamnese
- Die Krankheitsentwicklung verläuft meist schleichend.
- Zwischen Symptombeginn und Diagnosestellung vergehen im Mittel 2–3 Jahre.5
- Im Vordergrund der von Patient*innen geäußerten Beschwerden stehen häufig:3
- Veränderungen des äußeren Erscheinungsbildes und des Habitus
- Der Vergleich mit älteren Fotos kann hilfreich sein.6
- Dysregulationen der Körperfunktionen (z. B. Amenorrhö, Libido- und Potenzverlust, depressive Verstimmung, Muskel- oder Knochenschmerzen).
- Veränderungen des äußeren Erscheinungsbildes und des Habitus
Symptome1-3
- Gewichtszunahme
- Fatigue
- Schlafstörungen
- Haarverlust
- Rücken- und Knochenschmerzen
- Muskelschwäche
- Hyperpigmentierungen (Gelenke, Narben, perioral, bukkale Schleimhaut)
- Wundheilungsstörungen
- Neigung zu Ekchymosen, Hämatomen
- Zyklusunregelmäßigkeiten, Amenorrhö
- Libidoverlust
- Potenzverlust
- St. n. Fraktur (Osteoporose)
- Depression, Angststörung
- Steht klinisch nicht selten im Vordergrund und ist daher nicht zu unterschätzen.7
- Kognitive Störungen
Klinische Untersuchung
- Arterielle Hypertonie
- Rotes, gerundetes Gesicht
- Stammbetonte Fettsucht
- Supraklavikuläre Fettpolster
- Stiernacken
- Dünne Haut
- Livide Striae
- Hirsutismus
- Akne
- Proximale Muskelschwäche
Ergänzende Untersuchungen in der hausärztlichen Praxis
- Ein Screening kann im hausärztlichen Bereich durchgeführt werden.8
Indikation zum Screening
- Es sollten nur Patient*innen mit einer hohen klinischen A-priori-Wahrscheinlichkeit für ein Cushing-Syndrom getestet werden.6
- Ein Screening wird empfohlen bei:2
- Patient*innen mit mehreren Symptomen, die charakteristisch für ein Cushing-Syndrom sind.
- Patient*innen mit Hypophysen- oder Nebennieren-Inzidentalom
- Patient*innen mit für ihr Alter untypischen Symptomen (z. B. Osteoporose bei jungen Menschen)
- Verbreitete Erkrankungen wie Adipositas, Diabetes mellitus oder arterielle Hypertonie rechtfertigen ein Screening nicht.6
Laborscreening
- Kein Goldstandardtest, Anamnese und Klinik sind unverzichtbare Bestandteile der diagnostischen Endbeurteilung.6
- Ein Screening sollte auf keinen Fall lediglich über die Bestimmung eines basalen Kortisols oder ACTH durchgeführt werden.3
- Vor einem Laborscreening sollte eine exogene Kortikosteroidzufuhr ausgeschlossen sein (inkl. Quellen wie intraartikuläre Injektionen, Crèmes oder pflanzliche/nicht verschreibungspflichtige Arzneimittel v. a. aus dem asiatischen Raum)6
- Zur Erhärtung des V. a. ein Cushing-Syndrom kann gemäß Leitlinien einer der 3 folgenden Tests verwendet werden:2,6,9
- Im hausärztlichen Bereich sollte bei klinischem Verdacht als erste Untersuchung ein 1-mg-Dexamethason-Hemmtest durchgeführt werden, da dieser in der Praxis häufig am praktikabelsten ist.
- Bei positivem Befund kann weitere Diagnostik mit den anderen Verfahren erfolgen oder die Überweisung an Endokrinolog*innen erwogen werden.2
Niedrig dosierter Dexamethason-Hemmtest
- Sensitivität 99 %, Spezifität 91 %
- Durchführung9
-
- abendliche Einnahme von 1 mg Dexamethason zwischen 23.00 und 24.00 Uhr
- Blutentnahme zur Kortisolbestimmung zwischen 8.00 und 9.00 Uhr
- beim Cushing-Syndrom fehlende Suppression von Kortisol, normalerweise Suppression auf < 1,8 μg/dl (50 nmol/l)
Bestimmung von Kortisol im 24-Stunden-Sammelurin
- Sensitivität 94 %, Spezifität 93 %
- Zur Durchführung siehe auch Artikel Kortisol, Urin.
Messung des spätabendlichen Speichelkortisols
- Sensitivität 99 %, Spezifität 93 %
- Zur Durchführung siehe auch Artikel Kortisol, Speichel.
Allgemeines Labor
- Blutbild
- Glukose, HbA1c
- Nachweis eines Diabetes mellitus
Diagnostik bei Spezialist*innen
- Nach Nachweis eines Hyperkortisolismus werden weitere Laboruntersuchungen und bildgebende Verfahren zur Lokalisationsdiagnostik durchgeführt.
Labor
- Im nächsten Schritt wird die Frage nach ACTH-abhängigem bzw. ACTH-unabhängigem Hyperkortisolismus beantwortet.2,6
- ACTH hoch/normal: hypophysäre/ektope Ursache
- Zwischen hypophysärer und ektoper Ursache kann mit dem CRH-Test weiter differenziert werden (bei unklaren Fällen evtl. ACTH-Messung mit Sinus-petrosus-Katheter nach CRH-Gabe).
- ACTH tief/nicht messbar: adrenale Ursache
- ACTH hoch/normal: hypophysäre/ektope Ursache
Bildgebung
- Bildgebung erst nach Sicherung der Diagnose2
- adrenales Cushing-Syndrom: CT der Nebennieren ohne Kontrastmittel
- hypophysäres Cushing-Syndrom (Morbus Cushing): Dünnschicht-MRT der Hypophyse mit Kontrastmittel
- ektopes Cushing-Syndrom: CT von Hals, Thorax und Abdomen sowie ggf. weitere funktionelle Bildgebung (DOTATATE-PET, FDG-PET, DOPA-PET)
Indikationen zur Überweisung
- Bei Verdacht auf ein endogenes Cushing-Syndrom kann das Basis-Screening in der hausärztlichen Praxis erfolgen.
- Bei erhärtetem Verdacht sollte die Überweisung an Endokrinolog*innen erfolgen.6
Therapie
Therapieziele
- Ziele der Behandlung sind:11
- Normalisierung des Hormonspiegels bzw. Hemmung der Kortisolwirkung zur Eliminierung der Krankheitszeichen und -symptome
- Behandlung von Komorbiditäten
Allgemeines zur Therapie
- Das Cushing-Syndrom ist grundsätzlich therapiebedürftig, unbehandelt beträgt die 5-Jahres-Mortalität ca. 50 %.3
- Nach einer gezielten biochemischen und radiologischen Diagnostik/Lokalisation ist eine kausale Behandlung möglich.6
- Primäre Therapieoption ist die operative Entfernung hormonproduzierender Raumforderungen (hypophysär, adrenal, ektop).
- Bei inoperablen Patient*innen bestehen medikamentöse Optionen zur Krankheitskontrolle.
Operative Therapie
- Option für alle Subtypen mit lebenslanger Remission ist die bilaterale Adrenalektomie, aufgrund der verursachten Nebenniereninsuffizienz mit dem Risiko lebensbedrohlicher Addison-Krisen ist dies aber im Allgemeinen keine Primärtherapie.2
Zentrales Cushing-Syndrom (M. Cushing)
- Therapie der Wahl ist die transsphenoidale Resektion des Hypophysenadenoms.11
- Die Operation sollte in einem hierfür spezialisierten Zentrum durchgeführt werden.2
- Ergänzende Strahlentherapie nur bei Persistenz der Erkrankung nach Operation oder bei einem Rezidiv.2
Adrenales Cushing-Syndrom
- Bei singulärem benignem Tumor Adrenalektomie der entsprechenden Seite11
- Bei bilateraler mikronodulärer Hyperplasie erfolgt die beidseitige Adrenalektomie.11
- Bei häufig mild verlaufender bilateraler makronodulärer Hyperplasie kann im Sinne eines Debulkings eine einseitige Adrenalektomie erfolgen oder versuchsweise eine medikamentöse Therapie.2
- Bei Nebennierenrindenkarzinomen ist eine En-bloc-Resektion des Tumors mit umgebendem retroperitonealem Fettgewebe die Standardtherapie.12
Ektopes Cushing-Syndrom
- Bei ektopem Cushing-Syndrom möglichst Resektion des jeweiligen Tumors2
- Bei dem seltenen okkulten Cushing-Syndrom (keine Tumordarstellung in der Bildgebung) medikamentöser Therapieversuch oder bilaterale Adrenalektomie2
Medikamentöse Therapie
- Pharmakologische Therapie bei inoperablen Patient*innen oder ektopen Quellen im Rahmen eines malignen Tumors6
- Durch neue Wirkstoffe zunehmende Bedeutung in den vergangenen Jahren2
- Zur Verfügung stehen:5-6
Verlauf, Komplikationen und Prognose
Komplikationen und Komorbiditäten
- Auch nach erfolgreicher Therapie können Komorbiditäten anhalten oder sind nur langsam reversibel.2
- arterielle Hypertonie (58–85 %)
- partiell reversibel (Persistenz in 24–56 % der Fälle)
- Diabetes mellitus (80–90 % gestörte Glukosetoleranz, 20 % Diabetes mellitus)
- partiell reversibel
- Dyslipidämie (40–70 %)
- Persistenz eines abnormen Lipidprofils in ca. 1/3 der Fälle
- Myopathie (40–70 % periphere Muskelschwäche)
- persistierend für mehrere Jahre
- Depression (50–80 %)
- häufig Persistenz
- Osteoporose (22–57 %)
- Normalisierung der Knochendichte innerhalb von Jahren möglich
- Hyperkoagulabilität (erhöhtes Risiko für thrombotische und thrombembolische Ereignisse)
- persistierend über Jahre trotz Remission
- Infektanfälligkeit (erhöhtes Risiko für schwere Infektionen)
- reversibel
Verlauf und Prognose
- Unbehandelt verläuft die Cushing-Erkrankung letal mit kardiovaskulären Komplikationen als häufigster Todesursache.3
- Unbehandelt beträgt die Mortalität ca. 50 % nach 5 Jahren.3
- Nach vollständiger Entfernung eines Tumors günstige Prognose3
- Morbidität und Mortalität sind vorwiegend mit den durch den Glukokortikoidexzess verursachten Komorbiditäten/Komplikationen assoziiert.15
- Bei Patient*innen mit Morbus Cushing treten relativ häufig Rezidive auf (15–50 %).2
Postoperativer Verlauf und Verlaufskontrolle
- In der Regel kommt es zu einer tertiären (hypothalamischen) Nebenniereninsuffizienz, daher obligate postoperative Behandlung mit Hydrokortison.2
- zur Vermeidung eines postoperativen Glukokortikoidentzugssynsdroms (Fatigue, Depression, Myopathie, Gelenkbeschwerden) passager erhöhte Hydrokortisondosis vor der Erhaltungsdosis von 20–25 mg/d2
- Langfristig Verlaufskontrollen 1-mal jährlich hinsichtlich:2
- Rezidiv
- Komorbiditäten.
- Bei Patient*innen nach transsphenoidaler Hypophysenoperation Untersuchung der Hypophysenfunktion und ggf. Substitution2
- Schulung der Patient*innen zum Umgang mit Nebennierenkrisen, Aushändigung von Notfallausweis und Notfallset2
Patienteninformationen
Patienteninformation in Deximed
Illustrationen
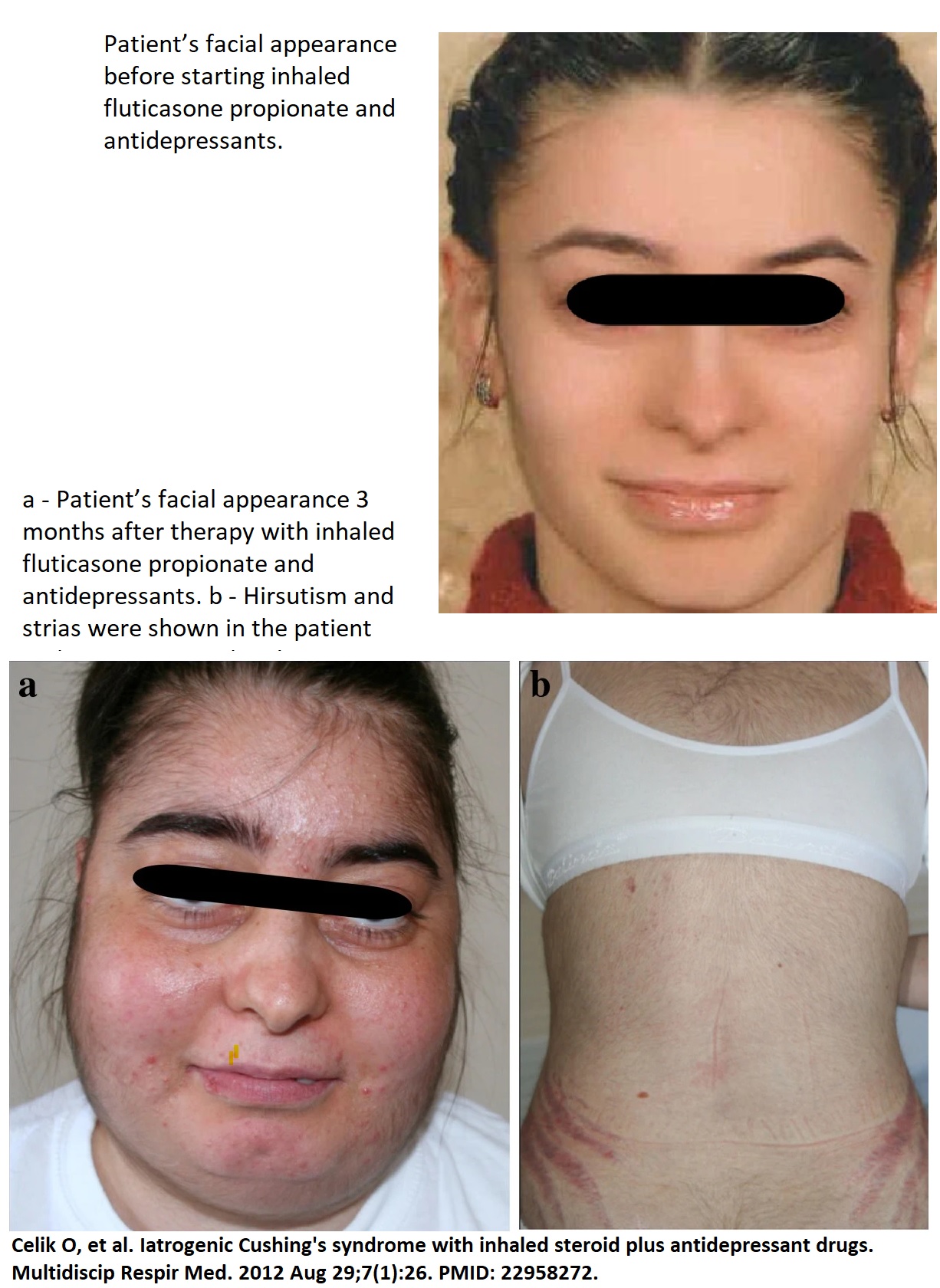
Iatrogenes Cushing-Syndrom mit typischen Symptomen: rotes gerundetes Gesicht, Akne, Hirsutismus, Striae

Niere und Nebenniere
Quellen
Leitlinien
- Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie. Operative Therapie von Nebennierentumoren. AWMF-Leitlinie Nr. 088-008. S2k, Stand 2017. www.awmf.org
- Deutsche Gesellschaft für Kinder- und Jugendmedizin, Deutsche Gesellschaft für Endokrinologie. Cushing-Syndrom. AWMF-Leitlinie Nr. 027-033. S1, Stand 2010. www.awmf.org
- Pituitary Society. Consensus on diagnosis and management of Cushing's disease: a guideline update. Stand 2021. www.eprints.whiterose.ac
- Endocrine Society. Treatment of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2015. www.endocrine.org
- Endocrine Society. Diagnosis of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2008. www.endocrine.org
Literatur
- Niemann L. Recent Updates on the Diagnosis and Management of Cushing’s Syndrome. Endocrin Metab 2018; 33: 139-146. doi:10.3803/EnM.2018.33.2.139 DOI
- Vogel F, Braun L, Reincke M. Morbidität und Mortalität beim Cushing-Syndrom. Internist 2022; 63: 34-42. doi:10.1007/s00108-021-01222-7 DOI
- Fornara P, Kawan F. Hyperkortisolismus (Cushing-Syndrom, Morbus Cushing, adrenales Cushing-Syndrom). eMedpedia, publiziert 07.01.15, Zugriff 15.08.22. www.springermedizin.de
- Deutsche Gesellschaft für Kinder- und Jugendmedizin, Deutsche Gesellschaft für Endokrinologie. Cushing-Syndrom. AWMF-Leitlinie Nr. 027-033, Stand 2010. www.awmf.org
- Lonser R, Nieman L, Oldfield E. Cushing’s disease: pathobiology, diagnosis, and management. J Neurosurg 2017; 126: 404-417. doi:10.3171/2016.1.JNS152119 DOI
- Gasser M, Meier C. Cushing-Syndrom 2016. Swiss Med Forum 2016; 16: 515-519. doi:10.4414/smf.2016.02681 DOI
- Schilling T, Räpple D, Heymer J, et al. Endokrinologische Notfälle. Notfall Rettungsmed 2021; 24: 83-97. doi:10.1007/s10049-020-00766-9 DOI
- Kirk L, Hash R, Katner H, et al. Cushing's Disease: Clinical Manifestations and Diagnostic Evaluation. Am Fam Physician 2000; 62: 1119-1127. www.aafp.org
- Endocrine Society. Diagnosis of Cushing´s Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2008 www.endocrine.org
- Stiefelhagen P. Das Cushing-Syndrom ist eine diagnostische Fallgrube. Info Diabetologie 2017; 11: 47. doi:10.1007/s15034-017-1224-x DOI
- Endocrine Society. Treatment of Cushing's Syndrome: An Endocrine Society Clinical Practice Guideline. Stand 2015. www.endocrine.org
- Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie. Operative Therapie von Nebennierentumoren. AWMF-Leitlinie Nr. 088-008. Stand 2017. www.awmf.org
- Vetter Ch. Deutsches Ärzteblatt. Cushing-Syndrom: Somatostatin-Analogon drosselt die ACTH-Sekretion. Dtsch Arztebl 2012; 109: A-587. www.aerzteblatt.de
- Fleseriu M, Auchus R, Bancos I et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. The Lancet Diabetes & Endocrinology 2021;9:847-875. eprints.whiterose.ac.uk
- Nguyen H. Endogenous Cushing Syndrome. Medscape, updated Mar 13, 2020. Zugriff 17.08.22. emedicine.medscape.com
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).