Zusammenfassung
- Definition:Die auch als Ostitis deformans bezeichnete Krankheit ist eine fokale oder multifokale chronische Knochenerkrankung mit erhöhter osteoklastischer Knochenresorption und nachfolgend erhöhter Knochenneubildung, die jedoch ein anomales Knochengewebe von verminderter Stabilität hervorbringt.
- Häufigkeit:In Deutschland etwa 1–2 %, Tendenz stark rückläufig.
- Symptome:Die Erkrankung ist zunächst asymptomatisch, mit der Zeit stellen sich jedoch lokale Symptome in Form von Missempfindungen und chronischen Knochenschmerzen ein, in der Regel konstant und nachts am schlimmsten sind.
- Befunde:Der klinische Befund kann ein besonders weiches oder besonders hartes Knochengewebe zeigen. Eine zunehmende Deformierung kann zu einem vergrößerten Schädel, einer gebogenen Tibia oder gesteigerter Kyphose führen.
- Diagnostik:Zur genauen Diagnostik werden Röntgen und Szintigrafie eingesetzt.
- Therapie:Die meisten Betroffenen benötigen keine Therapie; ggf. Bisphosphonate.
Allgemeine Informationen
Definition
- Synonym Ostitis deformans
- Knochendysplasie unbekannter Ursache mit genetischer Prädisposition
- Erstbeschreibung 1877 von J. Paget1
- Die Ostitis deformans ist eine fokale, chronische Knochenerkrankung mit erhöhter osteoklastischer Knochenresorption und sekundär erhöhter Knochenneubildung, die jedoch ein anomales, hypervaskularisiertes Knochengewebe von verminderter Stabilität hervorbringt.2
- Die fokalen Veränderungen sind in einem oder in mehreren Knochen zu beobachten.
- Die Krankheit kann Schmerzen, Deformitäten und lokale Überwärmung (Hypervaskularisation) verursachen, ist bei den meisten Patient*innen aber asymptomatisch.
- Mögliche Komplikationen der Ostitis deformans sind Frakturen, Arthrose, Schwerhörigkeit, Spinalstenose, Kompression peripherer Nerven, ein vaskuläres „Steal-Phänomen“, Herzinsuffizienz, Hyperkalzämie, Nephrolithiasis und Hyperurikämie.
- Die Krankheit wird in frühen Stadien oft fehldiagnostiziert.3
Häufigkeit
- Äußert sich meist nach dem 50. Lebensjahr, und ist etwas häufiger bei Männern als bei Frauen.4
- Die geografische Variation der Häufigkeit lässt eine genetische Komponente vermuten.
- In Großbritannien sind 3–5 % aller Menschen über 50 Jahren betroffen5-6; in Westeuropa generell über 1 %, in Japan hingegen < 0,01 %.4
- Die aktuellsten Zahlen für Deutschland sind aus dem Jahre 1984 und beschreiben eine Prävalenz von 1,8 % bei Personen > 40 Jahre.7
- positive Familienanamnese bei 5–40 % der Patient*innen8-9
- Prävalenz weltweit deutlich rückläufig10
- Lokalisiert auf einen Knochen bei 25 % (in der Regel Femur, Becken, Schädel oder Tibia), auf mehrere Knochen bei 75 %11
- Es kann generell jeder Knochen betroffen sein.12
- Der sog. „juvenile Morbus Paget“ ist eine extrem seltene autosomal-rezessive Krankheit, die durch Taubheit, Frakturen und Deformitäten gekennzeichnet ist und durch einen generalisierten, lebenslang beschleunigten Knochenumsatz verursacht wird, in der Regel aufgrund eines Mangels an Osteoprotegerin.13
Ätiologie und Pathogenese
- Die Ätiologie ist unbekannt; es scheinen sowohl genetische als auch Umweltfaktoren beteiligt zu sein.14-15
- Eine Mutation im SQSTM1-Gen erhöht das Risiko, am M. Paget zu erkranken.16
- Die Mutation führt zu Aktivierung von Osteoklasten und Induktion der Autophagozytose über den NF-κB-Signalweg.19
- Als auslösende Umweltfaktoren bei den nicht-genetischen Fällen kommen Virusinfektionen infrage, möglicherweise mit einem Paramyxo- oder Masernvirus.4,20
- Ist anfangs oft auf einen Knochen lokalisiert, breitet sich aber in vielen Fällen auf größere Areale des Skelettsystems aus.
Pathophysiologie
- Entzündliches Erscheinungsbild an den Stellen, wo Knochenabbau (erhöhte Aktivität der Osteoklasten) und Knochenneubildung in unkoordinierter Weise geschehen.
- Erhöhte Knochenresorption aufgrund einer gesteigerten Zahl und Größe der Osteoklasten.23
- progrediente fokale Desorganisation der Knochenstruktur mit allmählicher Deformierung
- Die normale Kortikalis wird durch ein grob unregelmäßiges trabekuläres Knochengewebe ersetzt.12
- Der Knochen nimmt an Dicke zu aufgrund einer lebhaften Knochenneubildung, die sowohl auf der Innenseite als auch an der Oberfläche stattfindet.
- Die Knochenfestigkeit kann erheblich geschwächt werden, und vor allem in den langen Röhrenknochen führt dies zu einer Deformierung und evtl. zu einer pathologischen Fraktur.24
Prädisponierende Faktoren
- Virusinfektion?
- Erbliche Veranlagung
ICPC-2
- L99 Muskuloskelet. Erkrankung, andere
- Schließt Morbus Paget mit ein.
ICD-10
- M88 Osteodystrophia deformans [Paget-Krankheit]
- M88.0 Osteodystrophia deformans der Schädelknochen
- M88.8 Osteodystrophia deformans sonstiger Knochen
- M88.9 Osteodystrophia deformans, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Bleibt in der Regel lange asymptomatisch.24
- Häufig Zufallsbefund bei erhöhter AP oder Röntgenuntersuchung
- Das Röntgenbild zeigt oft eine typische Pathologie.
- Die Szintigrafie kann „warme“ Areale (Hypervaskularisation) identifizieren.
Differenzialdiagnosen
- Metastasen
- Osteomyelitis
- Osteodystrophia fibrosa generalisata
- Fibröse Dysplasie
- Maligner Tumor
Anamnese
- Im frühen Stadium ist die Erkrankung asymptomatisch.
- Allmählich stellen sich lokale Symptome ein in Form von Missempfindungen und leichten Schmerzen, die vom Skelett herrühren. Die Schmerzen sind häufig konstant und am schlimmsten nachts; auch können sie sehr stark sein.
- Bei einer pathologischen Fraktur ändern die Schmerzen für gewöhnlich ihren Charakter und werden als Belastungsschmerzen wahrgenommen.
- Die Krümmung der Knochen führt zu Fehlbelastungen, was eine sekundäre Arthrose begünstigen kann.
- Ist der Schädel betroffen, kommt es zum Teil zu Kopfschmerzen; eine Otosklerose kann Schwerhörigkeit verursachen, und eine Kompression des Sehnervs kann in Einzelfällen zur Erblindung führen.
Klinische Untersuchung
- Die Erkrankung kann zwar mehrere Knochen befallen, dabei jedoch keine Gelenke überqueren.
- Aufgrund der erhöhten Durchblutung ist der Knochen spürbar erwärmt, sofern er dicht genug unter der Haut liegt (wie z. B. bei der Tibia).
- Bei stark ausgeprägter Krankheit lassen sich ein auffällig großer Schädel, eine gebogene Tibia oder eine verstärkte Kyphose beobachten.
- Bei Schädelbefall tritt durch die Kompression von Hör- oder Sehnerv in 30–50 % eine Hypakusis auf25, ebenso ist Blindheit möglich.26
- Ursache der Hypakusis sind zudem Schallleitungsstörungen durch ankylosierte Ohrknöchelchen.
- Pathologische Frakturen und Gelenkschmerzen
- Eine Spinalstenose ist eine häufige Komplikation in Gestalt einer Verengung des Wirbelkanals, was zu Parästhesien und Muskelschwäche führen kann.27
Ergänzende Untersuchungen in der Hausarztpraxis
- Die AP ist in der Regel erhöht und spiegelt sowohl die Ausbreitung als auch die Aktivität der Erkrankung wider. Die Werte können aber auch normal sein.28-29
- Kalzium und Phosphat sind normal. Eine Hyperkalzämie ist selten.2
- Messungen des Serumkalziums und des 25-Hydroxyvitamin-D-Spiegels sind sinnvoll, um einen primären Hyperparathyreoidismus und Vitamin-D-Mangel auszuschließen.30
- Hydroxyprolin ist als Marker der gesteigerten Knochenresorption im Serum und Urin erhöht.
- Die BSG ist häufig erhöht. Eine zunehmende BSG kann auf eine maligne Transformation deuten.
- Der CRP-Wert ist normalerweise auch erhöht.
Weitere Diagnostik
- Der Abschnitt basiert auf dieser Referenz.25
- Bestimmung der Aktivität alkalischer Phosphatase (AP) im Serum
- Diagnose und Verlaufsbeobachtung
- In 85 % der Fälle mit unbehandeltem M. Paget ist die AP erhöht.31
- Zur Verlaufskontrolle unter Therapie (z. B. Bisphosphonate) Bestimmung der AP etwa 3 Monate nach Behandlungsbeginn zur Erfassung des dann erreichten tiefsten Wertes
- Danach sind Intervalle von 6 Monaten ausreichend.
- Jede isolierte Erhöhung der AP sollte nach Ausschluss eines Vitamin-D-Mangels (Serumkalzium, Phosphat, PTH, 25-Hydroxy-Cholecalciferol) oder nach Persistenz trotz Vitamin-D-Behandlung mittels Knochenszintigrafie weiter abgeklärt werden.
- Bei gleichzeitig vorliegenden Lebererkrankungen wird zur Differenzierung zwischen Leber- und Knochen-AP-Erhöhung die Bestimmung der knochenspezifischen Isoform der AP empfohlen.
- Diagnose und Verlaufsbeobachtung
- Röntgen der knöchernen Areale mit Beschwerden
- kein „Ganzkörperröntgen"
- Szintigrafie bei Erstdiagnose zum Aufspüren weiterer Herde
- Auffällige Bereiche (fokale Mehrspeicherung) sollten röntgenologisch als Paget-Befall identifiziert werden.
- CT und/oder MRT
- nur zur Abklärung unklarer Befunde, spinaler oder neurologischer Komplikationen und bei V. a. sarkomatöse Entartung
- Biopsie
- in Zweifelsfällen zur Sicherung der Diagnose
Diagnostik bei Spezialist*innen
Röntgen
- Die Krankheit kann zufällig auf Röntgenbildern festgestellt werden. Die Röntgenbefunde haben ein charakteristisches Aussehen.
- Radiologisch können 3 Phasen unterschieden werden:25
- Frühphase: Osteolysen
- mittlere, häufigste Phasen: Mischbild aus Osteolysen und Sklerose-Zonen
- Spätphase: hauptsächlich Sklerose-Zonen.
- Die langen Röhrenknochen sind ggf. bogenförmig deformiert.32
Szintigrafie
- In der Szintigrafie werden die „warmen“ Areale und damit das Ausmaß der Erkrankung erkennbar.4
- „Reife“ Läsionen können mit der Zeit aber auch wieder „kalt“ geworden sein, weil die pathologische Aktivität aufgehört hat.32
Weitere bildgebende Diagnostik
- Eine Untersuchung mittels CT oder MRT, evtl. auch Biopsie, ist indiziert, wenn der Verdacht auf eine maligne Transformation besteht.2
Knochenbiopsie
- Höchste Sensitivität und Spezifität, aber selten erforderlich
Indikationen zur Überweisung
- Bei Verdacht auf die Erkrankung
Therapie
Therapieziele
- Schmerzen behandeln.
- Den lokal gesteigerten Knochenumbau bremsen, um Komplikationen zu verhindern.
Allgemeines zur Therapie
- Die Therapie ist eine fachärztliche Aufgabe; eine kurative Therapie gibt es nicht.
- Therapieindikationen25
- Schmerzen im Pagetareal oder andere beeinträchtigende Symptome
- Befall von Skelettanteilen, die mechanisch belastet sind und deformiert werden können (z. B. Becken, Femur, Tibia) oder bei Gefahr von funktionellen Störungen an Nerven, ZNS, Gehör, Gelenken.
- Alle anderen Patient*innen benötigen keine medikamentöse Therapie, Verlaufskontrollen werden jedoch empfohlen.
- Ausschlaggebend für die Therapie ist die Wirkung in Hinblick auf die Symptome und etwaige Komplikationen, aber auch die Dauer der Remission sowie das Auftreten von Nebenwirkungen.
- Sofern Bedarf für eine krankheitsmodifizierende Therapie besteht, sind potente Bisphosphonate das Mittel der Wahl.
- Ziel: Senkung der AP in den Normbereich, da AP mit Paget-Aktivität korreliert.
Medikamentöse Therapie
- Bisphosphonate führen zu einer Verringerung der Aktivität in den Läsionen, reduzieren die Schmerzen und erhöhen die Lebensqualität; außerdem normalisieren sie die AP.4
- Bisphosphonate können peroral oder intravenös verabreicht werden.
- Es hat sich gezeigt, dass es keine allgemeine Bisphosphonatresistenz als Klasseneffekt gibt, sondern dass eine Nichtansprechen vielmehr substanzspezifisch zu sein scheint.33
- In Deutschland zugelassene Medikamente zur Behandlung des M. Paget25
- Risedronat: 30 mg/Tag oral, für 2 Monate
- Pamidronat: 30 mg/Woche i. v. über 4 Stunden, für 6 Wochen
- Zoledronsäure: 5 mg Kurzinfusion über 15 Minuten, einmalig
- Ebenfalls zugelassen, jedoch mit schwächerer Wirkung auf die Normalisierung der AP und daher nachrangig zu verwenden:
- Tiludronat: 400 mg/d oral, für 3 Monate
- Etidronat: 400 mg/d oral, für 6 Monate.
- Wenn mit einem der Präparate in einem vertretbaren Zeitraum kein ausreichender Therapieeffekt erreicht wird, ist entweder die Dosis zu erhöhen, sind die Applikationsintervalle zu verkürzen, oder es sollte auf ein anderes Präparat gewechselt werden.
- In einigen Fällen kann auch die Therapie mit Calcitonin erfolgen:
- Calcitonin: 100 E/Tag s. c. für 1 Monat, gefolgt von bis zu 300 E/Woche s. c. für 6 Monate.
Ergänzungen von Kalzium und Vitamin D?
- Patient*innen, die Bisphosphonate einnehmen, benötigen in der Regel Kalzium- und Vitamin-D-Supplemente.
- Studien deuten auf einen möglichen Zusammenhang zwischen Kalziumsupplementen und einem erhöhten Risiko für kardiovaskuläre Komplikationen hin.34
- Vor- und Nachteile solcher Supplementierungen sind gegeneinander abzuwägen.
Weitere Therapien
- Bei Problemen, die im Zusammenhang mit dem Beugen der unteren Extremitäten, mit Gangstörungen oder einer Spinalstenose stehen, kann mithilfe orthopädischer Schuhtechnik, eines Stocks, von Orthesen oder einer Physiotherapie Abhilfe geschaffen werden.
- Sturzprophylaxe
- Das Heben schwerer Lasten unter Beteiligung der Wirbelsäule vermeiden.
- Übergewicht vermeiden, um die Belastung der gewichttragenden Knochen zu reduzieren.
- Hörgeräte sind von einem frühen Zeitpunkt an angebracht.
- Eine Operation ist selten erforderlich und kommt in erster Linie dann zur Anwendung, wenn Komplikationen auftreten.
Verlauf, Komplikationen und Prognose
Verlauf
- Chronische, fortschreitende Erkrankung, deren Progression mittels Bisphosphonat-Therapie signifikant verlangsamt werden kann.
Komplikationen
- Mögliche Komplikationen der Ostitis deformans sind Frakturen, eine Arthrose, Schwerhörigkeit, Spinalstenose, Kompression peripherer Nerven, ein vaskuläres „Steal-Phänomen“, Herzinsuffizienz, Hyperkalzämie, Nephrolithiasis und Hyperurikämie.
- Nervenkompressionssyndrome aufgrund neugebildeter Knochen, die auf Nerven Druck ausüben.
- Pathologische Frakturen sind häufig, heilen aber oft schnell.
- Bei deutlich weniger als 1 % der Patient*innen entwickelt sich ein Paget-Sarkom, ein ausgesprochen maligner Tumor.35-36
- Risikofaktoren für Entartung: ältere Männer, polyostotischer M. Paget35-36
Prognose
- Die Prognose ist gut, und die Krankheit hat keinen Einfluss auf die Lebensdauer.
- Die meisten Betroffenen benötigen keine Therapie.
- Ist eine Therapie erforderlich, kommt es vor allem auf einen frühzeitigen Therapiebeginn an, um Komplikationen zu verhindern.
Verlaufskontrolle
- Die Verlaufskontrolle orientiert sich an der Beobachtung bzw. Reduzierung der Symptome sowie an der regelmäßigen AP-Messung.
Leitlinie: Morbus Paget des Knochens – Verlaufskontrollen25
- Messung der AP-Werte alle 6 Monate
- Bei Anstieg der AP über > 25 % des minimalen AP-Wertes mit Lage oberhalb des Normbereichs wird empfohlen, eine erneute medikamentöse Behandlung durchzuführen.
- Therapieindikationen nach bereits erfolgter erster medikamentöser Therapie
- erneut auftretende Schmerzen in einem Pagetareal
- Radiologische Progredienz, die benachbarte Strukturen bedrohen könnte (z. B. Rückenmark, Nervenaustrittsstellen am Schädel).
- Richtungsweisend für die Sicherung der Diagnose eines M. Paget bei fortbestehenden Beschwerden in dem Bereich ist die Beobachtung, dass sich das Pagetareal niemals über Gelenke hinaus oder über den ursprünglich vom Paget betroffenen Knochen des Skelettsystems hinaus ausbreitet.
- Falls Knochen- oder Gelenkgrenzen nicht respektiert werden, sollte an ein malignes Geschehen gedacht werden.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Das Paget-Syndrom ist eine Knochenerkrankung, bei der es zum fokalen Knochenabbau sowie zur Neubildung von Knochengewebe kommt.
- Die Erkrankung kann frei von Symptomen verlaufen, sodass keine Therapie erforderlich ist.
- Bei Schmerzen oder wenn das Risiko von Komplikationen besteht, wird eine Behandlung mit Bisphosphonaten empfohlen.
Patienteninformationen in Deximed
Illustrationen
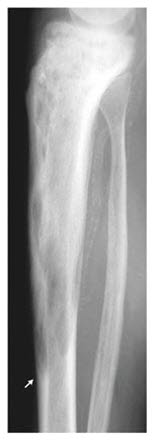
Morbus Paget
Quellen
Literatur
- Paget J. On a form of chronic inflammation of bones (osteitis deformans). Trans Med-Chir Soc 1877; 60: 37-63. www.ncbi.nlm.nih.gov
- Whyte MP. Paget's disease of bone. N Engl J Med 2006; 355: 593-600. PubMed
- Mikosch P, Trifina E, Roschger P, et al. Klinik und Diagnose des Morbus Paget. Journal für Mineralstoffwechsel & Muskuloskelettale Erkrankungen 2012; 19(2): 68-73. www.kup.at
- Bolland MJ, Cundy T. Paget's disease of bone: clinical review and update. J Clin Pathol 2013; 66: 924-7. PubMed
- Van Staa TP, Selby P, Leufkens HG, Lyles K, Sprafka JM, Cooper C. Incidence and natural history of Paget's disease of bone in England and Wales. J Bone Miner Res 2002; 17: 465-71. PubMed
- Barker DJ, Clough PW, Guyer PB, et al.. Paget ́s disease of bone in 14 British towns. Br Med J 1977; 1: 1181-83. www.jstor.org
- Ringe JD, Jend HH, Becker H. Epidemiologie der Ostitis deformans Paget. Münch med Wschr 1984; 126: 683-686.
- Eekhoff EW, Karperien M, Houtsma D, et al. Familial Paget’s disease in The Netherlands: occurrence, identification of new mutations in the sequestosome 1 gene, and their clinical associations. Arthritis Rheum 2004; 50(5): 1650-54. www.ncbi.nlm.nih.gov
- Morales-Piga AA, Rey-Rey JS, Corres-Gonzalez J, et al. Frequency and characteristics of familial aggregation of Paget’s disease of bone. J Bone Miner Res 1995; 10(4): 663-670. www.ncbi.nlm.nih.gov
- Poor G, Donath J, Fornet B, et al. Epidemiology of Paget’s disease in Europe: the prevalence is decreasing. J Bone Miner Res 2006; 21(10): 1545–1549. www.ncbi.nlm.nih.gov
- Nance MA, Nuttall FQ, Econs MJ, et al. Heterogeneity in Paget disease of the bone. Am J Med Genet 2000;92:303-307. PubMed
- Seitz S, Priemel M, Zustin J, et al. Paget’s disease of bone: histologic analysis of 754 patients. J Bone Miner Res 2009; 24(1): 62-69. www.ncbi.nlm.nih.gov
- Whyte MP, Obrecht SE, Finnegan PM, et al. Osteoprotegerin deficiency and juvenile Paget's disease. N Engl J Med 2002; 347: 175-84. New England Journal of Medicine
- Takata S, Yasui N, Nakatsuka K, Ralston SH. Evolution of understanding of genetics of Paget's disease of bone and related diseases. J Bone Miner Metab 2004; 22: 519-23. PubMed
- Cavey JR, Ralston SH, Hocking LJ, et al. Loss of ubiquitin-binding associated with Paget's disease of bone p62 (SQSTM1) mutations. J Bone Miner Res 2005; 20: 619-24. PubMed
- Laurin N, Brown JP, Morissette J, et al. Recurrent mutation of the gene encoding sequestosome 1 (SQSTM1/p62) in Paget disease of bone. Am. J. Hum. Genet 2002; 70(6): 1582–1588. www.ncbi.nlm.nih.gov
- Singer FR, Bone HG, 3rd, Hosking DJ, et al. Paget’s disease of bone: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014; 99(12): 4408–4422. www.ncbi.nlm.nih.gov
- Morissette J, Laurin N, Brown JP. Sequestosome 1: mutation frequencies, haplotypes, and phenotypes in familial Paget’s disease of bone. J Bone Miner Res 2006; 2: 38-44. www.ncbi.nlm.nih.gov
- McManus S, Bisson M, Chamberland R, et al. Autophagy and phospho-inositide dependent kinase 1 (PDK1)-related kinome in Pagetic osteoclasts. J Bone Miner Res 2016; 31(7): 1334–1343. www.ncbi.nlm.nih.gov
- Roodman GD, Windle JJ. Paget disease of bone. J Clin Invest 2005; 115: 200-8. PubMed
- Kanis JA. Pathophysiology and treatment of Paget’s disease of bone. London: Martin Dunitz, 1992.
- van Staa TP, Selby P, Leufkens HG, et al. Incidence and natural history of Paget's disease of bone in England and Wales. J Bone Miner Res 2002;17:465-471. PubMed
- Deftos LJ. Treatment of Paget's disease - taming the wild osteoclast. N Engl J Med 2005; 353: 872-5. PubMed
- Lojo Oliveira L, Torrijos Eslava A. Treatment of Paget’s disease of bone. Reumatol Clin 2012; 8(4): 220-24. www.ncbi.nlm.nih.gov
- Dachverband Osteologie e. V. Leitlinien zur Diagnostik und Behandlung des Morbus Paget des Knochens. www.dv-osteologie.org www.dv-osteologie.org
- Monsell EM. The mechanism of hearing loss in Paget's disease of bone. Laryngoscope 2004; 114: 598-606. PubMed
- Parvizi J, Restrepo C, Sim FH. Paget's disease of the hip: surgical management. Future Rheumatology 2006;1:373-377. PubMed
- Eastell R. Biochemical markers of bone turnover in Paget's disease of bone. Bone 1999; 24:Suppl 5): 49-50. www.ncbi.nlm.nih.gov
- Eekhoff ME, van der Klift M, Kroon HM, et al. Paget's disease of bone in The Netherlands: a population-based radiological and biochemical survey--The Rotterdam Study. J Bone Miner Res 2004;19:566-570. PubMed
- Rosen CJ, Brown S. Severe hypocalcemia after intravenous bisphosphonate therapy in occult vitamin D deficiency. N Engl J Med 2003; 348: 1503-4. New England Journal of Medicine
- Eastell R. Biochemical markers of bone turnover in Paget`s disease of bone. Bone 1999; 24(5): 49-50. www.ncbi.nlm.nih.gov
- Whitehouse RW. Paget's disease of bone. Semin Musculoskelet Radiol 2002;6:313-322 PubMed
- Joshua F, Epstein M, Major G. Bisphosphonate resistance in Paget's disease of bone. Arthritis Rheum 2003; 48(8): 2321-3. www.ncbi.nlm.nih.gov
- Bolland MJ, Avenell A, Baron JA, et al. Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis. BMJ 2010;341:c3691. BMJ (DOI)
- Moore TE, King AR, Kathol MH. Sarcoma in Paget disease of bone: clinical, radiologic, and pathologic features in 22 cases. AJR Am J Roentgenol 1991; 156(6): 1199-203. www.ncbi.nlm.nih.gov
- Deyrup AT, Montag AG, Inwards CY, et al. Sarcomas arising in Paget disease of bone: a clinicopathologic analysis of 70 cases. Arch Pathol Lab Med 2007; 131(6): 942-6. www.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung Orthopädie und Unfallchirurgie, Münster
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).