Zusammenfassung
- Definition:Myokardialer Ischämieschmerz in Ruhe oder bei nur geringer Belastung, jedoch ohne akute Schädigung oder Nekrose von Kardiomyozyten.
- Häufigkeit:Bei unselektierten Patient*innen mit akutem Thoraxschmerz in der Notaufnahme kann eine Prävalenz von 10 % für die instabile Angina erwartet werden. In der Hausarztpraxis liegt die Prävalenz naturgemäß erheblich niedriger.
- Symptome:Retrosternales Druckgefühl, das in Ruhe oder bei geringer Belastung auftritt.
- Befunde:Bei einer Koronarerkrankung ohne Komplikation sind die klinischen Befunde gering ausgeprägt.
- Diagnostik:EKG, Troponin-Bestimmung und abhängig vom Risiko Koronarangiografie oder nichtinvasive Bildgebung.
- Therapie:Sofortige Krankenhauseinweisung. Akuttherapie mittels Blutverdünnung (ASS + Heparin), Nitrat, Betablocker und ggf. Sauerstoffgabe (periphere Sättigung < 90 %) und Morphin.
Allgemeine Informationen
Definition
- Die instabile Angina pectoris bezeichnet eine myokardiale Ischämie in Ruhe oder bei nur geringer Belastung ohne eine akute Schädigung oder Nekrose von Kardiomyozyten.1
- kein Anstieg von Troponin
- Als instabile pektanginöse Beschwerden gelten:2
- Ruheangina (anhaltender Ruheschmerz, oft > 20 min)
- De-novo-Angina oder Recent-onset-Angina im Sinne einer erstmalig auftretenden Angina pectoris in Ruhe oder bei geringer Belastung
- Postinfarktangina in der frühen Postinfarktphase (< 4 Wochen)
- Crescendo-Angina, d. h. bei vorheriger stabiler Angina entwickelt sich eine Zunahme der Anfallshäufigkeit, -dauer oder -intensität oder eine Angina auf zunehmend niedriger Belastungsstufe.
- Das Bild der instabilen Angina pectoris und des Nicht-ST-Hebungs-Infarkt (NSTEMI) wird unter dem Begriff des akuten Koronarsyndroms (ACS) ohne ST-Hebung (NSTE-ACS) zusammengefasst.2
- Das Krankheitsbild ACS umfasst zusätzlich den ST-Hebungs-Infarkt.
Häufigkeit
- Bei 3,7 % der Frauen und 6,0 % der Männer in Deutschland bestand in den letzten 12 Monaten eine koronare Herzkrankheit.3
- definiert als Herzinfarkt, chronische Beschwerden infolge eines Herzinfarktes oder Angina pectoris
- Der Anteil der instabilen Angina pectoris an diesen Fällen wird vom Robert Koch-Institut nicht genauer aufgeschlüsselt.
- Die 12-Monats-Prävalenz einer koronaren Herzkrankheit steigt mit dem Alter überproportional an bis auf rund 16 % bei Frauen und rund 24 % bei Männern ab 75 Jahren.3
- In der Hausarztpraxis ist mit folgender Verteilung von Ursachen des Thoraxschmerzes zu rechnen:4
- Brustwandsyndrom 46 %
- stabile KHK 11 %
- psychogene Ursachen 10 %
- respiratorische Ursachen 10 %
- gastrointestinale Ursachen 6 %
- ACS 3,5 %.
- Bei unselektierten Patient*innen mit akutem Thoraxschmerz in der Notaufnahme kann folgende Krankheitsprävalenz erwartet werden:5
- 5–10 % STEMI
- 15–20 % NSTEMI
- 10 % instabile Angina pectoris
- 15 % andere Herzerkrankungen
- 50 % nicht-kardiale Erkrankungen.
Ätiologie und Pathogenese
- Die pektanginösen Beschwerden entstehen durch einen Ischämieschmerz des Myokards.
- Die Ischämie kann durch verschiedene Faktoren bedingt sein:6
- akute Plaque-Ruptur oder Erosion mit lokaler Thrombozytenaggregation ohne komplette Gefäßokklusion
- Dysbalance von myokardialem Sauerstoffbedarf und -angebot, z. B. bei Koronarspasmus, Anämie oder Brady-/Tachyarrhythmien
Instabile Angina versus Nicht-ST-Hebungsinfarkt
- Instabile Angina und Nicht-ST-Hebungsinfarkt (NSTEMI) unterscheiden sich primär durch den Grad der Myokardschädigung. Beim NSTEMI führt die Minderperfusion zur Myokardschädigung und nachfolgend zum Troponinanstieg, bei der instabilen Angina nicht.1,7
- Eine instabile Angina liegt demnach bei Patient*innen mit ischämischen Symptomen vor, die auf ein akutes Koronarsyndrom hindeuten, bei denen aber keine Anhebung des Troponin-Wertes festzustellen ist. Vorübergehende EKG-Änderungen sind bei der instabilen Angina pectoris durchaus möglich.
- Da ein Anstieg des Troponin-Wertes nicht unmittelbar nach Einsetzen der Beschwerden erfolgt, ist es oft nicht möglich, frühzeitig zwischen instabiler Angina und NSTEMI zu unterscheiden – deshalb ist der Wert der Troponin-Bestimmung in der Hausarztpraxis auch eher relativ zu sehen.
Prädisponierende Faktoren
- Eine Vielzahl von Risikofaktoren ist für die Entwicklung einer KHK und in der Folge instabilen Angina pectoris bekannt, u. a.:
- Diabetes mellitus
- arterielle Hypertonie
- Nikotinabusus
- Hyperlipidämie
- Übergewicht/Adipositas
- körperliche Inaktivität
- Homocystein
- aggressive Stressbewältigung
- positive Familienanamnese
- männliches Geschlecht
- fortgeschrittenes Alter.
- Zur Beurteilung des kardiovaskulären Risikos siehe auch den ARRIBA-Rechner.
- Der Artikel Stabile Angina pectoris enthält weitere ergänzende Informationen.
ICPC-2
- K74 ischämische Herzerkrankung mit Angina (einschließlich instabiler Angina pectoris)
ICD-10
- I20.0 Instabile Angina
Diagnostik
Diagnostische Kriterien
- Typische instabile Angina-pectoris-Beschwerden (siehe Abschnitt Definition)
- Ggf. transiente EKG-Veränderungen
- Kein Troponinanstieg nachweisbar.
- Vorgehen bei Brustschmerzen4
- Ersteinschätzung: Liegt eine vitale Bedrohung vor?
- Beurteilung der Wahrscheinlichkeit einer KHK/eines ACS
- ggf. Abklärung nicht-kardialer Ursachen
DEGAM-Leitlinie: Brustschmerz4
Kriterien für eine lebensbedrohliche oder instabile Situation
- Hinweise für lebensbedrohliche oder instabile Situation?
- In diesem Fall:
- lebensrettende Sofortmaßnahmen und symptomatische Therapie
- Überwachung entsprechend der Möglichkeiten
- Alarmierung des Rettungsdienstes
- stationäre Einweisung
- EKG, weitere diagnostische Schritte nur, falls in der Situation möglich
Kriterien zur Einschätzung der Wahrscheinlichkeit einer KHK
- Marburger Herz-Score
- einfaches, für den hausärztlichen Bereich entwickeltes Instrument zur Wahrscheinlichkeitsabschätzung
- 5 Kriterien (jeweils 1 Punkt bei positivem Kriterium):
- Alter/Geschlecht (Männer ≥ 55 J. und Frauen ≥ 65 J.)
- bekannte vaskuläre Erkrankung
- Beschwerden belastungsabhängig
- Schmerzen durch Palpation nicht reproduzierbar
- Patient*in vermutet Herzkrankheit als Ursache.
- Wahrscheinlichkeit für KHK
- 0–1 Punkte: sehr gering (< 1 %)
- 2 Punkte: gering (4 %)
- 3 Punkte: mittel (17 %)
- 4–5 Punkte: hoch (50 %)
- Zusätzliche klinische Kriterien gemäß der DEGAM-Leitlinie
- Keines der Kriterien besitzt für sich allein eine ausreichende Aussagekraft.
- Herzinsuffizienz (+)
- Diabetes mellitus Typ 1 oder Typ 2 (+)
- Die Patient*innen denken, dass der Schmerz vom Herzen kommt (+).
- Schmerzdauer zwischen 1–60 Minuten (+)
- substernaler Schmerz (+)
- stechender Schmerz (–)
- Husten (–)
- Herzangst (–)
Kriterien zur Einschätzung der Wahrscheinlichkeit eines ACS
- Bei Patient*innen mit mittlerer bis hoher Wahrscheinlichkeit für eine KHK (Marburger Herz-Score > 2 Punkte) sollte bei Brustschmerz die Wahrscheinlichkeit für das Vorliegen eines ACS beurteilt werden.
- Neu aufgetretene Beschwerden in Ruhe (+)
- Beschwerdedauer in Ruhe > 20 min (+)
- Crescendo-Angina (+)
- De-novo-Angina bei leichter Belastung (+)
- Patient*in ist anders als sonst (+).
- Patient*in „gefällt“ Ihnen nicht (+).
- Patient*in ist kaltschweißig (+).
- Patient*in ist blass (+).
- Thoraxschmerz ist nicht der eigentliche Beratungsanlass (–).
DGK-Leitlinie: Diagnostik akutes Koronarsyndrom ohne ST-Hebung5
- Typischer Thoraxschmerz zeichnet sich durch ein retrosternales Druck- oder Schweregefühl („Angina") aus, das in den linken Arm (seltener in beide Arme oder in den rechten Arm), Hals oder Kiefer ausstrahlt, und intermittierend (in der Regel mehrere Minuten anhaltend) oder persistierend sein kann.
- Die körperliche Untersuchung verläuft bei Patient*innen mit vermutetem NSTE-ACS oft unauffällig. Zeichen von Herzinsuffizienz, hämodynamischer oder elektrischer Instabilität erfordern eine rasche Diagnose und Behandlung.
- Empfohlen wird ein EKG innerhalb von 10 Minuten nach dem ersten medizinischen Kontakt. Das EKG kann normal sein; charakteristische Anomalien sind ST-Senkung, transiente ST-Hebung und T-Wellen-Veränderungen. Bei Patient*innen mit entsprechenden Symptomen deutet eine persistierende ST-Hebung auf einen STEMI hin, was nach sofortiger Reperfusion verlangt. Die Ableitung eines normalen EKG sollte aber nicht zu dem Fehler verleiten, deshalb ggf. erforderliche Maßnahmen nicht zu ergreifen.
- Die Bestimmung eines Biomarkers für die Schädigung von Herzmuskelzellen, vorzugsweise des hochsensitiven kardialen Troponins, ist bei allen Patient*innen mit vermutetem NSTE-ACS obligatorisch.
- Anmerkung der Redaktion: Ob das Troponin bereits in der Hausarztpraxis bestimmt werden sollte, hängt wesentlich davon ab, wie weit der Weg zur nächsten interventionellen Klinik ist und wie rasch Rettungsmittel die Patient*innen dorthin transportieren können. Es muss auch berücksichtigt werden, dass ein Troponin-Anstieg mit einer zeitlichen Latenz erfolgt.
Differenzialdiagnosen
- Stabile Angina pectoris
- Herzinfarkt
- Gastroösophagealer Reflux
- Lungenembolie
- Aortendissektion
- Tietze-Syndrom
- Kostochondritis
- Interkostalmyalgie
- Pleuritis
- Perikarditis
- Spontanpneumothorax
- Hyperventilation
Anamnese
- Angina pectoris ist eine klinische Diagnose, die anhand der Schmerzanamnese gestellt wird.
- Weisen Patient*innen alle Leitsymptome auf, dann ist die Wahrscheinlichkeit für eine Angina pectoris sehr hoch:
- retrosternale Schmerzen
- Schmerzen in Verbindung mit Anstrengung
- schnelle Schmerzlinderung bei Ruhe, evtl. nach Einnahme von Nitroglyzerin
- vor allem: hohe Vortest-Wahrscheinlichkeit durch Vorliegen von Risikofaktoren (männliches Geschlecht, Raucher, über 50 Jahre etc.)
- Für die Kriterien einer instabilen Angina pectoris siehe Abschnitt Definition.
Klinische Untersuchung
- Bei einer Koronarerkrankung ohne Komplikationen sind die klinischen Befunde gering ausgeprägt.
- Ödeme oder Kurzatmigkeit können Anzeichen sein für eine Herzinsuffizienz oder ein Cor pulmonale.
- Erhebung der Vitalparameter:
- Blutdruck
- Puls
- Sauerstoffsättigung
- Atemfrequenz.
Ergänzende Untersuchungen in der Hausarztpraxis
- EKG, um später Ausgangsbefund zu haben und den Verlauf beurteilen zu können.
- möglicherweise transiente Ischämiezeichen
- EKG-Manifestationen einer akuten kardialen Ischämie8
- ST-Hebung – neue ST-Hebung am J-Punkt in 2 aufeinanderfolgenden Ableitungen, als signifikant gelten:
- in allen Ableitungen außer Abl. V2–V3: ≥ 0,1 mV
- Abl. V2–V3: ≥ 0,2 mV bei Männern ≥ 40 Jahre
- ≥ 0,25 mV bei Männern < 40 Jahre
- ≥ 0,15 mV bei Frauen.
- ST-Senkungen und Veränderungen der T-Welle
- neue horizontale oder deszendierende ST-Senkung ≥ 0,05 mV in 2 aufeinanderfolgenden Ableitungen und/oder T-Inversion ≥ 0,1 mV in 2 aufeinanderfolgenden Ableitungen mit prominenter R-Zacke oder R/S > 1
- ST-Hebung – neue ST-Hebung am J-Punkt in 2 aufeinanderfolgenden Ableitungen, als signifikant gelten:
- Die Einweisung ins Krankenhaus wird abhängig vom klinischen Eindruck und unabhängig vom Ergebnis des EKG empfohlen.
Diagnostik bei Spezialist*innen
ESC-Leitlinie: ACS ohne persistierende ST-Hebung 1
- Anmerkung der Redaktion: Die aktuelle Leitlinie der European Society of Cardiology von 2020 ist derzeit nur auf Englisch verfügbar. Der entsprechende Abschnitt wurde von der Redaktion ins Deutsche übersetzt.
- Eine invasive Koronarangiografie wird bei Patient*innen mit hoher klinischer Wahrscheinlichkeit für eine instabile Angina pectoris als beste Option angesehen, selbst wenn ein NSTEMI ausgeschlossen wurde.
- Die Koronar-CT-Angiografie („Cardio-CT") hat einen hohen negativ-prädiktiven Wert und ist daher exzellent zum Ausschluss einer KHK bei Patient*innen mit geringer bis moderater klinischer Wahrscheinlichkeit für eine instabile Angina pectoris geeignet.
- Eine Myokard-Perfusions-SPECT, eine Stress-Echokardiografie und ein Kardio-MRT sind weitere diagnostische Optionen, die abhängig vom Risiko in Erwägung gezogen werden können.
- Zudem bietet es nichtinvasiv die Möglichkeit einer Lokalisation ggf. vorhandener Koronarstenosen und damit schon vorab die Wahl der Zuweisung an die Kardiologie oder bei Hauptstammstenose oder Mehrgefäßerkrankung an die Kardiochirurgie.
Ruhe-EKG
- Ein Normalbefund beim EKG schließt eine KHK bzw. instabile Angina nicht aus.
Echokardiografie
- Nachweis von Wandbewegungsstörungen aufgrund von Minderperfusion als indirekter Hinweis möglich
- Stresstest durch körperliche Belastung auf Ergometer oder pharmakologische Steigerung der Herzfrequenz
Koronare Angiografie
- Invasive Untersuchung
- Zeigt den Grad der Koronarstenose und ermöglicht neben der diagnostischen Aussage bei Bedarf auch direkt eine therapeutische Intervention, z. B. die Dilatation und Stent-Implantation
Koronar-CT-Angiografie („Cardio-CT")
- Exakte Darstellung der Koronararterien, bei unauffälligem Befund ist der Ausschluss einer KHK möglich.
- In der Regel native Phase zum Nachweis von Kalk in den Gefäßen und kontrastmittelunterstützte Phase zur Beurteilung möglicher Stenosen
- Während der KM-Phase besteht eine relativ hohe Strahlenbelastung.
- Die Bestimmung der Nierenwerte ist vor der Untersuchung notwendig.
Myokard-Perfusions-SPECT9
- Nichtinvasives semiquantitatives Untersuchungsverfahren der Nuklearmedizin, das, auf der Tracer-Methode basierend, die Durchblutung des Myokards bildlich darstellt.
- Die Myokard-SPECT erfolgt nach i. v. Injektion eines Radiopharmakons, das perfusionsabhängig von den Kardiomyozyten aufgenommen wird.
- Ausdehnung und Schweregrad von szintigrafisch nachweisbaren Perfusionsstörungen sind nicht nur für die Diagnostik und Lokalisation der KHK, sondern auch für die Prognosebeurteilung und Therapieplanung (medikamentöse Therapie vs. Revaskularisation) bedeutsam.
Kardio-MRT
- Gute Darstellung der Ventrikel und ihrer Pumpfunktion möglich
- Durch Stressbelastung mittels Adenosin können minderperfundierte Myokardareale detektiert werden.
- Vorteile sind die fehlende Strahlenbelastung und die gute Darstellbarkeit des Herzens bei eingeschränkter Beurteilbarkeit in der Echokardiografie, z. B. bei vorliegendem Lungenemphysem.
Indikationen zur Klinikeinweisung
- Bei V. a. auf instabile Angina pectoris notfallmäßige Einweisung zum Ausschluss eines NSTEMI
Checkliste zur Einweisung
Angina pectoris, instabile
- Zweck der Überweisung
- Bestätigende Diagnostik? Therapie? Weitere/s?
- Anamnese
- Dauer und Beginn? Progression?
- Schmerz: Lokalisation, Ausstrahlung, Art, schmerzlindernde Maßnahmen? Dauer der Anfälle?
- Auslösende Faktoren: Zusammenhang zu Anstrengung, Mahlzeiten, Bewegung?
- Sonstige Symptome: Übelkeit, Husten, Kurzatmigkeit?
- Andere relevante Krankheiten? Diabetes mellitus? Niereninsuffizienz? Familiäre Disposition? Rauchen?
- Evtl. durchgeführte Behandlungsmaßnahmen und deren Wirkung?
- Regelmäßige und aktuelle Medikation?
- Folgen: beruflich, sozial, körperliche Aktivität, sonstige?
- Klinische Untersuchung
- Allgemeinzustand?
- Blutdruck, Puls, Herz: Herzgeräusche, Rhythmus, Frequenz, Insuffizienz? Lunge: Nebengeräusche, Infektion oder Insuffizienz, Anzeichen einer Obstruktion? Periphere Ödeme?
- Ergänzende Untersuchungen
Therapie
Therapieziele
- Schmerzen lindern.
- Herzinfarkt und Tod verhindern.
- Die Patient*innen identifizieren, die eine Revaskularisation benötigen – und ggf. je nach Ausdehnung und Lokalisation entscheiden, welches Revaskularisationsverfahren eher in Betracht kommt.
Allgemeines zur Therapie
- Die instabile Angina pectoris ist ein Krankheitsbild, das im Krankenhaus behandelt werden sollte.
- Die Akuttherapie kann bereits in der Hausarztpraxis begonnen werden.
- Die Differenzierung zwischen NSTEMI und instabiler Angina pectoris ist ohne vorliegendes Troponin nicht möglich, daher gibt es bei diesen beiden Krankheitsbildern keinen Unterschied in der Akuttherapie.
DEGAM-Leitlinie: Allgemeinmaßnahmen bei V. a. ACS4
- Überwachung entsprechend der Möglichkeiten
- Alarmierung des Rettungsdienstes – stationäre Einweisung
- Lagerung mit 30 Grad angehobenem Oberkörper
- i. v. Zugang
DGK-Leitlinie: Medikamentöse Akuttherapie NSTE-ACS5
- Die frühzeitige Einleitung einer Betablockertherapie wird bei Patient*innen mit bestehenden ischämischen Symptomen und ohne Kontraindikationen empfohlen.
- Anmerkung der Redaktion: z. B. 2,5–5mg Metoprolol i. v., dadurch Verminderung des myokardialen Sauerstoffverbrauchs
- Die initiale Behandlungsmaßnahme sollte bei persistierendem Thoraxschmerz, Hypertonie oder Herzinsuffizienz Nitrate (sublingual oder i. v.) umfassen.
- Sollte den Patient*innen kurz nach Einnahme von Sildenafil oder Vardenafil (< 24 h) oder von Tadalafil (< 48 h) nicht verabreicht werden.
- Anmerkung der Redaktion: z. B. 1–2 Hub Nitro, sofern Patient*in nicht hypoton oder vorherige Einnahme der o. g. PDE5-Inhibitoren
- Alle Patient*innen ohne Kontraindikation sollten ASS mit einer oralen Initialdosis von 150–300 mg (bei nicht mit ASS vorbehandelten Patient*innen) und einer Erhaltungsdosis von 75–100 mg täglich auf Dauer und unabhängig von der ansonsten gewählten Behandlungsstrategie erhalten.
- Der Medikation mit ASS sollte für 12 Monate ein P2Y12-Rezeptorantagonist hinzugefügt werden, wenn keine Kontraindikation, wie z. B. ein stark erhöhtes Blutungsrisiko, vorliegt.
- Empfehlungen der DEGAM10
- Bei notfallmäßiger Einweisung evtl. mit dem Katheterlabor absprechen, ob eine präklinische Gabe eines 2. Thrombozytenaggregationshemmers gewünscht wird; eine solche Gabe ist aber nicht routinemäßig erforderlich.
- Die bevorzugte Substanz ist ggf. Ticagrelor mit Loading Dose 180 mg oral.
- Von Prasugrel rät die DEGAM aufgrund eines ungünstigen Nutzen-Risiko-Verhältnisses ab. Es sollte bei akutem Koronarsyndrom nicht regelhaft eingesetzt werden.10
- Empfehlungen der DEGAM10
- Eine parenterale Antikoagulationstherapie bei Vorliegen Ischämie-bedingter EKG-Veränderungen oder erhöhter Enzymmarker, wird ab dem Zeitpunkt der Diagnose empfohlen.
- Fondaparinux (2,5 mg s. c. tgl.) wird wegen des günstigsten Effektivität-Sicherheit-Profils empfohlen, unabhängig von der Managementstrategie.
- Enoxaparin (1 mg/kg KG s. c. 2 x tgl.) oder unfraktioniertes Heparin (UFH) werden empfohlen, wenn Fondaparinux nicht verfügbar ist.
- UFH 70–100 IE/kg KG i. v. (50–70 IE/kg KG, wenn gleichzeitig mit GPIIb/IIIa-Rezeptorantagonisten) wird bei Patient*innen empfohlen, die einer PCI zugeführt werden und kein Antikoagulans erhalten haben.
- Anmerkung der Redaktion: Bei den meisten Patient*innen mit unklarem Gewicht ist die Gabe von 5.000 IE UFH i. v. passend.
- Sauerstofftherapie sollte bei einer Sauerstoffsättigung des Blutes von < 90 % oder Atemnot zum Einsatz kommen.
- Morphin (i. v. oder s. c.) oder andere Opiate sind Patient*innen mit persistierendem schwerem Thoraxschmerz vorbehalten.
- Anmerkung der Redaktion: z. B. fraktionierte Gabe von 5 mg Morphin i. v.
- bei (opiatbedingter) Übelkeit 10 mg Metoclopramid i. v. oder 62 mg Dimenhydrinat i. v.4
Empfehlungen für Patient*innen
- Die Empfehlungen sind die gleichen wie bei der stabilen Angina pectoris – Reduktion von Risikofaktoren für eine KHK, u. a.:
- Raucherentwöhnung
- körperliche Aktivität
- gesunde Ernährung
- Gewichtsabnahme bei Übergewicht
- Stressreduktion
- optimale Einstellung einer möglichen arteriellen Hypertonie, Dyslipidämie und/oder Diabetes mellitus.
Notfallbehandlung im Krankenhaus
DGK-Leitlinie: NSTE-ACS5
- Eine sofortige invasive Strategie (< 2 h) empfiehlt sich bei Patient*innen mit mindestens 1 der folgenden Hochrisiko-Kriterien:
- hämodynamische Instabilität oder kardiogener Schock
- Wiederkehrender oder bestehender Thoraxschmerz, der nicht auf medikamentöse Behandlung anspricht.
- lebensbedrohliche Arrhythmien oder Herzstillstand
- mechanische Komplikationen eines Myokardinfarkts
- akute Herzinsuffizienz mit refraktärer Angina oder
ST-Strecken-Veränderungen - wiederkehrende dynamische ST- oder T-Wellen-Veränderungen, insbesondere mit intermittierender ST-Hebung.
- Eine frühe invasive Strategie (< 24 h) empfiehlt sich bei Patient*innen mit mindestens 1 der folgenden Hochrisiko-Kriterien:
- Anstieg oder Abfall des kardialen Troponins im Einklang mit Myokardinfarkt
- dynamische ST- oder T-Wellen-Veränderungen (symptomatisch oder stumm)
- GRACE-Score > 140
- Eine invasive Strategie (< 72 h) empfiehlt sich bei Patient*innen mit:
- mindestens 1 der folgenden Kriterien für intermediäres
Risiko:- Diabetes mellitus
- Niereninsuffizienz (eGFR < 60 ml/min/1,73 m2)
- LVEF < 40 % oder Herzinsuffizienz
- frühe Postinfarktangina
- rezente PCI
- stattgehabter Bypass-Operation
- GRACE-Risiko-Score > 109 und < 140
- oder wiederkehrenden Symptomen oder Ischämie bei nichtinvasiven Tests.
- mindestens 1 der folgenden Kriterien für intermediäres
- Bei Patient*innen mit keinem der genannten Risikokriterien und keinen wiederkehrenden Symptomen werden nichtinvasive Untersuchungen auf Ischämie (vorzugsweise mit Bildgebung) empfohlen, bevor die Entscheidung für eine invasive Evaluierung fällt.
- Anmerkung der Redaktion: Siehe Abschnitt Diagnostik bei Spezialist*in für die empfohlene Bildgebung.
GRACE-Risiko-Score
- Der GRACE 2.0 Risiko-Rechner (www.gracescore.org) ermöglicht die Berechnung eines Scores zur direkten Risikoeinschätzung der Sterblichkeit während des stationären Aufenthalts, nach 6 Monaten, 1 und 3 Jahren. Auch das kombinierte Risiko für Tod oder Myokardinfarkt nach 1 Jahr wird ermittelt.5
Weitere Therapien
Perkutane koronare Intervention (PCI) oder Bypass-Chirurgie
- PCI
- Die standardmäßige Erstbehandlung bei Patient*innen mit Gefäßerkrankung in einem oder zwei Gefäßen, häufig ergänzt durch das Einsetzen eines oder mehrerer Stents nach Dilatation einer relevanten Stenose.
- Hochrisikopatient*innen mit instabiler Angina oder Nicht-ST-Hebungsinfarkt profitieren unmittelbar von der Koronarangiografie und der Revaskularisation.11-12
- Bypass-Operation
- Bei Dreigefäßerkrankung, Hauptstamm-Stenosen oder bei Stenosen, die für Stenting technisch nicht geeignet liegen.
- Die Entscheidung bei komplexen Gefäßsituationen liegt beim interdisziplinären Herzteam.
DEGAM-Leitlinie: Neue Thrombozytenaggregationshemmer – Einsatz in der Hausarztpraxis10
Nach akutem Koronarsyndrom
- Unabhängig von Stentimplantation (ja/nein), unabhängig von Art des verwendeten Stents (DES/BMS)
- ASS 100 mg/d dauerhaft
- Ticagrelor 2 x 90 mg/d für 12 Monate
- Wenn Ticagrelor nicht vertragen wird, sollten 12 Monate lang 10 mg, bei über 75 Jahre alten und/oder unter 60 kg wiegenden Patient*innen 5 mg Prasugrel angeboten werden
Triple-Therapie (Phenprocoumon + ASS + Clopidogrel) nach Stentimplantation bei Patient*innen mit akutem Koronarsyndrom und Indikation zur Antikoagulation
- So kurz wie möglich
- INR-Ziel nur 2,0–2,5
- Clopidogrel statt Ticagrelor
- OAK + DES: Triple 6 Monate, dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- Bei deutlich erhöhtem Blutungsrisiko kann die Gabe von ASS auf 4 Wochen und die von Clopidogrel auf 6 Monate beschränkt werden.
Verlauf, Komplikationen und Prognose
Verlauf
- Brustschmerzen, die bei geringer Anstrengung auftreten, sollten als Gefahrensignale verstanden werden und können auf einen ernsten Grad der Stenose in den Koronargefäßen hinweisen.
- Zugleich ist als häufige Differenzialdiagnose die Herzangst/Herzneurose zu berücksichtigen – bei dieser sollte eine apparative Diagnostik so weit wie möglich begrenzt werden.
Komplikationen
- Herzinfarkt
- Herzrhythmusstörungen
- Plötzlicher Herztod
Prognose
- Die Gesamtsterblichkeit von Patient*innen mit instabiler Angina ist relativ gering.13
- 30 Tage und ein Jahr nach dem Ereignis beträgt sie 0,5–0,7 % bzw. 3,3–5,1 % (vs. 3,7–7,4 % bzw. 10,4–22,9 % nach NSTEMI). 13
- Das Risiko für Patient*innen mit instabiler Angina, während des folgenden Jahres einen nichttödlichen Herzinfarkt zu erleiden, liegt bei rund 11 % und unterscheidet sich nicht signifikant vom Risiko der Patient*innen mit NSTEMI.13
Verlaufskontrolle
- Nach Maßgabe der mitbehandelnden kardiologischen Spezialist*innen
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Anzeichen eines Herzinfarkts – wie soll man sich verhalten?
- Berechnung des kardiovaskulären Gesamtrisikos: Siehe ARRIBA-Rechner.
Patienteninformationen in Deximed
- Instabile Angina pectoris
- Koronare Herzkrankheit
- Koronare Herzerkrankungen, Untersuchungen
- Koronare Herzkrankheit, Ernährung und Bewegung
- Warum sollten Sie mit dem Rauchen aufhören, und wie gelingt es?
Diagnostik
Übergewicht und Gewichtsabnahme
Weitere Informationen
- Gesundheitsinformation.de (IQWiG): Medikamente zur langfristigen Behandlung der koronaren Herzkrankheit
- Ärztliches Zentrum für Qualität in der Medizin (ÄZQ): KHK ‒ wenn sich die Herzgefäße verengen
Illustrationen
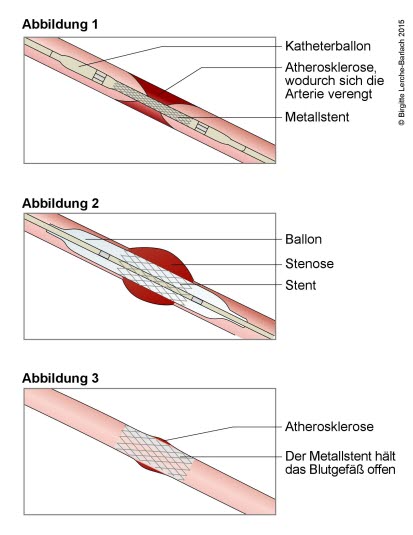
Stentbehandlung eines engen Blutgefäßes
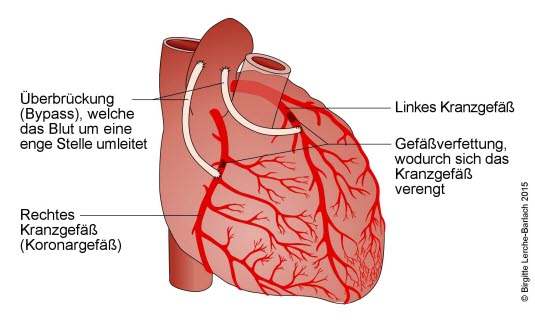
Bypass
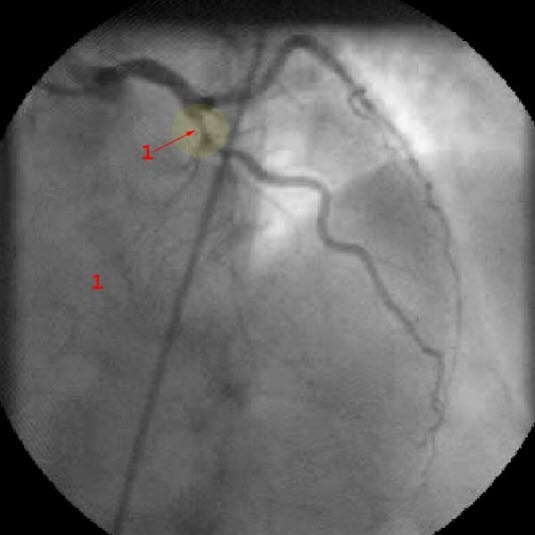
Koronarangiografie: ausgeprägte RIVA-Stenose (1)
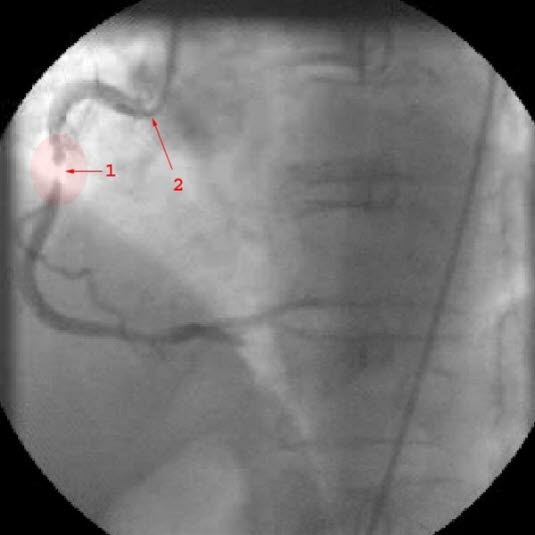
Koronarangiografie: Darstellung einer hochgradige Stenosen (1) in der rechten Koronararterie (2 = Katheter).
Quellen
Leitlinien
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische KHK – Langfassung, 5. Aufl. 2019. www.leitlinien.de
- European Society of Cardiology. Acute Myocardial Infarction in patients presenting with ST-segment elevation, Management of, Stand 2017. www.escardio.org
- European Society of Cardiology. Acute Coronary Syndromes (ACS) in patients presenting without persistent ST-segment elevation, Management of, Stand 2020. www.escardio.org
- Deutsche Gesellschaft für Kardiologie. ESC Pocket Guidelines. Akutes Koronarsyndrom ohne ST-Hebung. Version 2015. www.leitlinien.org
- Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Myokard-Perfusions-SPECT. AWMF-Nr. 031-006. S1, Stand 2017. www.awmf.org
- DEGAM-Leitlinie 053-023. Brustschmerz. Stand 2011. www.degam.de
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e. V. (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. AWMF-Leitlinie Nr. 053-041. S2e, Stand 2019. Aktualisierung Januar 2020. www.awmf.org
Literatur
- European Society of Cardiology. Acute Coronary Syndromes (ACS) in patients presenting without persistent ST-segment elevation, Management of, Stand 2020. www.escardio.org
- Rupprecht HJ, Geeren M, Geeren M et al. Akutes Koronarsyndrom ohne ST-Hebung (NSTE-ACS). Herz 2019; 44: 10-15. link.springer.com
- Busch MA, Kuhnert R. 12-Monats-Prävalenz einer koronaren Herzkrankheit in Deutschland. Journal of Health Monitoring 2017; 2(1): 64-69. www.rki.de
- DEGAM-Leitlinie 053-023. Brustschmerz. Stand 2011. www.degam.de
- Deutsche Gesellschaft für Kardiologie. ESC Pocket Guidelines. Akutes Koronarsyndrom ohne ST-Hebung. Version 2015. leitlinien.dgk.org
- Liebetrau C, Hamm CW. Management des akuten Koronarsyndroms ohne ST-Strecken-Hebung. Herz 2017; 42: 211-28. link.springer.com
- European Society of Cardiology. Acute Myocardial Infarction in patients presenting with ST-segment elevation, Management of, Stand 2017. www.escardio.org
- Thygesen K, Alpert J, Jaffe A, et al. Fourth universal definition of myocardial infarction . Eur Heart J 2018; 40: 237-69. academic.oup.com
- Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Myokard-Perfusions-SPECT. AWMF-Nr. 031-006. Stand 2017. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin e.V. (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. AWMF-Leitlinie Nr. 053-041. Stand 2019. Aktualisierung Januar 2020. www.awmf.org
- O'Donoghue M, Boden WE, Braunwald E, et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction. A meta-analysis. JAMA 2008; 300: 71-80. pubmed.ncbi.nlm.nih.gov
- Mehta SR, Cannon CP, Fox KA, et al. Routine vs selective invasive strategies in patients with acute coronary syndrome. A collaborative meta-analysis of randomized trials. JAMA 2005; 293: 2908-17. pubmed.ncbi.nlm.nih.gov
- Bublak R. Instabile Angina ist seltener als NSTEMI. Notfall 2019; 16: 41. link.springer.com
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Günther Egidi, Dr. med., Arzt für Allgemeinmedizin, Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).