Allgemeine Informationen
- Die Dermatoskopie ist ein diagnostisches Hilfsmittel bei pigmentierten und unpigmentierten Hautläsionen, vor allem bei V. a. malignes Melanom.1-2
- Sie soll in Zusammenschau mit klinischen Informationen und einer Inspektion mit bloßem Auge beurteilt werden.1-2
- Sie ermöglicht es, tiefer liegende Hautstrukturen erkennen, die mit bloßem Auge nicht sichtbar sind.3
- Sie setzt Kenntnisse über die verschiedenen erkennbaren Strukturen sowie die Merkmale der jeweiligen Hautläsionen voraus.
- Ohne ausreichende Schulung/Erfahrung durchgeführt, kann sie die Genauigkeit der Untersuchung sogar verschlechtern.4
- Der visuelle Verdacht auf ein malignes Melanom kann derzeit nur durch eine Exzision und histopathologische Untersuchung bestätigt werden.
- Ziel ist es, ein malignes Melanom zu einem frühen Zeitpunkt zu erkennen, die Zahl unnötiger chirurgischer Exzisionen zu verringern und den Anteil der malignen Läsionen in den Überweisungen an Spezialist*innen zu erhöhen.1-3,5
Funktionsweise
- Das Dermatoskop (Auflichtmikroskop) ist ein Handmikroskop, das aus einer Lichtquelle und einem Vergrößerungsglas besteht, das in der Regel eine bis zu 10-fache Vergrößerung zulässt.
- Die Lichtquelle besteht aus polarisiertem oder unpolarisiertem Licht, ggf. auch aus beidem.
- Indem die Lichtreflexion an der Hautoberfläche reduziert wird, können Strukturen direkt unter der Hautoberfläche sichtbar gemacht werden.
- Polarisiertes und unpolarisiertes Licht liefern jeweils leicht unterschiedliche Bilder und Informationen, sodass manche Dermatoskope beide Lichtformen haben, um sich ergänzende Informationen zu liefern.6
Unpolarisiertes oder polarisiertes Licht
- Dermatoskope mit unpolarisiertem Licht
- Aufsetzen auf der Haut mit einer Immersionsflüssigkeit (Öl, Gel)
- Stabile Fixierung auf der Haut, wenn eine Kamera zur Dokumentation eingesetzt wird.
- Dermatoskope mit polarisiertem Licht
- Hautkontakt und Immersionsflüssigkeit sind nicht nötig.
- bessere Hygiene
- Ohne Immersionsflüssigkeit lassen sich multiple Läsionen schneller untersuchen.6
Indikationen
Hautkrebs-Früherkennung
- In Deutschland haben Versicherte in der vertragsärztlichen Versorgung ab dem 35. Lebensjahr alle 2 Jahre Anspruch auf eine Früherkennungsmaßnahme zur Erkennung von Malignomen der Haut, die durch Dermatolog*innen und Hausärzt*innen nach Teilnahme an einer zertifizierten Fortbildung durchgeführt werden kann.7
- Bei Risikopersonen sollte die Frequenz der Inspektionen individuell festgelegt und die Patient*innen in der Selbstuntersuchung geschult werden.5
- Zur Früherkennung gehören:
- Aufklärung über Ablauf, Vor- und Nachteile des Screenings
- Anamnese
- visuelle Inspektion des gesamten Integuments einschließlich des behaarten Kopfes und aller Hautfalten
- bei auffälligen Befunden Überweisung an eine dermatologische Praxis zur erneuten fachärztlichen Ganzkörperinspektion und Beurteilung bzw. ggf. Exzision der Läsion zur histopathologischen Untersuchung
- Aufklärung der Patient*innen über das Ergebnis des Screenings
- Beratung bezüglich des Risikoprofils der Patient*innen und Präventionsmaßnahmen
- Dokumentation.5,7-8
- Die Inspektion kann mit bloßem Auge durchgeführt werden. Das Dermatoskop kann bei entsprechender Ausbildung zur genaueren Untersuchung auffälliger Läsionen verwendet werden.5,7-8
- Dermatolog*innen wird empfohlen, die Dermatoskopie zur Diagnostik von Hautveränderungen anzubieten und sich entsprechend fortzubilden.8
- Das Screening erhöht die Erkennungsrate von Hautkrebs und könnte dadurch Einfluss auf Morbidität und Mortalität haben.5
- Nachteile für die Patient*innen können durch unnötige Exzisionen gutartiger Hautläsionen, Überdiagnose, Übertherapie sowie dadurch entstehende psychologische Belastungen oder übersehene auffällige Befunde entstehen.5
- Während die federführenden Fachgesellschaften in der S3-Leitlinie zur Prävention von Hautkrebs von 2021 ein Hautkrebsscreening in der allgemeinen erwachsenen Bevölkerung empfehlen, sieht die Deutsche Gesellschaft für Allgemeinmedizin (DEGAM) in einem Sondervotum keine ausreichende Evidenz für deren Nutzen und empfiehlt eine Durchführung nur nach ausgewogener Aufklärung über Nutzen und Risiko bei Personen mit erhöhtem Risiko.5
- Auch ein Cochrane-Review von 2019 und eine Übersichtsarbeit des US Preventive Services Task Force 2016 sehen keine ausreichenden Evidenzgrundlage, um ein Hautkrebsscreening in der allgemeinen Bevölkerung zu empfehlen. Die Empfehlungen dieser Arbeiten beziehen sich ausdrücklich nicht auf Patient*innen aus Gruppen mit erhöhtem Risiko für Hautkrebs.9-10
Leitlinie: Prävention von Hautkrebs (Kurzversion)5
Empfehlungen zum Hautkrebsscreening
- Im Rahmen der Prävention von Hautkrebs sollte ein Hautkrebsscreening angeboten werden.
- Die Deutsche Gesellschaft für Allgemein- und Familienmedizin (DEGAM) bewertet die Evidenz für den Nutzen eines generellen Hautkrebsscreenings als unzureichend.
- Daher soll kein anlassloses Hautkrebs-Screening angeboten werden.
- Im Einzelfall kann eine Früherkennung auf Hautkrebs nach ausgewogener Aufklärung über Vor- und Nachteile durchgeführt werden, insbesondere bei Menschen mit erhöhtem Risiko.
- Zum Hautkrebs-Screening soll eine standardisierte Ganzkörperinspektion der Haut von Ärzt*innen durchgeführt werden, die an einer speziellen, in der Krebsfrüherkennungsrichtlinie definierten Fortbildung zur Früherkennung von Hautkrebs teilgenommen haben.
- Bei der Ganzkörperinspektion soll der Untersuchungsraum ausreichend hell sein und die Untersucher*innen so nah an die Patient*innen herantreten, dass sie mit dem bloßen Auge auch kleine Hautveränderungen erkennen können.
- Die zu screenende Person soll zu Beginn des Screenings/der Verdachtsdiagnostik nach Veränderungen an ihrer Haut befragt werden.
- Im Rahmen eines Hautkrebsscreenings sollte der Vorstellungszeitraum zur weiteren Befundsicherung nach Verdacht auf ein malignes Melanom, Basalzellkarzinom oder Plattenepithelkarzinom 10 Tage nicht überschreiten.
- Die Hautselbstuntersuchung soll empfohlen werden.
- Risikopersonen sollen so geschult werden, dass diese eine Selbstuntersuchung der Haut durchführen können, um auffällige Hautläsionen zu identifizieren.
- Dermatolog*innen sollen zur Verdachtsdiagnostik pigmentierter und nicht-pigmentierter Haut- und Nagelveränderungen die Dermatoskopie anbieten.
- Die histopathologische Untersuchung einer geeigneten Gewebeprobe ist die Standardmethode der Bestätigungsdiagnostik.
- Zur Bestätigung einer verdächtigen Läsion soll die histopathologische Diagnostik angewandt werden.
Weitere Indikationen
- Eine Inspektion des Integuments, ggf. ergänzt durch eine Dermatoskopie, ist empfehlenswert, wenn
- sich Patient*innen mit einem Nävus vorstellen, der ihnen Sorgen bereitet.
- Ärzt*innen eine verdächtige Hautläsion bemerken.
- bei der jeweiligen Person ein erhöhtes Melanom-Risiko besteht:
- früheres Melanom
- Melanom-Fälle in der Familie
- Männer über 50 Jahre europäischer Abstammung
- Sonnenexposition (insbesondere intermittierende Exposition) und Sonnenbrände
- viele Nävi, große Nävi oder mehrere atypische Nävi
- Hauttyp, insbesondere Hauttyp 1.5,11-12
- bei der Person ein erhöhtes Risiko für nicht-melanozytären Hautkrebs besteht:
- heller Hauttyp
- Sonnenexposition (bei Plattenepithelkarzinomen kumulative Dosis, bei Basalzellkarzinomen intermittierende Exposition und Sonnenbrände)
- aktinische Keratose
- Immunsuppression
- Bestrahlung
- HPV
- berufliche Exposition mit Arsen oder Teer
- vorheriger nicht-melanozytärer Hautkrebs.5
- Neben malignen und prämalignen Läsionen kann die Dermatoskopie auch bei der Erkennung gutartiger Läsionen wie seborrhoischer Keratose, Angiomen, Dermatofibromen, blauen Nävi, Skabies, Läusen oder Fremdkörpern hilfreich sein.
- Die Dermatoskopie ist kein Ersatz für eine gezielte Untersuchung samt Anamneseerhebung und Inspektion, kann jedoch Zusatzinformationen liefern.
Testeigenschaften
- Die Dermatoskopie kann sowohl bei der Erkennung melanozytärer als auch nicht-melanozytärer Hautkrebsarten eine hilfreiche Ergänzung zur Inspektion mit bloßem Auge sein.1-2
- Bei der Diagnose des malignen Melanoms mit bloßem Auge liegt die diagnostische Treffsicherheit bei ca. 70 % und kann mithilfe der Dermatoskopie auf fast 90 % steigen.13
- Durch die Dermatoskopie kann so die Anzahl diagnostischer Exzisionen reduziert werden.3
- Allerdings basiert der aussagekräftige Einsatz der Dermatoskopie vor allem auf umfangreicher Erfahrung.1
- Hausärzt*innen untersuchen in ihrer Praxis in der Regel keine ausreichende Zahl an Patient*innen mit malignen Hautveränderungen, um denselben Nutzen aus einer Dermatoskopie ziehen zu können wie Dermatolog*innen.
- Ohne Vorkenntnisse oder entsprechende Schulung kann die Dermatoskopie die diagnostische Sensitivität verringern.4
- Mehreren Studien zufolge kann die diagnostische Treffsicherheit im Hinblick auf das maligne Melanom erhöht werden, wenn die Untersuchenden eine kurze Schulung in der Anwendung der Dermatoskopie absolvieren.3
- Auch im hausärztlichen Bereich belegten mehrere Studien, dass bei entsprechender Erfahrung bzw. nach einer Schulung die Dermatoskopie der Sensitivität für die Erkennung maligner Hautläsionen steigert.14-16
-
- Die Aufgabe der Hausärzt*innen liegt hier vor allem bei der Erkennung suspekter Läsionen zur Weiterleitung an die Dermatologie.1
- Da die Dermatoskopie auf der Erkennung typischer Merkmale maligner Hautläsionen beruht, ist die Sensitivität bei uncharakteristischen Läsionen wesentlich geringer. Dies macht z. B. etwa 5–10 % der Melanome aus.3
- Die Rolle computerassistierter Systeme zur Erkennung von Hautkrebs ist derzeit noch unklar.17
Die Untersuchung
Farben
- Durch das Dermatoskop lassen sich verschiedene Farben in der Haut erkennen.
- Die Farben entsprechen verschiedenen Hautstrukturen, wobei die Strukturen in den verschiedenen Hautschichten unterschiedliche Farben aufweisen können.
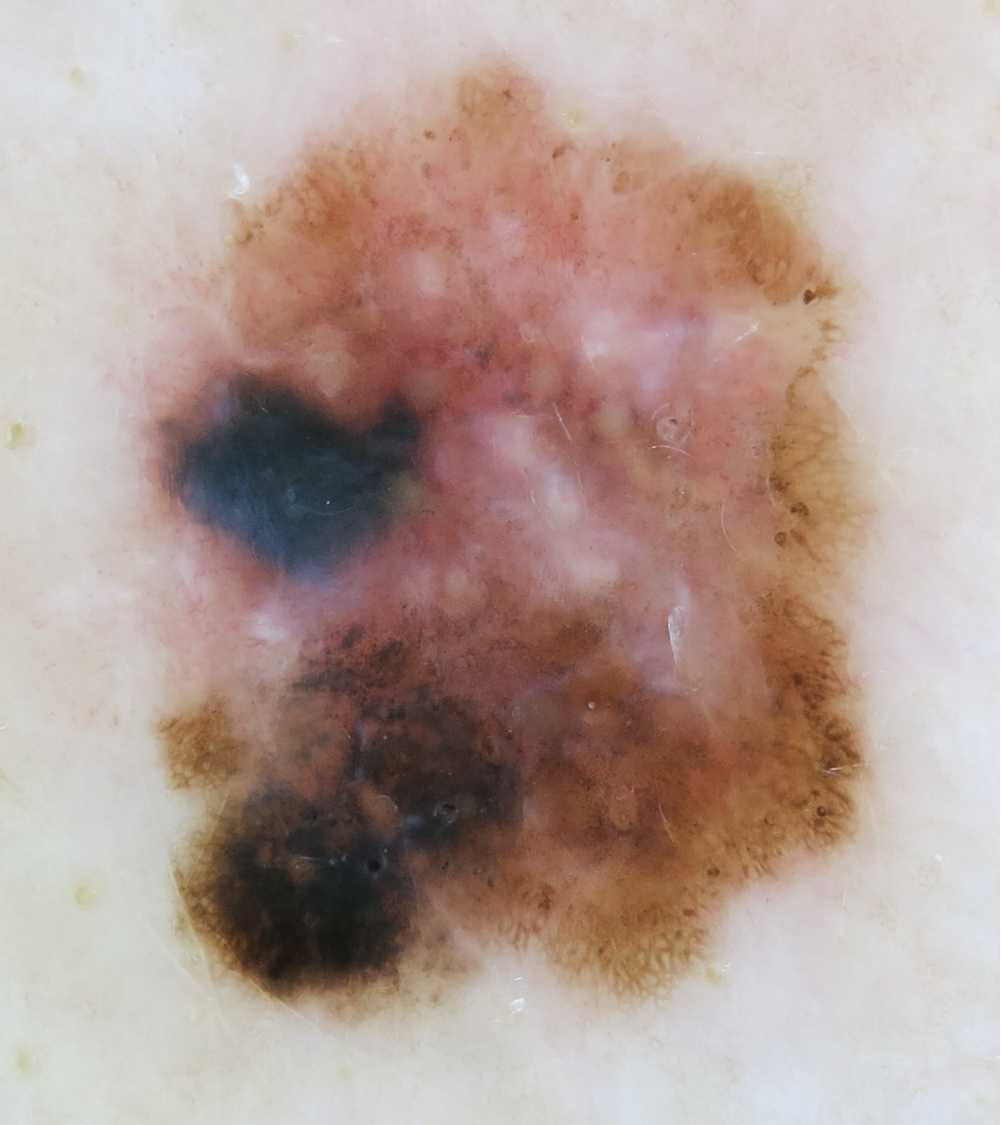
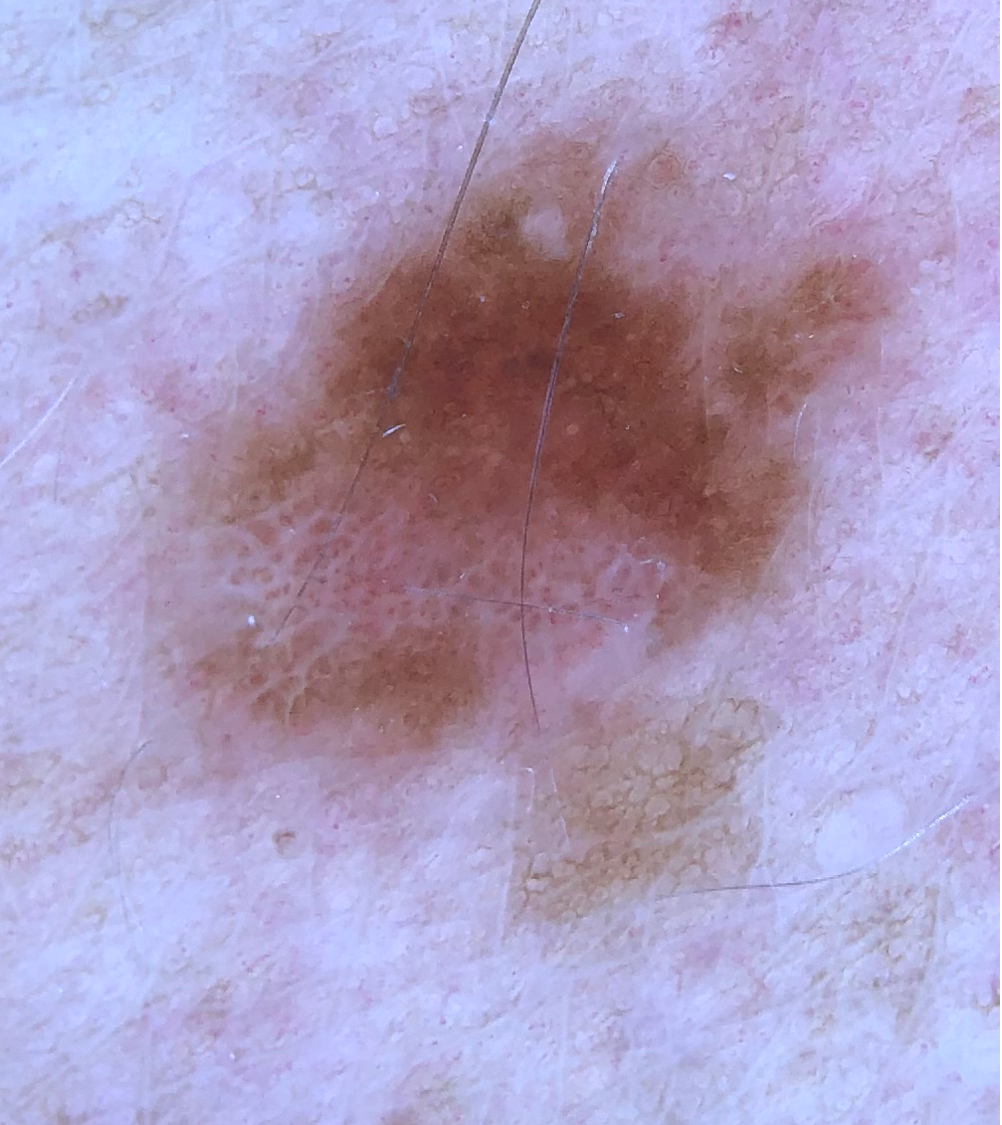
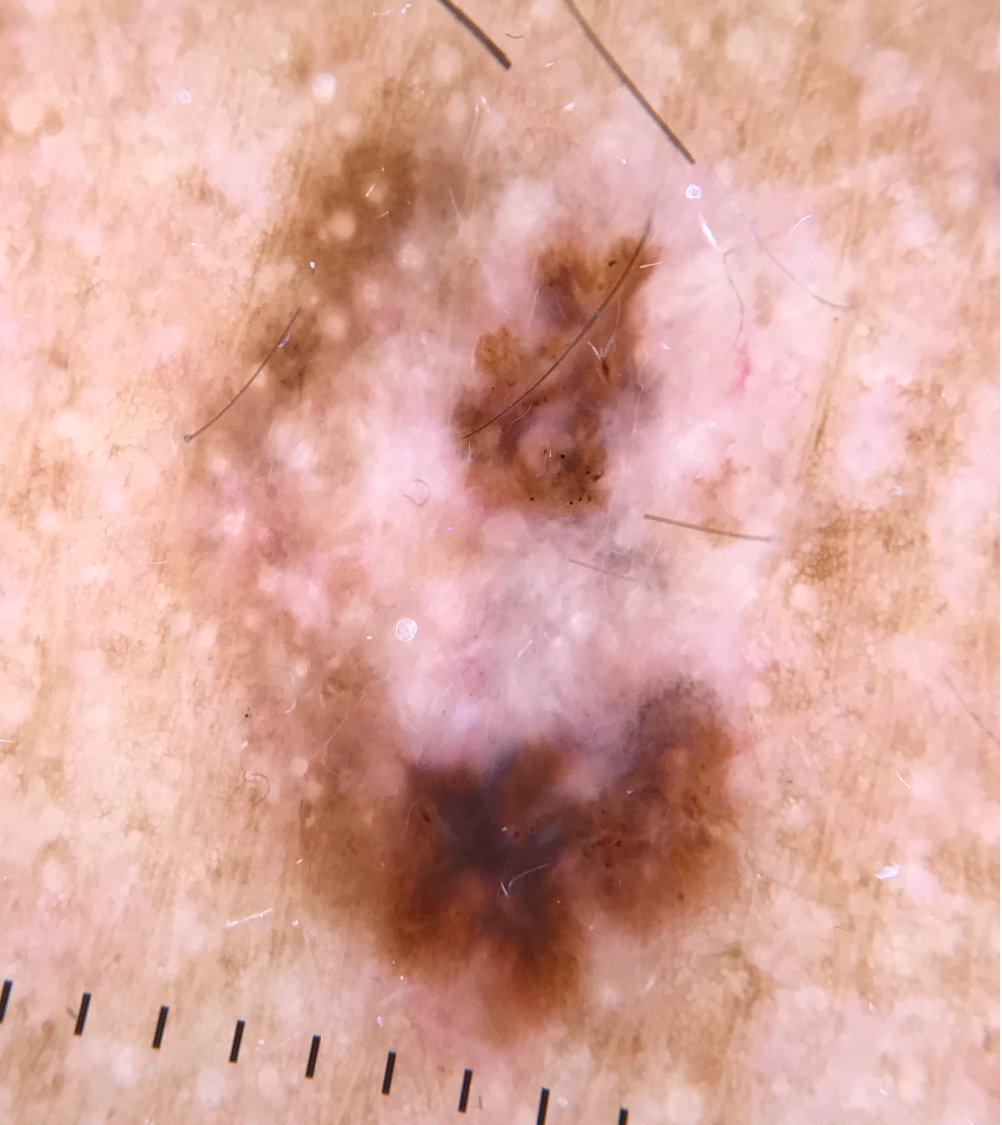
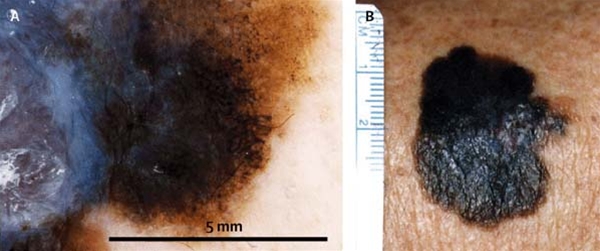
- Melanin kann je nachdem, ob es oberflächlich in der Epidermis, tief in der Epidermis oder in der Dermis vorliegt, schwarz, braun oder blau erscheinen.3,18-19
|
Struktur |
Hautschicht |
|
|
Schwarz |
Melanin |
Hornschicht oder oberflächlich in der Epidermis |
|
Braun |
Melanin |
tiefe Epidermis |
|
Grau |
Melanin |
oberflächliche Dermis |
|
Blau |
Melanin |
tiefe Dermis |
|
Weiß |
Kollagen |
Dermis |
|
Gelb |
Keratin |
oberflächliche Epidermis |
|
Rot |
Blut |
Dermis |
Strukturen und Muster pigmentierter Läsionen
- Der gesamte Abschnitt basiert auf diesen Referenzen.3,18-19
- Die verschiedenen Strukturen und Muster spiegeln die Verteilung von Pigment, Keratin, Kollagen und Gefäßen wider (siehe Illustrationen unten).
|
Struktur |
Beschreibung |
Malignes Melanom |
|
Globuli |
Symmetrische runde oder ovale Strukturen mit einer Größe von mehr als 0,1 mm; können verschiedene Farben aufweisen; liegen in Nestern gesammelt, verstreut, am Rand der Läsion oder gleichmäßig verteilt vor. Bei gutartigen Nävi im Zentrum der Läsion gelegen und regelmäßig in Größe und Form |
beim Melanom braun und/oder schwarz bei bösartigen Nävi periphere Lage und unregelmäßige Form, Größe und Farbe |
|
Punkte |
kleine, runde, schwarze, braune, oder blaugraue Strukturen mit einer Größe von unter 0,1 mm Schwarze Punkte können auch in gutartigen Nävi auftreten und befinden sich dann häufig im Zentrum der Läsion. |
bei bösartigen Nävi periphere Lage und unregelmäßige Form, Größe und Farbe |
|
Flecke |
schwarze oder dunkelbraune homogene Strukturen aus konzentriertem Pigment |
asymmetrisch, peripher lokalisiert, inhomogene Färbung |
|
Streifen |
radiär vom Tumor ausgehende Streifen vom Tumor; beim Spitz-Nävus in der gesamten Läsion gleichmäßig und symmetrisch |
beim Melanom unregelmäßig und peripher gelegen |
|
Pseudopodien |
fingerartige, dunkel pigmentierte Strukturen am Rand der Läsion |
beim Melanom unregelmäßig, symmetrisch oder lokalisiert |
|
Blau-weißlicher Schleier |
blaue konfluierende Pigmente mit darüberliegenden milchglasartigen Schleiern beim blauen Nävus homogenes blaues Pigment in der gesamten Läsion |
Fokales blaues Pigment verschiedener Farbtöne ist ein Zeichen für Malignität. |
| Gefäße
|
polymorph, unregelmäßig und schlangenartig oder gepunktet mit milchigem Hintergrund |
|
| Kristalline Strukturen |
parallel angeordnete weiße Linien |
|
Beschreibung |
Malignes Melanom |
|
|
Pigmentnetz |
gitterartiges Netzwerk aus pigmentierten Linien Ein typisches Netzwerk ist regelmäßig, bedeckt nahezu die gesamte Läsion und dünnt zum Rand hin aus. |
Atypische Netze sind unregelmäßig, weisen verbreiterte Gitterlinien auf und sind deutlich/scharf von der gesunden Haut abgegrenzt. |
|
Pseudo-Netzmuster |
diffuse Pigmentierung mit hellen Arealen dazwischen, meist in der Gesichtshaut |
|
|
Negatives Netzmuster |
|
schlangenartige, hypopigmentierte Linien zwischen unregelmäßig geformten pigmentierten Strukturen |
|
Regressions-strukturen |
|
narbenartige Depigmentierungen, heller bis blau-weißlich, schleierartig |
|
Strukturlose Areale |
Bereiche ohne Netz und Struktur, meist heller als übrige Läsion |
in der Peripherie der Läsion, mehr als 10 % der Gesamtgröße |
Merkmale des malignen Melanoms
- Siehe Artikel Malignes Melanom.
- Allgemeines Erscheinungsbild
- Dermatoskopie
- Das Risiko für ein Melanom ist laut einer Metaanalyse am größten bei:21
- glänzenden weißen Strukturen (OR 6,7)
- atypischen Pseudopodien (OR 6,7)
- unregelmäßiger Pigmentierung (OR 6,4)
- atypischen blau-weißen Strukturen/blau-weißlichem Schleier (OR 6,3)
- grau-blauen Flecken (OR 6,3).
- Andere Kennzeichen können sein:
- Das Risiko für ein Melanom ist laut einer Metaanalyse am größten bei:21
Algorithmen für die Differenzierung pigmentierter Läsionen
- Es wurden mehrere Algorithmen für die Dermatoskopie entwickelt, die primär der Differenzierung benigner und maligner pigmentierter Hautläsionen dienen.
- Die Algorithmen existieren teilweise in verschiedenen Varianten.
- Sie sind als Ergänzung zur allgemeinen klinischen Einschätzung gedacht. Im Allgemeinen erhöhen die Algorithmen die diagnostische Genauigkeit, allerdings variieren Sensitivität und Spezifizität in verschiedenen Studien.
- Bei der dermatoskopischen Beurteilung verdächtiger pigmentierter Läsionen scheint sich mit einer Musteranalyse eine höhere diagnostische Treffsicherheit erzielen zu lassen als mit anderen Algorithmen.3,22-23
Klinische ABCD(E)-Regel23
- Diese weit verbreitete Regel dient der Einschätzung der Malignität pigmentierter Hautläsionen mit dem bloßen Auge:
- A = Asymmetrie von Begrenzung und Struktur
- B = unregelmäßige Begrenzung
- C = unregelmäßiges, oft dunkles Kolorit
- D = Durchmesser (meist > oder = 6 mm)
- E = Evolution über die Zeit (dieses Kriterium wird nicht immer beschrieben).
ABCD-Regel der Dermatoskopie3,23
- In der klassischen ABCD-Regel der Dermatoskopie steht „D“ nicht für Durchmesser, sondern für dermatoskopisch malignitätssuspekte Strukturen.
- Die Evaluierung erfolgt mit einem Punktesystem für jeden Aspekt:
- A = Asymmetrie von Begrenzung und Struktur
- B = unregelmäßige, oft scharfe Begrenzung (gegenüber einer in der Peripherie langsam abnehmenden Pigmentdichte)
- C = Colorit
- D = malignitätssuspekte dermatoskopische Strukturen.
3-Punkte-Checkliste18
- Sehr einfacher, aber sensitiver Algorithmus mit nur 3 Kriterien:
- Asymmetrie von Muster und Farbe (nicht der Begrenzung)
- irreguläres Pigmentnetzwerk
- blau-weiße Schleier, weiße narbige Depigmentierungen oder blaue Granulierungen.
- Beim Vorhandensein von 2 Kriterien wird eine weitere Evaluation bzw. Exzision empfohlen.
- Aufgrund seiner Einfachheit gut für die Hausarztpraxis geeignet
Musteranalyse3,18,23
- Qualitative Analyse von Mustern und Strukturen auf typische benigne bzw. typisch maligne Charakteristika.
- Kriterien
- allgemeine Erscheinung
- Pigmentierung und Muster der Pigmentierung
- Farbe
- irreguläres Pigmentnetzwerk
- irreguläre braune Globuli
- irreguläre schwarze Punkte
- irreguläre Depigmentierungen
- irreguläre, scharfe Begrenzung
7-Punkte-Checkliste3
- Untersuchung ähnlich der Musteranalyse mit weniger Kriterien
- Hauptkriterien (je 2 Punkte):
- atypisches Netz
- blau-weißlicher Schleier
- atypisches Gefäßmuster.
- Nebenkriterien (je 1 Punkt):
- unregelmäßige Streifen
- unregelmäßige Punkte/Globuli
- unregelmäßige Pigmentierung
- Regressionsstrukturen.
- 3 oder mehr Punkte sprechen für ein Melanom.
Methode nach Menzies3
- Vereinfachte Methode mit weniger Kriterien:
- Asymmetrie des Musters
- Kolorit (definiert als mehr als eine Farbe)
- Erkennung von 1 von 9 Positivmerkmalen für maligne Melanome.
CASH Algorithm3
- Ähnelt der ABCD-Regel
- Punktesystem mit Punkten für jedes Kriterium
- Kriterien:
- Kolorit
- Regelmäßigkeit der Architektur
- Symmetrie
- Homogenität.
„Chaos and Clues“24
- Definiert 5 Elemente: Streifen, Pseudopodien (fingerartige Streifen, die vom Tumor in Richtung der gesunden Haut verlaufen), Ringe, Flecken/Schollen (scharf begrenzte Strukturen beliebiger Form) und Punkte/Dots
- Darüber hinaus werden 5 Untergruppen von Streifen unterschieden: retikuläre, verzweigte, parallele, radiäre/ausstrahlende und gebogene.
- Liegt mindestens eine dieser Strukturen asymmetrisch verteilt vor, sollten weitere diagnostische Schritte unternommen werden.
Links
- www.dermnetnz.org: DermNet New Zealand, von der Dermatologin Amanda Oakley in Zusammenarbeit mit der University of Auckland
- www.dermoscopyatlas.com: Informationsblog und Atlas vom Australian Institute of Dermatology und dem Skin Cancer College of Australia and New Zealand
- www.pcds.org.uk: Primary Care Dermatology Society, Großbritannien
- www.dermoscopedia.org: Informationsangebot zur Dermatoskopie in Zusammenarbeit mit der International Dermoscopy Society (IDS).
- www.enzyklopaedie-dermatologie.de: Altmeyers Enzyklopädie
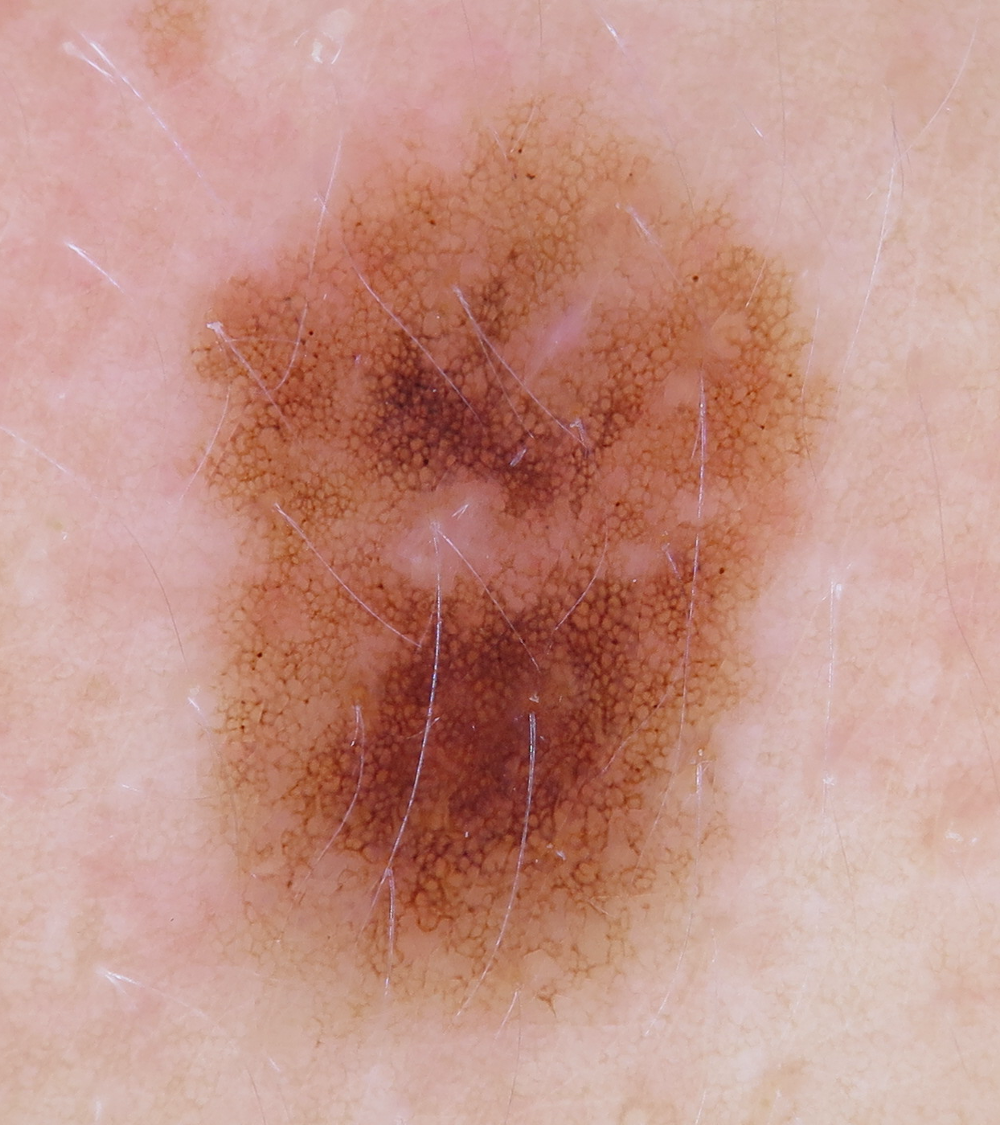
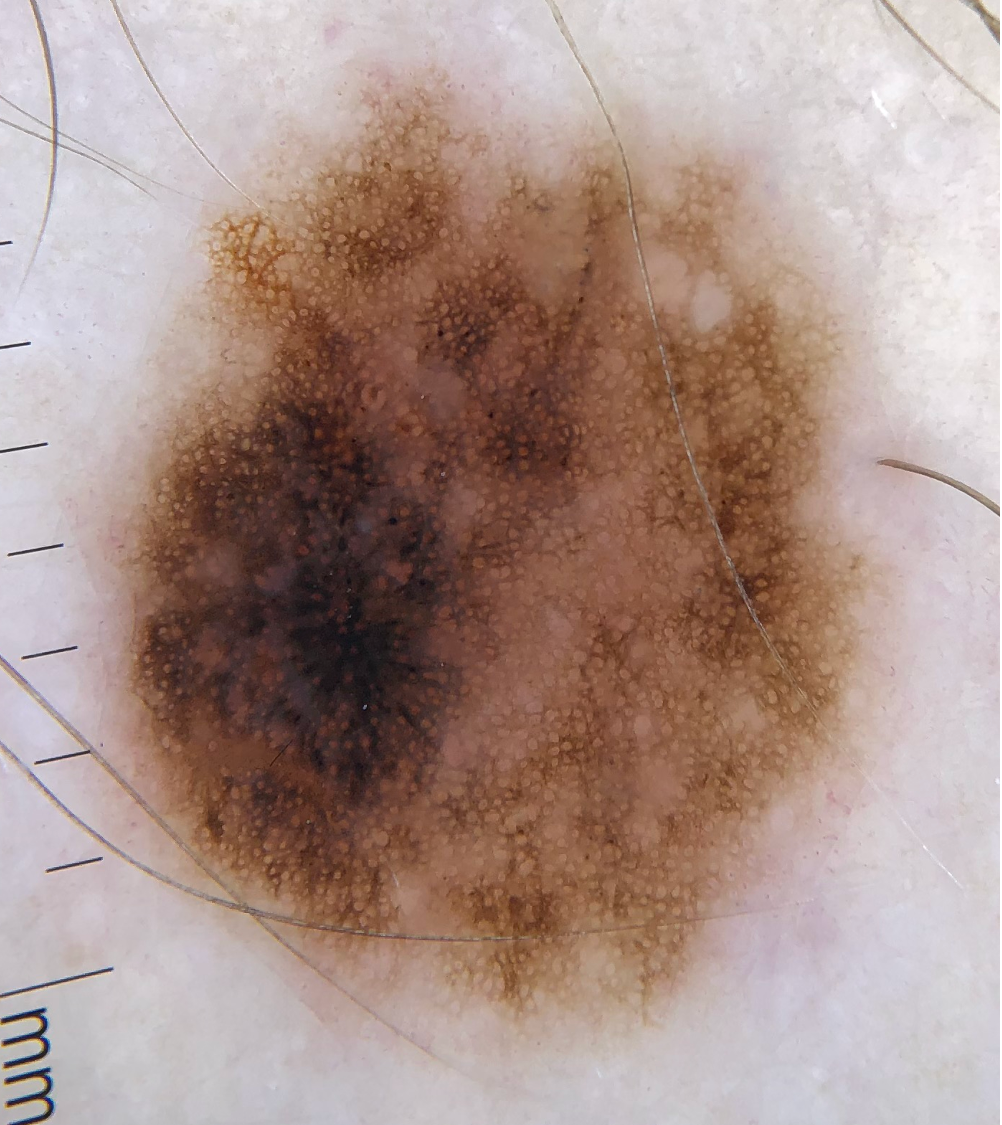
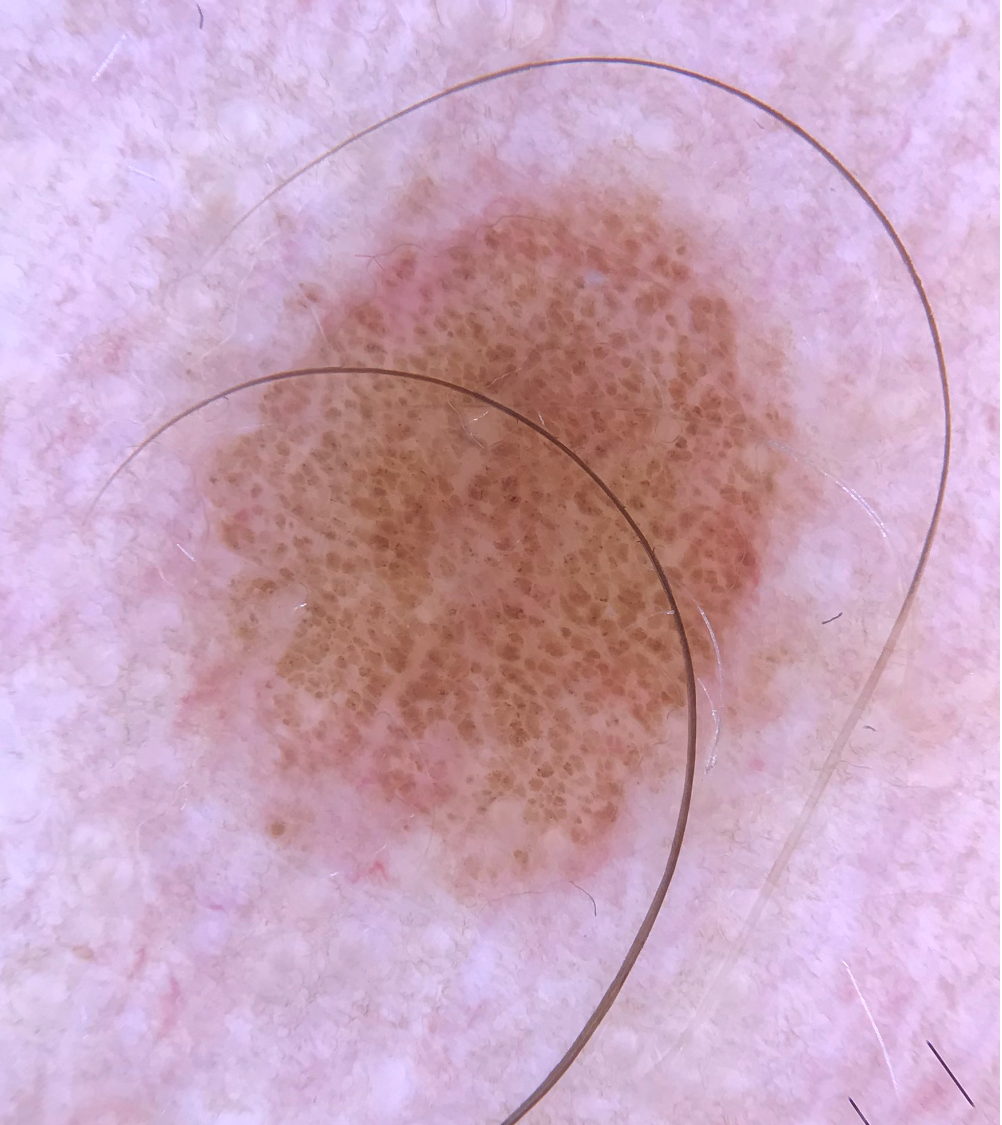
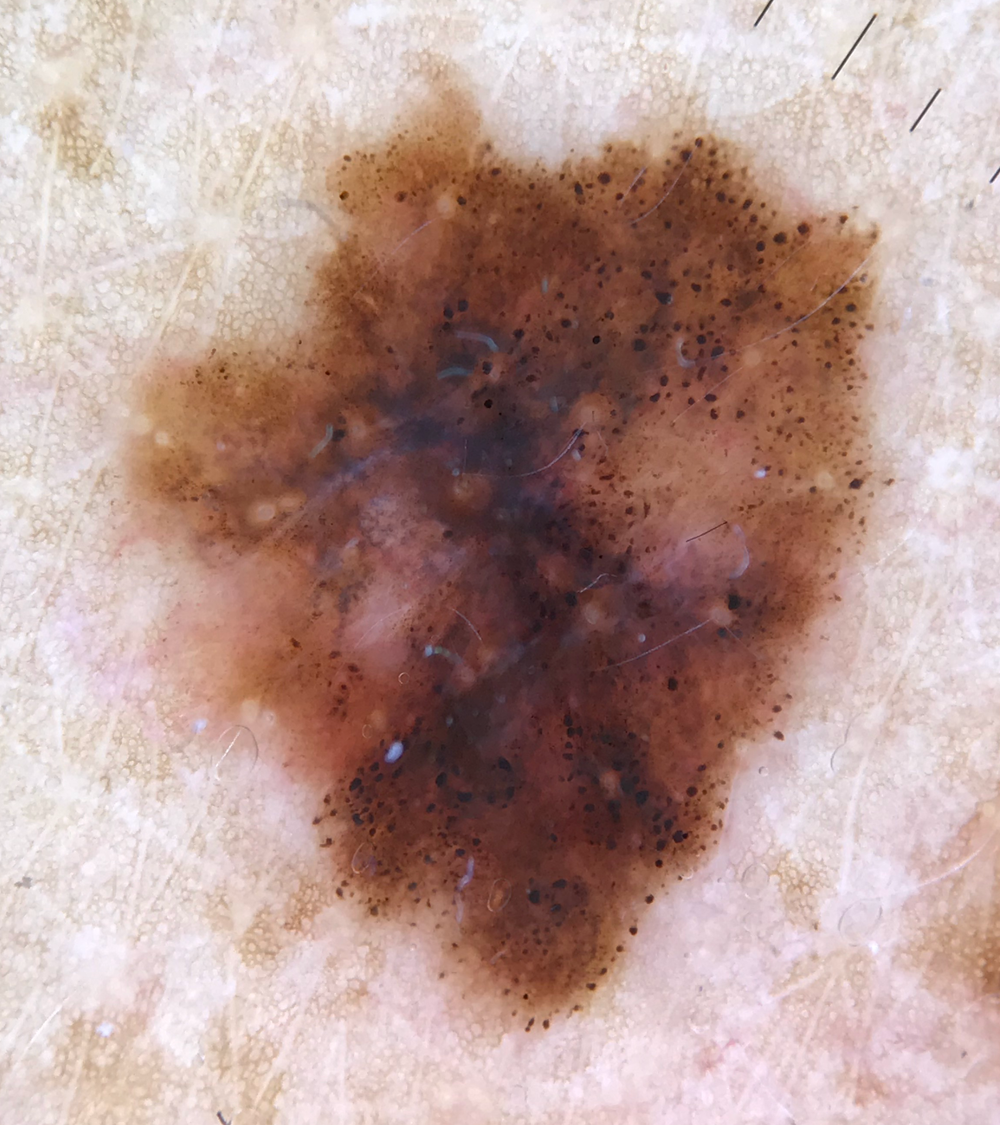
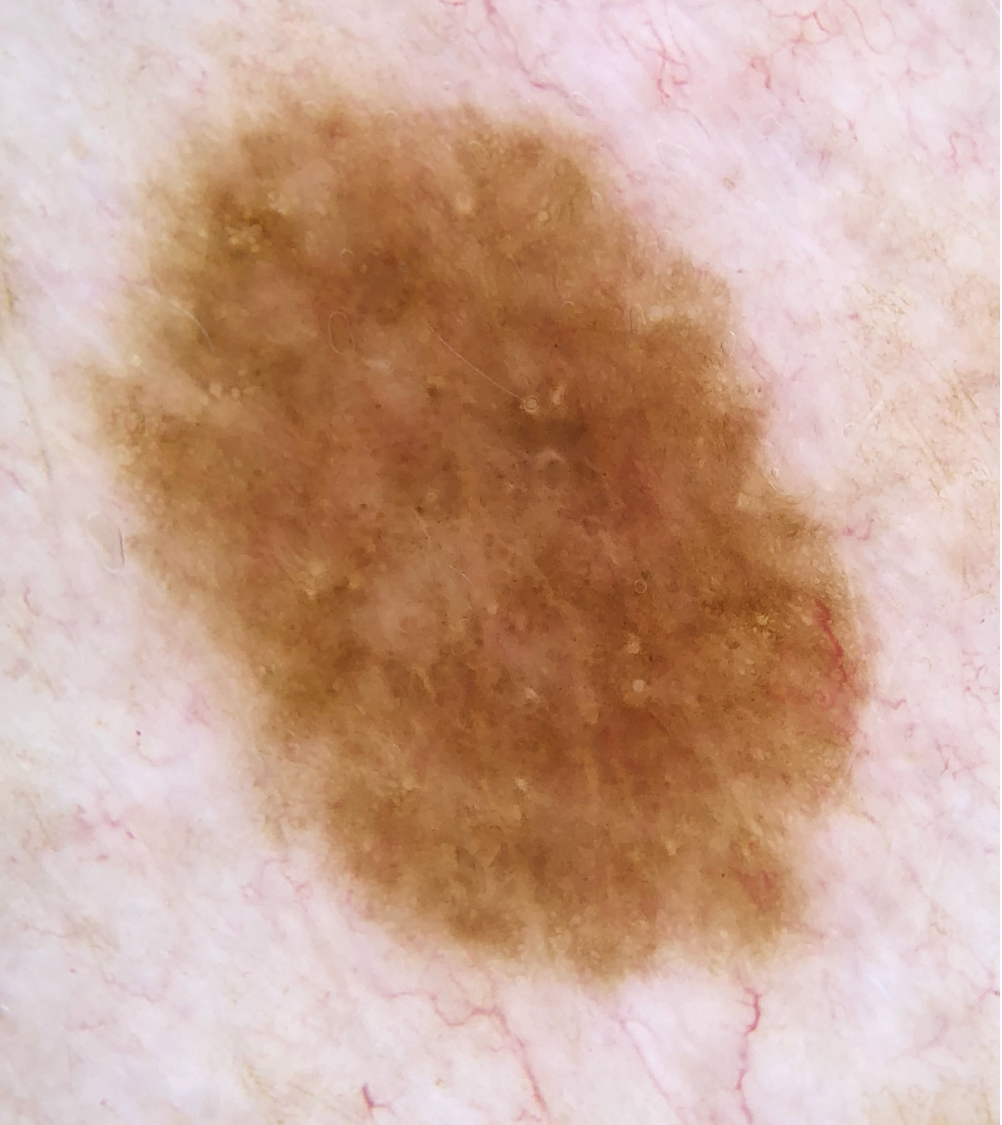
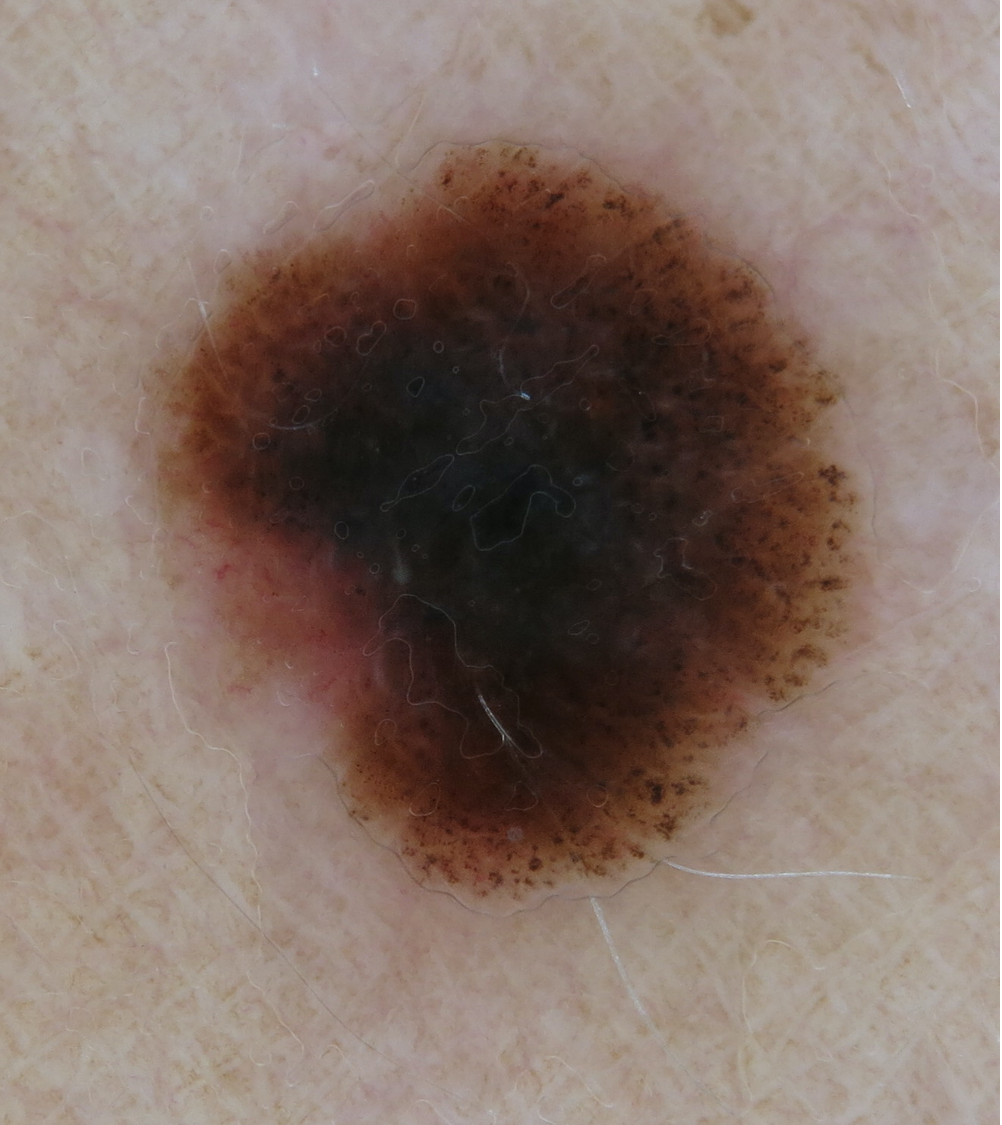
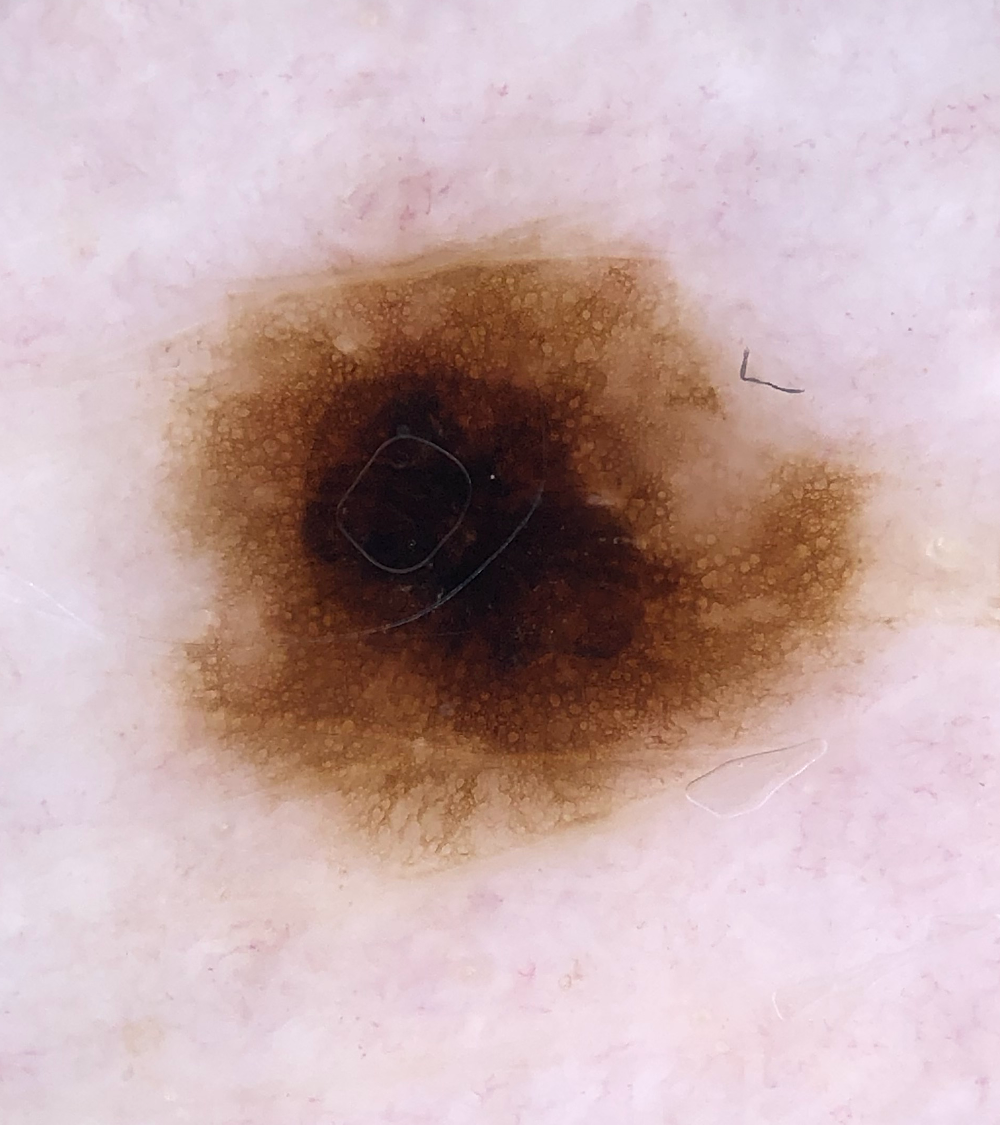
Illustrationen
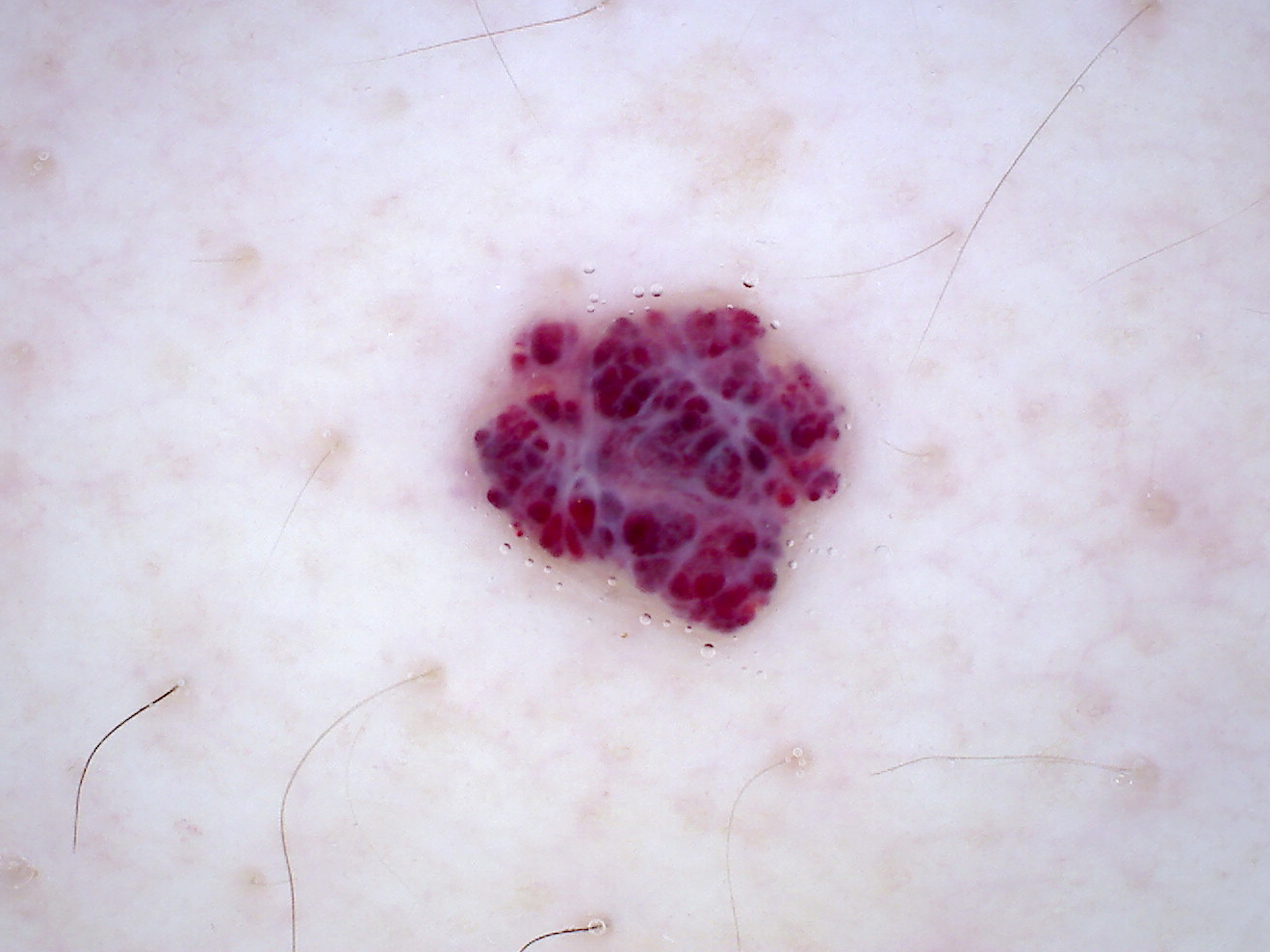
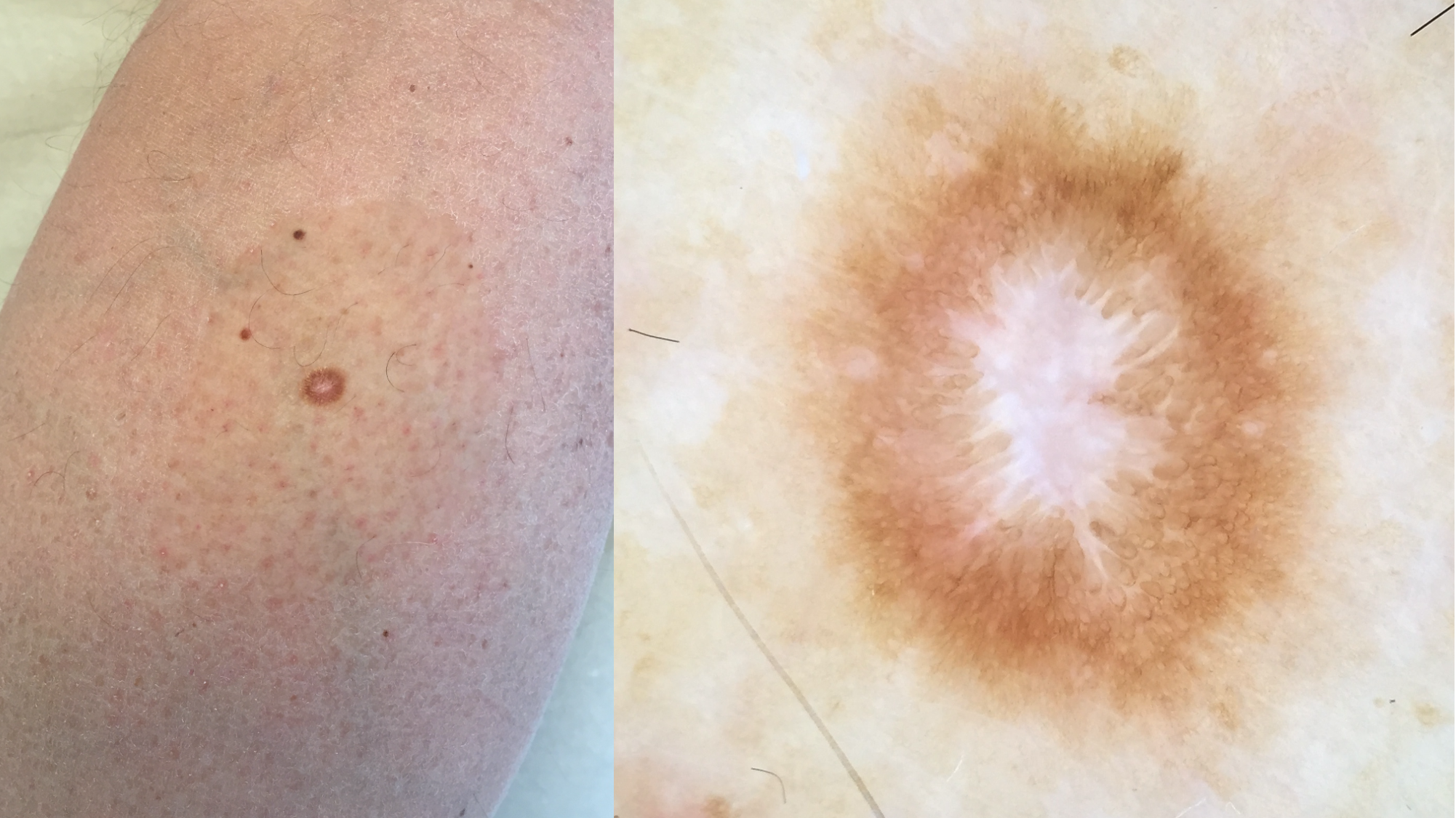
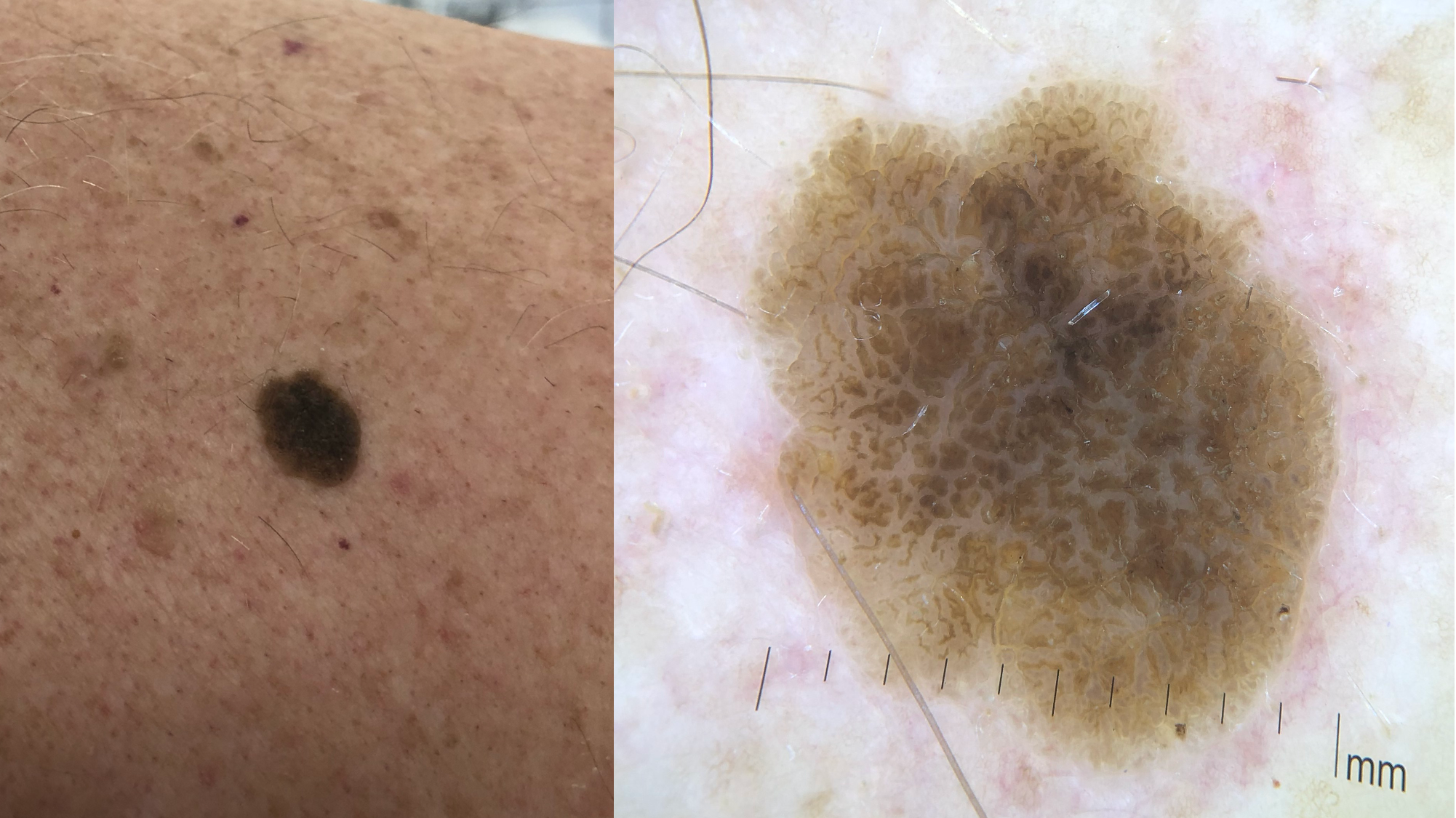
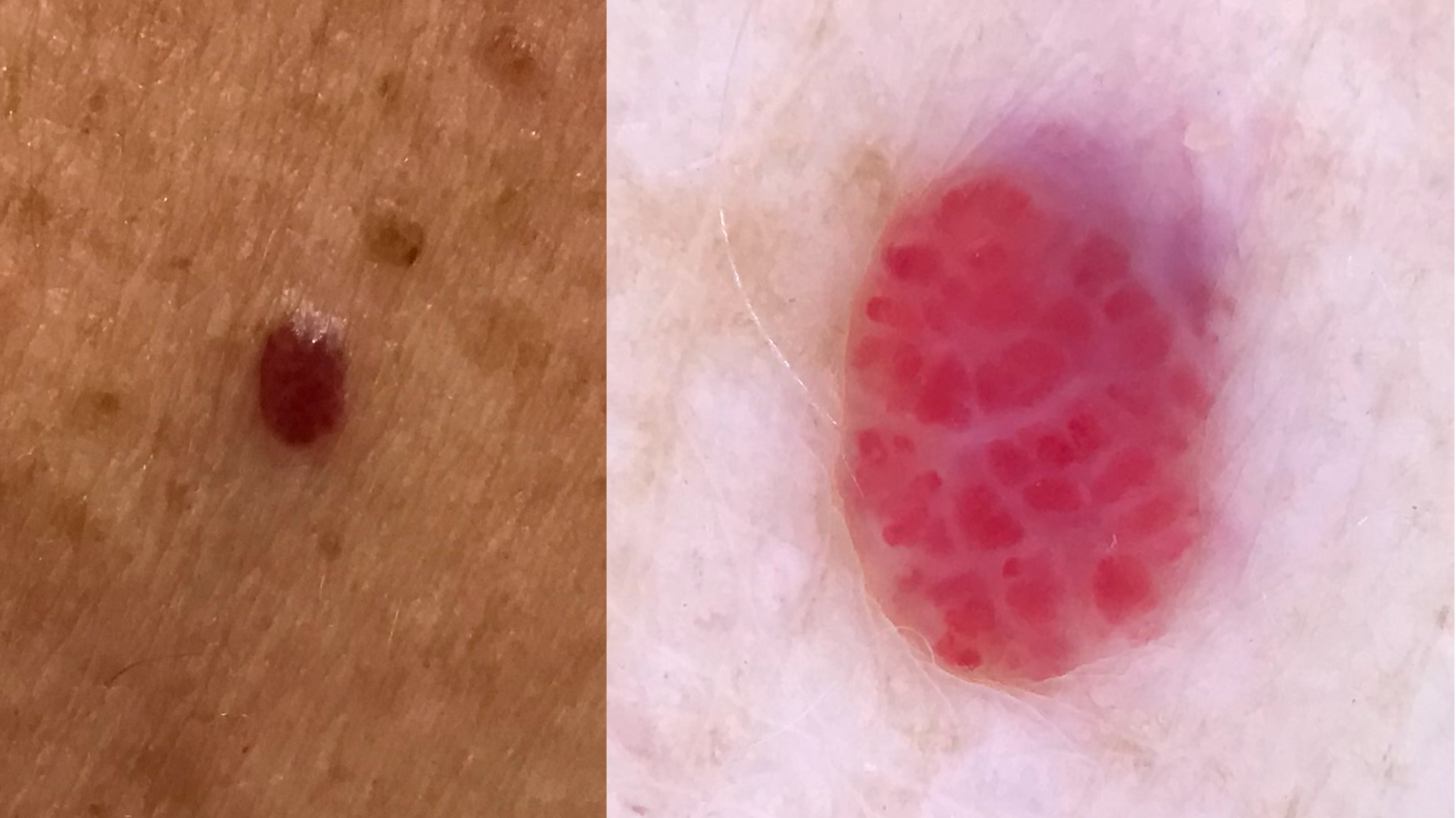
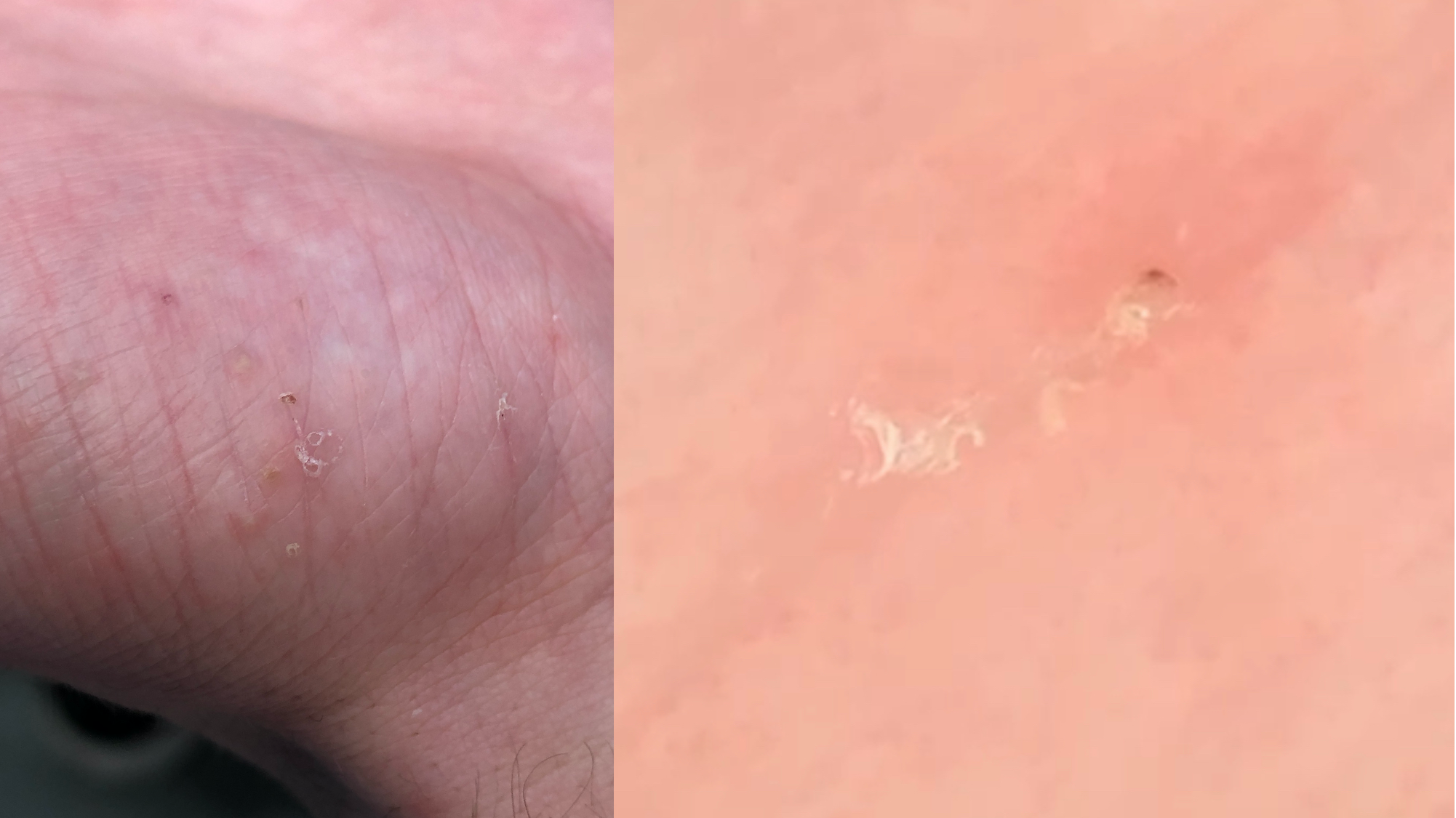
![Klassischer Befund einer seborrhoischen Keratose mit zerebriformer Oberfläche (rechts) und eines dermalen Nävus (Quelle: Prof. Dr. med. Thomas Eigentler, Melanozytärer Nävus, Dtsch Arztebl 2019; 116[11]) Seborrhoische Keratose mit scharfer Randbegrenzung.jpg](https://imagevault.nhi.no/publishedmedia/hjmffmr15hjol8pzob94/Seborrhoische_Keratose_mit_scharfer_Randbegrenzung.jpg)
![Melanozytärer Nävus mit prominentem Pigmentnetz (retikuläres Muster) (Quelle: Prof. Dr. med. Thomas Eigentler, Melanozytärer Nävus, Dtsch Arztebl 2019; 116[11]) Melanozytärer Nävus mit prominentem Pigmentnetz.jpg](https://imagevault.nhi.no/publishedmedia/w2b5zoxcj8dezw3gjg8i/Melanozyt-rer_N-vus_mit_prominentem_Pigmentnetz.jpg)
![Melanozytärer Nävus mit dominanten Schollen (globuläres Muster) (Quelle: Prof. Dr. med. Thomas Eigentler, Melanozytärer Nävus, Dtsch Arztebl 2019; 116[11]) Melanozytärer Nävus mit dominanten Schollen.jpg](https://imagevault.nhi.no/publishedmedia/gmj0jfb7e18ewscpirq1/Melanozyt-rer_N-vus_mit_dominanten_Schollen.jpg)
![Lentigo maligna – pigmentierte Follikelöffnungen, anulär-granuläres Pigmentmuster (Quelle: Prof. Dr. med. Thomas Eigentler, Melanozytärer Nävus, Dtsch Arztebl 2019; 116[11]) Lentigo maligna – pigmentierte Follikelöffnungen.jpg](https://imagevault.nhi.no/publishedmedia/zps6deyzfjphc0yjtlvt/Lentigo_maligna_-_pigmentierte_Follikel-ffnungen.jpg)
![Fingerprintartiges Muster einer flachen seborrhoischen Keratose im Gesicht (Quelle: Prof. Dr. med. Thomas Eigentler, Melanozytärer Nävus, Dtsch Arztebl 2019; 116[11]) Fingerprintartiges Muster einer flachen seborrhoischen Keratose im Gesicht.jpg](https://imagevault.nhi.no/publishedmedia/nz7ra9rhuo710ht03mwe/Fingerprintartiges_Muster_einer_flachen_seborrhoischen_Keratose_im_Gesicht.jpg)
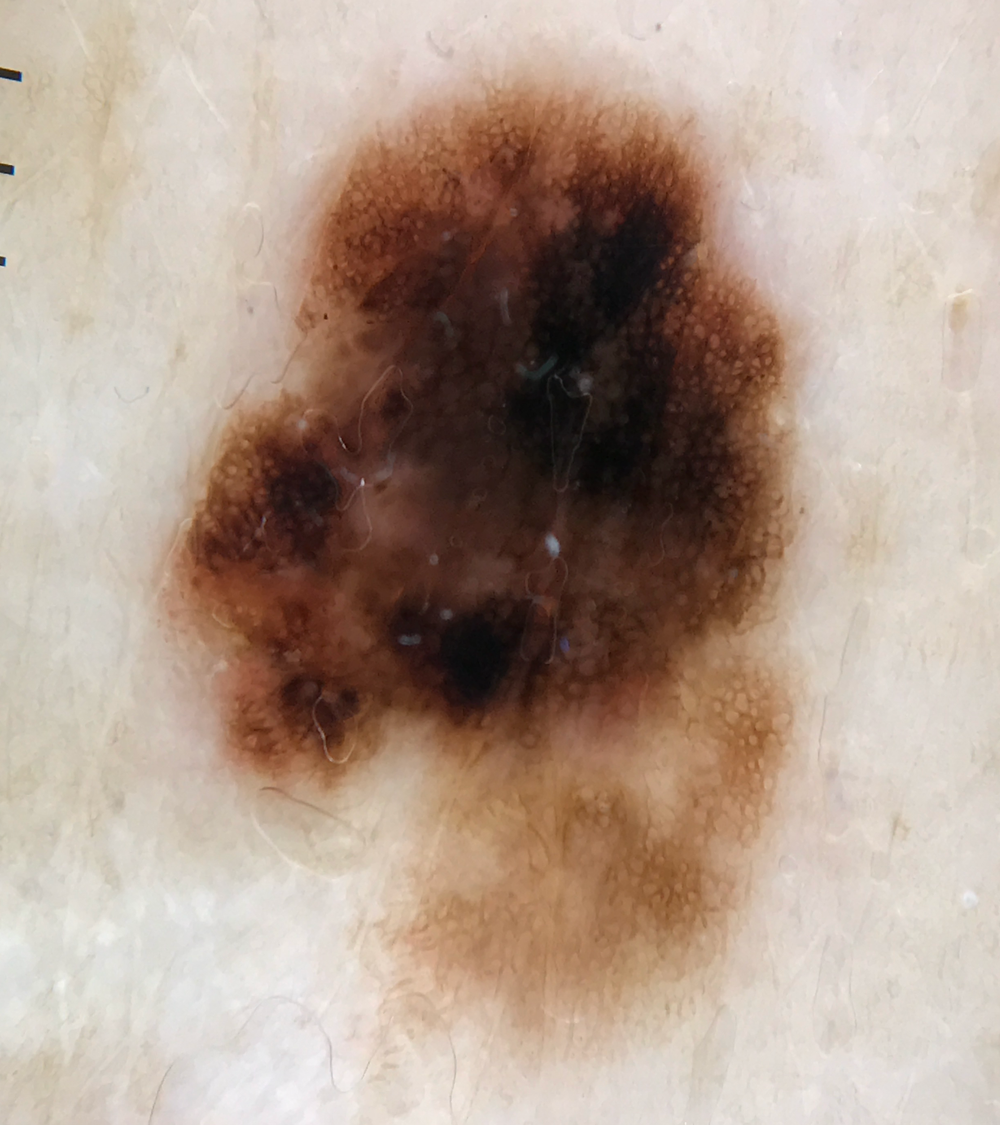
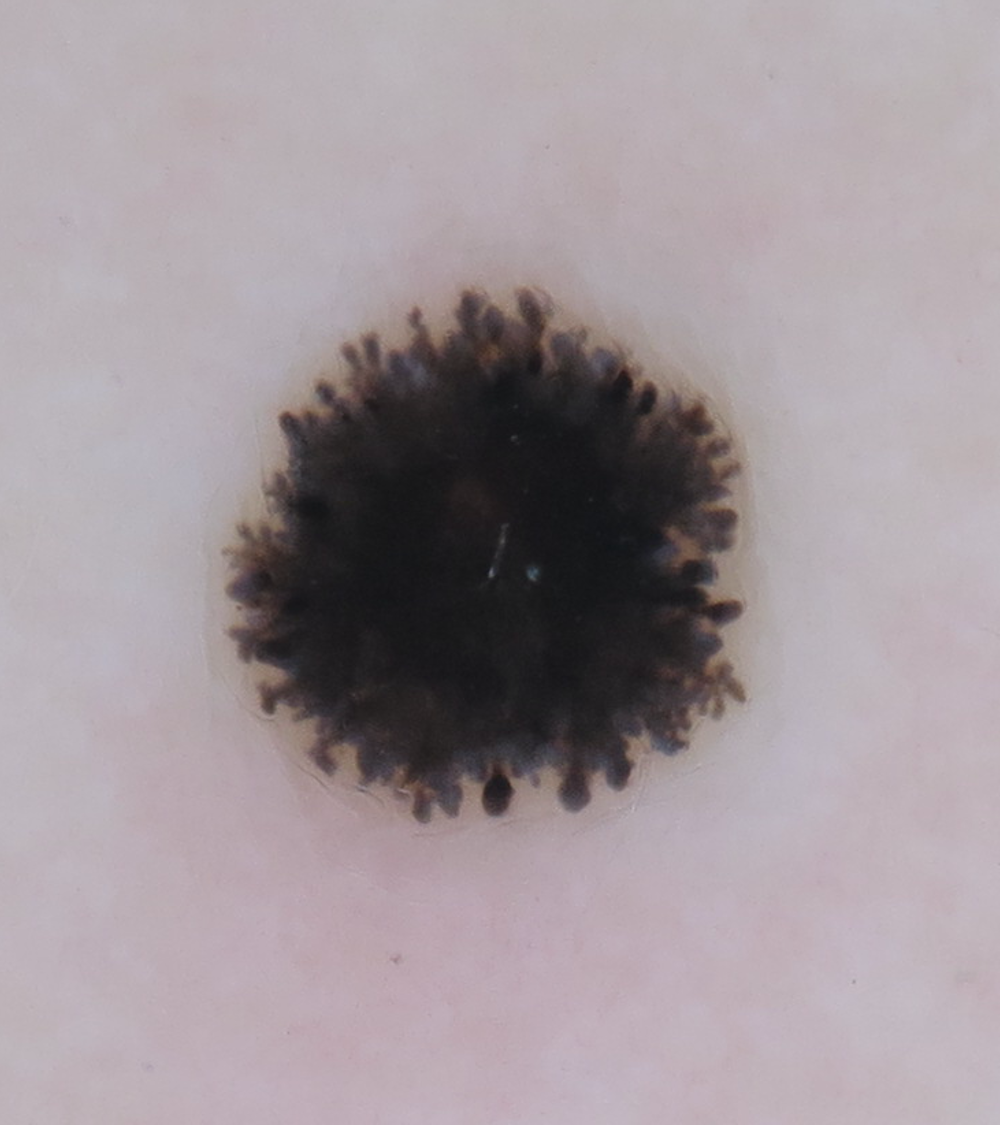
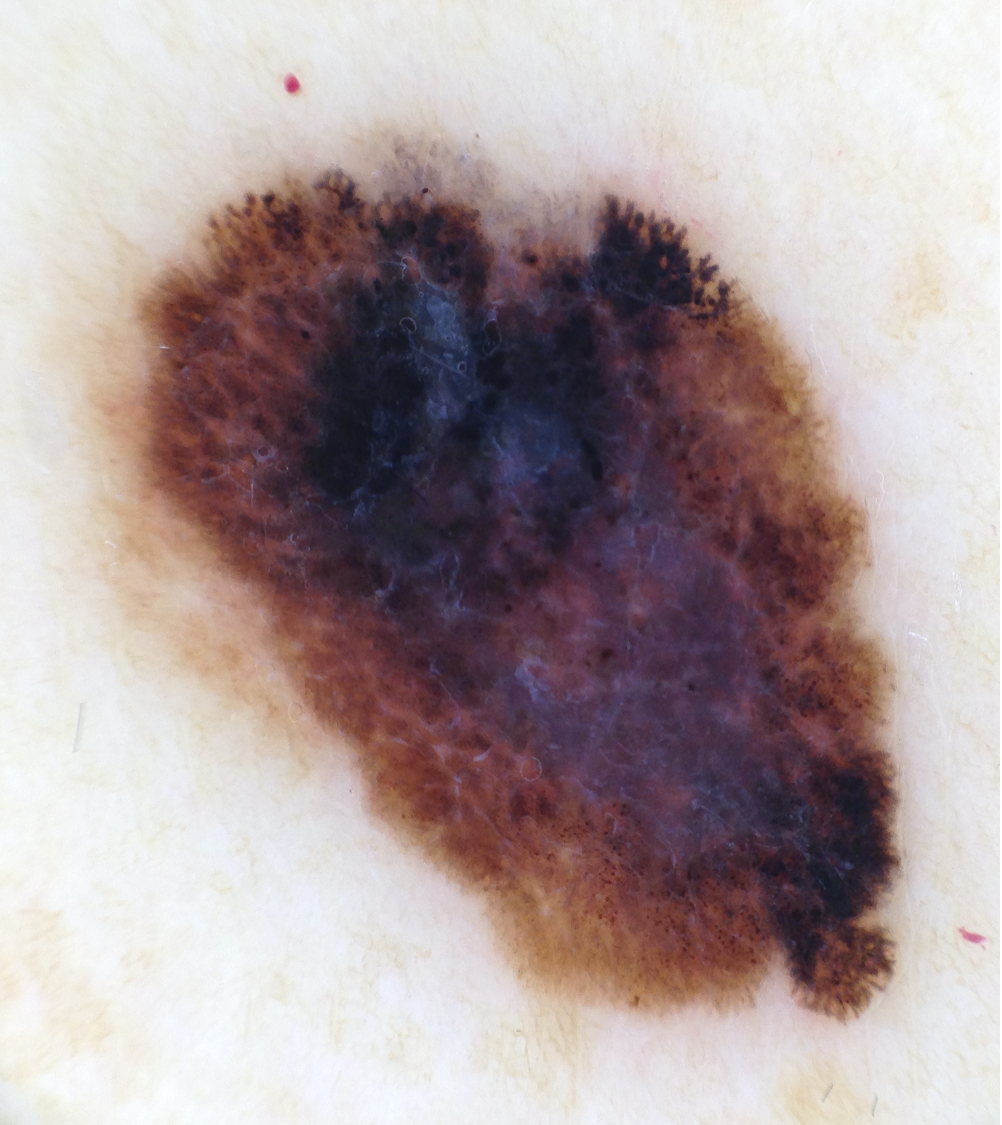
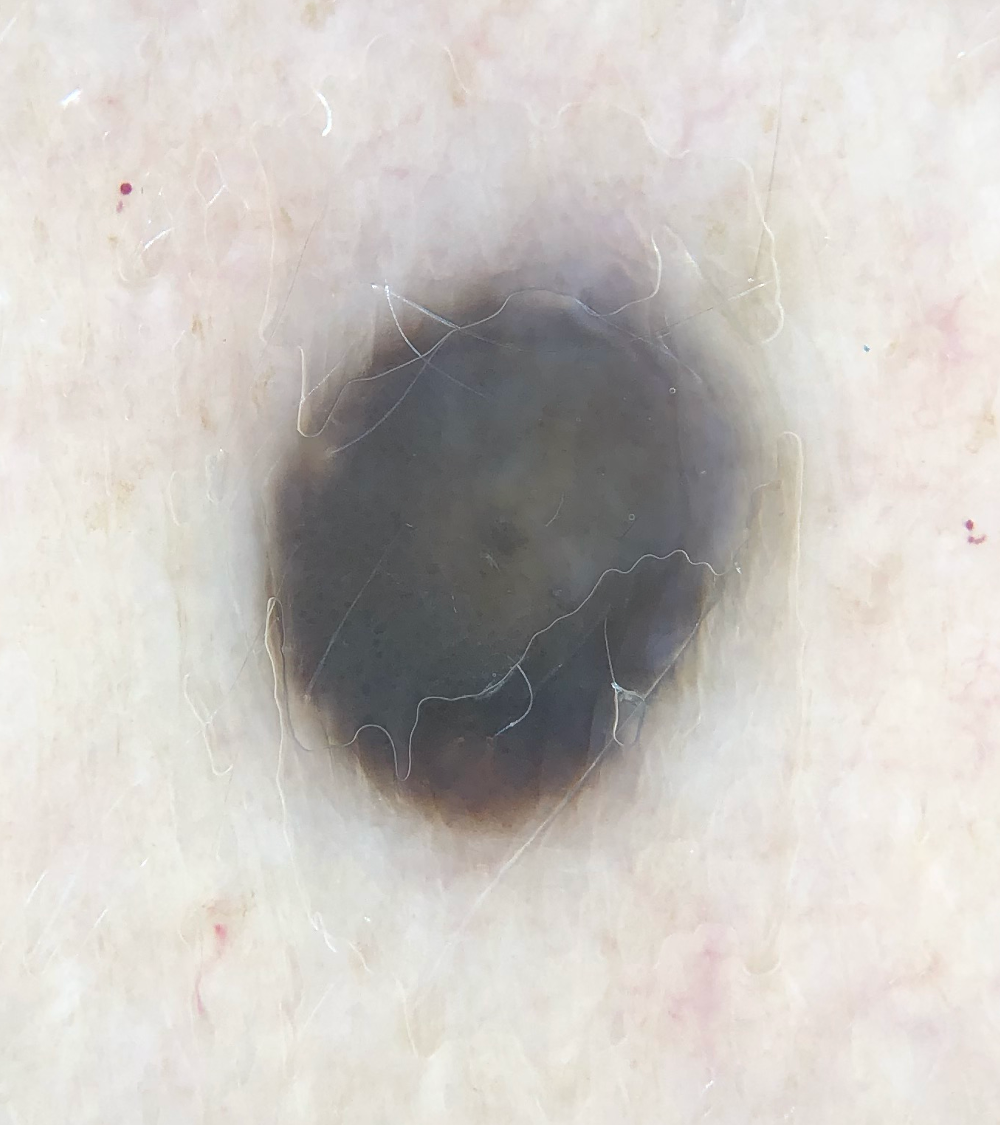

Quellen
Leitlinien
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF). Prävention von Hautkrebs. AWMF-Leitlinie Nr. 032-053OL. S3, Stand 2021. www.awmf.org
- Deutsche Dermatologische Gesellschaft. Diagnostik, Therapie und Prävention des Melanoms. AWMF-Leitlinie Nr. 032-024OL. S3, Stand 2019. www.awmf.org
Literatur
- Dinnes J, Deeks JJ, Chuchu N, et al. Dermoscopy, with and without visual inspection, for diagnosing melanoma in adults. Cochrane Database Syst Rev. 2018;12(12):CD011902. Published 2018 Dec 4. PMID: 30521682 www.cochranelibrary.com
- Dinnes J, Deeks JJ, Chuchu N, et al. Visual inspection and dermoscopy, alone or in combination, for diagnosing keratinocyte skin cancers in adults. Cochrane Database Syst Rev. 2018;12(12):CD011901. Published 2018 Dec 4. PMID: 30521688 www.cochranelibrary.com
- Rao BK, Ahn CS. Dermatoscopy for melanoma and pigmented lesions. Dermatol Clin. 2012;30(3):413–434. PMID: 22800549 www.sciencedirect.com
- Binder M, Puespoeck-Schwarz M, Steiner A et al. Epiluminescence microscopy of small pigmented skin lesions: short-term formal training improves the diagnostic performance of dermatologists. J Am Acad Dermatol 1997; 36: 197-202. PMID: 9039168 www.jaad.org
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF). S3-Leitlinie Prävention von Hautkrebs, Kurzversion. AWMF-Leitlinie Nr. 032/052OL, Stand 2021. www.awmf.org
- Kittler H, Tschandl P: Dermatoskopie. Wien, Österreich: Facultas Universitätsverlag 2009; S. 9-12.
- Richtlinie des Gemeinsamen Bundesausschusses über die Früherkennungen von Krebserkrankungen. Fasssung vom 18.06.2009, zuletzt geändert am 05.12.2019. Bundesanzeiger BAnz AT 20.12.2019 B10. www.g-ba.de www.g-ba.de
- Deutsche Dermatologische Gesellschaft. S3-Leitlinie Diagnostik, Therapie und Prävention des Melanoms. AWMF-Leitlinie 032-024OL, Stand 2019. www.awmf.org www.awmf.org
- Johansson M, Brodersen J, Gøtzsche PC, Jørgensen KJ. Screening for reducing morbidity and mortality in malignant melanoma. Cochrane Database Syst Rev. 2019;6(6):CD012352. Published 2019 Jun 3. PMID: 31157404 www.cochranelibrary.com
- US Preventive Services Task Force, Bibbins-Domingo K, Grossman DC, et al. Screening for Skin Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2016;316(4):429–435. PMID: 27458948 jamanetwork.com
- Belbasis L, Stefanaki I, Stratigos AJ, Evangelou E. Non-genetic risk factors for cutaneous melanoma and keratinocyte skin cancers: An umbrella review of meta-analyses. J Dermatol Sci 2016; 84: 330-9. PMID: 27663092 www.jdsjournal.com
- Haenssle HA, Mograby N, Ngassa A et al. Association of Patient Risk Factors and Frequency of Nevus-Associated Cutaneous Melanomas. JAMA Dermatol 2016; 152: 291-8. PMID: 26536613 jamanetwork.com
- Vestergaard ME, Macaskill P, Menzies SW. Dermoscopy compared with naked eye examination for the diagnosis of primary melanoma: a meta-analysis of studies performed in a clinical setting. Br J Dermatol 2008; 159: 669-76. PMID: 18616769 onlinelibrary.wiley.com
- Westerhoff K, McCarthy WH, Menzies SW. Increase in the sensitivity for melanoma diagnosis by primary care physicians using skin surface microscopy. Br J Dermatol 2000; 143: 1016-20. PMID: 11069512 onlinelibrary.wiley.com
- Argenziano G, Puig S, Zalaudek I, Sera F et al. Dermoscopy improves accuracy of primary care physicians to triage lesions suggestive of skin cancer. J Clin Onol 2006; 24: 1877-82. PMID: 16622262 ascopubs.org
- Herschorn A. Dermoscopy for melanoma detection in family practice. Can Fam Physician 2012; 58: 740-5. PMID: 22859635 www.ncbi.nlm.nih.gov
- Ferrante di Ruffano L, Takwoingi Y, Dinnes J, et al. Computer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. Cochrane Database Syst Rev. 2018;12(12):CD013186. Published 2018 Dec 4. PMID: 30521691 www.cochranelibrary.com
- Marghoob AA, Usatine RP, Jaimes N. Dermoscopy for the family physician. Am Fam Physician. 2013;88(7):441–450. PMID: 24134084 www.aafp.org
- Pehamberger H, Steiner A, Wolff K. In vivo epiluminescence microscopy of pigmented skin lesions. I. Pattern analysis of pigmented skin lesions. J Am Acad Dermatol. 1987;17(4):571–583. PMID: 3668002 www.jaad.org
- Jones O, Jurascheck L, van Melle M et al. Dermoscopy for melanoma detection and triage in primary care: a systematic review. BMJ Open 2019; 9(8):e027529. PMID: 31434767 bmjopen.bmj.com
- Williams NM, Rojas KD, Reynolds JM et al. Assessment of Diagnostic Accuracy of Dermoscopic Structures and Patterns Used in Melanoma Detection: A Systematic Review and Meta-analysis. JAMA Dermatol. 2021 Aug 4. Epub ahead of print. PMID: 34347005. pubmed.ncbi.nlm.nih.gov
- Argenziano G, Soyer HP, Chimenti S, et al. Dermoscopy of pigmented skin lesions: results of a consensus meeting via the Internet. J Am Acad Dermatol. 2003;48(5):679–693. PMID: 12734496 www.jaad.org
- Harrington E, Clyne B, Wesseling N, et al. Diagnosing malignant melanoma in ambulatory care: a systematic review of clinical prediction rules. BMJ Open. 2017;7(3):e014096. Published 2017 Mar 6. PMID: 28264830 www.ncbi.nlm.nih.gov
- Rosendahl C, Cameron A, McColl I, Wilkinson D. Dermatoscopy in routine practice - 'chaos and clues'. Aust Fam Physician 2012; 41: 482-7. PMID: 22762066 www.racgp.org.au
Autor*innen
- Marlies Karsch-Völk, Dr. med., Fachärztin für Allgemeinmedizin, München
- Anneke Damberg, Dr. med., Fachärztin für Allgemeinmedizin, Münster
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).