Zusammenfassung
- Definition:Infektionskrankheit durch Protozoen der Gattung Leishmania, die durch den Biss der Sandmücke übertragen wird.
- Häufigkeit:Weltweit schätzungsweise ca. 12 Mio. Menschen betroffen, in Deutschland etwa 20 eingeschleppte Fälle pro Jahr.
- Symptome:Bei viszeraler Leishmaniose deutliche Beeinträchtigung des Allgemeinzustands, bei kutaner Leishmaniose nur lokale Symptome.
- Befunde:Bei viszeraler Leishmaniose Fieber, Hepatosplenomegalie und Panzytopenie. Bei kutaner Leishmaniose „Orientbeule" an der Bissstelle, ggf. zusätzlich Schleimhautläsionen bei mukokutaner Verlaufsform.
- Diagnostik:Direkter Erregernachweis mittels Histopathologie oder PCR aus Blut.
- Therapie:Immer systemische Therapie bei viszeraler oder mukokutaner Verlaufsform, bei einfachen kutanen Läsionen auch topische Therapie möglich.
Allgemeine Informationen
Definition
- Infektionskrankheit durch Protozoen der Gattung Leishmania1
- In Deutschland extrem selten, nicht meldepflichtig3
- Klassifikation nach Hauptmanifestationsorgan 1
- viszerale Leishmaniose (Kala Azar)
- Das Wort Kala Azar stammt aus dem Hindi und bedeutet „schwarze Haut".
- bei schweren Verlaufsformen Hyperpigmentierung möglich
- kutane Leishmaniose („Orientbeule")
- mukokutane Leishmaniose (Befall der oralen und nasalen Schleimhäute)
- viszerale Leishmaniose (Kala Azar)
Häufigkeit
- Prävalenz
- Weltweit sind schätzungsweise ca. 12 Mio. Menschen betroffen, die Zahl der jährlichen Todesfälle beträgt rund 20.000–30.000.2
- Inzidenz
- Geografische Verteilung
- Leishmaniose in Deutschland
- Das RKI geht von 20 Fällen pro Jahr aus, praktisch immer eingeschleppt.3
Ätiologie und Pathogenese
- Zoonose, die durch den Stich von Sandmücken übertragen wird.
- Die Mücken (1–3 mm) sind überwiegend dämmerungs- und nachtaktiv.8
- Der Mensch ist nur ein zufälliger Wirt, zu den Zwischenwirten zählen ebenfalls z. B. Nagetiere und Hunde.
- In Südwesteuropa sind etwa 10 % aller Hunde infiziert.9
- Die viszerale Leishmaniose ist auch von Mensch zu Mensch übertragbar (prä- oder perinatal von der Mutter auf ihr Kind, oder horizontal von Blut- und Organspendern).1
- Es existieren über 20 verschiedenen Leishmania-Arten:
Pathogenese11
- Beim Stich der weiblichen Sandmücke werden die begeißelten (promastigoten) Leishmanien in das subepidermale Gewebe der Haut übertragen.
- Sie dringen in lokale Wirtszellen, z. B. neutrophile Granulozyten, ein bzw. werden von diesen phagozytiert.
- In den Makrophagen werden die überlebenden Promastigoten zu unbegeißelten (amastigoten) Formen umgewandelt, die ihrerseits weitere Makrophagen im umliegenden Gewebe oder – nach entsprechender Ausbreitung – in anderen Bereichen des Körpers infizieren.
- Bei anfälligen Patient*innen kommt es daraufhin zu einer lokalen oder systemischen Entzündung, die bei reduziertem Immunstatus zum Ausbruch der Erkrankung führt.
- Die Inkubationszeit beträgt einige Wochen bis Monate.
- Der geschilderte Krankheitsverlauf schreitet langsam voran, sodass der Zusammenhang mit einer zurückliegenden Reise oder einem Mückenstich bei Auftreten der klinischen Symptomatik nicht immer gleich offensichtlich ist.
Latente Infektion
- Bei immunsupprimierten Patient*innen (z. B. bei einer Infektion mit HIV) ist eine Reaktivierung sogar noch Jahrzehnte später möglich.3
Prädisponierende Faktoren
- Der Abschnitt basiert auf dieser Referenz.1
- Reisende nach Aufenthalten in Endemiegebieten, Migrant*innen, Asylsuchende, Flüchtlinge aus Endemiegebieten
- HIV-infizierte Personen und andere Patient*innen mit Immundefiziten
ICPC-2
- A78 Infektiöse Erkrankung NNB, andere
ICD-10
- B55 Leishmaniose
- B55.0 Viszerale Leishmaniose
- B55.1 Kutane Leishmaniose
- B55.2 Mukokutane Leishmaniose
- B55.9 Leishmaniose, nicht näher bezeichnet
Diagnostik
Leitlinie: Wann sollte eine Diagnostik auf viszerale Leishmaniose veranlasst werden?1
- Bei jeder Person, die aus einem Endemiegebiet stammt oder sich dort aufgehalten hat und in den letzten Wochen bis Monaten (im Extremfall Intervall jedoch 10 Tage bis mehrere Jahre) von dort eingereist oder zurückgekehrt ist
und
- Fieber
- oder Hepatosplenomegalie
- oder Anämie, Leukopenie oder Thrombopenie (bzw. Panzytopenie)
- oder eine neu aufgetretene Hyperpigmentierung der Haut
- oder (selten) eine unklare Ferritin-Erhöhung aufweist
- oder ein unklares Hämophagozytose-Syndrom
- oder eine Hypergammaglobulinämie hat
oder
- eine bekannte HIV-Infektion hat und ein unklares Krankheitsbild aufweist.
Wann sollte eine Diagnostik auf kutane Leishmaniose veranlasst werden?
- Der Abschnitt basiert auf dieser Referenz.8
- Bei jeder Person, die sich in den letzten Wochen bis Monaten (mukokutane Leishmaniose: bis Jahren) in einem Endemiegebiet aufgehalten hat und
- nicht heilende Haut- und/oder Schleimhautveränderungen aufweist, die länger als 3–4 Wochen bestehen.
Diagnostische Kriterien
- Goldstandard ist der direkte Parasitennachweis oder der Nachweis Leishmanien-spezifischer Nukleinsäure mittels PCR aus dem peripheren Blut1,8
Differenzialdiagnosen
Viszerale Leishmaniose
- Leukämie
- Lymphom
- Rheumatologische Erkrankungen
- Polyarthritis, rheumatoide Arthritis (RA), Lupus erythematodes (SLE), Dermatomyositis, Vaskulitiden
- Tuberkulose
- Brucellose
- Malaria
- Typhus
- Schistosomiasis
- Infektiöse Endokarditis
- Leberzirrhose
Kutane Leishmaniose8
- Ekthym oder erosiv-ulzerierte Pyodermie (Staph. aureus)
- Primäre Hauttuberkulose
- Tuberculosis cutis verrucosa
- Atypische Mykobakteriosen (Buruli-Ulkus, Schwimmbadgranulom)
- Lepra
- Tiefe Trichophytie bzw. entzündlich-pustulöse Tinea (durch zoophile und geophile Fungi)
- Syphilis
- Hauttumoren
Anamnese
Viszerale Leishmaniose
- Infektion erfolgt über den Stich der Sandmücke
- Inkubationszeit in der Regel 2 Wochen bis 8 Monate5
- Anfangs kommt es zu Fieberschüben, mitunter bis zu 2-mal täglich, und zu einer zunehmenden deutlichen Beeinträchtigung des Allgemeinzustands mit Müdigkeit und Gewichtsabnahme.
- Zuweilen kann an der Einstichstelle ein nicht-ulzerierendes Knötchen beobachtet werden, ehe die systemische Manifestation der Erkrankung offensichtlich wird.
Kutane Leishmaniose8
- Inkubationszeit 2 Wochen bis mehrere Monate
- Entwicklung einer typischen Hautläsion an Einstichstelle (siehe Abschnitt Klinische Untersuchung)
- Systemische Symptome sind selten, zu Beginn kann es allerdings kurzzeitig zu leichtem Fieber kommen.
- Nach einigen Monaten heilen die Läsionen spontan ab, von zentral nach peripher bildet sich Granulationsgewebe, das schließlich die gesamte Wunde bedeckt.
Mukokutane Leishmaniose
- Anfangs imponieren an der Einstichstelle die klassischen Hautläsionen.
- Im Verlauf Disseminierung von Leishmanien aus den kutanen Herden in die Schleimhäute8
- orale und nasale Ulzera
Klinische Untersuchung
Viszerale Leishmaniose
- Kardinalsymptome: Fieber, Hepatosplenomegalie und Panzytopenie5
- Systemische Lymphknotenvergrößerung
- In Einzelfällen Hyperpigmentierung der Haut, vor allem an Händen, Füßen, Bauch und Stirn (Kala Azar = schwarze Haut)
- Folgen der Panzytopenie, z. B. Petechien und Spontanblutungen
Kutane Leishmaniose8
- Nach der Infektion entwickelt sich eine rote Papel, die zu einem Knoten oder Plaque heranwächst und meistens ulzeriert.
- Der Ulkus ist unregelmäßig konturiert, hat leicht erhabene, manchmal hyperkeratotische Ränder und typischerweise oft krustige Beläge.
- Manchmal weitere Ulzera in unmittelbarer Nähe (Autoinokulation) oder an weiteren unbedeckten Körperteilen (multilokale Infektion)
- Prädilektionsstellen unbedeckte Hautareale
- Einteilung in einfache und komplexe Läsionen. Komplex:
- > 3 Läsionen
- Einzelläsion > 40 mm im Durchmesser
- Läsionen an kosmetisch und funktionell heiklen Hautarealen wie z. B. im Gesicht, an den Händen, über Gelenken und in der Nähe von Haut-Schleimhaut-Übergängen
- Lymphangitis oder -adenitis („sporotrichoide" Verlaufsform) bzw. Auftreten von Satellitenläsionen
- therapierefraktäre Läsionen.
Mukokutane Leishmaniose
- Zusätzlich zu kutaner Manifestation nasale und orale Schleimhautläsionen
Obligate Untersuchungen
Leitlinie: Viszerale Leishmaniose1
- Aspiration von Knochenmark, Verarbeitung der Probe in einem darin ausgewiesenen Labor
- Färbung der Ausstriche mit Giemsa, Wright oder Leishman-Farbstoff, mikroskopischer Nachweis der Erreger
- Wenn Mikroskopie negativ (oder gleich im ersten Schritt):
- Nachweis Leishmanien-spezifischer Nukleinsäure mittels PCR
- Ein Erregernachweis (mikroskopisch, PCR) ist auch möglich aus Biopsien bzw. Punktaten von Lymphknoten, Leber oder Milz.
- Nachweis Leishmanien-spezifischer Nukleinsäure mittels PCR
- Die Sensitivität einer PCR aus dem peripheren Blut ist vergleichbar derjenigen aus Knochenmark.
- Es ist daher gerechtfertigt, zunächst eine PCR aus dem peripheren Blut zu veranlassen (bei negativem Befund und weiter bestehendem Verdacht sollte eine Untersuchung des Knochenmarks angeschlossen werden).
- Wenn eine viszerale Leishmaniose diagnostiziert wird, sollten das Ausmaß des Organbefalls festgestellt, evtl. Sekundärinfektionen erkannt und Parameter für die Verlaufkontrolle erhoben werden:
- großes Blutbild (Anämie, Leukopenie, Thrombopenie)
- CRP und/oder BSG (für Verlaufskontrollen)
- plasmatische Gerinnung (Prothrombinzeit erniedrigt)
- GOT, GPT, GGT, Bilirubin, Serumkreatinin oder Cystatin C, Elektrolyte
- Eiweißelektrophorese (Albumin erniedrigt; Globuline erhöht)
- Ultraschall des Abdomens (Hepatomegalie, Milz evtl. drastisch vergrößert)
- Rö-Thorax (Ausschluss zusätzlicher Tuberkulose)
- HIV-Test (mit Einverständnis der Patientin/des Patienten).
Kutane Leishmaniose8
- Zur Diagnostik ist zellreiches Material erforderlich, das möglichst unblutig gewonnen werden sollte.
- Zur Verfügung stehen:
- Biopsie
- Stanzbiopsie (z. B. 4 mm Stanzzylinder) vom Rand einer Läsion entnehmen.
- Skin Scraping
- Mittels Skalpell oder scharfem Löffel wird Gewebe möglichst unblutig aus Zentrum und Rand einer Ulzeration entnommen.
- Slit Skin Smear
- Mit einer sterilen Lanzette oder einem sterilen Skalpell werden möglichst unblutig eine oder mehrere Inzisionen (z. B. 3 mm lang und 3 mm tief) in die geschlossene Läsion oder den Ulkusrand gesetzt.
- Nach Entfernung des Blutes mit steriler Gaze wird von der Wand der Inzisionen Gewebe abgekratzt.
- Aspirat
- Mit einer feinen Kanüle (27 G) wird eine geringe Menge steriler NaCl-Lösung in die geschlossene Hautläsion injiziert.
- Nach mehrfacher Rotation der Kanüle wird Flüssigkeit reaspiriert.
- Diese wird auf einem Objektträger ausgestrichen und unfixiert verschickt.
- Biopsie
- Welches Entnahmeverfahren gewählt wird, hängt von individuellen Faktoren der Untersucher*innen und Patient*innen ab.
- Biopsien bieten den Vorteil, dass ausreichend Material für die parallele Durchführung mehrerer Diagnostikmethoden einschließlich der Differenzialdiagnostik (Histologie, weitere kulturelle oder molekulare mikrobiologische Untersuchungen) gewonnen wird, und die Sensitivität entsprechend hoch ist.
Indikationen zur Klinikeinweisung
- Bei Verdacht auf Leishmaniose Einweisung in Krankenhaus
Therapie
Therapieziele
- Überleben der Patient*innen sichern (viszerale Leishmaniose).
- Abheilung kutaner Hautläsionen unter Verhinderung von Sekundärinfektionen oder stigmatisierender Narbenbildung
Allgemeines zur Therapie
Leitlinie: Therapie der viszeralen Leishmaniose1
- Mittel der 1. Wahl ist liposomales Amphotericin B.
- Die Gesamtdosis beträgt 20 mg/kg, verteilt auf mindestens 5 Einzeldosen.
- jeweils i. v. Gabe von 3–4 mg/kg über einen Zeitraum von 10–21 Tagen (z. B. 3–4 mg/kg täglich an Tag 0, 1, 2, 3, 4 und 10)
- Miltefosin ist Mittel der 2. Wahl, z. B. bei Allergie gegen liposomales Amphotericin B.
- tägliche Dosis von 1,5–2,5 mg/kg KG oral, bis max. 150 mg/Tag, Behandlungsdauer 28 Tage
- Die Kapseln sollen zu den Mahlzeiten eingenommen werden.
Mukokutane und kutane Leishmaniose
- Aufgrund der Toxizität und der speziesabhängigen Wirksamkeit der eingesetzten Therapeutika sollte vor Therapiebeginn eine Speziesdifferenzierung angestrebt werden.8
- Bei einfachen Läsionen ist eine lokale Therapie oder das Abwarten auf ein spontanes Abheilen möglich.8
- Indikationen für eine systemische Therapie8
- komplexe Läsionen (siehe Abschnitt Klinische Untersuchung)
- Leishmaniosen der Neuen Welt (z. B. L. amazonensis)
- mukokutane Verlaufsformen
- rezidivierende, disseminierte oder diffus kutane Verläufe
- Da es multiple Subtypen der Leishmanien mit jeweils unterschiedlichen medikamentösen Ansätzen gibt, verweisen wir zur Auswahl des geeigneten Präparats auf die Leitlinie der Deutschen Gesellschaft für Tropenmedizin und Internationale Gesundheit (2010), die allerdings nicht mehr aktualisiert wurde.
Prävention
- In endemischen Gebieten finden Forschungsstudien zur Testung von Impfstoffen gegen viszerale Leishmaniose statt, bisher konnte allerdings kein wirksamer Impfstoff gefunden werden.12-13
- Reduktion der Sandmückenpopulationen in den Risikogebieten2
- Expositionsprophylaxe: bei Reisen in Endemiegebiete individueller Schutz vor Insektenstichen durch körperbedeckende Oberbekleidung, Repellents, feinmaschige Moskitonetze (möglichst mit Insektiziden präpariert)
Überwachung unter Therapie
- Unter Therapie mit liposomalem Amphotericin B
- Blutbild, Nierenfunktion und Elektrolyte 2-mal pro Woche
- Therapieabbruch bei Hypokaliämie < 3,2 mmol/l, Anstieg des Kreatinins oder des Cystatins C > 50 % des Ausgangswertes, signifikanten Blutbildveränderungen1
- Unter Therapie mit Miltefosin
- Leber- und Nierenfunktion wöchentlich
- Therapieabbruch bei Anstieg des Kreatinins oder des Cystatins C > 50 % des Ausgangswertes, Anstieg der Transaminasen auf > 3-Fache des oberen Normwertes1
- Rote-Hand-Brief vom 04.02.2021: soll bei Augensymptomen sofort abgesetzt werden.
Nachkontrollen
Leitlinie: Überwachung des Therapieerfolgs bei viszeraler Leishmaniose1
- Regelmäßige Nachkontrollen sollten alle 3 Monate über 2 Jahre durchgeführt werden.
- Milzgröße, Blutbild, Serum-Albumin und BSG sind sensitive Parameter für Rezidive.
- Die PCR aus Blut sollte in der Nachsorge alle 3 Monate durchgeführt werden.
- Eine erneute Knochenmarkpunktion ist im Verlauf nicht erforderlich.
Aufklärung der Patient*innen
- Die Patient*innen sollten informiert werden, sich bei erneutem Fieber, Lymphknotenschwellungen oder unklarer anderer Symptomatik wieder vorzustellen.1
Verlauf, Komplikationen und Prognose
Verlauf
- Bei medikamentös behandelter viszeraler Leishmaniose entfiebern die Patient*innen in der Regel innerhalb 1 Woche, und die Klinik und Laborparameter bessern sich innerhalb von 2 Wochen.1
- Die meisten Rezidive werden innerhalb von 6 Monaten beobachtet, in Einzelfällen aber auch später.1
Komplikationen
- Unbehandelt weist die viszerale Leishmaniose eine hohe Sterblichkeit auf durch Sekundärinfektionen mit Sepsis, Blutungen und schwerer Kachexie.10
- Post-Kalar-Azar-dermale Leishmaniose5
- Persistenz der Erreger in der Haut trotz Behandlung
- Makulopapulöser Ausschlag, der um den Mund beginnt und sich auf den Körperstamm ausbreitet.
- Post-Kalar-Azar-dermale Leishmaniose5
- Die kutane Leishmaniose kann zu eitrigen Komplikationen wie bei einer Lymphangitis oder einem Erysipel sowie stigmatisierenden Narben führen.
- Die mukokutane Leishmaniose kann durch die Zerstörung von Weichteilen und Knorpelgewebe in Nase, Lippen, Mund und Kehle zu Komplikationen führen.
- Häufig kommt es zu einer bakteriellen Sekundärinfektion.
- mutilierende Läsionen im Gesichtsbereich, z. B. deformierte Nase10
Prognose
- Die kutane Leishmaniose bildet sich meist innerhalb von 3–6 Monaten selbstständig zurück, hinterlässt jedoch häufig Narben.10
- sehr gutes Ansprechen auf medikamentöse Therapie, dann häufig narbenfreies Abheilen10
- Nach Ausbruch klinischer Symptome kommt es bei der viszeralen Leishmaniose unbehandelt zum zunehmenden Gewichtsverlust und meist innerhalb von 2 Jahren zum Tod der Patient*innen durch Sepsis aufgrund bakterieller Infektionen, ausgeprägter Anämie, Leberversagen oder Blutungen.5
- Bei frühzeitiger Diagnose und Behandlung geht die Letalität auf etwa 5 % zurück.10
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen
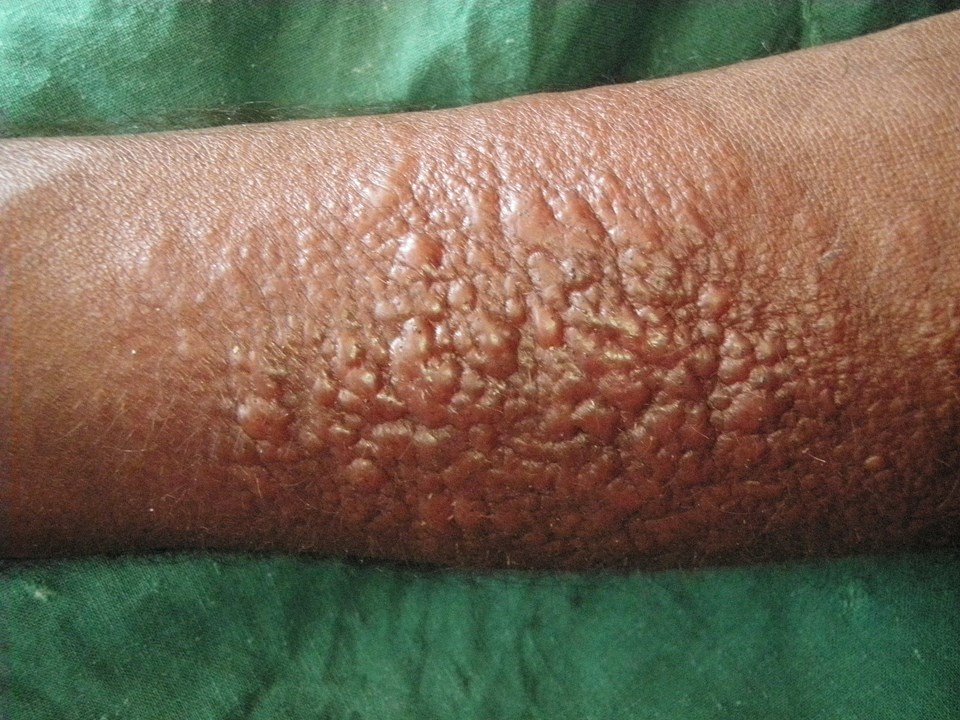
Leishmaniose: Komplexe Läsion > 40 mm mit Hyperpigmentierung.
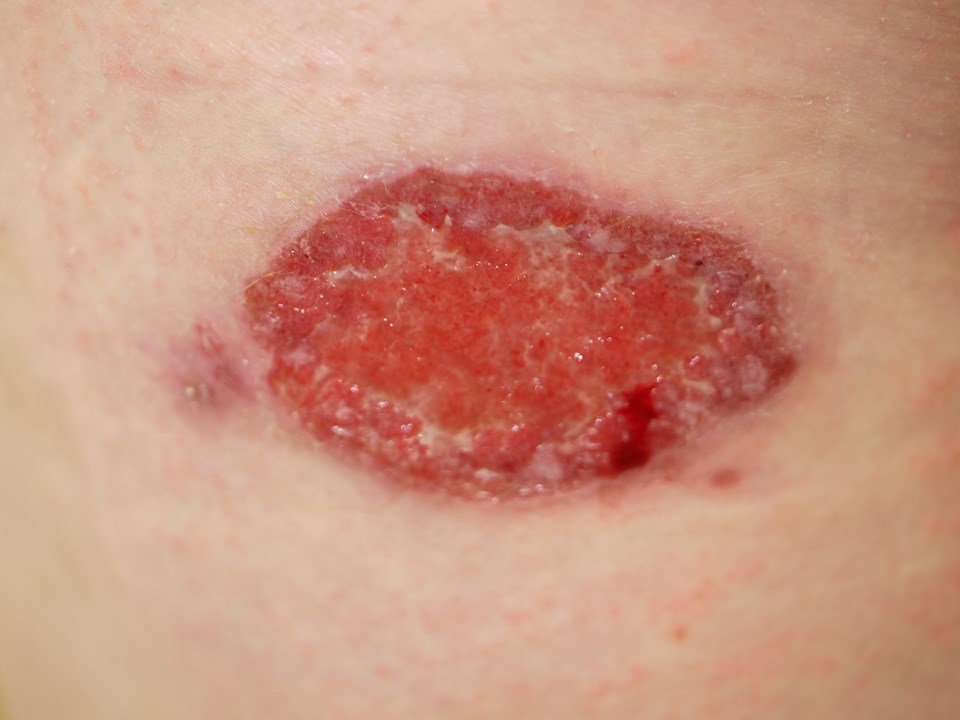
Leishmaniose: Einfache Läsion mit hyperkeratotischen Wundrändern.
Quellen
Leitlinien
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG). Viszerale Leishmaniasis (Kala-Azar), Diagnostik und Therapie. AWMF-Leitlinie Nr. 042-004. S1, Stand 2016. www.awmf.org
Literatur
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit e.V. (DTG). Viszerale Leishmaniasis (Kala-Azar), Diagnostik und Therapie. AWMF-Leitlinie Nr. 042 - 004. Stand 2016. www.awmf.org
- World Health Organization. Fact sheet: leishmaniasis (letzter Zugriff 27.04.2020). www.who.int
- Robert-Koch-Institut. Infektionskrankheiten A-Z. Antworten auf häufig gestellte Fragen zu Leishmaniose. Stand 04.10.2018. www.rki.de
- Roberts LJ, Handman E, Foote SJ. Leishmaniasis. Clinical review. BMJ 2000; 321: 801-4. PubMed
- Wilhelm TJ. Viszerale Leishmaniose. Der Chirurg 2019; 90: 833-7. doi.org
- Alvar J, Vélez ID, Bern C, et al; WHO Leishmaniasis Control Team. Leishmaniasis worldwide and global estimates of its incidence. PLoS One. 2012;7:e35671. journals.plos.org
- Burza S, Croft SL, Boelaert M. Leishmaniasis. Lancet 2018; 392(10151): 951-70. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG). Diagnostik und Therapie der kutanen und mukokutanen Leishmaniasis in Deutschland. Stand 2010. www.dtg.org
- Franco AO, Davies CR, Mylne A, et al. Predicting the distribution of canine leishmaniasis in western Europe based on environmental variables. Parasitology 2010; 138(14): 1878-91. www.ncbi.nlm.nih.gov
- Stark CG. Leishmaniasis. Medscape, last updated Feb 18, 2020. emedicine.medscape.com
- Belkaid Y, Mendez S, Lira R, Kadambi N, Milon G and Sacks D. A natural model of Leishmania major infection reveals a prolonged "silent" phase of parasite amplification in the skin before the onset of lesion formation and immunity. J Immunol 2000; 165: 969-77. PubMed
- Requena JM, Iborra S, Carrion J, Alonso C and Soto M. Recent advances in vaccines for leishmaniasis. Expert Opin Biol Ther 2004; 4: 1505-17. PubMed
- Coler RN and Reed SG. Second-generation vaccines against leishmaniasis. Trends Parasitol 2005; 21: 244-9. PubMed
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung Allgemeinmedizin, Frankfurt a. M.
- Birgit Wengenmayer, Dr. med., Fachärztin für Allgemeinmedizin, Freiburg
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).