Zusammenfassung
- Definition:Neoplastische Proliferation von myeloiden Zellen mit erhöhter Zahl von von Progenitorzellen (Blasten) im Knochenmark, evtl. mit Aussaat ins periphere Blut.
- Häufigkeit:Die Inzidenz liegt jährlich bei ca. 3,7 Fällen pro 100.000 Personen und steigt mit dem Alter an.
- Symptome:Typische Symptome sind Abgeschlagenheit und Müdigkeit, häufige Atemwegsinfektionen und spontane Blutungen unter die Haut und aus den Schleimhäuten.
- Befunde:Bei der Untersuchung können Blässe, Hauteinblutungen, Lymphknotenschwellungen und eine leichte Hepatosplenomegalie auffallen.
- Diagnostik:Klinik, Labor einschl. Knochenmarkuntersuchung.
- Therapie:Risikoadaptierte Therapieprotokolle (evtl. im Rahmen von Studien) je nach AML-Typ, biologischem Patientenalter und Komorbidität; diese können eine reine Kombinationschemotherapie oder auch im Verlauf eine allogene Stammzelltransplantation (SZT) umfassen.
Allgemeine Informationen
- Der gesamte Abschnitt basiert auf dieser Referenz.1
Definition
- Maligne Neoplasie der Myelopoese mit variabler Beteiligung myeloischer Zelllinien2
- Heterogene klonale Störung von hämatopoetischen Progenitorzellen (Blasten) und seltener von Stammzellen
- Störung der Zelldifferenzierung
- Störung der Proliferationsregulation3-4
- Vor Einführung wirksamer Medikamente führte die Krankheit meist innerhalb von 1 Jahr zum Tod durch Infektionen, Blutungen und Organinfiltration.
- Subklassifizierung auf der Grundlage von Morphologie und Histochemie (s. u.)5
Häufigkeit
- Inzidenz: 3,7/100.000
- Steigt mit dem Alter an.
- bei Patient*innen > 70 Jahre: Inzidenz > 1/1.000
- Altersmedian in einem schwedischen Register erwachsener Patient*innen: 72 Jahre6
Ätiologie und Pathogenese
- Der gesamte Abschnitt basiert auf diesen Referenzen.1-2,7-8
- Ursprung: pathologische Proliferation klonaler myeloischer Zellen
- meist im hochproliferativen Progenitorpool (d. h. CD34+/CD38+)
- seltener im Stammzellpool (d. h. CD34+/CD38–)
- Der proliferierende Klon überwächst das gesunde Knochenmark und führt zur Depletion der gesunden Hämatopoese. Das führt zu:
- Granulozytopenie (Infektanfälligkeit, Sepsis)
- Thrombozytopenie (Blutungsneigung)
- Anämie (Dyspnoe, Leistungsminderung)
- Verschiedene prognostisch bedeutsame zytogenetische Aberrationen
- Gentranslokationen, z. B.:
- Translokationen t(8;21), t(15;17)
- Inversion inv(16).
- numerische Aberrationen, z. B.:
- Trisomie 8
- Monosomie 7.
- komplexe Veränderungen (> 3 rekurrente chromosomale Aberrationen in einem Klon)
- Gentranslokationen, z. B.:
- Klonale Heterogenität
- Auch innerhalb einer betroffenen Person kann die Erkrankung aus genetisch verschiedenen Subklonen bestehen.
- bei etwa 50 % der Patient*innen neben dem dominanten Hauptklon mindestens ein weiterer Subklon
- Der Anteil der verschiedenen Klone kann sich über den Krankheitsverlauf ändern.
- Im peripheren Blut sind Genveränderungen oft nur in den malignen Zellen nachzuweisen.1,7,9
- Fast immer mindestens 1 Mutation in einer von 9 für die Transformation kritischen, funktionellen Gruppen:
- aktivierende Mutationen der Signaltransduktion (FLT3, KIT, KRAS, NRAS u. a.)
- Mutationen von myeloischen Transkriptionsfaktoren (RUNX1, CEBPA u. a.)
- Fusionen von Transkriptionsfaktor-Genen (PML-RARA, MYH11-CBFB u. a.)
- Mutationen von Chromatin-Modifikatoren (MLL-PTD, ASXL1 u. a.)
- Mutationen im Kohesin-Komplex (SMC1S u. a.)
- Spliceosomen-Mutationen
- Mutationen in Tumorsuppressorgenen (TP53, WT1 u. a.)
- NPM1-Mutationen
- Mutationen in Genen der DNA-Methylierung (TET1, TET2, IDH1, IDH2, DNMT3B, DNMT1, DNMT3A).
Prädisponierende Faktoren
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Exposition gegenüber:
- Rauchen12
- Erhöhung des AML-Risikos gegenüber Nichtraucher*innen
- bei aktiven Raucher*innen um 40 %
- bei ehemaligen Raucher*innen um 25 %
- Risiko korreliert mit der Zigarettenmenge.
- beide Geschlechter gleichermaßen betroffen
- Erhöhung des AML-Risikos gegenüber Nichtraucher*innen
- Behandlung mit Zytostatika2,13, z. B.:
- Alkylanzien
- Leukämiebeginn 4–6 Jahre nach Exposition
- Aberrationen der Chromosomen 5 und/oder 7
- Topoisomerase II-Hemmer
- Anthrazykline, Anthrachinone, Epipodophylotoxine
- Leukämiebeginn 1–3 Jahre nach Exposition
- häufig Aberrationen von Chromosom 11 Bande q23
- evtl. balancierte Translokation t(1,17)
- Alkylanzien
- Die AML zeigt bei manchen Patient*innen Beziehungen zum myelodysplastischen Syndrom (MDS), z. B.:
- MDS in der Vorgeschichte
- MDS-typische Morphologie bzw. Zytogenetik.
- Erbliche Faktoren?
- erhöhtes Risiko bei kongenitalen Chromosomenanomalien (z. B. Trisomie 21 oder Fanconi-Anämie)
- familiäre Häufung darüber hinaus nicht zweifelsfrei belegt
ICPC-2
- B73 Leukämie
ICD-10
- C92 Myeloische Leukämie
- C92.0 Akute myeloische Leukämie
- C92.2 Atypische chronische myeloische Leukämie, BCR/ABL-negativ (wird in Norwegen nicht verwendet)
- C92.4 Akute Promyelozyten-Leukämie [PCL]
- C92.5 Akute myelomonozytäre Leukämie
- C92.7 Sonstige myeloische Leukämie
- C92.9 Myeloische Leukämie, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Krankheitsdefinierend (Abgrenzung zum MDS)
- Blastenanteil von ≥ 20 % im peripheren Blut oder im Knochenmark
- Typische Laborbefunde
- peripheres Blut
- Zytopenie (Anämie und/oder Neutropenie und/oder Thrombozytopenie) oder Panzytopenie
- im weiteren Verlauf Leukozytose bei etwa 60 % der Patient*innen (cave: Leukostase, Näheres siehe Abschnitt Verlauf, Komplikationen und Prognose)
- seltener aleukämische Verläufe mit normaler oder sogar erniedrigter Leukozytenzahl (meist bei sekundären oder therapieassoziierten AML und bei älteren Patient*innen)
- evtl. Nachweis von – meist leukämischen – Blasten, unabhängig von der Leukozytenzahl
- Knochenmarkausstrich (Blasten stark vermehrt)14-15 und zytologische Untersuchung
- Morphologie
- Zytochemie
- Immunphänotypisierung
- Zyto- und Molekulargenetik
- peripheres Blut
- Typisches Erkrankungsbild (zu Beginn oft nur unspezifische Symptome)
- Evtl. extramedulläre Manifestationen (häufig bei myelomonozytär/monoblastär differenzierten AML)
- Hautinfiltrate
- Meningeosis leukaemica
- Gingivahyperplasie
- Infiltration von Milz und Leber
WHO-Klassifikation
- Der gesamte Abschnitt basiert auf dieser Referenz.16
- Die WHO-Klassifikation teilt die AML nach Ätiologie auf der Basis zytogenetischer und molekulargenetischer Charakteristika der im Knochenmark vorliegenden leukämischen Zellen ein. Basierend auf dieser Einteilung ist die Erkrankung heute bei weit über 50 % der Patient*innen klassifizierbar. Das sind deutlich mehr als mit den vorwiegend morphologischen Kriterien der bisher gebräuchlichen FAB(French-American-British)-Klassifikation allein.1-2,4-5,7,17
- Akute myeloische Leukämie mit wiederkehrenden zytogenetischen
Anomalien- AML mit t(8;21)(q22;q22); RUNX1-RUNX1T1
- AML mit inv(16)(p13.1q22) oder t(16;16)(p13.1;q22); CBFB-MYH11
- APL (akute Promyelozytenleukämie, FAB M3) mit t(15;17)(q22;q12); PML-RARA
- AML mit t(9;11)(p22;q23); MLLT3-KMT2A
- AML mit t(6;9)(p23;q34); DEK-NUP214
- AML mit inv(3)(q21q26.2) oder t(3;3)(q21;q26.2); GATA2, MECOM
- AML (megakaryoblastär) mit t(1;22)(p13;q13); RBM15-MKL1
- vorläufige Entität: AML mit BCR-ABL1
- AML mit mutiertem NPM1
- AML mit mutiertem CEBPA
- vorläufige Entität: AML mit mutiertem RUNX1
- Akute myeloische Leukämie mit Myelodysplasie-assoziierten Veränderungen
- Therapieassoziierte myeloische Neoplasien
- Akute myeloische Leukämie ohne weitere Kategorie
- AML mit minimaler Differenzierung (FAB M0)
- AML ohne Ausreifung (FAB M1)
- AML mit Ausreifung (FAB M2)
- akute myelomonozytäre Leukämie (FAB M4)
- akute monoblastäre/monozytäre Leukämie (FAB M5a, b)
- akute Erythroleukämie (FAB M6)
- reine Erythroleukämie
- Erythroleukämie, erythroid/myeloid
- akute Megakaryoblastenleukämie (FAB M7)
- akute Basophilenleukämie
- akute Panmyelosis mit Myelofibrose (Syn.: akute Myelofibrose; akute Myelosklerose)
- Myeloisches Sarkom (Syn. extramedullärer myeloischer Tumor; granulozytäres Sarkom; Chlorom)
- Myeloische Proliferationen bei Down-Syndrom
- Down-Syndrom-assoziierte myeloische Leukämie
- transient abnormale Myelopoese (Syn. transientes myeloproliferatives Syndrom)
- Akute Leukämien mit unklarer Linienzugehörigkeit
- akute undifferenzierte Leukämie
- akute Leukämie mit gemischtem Phänotyp und t(9;22)(q34;q11.2); BCR-ABL1
- akute Leukämie mit gemischtem Phänotyp und (v;11q23); MLL-Rearrangement/KMT2A
- akute Leukämie mit gemischtem Phänotyp, B/myeloisch, (nicht anderweitig spezifiziert)
- akute Leukämie mit gemischtem Phänotyp, T/myeloisch, (nicht anderweitig spezifiziert)
Differenzialdiagnosen
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Akute lymphatische Leukämie
- Myelodysplastische Syndrome
- Aplastische Anämie
- Leukämisch verlaufende Lymphome, z. B.:
- Myeloproliferative Syndrome, z. B.:
- Virusinfektionen, z. B. mit:
- Vitamin-B12-Mangelanämie (perniziöse Anämie)
- Folat(Folsäure)-Mangel-Anämie
Anamnese
- Die AML beginnt meist subakut mit:
- Anämie
- Granulozytopenie
- häufige Infektionen der oberen Atemwege
- Hautinfektionen
- Thrombozytopenie
- Blutungstendenz subkutan (Petechien, Ekchymosen)
- Schleimhautblutungen
- Menorrhagien
- Epistaxis.
- Häufige, aber unspezifische Symptome:
- Einige Patient*innen haben:
- Kopfschmerzen
- Übelkeit und Erbrechen (meningeale Infiltration)
- Sehstörungen
- Hautausschlag
- Knochen- und Gelenkschmerzen.
- 50 % der Patient*innen hatten Symptome innerhalb der letzten 3 Monate vor der Diagnosestellung.
- Komorbiditäten?
- Evaluation z. B. anhand des HCT-CI-Scores
Klinische Untersuchung
- Häufig ein erheblich geschwächter Allgemeinzustand
- Quantifizierung nach (ECOG-Performancestatus)
- Anämische Blässe
- Hautblutungen
- Petechien
- Ekchymosen
- Hämatome
- Anhaltende Infektionen
- Lymphknotenschwellung
- Moderate Hepatosplenomegalie
- Evtl. Schleimhautulzera, z. B. Aphthen
- Schmerzempfindlichkeit bei der Palpation von Knochen, insbesondere Sternum und Tibia
Ergänzende Untersuchungen in der Hausarztpraxis
- Blutbild und Differenzialblutbild
- Evtl. erhöhte BSG, Harnsäure und LDH
- Gerinnung (Anzeichen von Verbrauchskoagulopathie DIC?)
- Urinstatus
- Ggf. Schwangerschaftstest
- Hepatitis (HBV, HCV)- und HIV-Serologie
- Röntgen-Thorax
- EKG
- Herz-Echo
- Lungenfunktion
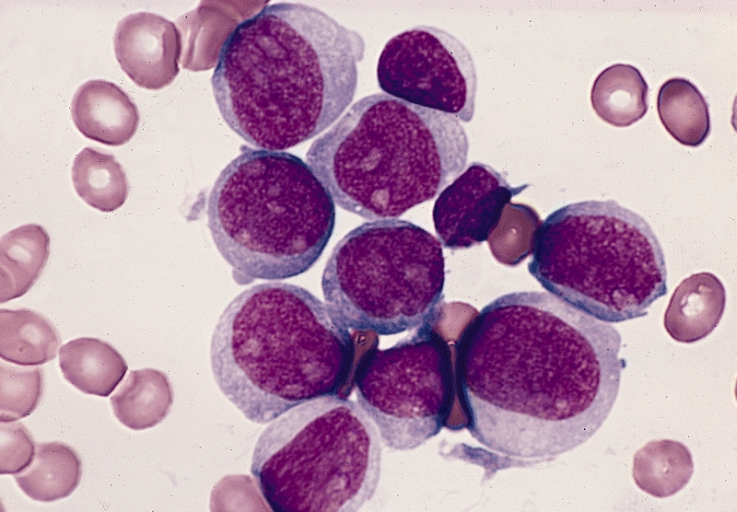
Blutausstrich
- Dominanz von leukozytären Progenitorzellen gleichartiger Morphologie – leukämischen Blasten – mit Auerstäbchen
- eosinophile nadelähnliche Einschlüsse im Zytoplasma
- pathognomonisch für AML
- bei 20–30 % der Patient*innen vorhanden
Diagnostik bei Spezialist*innen
Knochenmarkausstrich bei Hämatoonkolog*in
- Hyperzellulär und von Blasten dominiert (> 20 %)
- Histochemische Färbemethoden können bestätigen, dass die Leukämie von myeloiden Zellen herrührt, z. B. Peroxidasefärbung.
- Klassifikation nach WHO anhand zytogenetischer und molekulargenetischer Untersuchungen
Leitlinie: Sicherung der Diagnose AML2
- Anamnese und körperlicher Untersuchungsbefund
- Blutbild und Differenzialblutbild
- Knochenmarkzytologie und -zytochemie
- Knochenmarkbiopsie (zwingend notwendig bei Punctio sicca)
- Immunphänotypisierung
- Zytogenetik
- FISH
- Wenn die zytogenetische Analyse nicht erfolgreich ist, dann Nachweis von:
- Translokationen wie RUNX1-RUNX1T1, CBFB-MYH11, KMT2A (MLL), EVI1
- Verlust von Chromosom 5q, 7q oder 17p.
- Molekulargenetik (Mutationen)
- NPM1
- CEBPA
- RUNX1
- FLT3 (interne Tandemduplikationen (ITD), Mutant-Wildtyp-Quotient)
- TKD (Kodon D853 und I836)
- TP53
- ASXL1
- Molekulargenetik (Genumlagerungen)
- PML-RARA
- CBFB-MYH11
- RUNX1-RUNX1T1
- BCR-ABL1
- Vor allogener Stammzelltransplantation
- HLA-Typisierung (ggf. auch der Geschwister)
- CMV-Status
Weitere Untersuchungen
- Bildgebende Diagnostik ist in den meisten Fällen nicht notwendig.
- CT und MRT sind bei klinischem Verdacht auf extramedulläre Manifestationen indiziert.
Indikationen zur Überweisung
- Bei Verdacht auf akute Leukämie sind die Betroffenen unverzüglich an ein hämatoonkologisches Zentrum zu überweisen.
- Alarmsymptome
- neu entstandene spontane Blutungsneigung
- Anämie
- Gewichtsabnahme
- rezidivierende Infektionen
- Anämie zusammen mit Leukopenie und Thrombozytopenie
Therapie
Therapieziele
- Die Voraussetzung für eine Heilung oder für ein wesentlich verbessertes Überleben ist das Erreichen einer möglichst umfassenden, kompletten Remission.1,7 Dabei gelten folgende Remissionskriterien:2
- morphologisch leukämiefreier Zustand (MLFS)
-
Blasten in Knochenmark < 5 %
- Abwesenheit von Auerstäbchen und extramedullären Manifestationen
- keine Blasten im peripheren Blut
-
- morphologische komplette Remission (CR)
-
Blasten in Knochenmark < 5 %
- Abwesenheit von Auerstäbchen und extramedullären Manifestationen
- Neutrophile ≥ 1.000/µl und Thrombozyten ≥ 100.000/µl
- keine Blasten im peripheren Blut
-
- morphologische komplette Remission mit inkompletter Regeneration (CRi/CRp)
-
Blasten in Knochenmark < 5 %
- Abwesenheit von Auerstäbchen und extramedullären Manifestationen
- Neutrophile < 1.000/µl (CRi) und/oder Thrombozyten < 100.000/µl (CRp)
- keine Blasten im peripheren Blut
-
- zytogenetische komplette Remission (CRc)
-
CR mit Abwesenheit einer bei Erstdiagnose nachweisbaren zytogenetischen Aberration
-
- molekulare komplette Remission (CRm)
-
CR mit Abwesenheit einer bei Erstdiagnose nachweisbaren molekularen Veränderung
-
- komplette Remission mit partieller hämatologischer Regeneration (CRh)
- Blasten in Knochenmark < 5 %
- Abwesenheit von Auerstäbchen und extramedullären Manifestationen
- Neutrophile ≥ 500/µl und Thrombozyten ≥ 50.000/µl
- keine Blasten im peripheren Blut
- partielle Remission (PR)
-
Reduktion der Blasten im Knochenmark auf 5–25 %
- Neutrophile ≥ 1.000/µl und Thrombozyten ≥ 100.000/µl
- keine Blasten im peripheren Blut
-
- Rezidiv aus CR
-
Anstieg der Blasten im Knochenmark auf ≥ 5 % oder Blasten im peripheren Blut, die nicht mit reaktiver Blutbildregeneration erklärbar sind, oder
- extramedulläre AML-Manifestation.
-
- morphologisch leukämiefreier Zustand (MLFS)
Therapieplanung
- Partizipative Entscheidungsfindung mit den Patient*innen
- Risikoadaptiert
- Nach biologischem Alter (Fitness) der Patient*innen und Komorbidität
- Unterschiedliche Protokolle für verschiedene AML-Gruppen
- Viele neuere Therapien sind in der Erprobungsphase.
- Behandlung im Rahmen von Studien ist oft sinnvoll.
- Grundsätzliche Abfolge:
- Induktionstherapie
- Konsolidierungstherapie
- Reinduktionstherapie
- remissionserhaltende Chemotherapie.
- Ca. 60–80 % der Patient*innen, die eine Induktionsbehandlung erhalten, kommen in Remission. Die 5-Jahres-Rezidivfreiheit liegt bei ca. 30–40 %.
- Neudiagnostizierte AML-Patient*innen sollten zur Einschätzung der optimalen Behandlungsstrategie an einem erfahrenen Therapiezentrum vorgestellt werden.2
Primärbehandlung jüngerer Patient*innen
- Dieser Altersgruppe werden Patient*innen zugeordnet, die ein biologisches Alter unter 60–65 Jahre haben und keine oder wenige Komorbiditäten aufweisen.2
- Die Behandlung besteht aus zwei Phasen: Induktionsbehandlung und Konsolidierungsbehandlung.4
Induktionschemotherapie
- Sollte sobald als möglich nach Diagnosesicherung beginnen.2
- Eine Therapieverzögerung von mehr als 5 Tagen führt bei jüngeren AML-Patient*innen zu einer deutlichen Verschlechterung der Prognose und des Therapieergebnisses.18
- Standardkombination (3+7 Schema)2
- Cytarabin-Infusion (Ara-C) über 7 Tage – und –
- 3-tägige Behandlung mit einem Anthrazyklin/Anthracendion, z. B.:
- Daunorubicin
- Idarubicin
- Mitoxantron.
- Die Behandlung führt zu einer potenziell lebensbedrohlichen Granulozytopenie, Thrombozytopenie und Knochenmarkaplasie über die Dauer von 2–4 Wochen.
- Während dieser Zeit sind Erythrozyten- und Thrombozytentransfusionen erforderlich, um Blutungen zu verhindern.
- Zur Verhinderung von Infektionen wird ein Breitspektrum-Antibiotikum eingesetzt.
- Viele Betroffene benötigen eine parenterale Ernährung.
Konsolidierungstherapie (Postremissionstherapie)2
- Alle Patient*innen benötigen eine konsolidierende Behandlung, sobald eine komplette Remission erreicht wurde, da ansonsten ein schnelles Rezidiv der AML zu erwarten ist.
- Die Konsolidierungstherapie kann mit hochdosiertem Cytarabin oder einer allogenen Blutstammzelltransplantation erfolgen.
- Die Wahl der Konsolidierungstherapie orientiert sich am Risikoprofil der AML und dem Allgemeinzustand der Patient*innen.
- Die myeloablative Hochdosischemotherapie mit autologer Transplantation weist eine ähnlich niedrige therapieassoziierte Mortalität auf wie hochdosiertes Cytarabin und wird vereinzelt als alternative Konsolidierungsoption eingesetzt.
- Das Rezidivrisiko ist gegenüber der allogenen Transplantation jedoch deutlich erhöht, und eine Überlegenheit im Gesamtüberleben gegenüber hochdosiertem Cytarabin konnte bislang nicht gezeigt werden.
- Chemokonsolidierung mit Cytarabin
- Außerhalb von Studien sollten Patient*innen mit zytogenetisch günstigem Risiko, d. h. t(8;21) oder inv(16) eine Chemokonsolidierung mit hochdosiertem Cytarabin (HDAC) erhalten, da für sie auf diese Weise mit hoher Wahrscheinlichkeit eine Langzeitremission erreicht werden kann.
- Dies gilt auch für Patient*innen mit Normalkaryotyp und NPM1-Mutation ohne begleitende FLT3-ITD-Mutation.
- Die Erkrankung dieser Patient*innen kann durch Messung der minimalen Resterkrankung (MRD) anhand von mutiertem NPM1 monitoriert und bei molekularem Rezidiv einem Salvage(„Rettungs“)-Konzept, idealerweise unter Einbeziehung einer allogenen Stammzelltransplantation, zugeführt werden.
- Allogene Blutstammzelltransplantation (SZT)
-
Patient*innen mit ungünstiger Zyto- oder Molekulargenetik (ASXL-1, TP53, RUNX1) oder einer FLT3-ITD-Mutation mit hoher Mutationslast haben ein hohes Rezidivrisiko und sollten als Postremissionstherapie eine allogene SZT erhalten.
-
Da die Transplantationsergebnisse vom Krankheitsrisiko, dem Transplantationsrisiko und von Begleiterkrankungen abhängen, sollten diese Patient*innen, auch bei reduziertem Allgemeinzustand oder bei Begleiterkrankungen, frühzeitig an einem Transplantationszentrum vorgestellt werden, um diese Indikationsstellung gemeinsam mit dem Transplantationsteam vornehmen zu können.
- Stammzelltransplantationen haben Nebenwirkungen mit einem prozessbedingtem Mortalitätsrisiko von 15–20 % bei jüngeren Patient*innen in der ersten Remission – das ist höher als die Sterblichkeit bei intensiver Chemotherapie.
- Das individuelle Mortalitätsrisiko wird anhand eines Scoring-Systems berechnet, das Komorbidität, Alter und Spendertyp berücksichtigt.
- Bei Patient*innen mit intermediärem zytogenetischem Risiko und fehlenden günstigen molekularen Markern (NPM1, CEBPAdm) sollte außerhalb von Studien bei Vorhandensein eines HLA-identischen Geschwister- oder HLA-identischen Fremdspenders eine allogene SZT angestrebt werden.
- Patient*innen ohne Spender*in, mit signifikanten Komorbiditäten oder schlechtem klinischem Zustand sollen, wenn möglich, eine Chemokonsolidierung mit 2–3 Zyklen hoch dosiertem Cytarabin erhalten.
- Alternativ ist bei geeigneten Patient*innen ohne HLA-identischem Spender auch eine allogene Stammzelltransplantation mit einer HLA-haploidentischen familiären Spender*in zu erwägen.
- Stammzellspender*in und -empfänger*in sollten vor Transplantation gegen Hepatitis B, Hib und Pneumokokken geimpft werden.19
-
- Erhaltungstherapie
- Nach einer Induktionstherapie, die Hochdosis-Ara-C beinhaltet, kann eine monatliche myelosuppressive Erhaltungstherapie über bis zu 3 Jahre im Vergleich zu anderen Formen der Konsolidierung gleichwertige Therapieergebnisse erzielen, wobei allerdings eine deutlich längere Therapiedauer resultiert.
-
Eine mögliche Standardchemotherapie für jüngere Patient*innen außerhalb von Studien stellt das adaptierte CALGB-Protokoll (4 fünftägige Zyklen hoch dosiertes Cytarabin gefolgt von 4 monatlichen Zyklen Daunorubicin und Cytarabin) dar.
Ältere fitte Patient*innen
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Dieser Altersgruppe werden Patient*innen zugeordnet, die ein biologisches Alter über 60–65 Jahre haben und keine oder wenige Komorbiditäten aufweisen.
- Da sowohl Remissionsraten als auch Langzeitremissionen mit zunehmendem Alter abnehmen und gleichzeitig das Risiko therapieassoziierter Komplikationen steigt, sollten Chancen und Risiken in der Altersgruppe besonders gründlich abgewogen und mit den Patient*innen besprochen werden.
- Dabei kann eine Abschätzung der individuellen CR-Wahrscheinlichkeit und des Frühmortalitätsrisikos anhand von Scores hilfreich sein, z. B. www.aml-score.org und der genetischen Risikokonstellation.
- Auch Patient*innen höheren Alters können durch eine intensive Therapie Langzeitremissionen erreichen.
- Älteren Patient*innen mit einem biologischen Alter jenseits 75 Jahren und/oder mit signifikanten Komorbiditäten sollte angesichts hoher Toxizität und Frühsterblichkeit bei einer Chance von nur etwa 10 % auf eine Langzeitremission keine intensive, kurativ intendierte Therapie angeboten werden. Ziel einer Therapie ist die Lebensverlängerung mit möglichst guter Lebensqualität.
- Bei folgenden Konstellationen sollte eher eine palliative Therapie mit zytoreduktiver, ambulanter Chemotherapie oder bestmöglicher supportiver Therapie erwogen werden, weil die zu erwartenden Komplikationen einer intensiven Therapie einen möglichen Nutzen übersteigen:
- biologisches Alter > 75 Jahre
- Komorbiditäten
- diabetisches Spätsyndrom
- Leber- oder Nierenerkrankungen
- Herzinsuffizienz (EF < 30 %)
- ECOG ≥ 3
- keine intensive Chemotherapie gewünscht
- ungünstige soziale Situation
- geringe Heilungschancen, hohes Risiko für Frühsterblichkeit unter Induktion.
- Alle übrigen Patient*innen sollten für eine intensive kurativ intendierte Therapie evaluiert werden.
Induktionstherapie
- Analog zur Therapie jüngerer Patient*innen verläuft eine Standardtherapie bei Patient*innen über 60 Jahren wie folgt:
- Die Induktion wird mit einem Zyklus des 3+7-Schemas durchgeführt (siehe Abschnitt Induktionsschemotherapie).
- Ein zweiter Zyklus kommt optional zum Einsatz, wenn in der Knochenmarkspunktion an Tag 15 noch 5 % oder mehr Blasten nachweisbar sind.
Konsolidierungstherapie (Postremissionstherapie)
- Bei älteren Patient*innen ist auch die Abwägung bezüglich Dauer und Art der Konsolidierungstherapie von entscheidender Bedeutung.
- Chemokonsolidierung mit Cytarabin bei älteren, fitten Patient*innen
- Außerhalb von Studien sollten Patient*innen mit zytogenetisch günstigem Risiko, d. h. t(8;21) oder inv(16) eine Chemokonsolidierung mit Cytarabin erhalten, da für sie auf diese Weise mit hoher Wahrscheinlichkeit eine Langzeitremission erreicht werden kann.
- Da Cytarabin in der älteren Patientengruppe mit einer hohen Toxizität einhergeht, kommt zur besseren Verträglichkeit bei älteren Patient*innen intermediär dosiertes Cytarabin zum Einsatz.
- Allogene Blutstammzelltransplantation (SZT)
- Ältere fitte Patient*innen ohne t(8;21) oder inv(16), die nach Induktionstherapie eine CR erreicht haben, sollten die Möglichkeit einer allogenen SZT nach dosisreduzierter Konditionierung erhalten, da hierbei Langzeitremissionen um 30 % erreicht werden können, selbst bei Vorliegen eines HLA-Mismatches.
Ältere Patient*innen ohne intensive Therapiemöglichkeit
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Patient*innen
- mit einem biologischen Alter über 75 Jahre – oder –
- mit signifikanten Komorbiditäten wie
- diabetisches Spätsyndrom
- Lebererkrankungen
- Nierenerkrankungen
- Herzinsuffizienz (EF < 30 %)
- ECOG ≥ 3 – oder –
- geringen Heilungschancen aufgrund ungünstiger Zytogenetik (unfit, fragil oder gebrechlich).
- Bei diesen Patient*innen besteht das therapeutische Ziel in einer Lebensverlängerung bei möglichst hoher Lebensqualität.
- Neben einer bestmöglichen supportiven Therapie (siehe Abschnitt Supportive Therapie) soll diesen Patient*innen eine zytoreduktive ambulante Chemotherapie angeboten werden.
- Neben einer rein symptomatischen Gabe von Hydroxyurea zur Senkung der Leukozytenzahl werden die hypomethylierenden Substanzen (HMA) 5-Azacitidin und Decitabin empfohlen, da sie gegenüber dem historischen Standard von niedrigdosiertem Cytarabin höhere Ansprechraten und eine Überlebensverlängerung bewirken können.
- Aufgrund des Wirkmechanismus der HMA kann es zu einem verzögerten Ansprechen kommen, sodass eine Wirksamkeitsbeurteilung erst nach 3–4 Monaten empfehlenswert ist.
- Die Therapie sollte alle 4 Wochen bis zum Progress verabreicht werden, da nach Absetzen rasch Rezidive auftreten.
- Bei Kontraindikationen gegen HMA oder bei progredienter Erkrankung kann alternativ niedrigdosiertes Cytarabin (LDAC) eingesetzt werden. LDAC hat in dieser Situation eine höhere Wirksamkeit als Hydroxyrea.
- Neben einer rein symptomatischen Gabe von Hydroxyurea zur Senkung der Leukozytenzahl werden die hypomethylierenden Substanzen (HMA) 5-Azacitidin und Decitabin empfohlen, da sie gegenüber dem historischen Standard von niedrigdosiertem Cytarabin höhere Ansprechraten und eine Überlebensverlängerung bewirken können.
- Die Behandlung soll nach Möglichkeit im häuslichen Umfeld der Patient*innen erfolgen.20
Rezidivtherapie
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Es gibt keine prospektiven, kontrollierten Studien zur Überlegenheit einer definierten Therapiestrategie im Rezidiv der AML.
- Allgemeiner Konsens ist jedoch die Durchführung einer remissionsinduzierenden Reinduktionstherapie21, die intermediär oder hoch dosiertes Ara-C einschließt.
- Für die Konsolidierung ist die allogene Stammzelltransplantation die Therapie der Wahl.
- Sollten weder HLA-idente Familienspender*innen noch Fremdspender*innen vorhanden sein, kann auch auf alternative Stammzellquellen, wie Nabelschnurblut oder haploidente Transplantate zurückgegriffen werden.
- Im Rezidiv nach allogener SZT kann bei chemosensitiver Erkrankung in Einzelfällen eine erneute SZT erwogen werden.
- Patient*innen mit Rezidiv, die für eine intensive Salvage-Therapie nicht geeignet sind, können mit HMA behandelt werden.
Supportive Therapie
- Der gesamte Abschnitt basiert auf dieser Referenz.2
- Eine bestmögliche supportive Therapie trägt bei AML erheblich zu einer Verbesserung der Prognose sowie der Lebensqualität der betroffenen Person bei. Dazu gehören u. a.:
- Therapie und Prophylaxe von Infektionen bei immunsupprimierten und stammzelltransplantierten Patient*innen
- ggf. Transfusionen
- Antiemese
- Therapie gastrointestinaler Komplikationen.
- Fatigue, chronische Müdigkeit 21
- subjektives Gefühl von erhöhter Ermüdbarkeit und eingeschränkter Funktionskapazität; selbst nach Ruhe und Schlaf keine Besserung
- besonders häufig bei Patient*innen nach einer Strahlentherapie oder Zytostatika-Behandlung
- Wird von vielen Krebspatient*innen als die am meisten belastenden behandlungsbedingten Beschwerden bezeichnet.
- Behandlung
- Aufklärung über den Krankheitsverlauf, ggf. begleitende Psychotherapie
- Ein leichtes und individuelles Trainingsprogramm ist empfehlenswert.
Palliativbehandlung
- Symptomlindernde Behandlung, z. B.:20-21
- Fatigue
- Gewichtsverlust
- Übelkeit und Erbrechen
- Obstipation
- orale Beschwerden, z. B. Mundtrockenheit
- Atembeschwerden
- sexuelle Funktionsstörungen.
- Wiederherstellung physischer und psychischer Vitalität, z. B. Behandlung von:
- Wiederbefähigung zur Teilhabe am normalen gesellschaftlichen Leben
- Soweit die Patient*innen noch im Berufsleben stehen: Erhalt oder Wiederherstellung der Erwerbsfähigkeit (Rehabilitation).
- Auch in der nicht-kurativen Situation sollten rehabilitative Maßnahmen symptomorientiert empfohlen werden.
Besondere Situationen
- Akute Promyelozyten-Leukämie (APL)22
- Wird nach WHO-Klassifikation (siehe Abschnitt WHO-Klassifikation) den akuten myeloischen Leukämien mit wiederkehrenden zytogenetischen Anomalien zugeordnet (bisher als AML FAB M3 klassifiziert).
- in Deutschland ca. 5 % aller Fälle von AML bei Erwachsenen
- höhere Inzidenz in Italien, Spanien, Nord-, Mittel- und Südamerika
- diagnostisch beweisend: Nachweis der APL-spezifischen Chromosomentranslokation t(15;17) (q22;q21) oder des Fusionsgens PML/RARA
- meist hypergranulär mit Leukozytopenie
- in 5–10 % der Fälle: mikrogranuläre Variante mit Leukozytose
- Wird in der Regel von einer nichtkompensierten intravaskulären Gerinnung mit schwerer und rasch progredienter Blutungstendenz kompliziert.
- hohes Risiko für lebensgefährliche intrazerebrale Blutungen sowie Blutungen in Haut und Schleimhäute, Gastrointestinaltrakt und Lunge
- Wie bei allen anderen Formen von akuter Leukämie können auch die Symptome der Panzytopenie im Vordergrund stehen.
- häufig Symptome von Anämie und Neutropenie (s. o.)
- Selten thromboembolische Komplikationen, die auch große venöse Gefäße betreffen können.
- Es ist wichtig, die Erkrankung schnell zu diagnostizieren, da die Prognose gut sein kann, wenn die Induktionstherapie früh zum Einsatz kommt.
- Bei APL mit Standardrisiko (Leukozyten ≤ 10.000/µl) ist die Kombination des Vitamin-A-Derivats All-Trans-Retinsäure (ATRA) mit Arsentrioxid (ATO) mittlerweile Standard, sowohl im Erwachsenenalter22 als auch bei Kindern und Jugendlichen9 (Stand April 2020).
- Nur bei APL mit hohem Risiko ist weiterhin die früher als Standardtherapie geltende Kombination ATRA + Anthrazyklin + Ara-C angezeigt.
- Auf die Induktionstherapie folgt eine Konsolidierungschemotherapie sowie bei APL mit hohem Risiko eine 2-jährige Erhaltungstherapie.
- Monoblastenleukämie, häufig mit Hyperleukozytose (AML-Blasten > 50–100 x 109 im peripheren Blut)
- Isoliertes Myelosarkom
- intensive Zytostatika-Behandlung, evtl. kombiniert mit Strahlenbehandlung
- evtl. allogene Stammzelltransplantation
- ZNS-Leukämie
- intrathekale Zytostatika-Behandlung (Methotrexat)
Verlauf, Komplikationen und Prognose
Verlauf
- Oft subakute oder akute Erstmanifestation
- Progressionsgeschwindigkeiten variieren.
- Ca. 60–80 % der Patient*innen, die eine Induktionsbehandlung erhalten, kommen in Remission.
- je jünger die Patient*innen desto höher die Remissionschancen
- Ca. 50 % aller Patient*innen bekommen ein Rezidiv; die meisten davon innerhalb von 2–3 Jahren nach erreichter Remission.
- Das Rezidivrisiko liegt unter 35 % bei Patient*innen in der besten Prognosegruppe und über 70–80 % in der schlechtesten Prognosegruppe.
- Die Prognosegruppe ist abhängig vom Alter, dem zytogenetischen Befund und den Begleiterkrankungen.
- Tritt ein Rezidiv nach abgeschlossener Konsolidierungsbehandlung auf, ist das mit einer besseren Prognose assoziiert als ein Rezidiv unter laufender Konsolidierungsbehandlung.
- Eine neue Remission kann dann in 30–50 % der Fälle erreicht werden.
- Je länger die erste Remission angehalten hat, desto besser sind die Chancen auf eine erneute Remission.
Komplikationen
- Lebensbedrohliche Infektionen oder Blutungen
- Fertilität
- Kann nach Zytostikabehandlung vermindert sein.
- bei Patient*innen im reproduktionsfähigen Alter: ggf. fertilitätserhaltende Maßnahmen (Gefrierkonservierung von Samenzellen oder befruchteten Eizellen)
- Spätschäden: Fatigue, chronische Müdigkeit (siehe Abschnitt Supportive Therapie)
Prognose
- Die Behandlung führt bei den meisten Patient*innen zu einer primären Remission.
- bei 70–80 % aller Erwachsenen unter 60 Jahren, bei ca. 50 % über 60 Jahre
- Die Prognose bei über 60-Jährigen ist schlechter als bei jüngeren Patient*innen.
- häufiger ungünstige zytogenetischen Abberationen
- häufigere Therapieresistenz
- höherer Anteil sekundärer oder behandlungsbedingter AML23
- höhere Komorbidität
- oft schlechterer Allgemeinzustand
- Das 4-Jahres-Überleben bei AML ist abhängig vom jeweiligen Typ und von der jeweiligen Risikogruppe.
- bei akuter Promyelozyten-Leukämie: 94 %
- bei einer anderen akuten myeloischen Leukämie mit Niedrig-Risiko: 77 %
- bei mittlerem Risiko: 39 %
- bei Hochrisiko-Patient*innen: 29 %
Verlaufskontrolle
Während der Behandlung bei Hämatoonkolog*in
- In manchen Fällen übernehmen Hausärzt*innen einige Aufgaben zwischen den Zyklen.
- In solchen Fällen ist zusammen mit den Patient*innen ein Plan über den Verlauf der Kontrollen festzulegen.
- aktuelle Problemstellungen
- Diagnostizierung interkurrenter Erkrankungen
- Kontrolle der Blutwerte
- Bei Problemen wie Blutbildveränderungen sollte Rücksprache mit den behandelnden Hämatoonkolog*innen oder der Klinik gehalten werden.
Infektionsüberwachung
- Neutropenes Fieber
- Fieber über 38 °C und Leukozyten < 1.000/µl oder Neutrophile < 500/µl
- Patient*innen ins Krankenhaus einweisen.
- In der palliativen Phase kann es zuweilen angebracht sein, die Patient*innen bei derartigen Infektionen mit peroralen Antibiotika zu Hause zu behandeln.
- Neutropenie ohne Fieber oder Infektionssymptome sind engmaschig zu beobachten.
- Eine CRP-Erhöhung ist oft durch eine bakterielle Infektion verursacht (und nicht durch erhöhte Aktivität der Leukämiezellen).
Zentraler Venenkatheter
- Den Patient*innen wird oft ein zentraler Venenkatheter (ZVK, Hickman) für Probenahmen, Transfusionen und medikamentöse Behandlung gelegt.
- Das Öffnen und Schließen dieser Katheter ist ausschließlich von Pflegekräften auszuführen, die darin geübt sind und das Verfahren kennen (Gefahr von Luftembolie und Infektionen).
- Periphere Vene für Blutproben und evtl. Behandlung verwenden, falls eine kompetente Anwendung von ZVK nicht möglich ist.
Andere Problemstellungen
- Transfusionsbedarf: Symptomgrad beurteilen.
- Bei Hb < 8 g/dl (< 5 mmol/l) oder Thrombozyten < 10.000/µl ist eine evtl. Transfusion mit den behandelnden Hämatolog*innen zu besprechen.
- Antikoagulationsbehandlung
- Thrombozytopenie in der Folge von Behandlung oder Erkrankung führt zu erhöhtem Blutungsrisiko.
- Bei Thrombozyten < 50.000/µl ist eine Dosisreduzierung mit dem Hämatologen zu besprechen.
- Oft ist der Wechsel von peroraler Antikoagulation zu niedrigmolekularem Heparin (reduzierte Dosis) indiziert, ebenso das Absetzen in Phasen mit erheblicher Thrombozytopenie.
Nach Abschluss der Behandlung in der Klinik/bei Hämatolog*in
- Impfungen sind indiziert nach individueller Absprache mit dem behandelnden Zentrum. SZT geht mit tiefgreifender passagerer humoraler und zellulärer Immundefizienz einher. Bestehende Antikörperkonzentrationen gehen nach SZT rapide zurück. Daher ist die Wiederholung von Impfungen nach SZT sinnvoll.19
- Bei allogener SZT ist in der Regel nur eine vorübergehende Immunsuppression erforderlich. Bei regelrechtem Verlauf wird erwartet, dass die Patient*innen nach 1–2 Jahren über ein funktionsfähiges Immunsystem verfügen.
- Totimpfstoffe
- Unbedenklich, aber eingeschränkte Immunantwort direkt nach Transplantation, daher ggf. mehrfache Impfung nach Transplantation mit Kontrolle des Impferfolges sowie Booster nach 1 Jahr.
- Lebendimpfstoffe
- Zurzeit liegen keine hinreichenden Daten für die Verimpfung von Lebendimpfstoffen bei dieser Patientengruppe vor.
- Entsprechend den Vorschlägen der Fachgesellschaften sollen Lebendimpfungen frühestens 2 Jahre nach einer Stammzelltransplantation und in Abwesenheit einer immunsuppressiven Therapie oder aktiven chronischen Graft-versus-host-Reaktion sowie bei ausreichender Lymphozytenzahl (> 1.500/μl) geplant werden.
- ab 6 Monate nach SZT empfohlen
- jährliche Influenza-Impfung
- 1 Jahr nach SZT empfohlen
- DTPa-IPV (Diphtherie, Tetanus, Pertussis, inaktivierte Polioviren): 3 Impfungen
- Hib: 3 Impfungen
- Pneumokokken: 1- bis 2-mal Konjugat-Impfstoff, dann 23-valenter Polysaccharid-Impfstoff
- kontraindiziert: VZV-Impfung
- Nachsorge und Behandlung von Fatigue/chronischer Müdigkeit21 (siehe Abschnitt Supportive Therapie)
- Nach allogener Stammzelltransplantation
- Überwachung auf ein evtl. Rezidiv der Erkrankung
- Diagnostik von chronischer Transplantat-gegen-Wirt-Reaktion (Graft-versus-Host-Disease)
- Diagnostik von Spätschäden
Patienteninformationen
Patienteninformationen in Deximed
- Akute myeloische Leukämie
- Akute myeloische Leukämie, Diagnose
- Chemotherapie mit Zytostatika
- Essen bei Appetitlosigkeit
Lindernde Behandlung bei fortgeschrittener Krebserkrankung
- Palliativmedizin
- Angst
- Schmerzbehandlung
- Übelkeit und Erbrechen
- Verstopfung
- Mundtrockenheit
- Gewichtsverlust
- Depression
- Delir
Illustrationen
Quellen
Leitlinien
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie (DGHO). Leitlinien Akute Myeloische Leukämie (AML). Stand Oktober 2019. www.onkopedia.com
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie (DGHO). Leitlinien Akute Promyelozyten Leukämie (APL). Stand Januar 2018. www.onkopedia.com
- European Society for Medical Oncology. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Stand 2020. www.esmo.org
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Acute Myeloid Leukemia, Stand 2014. www.nccn.org
- Gesellschaft für Pädiatrische Onkologie und Hämatologie. Akute myeloische Leukämie – AML – im Kindes- und Jugendalter. AWMF-Leitlinie Nr. 025–031. S1, Stand 2019. www.awmf.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL. S3, Stand 2014. www.awmf.org
Literatur
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Acute Myeloid Leukemia, Stand 2014. www.nccn.org
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie (DGHO). Leitlinien Akute Myeloische Leukämie (AML). Stand Oktober 2019. www.onkopedia.com
- Estey E, Döhner H. Acute myeloid leukaemia. Lancet 2006; 368: 1894-907. PubMed
- Raj K, Mehta P. Acute myelogenous leukaemia. BMJ Best Practice, last updated Jan, 2016. bestpractice.bmj.com
- Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009;114:937-951. PubMed
- Juliusson G, Antunovic P, Derolf A, et al.: Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry. Blood 113:4179-4187, 2009. DOI:10.1182/blood-2008-07-172007 DOI
- European Society for Medical Oncology. Acute myeloblastic leukaemias in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Stand 2020. www.esmo.org
- Youn BS, Mantel C, Broxmeyer HE. Chemokines, chemokine receptors and hematopoiesis. Immunol Rev. 2000;177:150-174. PubMed
- Gesellschaft für Pädiatrische Onkologie und Hämatologie. Akute myeloische Leukämie - AML - im Kindes- und Jugendalter. AWMF-Leitlinie Nr. 025–031, Klasse S1, Stand 2019. www.awmf.org
- Cardi E, Gilbert FS, Carpenter L, et al. Effects of low doses of and low dose rates of external ionizing radiation: cancer mortality among nuclear industry workers in three countries. Radiat Res 1995; 142: 117-32. PubMed
- Wikipedia. Begasungsmittel. Stand 21.01.2017; letzter Zugriff 29.06.2017 de.wikipedia.org
- Fircanis S, Merriam P, Khan N, Castillo JJ: The relation between cigarette smoking and risk of acute myeloid leukemia: an updated meta-analysis of epidemiological studies. Am J Hematol 89:E125-132, DOI:10.1002/ajh.23744 DOI
- Smith SM, Le Beau MM, Huo D, et al. Clinical-cytogentic associations in 306 patients with therapy-related myelodysplasia or myeloid leukemia: the University of Chicago series. Blood 2003; 102: 43-52. www.ncbi.nlm.nih.gov
- Kelly LM, Gilliland DG. Genetics of myeloid leukemias. Annu Rev Genomics Hum Genet 2002; 3: 179-98. PubMed
- Fröhling S, Scholl C, Gilliland DG, Levine RL. Genetics of myeloid malignancies - pathogenetic and clinical implications. J Clin Oncol 2005; 23: 6285-95. PubMed
- Arber DA, Orazi A, Hasserjian R et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 127:2391-2405, 2016. DOI:10.1182/blood-2016-03-643544 DOI
- Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H et al., red. WHO classification of tumours of haematopoietic and lymphoid tissue. 4 utg. Lyon: IARC; 2008. www.ncbi.nlm.nih.gov
- Sekeres MA, Elson P, Kalaycio ME et al.: Time from diagnosis to treatment initiation predicts survival in younger, but not older, acute myeloid leukemia patients. Blood 113:28-36, 2009. DOI:10.1182/blood-2008-05-157065 DOI
- Robert-Koch-Institut. Mitteilung der Ständigen Impfkommission (STIKO) am Robert Koch-Institut: Hinweise zu Impfungen für Patienten mit Immundefizienz. Epidemiologisches Bulletin 11/2005. www.rki.de
- Deutsche Gesellschaft für Palliativmedizin. Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL, Stand 2015. www.awmf.org
- Deutsche Krebsgesellschaft.Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL, Stand 2014. www.awmf.org
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie (DGHO). Leitlinien Akute Promyelozyten Leukämie (APL). Stand Januar 2018. www.onkopedia.com
- Leone G, Pagano L, Ben-Yehuda D, et al. Therapy-related leukemia and myelodysplasia: susceptibility and incidence. Haematologica. 2007;92:1389-1398. PubMed
Autor*innen
- Thomas M. Heim, Dr. med., Wissenschaftsjournalist, Freiburg
- Dirk Nonhoff, Dr. med., Facharzt für Allgemeinmedizin, Köln
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).