Zusammenfassung
- Definition:Chronische (Dauer > 3 Monate) pathologische Veränderungen von Nierenstruktur oder -funktion mit Auswirkungen auf den Gesundheitszustand.
- Häufigkeit:In Deutschland sind ca. 2 Mio. Menschen betroffen, zunehmende Prävalenz mit dem Alter (jede 8. Person in der Altersgruppe 70–79 Jahre). Nur bei einer Minderheit der Betroffenen ist die Erkrankung bekannt und in Behandlung.
- Symptome:In den frühen Stadien wenig symptomatisch bzw. unspezifische Symptome wie Leistungsminderung, Müdigkeit. Bei fortgeschrittener Erkrankung Blässe, Übelkeit, Ödeme, Dyspnoe, Knochenschmerzen, Juckreiz, Restless Legs.
- Befunde:Hypertonie, blasses Hautkolorit, Foetor, Ödeme, Perikarditis/Pleuritis.
- Diagnostik:Diagnose erfolgt durch 1. Nachweis eines strukturellen Nierenschadens (vor allem Erfassung einer Albuminurie) und/oder 2. Nachweis einer eingeschränkten Nierenfunktion (eGFR < 60 ml/min/1,73 m2).
- Therapie:Allgemeinmaßnahmen wie begrenzte Salzzufuhr, Rauchstopp. Falls indiziert, medikamentöse Behandlung der kardiovaskulären Risikofaktoren. Blockade des Renin-Angiotensin-Systems zur Verbesserung der Proteinurie. Ggf. Behandlung von Azidose, Anämie und Mineralstoffwechselstörungen. Bei terminaler Niereninsuffizienz Dialyse oder Nierentransplantation.
Allgemeine Informationen
Definition
- Definition der chronischen Nierenkrankheit (Chronic Kidney Disease = CKD)1
- pathologische Veränderungen von Nierenstruktur oder Nierenfunktion
- Dauer > 3 Monate
- Auswirkungen auf den Gesundheitszustand
- Kriterien einer chronischen Nierenkrankheit (eines der folgenden Kriterien für > 3 Monate)
- Marker eines Nierenschadens (1 oder mehrere)
- Albuminurie: ≥ 30 mg/24 h bzw. Albumin-Kreatinin-Quotient (ACR) ≥ 30 mg/g (≥ 3 mg/mmol)
- pathologisches Urinsediment
- Elektrolytstörungen und andere pathologische Veränderungen infolge von Tubulopathien
- histologische Nierenschäden
- Nachweis pathologischer Nierenveränderungen durch bildgebende Verfahren
- Z. n. Nierentransplantation
- Verminderung der GFR (< 60 ml/min/1,73 m2)
- Marker eines Nierenschadens (1 oder mehrere)
Klassifikation und Stadieneinteilung1
- Die Klassifikation erfolgt anhand von 3 Kriterien (CGA-Klassifikation):
- C = Grunderkrankung
- Angabe einer systemischen Erkrankung oder einer pathologisch-anatomischen Veränderung der Niere mit Lokalisation
- G = glomeruläre Filtrationsrate (ml/min/1,73 m2)
- G1: ≥ 90
- G2: 60–89
- G3a: 45–59
- G3b: 30–44
- G4: 15–29
- G5: < 15
- A = Albuminurie
- A1: < 30 mg/24 h (ACR < 30 mg/g bzw. < 3 mg/mol)
- A2: 30–300 mg/24 h (ACR 30–300 mg/g bzw. 3–30 mg/mmol)
- A3: > 300 mg/24h (ACR > 300 mg/g bzw. > 30 mg/mmol).
- C = Grunderkrankung
- Abnahme der Nierenfunktion und Albuminurie sind unabhängige Risikomarker für Progression und kardiovaskuläre Morbidität/Mortalität.2-3
- Siehe Tabelle Klassifizierung, Risikoabschätzung der chronischen Nierenkrankheit (Chronic Kidney Disease).
Zur Terminologie
- Im deutschen Sprachraum ist bislang der Begriff „chronische Niereninsuffizienz“ sehr gebräuchlich, in den nephrologischen Leitlinien wird hingegen treffender von „Chronic Kidney Disease“ (CKD) gesprochen.1,4
- Dies trägt dem Umstand Rechnung, dass „Niereninsuffizienz“ lediglich die verminderte Reinigungsfunktion beschreibt.
- „CKD“ umfasst hingegen zusätzlich morphologische Veränderungen und die prognostisch ebenfalls bedeutsame Proteinurie.4-5
Häufigkeit
- In deutschen Hausarztpraxen wird die Prävalenz der CKD auf bis zu 28 % geschätzt, überwiegend geriatrische Patient*innen mit altersbedingt eingeschränkter Nierenfunktion in den frühen CKD-Stadien.6-7
- Physiologische Abnahme der Nierenfunktion im Alter, wobei die CKD-Klassifikation bislang keine Adjustierung nach Alter ermöglicht (bei über 65-Jährigen Anstieg der Mortalität erst ab einer GFR < 45 ml/min/1,73 m2).8
- In Deutschland sind ca. 2 Mio. Menschen betroffen.9
- Ca. 2,3 % der Menschen im Alter von 18–79 Jahren weisen eine GFR von < 60 ml/min/1,73 m2 auf.9
- Steigende Prävalenz mit dem Alter10
- Bei unter 50-Jährigen selten, in der Altersgruppe 70–79 Jahre ist ca. jede 8. Person betroffen.9
- Nur 28 % der Betroffenen wissen von ihrer Nierenfunktionsstörung und nur 2/3 derjenigen, die davon wissen, sind diesbezüglich in ärztlicher Behandlung.11
- Insbesondere Älteren ist die Erkrankung häufig nicht bekannt.12
Ätiologie und Pathogenese
- Bei hausärztlichen Patienten mit eingeschränkter Nierenfunktion (CKD Stadium III, GFR im Durchschnitt 52ml/min lagen die folgenden Begleiterkrankungen vor:13
- Hypertonie (88%)
- Chronische Schmerzen (30%)
- KHK (23%)
- Diabetes (17%)
- Weitere, seltenere mögliche Grunderkrankungen:14
- chronische Glomerulonephritis
- interstitielle Nephropathie
- Zystennieren
- Systemerkrankungen: Amyloidose, Lupusnephritis, Goodpasture-Syndrom, monoklonale Gammopathien, Vaskulitiden, Anti-Phospholipid-Syndrom, hämolytisch-urämisches Syndrom, thrombotisch-thrombozytopenische Purpura
- genetische Erkrankungen
Prädisponierende Faktoren
- Folgende Faktoren erhöhen das Risiko für die Entstehung einer chronischen Nierenerkrankung:2,15-16
- höheres Alter
- Rauchen
- Übergewicht
- Herzerkrankung
- Familiengeschichte einer Nierenerkrankung
- asiatische oder afrikanische Herkunft.
ICPC-2
- U99 Erkrankung Harnorgane, andere
ICD-10
- N18 Chronische Nierenkrankheit – inklusive Chronisches Nierenversagen
- N18.1 Chronische Nierenkrankheit, Stadium 1
- N18.2 Chronische Nierenkrankheit, Stadium 2
- N18.3 Chronische Nierenkrankheit, Stadium 3
- N18.4 Chronische Niereninsuffizienz, Stadium 4, präterminale Niereninsuffizienz
- N18.5 Chronische Niereninsuffizienz, Stadium 5, dialysepflichtige Niereninsuffizienz
- N18.8 Sonstige chronische Nierenkrankheit
- N18.9 Chronische Nierenkrankheit, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Nachweis eines Markers für einen Nierenschaden (mindestens 1)
- Albuminurie: ≥ 30 mg/24 h bzw. Albumin-Kreatinin-Quotient (ACR) ≥ 30 mg/g (≥ 3 mg/mmol)
- pathologisches Urinsediment
- Elektrolytstörungen und andere pathologische Veränderungen infolge von Tubulopathien
- histologische Nierenschäden
- Nachweis pathologischer Nierenveränderungen durch bildgebende Verfahren
- Z. n. Nierentransplantation
- Nachweis einer eingeschränkten Nierenfunktion
- Verminderung der GFR (< 60ml/min/1,73m2)
- Mindestens eines dieser Kriterien muss für einen Zeitraum von > 3 Monate erfüllt sein.
Anamnese
- In frühen Stadien ist CKD häufig asymptomatisch.
- Symptomatik unspezifisch, z. T. erst bei fortgeschrittener Nierenerkrankung
- Müdigkeit, Abgeschlagenheit
- Kopfschmerzen
- Übelkeit
- Ödeme
- Dyspnoe
- Palpitationen
- Juckreiz
- Restless Legs
- Krämpfe
- Knochenschmerzen
- Vorgeschichte (auch im Hinblick auf kardiovaskuläre Risikofaktoren)
- Diabetes mellitus
- arterielle Hypertonie
- Fettstoffwechselstörung
- Rauchen
- kardiovaskuläre Erkrankung
- Medikation: nephrotoxische Substanzen
- Nierenerkrankungen in der Familie
Klinische Untersuchung
- Größe/Gewicht (BMI = Body Mass Index)
- Blutdruck/Puls (Hypertonie, Herzrhythmusstörungen)
- Haut
- Herz
- Reibegeräusch (Perikarditis)
- Lunge
- pulmonale Stauung (Überwässerung, evtl. Herzinsuffizienz)
- Reibegeräusch (Pleuritis)
- Magen
- Foetor uraemicus
- Nervensystem
- Sensibilitätsstörungen (Polyneuropathie)
Untersuchungen in der Hausarztpraxis
EKG
- Zeichen der linksventrikulären Hypertrophie (siehe auch EKG, Checkliste)
Rö-Thorax
- Bei klinischem V. a. pulmonale Stauung, Pleuraerguss
Labor
- Labordiagnostik mitentscheidend zum Nachweis und zur Risikostratifizierung von Nierenerkrankungen11
- Beurteilung der Nierenfunktion durch Abschätzung der glomerulären Filtrationsrate (eGFR)
- Urindiagnostik auf Hinweise für morphologische Nierenschädigungen
- Blutuntersuchungen
- Blutbild
- eGFR (ml/min/1,73 m2), Kreatinin
- Auf dem Laborbericht sollte immer der eGFR-Wert angegeben werden.1,11
- Bestimmung der eGFR gemäß MDRD- oder CKD-EPI-Formel (Letztere favorisiert)
- Bei älteren Patient*innen (> 70 Jahre) sind diese Formeln weniger zulässig. Möglicherweise sind speziell in dieser Altersgruppe validierte Formeln besser (BIS 1).
- Kreatinin ist als Frühmarker einer Nierenfunktionsstörung ungeeignet, Anstieg erst bei Funktionsunfähigkeit von mehr als der Hälfte der Nephrone.11
- Na, K
- Glukose
- Lipidprofil (Cholesterin, HDL, LDL, Triglyzeride)
- Evtl. Ca, Phospat, Vitamin-D-Spiegel, Parathormon sollten ab CKD-Stadium 4 regelmäßig bestimmt werden.7
- Die basale Urindiagnostik11 besteht aus:
- Urinteststreifen
- ggf. mikroskopische Untersuchung des Urinsediments (bei auffälligem Streifentest)
- Diagnostik einer Proteinurie durch Bestimmung der Albumin-Kreatinin Ratio (ACR)
- Urinteststreifen – gibt evtl. erste Hinweise auf einen strukturellen Nierenschaden durch Erfassung von:
- Hämaturie
- Proteinurie: Geringe Albuminausscheidung < 100 mg/l wird durch Routineteststreifen nicht erfasst.
- Harnwegsinfektion.
- Mikroskopie
- Gibt z. B. Hinweise auf Glomerulonephritiden, Stoffwechselerkrankungen oder die Pathogenese von Nierensteinen.
- Proteinurie-Diagnostik
- Untersuchung des Spontanurins, vorzugsweise wird der 2. Morgenurin untersucht.
- Bei Erstdiagnose der CKD (GFR < 60 ml/min) soll eine Bestimmung der Albumin-Kreatinin-Ratio im Urin erfolgen.7
- Bei einer ACR > 30 mg/g (bzw. > 30 mg/24 h) liegt eine Nierenschädigung vor.
Risikostratifizierung/Indikationen zur Überweisung zur Nephrologie
- Zur renalen und kardiovaskulären Risikoabschätzung wird bei Patient*innen mit CKD empfohlen:17
- eine Bestimmung der eGFR
- eine quantitative Bestimmung der Albuminurie (z. B. ACR im Spontanurin).
- Das Risiko eines Nierenversagens kann mit der Kidney Failure Risk Equation berechnet werden.18
- Der hierzu benötigte Bikarbonat-Wert kann auch aus dem Serum bestimmt werden. (Anmerkung des Reviewers)
- Patient*innen mit leichter – mäßiger Funktionseinschränkung der Niere und/oder leichter – mäßiger Albuminurie können hausärztlich kontrolliert werden.
- Bei höhergradiger Funktionseinschränkung und/oder schwergradiger Albuminurie sollte eine Überweisung zur Nephrologie angeboten werden.1,19
- Überweisungsempfehlungen siehe DEGAM-Leitlinie.7
- Werden Patient*innen erst im Spätstadium der Erkrankung überwiesen, ist dies mit einer schlechteren Prognose verbunden.17
Leitlinie: Überweisung von Patient*innen mit CKD zu Spezialist*innen7
- Eine Überweisung zur nephrologischen Untersuchung sollte angeboten werden:
- bei erstmals festgestellter CKD mit eGFR < 30 ml/min
- bei erstmals festgestellter CKD mit eGFR zwischen 30 und 60 ml/min und
-
- persistierender nicht urologisch erklärbarer Hämaturie 2+ oder
- Albuminurie Stadium ≥ A2 oder
- refraktärer Hypertonie mit ≥ 3 Blutdruckmedikamenten.
- Diese Überweisungskriterien stellen allerdings keine generelle Empfehlung dar. Bei vielen Patient*innen in der Hausarztpraxis stellt die eingeschränkte Nierenfunktion aufgrund relevanter Begleiterkrankungen oder anderer Umstände (z. B. schwere Pflegebedürftigkeit, limitierte Lebenserwartung) kein prioritäres Problem dar, eine Überweisung ist in diesen Fällen nicht geboten.
Therapie
Therapieziele
- Progression verzögern.
- Terminale Niereninsuffizienz/Dialyse vermeiden.
- CKD-bedingten Begleiterkrankungen behandeln.
- Prävention von kardiovaskulären Erkrankungen
Allgemeines zur Therapie
- Hausärztliche Maßnahmen können das Fortschreiten einer CKD verlangsamen.20
- Die Behandlung einer CKD umfasst ein Bündel von allgemeinen und medikamentösen Maßnahmen.
- Maßnahmen zur Behandlung einer Grunderkrankung, Verzögerung der Progression und zur Vermeidung von kardiovaskulären Komplikationen gehen dabei häufig Hand in Hand.
- Bei z. B. einer hypertensiven Nierenerkrankung wird mit dem erhöhten Blutdruck die Grunderkrankung behandelt.
- Eine gute Blutdruckeinstellung ist allgemein eine der wichtigsten Maßnahmen der Progressionshemmung bei chronischen Nierenerkrankungen.21
- Die antihypertensive Therapie vermindert gleichzeitig das Risiko für kardiovaskuläre Komplikationen.
- Durch eine Blockade des RAS (Renin-Angiotensin-Systems) mit z. B. ACE-Hemmer wird nicht nur der Blutdruck eingestellt, sondern auch die progressionsfördernde Albuminurie vermindert.
- Lässt sich eine Progression zur terminalen Niereninsuffizienz nicht vermeiden, sollten Nierenersatzverfahren frühzeitig mit den Patient*innen diskutiert und vorbereitet werden.20
Verlangsamung der Progression/Prävention von kardiovaskulären Erkrankungen
Allgemeinmaßnahmen/Lebensstil
- Ernährung/Eiweißaufnahme
- Die Progression einer CKD wird ebenso wie das Risiko für kardiovaskuläre Erkrankung durch die Art der Ernährung beeinflusst.22
- Ungünstig ist eine „westliche Diät“ mit einem Übergewicht an tierischen Proteinen und geringem Anteil an Ballaststoffen.22
- Es sollte eine ballaststoffreiche Ernährung angestrebt werden.22
- Bei Patient*innen mit einer eGFR von < 30 ml/min/1,73 m2 (Kategorie G4–G5) sollte die Eiweißzufuhr auf 0,8 g/kg KG/d beschränkt werden (Ernährungsberatung empfohlen).1
- Ab CKD-Stadium 4 sollte allen Patient*innen eine Ernährungsberatung angeboten werden.7
- Salzzufuhr
- Flüssigkeitszufuhr
- Steuerung der Flüssigkeitszufuhr sollte individuell erfolgen unter Berücksichtigung von Grunderkrankung und Komorbiditäten.17
- Im Allgemeinen sollte keine hohe orale Flüssigkeitszufuhr zum „Nierenspülen“ eingesetzt werden.17
- In den meisten Fällen ist eine tägliche Trinkmenge von 1,5–2 l ausreichend.20Wenn keine Herzinsuffizienz vorliegt, ist eine Restriktion der Trinkmenge nicht erforderlich.7
- Hyperurikämie
- keine Evidenz hinsichtlich der Wirkung einer harnsäuresenkenden Therapie auf die Progression der CKD (sowohl bei symptomatischen als auch asymptomatischen Patient*innen mit Hyperurikämie)1
- Rauchstopp
- Körpergewicht
- Körperliche Aktivität
- regelmäßige körperliche Aktivität entsprechend der kardiovaskulären Belastbarkeit (Ziel mindestens 5 x wöchentlich für 30 min)1
Verlangsamung der Progression durch SGLT-2-Inhibition
- Der SGLT-2-Inhibitor Dapagliflozin weist neben der blutzuckersenkenden auch eine renoprotektive Wirkung auf.26
- Dapagliflozin wurde 2021 zur Behandlung der chronischen Nierenkrankheit für Patient*innen mit und ohne Diabetes mellitus zugelassen und kann zusätzlich zu einem ACE-Hemmer/AT1-Antagonisten eingesetzt werden.27
- Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) sieht einen Zusatznutzen bei Erwachsenen mit chronischer Nierenkrankheit.28
Kardiovaskuläres Risiko bei chronischer Niereninsuffizienz
- Eine abnehmende GFR ist unabhängig von anderen Risikofaktoren mit einem erhöhten kardiovaskulären Risiko verbunden.29
- Patient*innen mit CKD mit signifikant reduzierter GFR (Stadium G3–G5) weisen per se ein hohes bis sehr hohes kardiovaskuläres Risiko auf.29
- GFR 30–59 ml/min/1,73 m2 (G3): hohes kardiovaskuläres Risiko
- GFR < 30 ml/min/1,73 m2 (G4–5): sehr hohes kardiovaskuläres Risiko
- Validierte Instrumente zur Bestimmung des kardiovaskulären Risikos berücksichtigen die Niereninsuffizienz bei der Risikokalkulation allerdings nicht, weil diese wenig zur Genauigkeit der Risikovorhersage beitragen. Daher wird auch bei Patient*innen mit CKD die Verwendung eines der etablierten kardiovaskulären Risikoscores empfohlen.7
Arterielle Hypertonie/Blockade des Renin-Angiotensin-Systems
- Eine antihypertensive Behandlung sollte bei einem RR > 140/90 mmHg eingeleitet werden.30
- Insbesondere für Patient*innen mit Diabetes mellitus und/oder Albuminurie empfehlen einige Leitlinien einen Zielblutdruck von > 130 mmHg systolisch < 80 mmHg diastolisch. In der DEGAM-Leitlinie wird hier ein individuelles Therapieziel empfohlen.7
- Priorität bei der Blutdrucksenkung hat die Blockade des Renin-Angiotensin-Systems (RAS) mit ACE-Hemmern oder AT-Blockern, da hierdurch zusätzlich die Albuminurie günstig beeinflusst wird.30-31
- Als initiale Therapie sollte eine Kombination aus RAS-Blocker/Ca-Antagonist oder RAS-Blocker/Diuretikum verwendet werden (bei eGFR < 30 ml/min/1,73m2 bevorzugt Schleifendiuretikum).30
- Bei Vorliegen einer Albuminurie sollten auch normotensive Patient*innen mit einem RAS-Blocker behandelt werden (Patient*innen mit Diabetes mellitus bei ACR ≥ 30 mg/g, Patient*innen ohne Diabetes bei ACR ≥ 300 mg/g).1
- Zu Beginn der Behandlung ist ein Absinken der eGFR um 10–20 % nicht ungewöhnlich.30,32
- Monitoring von eGFR und Elektrolyten, nach einigen Wochen meistens Stabilisierung30
Diabetes mellitus
- Die Behandlungsziele zwischen Diabetes-Patient*innen mit und ohne CKD unterscheiden sich nicht, es sollten individuelle festgelegt werden. Der Zielkorridor des HbA1c zur Vermeidung oder Verzögerung von mikrovaskulären Komplikationen einschließlich diabetischer Nephropathie liegt bei 6,5–7,5 %, bei Älteren/Menschen mit reduzierter Lebenserwartung sind auch Werte bis 8,0 % akzeptabel.1,7
- Bei erhöhtem Risiko für Hypoglykämien können höhere HbA1c-Werte akzeptiert werden.1
- Einige orale Antidiabetika müssen abhängig von der eGFR in der Dosis angepasst werden oder sind bei höhergradiger Funktionsstörung kontraindiziert.
- Für den sachgerechten Einsatz von oralen Antidiabetika ist daher Kenntnis der aktuellen Nierenfunktion und ihre Verlaufskontrolle in 3- bis 6-monatigen Abständen erforderlich.2
- Metformin sollte bei CKD und Typ-2-Diabetes bis zu einer eGFR von ≥ 30 ml/min/1,73 m2 bevorzugt angeboten werden, wenn der HbA1c nicht im individuellen Zielbereich liegt.
- Bei höhergradiger Niereninsuffizienz (eGFR <30 ml/min/1,73 m2) kann mit einer der folgenden Substanzklassen behandelt werden:33
- Glinide
- DPP-4-Inhibitoren
- GLP-1-RA
- Insulin.
- Bei Nichterreichen der Therapieziele Kombination aus Basalinsulin mit einem der oben genannten Wirkstoffe33
- Bei Patient*innen mit Diabetes mellitus und Mikroalbuminurie sollte eine Behandlung mit einem RAS-Blocker auch bei noch nicht verminderter eGFR begonnen werden.21
Dyslipidämie
- Aufgrund uneinheitlicher Daten, ob eine cholesterinsenkende Therapie die Progression der CKD günstig beeinflusst, wird dies kontrovers diskutiert.21,34
- Patient*innen mit einer Niereninsuffizienz sind in Studien zu Statinen unterrepräsentiert.35
- Die Behandlung mit Statinen entspricht den Empfehlungen für Patient*innen ohne CKD.7
- Eine spezielle Gruppe sind die Patient*innen mit weit fortgeschrittener Niereninsuffizienz unter Dialyse/nach Nierentransplantation, hier ist der Nutzen einer lipidsenkenden Behandlung unsicher.36-37
- Bei Patient*innen unter Dialyse: Eine lipidsenkende Therapie sollte nicht neu eingeleitet, eine bereits bestehende aber fortgeführt werden.
- Patient*innen nach Nierentransplantation: Statingabe
- Die Nierenfunktion ist bei der Statinmedikation und -dosis zu beachten.38
- Gemäß DEGAM-Leitlinie sind bei Niereninsuffizienz Fluvastatin bzw. Pravastatin zu bevorzugen, die Dosen von Lovastatin und Simvastatin zu reduzieren.38
Behandlung einer Azidose
- Die metabolische Azidose entsteht durch verminderte Ammoniogenese und dadurch verminderte Säureausscheidungskapazität sowie verminderte Reabsorption/Synthese von Bikarbonat.39
- Zunehmende Prävalenz einer metabolischen Azidose mit Abnahme der GFR40
- Auftreten bei ca. 3–5 % der Patient*innen mit Stadium III, 17–19 % der Patient*innen mit IV und 23 % der Betroffenen mit Stadium V39
- Die Progression der Niereninsuffizienz wird durch die Azidose begünstigt, zudem hat sie ungünstige Auswirkungen auf den Stoffwechsel von Muskulatur und Knochen sowie auf die Herzfunktion und die Respiration.39
- Diätetisch wirkt eine alkalisierende Ernährung mit viel Obst und Gemüse günstig.21
- Patient*innen mit einem Serumbikarbonat < 22 mmol/l sollte Bikarbonat oral verabreicht werden, um den Bikarbonatspiegel im Normbereich zu halten.1
Behandlung von weiteren Folgeerkrankungen der CKD
Anämie
- Die Anämie bei CKD entwickelt sich in der Regel ab einer GFR < 60 ml/min/1,73 m2 (Stadium G3).41
- Die Anämie wird vorwiegend durch eine mit zunehmendem Funktionsverlust abnehmende Produktion von Erythropoetin verursacht.
- Normozytäre, normochrome Anämie, Retikulozyten meist gering erhöht
- Zudem besteht eine unzureichende Verfügbarkeit des vorhandenen Eisens (funktioneller Eisenmangel) und eine verminderte gastrointestinale Aufnahme.41
- Eine Normalisierung der Hämoglobinwerte durch eine intensive Therapie mit Erythropoietin (EPO) oder Erythropoese-stimulierenden Agenzien (ESA) hatte allerdings keinen prognostischen Nutzen gezeigt.42-44
- Ein hoher Ziel-Hb > 12 g/dl (> 7,5 mmol/l) führt auch nicht zu einer Verbesserung der Lebensqualität.45
- Bei restriktiverem Einsatz von EPO/ESA wurde in den vergangenen Jahren vermehrt auf eine hochdosierte intravenöse Eisentherapie gesetzt.46
- Grundzüge der KDIGO-Leitlinien zur Diagnose und Therapie der renalen Anämie47
- Diagnostik
- Diagnose einer Anämie bei Hb < 12 g/dl (<7,5 mmol/l) (Frauen) bzw. 13 g/dl (8 mmol/l)(Männer)
- Bei Patient*innen mit Anämie sollten (unabhängig vom Grad der Nierenfunktionsstörung) bestimmt werden: Blutbild, Retikulozyten, Ferritin, Transferrinsättigung, Vitamin B12, Folsäure
- Eisentherapie
- Abwägen von Nutzen und Risiko (z. B. anaphylaktoide Reaktion bei i. v. Gabe)
- Behandlungsversuch durch i. v. Infusion (bei Nicht-Dialyse-Patient*innen auch orale Gabe für 1–3 Monate), wenn
- 1. ein Anstieg des Hb angestrebt wird (z. B. zur Symptomverbesserung)
- 2. Transferrin-Sättigung ≤ 30 %, 3. Ferritin ≤ 500 ng/ml (bzw. ≤ 50 µg/l oder 105 pmol/l).
- ESA-Therapie (Erythropoese-stimulierende Substanzen)
- Bei Hb ≥ 10 g/dl (≥ 6,2 mmol/l) wird eine ESA-Therapie nicht empfohlen.
- Vor Beginn einer ESA-Therapie sollten zunächst andere korrigierbare Anämieursachen behandelt werden (z. B. Eisenmangel, Entzündung).
- Bei Hb ≤ 10 g/dl (≤ 6,2 mmol/l) basiert die individuelle Entscheidung auf den Anämiesymptomen, Hb-Abfall, Ansprechen auf Eisentherapie, Risiken der ESA-Therapie.
- Erythrozytentransfusion
- Sollte möglichst vermieden werden.
- Option, wenn die ESA-Therapie unwirksam oder zu riskant ist.
- Diagnostik
Renale Osteopathie/Kalzium-Phosphat-Stoffwechsel
- Veränderungen im Mineralstoffwechsel setzen bei CKD-Patient*innen bereits früh ein.20
- Zu den hierdurch verursachten Veränderungen gehören die renale Osteodystrophie, aber auch extraskelettale (kardiovaskuläre) Verkalkungen.17
- Zunehmend wird der Begriff „CKD-MBD“ („Chronic Kidney Disease – Mineral and Bone Disorder“) favorisiert, um eine rein knochenzentrierte Sicht zu vermeiden und das Zusammenspiel von Nierenerkrankung, Knochenstoffwechsel und Gefäßverkalkungen zu beschreiben.48
- Mit fortschreitender Nierenerkrankung kommt es zu eine verminderten Aktivierung von Vitamin D, erniedrigter Kalziumaufnahme und etwa ab Stadium G4 (GFR < 30 ml/min/1,73 m2) zu einem sekundären Hyperparathyreoidismus.4
- Folgen sind Minderverkalkung des Knochens und Osteomalazie, klinisch Knochenschmerzen und im Stadium G5 ein zweifach erhöhtes Frakturrisiko.4
- Die schließlich sich entwickelnde Hyperphosphatämie trägt maßgeblich zur Entwicklung der Gefäßverkalkungen bei.4
- Die frühzeitige Diagnose entsprechender Laborveränderungen ist für die Einleitung von Therapiemaßnahmen wichtig.17
- Bei Patient*innen mit CKD ab Stadium 3b (eGFR < 45ml/min/ 1,73 m2 ) sollte eine Bestimmung von Kalzium, Phosphat, intaktem Parathormon (iPTH) und 25-OH-Vitamin D3 erfolgen.17,49
- Bei Hyperphosphatämie diätetische Phosphatrestriktion (orale Phosphatbindertherapie nur für Dialyse-Patient*innen zugelassen)4
- Calcitriol und Vitamin-D-Analoga sollten bei Patient*innen im Stadium G3–5 (keine Dialyse) nicht routinemäßig verwendet werden, Anwendung im Stadium G4 und G5 bei schwerem Hyperparathyreoidismus.49
Sonstige Maßnahmen
Impfungen
- Ansteigendes Risiko für infektiöse Erkrankungen und schwere Verläufe dieser Erkrankungen mit zunehmender Funktionsminderung der Niere17
- Bei allen Patient*innen mit CKD soll daher regelmäßig der Impfstatus geprüft und Impfungen gemäß den Empfehlungen der Ständigen Impfkommission (STIKO) auf- gefrischt werden.17
- Impfungen empfohlen gegen:50
- Bei Dialyse-Patient*innen wird auch eine Hepatitis-B-Impfung empfohlen.50
Schmerztherapie
- NSAR sollen bei CKD jeder Genese nicht regelmäßig eingesetzt werden.17
- NSAR können ein akutes Nierenversagen auslösen und den Verlauf der CKD sowie eine Hypertonie verschlechtern.17
- Gelegentliche Einnahme (z. B. 1-mal pro Woche) kann in Ausnahmefällen akzeptiert werden, wenn andere Analgetika nicht ausreichend wirksam sind.17
- Eine notwendige Schmerztherapie sollte in erster Linie durchgeführt werden mit:20
- Paracetamol
- Metamizol.
- Ggf. können Opioide eingesetzt werden, hier ist ab einer GFR < 60 ml/min/1,73 m2 eine Dosisanpassung vorzunehmen.20
Radiologische Untersuchungen bei CKD
- Der Einsatz von Kontrastmitteln kann die Nierenfunktion verschlechtern.
- Andererseits soll eine Unterdiagnostik/Untertherapie bei CKD-Patient*innen vermieden werden.17
- Das Risiko eines röntgenkontrastmittelinduzierten akuten Nierenversagens bzw. einer nephrogenen systemischen Fibrose nach MR-Kontrastmitteln wird insgesamt wahrscheinlich deutlich überbewertet.17
- Es wird daher neuerdings empfohlen, bei höhergradig eingeschränkter Nierenfunktion (Stadium 4–5, d. h. GFR < 30 ml/min/1,73 m2) den diagnostischen Nutzen einer Röntgen-/MRT-Kontrastmittel-Gabe mit potenzieller Reduktion der Morbidität und Mortalität gegenüber potenziellen Risiken stärker zu berücksichtigen.17
- Empfohlene Maßnahmen zur Nephroprotektion1
- gute Hydratation vor, während und nach der Untersuchung
- Potenziell nephrotoxische Medikamente vor und nach der Untersuchung pausieren.
- Bestimmung der eGFR 48–96 Stunden nach der Untersuchung
Terminale Niereninsuffizienz/Nierenersatzverfahren/Transplantation
- Im letzten Stadium der CKD kommt es zu Symptomen und Zeichen der Urämie (u. a. Antriebslosigkeit, Erbrechen, Bewusstseinsstörungen, Serositis, Restless Legs), Elektrolytentgleisungen und Überwässerung.51
- Individuell sehr unterschiedliche Geschwindigkeit dieses Prozesses
- Ab Stadium G4 (GFR < 30 ml/min/1,73 m2) sollte daher eine Aufklärung über Nierenersatzverfahren erfolgen.20
- Entscheidend für die Indikation zur Dialyse ist, ob der klinische Verlauf auf eine beginnende Urämie hinweist.4
- Eine Nierenersatztherapie kann durch zentrumsbasierte Hämodialyse oder im häuslichen Rahmen durch Peritonealdialyse erfolgen.
- Es gibt keine prognostischen Unterschiede zwischen den beiden Verfahren, gemeinsame Entscheidung mit den Patient*innen nach persönlicher Präferenz.4
- Anteil der Peritonealdialyse in Deutschland < 5 %, in anderen Ländern z. T. deutlich höher4
- Dialysepflichtige Patient*innen haben einen Anspruch auf Prüfung einer Transplantationsindikation (prognostisch günstigstes Verfahren), hier sind vor allem auch Begleiterkrankungen zu berücksichtigen.4
Urämischer Pruritus
- Patient*innen mit präterminaler Niereninsuffizienz und vor allem Dialyse-Patient*innen leiden häufig unter Pruritus.
- Therapeutisch kommen infrage:52
- topische Behandlung (z. B. Capsaicin)
- medikamentöse Behandlung (z. B. Gabapentin)
- Behandlung mit ultravioletten Strahlen (UVB).
- Definitive Behandlung nur durch Nierentransplantation
Restless Legs
- Restless Legs bei ca. 20–40 % der dialyseabhängigen Patient*innen53
- Therapie der Wahl ist die Nierentransplantation, da die Beschwerden nach einer erfolgreichen Nierentransplantation sistieren.53
- Zu weiteren Therapieoptionen siehe Artikel Restless-Legs-Syndrom.
KDIGO-Empfehlungen für die zeitliche Planung von Dialyse/Nierentransplantation1
Dialyse
- Vorliegen von einem oder mehreren der folgenden Kriterien:
- Symptome oder Zeichen des Nierenversagens (Serositis, Entgleisung von Säure-Basen-Haushalt oder Elektrolyten, Pruritus)
- mangelnde Kontrolle von Volumenstatus und Blutdruck
- progrediente Verschlechterung des Ernährungszustands
- kognitive Störungen.
Nierentransplantation
- Eine präemptive Nierentransplantation durch Lebendspende sollte erwogen werden, falls
- GFR < 20 ml/min/1,73 m2 und
- zu erwartendes Nierenversagen in den folgenden 6–12 Monaten.
Anpassung von Pharmakotherapien bei chronischer Nierenerkrankung
- Die Anpassung der Medikamentendosierung ist sowohl im ambulanten als auch im stationären Bereich ein häufiges Problem.54
- Eine nicht oder falsch angepasste Dosierung von Medikamenten bei CKD-Patient*innen kann Toxizität oder eine ineffektive Behandlung verursachen.55
- Ab einer GFR < 60 ml/min/1,73 m2 (Stadium G3) können bestimmte Medikamente nicht mehr oder nur in reduzierter Dosis verabreicht werden.56
- Grundlage der Dosisanpassung ist die Bestimmung der eGFR (MDRD- oder CKD-EPI-Formel).54
- Eine alleinige Bestimmung des Serumkreatinins gefährdet potenziell die Patient*innen.54
- Bei den meisten Medikamenten wird eine niedrigere Dosierung gewählt, es gibt aber Ausnahmen:
- Bei Antibiotika darf die Initialdosis nicht reduziert werden, um ausreichend hohe Wirkspiegel zu erzielen, Anpassung erst im Verlauf.54
- Schleifendiuretika müssen bei zunehmender Niereninsuffizienz höher dosiert werden.54
- Siehe auch www.dosing.de.
KDIGO-Empfehlungen für die Anpassung medikamentöser Therapien bei CKD1
Antihypertensiva/Herzmedikamente
- RAS-Blocker (ACE-Hemmer, Angiotensin-Blocker, Aldosteronantagonisten)
- Bei GFR < 45 ml/min/1,73 m2 in niedriger Dosis beginnen.
- Kontrolle von GFR und Kalium eine Woche nach Beginn bzw. nach jeder Dosiserhöhung
- kein routinemäßiges Absetzen bei Patient*innen mit GFR < 30 ml/min/1,73 m2, da weiterhin nephroprotektiv
- Betablocker
- Halbierung der Dosis bei GFR < 30 ml/min/1,73 m2
- Digoxin
- Dosisreduktion gemäß Plasmaspiegel
Analgetika
- NSAR
- Gabe bei GFR < 30 ml/min/1,73 m2 sollte vermieden werden.
- Längerfristige Gabe ist nicht empfohlen bei GFR < 60 ml/min/1,73 m2.
- Sollten nicht gleichzeitig mit Lithium verabreicht werden.
- Gleichzeitige Gabe mit RAS-Blockern sollte vermieden werden.
- Opioide
- Dosisreduktion bei GFR < 60 ml/min/1,73 m2
- Vorsicht bei GFR < 15 ml/min/1,73 m2
Antibiotika
- Penicillin
- bei GFR < 15 ml/min/1,73 m2 in hohen Dosen neurotoxisch (max. 6 g/d)
- Makrolide
- Dosisreduktion um 50 % bei GFR < 30 ml/min/1,73 m2
- Fluorchinolone
- Dosisreduktion um 50 % bei GFR < 15 ml/min/1,73 m2
- Tetracycline
- Dosisreduktion bei GFR < 45 ml/min/1,73 m2
- Aminoglykoside
- Dosisreduktion oder Verlängerung des Intervalls bei GFR < 60 ml/min/1,73m2
- Kontrolle des Spiegels im Serum
- Gleichzeitige Gabe von ototoxischen Substanzen wie Furosemid vermeiden.
Antimykotika
- Amphotericin
- Vermeiden bei GFR < 60 ml/min/1,73 m2 , sofern es Alternativen gibt.
- Fluconazol
- Dosisreduktion um 50 % bei GFR < 45 ml/min/1,73 m2
- Flucytosin
- Dosis reduzieren bei GFR < 60 ml/min/1,73 m2.
Antidiabetika
- Metformin
- wahrscheinlich sicher bei GFR > 45 ml/min/1,73 m2
- Bei GFR < 45 ml/min/1,73 m2 Weitergabe neu evaluieren, vermeiden bei GFR < 30 ml/min/1,73 m2.
- Sulfonylharnstoffe
- Vermeidung von Substanzen, die vorwiegend renal ausgeschieden werden.
Immunsuppressiva
- Methotrexat
- Dosisreduktion bei GFR < 60 ml/min/1,73 m2
- Möglichst vermeiden bei GFR < 15 ml/min/1,73 m2.
Antikoagulanzien
- Niedermolekulare Heparine
- Halbierung der Dosis bei GFR < 30 ml/min/1,73 m2
- Warfarin
- niedrigere Dosis und engmaschige Kontrollen bei GFR < 30 ml/min/1,73 m2
Lithium
- Nephrotoxische Substanz, die auch in therapeutischen Spiegeln die Nierenfunktion verschlechtern kann.
- Kontrolle von eGFR, Elektrolyten und Lithiumspiegel alle 6 Monate
- Gleichzeitige Gabe von NSAR vermeiden.
Verlauf, Komplikationen und Prognose
- CKD ist verbunden mit erhöhtem Risiko für Komplikationen, Hospitalisation und Tod, aber auch mit erhöhten Gesundheitskosten.57
- Viele Patient*innen sind über viele Jahre asymptomatisch.
- Nicht selten wird die Erkrankung erst beim Auftreten erster Komplikationen festgestellt.
- Eine CKD ist mit zahlreichen Komplikationsmöglichkeiten in verschiedenen Organsystemen verbunden, hervorzuheben ist dabei vor allem auch das erhöhte kardiovaskuläre Risiko.58-59
- Bei Patient*innen im Stadium G3 besteht aufgrund kardiovaskulärer Ereignisse ein höheres Risiko für einen vorzeitigen Tod als für eine Dialysepflichtigkeit.4
- Auch eine Albuminurie ist ein Prädiktor der Gesamt- und kardiovaskulären Mortalität.11
- Das Risiko der CKD-Progression in Richtung terminale Niereninsuffizienz wird ebenfalls wesentlich durch GFR und Albuminausscheidung bestimmt.1
- Siehe Tabelle Chronische Nierenerkrankung, Progressionsrisiko und Häufigkeit von Verlaufskontrollen.1
- Eine seltene (50–60 Fälle/Jahr), aber lebensbedrohliche Komplikation ist die Kalziphylaxie.60-61
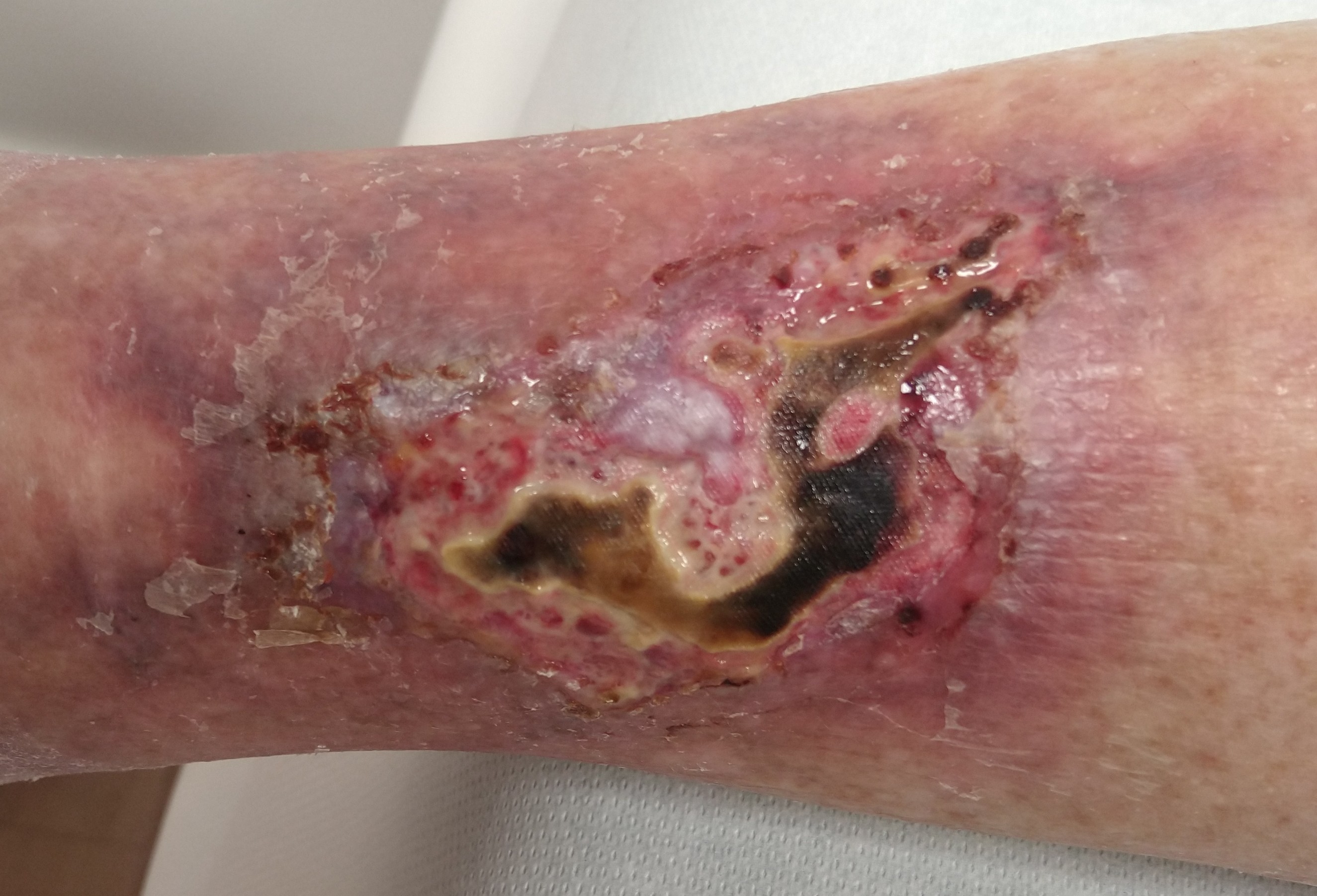 Kalziphylaxie
Kalziphylaxie- gekennzeichnet durch bläulich-livide Hautverfärbungen mit sehr schmerzhaften Ulzerationen/Nekrosen (Gefahr der Superinfektion/Sepsis) und arterielle Verkalkungen
Verlaufskontrollen
- GFR und Albuminausscheidung sollten bei allen CKD-Patient*innen mindestens 1 x/Jahr gemessen werden.1
- Inwieweit Verlaufskontrollen häufiger durchgeführt werden sollen, hängt neben der klinischen Entwicklung vom Progressionsrisiko ab.
- Bei steigendem Progressionsrisiko werden von KDIGO Verlaufskontrollen 2- bis 4-mal jährlich empfohlen:
Patienteninformationen
Patienteninformationen in Deximed
Illustrationen

Kalziphylaxie (mit freundlicher Genehmigung von Dr. med. Christina Linz)

Urografie der Nieren, Normalbefund. Seitengleiche Kontrastierung der Nieren und proximalen Ureteren. 1+2 = Nierenkelche, 3 = Nierenbecken, 4 = Harnleiter

Urografie, Abdomenübersichtsaufnahme. Zeichen eines Harnstaus links: verzögerte Kontrastmittelausscheidung, erweitertes Nierenbecken (1) und dilatierte, plumpe Nierenkelche (2). Harnleiter (3)

Urografie der Harnblase (1). Verzögerte Kontrastmittelausscheidung im rechten Ureter (2)

Übersichtszeichnung der Nieren, Harnwege, Harnblase
Quellen
Leitlinien
- Kidney Disease Improving Global Outcomes (KDIGO). Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Stand 2012. www.kdigo.org
- Kidney Disease Improving Global Outcomes (KDIGO). Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease. Stand 2013. www.kdigo.org
- Kidney Disease Improving Global Outcomes (KDIGO). Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Stand 2012. www.kdigo.org
- Kidney Disease Improving Global Outcomes (KDIGO) Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of chronic kidney disease-mineral and bone disorder. Stand 2017. www.kdigo.org
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie (NVL) Typ-2-Diabetes – Teilpublikation, 2. Auflage. Stand 2021. www.leitlinien.de
- Bundesärztekammer, Kassenärztlicher Bundesvereinigung und Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften. Nationale VersorgungsLeitlinie (NVL) Chronische KHK, 5. Auflage. Stand 2019. www.leitlinien.de
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Hausärztliche Risikoberatung zur kardiovaskulären Prävention. AWMF-Leitlinie Nr. 053-024. S3, Stand 2016. www.awmf.org
- European Society of Cardiology. Guidelines for the management of arterial hypertension. Stand 2018. www.escardio.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Versorgung von Patienten mit nicht-dialysepflichtiger Niereninsuffizienz in der Hausarztpraxis. AWMF-Register-Nr. 053-048. S3, Stand 2019. www.degam.de
Literatur
- Kidney Disease Improving Global Outcomes (KDIGO). KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney International supplements 2013; 3(1): 869-76. kdigo.org
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Nierenerkrankungen bei Diabetes im Erwachsenenalter, Stand 2015. www.leitlinien.de
- Hemmelgarn BR, Manns BJ, Lloyd A, et al. Relation between kidney function, proteinuria, and adverse outcomes. JAMA 2010; 303: 423-9. PubMed
- Girndt M. Diagnostik und Therapie der chronischen Nierenerkrankung. Internist 2017; 58: 243–256. doi:10.1007/s00108-017-0195-2 DOI
- Schultze G. „Chronic kidney disease“ ungleich chronische Niereninsuffizienz. Internist 2017; 58: 643. doi:10.1007/s00108-017-0233-0 DOI
- Gergei I, Klotsche J, Woitas RP, Pieper L, Wittchen H-U, Krämer BK, et al. Chronic kidney disease in primary care in Germany. J Public Health. 2017;25:223–30. link.springer.com
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Versorgung von Patienten mit nicht-dialysepflichtiger Niereninsuffizienz in der Hausarztpraxis. www.degam.de
- Delanaye P, Jager K, Bökenkamp A, et al. CKD: A Call for an Age-Adapted Definition. JASN 2019; 30: 1785–1805. doi:10.1681/ASN.2019030238 DOI
- Girndt M, Trocchi P, Scheidt-Nave C, et al. The prevalence of renal failure—results from the German Health Interview and Examination Survey for Adults, 2008–2011 (DEGS1). Dtsch Arztebl Int 2016; 113: 85-91. doi:10.3238/arztebl.2016.0085 DOI
- Zhang QL, Koenig W, Raum E, Stegmaier C, Brenner H, Rothenbacher D. Epidemiology of chronic kidney disease: results from a population of older adults in Germany. Prev Med 2009; 48(2): 122-7. pmid:19041887 PubMed
- Fiedler G, Vogt B. Labordiagnostik zum Nachweis einer Nierenerkrankung. Internist 2019; 60: 485-501. doi:10.1007/s00108-019-0598-3 DOI
- König M, Gollasch, Demuth I, et al. Prevalence of Impaired Kidney Function in the German Elderly: Results from the Berlin Aging Study II (BASE-II). Gerontology 2017; 63: 201-209. doi:10.1159/000454831 DOI
- Fraser S, Roderick P, May C, et al. The burden of comorbidity in people with chronic kidney disease stage 3: a cohort study. BMC Nephrology 2015; 16: 193. doi:10.1186/s12882-015-0189-z DOI
- Frei U, Schober-Halstenberg HJ. Nierenersatztherapie in Deutschland, 2005-2006, Jahresvergleiche 1995 bis 2005, Berlin, Quasi-Niere 2006. www.bundesverband-niere.de
- Mayo Clinic Patient Care and Health Information. Chronic Kidney Disease - Risk Factors. Zugriff 24.05.19. www.mayoclinic.org
- Haroun M, Jaar B, Hoffman S, et al. Risk Factors for Chronic Kidney Disease: A Prospective Study of 23,534 Men and Women in Washington County, Maryland. J Am Soc Nephrol 2003; 14: 2934–2941. doi:10.1097/01.ASN.0000095249.99803.85 DOI
- Galle J, Floege J. Klug entscheiden-Empfehlungen in der Nephrologie. Internist 2017; 58: 568–574. doi:10.1007/s00108-017-0248-6 DOI
- Tangri N, Grams ME, Levey AS, et al.; CKD Prognosis Consortium. Multinational Assessment of Accuracy of Equations for Predicting Risk of Kidney Failure: A Meta-analysis. JAMA. 2016 Jan 12;315(2):164-74. doi: 10.1001/jama.2015.18202. Erratum in: JAMA. 2016 Feb 23;315(8):822. PMID: 26757465; PMCID: PMC4752167. pubmed.ncbi.nlm.nih.gov
- Paige NM, Nagami GT. The top 10 things nephrologists wish every primary care physician knew. Mayo Clin Proc 2009; 84(2): 180-186. www.ncbi.nlm.nih.gov
- Fleig S, Patecki M, Schmitt R. Chronische Niereninsuffizienz - Was ist gesichert in der Therapie?. Internist 2016; 57: 1164–1171. doi:10.1007/s00108-016-0150-7 DOI
- Sollinger D, Schamberger B, Weinmann-Menke J, et al. Verminderung der Progression einer chronischen Niereninsuffizienz. Nephrologe 2016; 11: 260–267. doi:10.1007/s11560-016-0076-z DOI
- Evenepoel P. Darm-Nieren-Achse: Einfluss der Darmmikrobiota auf die Progression einer chronischen Nierenerkrankung. Nephrologe 2016; 11: 275-281. doi:10.1007/s11560-016-0067-0 DOI
- Orth SR. Effects of smoking on systemic and intrarenal hemodynamics: influence on renal function. J Am Soc Nephrol 2004; 15 Suppl 1:S58. pubmed.ncbi.nlm.nih.gov
- Orth SR, Hallan SI. Smoking: a risk factor for progression of chronic kidney disease and for cardiovascular morbidity and mortality in renal patients--absence of evidence or evidence of absence? Clin J Am Soc Nephrol 2008; 3:226. PubMed
- Staplin N, Hynes R, Herrington W, et al. Smoking and Adverse Outcomes in Patients With CKD: The Study of Heart and Renal Protection (SHARP). Am J Kidney Dis 2016; 68: 371-380. pubmed.ncbi.nlm.nih.gov
- Heerspink H, Stefansson B, Correa-Rotter R, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020; 383: 1436-1446. doi:10.1056/NEJMoa2024816 DOI
- Overbeck P. EU-Zulassung für Dapagliflozin bei chronischer Nierenerkrankung. kardiologie.org 09.08.21. Zugriff 22.02.22. www.kardiologie.org
- Arzneimittelkommission der deutschen Ärzteschaft. Stellungnahme der AkdÄ zu Dapagliflozin (neues AWG: chronische Niereninsuffizienz), 10.01.22. www.akdae.de
- Mach F, Baigent C, Catapano A, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 202o; 41: 111-188. doi:10.1093/eurheartj/ehz455 DOI
- Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39: 3021–3104. doi:10.1093/eurheartj/ehy339 DOI
- Siebenhofer A, Plank J, Horvath K, Berghold A, Sutton AJ, Sommer R, et al. Angiotensin receptor blockers as anti-hypertensive treatment for patients with diabetes mellitus; meta-analysis of controlled double-blind randomized trials. Diabet Med 2004; 21: 18-25. PubMed
- Levey AS. Clinical practice. Nondiabetic kidney disease. N Engl J Med 2002; 347: 1505-11. New England Journal of Medicine
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie (NVL) Typ-2-Diabetes – Teilpublikation, 2. Auflage. Stand 2021. www.leitlinien.de
- Weyrich P. Kardiovaskuläre Prävention - Grad der Niereninsuffizienz beeinflusst den Nutzen von Statinen. Info Diabetologie 2017; 11: 10-11. www.researchgate.net
- Bundesärztekammer, Kassenärztlicher Bundesvereinigung und Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften. Nationale VersorgungsLeitlinie (NVL) Chronische KHK, 5.Auflage. Stand 2019. www.leitlinien.de
- Wong M, Perkovic V. Knowing what we do not know: statin therapy in advanced chronic kidney disease. Lancet Diabetes Endocrinol 2016; 4: 801-803. www.thelancet.com
- Palmer SC, Craig JC, Navaneethan SD, et al. Benefits and harms of statin therapy for persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med 2012; 157: 263-75. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Hausärztliche Risikoberatung zur kardiovaskulären Prävention. AWMF-Nr. 053-024. Stand 2016. www.awmf.org
- Hoyer J. Chronische metabolische Azidose bei Niereninsuffizienz. Nephrologe 2012; 7: 472–480. doi:10.1007/s11560-012-0670-7 DOI
- Mohebbi N. Metabolische Azidose bei chronischer Nierenerkrankung und nach Nierentransplantation. Nephrologe 2018; 13: 5-11. www.zora.uzh.ch
- Schaefer R, Schaefer L. Eisen- und ESA-Therapie bei renaler Anämie. Nephrologe 2008; 3: 88-95. doi:10.1007/s11560-008-0145-z DOI
- Pfeffer M, Burdmann E, Chen C, et al. A Trial of Darbepoetin Alfa in Type 2 Diabetes and Chronic Kidney Disease. N Engl J Med 2009; 361: 2019-2032. doi:10.1056/NEJMoa0907845 DOI
- Drüeke T, Locatelli F, Clyne N, et al. Normalization of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med 2006; 355: 2071-2084. doi:10.1056/NEJMoa062276 DOI
- Singh A, Szczech L, Tang K, et al. Correction of Anemia with Epoetin Alfa in Chronic Kidney Disease. N Engl J Med 2006; 355: 2085-2098. doi:10.1056/NEJMoa065485 DOI
- Clement FM, Klarenbach S, Tonelli M, Johnson JA, Manns BJ. The impact of selecting a high hemoglobin target level on health-related quality of life for patients with chronic kidney disease. Arch Intern Med 2009; 169: 1104-12. PubMed
- Mayer G. Renale Anämie. Nephrologe 2015; 10: 396–398. doi:10.1007/s11560-015-1018-x DOI
- KDIGO 2012 Clinical Practice Guideline for Anemia in Chronic Kidney Disease. kdigo.org
- Jehle P. Update Knochenstoffwechsel bei Niereninsuffizienz - „High-“ und „Low-turnover“- Osteodystrophie. Nephrologe 2017; 12: 162-167. doi:10.1007/s11560-017-0142-1 DOI
- KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of chronic kidney disease–mineral and bone disorder. kdigo.org
- Ständige Impfkommission des (STIKO) des Robert-Koch- Instituts. Impfempfehlungen 2018/19. www.rki.de
- Meyer TW, Hostetter TH. Uremia. N Engl J Med 2007; 357: 1316-25. PubMed
- Mettang T. Pruritus bei nephrologischen und anderen nicht-dermatologischen Erkrankungen. Hessisches Ärzteblatt 2018;7/8: 473-478. www.laekh.de
- Oertel W, 1 Stiasny T, Wetter T, et al. Restless-Legs-Syndrom: Die vergessene Krankheit. Dtsch Arztebl 2000; 97: A2932. www.aerzteblatt.de
- Kielstein J, Keller F. Pharmakotherapie bei Patienten mit chronischer Nierenkrankheit. Internist 2012; 53: 802–809. doi:10.1007/s00108-011-3011-4 DOI
- Munar MY. Drug dosing adjustments in patients with chronic kidney disease. Am Fam Physician 2007; 75: 1487-96. PubMed
- Hartmann B, Czock D, Keller F. Drug Therapy in Patients With Chronic Renal Failure. Dtsch Arztebl Int 2010; 107: 647-656. doi:10.3238/arztebl.2010.0647 DOI
- Baumgarten M, Gehr T. Chronic kidney disease: detection and evaluation. Am Fam Physician 2011; 84: 1138-48. PubMed
- Angelantonio E, Chowdhury R, Sarwar N, et al. Chronic kdney disease and risk of major cardiovascular disease and non-vascular mortality: prospective population based cohort study. BMJ 2010; 341: c4986. pubmed.ncbi.nlm.nih.gov
- Lee M, Saver JL, Chang K-H, et al. Low glomerular filtration and risk of stroke: meta-analysis. BMJ 2010; 341: c4249. BMJ (DOI)
- Diehm C. Bei Kalziphylaxie droht Lebensgefahr. Cardiovasc 2011; 2: 58. doi:10.1007/BF03358940 DOI
- Ketteler M, Biggar P, Brandenburg V, et al. Epidemiologie, Pathophysiologie und Therapie der Calciphylaxie. Dtsch Arztebl 2007; 104: A3481-3485. www.aerzteblatt.de
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Guido Schmiemann, PD Dr. med. MPH, Facharzt für Allgemeinmedizin, Institut für Public Health und Pflegeforschung der Universität Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).
Link lists
Relevante Artikel
Leitlinien
- DEGAM-Leitlinie Versorgung von Patienten mit chronischer nicht-dialysepflichtiger Nierenerkrankung in der Hausarztpraxis
- Internationale Leitlinie - CKD Evaluation and management
- Internationale Leitlinie - Anemia in CKD
- Internationale Leitlinie - Lipids in CKD
- Internationale Leitlinie - CKD Mineral and Bone Disorder