Zusammenfassung
- Definition:Adenokarzinom im Pankreas unbekannter Ursache.
- Häufigkeit:Inzidenz liegt bei ca. 15/100.000/Jahr. Nach Kolon- und Magenkarzinom der dritthäufigste Tumor des Verdauungssystems. Leichte Zunahme der Inzidenz in den letzten 20 Jahren.
- Symptome:Die Symptome sind meist unspezifisch: Gewichtsverlust, Bauch- und Rückenschmerzen und Verdauungsstörungen.
- Befunde:Klinische Befunde in Form von Anämie, Ikterus, Gewichtsverlust und ggf. tastbarem Tumor treten erst spät auf.
- Diagnostik:Sonografie, ggf. Endosonografie sowie CT/MRT des Abdomens.
- Therapie:Einzige kurative Therapie ist die operative Entfernung des Tumors. Chemotherapie wird adjuvant und palliativ durchgeführt. Radiochemotherapie zur präoperativen Tumorverkleinerung kann erwogen werden.
Prüfungsrelevant für die Facharztprüfung Allgemeinmedizin1
Allgemeine Informationen
Definition
- Es handelt sich um einen malignen Tumor im Pankreas.2Es gibt verschiedene histologische Typen, das duktale Adenokarzinom tritt dabei mit über 95 % am häufigsten auf.3
- Das Adenokarzinom des Pankreas wird auch exokrines Pankreaskarzinom genannt.4
- Andere seltenere histologische Formen sind das zystische Adenokarzinom und der azinäre Tumor aus sekretproduzierenden Parenchymzellen.4
- Ebenso selten sind endokrine Tumoren, die sich von den endokrinen Zellen der Langerhans-Inseln ableiten.2
- Präkanzerosen des invasiven Pankreaskarzinoms sind:4
- die muzinöse-zystische Neoplasie (MCN)
- die intraduktale papilläre muzinöse Neoplasie (IPMN)
- die pankreatische intraepitheliale Neoplasie (PanIN).
- Die Progression von Dysplasie zum Adenokarzinom ist biologisch durch Akkumulation einer Vielzahl genetischer Aberrationen gekennzeichnet.4
- Das Adenokarzinom des Pankreas gehört zu den Malignomen mit der höchsten krebsspezifischen Mortalität.
- Die Fortschritte in der Diagnostik und Therapie des Pankreaskarzinoms haben bisher nur in kleinen Subgruppen zu einer Senkung der Sterblichkeit geführt.4
- Fast alle Patient*innen entwickeln frühzeitig Metastasen und sterben nach kurzer Krankheitsdauer.
- Zum Zeitpunkt der Diagnose hat über die Hälfte der Patient*innen Metastasen, und bei nur 8 % findet sich ein lokal begrenzter Tumor.5
 siehe Tabelle: Stadieneinteilung Pankreaskarzinom
siehe Tabelle: Stadieneinteilung Pankreaskarzinom
Häufigkeit
- Im Jahr 2016 erkrankten etwa 18.400 Menschen in Deutschland an einem Pankreaskarzinom.
- Aufgrund der ungünstigen Prognose verstarben auch fast ebenso viele Personen an dieser Erkrankung.6
- Laut deutschem Krebsregister erkrankten 2016 in Deutschland 9.180 Männer und 9.190 Frauen.6
- Die absolute Zahl der Neuerkrankungs- und Sterbefälle hat für beide Geschlechter über die Jahre kontinuierlich zugenommen, auch aufgrund der demografischen Entwicklung.6
- Die absolute 5-Jahres-Überlebensrate wird mit 8 % (Männer) bzw. 9 % (Frauen) angegeben, die relative 5-Jahres-Überlebensrate, die die Sterblichkeit in der Allgemeinbevölkerung berücksichtigt, liegt bei 9 % (Männer) bzw. 10 % (Frauen).6
- Das Pankreaskarzinom weist neben dem Mesotheliom die niedrigste Überlebensrate unter allen Krebserkrankungen auf.6
- Das Pankreaskarzinom ist die 8. häufigste Krebsneuerkrankung bei Männern und die 9. häufigste Krebserkrankung bei Frauen.7
- Die Krankheit tritt meist ab dem 70. Lebensjahr auf.3Ein Auftreten vor dem 50. Lebensjahr ist selten.
- In den nächsten 25 Jahren wird es voraussichtlich aufgrund der Verschiebung der Altersstrukturen in der Bevölkerung zu einem weiteren Anwachsen der Fallzahlen um mehr als 30 % kommen.4
Ätiologie und Pathogenese
- Die meisten Neoplasien im Pankreas sind Adenokarzinome, die von den maligne veränderten duktalen Epithelzellen ausgehen.2,8-10
- Sequenzielle Akkumulation von Mutationen und anderen genetischen Aberrationen führen über Präkanzerosen zur zunehmend malignen Transformation bis hin zum Karzinom.4
- Häufigste genetische Veränderungen sind Mutationen im KRAS-Onkogen (bei > 90 % der Patient*innen nachweisbar) sowie die Inaktivierung von Tumorsuppressorgenen wie TP53, SMAD4 und CDKN2A. Weiteren Einfluss haben das Stroma und die immunologische Regulation.4
- Die interindividuelle, aber auch die intratumorale, inter- und intrametastatische Heterogenität des Pankreaskarzinoms ist groß.4
- Das exokrine Pankreaskarzinom breitet sich rasch lokal aus und bildet in einem frühen Stadium lymphogene und hämatogene Metastasen.
- 75 % der Tumoren befinden sich im Pankreaskopf, die restlichen Tumoren befinden sich im Pankreaskörper und dem Pankreasschwanz.
- Karzinome im Pankreaskopf breiten sich häufig in den Gallengang aus, was zu einem obstruktiven Ikterus führen kann.
- Karzinome im Pankreaskörper oder -schwanz führen selten zu obstruktiven Symptomen.
Prädisponierende Faktoren
- Rauchen2,8-10
- Hohes Alter
- Eine Reihe von genetischen Erkrankungen und familiäre Belastung wird mit Pankreaskarzinomen in Verbindung gebracht (2–3 % der Neuerkrankungen).2,11-12
- Verwandte 1. Grades von Patient*innen mit Pankreaskarzinom haben ein im Vergleich zur Normalbevölkerung erhöhtes Risiko, ebenfalls an einem Pankreaskarzinom zu erkranken.2
- Genetische Erkrankungen mit erhöhtem Risiko:
- Peutz-Jeghers-Syndrom
- heridetäre Pankreatitis
- familiäres Pankreaskarzinom FPC (Familien mit mindestens 2 Verwandten 1. Grades mit Pankreaskarzinom)
- FAMMM- Und Pankreas-Melanom-Syndrom
- familiäres Mamma- und Ovarialkarzinom.
- Übergewicht und wenig körperliche Aktivität13
- Diabetes mellitus Typ 214
- Eine Metaanalyse von prospektiven Observationsstudien weist auf einen linearen Zusammenhang mit einem um 15 % gestiegenen Risiko für ein Pankreaskarzinom je Erhöhung um 0,5 mmol/l (= 9 mg/dl) des Nüchternblutzuckers hin.15
- Dieses Verhältnis wurde auch im oberen Bereich des normalen Blutzuckerspiegels (Prädiabetes) festgestellt.
- Ob und welche oralen Antidiabetika das Krebsrisiko erhöhen, ist weiterhin Grundlage aktueller Forschung; Metformin scheint jedoch auf die Entstehung von Pankreaskarzinomen protektiv zu wirken.16
- Eine Metaanalyse von prospektiven Observationsstudien weist auf einen linearen Zusammenhang mit einem um 15 % gestiegenen Risiko für ein Pankreaskarzinom je Erhöhung um 0,5 mmol/l (= 9 mg/dl) des Nüchternblutzuckers hin.15
- Chronische Pankreatitiden17
- Infektionen mit Erregern wie Helicobacter pylori und Hepatitis B (oder auch HIV) können die Entstehung von Pankreaskarzinomen begünstigen.6
- Sehr häufiger Verzehr von verarbeiteten Fleischwaren, geräucherten oder gegrillten Speisen könnte ebenfalls die Entstehung eines Pankreaskarzinoms begünstigen.6
- Alkoholmissbrauch18
- Regelmäßiger Alkoholkonsum, kann das Entstehen eines Pankreaskarzinoms begünstigen. Ein definierter Schwellenwert liegt nicht vor.
- Regelmäßiger Alkoholkonsum erhöht auch die Wahrscheinlichkeit für chronische Pankreatitiden, die wiederum ein Risikofaktor für die Entstehung eines Pankreaskarzinoms sind.
- Berufsbedingte Risikofaktoren
- U. a. wird der Kontakt mit Pestiziden, Herbiziden und Fungiziden als Risikofaktor diskutiert.19-27
ICPC-2
- D76 Bösartige Neubildung Pankreas
ICD-10
- C25 Bösartige Neubildung des Pankreas
- C25.0 Pankreaskopf
- C25.1 Pankreaskörper
- C25.2 Pankreasschwanz
- C25.3 Ductus pancreaticus
- C25.4 Endokriner Drüsenanteil des Pankreas
- C25.7 Sonstige Teile des Pankreas
- C25.8 Pankreas, mehrere Teilbereiche überlappend
- C25.9 Pankreas, nicht näher bezeichnet
Diagnostik
Diagnostische Kriterien
- Die Diagnose wird in der Regel mittels Ultraschall, endoskopischem Ultraschall und/oder MR-Angiografie in Kombination mit MRCP („One-stop-shop“-MRT) gestellt; teilweise auch Einsatz von Spiral-CT und PET.
Differenzialdiagnosen
Anamnese
- Wird die Diagnose gestellt, ist die Krankheit bei den meisten Betroffenen bereits weit fortgeschritten.
- Die Symptome sind lange Zeit unspezifisch bzw. nicht vorhanden.
- Ein schmerzfreier und sich schrittweise entwickelnder Ikterus sowie Gewichtsabnahme können Anzeichen eines infiltrativ wachsenden Pankreaskopfkarzinoms sein.
- Die Symptome hängen von der Lokalisation des Tumors ab.
- Bei periampullären Tumoren kann der Ikterus bereits relativ frühzeitig auftreten.
- Typische Symptome, aber unspezifische Symptome sind Rücken- und Bauchschmerzen, Appetitlosigkeit, Völlegefühl, Meteroismus, Gewichtsabnahme und damit verbunden allgemeine körperliche Schwäche.
- Eine schmerzloser Ikterus bei Patient*innen im Alter über 50 Jahren ist ein Alarmzeichen.
- Schmerzen
- Die Schmerzen werden durch das Einwachsen in den Plexus coeliacus verursacht und sind anhaltend und schneidend.28
- Die Schmerzen strahlen meist vom Oberbauch in den Rücken aus und gehen beim Vornüberbeugen etwas zurück.
- Die Schmerzen können sich nach Mahlzeiten und beim flachen Liegen verstärken.
- Die Schmerzen bestehen auch nachts.
- Ikterus
- Der Ikterus entsteht aufgrund einer Obstruktion und kann mit starkem Juckreiz einhergehen.
- Bei einigen Patient*innen kommt es zu Diarrhö/Steatorrhö aufgrund einer Obstruktion des Pankreasgangs und daraus resultierendem Enzymmangel.
- Bei Patient*innen > 50 Jahre kann eine erstmalige akute Pankreatitis unklarer Ätiologie auf ein Pankreaskarzinom hindeuten.
- Das Neuauftreten oder die Verschlechterung eines Diabetes mellitus können auf ein Pankreaskarzinom hinweisen.
- Die Einleitung einer Diagnostik auf ein Pankreaskarzinom sollte hier bei ausbleibenden weiteren Symptomen nicht erfolgen.2
Klinische Untersuchung
- Verschlussikterus mit dunkelgelbem bis braunem Urin, Gelbfärbung von Haut und Skleren und Pruritus
- Gewichtsabnahme
- Schwellungen im Abdomen aufgrund des Tumors sowie eine palpable Gallenblase (Courvoisier-Zeichen)
- Anämie
- Hämatombildung aufgrund einer gestörten Koagulation
- Linksseitige supraklavikuläre Lymphadenopathie (Virchow-Lymphknoten)
- Bei Metastasierung4
- Folgende paraneoplastische Syndrome sind mit dem Pankreaskarzinom assoziiert:4
- Thrombophilie
- Thrombophlebitis migrans
- Panniculits nodularis (Pfeifer-Weber-Christian-Syndrom).
Ergänzende Untersuchungen
- Labordiagnostik
- Sonografie des Abdomens
Diagnostik bei Spezialist*innen
- Erweiterte Labordiagnostik
- Antigene
- Das Cancer-Antigen 9 (CA 19-9) sollte zur Differenzialdiagnostik bei Nachweis einer Pankreasraumforderung bestimmt werden.2
- Die Bestimmung vor jeder geplanten Tumortherapie (Operation, Bestrahlung, medikamentöse Tumortherapie) zusammen mit dem Tumormarker CEA wird empfohlen.4
- CA19-9 ist nicht als Screening-Parameter geeignet, da es auch bei anderen Erkrankungen des Magen-Darm-Traktes erhöht ist.
- Die Sensitivität beträgt 50–75 % und die Spezifität liegt bei gut 80 %.
- Weitere Tumormarker, die mit dem Pankreaskarzinom assoziiert sind, sind CA 72-4 und Beta-hCG.
- Eine Studie von Louhimo et al. aus dem Jahr 2004 wies auf, dass die Tumormarker Beta-hCG und CA 72-4 in höherem Maße von prognostischen Faktoren abhängen als CA 19-9.29
- Bei einem Verdacht auf ein Pankreaskarzinom wird anfangs meist ein transabdominaler Ultraschall durchgeführt, da das Verfahren weit verbreitet und kostengünstig ist.
- Die Endosonografie wird immer häufiger verwendet.
- Die zunehmende Verbesserung der Diagnostik mit MRT (MR-Angiografie und MRCP) und die Möglichkeit, detaillierte Informationen zu dem Tumor und seiner Ausbreitung zu erhalten, haben zu einem verstärkten Einsatz dieses Verfahrens geführt.
Bildgebende Verfahren
- Ultraschalluntersuchung des Abdomens
- Prinzipiell wird bei initialem Verdacht auf ein Pankreaskarzinom zunächst eine Oberbauchsonografie empfohlen.
- einfaches und kostengünstiges Verfahren
- zunehmender Einsatz der Endosonografie (s. u.)
- Spiral-CT
- Diese Untersuchung wird bei korpulenten Patient*innen empfohlen, und wenn der Ultraschallbefund nicht eindeutig war oder eine genaue Stadien-Einteilung notwendig ist.30-32
- Wenn in der Sonografie des Abdomens keine Metastasen gefunden wurden, ist sie obligat.
- Sie hat eine hohe Sensitivität.
- Kleine, resektable Tumoren können bei einer CT aber übersehen werden.
- Einsatz für Staging und OP-Planung.
- MRT („One-stop-shop“-MRT)
- Kombination aus MR-Angiografie und MRCP sind einfachere Alternative zu CT und ERCP.
- In Kombination mit der Endosonografie können über 90 % der Tumoren erkannt werden.
- Die MRCP zur nichtinvasiven Abbildung der Gallenwege und des Pankreasgangs ersetzt zunehmend die endoskopisch retrograde Cholangiopankreatikografie (ERCP).
- Einsatz für Staging und OP-Planung
- ERCP
- Die ERCP (endoskopisch retrograde Cholangiopankreatikografie) bringt eine Raumforderung im Bereich des Pankreasganges nur indirekt zur Darstellung und reicht somit zur Diagnosestellung allein nicht aus.
- Auch die Kombination mit einer Bürstenzytologie ist nicht sensitiv genug und wird zur Diagnostik eines Pankreaskarzinoms nicht empfohlen.
- Endoskopischer Ultraschall
- Diese Untersuchung kann bei entsprechender Expertise der Ärzt*innen eine hohe Sensitivität aufweisen.33
- Mit einem endoskopischen Ultraschall können Pankreaskarzinome in einem frühen Stadium diagnostiziert, vergrößerte Lymphknoten dargestellt und Biopsien entnommen werden.
- Zur OP-Planung wird die CT/MRT aufgrund der Bildqualität oft bevorzugt.
- CT-Angiografie oder MRT-Angiografie (s. o.)
- Zur Beurteilung der Operabilität muss das Einwachsen des Tumors in benachbarte Organe bzw. Gefäße dargestellt werden.
- Gefäße können mittels CT-Angiografie oder MRT-Angiografie, die die konventionelle Angiografie ersetzt haben, beurteilt werden.
- Biopsie/Zytologie
- Eine präoperative Biopsie erübrigt sich beim Vorliegen einer malignomverdächtigen, vom Pankreas ausgehenden Raumforderung, die potenziell resektabel erscheint. Hier wird eine primäre Resektion empfohlen. 2
- Bei V. a. Metastasen eines anderen Malignoms kann eine endosonografisch gesteuerte Biopsie durchgeführt werden.
- Eine Biopsie muss vor dem Beginn einer palliativen Chemotherapie erfolgen.
- Repräsentatives Material kann aus ca. 95 % der Biopsien mit einer diagnostischen Sensitivität von bis zu 95 % entnommen werden.
- Evtl. ist es einfacher, eine Biopsie aus einer Lebermetastase zu entnehmen.34
- Laparaskopie, evtl. mit Ultraschall
- Das Verfahren eignet sich zur Diagnose von nicht entdeckten Lebermetastasen und peritonealen Karzinosen.35
- kein routinemäßiger Einsatz zum Staging
- Entnahme von Biopsien möglich
Staging2
- Abdomensonografie
- Röntgen-Thorax
- Ggf. Computertomografie, wenn in der Abdomensonografie keine systemische Metastasierung nachgewiesen wurde.
- Fakultativ
- MRT
- Thorax-CT
- Laparaskopie
- Endosonografie, ERCP und MRCP sowie Skelettszintigrafie werden nicht zum Tumorstaging herangezogen.
- Die FDG-PET Untersuchung und die Mikrometastasendiagnostik aus Vollblut haben aktuell keinen Stellenwert.
Therapie
Therapieziele
- Die Operation ist die einzige kurative Therapieoption.36-37
- In den meisten Fällen ist das Therapieziel palliativ.2,10
Allgemeines zur Therapie
- Pankreaskarzinome können in resektable, lokal fortgeschrittene und metastasierte Karzinome eingeteilt werden.38
- Chirurgische R0-Resektion (15 % der Fälle) mit Lymphadenektomie ist die einzige mögliche kurative Therapie.2
- Die Beurteilung des Aktivitätsstatus ermöglicht die Einschätzung des Allgemeinzustandes der (onkologischen, geriatrischen) Patient*innen und wird häufig für eine bessere Therapieplanung zu Rate gezogen.
- Am häufigsten wird der Karnofsky-Index oder der ECOG(Eastern Co-operative of Oncology Group)-Status ermittelt.
- Der Karnofsky-Index unterteilt den Aktivitätsstatus in 11 Stufen (100 % = normal, 0 = Tod), der ECOG-Status in 6 Grade (0 = normal, 5 = Tod).
- Am häufigsten wird der Karnofsky-Index oder der ECOG(Eastern Co-operative of Oncology Group)-Status ermittelt.
Präoperative Beurteilung
- Bei zeitnah angestrebter Operation wird bei Cholestase eine präoperative Galleableitung mittels Stent nur empfohlen, wenn zudem eine Cholangitis vorliegt.
- Inoperables Pankreaskarzinom
- In der Regel werden Patient*innen mit Peritonealkarzinose, Organmetastasen, Infiltration in die A. mesenterica superior oder in den Truncus coeliacus, Lymphknotenfernmetastasen oder mit lokalen Einwüchsen in nicht resektable Strukturen nicht operiert.
- Operables Pankreaskarzinom
- Nur wenige Tumoren können überhaupt operiert werden, und die Prognose ist schlecht.39
- Die Lokalisation ist für die Wahl des Operationsverfahrens ausschlaggebend.
- Tumoren im Pankreaskörper oder -schwanz sind eher operabel als Tumoren im Pankreaskopf.
- Hier wird eine Pankreaslinksresektion (Karzinom im Pankreasschwanz), eine subtotale Pankreaslinksresektion oder eine totale Duodenopankreatektomie (Korpuskarzinom) durchgeführt.
- Bei einem Karzinom im Pankreaskopf, der Papilla Vateri und im Duodenum wird die Whipple-Operation durchgeführt.
Behandlung mittels Operation
- Resektables Pankreaskarzinom2
- Eine radikale Resektion ist die einzige potenziell kurative Therapieform (15 % der Fälle, danach 5-Jahresüberlebensrate von 40 %).
- Die Whipple-Operation ist die Standardtherapie bei Tumoren im Pankreaskopf, während bei Tumoren im Pankreaskörper oder -schwanz Pankreaslinksresektionen oder totale Duodenopankreatektomien durchgeführt werden.
- Bei der klassichen Whipple-Operation erfolgt eine Resektion von Pankreaskopf, Duodenum, Gallenblase, Ductus choledochus und distalem Magen. Regionäre Lymphknoten werden ebenfalls entfernt.
- Gleichwertig bzgl. Outcome und postoperativer Komplikation ist jedoch auch die pyloruserhaltende Whipple-Operation, bei der keine Magenteilresektion erfolgt und Operationszeit gespart werden kann.40
- Eine totale Pankreatektomie kann bei einer diffusen Infiltration des Pankreas notwendig sein.
- Schwere postoperative Komplikationen dürfen dabei 30 % nicht übersteigen, und die Mortalität darf nicht über 5 % liegen.
- Nichtresektables Pankreaskarzinom
- Liegen Fernmetastasen, Infiltration in Arteria mesenterica superior, Vena cava inferior, Aorta oder Truncus coeliacus sowie Verschlüsse der Vena mesenterica superior/Vena portae vor, kann primär keine oparative Resektion erfolgen.34
- Bei Patient*innen mit lokal fortgeschrittenem Tumor in ausreichend gutem Allgemeinzustand kann zunächst eine neoadjuvante Chemotherapie durchgeführt werden, um die Resektabilität des Tumors zu erzielen.
- Die höchsten Remissionsraten erzielen hier FOLFIRINOX (siehe Abschnitt Medikamentöse Therapie) oder Nab-Paclitaxel/ Gemcitabin.4
- Auch die Durchführung einer Radiochemotherapie zur lokoregionäre Intensivierung der Behandlung ist möglich.4
- Bei lokal fortgeschrittenem Karzinom und Fernmetastasen ist die Therapie palliativ (s. u.).
Komplikationen durch den Eingriff
- Verzögerte Magenentleerung, Pankreasfistel, Anastomoseninsuffizienz, Wundinfektion, intraabdomineller Abszess, Blutung, Diabetes und exokrine Pankreasinsuffizienz
Inoperables Pankreaskarzinom
- Bei einem schmerzhaften Ikterus wird eine ERCP mit interner Drainage oder eine perkutane transhepatische Cholangiodrainage durchgeführt.41
- Bei Patient*innen mit inoperablem Tumor kann eine Gallengangendoprothese Linderung bei schwerem Ikterus und Juckreiz verschaffen, die Überlebenszeit aber nicht verlängern.42-43
- Die Anlage eine biliodigestiven Anastomose bei Cholestase ist indiziert, wenn erst intraoperativ die Irresektabilität festgestellt und von einer längeren Überlebenszeit ausgegangen wird.
- Bei tumorbedingter Magenentleerungsstörung
- Kann eine medikamentöse Therapie mit Metoclopromid versucht werden.
- Bei tumorbedingter duodenaler Obstruktion
- Endoskopie mit Stenteinlage
- Gastroenterostomie
- Traditionell wird die Gastroenteroanastomose als offener Eingriff durchgeführt. In den letzten Jahren werden vermehrt minimalinvasive Eingriffe vorgenommen, z. B. Laparaskopie oder selbstexpandierende Metallstents44, wobei letztere Methode wahrscheinlich am besten geeignet ist.
- Siehe auch im Abschnitt Weitere Behandlungsmöglichkeiten.
Medikamentöse Therapie
- Eine adjuvante Chemotherapie innerhalb von 6(–12) Wochen nach Operation über 6 Monate soll durchgeführt werden nach R0-Resektion des Primärtumors, wenn die Patient*innen einen guten Allgemeinzustand aufweisen (ECOG-Status 0–2).3-4
- Anhand aktueller Daten mit der deutlichen Verbesserung des Gesamtüberlebens wird modifiziertes FOLFIRINOX (mFOLFIRINOX) bei Patient*innen mit einem sehr guten und guten Allgemeinzustand (ECOG 0–1) als neuer Standard in der adjuvanten Therapie angesehen.4
- mFOLFIRINOX ist die Abkürzung für eine Polychemotherapie mit Oxaliplatin, Leucovorin und Irinotecan an Tag 1 und 5-Fluorouracil (5-FU) per Pumpe über 46 Stunden alle 14 Tage für 12 Zyklen.45
- Häufig schwerwiegende Nebenwirkungen unter mFOLFIRINOX sind z. B. Diarrhö, sensorische Polyneuropathie, Fatigue, Erbrechen, Leukopenie und Mukositis; sie nehmen jedoch meist nach 2 Therapiezyklen ab.4
- Bei Patient*innen mit einem schlechteren Allgemeinzustand (ECOG ≥ 2) oder Kontraindikationen gegen mFOLFIRINOX kann vor allem die Gemcitabin-Monotherapie, bei Unverträglichkeit von Gemcitabin 5-FU/Folinsäure, alternativ eingesetzt werden.4
- Anhand aktueller Daten mit der deutlichen Verbesserung des Gesamtüberlebens wird modifiziertes FOLFIRINOX (mFOLFIRINOX) bei Patient*innen mit einem sehr guten und guten Allgemeinzustand (ECOG 0–1) als neuer Standard in der adjuvanten Therapie angesehen.4
- Nach R1-Resektion wird ebenfalls eine anschließende 6-monatige Chemotherapie nach gleichem Schema empfohlen.3-4
- Palliative Therapie4
- Die Therapie in fortgeschrittenen Stadien ist palliativ. Die Durchführung einer möglichst zeitnahen Chemotherapie führt zu einer Verlängerung der Überlebenszeit und zur Verbesserung der Lebensqualität.
- Eingesetzte Chemotherapeutika bei gutem Allgemeinzustand in der Erstlinientherapie sind Nab-Paclitaxel mit Gemcitabin oder FOLFIRINOX (Fluorouracil, Folinsäure, Irinotecan und Oxaliplatin).
- Die palliative medikamentöse Tumortherapie kann bis zum Progress oder bei sehr gutem Ansprechen als Intervalltherapie durchgeführt werden.
- Für Patient*innen in schlechtem Allgemeinzustand (ECOG > 2, Karnofsky-Index < 60 %) ist der Nutzen einer medikamentösen Tumortherapie fraglich.
- Zum Einsatz kommt meist Gemcitabin (+nab-Paclitaxel).
- Anderenfalls erfolgt die Therapie dem Prinzip des Best Supportive Care.
Palliativtherapie
Allgemeines
- Jede/r von einer nicht-heilbaren Krebserkrankung Betroffene sollte Zugang zu einer allgemeinen Palliativversorgung haben.46
- Die allgemeine Palliativversorgung von Patient*innen mit einer nicht-heilbaren Krebserkrankung sollte folgende Aufgabenfelder beinhalten:46
- Behandlung von Symptomen und Begleitung bei Problemen in allen 4 Dimensionen (physisch, psychisch, sozial und spirituell), Berücksichtigung von Patientenpräferenzen und deren Bedürfnisse unter Wahrung der kulturellen, weltanschaulichen und religiösen Identität der Betroffenen.
- Schaffen von Rahmenbedingungen, die die Intimität der Patient*innen respektieren.
- Durchführung einer angemessenen differenzialdiagnostischen Ursachenklärung eines Symptoms zur zielgerichteten Therapie und Erfassung potenziell reversibler Ursachen sowie Einsatz von präventiven Maßnahmen
- Durchführung einer symptomatischen Therapie – allein oder parallel zu einer ursächlichen Therapie
- Abwägung tumorspezifischer Maßnahmen (z. B. Strahlentherapie, operative Verfahren, medikamentöse Tumortherapien) mit dem primären oder alleinigen Therapieziel der Symptomlinderung in interdisziplinärer Zusammenarbeit unter Abwägung von Nutzen und Belastung im Austausch mit den Patient*innen und ggf. den Angehörigen
- Kommunikation, inklusive Einbeziehung und Begleitung Angehöriger (Empfehlung von Selbsthilfegruppen, Angehörigenschulung)
- Haltung einer nichtwertenden Achtung und Aufrichtigkeit gegenüber den Patient*innen
- Ehrlich sein, ohne zu verletzen oder ohne mehr (detaillierte) Informationen zu vermitteln, als von den Betroffenen verlangt wird.
- Die Themen Sterben und Tod ggf. auch aktiv ansprechen.
- Behandlung von Symptomen und Begleitung bei Problemen in allen 4 Dimensionen (physisch, psychisch, sozial und spirituell), Berücksichtigung von Patientenpräferenzen und deren Bedürfnisse unter Wahrung der kulturellen, weltanschaulichen und religiösen Identität der Betroffenen.
- Realistische partizipative Therapiezielfindung (Lebenszeitverlängerung, Verbesserung/Erhalt der Lebensqualität, Symptomlinderung, Ermöglichung eines Sterbens in Würde)
- Vorausschauende Versorgungsplanung
- Benennung von Vorsorgebevollmächtigten oder Vorschlag von Betreuer*innen
- Umfang und Grenzen der Behandlung im Fall (erkrankungs-)typischer sowie häufiger und möglicher Szenarien und Komplikationen
- individuelle Präferenzen hinsichtlich der Versorgung in der letzten Lebensphase, des Betreuungs- und Sterbeortes sowie ggf. der Bestattung
- Koordination der Versorgung
- Einbeziehung von einer ambulanten spezialisierten Palliativversorgung (SAPV) oder Hospiz
- SAPV muss ärztlich verordnet und kassenseitig genehmigt werden. Die Verordnung (Muster 63) richtet sich nach dem aktuellen Bedarf der Patient*innen und setzt ihr Einverständnis voraus.
- Einbeziehung von einer ambulanten spezialisierten Palliativversorgung (SAPV) oder Hospiz
- Bei Krankenhausbehandlungsbedürftigkeit (Unsicherheiten bezüglich des Therapieziels, Aufwändige medizinische oder pflegerische Versorgung, Überforderung oder Unsicherheit der häuslichen Versorgung) stationäre Aufnahme auf eine Palliativstation, falls indiziert.
Symptomorientierte Therapie des fortgeschrittenen Pankreaskarzinoms
- Zu den häufigsten Symptomen bei Patient*innen mit fortgeschrittenem Pankreaskarzinom gehören:4
- Schmerzen
- allgemeine Schmerztherapie nach dem WHO-Stufenschema
- Lokale Therapiemaßnahmen: Strahlentherapie, Coeliacusblockade
- Die Wirksamkeit einer palliativen Schmerztherapie wird durch simultane Chemotherapie (Chemoradiotherapie) gesteigert.
- Kachexie
- bei exokriner Pankreasinsuffizienz: Substitution mit Pankreasenzymen
- supplementäre oder totale parenterale Ernährung
- Bei Magenausgangsstenose kann eine Gastroenterostomie erfolgen.
- Cholestase
- Implantation eines Metall- oder Plastikstents (Therapie der 1. Wahl)
- perkutane transhepatische Cholangiodrainage (PTCD)
- chirurgische Anlage einer biliodigestiven Anastomose (nur im Ausnahmefall)
- venöse Thrombembolien
- Prophylaxe mit halbtherapeutisch dosiertem NMH erwägen.
- Aszites
- Punktion
- bei Bedarf wiederholter Punktionen Anlage einer dauerhaften Peritonealdrainage
- Schmerzen
- Siehe hierzu auch die folgenden Artikel:
- Schmerz, palliative Behandlung
- Übelkeit und Erbrechen, palliative Behandlung
- Obstipation, palliative Behandlung
- Maligne gastrointestinale Obstruktion
- Orale Beschwerden, Mundtrockenheit
- Mangelernährung und Dehydratation
- Dyspnoe, palliative Behandlung
- Angst, palliative Behandlung
- Depression, palliative Behandlung
- Delir, palliative Behandlung
Weitere Behandlungsmöglichkeiten
- Eine psychoonkologische Mitbetreuung kann sich positiv auf Schmerzen auswirken.36
- Immunstimulationstherapie wird momentan in Studien untersucht.
- Bei exokriner Pankreasinsuffizienz Insulintherapie und Pankreasenzymsubstitution
Prävention
- Verzicht auf Tabakkonsum
- Verzicht auf exzessiven Alkoholkonsum
- Vermeidung von Übergewicht
- Regelmäßige, körperliche Bewegung
- Es ist möglich, aber bisher nicht hinreichend belegt, dass eine frühzeitige und wirksame Therapie von Prädiabetes und Typ-2-Diabetes zu einer Verhinderung der Entstehung von Pankreaskarzinomen beitragen kann.
- Eine Zufuhr Vitamin-C-haltiger Nahrung ist möglicherweise förderlich zur Reduktion des Pankreaskarzinomrisikos.2
- Ein Screening der Bevölkerung zur Vorsorge gibt es bislang nicht. Die bisher eingesetzten Methoden, z. B. der CA19-9-Testung im Serum, haben die krebsspezifische Mortalität nicht gesenkt.4
- Identifizierung und Screening von Hochrisikopatient*innen, wie das familiäre Pankreaskarzinom, in spezialisierten Zentren.
- Siehe dazu auch: Nationale Fallsammlung familiäres Pankreaskarzinom.
Verlauf, Komplikationen und Prognose
- Die Symptome bei einem Pankreaskarzinom sind so unauffällig, dass 80–85 % der Tumoren aufgrund des fortgeschrittenen Stadiums nicht mehr chirurgisch entfernt werden können, wenn die Diagnose gestellt wird (meist erst 4–6 Monate nach dem Auftreten der ersten Symptome).
- Die Prognose ist schlecht34, da die Tumoren
- schwer zugänglich sind.
- in der Nähe anderer wichtiger Organe liegen.
- ein aggressives Wachstum haben und frühzeitig metastasieren.
- mit einer erheblichen Morbidität verbunden sind.
- gegen die meisten Therapieformen resistent sind.
- Überlebensrate
- Nachdem die Diagnose gestellt wurde, beträgt die durchschnittliche Überlebenszeit ein halbes Jahr.
- relative 5-Jahres-Überlebensrate (%)3
- Männer: 8 %
- Frauen: 7 %
- Bei Karzinoiden und anderen seltenen oder speziellen histologischen Formen des Pankreaskarzinoms ist die Prognose besser.
- Um die Operationsergebnisse zu verbessern, werden die entsprechenden Operationen nur an spezialisierten Zentren durchgeführt.
Nachsorge bei Patient*innen mit Radikaloperation
- Anpassung der Ernährung ggf. durch Ernährungsmediziner*in/Ökotropholog*in
- Diabetestherapie bei totaler Pankreatektomie
- Nachsorgeschema zur Detektion von Lokalrezidiven oder Oligometastasen
- In den ersten 2 Jahren erfolgt die Nachsorge alle 3 Monate, danach halbjährlich über weitere 3 Jahre und beinhaltet:
- körperliche Untersuchung
- Labor: CA 19-9 und CEA
- CT Thorax/Abdomen/Becken.
- In den ersten 2 Jahren erfolgt die Nachsorge alle 3 Monate, danach halbjährlich über weitere 3 Jahre und beinhaltet:
Patienteninformationen
Patienteninformationen in Deximed
- Bauchspeicheldrüsenkrebs (Pankreaskarzinom)
- Angstbehandlung in der Palliativmedizin
- Was ist Palliativmedizin?
- Übelkeit und Erbrechen, Palliativmedizin
- Verstopfung, Palliativmedizin
- Mundbeschwerden, Palliativmedizin
- Depression, Palliativmedizin
- Delirium, Palliativmedizin
- Schmerzen und andere Symptome, Palliativmedizin
Deutsches Krebsforschungszentrum
Patientenverbände
Illustrationen
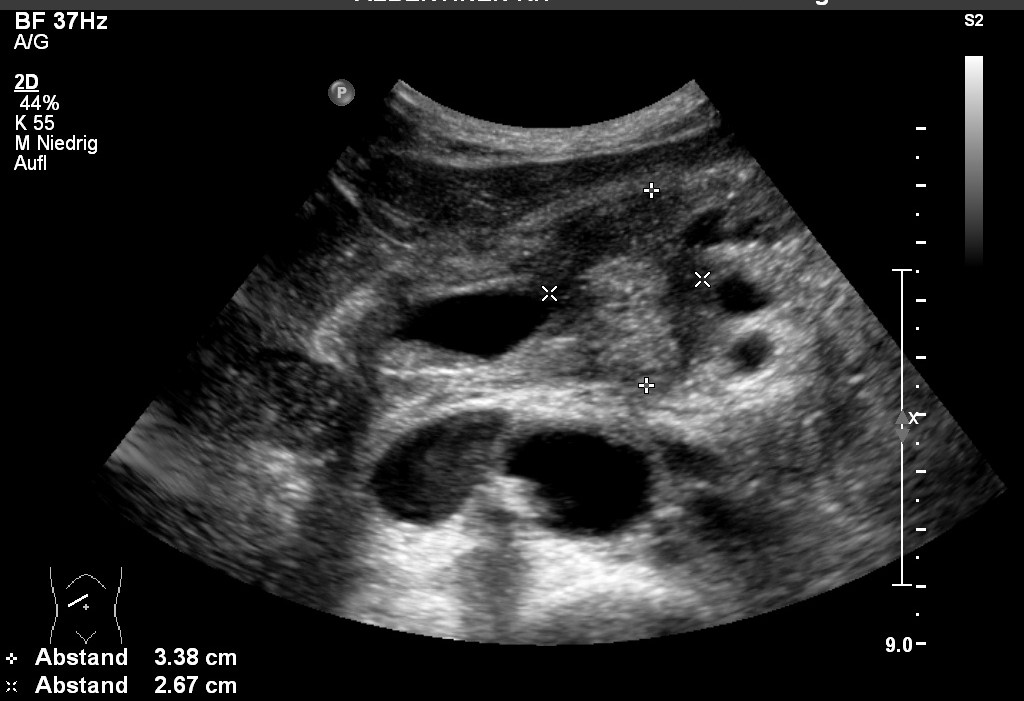
Sonografie: Pankreaskopfkarzinom (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
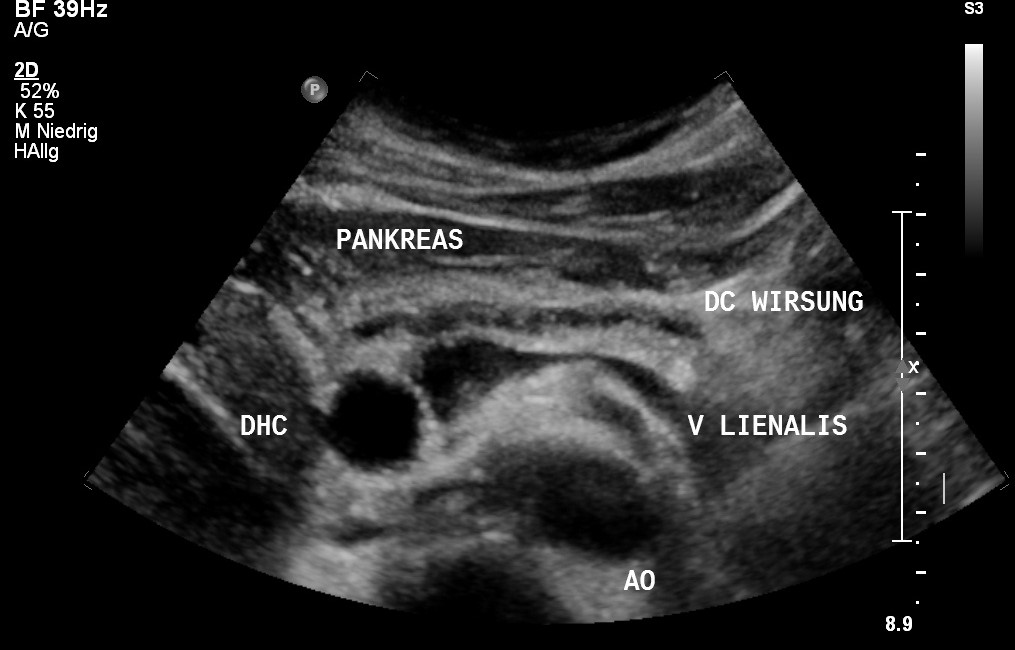
Sonografie: Erweiterter Ductus wirsungianus bei Pankreaskarzinom (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). Exokrines Pankreaskarzinom. AWMF-Leitlinie Nr. 032-010OL. S3, Stand 2013. www.awmf.org
- European Society for Medical Oncology. Cancer of the Pancreas: ESMO Clinical Practice Guidelines. Stand 2015. www.esmo.org
- Deutsche Krebsgesellschaft. Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL. S3, Stand 2014. www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin. Erweiterte S3-Leitlinie Palliativmedizin für Patienten mit einer nicht-heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128/001-OL. Stand 2020. www.awmf.org
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie e. V. (DGHO). Pankreaskarzinom. Stand 2018. www.onkopedia.com
Literatur
- Lohnstein M, Eras J, Hammerbacher C. Der Prüfungsguide Allgemeinmedizin - Aktualisierte und erweiterte 3. Auflage. Augsburg: Wißner-Verlag, 2018.
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). S3-Leitlinie Exokrines Pankreaskarzinom. Registernummer 032-010OL,Stand 2013. www.awmf.org
- Takhar AS, Palaniappan P, Dhingsa R, Lobo DN . Recent developments in diagnosis of pancreatic cancer. BMJ 2004; 329: 668-73. PubMed
- Deutsche Gesellschaft für Hämatologie und medizinische Onkologie e.V. (DGHO). Leitlinie Pankreaskarzinom. Stand 2018. www.onkopedia.com
- Freelove R, Walling AD. Pancreatic cancer: Diagnosis and management. Am Fam Physician 2006; 73: 485-92. PubMed
- Robert Koch Institut. Zentrum für Krebsregisterdaten. Pankreaskarzinom.Stand: 17.12.2019. www.krebsdaten.de
- Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V.. Bericht zum Krebsgeschehen in Deutschland 2016. Zentrum für Krebsregisterdaten im Robert Koch-Institut (Hrsg). Berlin, 2016 www.krebsgesellschaft.de
- Qiu, D., et al.. Overview of the epidemiology of pancreatic cancer focusing on the JACC Study. J Epidemiol 2005; 15 Suppl 2: S157-67. pmid:16127228 PubMed
- de la Cruz MSD, Young AP, Ruffin MT. Diagnosis and management of oancreatic cancer. Am Fam Physician. 2014 Apr 15;89(8):626-632. PubMed
- European Society for Medical Oncology. Cancer of the Pancreas: ESMO Clinical Practice Guidelines, Stand 2015. www.esmo.org
- Schenk M, Schwartz AG, O'Neal E, et al. Garabrant familial risk of pancreatic cancer. J Natl Cancer Inst 2001; 93: 640-44. PubMed
- Vincent A, Herman J, Schulick R, et al. Pancreatic cancer. Seminar. Lancet 2011; 378: 607-20. PubMed
- Michaud DS, Giovannucci E, Willett WC, Colditz GA, Stampfer MJ, Fuchs CS. Physical activity, obesity, height, and the risk of pancreatic cancer. JAMA 2001; 286: 921-9. PubMed
- Ben Q, Xu M, Ning X, et al. Diabetes mellitus and risk of pancreatic cancer. A meta-analysis of cohort studies. Eur J Cancer 2011; 47: 1928-37 PubMed
- Liao W-C, Tu YK, Wu MS, et al. Blood glucose concentration and risk of pancreatic cancer: Systematic review and dose-response meta-analysis. BMJ 2015 Jan 3; 349:g7371. doi: 10.1136/bmj.g7371 DOI
- Navid Sadeghi et all. Metformin use is associated with better survival of diabetic patients with pancreatic cancer. Clinical Cancer Research 2012; 18: 2905-2912. doi:10.1158/1078-0432.CCR-11-2994 DOI
- Hidalgo M. Pancreatic cancer. Review article. N Engl J Med 2010; 362: 1605-17. PubMed
- Gapstur SM, Jacobs EJ, Deka A, et al. Association of alcohol intake with pancreatic cancer mortality in never smokers. Arch Intern Med 2011; 171: 444-51. PubMed
- Fryzek, J.P., et al.. A case-control study of self-reported exposures to pesticides and pancreas cancer in southeastern Michigan. Int J Cancer 1997; 72(1): 62-7. www.ncbi.nlm.nih.gov
- Ji, B.T., et al.. Occupational exposure to pesticides and pancreatic cancer. Am J Ind Med 2001; 39(1): 92-9. www.ncbi.nlm.nih.gov
- Ojajarvi, I.A., et al.. Occupational exposures and pancreatic cancer: a meta-analysis. Occup Environ Med 2000; 57(5): 316-24. www.ncbi.nlm.nih.gov
- Ojajarvi, A., et al.. of pancreatic cancer in workers exposed to chlorinated hydrocarbon solvents and related compounds: a meta-analysis.. Am J Epidemiol 2001; 153(9): 841-50. www.ncbi.nlm.nih.gov
- Weiderpass, E., et al. Occupational exposures and gastrointestinal cancers among Finnish women. J Occup Environ Med 2003; 45(3): 305-15. www.ncbi.nlm.nih.gov
- Yassi, A., R.B. Tate, and M. Routledge. Cancer incidence and mortality in workers employed at a transformer manufacturing plant: update to a cohort study. Am J Ind Med 2003; 44(1): 58-62. www.ncbi.nlm.nih.gov
- Alguacil, J., M. Pollan, and P. Gustavsson. Occupations with increased risk of pancreatic cancer in the Swedish population. Occup Environ Med 2003; 60(8): 570-6. www.ncbi.nlm.nih.gov
- Alguacil, J., et al.. Occupation and pancreatic cancer in Spain: a case-control study based on job titles. PANKRAS II Study Group. . Int J Epidemiol 2000; 29(6): 1004-13. www.ncbi.nlm.nih.gov
- Laakkonen, A., T. Kauppinen, and E. Pukkala. Cancer risk among Finnish food industry workers. Int J Cancer 2006; 118(10): 2567-71. www.ncbi.nlm.nih.gov
- DiMagno EP. Pancreatic cancer: clinical presentation, pitfalls and early clues. Ann Oncol 1999; 10(suppl 4): 140-2. pubmed.ncbi.nlm.nih.gov
- Louhimo J, Alfthan H, Stenman UH, Haglund C. Serum HCG beta and CA 72-4 are stronger prognostic factors than CEA, CA 19-9 and CA 242 in pancreatic cancer. Oncology 2004; 66: 126-31. PubMed
- Pisters PW, Hudec WA, Hess KR, et al. Effect of preoperative biliary decompression on pancreaticoduodenectomy-associated morbidity in 300 consecutive patients. Ann Surg 2001; 234: 47-55. PubMed
- Sewnath ME, Karsten TM, Prins MH, et al. A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice. Ann Surg 2002; 236: 17-27. PubMed
- Wong JC, Lu DS. Staging of pancreatic adenocarcinoma by imaging studies. Clin Gastroenterol Hepatol. 2008;6(12):1301–1308. pubmed.ncbi.nlm.nih.gov
- Gress F, Gottlieb K, Sherman S, Lehman G. Endoscopic ultrasonography-guided fine-needle aspiration biopsy of suspected pancreatic cancer. Ann Intern Med 2001; 134: 459-64. PubMed
- Li D, Xie K, Wolff R, Abbruzzese JL. Pancreatic cancer. Lancet 2004; 363: 1049-57. PubMed
- Durup-Scheel HJ, Mortensen MB, Qvist N, Hovendal CP. TNM staging and assessment of resectability of pancreatic cancer by laparoscopic ultrasonography. Surg Endosc 1999; 13: 967-71. PubMed
- Deutsche Krebsgesellschaft.Psychoonkologische Diagnostik, Beratung und Behandlung von erwachsenen Krebspatienten. AWMF-Leitlinie Nr. 032-051OL, Stand 2014. www.awmf.org
- Deutsche Gesellschaft für Palliativmedizin.Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. AWMF-Leitlinie Nr. 128-001OL, Stand 2015. www.awmf.org
- Jemal A, Clegg LX, Ward E, Ries LA, Wu X, Jamison PM, et al. Annual report to the nation on the status of cancer, 1975-2001, with a special feature regarding survival. Cancer 2004; 101: 3-27. PubMed
- Sohn TA, Yeo CJ, Cameron JL, et al. Resected adenocarcinoma of the pancreas -- 616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 2000;4:567-579. PubMed
- Keim, Volker; Klar, Ernst; Poll, Michael; Schoenberg, Michael H.. Der pankreasoperierte Patient. Deutsches Ärzteblatt 2009; 106(48): 789-794. doi:10.3238/arztebl.2009.0789 DOI
- Burcharth F, Olsen SD, Trillingsgaard J et al. Pancreaticoduodenectomy for periampullary cancer in patients more than 70 years of age. Hepato Gastroenterol 2001; 48: 1149-52. www.ncbi.nlm.nih.gov
- Povoski SP, Karpeh MS, Conlon KC, Blumgart LH, Brennan MF. Association of preoperative biliary drainage with postoperative outcome following pancreaticoduodenectomy. Ann Surg 1999; 230: 131-42. PubMed
- Van der Gaag NA, Rauws EA, Van Eijck CH, et al. Preoperative biliary drainage for cancer of the head of the pancreas. N Eng J Med 2010; 362: 129-37. www.nejm.org
- Dormann A, Meisner S, Verin N et al. Self-expanding metal stents for gastroduodenal malignancies: systematic review of their clinical effectiveness. Endoscopy 2004; 36: 543-50. PubMed
- Joachim Freischem. oncotrends.de. Fortschritte insbesondere im Bereich der adjuvanten Therapie bei Patienten mit Pankreaskarzinom. Stand 9. Juli 2018. www.oncotrends.de
- Deutsche Krebsgesellschaft (DKG). Erweiterte S3 Leitlinie Palliativmedizin für Patienten mit einer nicht heilbaren Krebserkrankung. Langversion 2.1 – Januar 2020 AWMF-Registernummer: 128/001-OL. www.dgpalliativmedizin.de
Autor*innen
- Kristine Scheibel, Dr. med., Fachärztin für Allgemeinmedizin, Norderney
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).