Zusammenfassung
- Definition:Lebererkrankung mit vermehrter Fettspeicherung in der Leber bei Personen ohne oder mit nur sehr geringem Alkoholkonsum. Das Spektrum reicht von der Fettleber über die nicht-alkoholische Fettleberhepatitis bis zur Zirrhose und HCC. Die Erkrankung tritt häufig in Verbindung mit dem metabolischen Syndrom auf.
- Häufigkeit:Die Prävalenz der Fettlebererkrankungen liegt zwischen 20 und 30 % in der erwachsenen Bevölkerung.
- Symptome:Wenige, keine typischen Symptome.
- Befunde:Oft mit metabolischem Syndrom vergesellschaftet. Fettleber sonografisch darstellbar, ggf. Leberwerte erhöht.
- Diagnostik:Anamnese, Labor, Berechnung von Fibrose-Scores, Bildgebung (Sonografie/Elastografie) und ggf. Leberbiopsie.
- Therapie:Hauptsächlich Lebensstilmodifikation, Gewichtsabnahme. Keine spezielle medikamentöse Therapie empfohlen.
Allgemeine Informationen
Definition
- Das morphologische Spektrum der nicht-alkoholischen Fettlebererkrankung (NAFLD) reicht von der einfachen Steatose über die Steatohepatitis (NASH) zu Leberfibrose und Zirrhose und damit bis zum hepatozellulären Karzinom oder seltener bis zum intrahepatischen Cholangiokarzinom.1
- reine Steatose, ohne begleitende Entzündung oder Fibrose: reversibel mit in der Regel nicht progredientem Verlauf1
- Die Steatosis hepatis (Fettleber) zeichnet sich durch eine Einlagerung von Fett in die Hepatozyten aus. Eine Steatohepatitis liegt dann vor, wenn neben der Steatosis hepatis zusätzlich eine Entzündung nachweisbar ist.1
- Eine geringgradige (milde) Steatose betrifft < 33 %, eine mittelgradige (mäßige) 33–66 % und eine hochgradige (schwere) > 66 % des Parenchyms.
- Für die Diagnose einer NAFLD müssen ein signifikanter Alkoholkonsum und andere sekundäre Ursachen für die Leberverfettung ausgeschlossen sein.2
- Internationale Autor*innen fordern eine Unbenennung der Krankheitsentität nach ihrer Ursache: Metabolic (Dysfunction) Associated Fatty Liver Disease, MAFLD.3
Häufigkeit
- Prävalenz der NAFLD in der erwachsenen Allgemeinbevölkerung weltweit ca. 25 %1
- in Deutschland ca. 23 %
- Die globale Prävalenz der NASH wird ca. 3–5 % geschätzt.1
- in Deutschland 4 %
- Wenige Daten zur Prävalenz der NASH-Zirrhose in der Allgemeinbevölkerung1
- In Risikopopulationen wurden Prävalenzen der NASH von bis zu 50 % geschätzt.1
- Die Häufigkeit nimmt stark mit Übergewicht/Adipositas und bei Diabetes zu.
- Populationsbasierte Untersuchungen an größeren Kohorten zeigten mit 19–31 % eine höhere Prävalenz der NAFLD bei Männern (gegenüber 15–16 % bei Frauen).1
- Diese Unterschiede treffen wohl vor allem für übergewichtige Patient*innen zu.
- Bei schlanken Patient*innen und bei Personen mit NASH scheint der Einfluss des Geschlechts weniger klar zu sein.1
- Kinder und Jugendliche sind in industrialisierten Ländern zunehmend häufiger von NAFLD betroffen. Die Prävalenz von NAFLD ist signifikant höher bei übergewichtigen Jungen im Vergleich zu Mädchen. Auch bei Kindern und Jugendlichen können progrediente Formen vorkommen.1
- Die Prävalenz der NAFLD bei Kindern und Jugendlichen in der Gesamtbevölkerung ist mit 3–10 % niedriger als bei Erwachsenen.
- Die NASH-induzierte Leberzirrhose und das hepatozelluläre Karzinom (HCC) auf dem Boden einer NASH stellen zunehmend häufiger eine Indikationen zur Lebertransplantation (LTX) dar.1
Ätiologie und Pathogenese
- Die Entwicklung einer NAFLD hat genetische, epigenetische, ethnische, hormonelle und umweltbedingte Ursachen.1
- Eine nicht-alkoholische Fettlebererkrankung (NAFLD) ist im weitesten Sinne metabolisch bedingt.1
- Meist bestehen bei Patient*innen mit einer NAFLD eine zentrale Adipositas und weitere Komponenten eines metabolischen Syndroms.
- Die NAFLD kann sich aber auch bei normalgewichtigen Patient*innen (sog. Lean-NAFLD, ca. 20 % der Fälle, BMI = 18,5–24,9 kg/m2) entwickeln.
- Der natürliche Verlauf einer NAFLD wird durch den Lebensstil wie Ernährung und körperliche Aktivität beeinflusst.1
- Adipositas ist ein gemeinsamer Risikofaktor für NAFLD und Typ-2-Diabetes. Alle 3 Entitäten zeigen eine steigende Prävalenz. NAFLD und Typ-2-Diabetes sind in Hinblick auf Inzidenz und Prognose wechselseitig assoziiert.1
- Es besteht eine positive Korrelation zwischen NAFLD und verschiedenen metabolischen Parametern (Bauchumfang, Body Mass Index, Triglyzeride).
- Mehrere Studien weisen darauf hin, dass das intestinale Mikrobiom sowohl an der Entstehung als auch der Progression einer NAFLD beteiligt ist.
- Eine „westliche Ernährungsweise“ bei Jugendlichen ist prospektiv mit einem erhöhten Risiko der späteren Entwicklung einer Fettleber assoziiert. Hier spielt insbesondere der Konsum von sog. Softdrinks eine wichtige Rolle.
- Zusatz von Zucker, Saccharose und wahrscheinlich besonders Fruktose, kann zu einer erhöhten Lipogenese und erniedrigter Fettoxidation beitragen.2
- Mischformen zwischen NAFLD und der alkoholischen Fettlebererkrankung sind möglich.4
Disponierende Faktoren
- Mit dem Vorliegen einer NAFLD assoziiert sind:1
- ein erhöhter BMI (insbesondere mit viszeraler Adipositas)
- das Vorliegen einer Insulinresistenz bzw. eines Typ-2-Diabetes
- höheres Alter
- männliches Geschlecht
- hispanische Abstammung
- genetische Prädisposition.
- Zu den endogenen pathogenetischen Faktoren zählen genetische Disposition und wahrscheinlich die Zusammensetzung des Darmmikrobioms.1
- Genetik
- Verschiedene genetische Polymorphismen konnten als mögliche Risikofaktoren für die NAFLD und die Erkrankungsschwere identifiziert werden.5
- Insbesondere Träger*innen des PNPLA3 p.I148M Risikoallels (homo- oder heterozygot sind 50 % der Personen europäischer Abstammung) haben ein erhöhtes Risiko für die Entwicklung einer Fettleber, Fibrose, Zirrhose und HCC.1
- Die NAFLD gilt zudem als ein unabhängiger kardiovaskulärer Risikofaktor und ist ein Prädiktor für die Entwicklung eines Typ-2-Diabetes. Konsequenterweise sollte die NAFLD nicht als isolierte Lebererkrankung, sondern als Teil einer Systemerkrankung betrachtet werden.6
- Rauchen ist mit einer fortgeschrittenen Leberfibrose bei NAFLD assoziiert.1
ICPC-2
- D97 Lebererkrankung NNB
ICD-10
- K75.8 Sonstige näher bezeichnete entzündliche Leberkrankheiten/Nicht-alkoholische Steatohepatitis [NASH]
- K76.0 Sonstige Krankheiten der Leber
Diagnostik
Diagnostische Kriterien
Ausschluss anderer Ursachen
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Zur Abgrenzung einer NAFLD von einer ALD oder Mischformen sollte ein täglicher Alkoholgrenzwert von 10 g bei der Frau und 20 g beim Mann angesetzt werden.
- Der Nachweis von CDT ist aufgrund mangelnder Sensitivität und Spezifität für die differenzialdiagnostische Abklärung von NAFLD versus ALD nicht geeignet.
- Bei Notwendigkeit eines sicheren Nachweises von Alkoholkonsum kann eine Bestimmung von Ethylglucuronid im Urin oder Haar erfolgen, z. B. vor Aufnahme auf eine Lebertransplantationsliste.
- Bei der Diagnostik von Fettlebererkrankungen sollen neben dem Alkohol weitere sekundäre Ursachen und begleitende Lebererkrankungen ausgeschlossen werden.
- Bei inzidentellem Nachweis einer Fettleber und Symptomfreiheit und unauffälligen leberassoziierten Laborwerten: Abklärung des Vorliegens kardiometabolischer Erkrankungen, Alkoholkonsum sowie Medikamentennebenwirkungen
Zufallsbefunde
- Bei inzidentellem Nachweis einer Fettleber und entweder klinischen Symptomen bzw. Zeichen einer Lebererkrankung oder auffälligen leberassoziierten Laborwerten soll das Vorliegen einer NASH weiter evaluiert werden.1
- Für die nichtinvasive Risikoeinschätzung hinsichtlich der Fibrose-Progression kann der NAFLD-Fibrose-Score herangezogen werden, der sich aus den Parametern Alter, BMI, Blutglukosekonzentration, Thrombozytenzahl, Albumin und dem GOT/GPT-Quotienten berechnet.5
Nachweis entzündlicher Aktivität
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Aktuell ist kein etabliertes bildgebendes Verfahren für die nichtinvasive Beurteilung der entzündlichen Aktivität verfügbar.
- Für die Diagnose einer NASH gibt es keine gut etablierten nichtinvasiven Marker.
Histologische Kriterien
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Die histologische Diagnose einer einfachen Steatose (NAFL) soll gestellt werden, wenn > 5 % verfettete Hepatozyten nachgewiesen werden und die Kriterien der NASH nicht erfüllt werden.
- Die histologische Diagnose einer Steatohepatitis (NASH) soll gestellt werden, wenn neben der Steatose (> 5 %), ballonierte Hepatozyten und lobuläre Inflammation nachweisbar sind.
- Zur Erkennung von frühen Fibrose-Stadien, nekroinflammatorischer Aktivität und ballonierender Zellschädigung ist die Leberbiopsie nichtinvasiven Methoden (Laborwerte, Bildgebung, Elastografie) überlegen.
Differenzialdiagnosen
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Alkoholische Steatohepatitis
- CASH (Chemotherapie-assoziierte Steatohepatitis)
- Virushepatitiden
- Mangelernährung als Ursache
- Fettstoffwechselstörung als Ursache
- Medikamentenbedingte Lebererkrankung
- Hämochromatose
- Morbus Wilson
- Alpha-1-Antitrypsin-Mangel
- Autoimmune Hepatitis
- Akute Schwangerschaftsfettleber
- Zöliakie als Ursache
- Bakterielle Fehlbesiedelung des Dünndarms als Ursache
- Medikamentös bedingte Fettleber: z. B. durch Valproat, Tetrazykline, Nukleosidanaloga, ASS, Amiodaron, Tamoxifen, Methotrexat, Kortikosteroide, antiretrovirale Therapie, Irinocetan, Spironolacton, Sulfasalazin
Anamnese
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Patient*innen mit NAFLD sind überwiegend asymptomatisch, und die meisten haben normale Transaminasen.1
- Evtl. zunächst unspezifische Symptome, wie Antriebslosigkeit, Krankheitsgefühl und Beschwerden im oberen rechten Abdominalquadranten.
- Medikamentenanamnese und Fragen zum Lebensstil (Ernährung, Bewegung)
- Übergewicht bzw. Adipositas gelten als die wichtigsten Promotoren des metabolischen Syndroms.1
- Gewohnheiten bezüglich des Alkoholkonsums, z. B. mithilfe AUDIT-Fragebogen
- Familienanamnese
Klinische Untersuchung
- Die körperliche Untersuchung ist meist unauffällig, eine vergrößerte Leber kann tastbar sein.
- Häufig fallen Zeichen eines metabolischen Syndroms auf.
Ergänzende Untersuchungen in der Hausarztpraxis
- Labor
- Ultraschall
- Eine ausgeprägte Fettleber kann relativ einfach durch eine Ultraschalluntersuchung (hyperechogenes Lebergewebe, dorsale Abschwächung des Parenchymsignals) diagnostiziert werden.1,6
- Ein transabdomineller Ultraschall sollte als primäre Bildgebung bei Patient*innen mit Verdacht auf NAFLD eingesetzt werden. Die Untersuchung erlaubt keinen Ausschluss einer Steatosis hepatis und keine Unterscheidung zwischen NAFLD und NASH.1
Leitlinie: Nicht-alkoholische Fettlebererkrankungen1
Diagnostik
- Bei Erstdiagnose einer NAFLD sollte bei allen Patient*innen eine Risikostratifizierung hinsichtlich des zugrunde liegenden Fibrose-Stadiums durchgeführt werden. Hierfür sollten nichtinvasive Tests/Scores (NAFLD-Fibrose-Score (NFS), FIB-4) oder die Elastografie, ggf. auch in Kombination eingesetzt werden.
- Bei Patient*innen mit niedrigem Fibroserisiko kann in regelmäßigen Abständen eine Verlaufskontrolle, z. B. von FIB-4 oder NFS und der Transaminasen, vorgenommen werden.
- bei erhöhtem Risiko einer Fibrose oder wiederholt erhöhten Leberwerten: Überweisung an Gastroenterolog*in/Hepatolog*in
- Bei Patient*innen mit FIB-4 oder NFS im intermediären (zwischen den beiden Grenzwerten liegenden) oder hohen (FIB-4 ≥ 2,67 bzw. NFS > 0,676) Bereich wird nach Berücksichtigung relevanter Komorbiditäten als weiteres Testverfahren eine Elastografie mittels VCTE (Vibration Controlled Transiente Elastography, Anm. d. Red.) empfohlen.
- Ultraschallbasierte Elastografie-Verfahren können zum Ausschluss einer fortgeschrittenen Leberfibrose und Leberzirrhose bei NAFLD herangezogen werden.
- Eine Leberbiopsie soll durchgeführt werden, wenn eine Fibrose sicher nachgewiesen oder ausgeschlossen werden soll.
- Patient*innen, bei denen mittels nichtinvasiver Verfahren oder histologisch Hinweise auf eine Zirrhose bestehen, sollen regelmäßig bezüglich der Entwicklung von leberassoziierten Komplikationen überwacht werden.
- Risikofaktoren und Begleiterkrankungen bei NAFLD
- NAFLD-Patient*innen sollen hinsichtlich ihres kardiovaskulären Risikos wie Risikopatient*innen entsprechend den Leitlinien der kardiologischen Fachgesellschaften evaluiert werden.
- Wegen der engen und wechselseitigen Assoziation der NAFLD mit metabolischen Risikofaktoren sollen in der Diagnostik der NAFLD BMI, Bauchumfang sowie der Blutdruck dokumentiert werden und eine Messung des Nüchternglukose-Wertes, des HbA1c, der Triglyzeride sowie des LDL- und HDL-Cholesterins durchgeführt werden.
- Weitere Komorbiditäten wie (subklinische) Hypothyreose, polyzystisches Ovarialsyndrom (PCOS) und obstruktives Schlafapnoe-Syndrom sollten in der Abklärung der NAFLD berücksichtigt werden.
- Prognoseabschätzung und Risikostratifizierung
- Die diagnostischen Maßnahmen sollen eine Feststellung der Krankheitsschwere zum Ziel haben und dadurch der individuellen Prognoseabschätzung/Risikostratifizierung dienen.
Diagnostik bei Spezialist*innen
- Elastografie/Elastometrie1
- Siehe Leitlinienkasten oben.
- MRT
- Für die Durchführung einer MRS-PDFF-Untersuchung gibt es gut validierte Daten, diese Untersuchung ist jedoch noch kein Teil der klinischen Routine und im Vergleich zum Ultraschall nicht so breit verfügbar, teurer und aufwändiger.6
- CT
- Sollte nicht als primäre Such- oder Screeningmethode für die NAFLD eingesetzt werden. Eine Differenzierung zwischen NASH und NAFL ist mit der CT nicht adäquat möglich.1
- Leberbiopsie
- zur sicheren Unterscheidung einer NAFLD von einer NASH und von der NASH-Zirrhose1
- Bei sehr niedrigem Risiko für eine Fibrose ist eine Biopsie nicht erforderlich.6
- Bei ungefähr 2–7 % der Patient*innen mit einer NAFLD sind in der Leberbiopsie Entzündung (NASH) und Fibrose nachzuweisen.7
- Zum Ausschluss anderer Lebererkrankungen kann eine histologische Sicherung erforderlich sein.1
Indikationen zur Überweisung
- Bei erhöhtem Fibrose-Risiko oder wiederholt erhöhten Leberwerten Überweisung an Gastroenterolog*in/Hepatolog*in
Therapie
Therapieziele
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Progression der Erkrankung verhindern.
- Prävention und Früherkennung des HCC und extrahepatischer Malignome
- Risikofaktoren vorbeugen/behandeln.
- Prävention der erhöhten kardiovaskulären Morbidität und Letalität
Allgemeines zur Therapie
- Zahlreiche Studien belegen, dass durch Lebensstilmodifikationen wie Ernährungsumstellung mit Gewichtsreduktion und körperliche Aktivität sowohl die Transaminasen als auch die Leberhistologie verbessert werden können.1
- Grundpfeiler der aktuellen Therapie sind die Anpassung des Lebensstils sowie die Kontrolle und Therapie des metabolischen Syndroms, insbesondere eine Behandlung der kardiovaskulären Risikofaktoren.
- Bei adipösen Patient*innen ist bereits eine Gewichtsreduktion von 10 % innerhalb eines Jahres ausreichend, um den NAS-Score und das Fibrose-Stadium signifikant zu senken.6
- Laut einer Metaanalyse von 2019 ist eine Gewichtsreduktion deutlich mit einer Verbesserung des histologische Befundes, Normalisierung des GPT-Wertes, Abnahme der Steatose und einer günstigeren Prognose assoziiert.8
- Versagen bei schwerer Adipositas gewichtsreduzierende Diäten und eine Veränderung des Lebensstils, sollte eine bariatrische Operation in Erwägung gezogen werden.1
- Alkohol- und Nikotinkarenz
- Der Konsum von Kaffee kann aufgrund hepato- und kardioprotektiver Effekte empfohlen werden.1
Empfehlungen für Patient*innen
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Gewichtsreduktion
- hypokalorische Diät bei übergewichtigen oder adipösen NAFLD-Patient*innen
- Ausgewogene Ernährung (mediterrane Diät, komplexe Kohlenhydrate)
- Körperliche Aktivität (3 h/Woche aerobes Training)
- Bei NAFLD und moderatem Alkoholkonsum diesen reduzieren.
- Bei NAFLD-assoziierter Zirrhose Alkohol- und Nikotinkarenz
Medikamentöse Therapie
Prävention
- Der gesamte Abschnitt basiert auf dieser Referenz.1
- Regelmäßige körperliche Aktivität senkt das Risiko für NAFLD.
- Spazierengehen, Radfahren, Schwimmen
- regelmäßige (2- bis 3-mal pro Woche) und mindestens 30-minütige körperliche Betätigung
- Eine erhöhte Kalorienaufnahme ist ein Risikofaktor.
- Therapie eines metabolischen Syndroms
- Kaffeekonsum senkt das Risiko für ein HCC bei NAFLD.
Verlauf, Komplikationen und Prognose
Verlauf
- Die reine Steatose, ohne begleitende Entzündung oder Fibrose ist im Prinzip reversibel und zeigt in der Regel einen indolenten, allenfalls leicht progredienten Verlauf.
- Die nicht-alkoholische Steatohepatitis (NASH) kann zu einer Leberfibrose bis zur Leberzirrhose führen und ein hepatozelluläres Karzinom (HCC) oder seltener ein intrahepatisches Cholangiokarzinom (iCCa) verursachen.1
Komplikationen
- Patient*innen mit einer NAFLD haben eine erhöhte Gesamtmortalität, die vor allem auf kardiovaskuläre Erkrankungen, Tumorerkrankungen und einen Progress der Lebererkrankung selbst zurückzuführen ist.1
- Kardiovaskuläre Erkrankungen bei Patient*innen NAFLD sind eine häufigere Todesursache als leberbedingte Komplikationen.6
- Leberkarzinom (HCC)1
- Insulinresistenz, Entzündung sowie Veränderungen der Adipokine und Angiogenesefaktoren, die mit NAFLD assoziiert sind, sind eng mit dem HCC-Risiko verknüpft.
- NASH ist die zweithäufigste ätiologisch zugrunde liegende Lebererkrankung für die LTX bei Patient*innen mit einem HCC in den USA.
- Leberzirrhose
- Neben dem Risiko für HCC ist das Risiko für die Entwicklung extrahepatischer Malignome bei NAFLD erhöht, diese stellen bei diesen Patient*innen die zweithäufigste Todesursache dar.5
- Bei NAFLD mit fortgeschrittener Fibrose erhöhtes Risiko für kolorektale Karzinome und Mammakarzinome.
Prognose
- Die NAFLD ist mit einer erhöhten Mortalität in der Allgemeinbevölkerung verbunden. Diese ist bedingt durch kardiovaskuläre Erkrankungen, Tumorerkrankungen und die Lebererkrankung an sich.1
- NAFLD und NASH gelten als wichtige Ursache einer Leberzirrhose.
- Das Risiko für ein HCC bei NASH-Patient*innen ohne Leberzirrhose liegt bei 0,02 % pro Jahr. Bei bestehender Zirrhose beträgt das HCC Risiko 1,5 % pro Jahr.1
- Bei NASH wurden auch bei geringer bis mäßiger Fibrose Fälle mit HCC beschrieben.1
- Auch in Deutschland ist die NASH-Zirrhose oder das NASH-assoziierte HCC eine zunehmende Indikation zur Lebertransplantation.6
Verlaufskontrolle
- Der folgende Abschnitt basiert auf dieser Referenz.1
- Ein Selbstmonitoring von Gewicht, körperlicher Aktivität und Ernährung soll allen Patient*innen mit NAFLD empfohlen werden.
- Bei allen Patient*innen mit NAFLD sollen klinische und laborchemische Verlaufskontrollen durchgeführt werden.
- Die individuelle Fibrose-Progression bei Patient*innen mit NAFLD kann durch die wiederholte Anwendung von nichtinvasiven Tests evaluiert werden.
- Basisdiagnostik für das Langzeitmanagement
- körperliche Untersuchung mit Bestimmung von BMI, Taillenumfang, Blutdruck
- laborchemische Untersuchung: ALT, AST, GGT, Bilirubin, AP, Blutbild, Lipidstatus (Triglyzeride, Cholesterin, HDL-, LDL-Cholesterin) Nüchternblutzucker, HbA1C
- Untersuchungsintervalle
- bei Patient*innen mit inzidenteller NAFLD ohne fortgeschrittene Fibrose und ohne typische Begleiterkrankungen: alle 2–3 Jahre
- bei Patient*innen mit fortgeschrittener Fibrose und/oder NASH Basisuntersuchungen in jährlichen Abständen
- Im Langzeitverlauf sollte regelmäßig das kardiovaskuläre Risikoprofil überprüft werden und auf Angebote der gesetzlichen Krebsfrüherkennung hingewiesen werden.
- HCC-Surveillance bei NAFLD-Zirrhose
- Die HCC-Überwachung sollte mittels halbjährlicher sonografischer Untersuchung der Leber durch erfahrene Untersucher*innen mit einem technisch ausreichenden Gerät erfolgen.
- Eine ergänzende AFP-Bestimmung kann durchgeführt werden.
- Bei unzureichenden sonografischen Untersuchungsbedingungen kann eine ergänzende MRT der Leber durchgeführt werden.
- HCC-Surveillance bei NAFLD ohne Zirrhose
- NAFLD-Patient*innen ohne nachgewiesene Zirrhose kann aktuell keine allgemeine Empfehlung für eine systematische HCC-Überwachung ausgesprochen werden.
- Bei fortgeschrittener NAFLD-Leberfibrose und weiteren Risikofaktoren (männliches Geschlecht, höheres Lebensalter, Typ-2-Diabetes, chronische hepatische Entzündungsrektion, genetische Risikofaktoren) kann ein Vorgehen entsprechend der Empfehlung bei NAFLD-Zirrhose angeboten werden.
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Es besteht ein Zusammenhang zwischen Übergewicht, einem zu hohen Gehalt an Fettstoffen im Blut, Diabetes und Fettlebererkrankungen.
- Patient*innen mit Fettlebererkrankungen, die keinen Alkohol konsumieren, haben eine deutlich bessere Prognose als Personen mit einer vergleichbaren Erkrankung, die Alkohol konsumieren.
Patienteninformationen in Deximed
Illustrationen
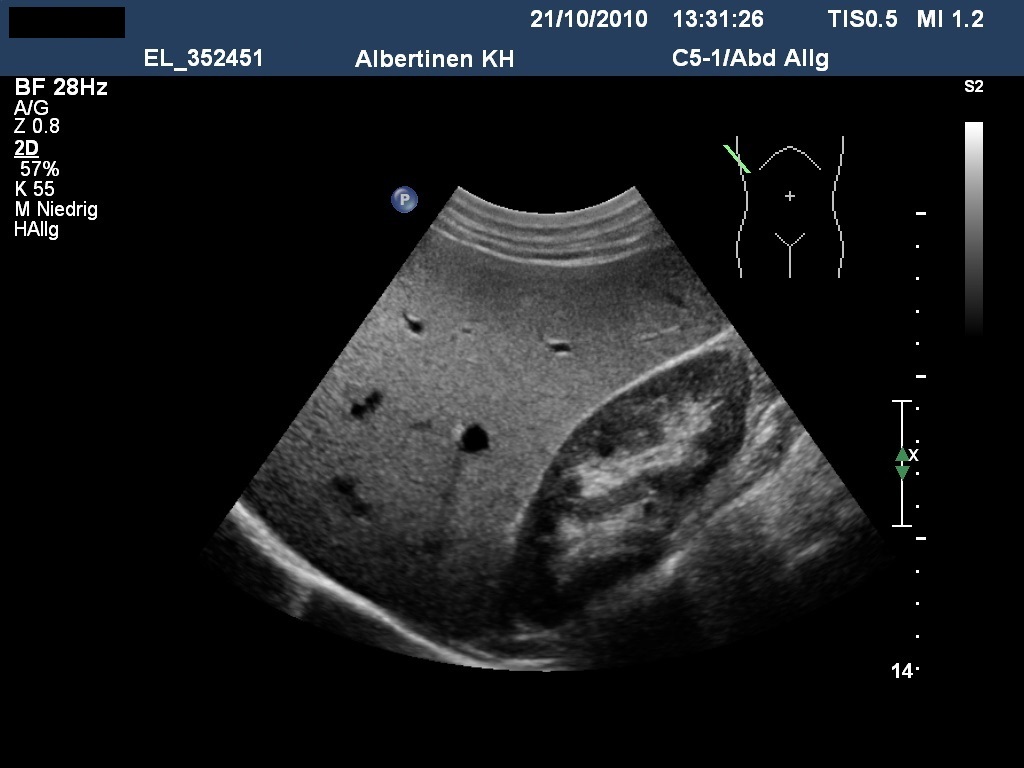
Sonografie: Echoreiche Fettleber bei metabolischem Syndrom (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Quellen
Leitlinien
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Nicht-alkoholische Fettlebererkrankungen. AWMF-Leitlinie Nr. 021–025. S2k, Stand 2022. www.awmf.org
Literatur
- Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. Nicht-alkoholische Fettlebererkrankungen. AWMF-Leitlinie Nr. 021–025, Stand 2022. www.awmf.org
- DiNicolantonio JJ, Subramonian AM, O'Keefe JH. Added fructose as a principal driver on non-alcoholic fatty liver disease: a public health crisis. Open Heart 2017. pmid:29118995 PubMed
- Eslam M, Sanyal AJ, George J; International Consensus Panel. MAFLD: A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterology. 2020 May;158(7):1999-2014.e1. doi: 10.1053/j.gastro.2019.11.312. Epub 2020 Feb 8. PMID: 32044314. pubmed.ncbi.nlm.nih.gov
- Weiß J, Rau M, Geier A. Nichtalkoholische Fettlebererkrankung. Deutsches Ärzteblatt 2014. www.aerzteblatt.de
- Wehmayer MH, Lohse AW, Kluwe J. Die nichtalkoholische Steatohepatitis und ihre Folgen. Der Diabetologe 2016. www.springermedizin.de
- Schuhmacher F, Tacke F. Die nicht-alkoholische Fettlebererkrankung (NAFLD). Hepatitis&more. 2017. www.hepatitisandmore.de
- Paul S, Davis AM. JAMA Clinical Guidelines Synopsis. Diagnosis and management of Nonalcoholic Fatty Liver Disease. JAMA 2018. doi:10.1001/jama.2018.17365 jamanetwork.com
- Koutoukidis DA, Astbury NM, Tudor KE, et al. Association of Weight Loss Interventions With Changes in Biomarkers of Nonalcoholic Fatty Liver Disease A Systematic Review and Meta-analysis. JAMA Intern Med 2019. pmid:31260026. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Marlies Karsch-Völk, Dr. med., Fachärztin für Allgmeinmedizin, München
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).
Link lists
Relevante Artikel
- Leberzirrhose und chronische Leberinsuffizienz
- Leberzellkarzinom
- Übergewicht/Adipositas
- Metabolisches Syndrom
- Lebertransplantation
- Alkoholische Lebererkrankung
- Leberschäden durch Medikamente (DILI = Drug-Induced Liver Injury)
- Eisenüberladung (Hämosiderose, Hämochromatose)
- Wilson-Krankheit
- Autoimmunhepatitis (AIH)
- Akute Schwangerschaftsfettleber
- Typ-2-Diabetes