Zusammenfassung
- Definition:Idiopathische systemische Vaskulitis von kleinen und mittelgroßen Arterien, begleitet von schwerem Asthma und Eosinophilie.
- Häufigkeit:Inzidenz etwa 2–4:1.000.000 in USA und Westeuropa.
- Symptome:Asthma bronchiale als Erstsymptom, im Verlauf systemische Ausbreitung.
- Befunde:Stark variable Organmanifestationen, u. a. kutan, kardial und renal.
- Diagnostik:Nachweis von Asthma sowie Eosinophilie im Blutbild, zudem klinische Manifestationen der Vaskulitis, ggf. Biopsie.
- Therapie:Immunsuppression.
Allgemeine Informationen
Definition
- Seit 2012 offizielle Bezeichnung „eosinophile Granulomatose mit Polyangiitis (EGPA)“1
- vorher nach den Entdeckern Churg-Strauss-Syndrom benannt2
- Idiopathische systemische Vaskulitis von kleinen und mittelgroßen Arterien, begleitet von schwerem Asthma und Eosinophilie3
- Gehört zur Gruppe der ANCA-assoziierten systemischen Vaskulitiden, zusammen mit Wegener-Granulomatose und mikroskopischer Polyangiitis4
- Schwerwiegende Organmanifestationen vor allem an Herz, Nieren und Lunge5
Häufigkeit
- Das Vorkommen variiert je nach Region und zugrunde liegenden Diagnosekriterien.
- Mittleres Alter bei Diagnosestellung 49 Jahre5
- Männer und Frauen sind ähnlich häufig betroffen.5
- Insgesamt seltene Erkrankung
Ätiologie und Pathogenese
- Ätiologie unbekannt4
- Mehrere genetische Risikofaktoren wurden bislang identifiziert.9-10
- Neben der genetischen Prädisposition sind vermutlich weitere Umweltfaktoren zum Ausbruch der Erkrankung nötig.11
- mögliche Trigger: Infektionen, Allergene oder Medikamente
- Pathomechanismus13
- hyperreagible Immunantwort der Th2-Helferzellen mit gesteigerter Ausschüttung von IL-4, IL-13 und IL-5
- Aktivierung von Eosinophilen, die Gewebe und Gefäße schädigen können.
- hyperreagible Immunantwort der Th2-Helferzellen mit gesteigerter Ausschüttung von IL-4, IL-13 und IL-5
- 2 Subtypen anhand ANCA(anti-neutrophile cytoplasmatische Antikörper)-Positivität14
- 40 % der Patient*innen sind ANCA-positiv.
- erhöhte Prävalenz von Nierenkomplikationen und Lungenblutungen durch Läsionen der Alveolarkapillaren
- jedoch deutlich weniger kardiale Komplikationen
- 40 % der Patient*innen sind ANCA-positiv.
- Histologisch11
- Eine Biopsie ist nicht obligat, sichert die Diagnose jedoch weiter ab.
- typisch: eosinophile Infiltrate, extravaskuläre Granulome, nekrotisierende Vaskulitis und Glomerulonephritis
Prädisponierende Faktoren
- Asthma
- Genetische Prädisposition
ICPC-2
- K99 Herz-Gefäßerkrankung IKA
ICD-10
- M30 Polyarteriitis nodosa und damit verwandte Zustände
- M30.1 Panarteriitis mit Lungenbeteiligung
Inkl.: Allergische Granulomatose [Churg-Strauss-Granulomatose]
- M30.1 Panarteriitis mit Lungenbeteiligung
Diagnostik
Diagnostische Kriterien
- Es sind leider verschiedene Diagnosekriterien in Gebrauch, die aktuellsten wurden 2012 vorgestellt.1
- Churg und Strauss (1951)2
- Die Diagnose beruht auf Biopsie, zudem:
- Asthma
- eosinophile Infiltrate
- systemische Vaskulitis
- extravaskuläre Granulome
- fibrinoide Nekrosen im Bindegewebe.
- Lanham und Mitarbeiter*innen (1984)15
- klinischer Befund mit pathologischem oder ohne pathologisches Material
- Asthma
- Eosinophilie im Blut > 1,5 x 109/l oder > 10 % aller Leukozyten
- Nachweis von Vaskulitis in mindestens 2 Organen
- klinischer Befund mit pathologischem oder ohne pathologisches Material
- American College of Rheumatology (1990)16
- Mindestens 4 von 6 Kriterien sind zur Diagnosestellung nötig (Sensitivität 85 %, Spezifizität mindestens 99 %):
- Asthma bronchiale
- Eosinophilie im Blut > 10 % aller Leukozyten
- Neuropathie (Mononeuropathie oder Polyneuropathie)
- Lungeninfiltrate
- Affektion der Nasennebenhöhlen
- extravaskuläre eosinophile Infiltrate bei Biopsie.
- Mindestens 4 von 6 Kriterien sind zur Diagnosestellung nötig (Sensitivität 85 %, Spezifizität mindestens 99 %):
- Revidierte Nomenklatur der Chapel Hill Consensus Conference (2012)1
- pathologische und klinische Befunde
- Eosinophilenreiche und nekrotisierende granulomatöse Entzündung, die oft die Atemwege befällt, sowie nekrotisierende Vaskulitis, die vor allem kleine und mittelgroße Gefäße betrifft, assoziiert mit Asthma und Eosinophilie.
- pathologische und klinische Befunde
Differenzialdiagnosen
- Allergische Erkrankungen
- Asthma
- allergische bronchopulmonale Aspergillose
- Sarkoidose
- Eosinophile Erkrankungen
- pulmonale Eosinophilie durch Medikamente oder Parasiten
- chronische eosinophile Pneumonie
- Hypereosinophilie-Syndrom
- exogen allergische Alveolitis
- eosinophile Gastroenteritis
- rheumatische Arthritis
- Vaskulitiden
- Wegener-Granulomatose
- mikroskopische Polyangiitis
- Polyarteriitis nodosa
- Guillain-Barré-Syndrom
Anamnese
- Typischer Verlauf15
- allergische Prodromalphase über mehrere Jahre mit Asthma, allergischer Rhinitis und Sinusitis
- eosinophile Phase mit peripherer Eosinophilie und eosinophiler Gewebeinfiltration
- finale systemische Phase mit Organkomplikationen wie Glomerulonephritis und Neuropathien
- Klassische Patient*in
- Patient*in mittleren Lebensalters5
- seit mehreren Jahren unter Asthma leidend
- durchschnittliche Dauer von Beginn einer Asthma-Symptomatik bis zur Diagnosestellung EPGA 11,8 Jahre17
- Im Verlauf wird Asthma schwerwiegender mit Steroidabhängigkeit.17
- 70–80 % der Patient*innen mit rezidivierenden Sinusitiden11
- zunehmende Beeinträchtigung des Allgemeinzustandes mit Abgeschlagenheit, Gewichtsverlust, Fatigue-Syndrom, Fieber, Arthralgien und Mononeuritis multiplex18
Basisuntersuchungen bei Erstdiagnostik
Leitlinie: Basisuntersuchungen für die Erstdiagnostik19
- Vollständige körperliche Untersuchung einschl. klinisch neurologischer Untersuchung
- Labor
- Differenzialblutbild
- C-reaktives Protein (CRP), Blutsenkungsgeschwindigkeit (BSG)
- Kreatinin (glomeruläre Filtrationsrate [GFR]), Harnstoff
- Elektrolyte
- Gamma-Glutamyl-Transferase (Gamma-GT), Alanin-Aminotransferase (ALT), Aspartat-Aminotransferase (AST), Kreatinkinase (CK), Laktatdehydrogenase (LDH)
- Urinstatus und -sediment
- ANCA-IFT und ANCA-ELISA bzw. ANCA-Zielantigen-spezifischer Test
- Elektrokardiogramm (EKG)
- Echokardiografie
- Thorax-Röntgenaufnahme in 2 Ebenen
- Lungenfunktionsuntersuchung einschl. Bodyplethysmografie und Bestimmung der Diffusionskapazität
- Abdomensonografie
- Kranielle Magnetresonanztomografie inkl. Abbildung von Nasennebenhöhlen und Orbitae
- Die erweiterte Diagnostik richtet sich nach den initialen Befunden und der klinischen Symptomatik sowie den in Betracht zu ziehenden Differenzialdiagnosen, wobei im Sinne einer vollständigen Ausbreitungsdiagnostik jedem Symptom nachgegangen werden sollte.
Klinische Untersuchung
- Befunde abhängig von der Organbeteiligung
- Lunge
- regelhaft betroffen
- spastisches, obstruktives Atemgeräusch bei akutem Asthma
- Hämoptysen bei Befall der alveolären Kapillaren
- Obere Atemwege4
- Nervensystem
- klassisch Mononeuritis multiplex20
- asymmetrische, unilaterale Neuropathien (im Gegensatz zu Polyneuropathie)
- Affektion des ZNS mit Schlaganfall möglich4
- klassisch Mononeuritis multiplex20
- Herz
- 27–45 % der Patient*innen betroffen, diverse Krankheitsbilder11
- am häufigsten Perikarditis und Kardiomyopathien
- Die Herzbeteiligung ist ein starker Prädiktor für die Lebenserwartung.21
- 27–45 % der Patient*innen betroffen, diverse Krankheitsbilder11
- Gastrointestinal-Trakt
- eher selten, abdominelle Schmerzen oder Diarrhöen bei 8 % der Patient*innen5
- Haut
- Nieren
- Nierenbeteiligung bei 16–27 % der Patient*innen (seltener als bei anderen Vaskulitiden)11
- typischerweise Pauci-Immun-Glomerulonephritis
Ergänzende Untersuchungen
- Blutuntersuchung
- häufig Anämie4
- Leukozytose mit Eosinophilie
- erhebliche Eosinophilie im peripheren Blut (Werte > 1,5 x 109/l oder > 10 % der Leukozyten ist selten bei Asthma und begründet den Verdacht auf EGPA)
- BSG und CRP oft erhöht4
- Antineutrophile zytoplasmatische Antikörper (ANCA), und insbesondere gegen Myeloperoxidase (MPO) gerichtete ANCA, sind bei 48–66 % der Patient*innen vorhanden und haben eine hohe Spezifizität für EPGA.22
- bei Nierenaffektion Kreatinin erhöht
- Urinuntersuchung
- Proteinurie, Hämaturie, Zellzylinder
- Lungenfunktionsuntersuchung
- EKG
- Arrhythmien
Diagnostik bei Spezialist*innen
- Röntgen-Thorax
- oft unspezifischer Befund
- Kann diffuse Infiltrate oder multiple Verdichtungen anzeigen.
- CT Thorax
- bei Auffälligkeiten im Röntgen-Thorax
- Echokardiografie
- Gastro- oder Koloskopie bei Darmblutung
- Biopsie eines klinisch betroffenen Organs, um die Diagnose zu bestätigen.
Indikationen zur Überweisung
- Einweisung ins Krankenhaus bei Verdacht auf EGPA zur Erfassung der möglichen Organmanifestationen und Einleitung der systemischen Therapie
- Diagnostik und Therapie sollten durch ein interdisziplinäres Team an einem in der Behandlung erfahrenen Zentrum erfolgen, in der Regel koordiniert durch internistischen Rheumatolog*innen.19
Therapie
Therapieziele
- Ziel der Behandlung ist die vollständige Remission der Erkrankung und Verhinderung von Rezidiven.
- Remission = Abwesenheit von signifikanter Krankheitsaktivität unter einer täglichen Dosis von ≤ 7,5 mg Prednisolonäquivalent und stabiler immunsuppressiver Therapie19
Allgemeines zur Therapie
- Siehe Therapiealgorithmus aus der S1-Leitlinie als Fließschema.19
- Bei dauerhafter Glukokortikoid-Gabe sollte eine Vitamin-D-Prophylaxe erfolgen.19
Leitlinie: Medikamentöse Therapie19
- Remissionsinduktion
- organ- oder lebensbedrohliches Stadium
- Remissionsinduktion mit Cyclophosphamid
- zusätzlich initial hochdosiert Glukokortikoide (1 mg/kg KG Prednisolonäquivalent/Tag, max. 80 mg)
- Bei schwerer Nierenfunktionseinschränkung (Kreatinin > 5,8 mg/dl [> 513 µmol/l]) aufgrund einer aktiven rapid progressiven Glomerulonephritis soll zusätzlich eine Plasmaseparationsbehandlung erwogen werden.
- kein organ- oder lebensbedrohliches Stadium
- Induktion mit Glukokortikoiden und Methotrexat (0,3 mg/kg KG wöchentlich, max. 25 mg) erwägen.
- organ- oder lebensbedrohliches Stadium
- Remissionserhaltung
- nach Erreichen einer Remission, üblicherweise 3–4 Monate nach Beginn einer Remissionsinduktion, Umstellung auf remissionserhaltende Therapie
- Methotrexat und Azathioprin sollen als gleichwertig potente Medikamente der 1. Wahl zum Remissionserhalt eingesetzt werden.
- Fortführung der remissionserhaltende Therapie über einen Zeitraum von mindestens 24 Monaten nach Erreichen der Remission
- Rezidive
- Rezidiv mit organbedrohenden Manifestationen (Major-Rezidiv)
- Erneute Induktionstherapie mit Cyclophosphamid in Kombination mit Glukokortikoiden (1 mg/kg KG Prednisolonäquivalent, max. 80 mg/Tag)
- Rezidive ohne organbedrohende Manifestationen (Minor-Rezidiv)
- vorübergehende Dosiserhöhung der Glukokortikoide und Dosiserhöhung der remissionserhaltenden Therapie
- Rezidiv mit organbedrohenden Manifestationen (Major-Rezidiv)
Neuartige Medikamente
- Mepolizumab: Monoklonaler Antikörper, der Interleukin-5 bindet.
Verlauf, Komplikationen und Prognose
Verlauf
- Unbehandelt sind Morbidität und Mortalität hoch.4
- Mit modernen Behandlungsmethoden ist die Prognose gut.
- Die häufigsten Todesursachen sind kardiale Komplikationen.5,21
Komplikationen
- Der Abschnitt basiert auf dieser Referenz.4
- Atemwege
- Status asthmaticus
- Magendarm-Trakt
- gastrointestinale Blutungen
- Herz
- Nervensystem24
- ischämische Optikusneuritis, Schlaganfall, epileptischer Anfall, Koma und Psychose
- Mononeuritis multiplex
- Nieren
- Glomerulonephritis
- terminale Niereninsuffizienz
- Mögliche Komplikationen einer Behandlung mit hochdosierten Kortikosteroiden
- iatrogenes Cushing-Syndrom
- Diabetes mellitus
- Myopathien
- Steroidpsychosen
- Osteoporose
- Mögliche Komplikationen einer Cyclophosphamid-Behandlung
- hämorrhagische Zystitis, Blasenfibrose, Knochenmarkssuppression25
- Infertilität
- Langfristige Behandlung mit Cyclophosphamid ohne die Toxizität abschwächende Medikamente erhöht das Risiko für Blasenkrebs um das 14- bis 45-Fache.26-29
Prognose
- Ohne Behandlung liegt die 5-Jahres-Überlebensrate bei nur 25 %.4
- Die Prognose ist mit modernen Behandlungsmethoden generell gut.
- Bei Therapie in einem spezialisierten Zentrum in Deutschland liegt die 5-Jahres-Überlebensrate bei 97 % und die 10-Jahres-Überlebensrate bei 89 %5, somit vergleichbar mit der Normalbevölkerung.
- Bei kardialer Beteiligung mit Herzinsuffizienz erhöht sich die Mortalität um das 3-Fache.5
Verlaufskontrolle
- Es sollten regelmäßige klinische und laborchemische Kontrollen bei internistischen Rheumatolog*innen erfolgen.19
- Besonderes Augenmerk liegt auf klinischen Zeichen von Rezidiven, da in diesem Fall die Behandlung schnell intensiviert werden sollte.
- Therapieänderung allein aufgrund eines steigenden ANCA-Titers oder erneuter ANCA-Positivität ist nicht empfohlen.19
Patienteninformationen
Worüber sollten Sie die Patient*innen informieren?
- Informieren Sie die Betroffenen darüber, dass die Krankheit schwer, die Prognose aber gut ist, wenn die Krankheit richtig behandelt wird.
- Auf bestehende Selbsthilfegruppen aufmerksam machen.19
- Siehe Informationen zu bestehenden Selbsthilfegruppen.
- Cyclophosphamid ist gonadotoxisch und kann Infertilität und den frühen Eintritt der Menopause induzieren.19
- Beratung in Fertilitätszentrum, ggf. Kryokonservierung von Spermien/Eizellen
- Erhöhtes Risiko für Infektionen unter Immunsuppression
- Schutzimpfungen des RKI empfohlen19
- Lebendimpfstoffe unter immunsuppressiver Therapie sind in der Regel kontraindiziert.
- Schutzimpfungen des RKI empfohlen19
- Malignomvorsorgeuntersuchungen inklusive dermatologischer Vorsorge sollten gemäß Geschlecht, Alter und familiärem Risikoprofil konsequent erfolgen.19
- Malignome sind eine der Haupttodesursachen bei EPGA, insbesondere nichtmelanotischer Hautkrebs tritt gehäuft auf.
Patienteninformationen in Deximed
Illustrationen
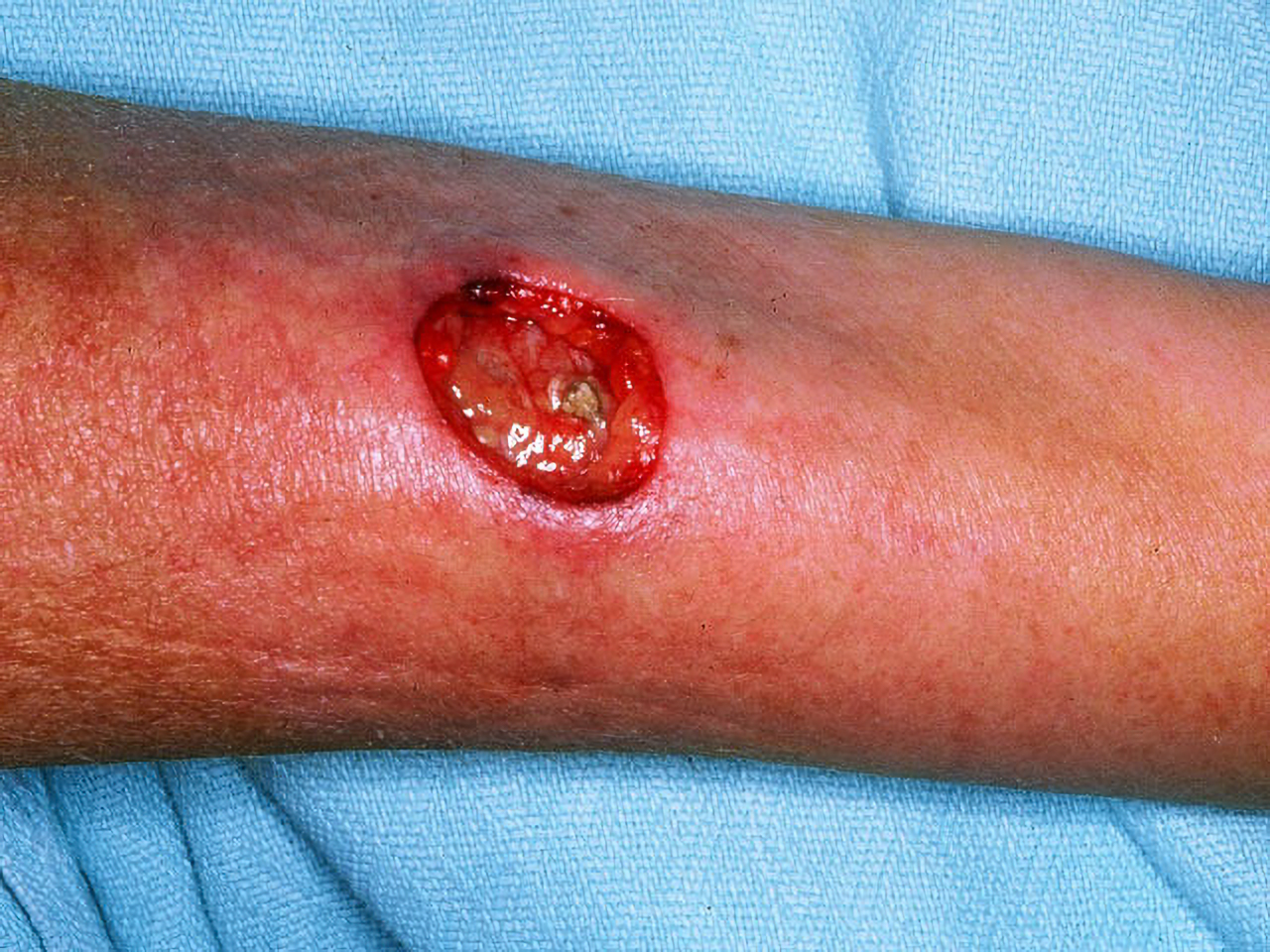
Churg-Strauss-Syndrom, eosinophile Granulomatose mit Polyangiitis
Quellen
Leitlinie
- Schirmer JH, Aries PM, De Groot K, et al. Im Auftrag der Deutschen Gesellschaft für Rheumatologie (DGRh). S1-Leitlinie Diagnostik und Therapie der ANCA-assoziierten Vaskulitiden. Stand 2017. www.doi.org
Literatur
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013; 65(1): 1-11. www.ncbi.nlm.nih.gov
- Churg J, Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa. Am J Pathol 1951; 27: 277-301. PubMed
- Noth I, Strek ME, Leff AR. Seminar: Churg-Strauss syndrome. The Lancet 2003; 361: 587-94. www.ncbi.nlm.nih.gov
- Lowe ST. Eosinophilic Granulomatosis with Polyangiitis (Churg-Strauss Syndrome). Medscape, last updated Dec 24, 2018. emedicine.medscape.com
- Moosig F, Bremer JP, Hellmich B, et al. A vasculitis centre based management strategy leads to improved outcome in eosinophilic granulomatosis and polyangiitis (Churg–Strauss, EGPA): monocentric experiences in 150 patients. Ann Rheum Dis 2013; 72(6): 1011-7. www.ncbi.nlm.nih.gov
- Berti A, Cornec D, Crowson CS, et al. The Epidemiology of Antineutrophil Cytoplasmic Autoantibody-Associated Vasculitis in Olmsted County, Minnesota: A Twenty-Year US Population-Based Study. Arthritis Rheumatol 2017; 69(12): 2338-50. www.ncbi.nlm.nih.gov
- Watts RA, Lane SE, Bentham G, Scott DG. Epidemiology of systemic vasculitis: a ten-year study in the United Kingdom. Arthritis Rheum 2000; 43: 414-19. PubMed
- Sada KE, Amano K, Uehara R, et al. A nationwide survey on the epidemiology and clinical features of eosinophilic granulomatosis with polyangiitis (Churg-Strauss) in Japan. Mod Rheumatol 2014; 24(4): 640-4. www.ncbi.nlm.nih.gov
- Vaglio A, Martorana D, Maggiore U, et al. HLA-DRB4 as a genetic risk factor for Churg-Strauss syndrome. Arthritis Rheum 2007; 56(9): 3159-66. www.ncbi.nlm.nih.gov
- Wieczorek S, Hellmich B, Arning L, et al. Functionally relevant variations of the interleukin-10 gene associated with antineutrophil cytoplasmic antibody-negative Churg-Strauss syndrome, but not with Wegener's granulomatosis. Arthritis Rheum 2008; 58(6): 1839-48. www.ncbi.nlm.nih.gov
- Wu EY, Hernandez ML, Jennette JC, et al. Eosinophilic Granulomatosis with Polyangiitis: Clinical Pathology Conference and Review. J Allergy Clin Immunol Pract 2018; 6(5): 1496-504. www.ncbi.nlm.nih.gov
- Lilly CM, Churg A, Lazarovich M, et al. Asthma therapies and Churg-Strauss syndrome. J Allergy Clin Immunol 2002; 109(1): 1-19. www.ncbi.nlm.nih.gov
- Vaglio A, Buzio C, Zwerina J. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): state of the art.. Allergy 2013; 68(3): 261-73. www.ncbi.nlm.nih.gov
- Sinico RA, Di Toma L, Maggiore U, et al. Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in Churg-Strauss syndrome.. Arthritis Rheum 2005; 52(9): 2926-35. www.ncbi.nlm.nih.gov
- Lanham JG, Elkon KB, Pusey CD, et al. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg-Strauss syndrome. Medicine (Baltimore) 1984; 63: 65-81. www.ncbi.nlm.nih.gov
- Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33: 1094-100. PubMed
- Cottin V, Bel E, Bottero P, et al. Respiratory manifestations of eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Eur Respir J 2016; 48(5): 1429-41. www.ncbi.nlm.nih.gov
- Guillevin L, Cohen P, Gayraud M, et al. Churg-Strauss syndrome: clinical study and long-term follow-up of 96 patients. Medicine 1999; 78: 26-37. PubMed
- Schirmer JH, Aries PM, De Groot K, et al. S1-Leitlinie Diagnostik und Therapie der ANCA-assoziierten Vaskulitiden. Stand 2017. link.springer.com
- Koike H, Sobue G. Clinicopathological features of neuropathy in anti-neutrophil cytoplasmic antibody-associated vasculitis. Clin Exp Nephrol 2013; 17(5): 683-5. www.ncbi.nlm.nih.gov
- Hazebroek MR, Kemna MJ, Schalla S, et al. Prevalence and prognostic relevance of cardiac involvement in ANCA-associated vasculitis: eosinophilic granulomatosis with polyangiitis and granulomatosis with polyangiitis. Int J Cardiol 2015; 199: 170-9. www.ncbi.nlm.nih.gov
- Hagen EC, Daha MR, Hermans J, et al. Diagnostic value of standardized assays for anti-neutrophil cytoplasmic antibodies in idiopathic systemic vasculitis. Kidney Int 1998; 53: 743-53. PubMed
- Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis. NEJM 2017; 376: 1921-1932. www.nejm.org
- Fredheim JM, Vedeler CA. Nevrologisk presentasjon av Churg-Strauss' syndrom. Tidsskr Nor Lægeforen nr. 8, 2003; 123: 1078-80. tidsskriftet.no
- Hoffman G, Kerr GS, Leavitt RY, et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992; 116: 488-98. www.ncbi.nlm.nih.gov
- Aptekar RG, Atkinson JP, Deckler JL, Wolff S, Chu E. Bladder toxicity with chronic oral cyclophosphamide therapy in non-malignant disease. Arthritis Rheum 1973; 16: 461-67. PubMed
- Plotz PH, Klippel JH, Deckler JL, et al. Bladder complications in patients receiving cyclophosphamide for systemic lupus erythematosus and rheumatoid arthritis. Ann Intern Med 1979; 91: 221-23. Annals of Internal Medicine
- Fairchild WV, Spence CR, Solomon HD, Gangai M. The incidence of bladder cancer after cyclophosphamide therapy. J Urol 1979; 122: 163-64. PubMed
- Ansell ID, Castro JE. Carcinoma of the bladder complicating cyclophosphamide therapy. Br J Urol 1975; 47: 413-18. PubMed
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).