Zusammenfassung
- Definition:Nachweis einer Myokardnekrose bei klinischem Bild einer akuten myokardialen Ischämie.
- Häufigkeit:Hospitalisierungsrate wegen Herzinfarkt ca. 360/100.000 Männer und ca. 180/100.000 Frauen in Deutschland (2015). Die Häufigkeit geht weiter zurück.
- Symptome:Andauernder Brustschmerz, thorakales Engegefühl, Atemnot, Angst, Übelkeit.
- Befunde:Keine spezifischen klinischen Befunde; evtl. Blässe, Kaltschweißigkeit, Tachypnoe. Blutdruck und Puls können normal, erhöht oder erniedrigt sein.
- Diagnostik:Die Diagnose wird im Allgemeinen gestellt auf der Basis von Vortest-Wahrscheinlichkeit, Symptomen, Troponin-Test. Das EKG erlaubt, zwischen Infarkt mit (STEMI) und ohne ST-Hebung (NSTEMI) zu differenzieren.
- Therapie:Bei akutem Koronarsyndrom schnellstmögliche primäre PCI, bei nicht vermeidbarer Zeitverzögerung > 120 min Thrombolyse. Duale Plättchenhemmung und Behandlung der Risikofaktoren.
Prüfungsrelevant für die Facharztprüfung Allgemeinmedizin1
- Befundung eines EKG bei Herzinfarkt
- Notfallmanagement eines Herzinfarkts in der Hausarztpraxis
- Akutbehandlung vor der Einweisung, inklusive Dosierungen der Medikamente
Allgemeine Informationen
Definition
- Definition des Myokardinfarkts der ESC/ACC/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction2
- akuter Herzinfarkt
- Nachweis einer Myokardnekrose (Troponinanstieg) bei klinischem Bild einer akuten myokardialen Ischämie
- alter Herzinfarkt
- pathologische Q-Zacken mit oder ohne Symptome bei Abwesenheit nichtischämischer Ursachen
- Nachweis eines Verlusts an vitalem Myokard in der Bildgebung, Bildgebungsmuster vereinbar mit ischämischer Ätiologie
- akuter Herzinfarkt
Klassifikation des Herzinfarkts aufgrund des EKG-Befundes
- Einteilung akuter Myokardinfarkte aufgrund des EKG-Befundes in 2 Gruppen:
- ST-Hebungsinfarkt oder STEMI (ST Elevation Myocardial Infarction)
- typischerweise verursacht durch eine komplette thrombotische Okklusion des Gefäßes3
- Nicht-ST-Hebungsinfarkt oder NSTEMI (Non ST Elevation Myocardial Infarction)
- verursacht durch partielle Okklusion des Gefäßes oder kompletten Verschluss mit Kollateralkreislauf.3
- ST-Hebungsinfarkt oder STEMI (ST Elevation Myocardial Infarction)
Häufigkeit
International
- Kardiovaskuläre Erkrankungen sind die häufigste Todesursache in Industriestaaten, aber auch in Entwicklungsländern.
- In den USA und in Europa gehen die Todesraten seit Mitte der 90er Jahre zurück.4
- Für die Entwicklungsländer wird ein starker Anstieg der kardiovaskulären Mortalität erwartet.5
- Umgekehrte Beziehung der Herzinfarktraten zum mittleren Einkommen eines Landes (1.92/2.21/4.13 Fälle pro 1.000 Personenjahre in Ländern mit hohem/mittlerem/niedrigem Einkommen)3
- Mehr als 80 % aller kardiovaskulären Todesfälle finden sich mittlerweile in den Entwicklungsländern.3
Deutschland
- Chronische KHK und akuter Myokardinfarkt führen die Todesursachenstatistik an.6
- Der Anteil der Todesfälle ist in den vergangenen Jahren aber rückläufig.6
- 2003: 7,5 % der Todesfälle durch akuten Myokardinfarkt
- 2013: 5,8 % der Todesfälle durch akuten Myokardinfarkt
- Kontinuierlicher Rückgang der Herzinfarkt-Neuerkrankungsraten7
- Im Jahr 2015 wurden wegen eines akuten Myokardinfarkts hospitalisiert:8
- 145.947 Männer (360/100.000 Einw.)
- 73.209 Frauen (176/100.000 Einw.).
- Der Rückgang der Koronarsterblichkeit ist bedingt durch:7
- Senkung der Herzinfarktinzidenz
- längeres Überleben nach Herzinfarkt.
- Im Jahr 2015 starben am akuten Myokardinfarkt:8
- 27.835 Männer (69/100.000 Einw.)
- 21.375 Frauen (51/100.000 Einw.).
- Lebenszeitprävalenz des ärztlich diagnostizierten Herzinfarktes 4,7 % in der Gruppe der 40- bis 79-Jährigen9
- Anstieg der Prävalenz mit zunehmendem Alter von 1,5 % bei 40- bis 49-Jährigen auf 10,2 % bei den 70- bis 79-Jährigen9
Ätiologie
Atherosklerose
- Ursache für ca. 90 % der Infarkte5
- Auslöser ist die Ruptur einer atherosklerotischen Plaque mit Thrombusbildung.
- Merke: Entscheidende Größen für die Entwicklung eines Infarkts sind Zusammensetzung und Vulnerabilität der Plaque, nicht die Größe der Plaque bzw. der Grad der Stenose!10
- Fettreiche, weiche Plaques sind gefährlicher als harte Plaques, da sie leichter rupturieren und nach Ruptur ein stärkeres thrombogenes Potenzial aufweisen.10
Embolie
- Ursächlich für ca. 3 % der akuten Infarkte11
- Häufigste Ursache ist Vorhofflimmern, andere Ursachen sind Kardiomyopathie, Klappenerkrankungen, infektiöse Endokarditis, maligne Tumoren und gekreuzte Embolien durch PFO/ASD11
Spasmus
- Gefäßobstruktion/-verschluss verursacht durch hyperreaktive glatte Muskelzellen und Endotheldysfunktion12
- Spasmen sind für ca. 1–1,5 % der Klinikeinweisungen wegen Angina pectoris verantwortlich.
Weitere Ursachen
- Seltenere Ursachen sind Vaskulitiden, Aortendissektionen, Drogen, Koronaranomalien, Traumata.5
Pathogenese
- Am häufigsten beginnt der pathophysiologische Prozess durch die Ruptur einer instabilen Plaque mit Thrombusbildung.
- Obstruktion des Gefäßes und dadurch Missverhältnis zwischen Sauerstoffbedarf und -angebot im Versorgungsgebiet des Gefäßes
- Die Kaskade von biochemischen und zellulären Veränderungen führt zu einer raschen Beeinträchtigung der Myokardfunktion und im weiteren Verlauf letztlich zur Nekrose von Myokardgewebe.
- Signifikante Wandbewegungsstörungen können bereits nach 60 sec auftreten.5
- Ein irreversibler Myokardschaden tritt zwischen 20 min und mehreren Stunden nach Beginn der Perfusionsstörung ein.5
- Wellenfrontartige Ausbreitung der Infarzierung von endokardial nach epikardial und zu den Grenzzonen der „Area at Risk“13
- Die Größe des Infarkts hängt ab von:13
- der Größe des ischämischen Areals
- der Dauer (und ggf. intermittierender Unterbrechung) der Koronarokklusion
- der Ausprägung des kollateralen Blutflusses
- dem Ausmaß der mikrovaskulären Dysfunktion.
- Reperfusion ist notwendig zur Rettung des ischämischen Myokards und Begrenzung der Infarktgröße.
- Andererseits führt nicht nur Ischämie, sondern auch Reperfusion per se zu einer zusätzlichen Schädigung von Myokard und Zirkulation.13
- Verschiedene mechanische und pharmakologische Strategien zur Begrenzung des Reperfusionsschadens wurden getestet, eine Übertragung experimenteller oder Proof-of-Concept-Studien in die klinische Praxis ist bislang aber nicht gelungen.13
- Ausbildung einer Koagulationsnekrose mit Vernarbung im weiteren Verlauf
- Evtl. Dilatation und Gestaltänderung des Ventrikels im Lauf des Heilungsprozesses, sog. „Remodeling“
Chronische Risikofaktoren
- Siehe auch Artikel Primärprävention von Herz- und Gefäßerkrankungen.
Modifizierbare Risikofaktoren
- In der INTERHEART-Studie wurden potenziell modifizierbare prädisponierende Faktoren für Herzinfarkt identifiziert.14
- Erhöhung des Risikos durch:
- Rauchen
- Diabetes mellitus
- Hypertonie
- abdominelle Adipositas (Taillen-Hüften-Verhältnis)
- erhöhtes ApoB/ApoA1-Verhältnis
- psychosoziale Belastung.
- Erniedrigung des Risikos durch:
- täglichen Konsum von Obst und Gemüse
- körperliche Aktivität
- möglicherweise moderaten Alkoholkonsum.
- Erhöhung des Risikos durch:
Nicht modifizierbare Risikofaktoren
- Alter
- Das Alter ist auch nach Adjustierung für sonstige, konventionelle Risikofaktoren ein unabhängiger Prädiktor für das kardiovaskuläre Risiko.15
- Das Alter ist Bestandteil diverser Risikorechner zur Berechnung des kardiovaskulären Risikos wie ARRIBA16, ESC-SCORE, AGLA-Risikorechner.
- Geschlecht
- Familienanamnese
- Die Risikoerhöhung durch positive Familienanamnese steht in Beziehung zu:18
- der Anzahl der betroffenen Angehörigen
- dem Alter, in dem der Infarkt bei Angehörigen aufgetreten ist (inverse Relation: je jünger das Alter, in dem der Infarkt bei der verwandten Person aufgetreten war, desto höher das Risiko).
- Die Risikoerhöhung durch positive Familienanamnese steht in Beziehung zu:18
Akute Risikofaktoren für die Auslösung eines Herzinfarktes
- Akute Risikofaktoren sind Aktivitäten oder Umstände, die das Risiko für einen akuten Herzinfarkt kurzfristig und passager erhöhen können:19
- zirkadianer Rhythmus: erhöhtes Risiko in den Morgenstunden
- körperliche Anstrengung
- mentaler Stress
- Kälteexposition
- sexuelle Aktivität
- große Menge Alkohol
- Kaffee
- Kokain
- exzessives Essen.
Weitere Risikofaktoren
- Weitere Faktoren können das Risiko erhöhen, u. a.:
- rheumatoide Arthritis und andere rheumatologische Erkrankungen20
- schwere Psoriasis21
- Gebrauch von NSAR bei Patient*innen mit KHK22-23
- hoher Ruhepuls24
- Influenza-Infektionen.25
ICPC-2
- K75 Akuter Myokardinfarkt
ICD-10
- I21 Akuter Myokardinfarkt
- I21.0 Akuter transmuraler Myokardinfarkt der Vorderwand
- I21.1 Akuter transmuraler Myokardinfarkt der Hinterwand
- I21.2 Akuter transmuraler Myokardinfarkt an sonstigen Lokalisationen
- I21.3 Akuter transmuraler Myokardinfarkt an nicht näher bezeichneter Lokalisation
- I21.4 Akuter subendokardialer Myokardinfarkt
- I21.9 Akuter Myokardinfarkt, nicht näher bezeichnet
- I22 Rezidivierender Myokardinfarkt
- I22.0 Rezidivierender Myokardinfarkt der Vorderwand
- I22.1 Rezidivierender Myokardinfarkt der Hinterwand
- I22.8 Rezidivierender Myokardinfarkt an sonstigen Lokalisationen
- I22.9 Rezidivierender Myokardinfarkt an nicht näher bezeichneter Lokalisation
Diagnostik
Diagnostische Kriterien
- Ein Herzinfarkt kann pathogenetisch-klinisch in 5 Typen kategorisiert werden:2
- Typ 1: Herzinfarkt auf dem Boden einer KHK, ausgelöst üblicherweise durch Plaqueruptur mit vollständigem oder unvollständigem thrombotischem Gefäßverschluss
- Nachweis eines Anstiegs und/oder Abfalls von Troponin mit mindestens einem Wert über dem Normbereich und mindestens eines der folgenden Kriterien:
- Ischämie-Symptome
- neue ischämische EKG-Veränderungen
- Entwicklung pathologischer Q-Zacken im EKG
- Bildgebung: neue Wandbewegungsstörung oder Verlust von vitalem Myokard
- Nachweis eines intrakoronaren Thrombus.
- Nachweis eines Anstiegs und/oder Abfalls von Troponin mit mindestens einem Wert über dem Normbereich und mindestens eines der folgenden Kriterien:
- Typ 2: Herzinfarkt durch Missverhältnis zwischen Sauerstoffbedarf und -angebot, per definitionem nicht durch Plaqueruptur verursacht (Auslöser z. B. Hypotonie, Anämie, Tachy- oder Bradyarrhythmie, Embolie, Spasmus)
- Nachweis von Troponinanstieg und weiteren Kriterien wie bei Typ 1 (außer Thrombusnachweis)
- Typ 3: kardialer Tod mit Symptomen und EKG-Veränderungen einer Ischämie, Todeseintritt vor Möglichkeit zur Blutentnahme oder vor Troponinanstieg oder Infarktnachweis durch Autopsie
- Typ 4: Herzinfarkt im Zusammenhang mit einer perkutanen Koronarintervention (PCI)
- Troponinanstieg > 5-fach des oberen Normwertes plus Nachweis von ischämischen EKG-Veränderungen oder Veränderungen in der Angiografie/Bildgebung des Myokards
- Typ 5: Herzinfarkt im Zusammenhang mit einer koronaren Bypass-Operation
- Troponinanstieg > 10-fach des oberen Normwertes plus Nachweis von ischämischen EKG-Veränderungen oder Veränderungen in der Angiografie/Bildgebung des Myokards
Differenzialdiagnosen
Kardiovaskuläre Erkrankungen
- Instabile Angina pectoris: akutes Koronarsyndrom (ACS) ohne Troponin-Anstieg
- Lungenembolie
- Perikarditis
- Stress-Kardiomyopathie (Tako-Tsubo)
- Aortenaneurysma
- Aortendissektion
- Myokarditis
- Aortenklappenstenose
Weitere Erkrankungen
- Lunge
- Gastrointestinaltrakt
- Brustwand
- Brustwandsyndrom
- Zoster
- Rippenfraktur
- Knochenmetastasen
- Angsterkrankung
Anamnese
Mögliche Prodromalsymptome
- Vor dem eigentlichen ACS können bei beiden Geschlechtern Prodromalsymptome auftreten, gehäuft bei Frauen:26-27
- Abgeschlagenheit
- Schlafstörungen
- Angstzustände
- Kurzatmigkeit
- leichte Brust-/Armbeschwerden.
Aktuelle Anamnese
- Brustschmerzen
- Hauptsymptom bei 70 % der Männer, aber nur bei 50 % der Frauen28
- Typische Brustschmerzen sind:29
- stark
- plötzlich aufgetreten
- linksseitig
- durch Anstrengung ausgelöst/verstärkt
- begleitet von Kurzatmigkeit, Angst.
- Ausstrahlung möglich in Arm(e), Hals, Unterkiefer, Epigastrium, Schultern
- Eine Besserung nach Nitratgabe ist nicht spezifisch für Ischämie.30
- Atemnot
- Übelkeit
- Angst
- Palpitationen
- Schwindel
- Atypische Beschwerden sind häufiger bei:
- Frauen
- älteren Menschen
- Diabetes mellitus
- Niereninsuffizienz
- Demenz.
- „Typische“ Symptome beweisen einen Herzinfarkt nicht, „untypische“ schließen ihn nicht aus!29
Vorgeschichte
- Kardiovaskuläre Risikofaktoren inkl. Familienanamnese
- Bekannte KHK, St. n. Herzinfarkt
- Sonstige kardiovaskuläre Erkrankungen
- Medikation
Klinische Untersuchung
Inspektion
- Allgemeinzustand
- Ängstlich?
- Bewusstseinsminderung?
- Blässe, Zyanose?
- Kaltschweißigkeit?
- Tachypnoe?
- Halsvenenstauung?
Vitalparameter
- Puls
- Frequenz
- Arrhythmie
- Blutdruck
- Kann normal, erhöht oder erniedrigt sein.
- V. a. eine neu aufgetretene Hypotonie ist möglicherweise ein Hinweis für die Entwicklung eines kardiogenen Schocks.
- Sauerstoffsättigung
- Körpertemperatur
- häufig Temperaturerhöhung in den ersten 24–48 h5
Auskultation
- Häufig keine auskultatorischen Befunde
- Evtl. 3. Herzton
- Evtl. Systolikum bei Mitralklappeninsuffizienz
- Siehe auch Artikel Herzgeräusche bei Erwachsenen.
- Rasselgeräusche über der Lunge bei Lungenstauung
Hausärztliches diagnostisches Vorgehen bei Brustschmerzen gemäß DEGAM-Leitlinie
- Der gesamte Abschnitt basiert auf dieser Referenz.31
- Ersteinschätzung: Liegt eine vitale Bedrohung vor?
- Beurteilung der Wahrscheinlichkeit einer KHK/eines ACS
- Ggf. Abklärung nichtkardialer Ursachen
Ersteinschätzung: Vitale Bedrohung?
- Ersteinschätzung der Situation beruht auf:
- den Umständen der Konsultation
- dringlicher Hausbesuch
- ängstliche Angehörige
- dem ersten Eindruck von der betroffenen Person
- der fokussierten Anamnese/Untersuchung
- (unmittelbar vorangegangene) Synkope oder Kollaps
- Kaltschweißigkeit
- hämodynamische Zeichen des Kreislaufversagens (Schockindex = Puls/syst. Blutdruck > 1)
- den Umständen der Konsultation
- Ggf. sind Maßnahmen der Erstversorgung bzw. lebensrettende Maßnahmen zu ergreifen.
- Lebensrettende Sofortmaßnahmen und symptomatische Therapie siehe auch die Artikel:
- Überwachung entsprechend den vorhandenen Möglichkeiten
- Alarmierung des Rettungsdienstes – stationäre Einweisung
- EKG, wenn möglich. Ein normales EKG sollte aber keinesfalls zur Entscheidung führen, von einer notfallmäßigen stationären Einweisung mit notärztlicher Begleitung abzusehen, wenn der Eindruck besteht, dass es sich um einen Herzinfarkt handeln könnte.
- weitere diagnostische Schritte nur, falls in der Situation möglich
Evaluation von KHK/ACS: Beurteilung der Wahrscheinlichkeit einer KHK (Marburger Herz-Score)
- Bei nicht unmittelbar pathologischen Vitalparametern erfolgt die Beurteilung der Wahrscheinlichkeit von KHK/ACS als häufigster Ursache für einen abwendbar bedrohlichen Verlauf.
- Ein einfaches Instrument für die Bestimmung der Wahrscheinlichkeit einer KHK ist der Marburger Herz-Score, der für den allgemeinärztlichen Bereich entwickelt wurde.
- Erfasst werden 5 Kriterien (jeweils 1 Punkt bei positivem Kriterium):
- Alter/Geschlecht (Männer ≥ 55 J. und Frauen ≥ 65 J.)
- bekannte vaskuläre Erkrankung
- Beschwerden belastungsabhängig
- Schmerzen durch Palpation nicht reproduzierbar
- Patient*in vermutet Herzkrankheit als Ursache.
- Wahrscheinlichkeit für KHK:
- 0–1 Punkte: sehr gering (< 1 %)
- 2 Punkte: gering: 5 %
- 3 Punkte: mittel: (25 %)
- 4–5 Punkte: hoch (65 %).
Evaluation von KHK/ACS: Beurteilung der Wahrscheinlichkeit eines akuten Koronarsyndroms (ACS)
- Bei Patient*innen mit mittlerer bis hoher Wahrscheinlichkeit für eine KHK (Marburger Herz-Score > 2 Punkte) sollte die Wahrscheinlichkeit für das Vorliegen eines ACS beurteilt werden.
- Kriterien, die für ein ACS sprechen:
- neu aufgetretene Beschwerden in Ruhe
- Beschwerdedauer in Ruhe > 20 min
- Crescendo-Angina
- Patient*in ist anders als sonst.
- Sie/er „gefällt" Ihnen nicht.
- Sie/er ist kaltschweißig.
- Sie/er ist blass.
- Kriterien, die gegen ein ACS sprechen:
- Der Thoraxschmerz ist nicht der eigentliche Beratungsanlass.
Ergänzende Untersuchungen
- Entscheidende ergänzende Untersuchungen für die initiale Diagnose bei klinischem V. a. ACS (akutes Koronarsyndrom) sind EKG und Labor (kardiales Troponin).
EKG
- 12-Kanal-EKG sollte bei V. a. ACS schnellstmöglich angefertigt werden. Wenn die Vortest-Wahrscheinlichkeit für ein ACS hoch ist, sollte aber ein normales EKG nicht dazu führen, dass weitere Maßnahmen unterbleiben – die Rate falsch negativer EKG-Befunde ist hoch.
- EKG sollte analysiert werden hinsichtlich (siehe auch Checkliste EKG):
- Endstreckenveränderungen
- persistierende ST-Hebungen
- ST-Senkungen
- T-Negativierungen
- Q-Zacken
- alter Herzinfarkt oder bereits fortgeschrittener akuter Herzinfarkt
- weiteren möglichen EKG-Veränderungen
- Schenkelblock
- ventrikuläre Tachykardien/Extrasystolen
- supraventrikuläre Tachykardien/Extrasystolen
- AV-Blockierungen, SA-Blockierungen.
- Evtl. ergänzend weitere Ableitungen aufzeichnen zur Erfassung eines lateralen (Abl. V7–V9) oder rechtsventrikulären (Abl. V3R–V4R) Infarktes.
- Arrhythmien – z. B. neu aufgetretenes Vorhofflimmern.
- Endstreckenveränderungen
- Bei symptomatischen Patient*innen mit initial nicht diagnostischem EKG sollten serielle EKG durchgeführt werden.
- Vergleich mit früheren EKG, wenn möglich
EKG-Manifestationen einer akuten kardialen Ischämie2
- ST-Hebung
- Neue ST-Hebung am J-Punkt in 2 aufeinanderfolgenden Ableitungen, als signifikant gelten:
- in allen Ableitungen außer Abl. V2–V3: ≥ 0,1 mV
- Abl. V2–V3: ≥ 0,2 mV bei Männern ≥ 40 Jahre; ≥ 0,25 mV bei Männern < 40 Jahre; ≥ 0,15 mV bei Frauen
- Neue ST-Hebung am J-Punkt in 2 aufeinanderfolgenden Ableitungen, als signifikant gelten:
- ST-Senkungen und Veränderungen der T-Welle
- neue horizontale oder deszendierende ST-Senkung ≥ 0,05 mV in zwei aufeinanderfolgenden Ableitungen und/oder T-Inversion ≥ 0,1 mV in zwei aufeinanderfolgenden Ableitungen mit prominenter R-Zacke oder R/S > 1
EKG-Manifestationen eines alten Herzinfarktes2
- Q-Zacke in Abl. V2–V3 ≥ 0,02 sec oder QS-Komplex in Abl. V2 und V3
- Q-Zacke ≥ 0,03 sec und ≥ 0,1 mV oder QS-Komplex in Abl. I, II, aVL, aVF oder V4–V6 in zwei Ableitungen
- R-Zacke ≥ 0,04 sec in Abl. V1–V2 und R/S ≥ 1 mit konkordant positivem T (sofern keine Überleitungsstörung)
Troponin
- Heutzutage wird für die Beurteilung eines myokardialen Schadens überwiegend das kardiale Troponin (I oder T) bestimmt.
- Die kardialen Troponine I und T werden nahezu ausschließlich im Herzmuskel exprimiert.
- Die früher vorwiegend durchgeführte Bestimmung der CK-MB ist dagegen mittlerweile von nachrangiger Bedeutung.
- Eine Troponinerhöhung zeigt Myokardschaden an, erlaubt aber per se keine Aussage über den zugrunde liegenden Mechanismus.2
- Die Troponinerhöhung ist definiert als Wert, der über der 99. Perzentile einer normalen Referenzpopulation liegt.2
- Anstieg nach 1–3 h, Maximum nach 12–96 h, Normalisierung in 1–2 Wochen
- Bestimmung mittels High-Sensitivity-Troponin-Assays bevorzugt32
- hoher negativer prädiktiver Wert
- Reduzieren das „troponin-blinde" Intervall, Anstieg ca. 1 Stunde nach Symptombeginn bei Verwendung von High-Sensitivity-Troponin-Assays.
- Anwendung von schnellen „Rule in-/Rule out"-Algorithmen in der Notaufnahme möglich
- Interpretation als quantitativer Marker (nicht nur „positiv“ oder „negativ“)
- je höher der Messwert, desto höher die Wahrscheinlichkeit eines Herzinfarktes als Ursache
- Point-of-care-Tests für den hausärztlichen Bereich sind nur sinnvoll unter der Berücksichtigung der Limitationen.
- niedrigere Sensitivität
- niedrigerer negativer prädiktiver Wert
- Die Latenz von einigen Stunden bis zur Ausbildung einer Troponin-Erhöhung ist zu berücksichtigen. Wird der Troponin-Test früher durchgeführt, sollte er bei entsprechender Klinik wiederholt werden. Keinesfalls sollte ein negativer Troponin-Test bei entsprechender Klinik von weiteren Maßnahmen abhalten. In Städten mit gut ausgebautem Rettungssystem erscheint der Troponin-Test meist verzichtbar. Ist die Entfernung zum nächsten Katheterlabor sehr hoch und sind mehrere Stunden seit Symptombeginn vergangen, kann die Troponin-Bestimmung einen wertvollen Hinweis auf das mögliche Vorliegen eines akuten Koronarsyndroms liefern.
Gegenwärtiger „Rule in-/Rule out“-Algorithmus
- Durch die Verwendung von High-Sensitivity-Troponin-Assays konnte die Zeit bis zum Nachweis/Ausschluss eines NSTEMI („Rule in/Rule out“) in der Klinik verkürzt werden.
- Bislang wurde der 0/3-Stunden-Algorithmus empfohlen (d. h. Troponinbestimmung bei Aufnahme und 3 Stunden später)30
- In den neuen ESC-Leitlinien wird die Anwendung eines 0/1-Stunden-Algorithmus (alternativ 0/2-Stunden) empfohlen.32
- verkürzte Zeit bis zur Diagnose, verkürzter Aufenthalt in der Notaufnahme
- Die Ärzt*innen sollten sich bewusst sein, dass die Bestimmung des Troponins weder die klinische Untersuchung noch das EKG ersetzt.33
Diagnosestellung in Zusammenschau von Klinik, EKG und Troponin
- Vor Veranlassung weiterer Diagnostik erfolgt die initiale Beurteilung in der Zusammenschau von klinischem Bild, EKG-Veränderungen und Troponinwerten.
- Troponin sollte als quantitativer Marker interpretiert werden: je höher das Troponin, desto höher die Wahrscheinlichkeit für einen akuten Myokardinfarkt als Ursache.32
- Typische Konstellationen30
- STEMI: starke, häufig typische Brustschmerzen (evtl. kardiogener Schock, St. n. Reanimation), ST-Hebungen, Troponin deutlich erhöht
- NSTEMI: unterschiedlich starke, typische oder atypische Beschwerden, Endstreckenveränderungen (allerdings normales EKG bei mehr als 1/3 der Patient*innen mit NSTEMI!), Troponin leicht bis deutlich erhöht
- andere kardiale Ursache (z. B. Tako-Tsubo-Kardiomyopathie, Tachyarrhythmie): leichtere, atypische oder „typische“ Beschwerden, Endstreckenveränderungen, Troponin leicht erhöht
- instabile AP: typische oder atypische Beschwerden, mit oder ohne Endstreckenveränderungen, Troponin normal
- nichtkardiale Ursache (z. B. Brustwandsyndrom, Pneumonie): eher atypische Beschwerden, keine EKG-Veränderungen, Troponin normal
Alternative Ursachen für Troponinerhöhung32
- Tachyarrhythmie
- Herzinsuffizienz
- Hypertensive Notfälle
- Kritische Erkrankungen (Sepsis, Schock)
- Myokarditis
- Tako-Tsubo-Kardiomyopathie
- Dekompensierte Vitien (z. B. Aortenklappenstenose)
- Aortendissektion
- Lungenembolie
- Niereninsuffizienz
- Ischämischer Schlaganfall/Hirnblutung
- Infiltrative Erkrankungen (z. B. Amyloidose, Sarkoidose)
- Hyper-/Hypothyreose
- Extremer Ausdauersport
Diagnostik bei Spezialist*innen
Echokardiografie
- Eine Echokardiografie sollte in Notaufnahmen/Chest Pain Units routinemäßig verfügbar sein.32
- Patient*innen mit NSTEMI sollten eine Echokardiografie erhalten.32
- Beurteilung der globalen und regionalen LV-Funktion
- Ausschluss/Nachweis von Differenzialdiagnosen
- Nach Ausschluss eines akuten Infarktes ggf. Stressechokardiografie im weiteren Verlauf zum Nachweis/Ausschluss einer KHK
MRT
- Im Einzelfall sinnvoll zum Nachweis von Differenzialdiagnosen (z. B. Myokarditis, Tako-Tsubo-Kardiomyopathie)
CT
- Bedeutung vor allem zum Nachweis von Differenzialdiagnosen (Lungenembolie, Aortendissektion)
- Option zum nichtinvasivem Ausschluss oder Nachweis einer KHK nach Ausschluss eines akuten Infarktes bei Patient*innen mit niedrigem Risiko3234
Koronarangiografie
- Bei akutem Koronarsyndrom Koronarangiografie mit ggf. perkutaner Koronarintervention (PCI), Timing abhängig von der Risikostratifizierung
- Variablen des zur Risikostratifizierung u. a. verwendeten GRACE-Scores sind Alter, systolischer Blutdruck, Puls, Serum-Kreatinin, Killip-Klasse, Troponin und ST-Veränderungen.
- Ziele der Koronarangiografie30
- definitiver Nachweis/Ausschluss einer kompletten oder partiellen Gefäßokklusion
- Identifizierung der infarktverursachenden Läsion
- Beurteilung der Eignung des Koronarsystems für PCI oder CABG
- Risikostratifizierung
- im Anschluss an die Koronarangiografie ggf. PCI (perkutane Koronarintervention) mit Stentimplantation
Indikationen zur Krankenhauseinweisung
- Sofortige Einweisung von Patient*innen mit V. a. ACS (akutes Koronarsyndrom)
- Ziel ist die Minimierung der Verzögerung entlang der Rettungskette.
- Anruf durch Patient*in (Erhöhung der Sensibilität durch Informationskampagnen)
- erster medizinischer Kontakt (Notärzt*in, Hausärzt*in)
- Ziel: möglichst kurze Zeit bis zum Eintreffen der Patient*innen im Katheterlabor bei hohem Verdacht auf ein akutes Koronarsyndrom
- medizinisches Zentrum, z. B. Chest Pain Unit (seit 2008 Zertifizierung von > 250 Chest Pain Units in Deutschland)
- bei prähospitaler Diagnose eines STEMI direkter Transport ins Katheterlabor (Zeitersparnis ca. 20 min)
- bei Erstaufnahme in Klinik ohne Katheterlabor Ziel-Zeit bis zur Weiterverlegung ≤ 30 min („Door-in/Door-out“)
Therapie
Therapieziele
- Besserung der akuten Symptomatik
- Minimierung des Myokardschadens
- Wiedereröffnung akut verschlossener Koronararterien
- Vermeidung einer akuten Herzinsuffizienz
- Vermeidung von Infarktkomplikationen
- Vermeidung eines Infarktrezidivs
- Vermeidung einer chronischen Herzinsuffizienz
- Reduktion der Mortalität
Hausärztliche Erstversorgung bei akutem Koronarsyndrom (ACS) gemäß DEGAM-Leitlinien
- In den DEGAM-Leitlinien werden folgende Maßnahmen zur Erstversorgung empfohlen:31,35
- Lagerung mit 30 Grad angehobenem Oberkörper
- Zugang i. v.
- ASS 500 mg i. v. oder oral, falls nicht bereits Dauermedikation
- Nitroglyzerin (Spray oder Kapsel s. l.), sofern RR syst. > 100 mmHg
- bei starken Schmerzen Morphin 5 mg i. v.; ggf. wiederholt bis Schmerzfreiheit
- bei (opiatbedingter) Übelkeit 10 mg Metoclopramid i. v. oder 62 mg Dimenhydrinat i. v.
- Heparin 5.000 IE i. v. oder Enoxaparin-Na, 1 mg/kg KG mg s. c. bei Vorliegen Ischämie-bedingter EKG-Veränderungen oder erhöhter Enzymmarker
- bei Bradykardie < 45/min 1 Amp. Atropin 0,5 mg i. v.
- nach Eintreffen des Rettungswagens: Monitoring des Herzrhythmus und Sauerstoff (2–4 l/min), falls Atemnot oder andere Zeichen der Herzinsuffizienz, bei Sauerstoffsättigung > 90 %, keine routinemäßige O2-Gabe
- Titrierte i. v. Opioide sollten zur Analgesie erwogen werden (IIa/C).
- Ein milder Tranquilizer (Benzodiazepin) sollte bei sehr ängstlichen Patient*innen erwogen werden (IIa/C).
- Einweisung in kardiologische Abteilung mit Katheterbereitschaft.
- Bei notfallmäßiger Einweisung evtl. mit Katheterlabor absprechen, ob eine präklinische Gabe eines 2. Thrombozytenaggregationshemmers gewünscht wird, eine solche Gabe ist aber nicht routinemäßig erforderlich.
- Bevorzugte Substanz ist ggf. Ticagrelor mit Loading Dose 180 mg p. o.
Leitlinien zur Therapie beim akuten Koronarsyndrom32,35-37
Reperfusionstherapie
- STEMI
- Reperfusionstherapie indiziert bei allen Patient*innen mit Symptombeginn < 12 h und persistierenden ST-Hebungen (I/A)
- primäre PCI empfohlen gegenüber Thrombolyse (I/A)
- falls zeitnahe PCI nicht möglich, Thrombolyse empfohlen innerhalb von 12 h nach Symptombeginn (I/A)
- Reperfusionstherapie indiziert bei allen Patient*innen mit Symptombeginn < 12 h und persistierenden ST-Hebungen (I/A)
- NSTEMI
- sofortige (< 2 h) Koronarangiografie/PCI bei sehr hohem Risiko (I/C)
- frühe (< 24 h) Koronarangiografie/PCI bei hohem Risiko (I/A)
- elektive Koronarangiografie/PCI bei niedrigem Risiko nach nichtinvasivem Ischämienachweis oder Nachweis einer obstruktiven KHK im Koronar-CT
- Stentauswahl
- Die Verwendung von DES (Drug-eluting Stents) hat im Vergleich zu BMS (unbeschichtete Stents) keinen prognostischen Vorteil (Tod, Myokardinfarkt), ist aber mit einer geringeren Rate an Restenosen/Revaskularisationen verbunden.38
Sekundärprävention – Blutgerinnungshemmung
- Nach jeder Form eines ACS (Angina pectoris, NSTEMI oder STEMI) und unabhängig von der initialen Therapie (konservativ, PCI oder ACVB) sollte, sofern vertragen, 1 Jahr lang 2 x 90 mg Ticagrelor zusätzlich zu ASS angeboten werden (A/Ia).
- Wenn Ticagrelor nicht vertragen wird, sollten 12 Monate lang 10 mg, bei über 75 Jahre alten und/oder unter 60 kg wiegenden Patient*innen 5 mg Prasugrel angeboten werden.
- Nach Bypass-Operation sollte bei Unverträglichkeit von Ticagrelor nur mit ASS behandelt werden.
- Bei Patient*innen mit hohem Blutungsrisiko kann das Absetzen des P2Y12-Inhibitors erwogen werden.
- bei Stentimplantation nach 6 Monaten (IIa/B)
- bei konservativer Therapie nach 1 Monat (IIa/C)
- Triple-Therapie (DAPT + OAK) nach Stentimplantation
- ASS und Clopidogrel als Plättchenhemmer (I/C), kein Ticagrelor oder Prasugrel
- Bei Patient*innen mit Erfordernis zur oralen Antikoagulation, die bei akutem Koronarsyndrom jedweder Art eine PCI bekommen, werden folgende Empfehlungen zur Dauer einer Triple-Therapie gegeben (B/IIa):
- bei DES jeder Art 6 Monate Triple-Therapie; dann OAK + Clopidogrel bis Monat 12, danach nur noch OAK mit Cumarinen
- Bei BMS 4 Wochen Triple-Therapie, danach sollte nur mit Cumarinen antikoaguliert werden.
- Bei deutlich erhöhtem Blutungsrisiko kann die Gabe von ASS auf 4 Wochen und die von Clopidogrel auf 6 Monate beschränkt werden.
- Für die Dauer einer Triple-Therapie sollte bei Einsatz von Cumarinen eine INR im unteren therapeutischen Zielbereich gewählt werden (z. B. 2,0–2,5) (B/IIa).
- bei Patient*innen mit hohem Blutungsrisiko Clopidogrel + OAK als Alternative (IIa/A)
- Absetzen der dualen Plättchenhemmung nach 12 Monaten (IIa/B), Weiterführung der OAK mit Phenprocoumon (INR 2–3)
- Wenn sich antikoagulierte Patient*innen einer koronaren Intervention unterziehen müssen, sollte eine Triple-Therapie mit Phenprocoumon bzw. Warfarin und nicht mit neuen oralen Antikoagulanzien durchgeführt werden (B/IIb).
Sekundärprävention – sonstige Medikation und Lebensstil
- Statintherapie dauerhaft (I/A)
- Betablocker bei LVEF ≤ 40 % (I/A)
- ACE-Hemmer bei LVEF ≤ 40 % (oder Zeichen der Herzinsuffizienz), Hypertonie (I/A)
- Aldosteronantagonisten bei LVEF ≤ 35 % und Herzinsuffizienz oder Diabetes (I/A)
- Alle Patient*innen sollten hinsichtlich Lebensstiländerung beraten werden (einschließlich Rauchstopp, körperliche Aktivität, gesunde Ernährung) (I/A).
Behandlung in der Klinik
- Die Behandlung erfolgt in einer Reihe von therapeutischen Schritten:
- symptomatische Therapie von Schmerz, Atemnot und Angst
- periprozedurale Pharmakotherapie
- PCI (perkutane Koronarintervention)
- Behandlung von Komplikationen
- Sekundärprophylaxe: Lebensstiländerungen, Pharmakotherapie, Device-Therapie
Symptomatische Therapie
- Opioide zur Schmerzbekämpfung
- Morphin führt allerdings zu verzögerter intestinaler Aufnahme von oralen Thrombozytenaggregationshemmern.30
- Bei ängstlichen Patient*innen kann ein Benzodiazepin verabreicht werden.36
- Eine routinemäßige Gabe von Nitraten wird nicht mehr empfohlen.36
- Gabe bei wiederkehrender Angina, hohem Blutdruck oder Zeichen der Herzinsuffizienz
- Eine routinemäßige Verabreichung von O2 wird nicht mehr empfohlen, da dies möglicherweise schädliche Wirkungen hat.39-40
- O2-Gabe erst bei Sättigung < 90 %
Blutgerinnungshemmende Therapie
Antikoagulation
- Zum Zeitpunkt der Diagnose sollte eine parenterale Antikoagulation eingeleitet werden.32
- Unfraktioniertes Heparin (70–100 IU/kg i. v.) und Enoxaparin (1 mg/kg s. c. 2 x tgl.) sind häufig verwendete Substanzen.32,41
Thrombozytenaggregationshemmung
- Bei akutem koronarem Syndrom (ACS) sollen 500 mg ASS gegeben werden, wenn nicht bereits damit vorbehandelt wurde.35
- Das Timing der Gabe eines 2. Thrombozytenaggregationshemmers (DAPT = Dual Antiplatelet Therapy) ist Gegenstand der Diskussion, eine Entscheidung wird aktuell üblicherweise nach Aufnahme/Diagnostik in der Klinik bzw. im Katheterlabor getroffen.
- 1. Wahl als 2. Thrombozytenaggregationshemmer ist Ticagrelor 2 x 90 mg tgl. (für 1 Jahr) zusätzlich zu ASS.35
- Gabe von Prasugrel möglich v. a. bei Patient*innen mit STEMI30
- Clopidogrel bei ACS ist nur noch bei Patient*innen mit Kontraindikationen gegen Ticagrelor und Prasugrel (St. n. Hirnblutung, Indikation zur OAK) eine Alternative.
Sonstige medikamentöse Therapie
- Betablocker
- Betablocker vermindern den myokardialen Sauerstoffverbrauch durch Reduktion von Puls, Blutdruck und Kontraktilität.36
- Für hämodynamisch stabile Patient*innen ist eine frühe Betablockade vor allem bei anhaltenden Ischämie-Symptomen sinnvoll.36
- Bei Patient*innen mit erhöhtem Risiko für die Entwicklung eines kardiogenen Schocks (ältere Menschen, Tachykardie, RR systolisch < 120 mmHg) wirken Betablocker möglicherweise eher ungünstig.43-44
- Statine
Revaskularisation
PCI (perkutane Koronarintervention) und Thrombolyse
STEMI
- Eine primäre PCI (perkutane Koronarintervention) bei STEMI ist der früher häufig durchgeführten thrombolytischen Behandlung überlegen.47-48
- Thrombolyse mit anschließender PCI bringt keine Vorteile im Vergleich zur primären PCI.49
- Eine Thrombolyse sollte nur durchgeführt werden, falls eine primäre PCI nicht schnell (< 120 min) möglich ist.36
- STEMI-Patient*innen mit Symptomen < 12 h und persistierenden ST-Hebungen sollten umgehend einer primären PCI zugeführt werden.36
- Die Zeit bis zur erfolgreichen Gefäßeröffnung beeinflusst das Outcome bei STEMI-Patient*innen.51-52
NSTEMI
- Der Nutzen einer routinemäßigen invasiven Strategie mit Revaskularisation bei NSTEMI konnte gezeigt werden für:53-55
- Mortalität
- Myokardinfarkt
- Rehospitalisierung.
- Das Timing der Koronarangiografie/PCI bei NSTEMI/instabiler AP ist abhängig von der Risikostratifizierung.32
- sofortige invasive Strategie (< 2 h) bei sehr hohem Risiko
- hämodynamische Instabilität
- therapierefraktäre Angina
- lebensbedrohliche Arrhythmien
- mechanische Komplikationen
- akute Herzinsuffizienz
- rezidivierende dynamische ST-Veränderungen
- frühinvasive Strategie (< 24 h) bei hohem Risiko (mind. 1 Hochrisiko-Kriterium)
- elektive invasive Strategie bei niedrigem Risiko
- Entscheid über invasive Untersuchung nach Durchführung eines Ischämietests oder eines Koronar-CT
- sofortige invasive Strategie (< 2 h) bei sehr hohem Risiko
Stentauswahl
- Die Verwendung von DES (Drug-eluting Stents) hat im Vergleich zu BMS (unbeschichtete Stents) keinen prognostischen Vorteil (Tod, Myokardinfarkt), ist aber mit einer geringeren Rate an Restenosen/Revaskularisationen verbunden.38
Gefäßzugang
- Der radiale Zugang ist auch bei Patient*innen mit ACS im Vergleich zum femoralen mit weniger Blutungskomplikationen verbunden.56
- Sofern technisch möglich, sollte der radiale Zugang bevorzugt werden.32,36
Koronare Bypass-OP
- Eine koronare Bypass-OP (CABG) ist heutzutage in der Primärversorgung akuter Koronarsyndrome von untergeordneter Bedeutung.
- Nach Versorgung des Infarktgefäßes ggf. bei Mehrgefäßerkrankung Risikostratifizierung und Diskussion/Entscheid über das weitere Vorgehen im „Heart Team“ (Kardiolog*innen und Kardiochirurg*innen).
Sekundärprophylaxe
Duale Plättchenhemmung
- Patient*innen nach Infarkt erhalten eine dauerhafte Plättchenhemmung mit ASS.
- Eine Ausnahme sind Erkrankte mit dauerhafter oraler Antikoagulation (OAK), bei denen nach einer Phase mit dualer Plättchenhemmung die Dauertherapie nur mit OAK möglich ist (s. u., Abschnitt Triple-Therapie).
- Eine duale Plättchenhemmung (DAPT = Dual Antiplatelet Therapy) mit ASS und einem P2Y12-Inhibitor ist sowohl nach PCI als auch bei konservativ behandelten Patient*innen nach ACS indiziert.37
- Bevorzugte Substanz als 2. Plättchenhemmer ist bei einem akuten Koronarsyndrom derzeit Ticagrelor (Erhaltungsdosis 2 x 90 mg/d).35,37
- Dies gilt auch für mit Clopidogrel vorbehandelte Patient*innen.37
- Nach jeder Form eines ACS (Angina pectoris, NSTEMI oder STEMI) und unabhängig von der initialen Therapie (konservativ, PCI oder ACVB) sollte, sofern vertragen, 1 Jahr lang 2 x 90 mg Ticagrelor zusätzlich zu ASS verabreicht werden.35
- Während die DEGAM zunächst von Prasugrel als Alternative zu Ticagrelor generell abriet (Blutungsrisiko), wird es aufgrund günstiger Ergebnisse einer neueren Studie inzwischen bei Ticagrelor-Unverträglichkeit empfohlen.35,42
- Wenn Ticagrelor nicht vertragen wird, sollten 12 Monate lang 10 mg, bei über 75 Jahre alten und/oder unter 60 kg wiegenden Patient*innen 5 mg Prasugrel angeboten werden.
- Nach Bypass-Operation sollte bei Unverträglichkeit von Ticagrelor nur mit ASS behandelt werden.35
- Die Dauer der dualen Plättchenhemmung beträgt im Allgemeinen 12 Monate, dann Dauertherapie mit ASS.
- Bei hohem Blutungsrisiko kann die duale Plättchenhemmung verkürzt werden auf:37
- 6 Monate nach Stentimplantation
- 1 Monat bei konservativer Therapie.
Triple-Therapie
- Bei Patient*innen mit Indikation zur oralen Antikoagulation (meist Vorhofflimmern oder Thrombose), die mit Stentimplantation behandelt wird, wird für einen begrenzten Zeitraum eine Triple-Therapie durchgeführt.
- Die Gefahr für Blutungskomplikationen steigt mit der Anzahl der blutgerinnungshemmenden Medikamente.
- NNH (Number Needed to Harm) beträgt 81 bei ASS + Clopidogrel, 45 für ASS + Warfarin, 15 für Clopidogrel + Warfarin und 12 für Triple-Therapie.57
- Die DEGAM empfiehlt für die Triple-Therapie folgendes Vorgehen bei ACS (und chronischem Koronarsyndrom):35
- OAK + BMS (chronisches Koronarsyndrom, ACS): Triple 4 Wochen, dann nur Phenprocoumon
- OAK + DES (chronisches Koronarsyndrom): Triple 1–3 Monate (Limus-Stent) bzw. 6 Monate (Paclitaxel-Stent), dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- OAK + DES (ACS): Triple 6 Monate, dann Phenprocoumon + Clopidogrel bis Monat 12, dann nur Phenprocoumon
- Es soll bei Triple-Therapie nur Clopidogrel als ADP-Rezeptor-Blocker verwendet werden (höheres Blutungsrisiko mit Ticagrelor).
- reduziertes INR-Ziel 2,0–2,5 für die Dauer der Triple-Therapie
- Die Patient*innen sollen sorgfältig überwacht werden, z. B. durch monatliche Blutbildkontrollen.
- In den neuen ESC-Guidelines wird eine weitere Verkürzung der Phase mit Triple-Therapie nach PCI empfohlen, dies gilt sowohl für Patient*innen mit ACS als auch mit chronischem Koronarsyndrom.32,58
- chronisches Koronarsyndrom (unabhängig vom gewählten Stent):
- 1 Woche Triple-Therapie, dann ASS-Stopp
- OAK + Clopidogrel für 6 Monate
- dann nur noch OAK
- ACS (unabhängig vom gewählten Stent)
- 1 Woche Triple-Therapie, dann ASS-Stopp
- OAK + Clopidogrel für 12 Monate
- dann nur noch OAK
- chronisches Koronarsyndrom (unabhängig vom gewählten Stent):
- Triple-Therapie mit Vit-K-Antagonist bzw. NOAK (neue orale Antikoagulanzien)
- Die DEGAM spricht sich gegen eine Triple-Therapie mit NOAK aus.35
- Bei Triple-Therapie sollte die INR bei der oralen Antikoagulation mit Phenprocoumon auf 2–2,5 eingestellt werden.35
- Viele Kliniken empfehlen inzwischen statt einer Triple-Therapie eine 2-fache Gerinnungshemmung mit einem NOAK und Clopidogrel; die DEGAM übernimmt diese Empfehlungen nicht. In den entsprechenden Studien waren die Vitamin-K-Antagonisten in den Kontrollgruppen mit INR-Ziel 2,0–3,00 zu hoch dosiert worden. Die entsprechend höhere Blutungsrate verwundert dann nicht.
- In den ESC-Guidelines werden NOAK für die Kombination mit Plättchenhemmern gegenüber Vit-K-Antagonisten bevorzugt.58
- Die DEGAM spricht sich gegen eine Triple-Therapie mit NOAK aus.35
Wechsel zwischen Thrombozytenaggregationshemmern
- Bei einer Umstellung von einem Thrombozytenaggregationshemmer auf einen anderen empfiehlt die DEGAM folgendes Vorgehen:35
Umstellung von Clopidogrel auf Ticagrelor
- 1–3 Tage Clopidogrel pausieren, dann Wechsel auf Ticagrelor.
Umstellung von Prasugrel auf Clopidogrel
- Es kann ohne Therapiepause auf die übliche Erhaltungsdosis von Clopidogrel gewechselt werden.
Umstellung von Prasugrel auf Ticagrelor
- Es kann ohne Therapiepause auf die übliche Erhaltungsdosis von Ticagrelor gewechselt werden.
Umstellung von Ticagrelor auf Clopidogrel
- Loading Dose von 300 mg Clopidogrel, dann übliche Erhaltungsdosis von 75 mg Clopidogrel/d
Sonstige medikamentöse Sekundärprävention/Lebensstiländerung
- Siehe auch Artikel Sekundärprävention von koronaren Erkrankungen.
- Statin-Therapie
- Eine Statin-Therapie sollte möglichst frühzeitig nach einem ACS eingeleitet und dauerhaft durchgeführt werden.32,36
- Von den kardiologischen Gesellschaften empfohlene LDL-Zielwerte sind nicht ausreichend evidenzbasiert.
- Die DEGAM bevorzugt eine Strategie der festen Dosis:6
- Verschreibung eines Statins in Hochdosis ohne weitere Kontrollen
- Einsatz anderer Substanzen nur bei Statin-Unverträglichkeiten
- Ezetimib kann angeboten werden, wenn eine Hochdosis-Statintherapie nicht toleriert wird.
- Betablocker
- Eine routinemäßige Gabe von Betablockern ist insbesondere bei Patient*innen nach STEMI etabliert.36
- Betablocker sind auf jeden Fall indiziert bei einer LVEF ≤ 40 % und/oder Zeichen der Herzinsuffizienz.32,36
- ACE-Hemmer
- ACE-Hemmer sind indiziert bei LV-Dysfunktion und/oder Zeichen der Herzinsuffizienz oder bei Hypertonie.32,36
- Ein Myokardinfarkt ist nicht per se eine Indikation für ACE-Hemmer, wenn der Blutdruck nicht erhöht und die kardiale Kontraktilität im Echo nicht eingeschränkt sind.
- Aldosteronantagonisten
- Aldosteronantagonisten sind indiziert bei einer LVEF ≤ 40 % und/oder Zeichen der Herzinsuffizienz.
- Hypertonie
- antihypertensive Therapie mit Blutdruckziel < 140/90 mmHg
- Diabetes mellitus
- Alle Patient*innen nach ACS sollten – sofern noch nicht bekannt – auf das Vorliegen eines Diabetes mellitus gescreent werden.32
- Grundsätzlich leitliniengerechte Therapie, eine etwas weniger stringente Einstellung sollte bei einigen Patientengruppen erwogen werden (ältere Menschen, fortgeschrittene KHK, multimorbide Patient*innen).
- Patient*innen sollen hinsichtlich Lebensstiländerungen beraten werden:
- Die Grippeimpfung reduziert möglicherweise das Risiko für schwere kardiovaskuläre Ereignisse.60
Kardiale Rehabilitation
- Ausführliche Informationen siehe hierzu auch im Artikel Herzrehabilitation.
- In der kardialen Rehabilitation sollen die Patient*innen mithilfe eines multidisziplinären Teams darin unterstützt werden, die individuell bestmögliche physische und psychische Gesundheit sowie soziale Integration wiederzuerlangen und langfristig aufrechtzuerhalten (Definition Nationale VersorgungsLeitlinie Chronische KHK).6
- Eine kardiologische Rehabilitation nach ACS soll möglichst früh, spätestens jedoch 3 Monate nach Entlassung begonnen werden.61
- Eine kardiologische Rehabilitation führt in verschiedenen Bereichen zu Verbesserungen für die Patient*innen:62
- geringere Mortalität
- Rückgang der Hospitalisationen
- Zunahme der Belastbarkeit
- bessere Lebensqualität
- Verbesserung des psychischen Befindens.
- Wichtige Komponenten eines Rehaprogramms sind:
- Beratung hinsichtlich körperlicher Aktivität, regelmäßiges Ergometertraining63
- Ernährungsberatung
- Kontrolle der Risikofaktoren
- allgemeine Gesundheitsberatung
- Beeinflussung psychosozialer Faktoren
- sozialmedizinische Komponenten.
Verlauf, Komplikationen und Prognose
Komplikationen
- Starker Rückgang der Komplikationsrate durch frühe Revaskularisation, dennoch gibt es weiterhin wichtige Ursachen für Morbidität/Mortalität nach einem Myokardinfarkt.3
- Die wichtigsten Komplikationen sind:
- kardiogener Schock
- Herzinsuffizienz
- Ausbildung eines Aneurysmas
- Aneurysmektomie ohne Vorteile
- Entwicklung einer hochgradigen Mitralklappeninsuffizienz
- verursacht durch veränderte Konfiguration des Klappenapparates/Papillarmuskeldysfunktion
- Thrombusbildung
- Kann ohne oder mit Aneurysmabildung auftreten.
- Antikoagulation bis zu 6 Monaten unter echokardiografischen Kontrollen36
- Arrhythmien (Kammerflimmern, ventrikuläre Tachykardie, AV-Block, Vorhofflimmern), plötzlicher Herztod
- mechanische Komplikationen
- Papillarmuskelruptur mit schwerer Mitralklappeninsuffizienz
- Ruptur der freien Ventrikelwand
- Ruptur des Septums
- Perikarditis
- frühe Postinfarktperikarditis (frühes Auftreten, transient)36
- späte Postinfarkt-Perikarditis (Dressler-Syndrom) nach 1–2 Wochen
Verlauf und Prognose
- Verbesserungen in der prästationären Versorgung und der stationären Therapie haben zu einem Rückgang der Sterblichkeit in den vergangenen Jahrzehnten geführt.
- Zwischen 1994 und 2006 alters- und geschlechtsabhängig Rückgang der Krankenhausmortalität um 30–50 %64
- Aktuell liegt die 30-Tage-Sterblickeit nach Myokardinfarkt bei ca. 7–10 %.65
- bei unter 50-Jährigen sogar nur ca. 3 % in einer kürzlichen dänischen Studie66
- Dagegen nur sehr niedrige 30-Tage-Mortalität bei ACS-Patient*innen mit sehr niedrigen Troponinwerten bei Aufnahme67
- Aufgrund der geringeren Mortalität durch frühe Komplikationen bestimmt die Entwicklung einer Herzinsuffizienz zunehmend die Langzeitprognose.3
- Die früher unterschiedlichen Mortalitätsraten zwischen Männern und Frauen (höher für Männer) gleichen sich allmählich an.68
- Risikofaktoren für eine schlechtere Prognose sind höheres Alter, Hypertonie, Diabetes mellitus, PAVK und St. n. Schlaganfall.68
Verlaufskontrolle
- Erste Verlaufskontrolle ca. 2–4 Wochen nach Myokardinfarkt
- Regelmäßige Untersuchung in der Hausarztpraxis (1/4- bis 1/2-jährlich) bei Patient*innen mit KHK im Rahmen des Disease-Management-Programms KHK, unabhängig von sonstigen notwendigen Kontakten (Verschlechterung, Komorbiditäten)6
- Gemeinsame Betreuung durch Hausärzt*in und Kardiolog*in bei Patient*innen mit:6
- weniger als 1 Jahr zurückliegendem ACS
- Herzinsuffizienz NYHA III–IV
- ventrikulären Rhythmusstörungen, ICD-Träger*innen.
- Überweisung von Hausärzt*in an Kardiolog*in in folgenden Situationen:6
- Eine befriedigende symptomatische Behandlung auf der hausärztlichen Versorgungsebene ist nicht möglich (Therapieziel Lebensqualität gefährdet).
- Die medikamentösen und sonstigen Maßnahmen zur Verbesserung der Prognose sind unzureichend umsetzbar (Therapieziel Verbesserung der Prognose gefährdet).
- deutliche Verschlechterung einer bekannten bzw. Verdacht auf neue Herzinsuffizienz
- neu aufgetretene, klinisch relevante Rhythmusstörungen.
- Für Patient*innen nach ACS ist die Teilnahme an einer Herzgruppe empfehlenswert.6
Patienteninformationen
Patienteninformationen in Deximed
Herzinfarkt
- Herzinfarkt
- Herzinfarkt, Rehabilitation
- Herzinfarkt, Thrombolyse
- Perkutane Koronarintervention (PCI)
- Bypass-Operation des Herzens
Gesundheitstipps
- Vollwertige Ernährung
- Fettarme Lebensmittel
- Warum sollten Sie das Rauchen aufgeben, und wie gelingt es?
- Krafttraining – gut fürs Herz
- Übergewicht und Gewichtsabnahme ‒ wie das gelingt
Weitere Informationen
- DEGAM-Patienteninformation: Herzinfarkt, Medikamente zur Hemmung der Blutgerinnung nach Herzinfarkt
- DEGAM-Patienteninformation: Medikamente zur dreifachen Hemmung der Blutgerinnung
- DEGAM-Patienteninformation: Medikamente zur Hemmung der Blutgerinnung nach Stent
- DEGAM-Patienteninformation: ASS zur Hemmung der Blutgerinnung
- DEGAM-Patienteninformation: Cholesterin
- DEGAM-Patienteninformation: Früherkennung, Herz-Kreislauf-Erkrankungen
- Gesundheitsinformation.de: Was passiert bei einer Herzkatheteruntersuchung?
Illustrationen
- Siehe EKG: Akuter Vorderwandinfarkt (STEMI)
- Siehe EKG: Akuter Hinterwandinfarkt (STEMI)
- Siehe EKG: Ventrikuläre Tachykardie vor und nach Kardioversion (Infarkt Hinterwand)

Infarkt, EKG-Änderung über Zeit
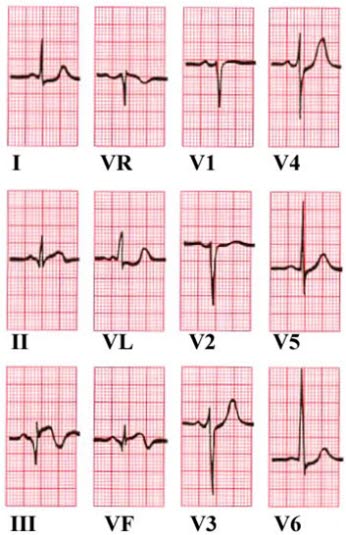
Q-Zacken in Ableitung III und aVF. ST-Hebung in Ableitung II und aVF. ST-Senkung in aVL und V6
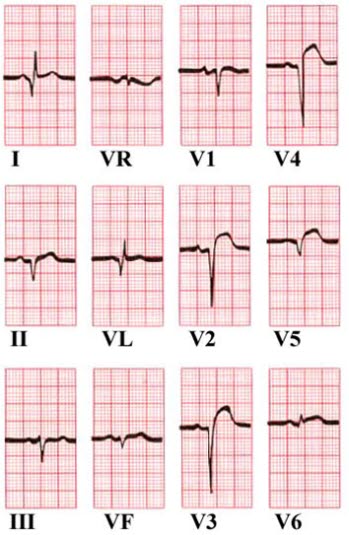
ST-Hebung in Ableitungen V2-V5
Herz mit Infarkt
Normales Herz Ansicht von hinten
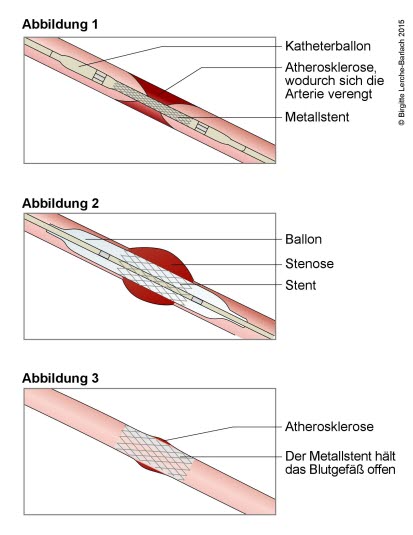
Stentbehandlung eines engen Blutgefäßes
Quellen
Leitlinien
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische KHK – Langfassung. S3, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Brustschmerz. AWMF-Nr. 053-023. S3, Stand 2011. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. DEGAM-Leitlinie Nr. 16. AWMF-Leitlinie Nr. 053-041. S2e, Stand 2019. www.awmf.org
- Deutsche Gesellschaft für Allgemeinmedizin. Hausärztliche Risikoberatung zur kardiovaskulären Prävention. AWMF-Leitlinie Nr. 053-024. S3, Stand 2017. www.awmf.org
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauferkrankungen (DGPR). Kardiologische Rehabilitation im deutschsprachigen Raum Europas Deutschland, Österreich, Schweiz (D, A, CH). AWMF-Leitlinie Nr. 133-001. S3, Stand 2020. www.awmf.org
- European Society of Cardiology. Fourth Universal Definition of Myocardial Infarction. Stand 2018. www.escardio.org
- European Society of Cardiology. Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Stand 2017. www.escardio.org
- European Society of Cardiology. Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Stand 2020. www.escardio.org
- European Society of Cardiology. Focused update on dual antiplatelet therapy in coronary artery disease developed. Stand 2017. www.escardio.org
- European Society of Cardiology. Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Stand 2015. www.escardio.org
- European Society of Cardiology. Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Stand 2020. www.escardio.org
Literatur
- Lohnstein M, Eras J, Hammerbacher C. Der Prüfungsguide Allgemeinmedizin - Aktualisierte und erweiterte 3. Auflage. Augsburg: Wißner-Verlag, 2018.
- Thygesen K, Alpert J, Jaffe A, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J 2019; 40: 237-269. doi:10.1093/eurheartj/ehy462 DOI
- Anderson L, Morrow D. Acute Myocardial Infarction. N Engl J Med 2017; 376: 2053-2064. doi:10.1056/NEJMra1606915 DOI
- Bansilal S, Castellano J, Fuster V. Global burden of CVD: focus on secondary prevention of cardiovascular disease. Int J Cardiol 2015; 201: S1-S7. doi:10.1016/S0167-5273(15)31026-3 DOI
- Zafari A. Acute Myocardial Infarction. Medscape. Updated February 11, 2018. Zugriff 23.06.18 emedicine.medscape.com
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Chronische KHK - Langfassung, 5. Aufl. 2019. www.awmf.org
- Meisinger C, Peters A, Linseisen J. Vom MONICA-Projekt über KORA zur NAKO-Studie: Vom praktischen Nutzen von Bevölkerungsstudien in der Region Augsburg. Gesundheitswesen 2016; 78: 84-90. doi:10.1055/s-0041-110916 DOI
- Deutsche Herzstiftung. Deutscher Herzbericht 2017. www.herzstiftung.de
- Gößwald A, Schienkiewitz A, Nowossadeck A, et al. Prävalenz von Herzinfarkt und koronarer Herzkrankheit bei Erwachsenen im Alter von 40 bis 79 Jahren in Deutschland. Bundesgesundheitsbl 2013; 56: 650–655. doi:10.1007/s00103-013-1666-9 DOI
- Falk E, Shah P, Fuster V. Coronary Plaque Disruption. Circulation 1995; 92: 657-671. doi:10.1161/01.CIR.92.3.657 DOI
- Shibata T, Kawakami S, Noguchi T, et al. Prevalence, Clinical Features, and Prognosis of Acute Myocardial Infarction Due to Coronary Artery Embolism. Circulation 2015; 132: 241-250. doi:10.1161/CIRCULATIONAHA.114.015134 DOI
- Ertan C, Özpelit M, limon Ö, et al. Vasospastic myocardial infarction: An even rarer occurrence of a rare entity. World J Emerg Med 2017; 8: 68-70. pubmed.ncbi.nlm.nih.gov
- Heusch G, Gersh B. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge. Eur Heart J 2017; 38: 774–784. doi:10.1093/eurheartj/ehw224 DOI
- Yusuf S, Hawken S, Ôunpuu S, et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937-52. doi:10.1016/S0140-6736(04)17018-9 DOI
- Dhingra R, Vasan R. Age as a Cardiovascular Risk Factor. Med Clin North Am 2012; 96: 87-91. www.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Risikoberatung zur kardiovaskulären Prävention. AWMF-Nr. 053-024. Stand 2016. www.awmf.org
- Anand S, Islam S, Rosengren A, et al. Risk factors for myocardial infarction in women and men: insights from the INTERHEART study. Eur Heart J 2008; 29: 932–940. doi:10.1093/eurheartj/ehn074 DOI
- Roncaglioni M, Santoro L, D'Avanzo B, et al . Role of Family History in Patients With Myocardial Infarction. Circulation 1992; 85: 2065-2072. pmid:1591825 PubMed
- Culic W. Acute risk factors for myocardial infarction. Int J Cardiol 2007; 117: 260-269. doi:10.1016/j.ijcard.2006.05.011 DOI
- Lindhardsen J, Ahlehoff O, Gislason GH, et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Ann Rheum Dis 2011; 70: 929-934. PubMed
- Mehta NN, Yu Y, Pinnelas R, et al. Attributable risk estimate of severe psoriasis on major cardiovascular events. Am J Med 2011; 124: 775. www.ncbi.nlm.nih.gov
- Olsen AM, Fosbøl EL, Lindhardsen J, et al. Long-term cardiovascular risk of NSAID use according to time passed after first-time myocardial infarction. A nationwide cohort study. Circulation 2012. www.ncbi.nlm.nih.gov
- Trelle S, Reichenbach S, Wandel S et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011:342:c7086. www.bmj.com
- Hsia J, Larson JC, Ockene JK, et al. Resting heart rate as a low tech predictor of coronary events in women: prospective cohort study. BMJ 2009; 338: b219. www.ncbi.nlm.nih.gov
- Kwong JC, Schwartz KL, Campitelli MA, et al. Acute myocardial infarction after laboratory-confirmed influenza infection. N Engl J Med 2018 Jan 25; 378(4): 345-353. pmid:29365305 PubMed
- McSweeney JC, Cody M, Sullivan P, et al. Women's early warning symptoms of acute myocardial infarction. Circulation 2003; 108: 2619-23. www.ncbi.nlm.nih.gov
- Khan N, Daskalopoulou S, Karp I, et al. Sex differences in prodromal symptoms in acute coronary syndrome in patients aged 55 years or younger. Heart 2017; 103: 863-869. doi:10.1136/heartjnl-2016-309945 DOI
- Milner KA, Vaccarino V, Arnold AL, et al. Gender and age differences in chief complaints of acute myocardial infarction.. Am J Cardiol 2004; 93: 606-8. www.sciencedirect.com
- Dezman Z, Mattu A, Body R, et al. Utility of the History and Physical Examination in the Detection of Acute Coronary Syndromes in Emergency Department Patients. West J Emerg Med 2017; 18: 752-760. www.ncbi.nlm.nih.gov
- Roffi M, Patrono C, Collet J, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2016; 37: 267–315. doi:10.1093/eurheartj/ehv320 DOI
- Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM). Brustschmerz. AWMF-Leitlinie 053-023. S3, Stand 2011. www.awmf.org
- Collet J, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presentingwithoutpersistentST-segment elevation. Eur Heart J 2020; 00: 1-79. doi:10.1093/eurheartj/ehaa575 DOI
- Ammann P, Pfisterer M, Fehr T, Rickli H. Raised cardiac troponins. BMJ 2004; 328: 1028-9. PubMed
- Maffei E, Seitun S, Martini C, et al. CT coronary angiography and exercise ECG in a population with chest pain and low-to-intermediate pre-test likelihood of coronary artery disease. Heart 2010; 96: 1973-9 PubMed
- Deutsche Gesellschaft für Allgemeinmedizin (DEGAM). Neue Thrombozyten-Aggregationshemmer, Einsatz in der Hausarztpraxis. DEGAM-Leitlinie Nr. 16. AWMF-Nr. 053-041. Stand 2019. www.degam.de
- Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2018; 39: 119-177. doi:10.1093/eurheartj/ehx393 DOI
- Valgimigli M, Bueno H, Byrne R, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39: 213–254. doi:10.1093/eurheartj/ehx419 DOI
- Bønaa et al. Drug-Eluting or Bare-Metal Stents for Coronary Artery Disease. N Engl J Med 2016;375:1242-52. www.ncbi.nlm.nih.gov
- Sepehrvand N, James SK, Stub D, et al. Effects of supplemental oxygen therapy in patients with suspected acute myocardial infarction: a meta-analysis of randomised clinical trials. Heart 2018 Mar 29. pmid:29599378 PubMed
- Cabello JB, Burls A, Emparanza JI, Bayliss SE, Quinn T. Oxygen therapy for acute myocardial infarction. Cochrane Database of Systematic Reviews Issue 12. pubmed.ncbi.nlm.nih.gov
- Eikelboom JW, Anand SS, Malmberg K, Weitz JI, Ginsberg JS, Yusuf S. Unfractioned heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a mata analysis. Lancet 2000; 355: 1936-42. PubMed
- Schüpke S, Neumann FJ, Menichelli M et al for the ISAR-REACT 5 trial investigators. Ticagrelor or Prasugrel in patients with acute coronary syndromes. N Engl J Med. 2019 Oct 17;381(16):1524-1534. www.ncbi.nlm.nih.gov
- Kontos M, Diercks D, Ho P, et al. Treatment and outcomes in patients with myocardial infarction treated with acute β-blocker therapy: results from the American College of Cardiology's NCDR(®). Am Heart J 2011; 161: 864-870. doi:10.1016/j.ahj.2011.01.006 DOI
- Bangalore S, Makani H, Radford M, et al. Clinical Outcomes with beta-Blockers for Myocardial Infarction: A Meta-analysis of Randomized Trials. Am J Med. 2014 Oct;127(10):939-53. PubMed
- Schwarzt G, Olsson A, Ezekowitz M, et al. Effects of Atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIACL study. JAMA 2001;285:1711-1718. www.ncbi.nlm.nih.gov
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. Lancet 2010; 376: 1670-1681. www.ncbi.nlm.nih.gov
- Zijlstra F, Hoorntje J, de Boer M, et al. Long-Term Benefit of Primary Angioplasty as Compared with Thrombolytic Therapy for Acute Myocardial Infarction. New Engl J Med 1999; 341: 1413-1419. doi:10.1056/NEJM199911043411901 DOI
- Keeley E, Boura J, Grines C. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials. Lancet 2003; 361: 13-20. doi:10.1016/S0140-6736(03)12113-7 DOI
- Armstrong PW, Gershlick AH, Goldstein P, et al. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N Engl J Med 2013. doi:10.1056/NEJMoa1301092 DOI
- Cantor WJ, Fitchett D, Borgundvaag B, et al, for the TRANSFER-AMI Trial Investigators. Routine early angioplasty after fibrinolysis for acute myocardial infarction. N Eng J Med 2009; 360: 2705-18. www.nejm.org
- McNamara RL, Wang Y, Herrin J, et al, for the NRMI Investigators. Effect of door-to-balloon time on mortality in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2006; 47: 2180-6. PubMed
- De Luca G, Biondi-Zoccai G, Marino P. Transferring patients with ST-segment elevation myocardial infarction for mechanical reperfusion: a meta-regression analysis of randomized trials. Ann Emerg Med 2008; 52: 665-76. PubMed
- Bavry A, Kumbhani D, Rassi A, et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials. J Am Coll Cardiol 2006; 48: 1319-1325. doi:10.1016/j.jacc.2006.06.050 DOI
- O'Donoghue M, Boden W, Braunwald E, et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction: a meta-analysis. JAMA 2008; 300: 71-80. doi:10.1001/jama.300.1.71 DOI
- Fox K, Clayton T, damman P, et al. Long-term outcome of a routine versus selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data. J Am Coll Cardiol 2010; 55: 2435-2445. doi:10.1016/j.jacc.2010.03.007 DOI
- Valgimigli M, Gagnor A, Calabro P, et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial. Lancet ; 385: 2465-76. doi:10.1016/S0140-6736(15)60292-6 DOI
- Sørensen R, Hansen ML, Abildstrom SZ, et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet 2009; 374: 1967-74. PubMed
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020; 00: 1-126. doi:10.1093/eurheartj/ehaa612 www.escardio.org
- Choo EH, Chang K, Ahn Y, et al. Benefit of β-blocker treatment for patients with acute myocardial infarction and preserved systolic function after percutaneous coronary intervention. Heart 2013. doi:10.1136/heartjnl-2013-305137 DOI
- Udell JA, Zawi R, Bhatt DL, et al. Association between influenza vaccination and cardiovascular outcomes in high-risk patients: a meta-analysis. JAMA 2013 Oct 23;310(16):1711-20. PubMed
- Deutsche Gesellschaft für Prävention und Rehabilitation von Herz-Kreislauferkrankungen (DGPR). Kardiologische Rehabilitation im deutschsprachigen Raum Europas Deutschland, Österreich, Schweiz (D, A, CH). AWMF-Leitlinie 133-001. Stand 2020. www.awmf.org
- Bäck M, Hansen T, Frederix I. European Society of Cardiology. Rehabilitation and exercise training recommendations. Stand 30.06.17. Zugriff 08.06.18 www.escardio.org
- Heran BS, Chen JMH, Ebrahim S, Moxham T, Oldridge N, Rees K, Thompson DR, Taylor RS. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database of Systematic Reviews 2011, Issue 7. Art. No.: CD001800. DOI: 10.1002/14651858.CD001800.pub2. pubmed.ncbi.nlm.nih.gov
- Vaccarino V, Parsons L, Peterson ED, et al. Sex differences in mortality after acute myocardial infarction. Arch Intern Med 2009; 169: 1767-74. PubMed
- Chung S, Gedeborg R, Nicholas O, et al. Acute myocardial infarction: a comparison of short-term survival in national outcome registries in Sweden and the UK. Lancet 2014; 383: 1305–12. www.ncbi.nlm.nih.gov
- Schmidt M, Szepligeti S, Horváth-Puhó E, et al. Long-Term Survival Among Patients With Myocardial Infarction Before Age 50 Compared With the General Population. Circ Cardiovasc Qual Outcomes 2016; 9: 523-531. doi:10.1161/CIRCOUTCOMES.115.002661 DOI
- Chapman et al. Association of High-Sensitivity Cardiac Troponin I Concentration With Cardiac Outcomes in Patients With Suspected Acute Coronary Syndrome. JAMA 2017 Nov 21;318(19):1913-1924. www.ncbi.nlm.nih.gov
- Johansson S, Annika Rosengren A, Young K, et al. Mortality and morbidity trends after the first year in survivors of acute myocardial infarction: a systematic review. BMC Cardiovasc Disord 2017; 17: 53. doi:10.1186/s12872-017-0482-9 DOI
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Günther Egidi, Dr. med., Facharzt für Allgemeinmedizin, Bremen (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).