Zusammenfassung
- Definition:Autoimmune Schilddrüsenerkrankung, bei der am häufigsten TSH-Rezeptor-Antikörper (TRAK) gebildet werden, die zu einer Hyperthyreose führen.
- Häufigkeit:Prävalenz von 0,5–2 % in Deutschland. Frauen deutlich häufiger betroffen.
- Symptome:Symptome einer Hyperthyreose, wie z. B. Schwitzen, Unruhe, Tremor.
- Befunde:Klassisch ist die Merseburger Trias: Tachykardie, Struma, Exophthalmus.
- Diagnostik:Laborchemischer Nachweis von TRAK. Typischer sonografischer Befund mit echoarmer Schilddrüse und Hypervaskularisation.
- Therapie:In der Regel medikamentöser Therapieversuch mit Thyreostatika über 12–18 Monaten. Bei Therapieversagen definitive Therapie mittels Radiojodtherapie oder Thyreoidektomie.
Allgemeine Informationen
Definition
- Synonyme: Autoimmunhyperthyreose, Grave's Disease
- Autoimmune Schilddrüsenerkrankung, bei der am häufigsten TSH-Rezeptor-Antikörper (TRAK) gebildet werden und zu einer Stimulation des Rezeptors und folglich vermehrten Synthese und Ausschüttung der Schilddrüsenhormone mit einer Hyperthyreose führen.1
- Benannt nach dem Deutschen Carl Adolph von Basedow, der die Störung 1840 erstmals beschrieben hat.2
- Die oft assoziierte endokrine Orbitopathie wird im Artikel Augenveränderungen infolge einer Hyperthyreose (endokrine Orbitopathie) besprochen.
Häufigkeit
- Prävalenz von 0,5–2 % in Deutschland3
- Zweithäufigste Ursache für Hyperthyreose insgesamt 3
- Häufigste Ursache ist eine funktionelle Autonomie, vor allem bei älteren Patient*innen.
- Verhältnis Frauen zu Männern 5:14
Ätiologie und Pathogenese
- Es besteht eine polygenetische Prädisposition für den Morbus Basedow. 2
- Verschiedene Umweltfaktoren zur Auslösung des Krankheitsbilds werden diskutiert.
- Der Morbus Basedow ist durch eine humorale Immunantwort vermittelt. 2
- Ein typischer Antikörper, der im Falle einer solchen Krankheit in den Immunzellen entsteht, ist der TSH-Rezeptor-Antikörper (TRAK).5
- Die Bindung der TRAK an den N-terminalen Teil des TSH-Rezeptors ahmt die Wirkung von TSH nach und führt überwiegend zu einer Stimulation. Daraus resultieren eine Anregung der Thyreozyten, eine Steigerung der Jodaufnahme in die Schilddrüse und schließlich eine vermehrte Bildung und Ausschüttung von T3 und T4.2
- In seltenen Fällen können allerdings auch blockierende TRAK vorliegen.1
- Zudem besteht eine Expression des TSH-Rezeptors auf dem retrobulbären Gewebe.1
- Die Bindung der TRAK beim M. Basedow führt vermutlich zu einer Stimulation mit zunehmender Fibrosierung in der räumlich begrenzten Orbita: Es entsteht eine endokrine Orbitopathie.
Disponierende Faktoren
- Polygenetische Prädisposition2
- verantwortlichen Gene vorwiegend in der HLA-Region DR3
- Nikotinabusus2
- vermutlich nur geringer Risikofaktor für die Entwicklung eines Morbus Basedow
- Scheint jedoch das Auftreten und den Schweregrad der endokrinen Orbitopathie nachteilig zu beeinflussen.
ICPC-2
- T99 Endo./metab./ernäh. Erkrank., andere
ICD-10
- E05.0 Hyperthyreose mit diffuser Struma, inkl. Basedow-Krankheit
Diagnostik
Diagnostische Kriterien
- Die europäische Leitlinie empfiehlt bei einer Hyperthyreose die Messung von TRAK als schnelle und akkurate Methode zur Differenzialdiagnose eines M. Basedow.6
- sehr hohe Sensitivität (97 %) und Spezifität (98 %)7
- Zudem empfiehlt die Leitlinie eine Ultraschalluntersuchung als Bildgebung der Wahl, um die Diagnose zu stützen.6
Differenzialdiagnosen
- Autonomes Adenom
- Thyreoiditis
- Zentrale Hyperthyreose (z. B. TSH-produzierendes Hypophysenadenom)
Anamnese
- In der Regel plötzliches Auftreten von den vielfältigen Symptomen einer Hyperthyreose1
- z. B. Unruhe, Gewichtsverlust, Abgeschlagenheit, vermehrtes Schwitzen, Zittern, Konzentrationsstörungen, Haarausfall und bei Frauen auch Zyklusstörungen5
- Zunehmende Schwellung der Schilddrüse, manchmal schmerzhaft
Klinische Untersuchung
- Zeichen einer Hyperthyreose, z. B.:
- Tachykardie, arterielle Hypertonie
- warme Haut
- Hyperreflexie
- Tremor.
- Klassischerweise Merseburger-Trias
- Struma
- Exophthalmus (endokrine Orbitopathie)
- Tachykardie
- Endokrine Orbitopathie (Ophthalmopathie)8
- häufigste extrathyreoidale Manifestation des M. Basedow
- subjektive Aktivitätszeichen: Schmerzen oder Druckgefühl hinter dem Augapfel oder Schmerzen bei Auf-, Ab- oder Seitenblick
- objektive Entzündungszeichen: Rötung oder Schwellung der Augenlider, diffuse Rötung der Konjunktiva in mindestens einem Quadranten, Chemosis und Karunkelschwellung
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- Bestimmung von TSH und FT4, um die Stoffwechsellage zu ermitteln.
- häufig Hyperthyreose, aber auch Hypothyreose möglich
- abhängig von Funktionalität der TRAK
- häufig Hyperthyreose, aber auch Hypothyreose möglich
- Bestimmung der für einen M. Basedow hochspezifischen und -sensiblen TSH-Rezeptor-AK6
- nach Möglichkeit auch Bestimmung der Funktionalität der TRAK (stimulierend oder blockierend)
Sonografie
- Typischerweise vergrößertes Schilddrüsenvolumen mit diffus echoarmem, inhomogenem Parenchym sowie einer deutlichen Hypervaskularisation.1
Diagnostik bei Spezialist*innen
Szintigrafie mit radioaktiv markiertem Jod9
- Bei Hyperthyreose und Verdacht auf eine Thyreoiditis
- Eine reduzierte/fehlende Aufnahme des Radiopharmakons bei hyperthyreoter Stoffwechsellage spricht diagnostisch für eine Thyreoiditis.
- Die Hyperthyreose bei einer Thyreoiditis beruht auf der vermehrten Hormonfreisetzung infolge einer Schilddrüsendestruktion und nicht, wie beim Morbus Basedow, aufgrund einer -überfunktion.
- Beim Morbus Basedow ist die Jodaufnahme aufgrund der vermehrten Schilddrüsenstimulation erhöht.
- In der Regel ist eine Schilddrüsenszintigrafie zur Diagnosestellung jedoch nicht erforderlich.1
Indikationen zur Überweisung/Einweisung
- Zum Zeitpunkt der Diagnosestellung sollten Patient*innen bei Unklarheiten oder ggf. auch zur Therapieeinstellung an eine endokrinologische Praxis überwiesen werden.
- Endokrinologisch versierte Hausärzt*innen können die Behandlung und die Verlaufskontrolle einer Hyperthyreose jedoch auch selbst übernehmen und weitere Maßnahmen koordinieren.
- Bei Verdacht auf eine endokrine Orbitopathie soll an eine Augenarztpraxis überwiesen werden.
- Indikationen zur Krankenhauseinweisung sind u. a.:
- Erstdiagnose Vorhofflimmern
- V. a. thyreotoxische Krise.
Überweisung im weiteren Krankheitsverlauf
- Planung einer Schwangerschaft bei Patientinnen mit Hyperthyreose
- Manifeste Hyperthyreose während oder nach einer Schwangerschaft
- Zur Indikationsstellung einer definitiven Therapie (Radiojodtherapie oder Thyreoidektomie)
- Rezidive nach abgeschlossener Radiojodtherapie oder subtotaler Thyreoidektomie
- Augenärztliche Kontrollen bei endokriner Orbitopathie
Therapie
Therapieziele
- Remission der Erkrankung
- Beschwerdefreiheit
- Verhinderung von Komplikationen
Allgemeines zur Behandlung
Europäische Leitlinie M. Basedow (Stand 2018)6
- Anmerkung der Redaktion: Übersetzung der Leitlinie vom Englischen ins Deutsche durch unsere Autor*innen
- Patient*innen mit neu diagnostiziertem M. Basedow sollten als Erstlinientherapie medikamentös mit Thyreostatika behandelt werden.
- Die Radiojodtherapie oder Thyreoidektomie sind als alternative Optionen individuell in Betracht zu ziehen.
- Bei allen nicht schwangeren Patient*innen sollte Thiamazol (alternativ Carbimazol) als Thyreostatikum eingesetzt werden.
- Die thyreostatische Medikation sollte für 12–18 Monate gegeben werden.
- Die initiale Dosierung beträgt bei Thiamazol 10–30 mg/d, abhängig vom Schweregrad der Hyperthyreose.
- Die Dosis kann im Verlauf reduziert werden, basierend auf den FT3- und FT4-Spiegel 3–4 Wochen nach Therapieeinleitung.
- Der TSH-Spiegel ist oft monatelang nach Therapieeinleitung supprimiert und deswegen nicht als Verlaufsparameter geeignet.
- Die Erhaltungsdosis für Thiamazol liegt meistens bei 2,5–10 mg/d.
- Alternativ können 30 mg Thiamazol in Kombination mit Levothyroxin gegeben werden („Block and Replace").
- Nach 12–18 Monaten kann ein Auslassversuch erfolgen, sofern TSH und TRAK normwertig sind.
- Bei Patient*innen mit persistierend hohen TRAK kann die thyreostatische Therapie für weitere 12 Monate fortgeführt werden mit anschließend erneuter TRAK-Bestimmung.
- Als Alternative sollte mit diesen Patient*innen eine Radiojodtherapie oder Thyreoidektomie besprochen werden.
- Eine Therapie mit Betablockern bei adrenergen Symptomen wird bei allen Patient*innen empfohlen.
- Propranolol 20–40 mg 4x/d
- Pro thyreostatische Therapie10
- Morbus Basedow mit geringem Rezidivrisiko (weiblich, > 40 Jahre, Schilddrüsen-Volumen < 40 ml, TRAK < 10 IU/l nach 6 Monaten der konservativen Therapie)
- Kontraindikationen gegen eine Operation oder Radiojodtherapie
- Pro operative Therapie10
- Morbus Basedow mit hohem Rezidivrisiko, Persistenz oder Rezidiv der Hyperthyreose nach 6–12 Monaten konservativer Therapie, insbesondere bei großer Struma
- Morbus Basedow mit florider endokriner Orbitopathie oder bei Kinderwunsch
- Pro Radiojodtherapie10
- Morbus Basedow mit hohem Rezidivrisiko, Persistenz oder Rezidiv der Hyperthyreose nach 6–12 Monaten konservativer Therapie, insbesondere bei kleiner oder mittlerer Struma
Empfehlungen für Patient*innen
- Bei Beginn der thyreostatischen Behandlung sollten die Patient*innen über die Symptome einer Agranulozytose (Fieber, Pharyngitis oder Zystitis) und Hepatitis (Ikterus, acholischer Stuhl oder dunkler Urin) aufgeklärt werden.1
- Bei Auftreten der Symptome sollten die Thyreostatika sofort abgesetzt und ein ärztlicher Kontakt gesucht werden.1
- Sofortiger Rauchstopp, um Risiko für ophthalmologische Komplikationen zu senken.5
Medikamentöse Behandlung
- Zur Durchführung der medikamentösen Therapie siehe die europäischen Leitlinienempfehlungen.
Thyreostatika – Präparate
- Carbimazol/Thiamazol
- Carbimazol ist Prodrug von Thiamazol, die Umwandlung erfolgt durch die Leber.
- Hemmung der Biosynthese der Schilddrüsenhormone durch Inhibition der Thyreoperoxidase (verantwortliches Enzym für Iodierung der Schilddrüsenhormone)
- aufgrund des günstigeren Nebenwirkungsprofils Medikamente der Wahl1
- Leberschädigung bei 0,4 % der Patient*innen im Gegensatz zu 2,7 % bei Einnahme von Propylthiouracil11
- Propylthiouracil (PTU)
Betablocker
- Indikation
Weitere Behandlungsformen
Radiojodtherapie
- Indikationen
- Siehe Abschnitt Pro Radiojodtherapie.
- Siehe Abschnitt Pro Radiojodtherapie.
- Durchführung
- Durchführung unter stationären Strahlenschutzbedingungen als Einzeittherapie auf einer nuklearmedizinischen Therapiestation10
- Systemische Applikation des Beta- und Gamma-Strahlers I–131 als Natriumiodid, um hohe intrathyreoidale Strahlendosen zu erreichen.10
- Verabreichung in der Regel p. o. (Kapsel oder flüssig)
- tägliche Messung von Uptake und effektiver Halbwertszeit
- bei Bedarf: Nachtherapie während des gleichen stationären Aufenthaltes
- Entlassung bei einer Dosisleistung von ≤ 3,5 μSv/h in 2 m Abstand
- Radioaktives Jod wird von den Follikelzellen aufgenommen, sodass die Strahlung ausschließlich das Schilddrüsengewebe schädigt.12
- Die volle Wirkung tritt im Laufe von 4–12 Wochen ein.
- Nebenwirkungen
- Infolge der Behandlung kommt es häufig zur Entwicklung einer permanenten Hypothyreose.
- etwa 60–70 % der Patient*innen betroffen10
- in diesem Fall Schilddrüsenhormonsubstitution
- Weitere Nebenwirkungen sind selten, und die Behandlung scheint das Krebsrisiko nicht zu erhöhen.13
- Mögliche Nebenwirkungen sind leichte Schmerzen im vorderen Halsbereich aufgrund einer Strahlenthyreoiditis und eine vorübergehend verstärkte Hyperthyreose (kann durch Vorbehandlung mit Thyreostatika vorgebeugt werden).
- erhöhtes Risiko für die Entwicklung eines Hyperparathyreoidismus14
- Infolge der Behandlung kommt es häufig zur Entwicklung einer permanenten Hypothyreose.
- Kontraindikationen
- Schwangerschaft und Stillzeit
- Innerhalb der ersten 6 Monate nach der Radiojodtherapie wird von einer Schwangerschaft abgeraten (gilt auch für Männer, die mit Radiojod therapiert wurden).
- Frauen, die ihre Familienplanung noch nicht abgeschlossen haben (relative Kontraindikation).
- endokrine Orbitopathie (kann sich durch die Therapie verschlimmern)15
- Wird bei bestehender Orbitopathie dennoch eine Radiojodbehandlung durchgeführt, sollten gleichzeitig Kortikosteroide in relativ hoher Dosierung verabreicht werden.10
- Schwangerschaft und Stillzeit
Thyreoidektomie
- Indikationen
- Siehe Abschnitt Pro operative Therapie.
- Durchführung
- Cave: Unterschied zwischen der Leitlinie der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie16 und der europäischen Leitlinie!6
- Deutsche Leitlinie: Thyreoidektomie oder fast-totale Thyreoidektomie16
- Europäische Leitlinie: immer vollständige Thyreoidektomie anstreben, da gleiches Komplikationsrisiko wie fast-totale Thyreoidektomie, aber geringeres Risiko für Rezidiv einer Hyperthyreose6
- Cave: Unterschied zwischen der Leitlinie der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie16 und der europäischen Leitlinie!6
- Vorbehandlung16
- Präoperativ ist das Erreichen einer klinischen Euthyreose anzustreben.
- Ein Vitamin-D-Defizit sollte ausgeglichen werden, um das postoperative Risiko von Hypokalzämien zu reduzieren.6
- Komplikationen
- Abhängig von der Menge des verbliebenen Schilddrüsengewebes entwickeln die meisten Patient*innen eine postoperative Hypothyreose.
- Hypoparathyreoidismus
- Schädigung des Nervus laryngeus recurrens
- vorübergehende Hypokalzämie
- generelle OP-Risiken wie Blutung oder Infektion
Schwangerschaft
- Laut Bulletin zur Arzneimittelsicherheit vom Dezember 2019 werden folgende Empfehlungen zur Thyreostatikagabe in der Schwangerschaft gegeben:17
- Patientinnen im gebärfähigen Alter, die mit Thiamazol (TMZ) bzw. Carbimazol (CMZ) behandelt werden, sollten für die Zeit der Behandlung eine effektive Verhütung anwenden, weil die Behandlung mit TMZ bzw. CMZ mit angeborenen Fehlbildungen assoziiert sein kann, wenn sie während der Schwangerschaft und insbesondere im ersten Trimenon der Schwangerschaft und in hoher Dosierung verabreicht werden.
- Eine routinemäßige Einstellung auf PTU sollte bei Patientinnen ohne Kinderwunsch vermieden werden, da die Anwendung von PTU mit einem höheren Risiko für akutes Leberversagen assoziiert ist.
- Patientinnen mit Morbus Basedow, die eine Schwangerschaft planen, sollte eine Beratung angeboten werden. Während dieser Beratung sind die Komplexität des Managements des Morbus Basedow während der Schwangerschaft und die vorhandenen therapeutischen Alternativen zu diskutieren.
- Grundsätzlich sollte eine Verschiebung der Empfängnis empfohlen werden, bis die mütterliche Grunderkrankung ausreichend kontrolliert ist bzw. definitiv behandelt wurde.
- Eine manifeste Hyperthyreose während der Schwangerschaft bedarf einer adäquaten Behandlung, um dem Auftreten von schweren mütterlichen und fetalen Komplikationen entgegenzuwirken.
- Wird eine Schwangerschaft unter thyreostatischer Therapie in Erwägung gezogen, sollten Patientinnen, die mit TMZ bzw. CMZ behandelt werden, nach individueller Nutzen-Risiko-Abwägung vor Empfängnis auf PTU umgestellt werden, da die derzeit vorhandene Datenlage auf ein
allenfalls gering erhöhtes Fehlbildungspotenzial von PTU hindeutet. - Die derzeitige Evidenz erlaubt keine verlässliche Aussage bezüglich des Nutzens der Umstellung von TMZ bzw. CMZ auf PTU im ersten Trimenon einer bereits bestehenden Schwangerschaft.
- Diesbezüglich sollte nach einer individuellen Nutzen-Risiko-Abwägung unter Beachtung des potenziellen Risikos für eine temporäre inadäquate Kontrolle der Schilddrüsenfunktion während der Umstellung entschieden werden.
- Die Anwendung von TMZ bzw. CMZ im ersten Trimenon der Schwangerschaft sollte auf die Fälle einer Unverträglichkeit gegenüber PTU begrenzt sein.
- Die Umstellung von PTU auf TMZ bzw. CMZ nach Vollendung der sensiblen Phase der Organogenese kann unter individueller Nutzen-Risiko-Abwägung erwogen werden, um das Risiko des mütterlichen Leberversagens zu reduzieren. Das potenzielle Risiko einer temporären Entgleisung der Schilddrüsenfunktion während der Umstellung sollte jedoch beachtet werden.
- Eine thyreostatische Therapie bei Schwangeren sollte grundsätzlich mit der niedrigsten wirksamen Dosis ohne zusätzliche Verabreichung von Schilddrüsenhormonen erfolgen.
- Ein engmaschiges Monitoring von Mutter, Fetus und Neugeborenem ist notwendig, falls eine thyreostatische Therapie bei Schwangeren angewendet wird.
Prävention
- Physiologische Selenspiegel können der Entwicklung einer Schilddrüsenerkrankung entgegenwirken.18
- Sowohl Mangel als auch Überversorgung von Selen vermeiden.
- Die Deutsche Gesellschaft für Ernährung empfiehlt als tägliche Selen-Zufuhr für Männer 70 µg und für Frauen 60 µg.19
- Selenreiche Lebensmittel sind Paranüsse (cave: radioaktiv, kein übermäßiger Verzehr empfohlen!), Pilze, Spargel und Hülsenfrüchte.20
- Tierfutter darf in der Europäischen Union mit Selen angereichert werden. Deshalb können tierische Lebensmittel wie Fleisch und Ei relativ konstant zur Selenversorgung beitragen.20
Verlauf, Komplikationen und Prognose
Verlauf
- Meistens plötzlicher Beginn der Erkrankung mit hyperthyreotischen Symptomen
- Fast alle Patient*innen entwickeln eine opthalmologische Symptomatik, aber nur bei etwa 5 % handelt es sich um visusbedrohende Komplikationen.21
Komplikationen
- Thyreotoxische Krise
- lebensbedrohliche Dekompensation einer Hyperthyreose
- Endokrine Orbitopathie
- Hypothyreose nach definitiver Therapie
- Herzrhythmusstörungen, z. B. Vorhofflimmern
Prognose
- Bei einem Auslassversuch nach mindestens 6-monatiger thyreostatischer Erstbehandlung liegt die Remissionsrate bei ca. 50–60 %.1
- Ungefähr die Hälfte der Rezidive (ca. 23 %) treten im ersten halben Jahr bzw. 2/3 (ca. 70 %) innerhalb des ersten Jahres nach dem Absetzen der Thyreostatika auf.
- Zur Einschätzung des Krankheitsverlaufs des Einzelnen kann die Höhe der TRAK hilfreich sein.1
- Die Aussichten auf eine langfristige Remission durch eine thyreostatische Therapie sind bei Schilddrüsenvolumina > 40 ml, bei jungen Patient*innen < 20 Jahre bzw. persistierend hohem TRAK > 10 U/l gering.4
Verlaufskontrolle
- In den meisten Fällen erfolgt die Therapie in Kooperation mit endokrinologischen Spezialist*innen.
- Nach Rücksprache mit Spezialist*in können die Verlaufskontrollen in der hausärztlichen Praxis erfolgen.
Thyreostatische Therapie
- Die Thyreostatikadosis wird anhand des FT4-Werts, der anfangs alle 3–4 Wochen bestimmt wird, bis zum Erreichen der Erhaltungsdosis titriert.
- Das Behandlungsziel ist, FT4 im oberen Normbereich zu halten.
- Nach Erreichen der Erhaltungsdosis sollten die Patient*innen in Abständen von 3–6 Monaten kontrolliert werden.
- Unter thyreostatischer Therapie sollen regelmäßig Blutbild (cave: Agranulozytose!), und Leberwerte (cave: Hepatitis!) kontrolliert werden.
Nach Radiojodtherapie oder operativer Therapie
- Kontrollen nach Maßgabe des behandelnden Zentrums
- Die meisten Patient*innen entwickeln nach einer definitiven Therapie eine Hypothyreose, die eine lebenslange Hormonsubstitution erfordert.
- Steuerung der Hormonsubstitution mittels FT4 und TSH
Patienteninformationen
Patienteninformationen in Deximed
Patienteninformationen des IQWIG
- Gesundheitsinformation.de: Schilddrüsenüberfunktion
Patientenorganisationen
- Schilddrüsen-Liga Deutschland e.V.: Dachverband der Selbsthilfegruppen für Schilddrüsenkranke und deren Angehörige
- Die Schmetterlinge e. V.: Selbsthilfeorganisation für Kinder und Erwachsene mit Schilddrüsenerkrankungen
Illustrationen
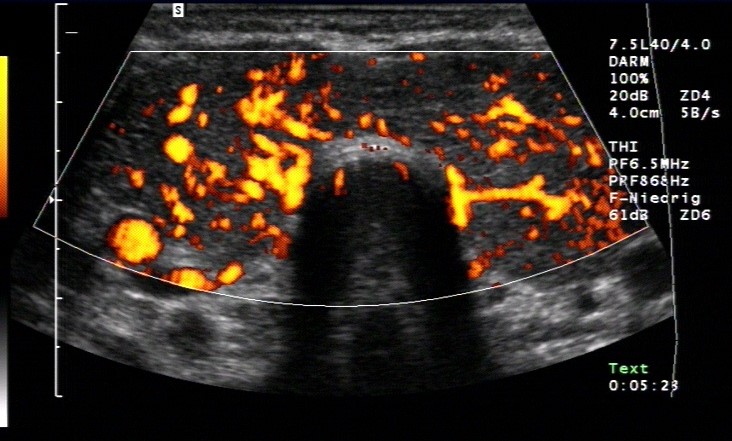
Duplexsonografie: Morbus Basedow mit Hypervaskularisation (mit freundlicher Genehmigung von sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg)
Quellen
Leitlinien
- European Thyroid Association. Guideline for the Management of Graves' Hyperthyroidism. Stand 2018. www.pubmed.ncbi.nlm.nih.gov
- American Thyroid Association. Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Stand 2016. www.pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Radioiodtherapie bei benignen Schilddrüsenerkrankungen. AWMF-Leitlinie Nr. 031-003. S1, Stand 2015. (abgelaufen) www.awmf.org
- Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie e.V. (DGAV). Benigne Schilddrüsenerkrankungen, operative Therapie. AWMF-Leitlinie Nr. 088-007. S2k, Stand 2015. (abgelaufen) www.awmf.org
Literatur
- Allelein S, Schott M. Update Morbus Basedow. Dtsch Med Wochenschr 2019; 144(3): 152-5. www.thieme-connect.com
- Allelein S, Feldkamp J, Schott M. Autoimmune Schilddrüsenerkrankungen. Der Internist 2017; 58: 47-58. link.springer.com
- Grünwald F, Derwahl KM. Diagnostik und Therapie von Schilddrüsenkrankheiten, Ein Leitfaden für Klinik und Praxis. Berlin: Lehmanns Media, 2016.
- Zieren HO, Leu BM, Dietlein M. Fortbildung Schwerpunkt: Bei diesen Symptomen sollten Sie an eine Hyperthyreose denken!. MMW Fortschritte der Medizin 2018. S. 38-42. www.springermedizin.de
- Schneider HJ, Jacobi N, Thyen J. Hormone – ihr Einfluss auf mein Leben. Berlin, Heidelberg: Springer, 2020. link.springer.com
- Kahaly GJ, Bartalena L, Hegedüs L, et al. 2018 European Thyroid Association Guideline for the Management of Graves' Hyperthyroidism. Eur Thyroid J 2018; 7(4): 167-86. pubmed.ncbi.nlm.nih.gov
- Tozzoli R, Bagnasco M, Giavarina D, et al. TSH receptor autoantibody immunoassay in patients with Graves’ disease: improvement of diagnostic accuracy over different generations of methods: systematic review and meta-analysis. Autoimmun Rev 2012; 12(2): 107-13. pubmed.ncbi.nlm.nih.gov
- Schmidt M. So erkennen und behandeln Sie die Hyperthyreose. CME 2017; 14: 9-23. link.springer.com
- Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Schilddrüsenszintigraphie. AWMF-Leitlinie Nr. 031-011. S1. Stand 2014. Letzter Zugriff 10.12.20. www.nuklearmedizin.de
- Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Radioiodtherapie bei benignen Schilddrüsenerkrankungen. AWMF-Leitlinie Nr. 031 - 003. S1. Stand 2015. www.awmf.org
- Ross DS, Burch HB, Cooper DS et al. 2016 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyreoid 2016; 26: 1343-1421. pubmed.ncbi.nlm.nih.gov
- Metso S, Jaatinen P, Huhtala H, Luukkaala T, Oksala H, Salmi J. Long-term follow-up study of radioiodine treatment of hyperthyroidism. Clin Endocrinol (Oxf) 2004; 61: 641-8. www.ncbi.nlm.nih.gov
- Bahn Chair RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid 2011; 21: 593. pubmed.ncbi.nlm.nih.gov
- Colaco SM, Si M, Reiff E, Clark OH. Hyperparathyroidism after radioactive iodine therapy. Am J Surg 2007; 194: 323-7. pubmed.ncbi.nlm.nih.gov
- Ginsberg J. Diagnosis and management of Graves' disease. CMAJ 2003; 168: 575-85. www.cmaj.ca
- Deutsche Gesellschaft für Allgemein- und Viszeralchirurgie e.V. (DGAV). Benigne Schilddrüsenerkrankungen, operative Therapie. AWMF-Leitlinie Nr. 088 - 007. S2k. Stand 2015 www.awmf.org
- Frizler M. Thyreostatische Behandlung des Morbus Basedow während der Schwangerschaft. Bulletin zur Arzneimittelsicherheit. Informationen aus BfArM und PEI 2019; 4: 14-29. www.bfarm.de
- Ventura M, Melo M, Carrilho F. Selenium and Thyroid Disease: From Pathophysiology to Treatment. International Journal of Endocrinology 2017. pubmed.ncbi.nlm.nih.gov
- Deutsche Gesellschaft für Ernährung. Referenzwerte Selen. Letzter Zugriff 11.12.2020. www.dge.de
- Deutsche Gesellschaft für Ernährung. Ausgewählte Fragen und Antworten zu Selen. Letzter Zugriff 11.12.2020. www.dge.de
- Bartalena L, Pinchera A, Marcocci C. Management of Graves' ophthalmopathy: reality and perspectives. Endocr Rev 2000; 21: 168-99. pubmed.ncbi.nlm.nih.gov
- Tun NN, Beckett G, Zammitt NN et al. Thyrotropin Receptor Antibody Levels at Diagnosis and After Thionamide Course Predict Graves’ Disease Relapse. Thyroid 2016; 26: 1004-9. pubmed.ncbi.nlm.nih.gov
Autor*innen
- Lino Witte, Dr. med., Arzt in Weiterbildung, Innere Medizin, Frankfurt