Zusammenfassung
- Definition:Systemische Skeletterkrankung, die aufgrund niedriger Knochenmasse und veränderter Mikroarchitektur des Knochens zu erhöhtem Frakturrisiko führt.
- Häufigkeit:In Deutschland sind ca. 5 Mio. Frauen und 1 Mio. Männer betroffen. Ganz überwiegend postmenopausale Frauen und Männer > 50 Jahre, exponentieller Anstieg mit dem Alter.
- Symptome:Lange asymptomatisch, Klinik geprägt durch Frakturen und ihre Folgen (Schmerzen, Funktionsminderung, Immobilisierung).
- Befunde:Verminderung der Körpergröße, verminderter Rippen-Becken-Abstand, Kyphosierung, Einschränkungen von Beweglichkeit und Mobilität.
- Diagnostik:Bei Risikokonstellation mit 10-Jahres-Frakturrisiko > 20 % wird eine Basisdiagnostik empfohlen: Anamnese/Befund, Labor, Knochendichtemessung mittels DXA (Dual-Energy X-Ray Absorptiometry), ggf. Röntgen zum Frakturnachweis.
- Therapie:Basistherapie mit Lebensstilmodifikation und ausreichender Zufuhr von Kalzium und Vitamin D. Spezifische medikamentöse Therapie zur Frakturprävention vor allem mit Biphosphonaten. Ergänzend Physiotherapie zur Verbesserung von Kraft und Mobilität sowie Minderung des Sturzrisikos.
Prüfungsrelevant für die Facharztprüfung Allgemeinmedizin1
- Risikofaktoren, Einfluss des Körpergewichts
- Klinische Untersuchung
- Untersuchung bei bestehendem erhöhtem Risiko für Osteoporose, Labor, Indikation für Röntgen und DXA
- Medikamentöse Therapie
- Kenntnis der DVO-Leitlinie Osteoporose:
Allgemeine Informationen
Definition
- Die Osteoporose ist eine systemische Skeletterkrankung, charakterisiert durch eine:2
- niedrige Knochenmasse
- mikroarchitektonische Verschlechterung des Knochengewebes.
- Folge der Erkrankung ist ein Anstieg der Knochenfragilität und der Neigung zu Frakturen.2
- Bei bereits aufgetretenen Frakturen spricht man von manifester Osteoporose.
- Operationale Definition der WHO für das Vorliegen einer Osteoporose3-4
- Knochenmineralgehalt < –2,5 Standardabweichungen vom Mittelwert einer 20- bis 29-jährigen Frau
- Angabe als T-Score: Anzahl der Standardabweichungen
- Die Knochendichtemessung erfolgt an der Lendenwirbelsäule und/oder am Femur mittels DXA (Dual-Energy X-Ray Absorptiometry).
- Die auf dem T-Score beruhende operationale Definition gilt erst nach Ausschluss anderer Erkrankungen mit Verminderung des Mineralgehalts.
- Knochenmineralgehalt < –2,5 Standardabweichungen vom Mittelwert einer 20- bis 29-jährigen Frau
- Die Diagnose einer Osteoporose stützt sich zwar weitgehend auf eine niedrige Knochendichte als wesentlicher Komponente der Osteoporose, klinische Beurteilung und insbesondere Therapieentscheidungen erfolgen aber unter Berücksichtigung des individuellen Risikoprofils.2
Aktuelle DVO-Leitlinien: Gültigkeitsbereich
- Der vorliegende Text bezieht sich auf die aktuellen Leitlinien der DVO (Dachverband der deutschsprachigen wissenschaftlichen osteologischen Gesellschaften).2
- Gegenstand der DVO-Leitlinie sind Prävention, Diagnose und Therapie der Osteoporose bei postmenopausalen Frauen und Männern ab 50 Jahren.2
- Die Leitlinie gilt hingegen nicht2
- für Kinder, Jugendliche, prämenopausale Frauen und jüngere Männer.
- für Frauen und Männer mit einer schweren Niereninsuffizienz (ab Stadium G4, d. h. GFR < 30 ml/min).
Häufigkeit
- Prävalenz der Osteoporose
- Häufigkeit osteoporotischer Frakturen
- Ca. 50 % der Frauen und 20 % der Männer erleiden im Lauf ihres Lebens (eine) osteoporosebedingte Fraktur(en).9-10
- am häufigsten Hüft-, Wirbel- und Handgelenksfrakturen
- Inzidenz im Alter von 50–79 Jahren11
- bei Frauen periphere Fraktur 1,9 %/Jahr, Wirbelkörperfraktur 1 %/Jahr
- bei Männern periphere Fraktur 0,7 %/Jahr, Wirbelkörperfraktur 0,6 %/Jahr
- exponentieller Anstieg mit dem Alter11
- Ca. 50 % der Frauen und 20 % der Männer erleiden im Lauf ihres Lebens (eine) osteoporosebedingte Fraktur(en).9-10
Ätiologie und Pathogenese
- Die größte Knochenmasse haben Frauen und Männer im Alter von 20–30 Jahren.
- Beginn des altersabhängigen Knochenabbaus in der 4.–5. Lebensdekade5
- vermehrter Knochenabbau durch Osteoklasten bei gleichzeitiger Verminderung der Knochenbildung durch Osteoblasten
- Bei Frauen ist dies vor allem mit dem absinkenden Östrogenspiegel bei Eintritt der Menopause verknüpft.13
- Bei Männern spielt Testosteron eine wichtige Rolle im Knochenstoffwechsel, langsamere Abnahme der Knochenmasse aufgrund der im Vergleich zu Frauen langsameren Abnahme der Sexualhormonspiegel.5
- Insgesamt multifaktorielle Erkrankung, man geht davon aus, dass die Variabilität in der Knochenfestigkeit (bestimmt durch Knochengröße, Knochendichte und Mikroarchitektur) zu einem großen Anteil genetisch bedingt ist.14
- Osteoporose bedeutet Insuffizienz in der mechanischen Funktion des Knochens mit erhöhtem Risiko der Fragilitätsfraktur bei Alltagsbelastung und Bagatelltrauma.15
Primäre Osteoporose
- Alter und Geschlecht sind bestimmende Faktoren, formal müssen andere Ursachen einer Mineralisationsstörung ausgeschlossen sein, Übergänge zu sekundären Osteoporosen allerdings häufig fließend und unscharf.14
- Postmenopausale Typ-1-Osteoporose6
- häufigste Form in Zusammenhang mit abnehmenden Östrogenspiegeln
- Senile Typ-2-Osteoporose6
- ab dem 70. Lebensjahr altersbedingter Knochendichteverlust gleichermaßen bei Frauen und Männern
Sekundäre Osteoporose
- Bei einer sekundären Osteoporose ist der dominante Pathomechanismus eine:15
- definierte Grunderkrankung
- endokrinologische Erkrankungen
- systemisch-entzündliche Erkrankungen
- maligne Erkrankungen
- Nierenerkrankungen
- Malabsorptionssyndrome
- medikamentöse Therapie
- vor allem Glukokortikoide.
- definierte Grunderkrankung
Risikofaktoren für osteoporotische Frakturen
Allgemeine Risikofaktoren2
- Lebensalter: zunehmendes Alter hoher Risikofaktor
- Geschlecht: Frauen mit höherem Frakturrisiko als Männer
- Wirbelkörperfrakturen: Risiko für inzidente Frakturen mit Anzahl von Wirbelkörperfrakturen ansteigend
- Nichtvertebrale Frakturen ab dem 50. Lebensjahr
- Proximale Femurfraktur bei Vater oder Mutter
- Multiple intrinsische Stürze
- Immobilität
- Verminderte Handgriffstärke
- Rauchen
- Untergewicht, Gewichtsabnahme, Anorexia nervosa
- Vitamin-D- und Kalziummangel
- Erhöhtes Homocystein, Folsäure-/Vitamin-B-Mangel
- Hochsensitives CRP erhöht
- Hyponatriämie
- Erhöhte Kadmiumzufuhr (z. B. durch Zigaretten, kontaminierte Meeresfrüchte)
- Alkohol
Grunderkrankungen2
- Endokrinologische Erkrankungen
- Diabetes mellitus Typ 1 und Typ 2, Cushing-Syndrom und subklinischer Hyperkortisolismus, primärer Hyperparathyreoidismus, Wachstumshormonmangel bei Hypophyseninsuffizienz, männlicher Hypogonadismus, subklinische und manifeste Hyperthyreose
- Rheumatologische Erkrankungen
- Gastroenterologische Erkrankungen
- Zöliakie und chronisch entzündliche Darmerkrankungen, B-II-Magenresektion oder Gastrektomie
- Neurologische Erkrankungen
- Epilepsie und Antiepileptika, Schizophrenie, apoplektischer Insult, Alzheimer-Erkrankung, Morbus Parkinson, erhöhtes Sturzrisiko
- Andere Erkrankungen
- Herzinsuffizienz, COPD, monoklonale Gammopathie unklarer Signifikanz, alkoholische Lebererkrankung
Medikamente2
- Glukokortikoide: abhängig von Dosis und Dauer der Anwendung
- Hormonablative Therapie, männlicher Hypogonadismus anderer Ursache
- Aromatasehemmer
- Therapie mit Thiazolidindionen (Glitazonen)
- Medikamente, die Stürze begünstigen.
- Antidepressiva
- Antiepileptika
- Opioide
- Protonenpumpenhemmer bei Langzeiteinnahme
- Schleifendiuretika
- Hyperthyreosis factitia
ICPC-2
- L95 Osteoporose, NNB
ICD-10
- M80 Osteoporose mit pathologischer Fraktur
- M80.0 Postmenopausale Osteoporose mit pathologischer Fraktur
- M80.1 Osteoporose mit pathologischer Fraktur nach Ovarektomie
- M80.2 Inaktivitätsosteoporose mit pathologischer Fraktur
- M80.3 Osteoporose mit pathologischer Fraktur infolge Malabsorption nach chirurgischem Eingriff
- M80.4 Arzneimittelinduzierte Osteoporose mit pathologischer Fraktur
- M80.5 Idiopathische Osteoporose mit pathologischer Fraktur
- M80.8 Sonstige Osteoporose mit pathologischer Fraktur
- M80.9 Nicht näher bezeichnete Osteoporose mit pathologischer Fraktur
- M81 Osteoporose ohne pathologische Fraktur
- M81.0 Postmenopausale Osteoporose
- M81.1 Osteoporose nach Ovarektomie
- M81.2 Inaktivitätsosteoporose
- M81.3 Osteoporose infolge Malabsorption nach chirurgischem Eingriff
- M81.4 Arzneimittelinduzierte Osteoporose
- M81.5 Idiopathische Osteoporose
- M81.8 Sonstige Osteoporose
- M81.9 Osteoporose, nicht näher bezeichnet
- M82 Osteoporose bei anderenorts klassifizierten Krankheiten
- M82.0 Osteoporose bei Plasmozytom
- M82.1 Osteoporose bei endokrinen Störungen
- M82.2 Osteoporose bei sonstigen anderenorts klassifizierten Krankheiten
M83 Osteomalazie im Erwachsenenalter
- M83.0 Osteomalazie im Wochenbett
- M83.1 Senile Osteomalazie
- M83.2 Osteomalazie im Erwachsenenalter durch Malabsorption
- M83.4 Aluminiumosteopathie
- M83.5 Sonstige arzneimittelinduzierte Osteomalazie bei Erwachsenen
- M83.8 Sonstige Osteomalazie im Erwachsenenalter
- M83.9 Osteomalazie im Erwachsenenalter, nicht näher bezeichnet
Diagnostik
- Die Indikation für die Diagnostik auf Osteoporose wird maßgeblich vom 10-Jahres-Frakturrisiko beeinflusst, es gilt folgendes Schema:16
- Frakturrisiko ≤ 20 %: keine Basisdiagnostik.
Indikationsstellung zur Basisdiagnostik
- Die Basisdiagnostik umfasst:2
- Anamnese
- klinischen Befund
- Basislabor
- DXA-Knochendichtemessung
- ggf. bildgebende Diagnostik bei klinischen Hinweisen auf osteoporotische Frakturen.
- Eine Basisdiagnostik wird empfohlen:17
- wenn das geschätzte 10-Jahres-Risiko für Wirbelkörperfrakturen und proximale Femurfrakturen 20 % übersteigt.
- baldmöglichst bei allen Fragilitätsfrakturen ab einem Alter von 50 Jahren.
- nach 3 Monaten Glukokortikoiden ≥ 7,5 mg/d Prednisolonäquivalent.
- generell bei Frauen ab dem 70. Lebensjahr, Männern ab dem 80. Lebensjahr (sofern Therapie erwogen wird).
- Für den deutschsprachigen Raum soll dabei die Risikoabschätzung nach DVO erfolgen.2
- Die Risikobeurteilung mit dem Fracture Risk Assessment Tool (FRAX®)18 kann alternativ oder zusätzlich verwendet werden.
- Ein eigener DVO-Risikorechner ist geplant, steht aktuell aber noch nicht zur Verfügung.
- Aktuell definieren die folgenden Konstellationen ein erhöhtes Frakturrisiko mit Indikation zur Basisdiagnostik:17
DVO-Empfehlungen: Risikokonstellationen mit Indikation zur Basisdiagnostik für Frauen ab 50 Jahren bzw. Männer ab 60 Jahren17
- Mit * gekennzeichnet: Frauen postmenopausal, Männer ab 50 Jahren
Frakturen
- Niedrigtraumatische singuläre Wirbelkörperfraktur 2. Grades oder multiple Wirbelkörperfrakturen 1. Grades, sofern andere Ursachen nicht wahrscheinlicher sind*.
- Klinisch manifeste niedrigtraumatische singuläre Wirbelkörperfraktur 1. Grades mit Deckplattenimpression, sofern andere Ursachen nicht wahrscheinlicher sind (ohne Klinik: Einzelfallentscheidung)*.
- Niedrigtraumatische nichtvertebrale Frakturen (mit Ausnahme von Finger-, Zehen-, Schädel- und Knöchelfrakturen)*
Endokrinologische Erkrankungen
- Cushing-Syndrom und subklinischer Hyperkortisolismus*
- Primärer Hyperparathyreoidismus*
- Wachstumshormonmangel bei Hypophyseninsuffizienz*
- Männlicher Hypogonadismus
- Subklinische und manifeste Hyperthyreose
- Diabetes mellitus Typ 1*
- Diabetes mellitus Typ 2
- Hyperthyreosis factitia, sofern persistierend
Rheumatologische Erkrankungen
Gastroenterologische Erkrankungen
- Zöliakie
- B-II-Magenresektion oder Gastrektomie*
Neurologische/psychiatrische Erkrankungen
- Epilepsie und Antiepileptika*
- Schizophrenie
- Apoplektischer Insult
- Alzheimer-Erkrankung
- Morbus Parkinson
- Depression
Andere Erkrankungen
- Herzinsuffizienz
- Monoklonale Gammopathie unklarer Signifikanz*
- Alkohol und alkoholische Lebererkrankung
- Anorexia nervosa
- Rauchen und chronisch obstruktive Atemwegserkrankung
Frakturrisiken durch eine medikamentöse Therapie
- Hormonablative Therapie, männlicher Hypogonadismus anderer Ursache*
- Aromatasehemmer*
- Eine bestehende oder geplante Therapie mit Glukokortikoiden ≥ 7,5 mg/d Prednisolonäquivalent über mehr als 3 Monate*
- Hochdosierte Glukokortikoide inhalativ
- Therapie mit Thiazolidindionen (Glitazonen)
- Medikamente, die Stürze begünstigen.
- Antidepressiva
- Antiepileptika
- Opioide
- Protonenpumpenhemmer bei chronischer Einnahme
Allgemeine Risikofaktoren
- Proximale Femurfraktur bei Vater oder Mutter
- Multiple intrinsische Stürze oder hohes Sturzrisiko
- Immobilität
Frauen ab dem 70. Lebensjahr, Männer ab dem 80. Lebensjahr
- Basisdiagnostik generell empfohlen, soweit eine Entscheidung über geplante therapeutische Maßnahmen ansteht.
Anamnese
- St. n. Frakturen, spontan oder nach Bagatelltraumen?
- vor allem Wirbelkörper, Femur, Radius
- Schmerzen
- Lokalisation, Stärke, Dauer
- Funktionelle Beeinträchtigung
- Stürze
- Risikofaktoren für Frakturen (s. o.)
- Körperliche Aktivität bzw. Immobilisierung
- Sonnenlichtexposition
- Ernährung
- Rauchen/Alkohol
- Grunderkrankungen
- Medikamente
Klinische Untersuchung
- Größe
- Abnahme der Körpergröße ≥ 3 cm?19
- Gewicht, BMI
- Untergewicht?
- Wirbelsäule
- Kyphosierung, Tannenbaumphänomen
- Klopfschmerz Dornfortsätze
- Rippen-Becken-Abstand < 2 cm19
- Beurteilung der Muskelkraft
Beurteilung von Mobilität, Koordination und Sturzrisiko
- Für die Beurteilung sind Timed-up-&-go-Test oder Chair-Rising-Test plus Tandemstand-Test empfohlen.16,19-20
Timed-up-&-go-Test (Mobilität)
- Ausrüstung: Stuhl (mit Armlehne), Streckenmarkierung (Fußboden) 3 m, Stoppuhr
- Durchführung
- Versuchsperson sitzt aufrecht auf einem Stuhl mit Armlehne.
- Aufforderung: „Stehen Sie bitte aus diesem Stuhl auf, gehen bis zu dieser Markierung (3 m), drehen sich um und setzen Sie sich wieder genauso hin! Ich werde die Zeit messen“ (Gehhilfen dürfen benutzt werden).
- Auswertung
- ≤ 10 sec: Keine Mobilitätsstörung anzunehmen.
- >11–29 sec: Interpretation nur in der Zusammenschau mit anderen Parametern möglich
- ≥ 30 sec: Mobilitätsstörung und Sturzgefährdung anzunehmen.
Chair-Rising-Test (Kraft der unteren Extremität)
- Ausrüstung: Stuhl (ohne Armlehne), Stoppuhr
- Durchführung
- Versuchsperson sitzt aufrecht auf einem Stuhl ohne Armlehne
- Aufforderung: „Stehen Sie bitte fünfmal hintereinander, so schnell Sie können, ganz auf, die Beine sollen gestreckt sein! Sie sollen die Arme nicht zu Hilfe nehmen! Ich werde die Zeit messen, die Sie dafür brauchen.– (wenn aus Sicherheitsgründen vertretbar: „Bitte kreuzen Sie die Arme vor der Brust!“)
- Auswertung
- ≤ 10 sec: Keine kraftbedingte Gangunsicherheit anzunehmen.
- ≥ 11 sec: Gangunsicherheit (hauptsächlich Muskelschwäche) anzunehmen.
Tandem-Standtest (Gleichgewicht)
- Ausrüstung
- evtl. gerade Linie (auf dem Fußboden) 0,5 m, Stoppuhr
- Durchführung
- Die Versuchsperson steht aufrecht.
- Aufforderung ist: „Setzen Sie beide Füße genau hintereinander auf eine (gedachte) Linie, die Ferse des vorderen Fußes genau vor die Fußspitze des hinteren. Fühlen Sie sich dabei unsicher, so suchen Sie bitte stabilen seitlichen Halt, z. B. in einer Zimmerecke oder an einem Tisch. Ich werde die Zeit messen, wie lange Sie so stehen können.“
- Auswertung
- ≥ 10 sec: Keine Gleichgewichtsstörung anzunehmen.
- < 10 sec: Gleichgewichtsstörung und Sturzgefährdung anzunehmen.
Ergänzende Untersuchungen in der Hausarztpraxis
Labor
- Laboruntersuchung dient der17
- Erfassung laborchemisch fassbarer Risikofaktoren und sekundärer Osteoporosen sowie differenzialdiagnostisch infrage kommender anderer Osteopathien.
- Erfassung von Kontraindikationen für eine medikamentöse Therapie.
- Basisuntersuchungen und verbundene Fragestellungen17
- Kalzium
- ↑ primärer Hyperparathyreoidismus oder andere Ursachen einer Hyperkalzämie
- ↓ z. B. sekundärer Hyperparathyreoidismus, Malabsorption
- Hypokalzämie als Kontraindikation für mehrere Osteoporose-Medikamente
- Phosphat
- ↑ Niereninsuffizienz Stadium IV, sekundärer renaler Hyperparathyreoidismus
- ↓ Malabsorption
- AP
- ↑ z. B. Osteomalazie
↓ möglicher Hinweis auf das Vorliegen einer Hypophosphatasie
- ↑ z. B. Osteomalazie
- Gamma-GT
- zur Differenzialdiagnose einer hepatisch bedingten AP-Erhöhung
- Hinweis auf Zöliakie oder Alkoholabusus (Sturzrisiko)
- eGFR
- ↓ renale Osteopathie
- höhergradige Niereninsuffizienz als Kontraindikation für verschiedene Medikamente
- BSG/CRP
- ↑ entzündlich rheumatische Erkrankungen, fortgeschrittene Malignome
- Blutbild
- Hinweise auf entzündliche und maligne Erkrankungen oder
Zöliakie
- Hinweise auf entzündliche und maligne Erkrankungen oder
- Natrium
- ↓ erhöhtes Risiko für vertebrale und nicht vertebrale Frakturen
- TSH
- < 0,3 mU/l endogen oder durch L-Thyroxin-Medikation bedingt als Risikofaktor für Frakturen
- Kalzium
- Optionale Untersuchungen17
- 25-Hydroxyvitamin D3
- V. a. Vitamin-D-Mangel
- Untersuchung sollte nur in ausgewählten Fällen erfolgen, z. B. bei V. a. Osteomalazie.
- Testosteron bei Männern
- V. a. Testosteronmangel
- Kalziumausscheidung im 24-h-Urin
- V. a. idiopathische Hyperkalziurie
- Kadmiumbestimmung im Urin
- V. a. erhöhte Kadmiumexposition
- Serumeiweißelektrophorese (evtl. mit Immunfixation)
- indiziert bei Auffälligkeiten in Entzündungsparametern oder Blutbild
- 25-Hydroxyvitamin D3
Diagnostik bei Spezialist*innen
Röntgen
- Erfassung von Frakturen
- Cave: Frische Wirbelkörpereinbrüche in der Frühphase sind im Routine-Röntgen oft nicht eindeutig nachweisbar, CT erkennt sie zuverlässig.
Knochendichtemessung
DXA (Dual-Energy X-Ray Absorptiometry)
- Goldstandard der Knochendichtemessung19
- Grundlage der meisten Frakturrisikoberechnungsmodelle19
- Weitere Vorteile sind:19
- sehr geringe Strahlenbelastung
- schnelle Durchführbarkeit
- niedrige Untersuchungskosten.
- Messung erfolgt an der Lendenwirbelsäule (L1–L4) sowie am Femur (Femurhals, Gesamtfemur).
- Wichtigster Messwert der DXA ist der sog. T-Wert: Abweichung in Standardabweichungen vom Mittelwert junger Erwachsener.11
- Ab einem T-Wert < –1 spricht man von Osteopenie, ab < –2,5 von Osteoporose.11
- Ergänzend kann der sog. Trabecular Bone Score (TBS) zur Beurteilung der Mikroarchitektur bestimmt werden.21
- Bedeutung der DXA besteht in:2,17
- Überprüfung, ob eine Osteoporose nach der operationalen Definition der WHO vorliegt (T-Score < –2,5).
- Optimierung der Frakturrisikobeurteilung
- Prüfung der Indikation für eine medikamentöse Therapie
QCT (quantitative Computertomografie)
- Erfasst die physikalische Dichte des Knochens an der Wirbelsäule oder auch peripher.19
- Ermöglicht Abschätzung des Frakturrisikos.2
- Fehlen von standardisierten Referenzdaten und großen prospektiven Studien2
- Die T-Werte einer QCT-Messung sind nicht in Ergebnisse einer DXA konvertierbar.2
- Keine Routineanwendung in der Osteoporose-Diagnostik
- Deutlich höhere Strahlenbelastung und Kosten, i.d.R. keine Kostenübernahme durch gesetzliche Krankenkassen
QUS (quantitativer Ultraschall)
- Messung der Geschwindigkeit des Ultraschalls und dessen Abschwächung am Kalkaneus19
- Ermöglicht eine Einschätzung des Frakturrisikos.2
- T-Scores nicht auf die Ergebnisse einer DXA-Messung übertragbar2
- Kein Routineverfahren bei unzureichender Studienlage2
Weitere bildgebende Verfahren (CT, MRT, Szintigrafie)
- Kein routinemäßiger Stellenwert in der Basisdiagnostik2
- Bedeutung bei:2
- Abklärung von Differenzialdiagnosen
- bestimmten Fragestellungen von Diagnostik und Therapie (z. B. Alter einer Fraktur, Abgrenzung von pathologischen Frakturen).
Indikationen zur Überweisung oder Klinikeinweisung
- Die Therapie der Osteoporose postmenopausaler Frauen und älterer Männer erfolgt in der Regel in der hausärztlichen Praxis. Außerdem regelmäßige zahnärztliche Vorsorgeuntersuchungen unter Bisphosphonaten oder Denusomab.
- Eine Überweisung zu Fachärzt*innen sollte erfolgen:20-22
- für erneute Knochendichtemessung
- bei Verdacht auf sekundäre Erkrankungsursache der Osteoporose
- bei Progression der Osteoporose unter Therapie
- bei Verdacht auf akute Wirbelkörperfraktur
- zur geriatrischen Mitbehandlung bei komplexen Krankheitskonstellationen
- für ambulante Schmerztherapie bei unzureichend kontrollierten chronischen Schmerzen
- zur kieferchirurgischen Abklärung bei Verdacht auf Kiefernekrose.
- Eine Krankenhauseinweisung sollte erfolgen:20-22
- bei akut immobilisierenden Frakturen
- bei Indikation zur teilstationären oder stationären multimodalen Schmerztherapie.
Therapie
Therapieziele
- Therapieziele gemäß DMP Osteoporose20
- Vermeidung von Frakturen, auch durch Vermeidung von Stürzen
- Erhöhung der Lebenserwartung
- Verbesserung oder Erhaltung der osteoporosebezogenen Lebensqualität
- Verbesserung oder Erhaltung einer selbstbestimmten Lebensführung
- Reduktion von Schmerzen
- Verbesserung oder Erhaltung von Funktion und Beweglichkeit
- Verhinderung der Progredienz der Erkrankung
Allgemeines zur Therapie
- Komponenten einer Osteoporose-Behandlung sind:
- Basistherapie
- spezifische medikamentöse Therapie
- ergänzende Therapiemaßnahmen.
- Die Indikation zur Basistherapie ergibt sich bereits aus der Indikation zur Basisdiagnostik: 10-Jahres-Frakturrisiko > 20 %. Elemente aus der Basistherapie dienen auch der Prophylaxe bei niedrigerem Risiko.
- Die Indikation zur spezifischen medikamentösen Therapie besteht, wenn der Nutzen der Medikation evtl. Therapierisiken erheblich übersteigt: 10-Jahres-Frakturrisiko > 30 %.11
Basistherapie
- Generelle Maßnahmen zur Prophylaxe von Frakturen sollen bei allen Risikogruppen erfolgen.17
- Empfehlung zur Reduktion beeinflussbarer Risikofaktoren
- Empfehlung begleitender Maßnahmen zur Krankheitsbewältigung
Körperliche Aktivität, Sturzvermeidung
- Muskelkraft und Koordination entsprechend dem funktionellen Status fördern.17
- Vermeidung von Immobilisation17
- Jährliche Sturzanamnese (Fragebogen z. B. via hausarzt.digital) bei hohem Sturzrisiko und ab der 8. Lebensdekade17
- Ursachen- und Risikoabklärung
- Therapie vermeidbarer Sturzursachen
- Beratung über zweckmäßige Heil- und Hilfsmittelversorgung20
Lebensstil
- Regelmäßiger Aufenthalt im Freien mit Sonnenexposition zur Vermeidung eines Vitamin-D-Mangels (ca. 30 min pro Tag, Kopf und Hände unbedeckt)11,26
- Kein Nikotinkonsum17
- Reduktion übermäßigen Alkoholkonsums20
Ernährung, Kalzium- und Vitamin-D-Zufuhr
- Vermeidung von Untergewicht, Body-Mass-Index (BMI) > 20 kg/m2 ohne Zunahme des Gewichts in den Bereich der Adipositas17
- Sicherstellung von 1.000 mg Kalzium Gesamtzufuhr täglich und 800–1.000 IE Vitamin D317
- Kalzium-Supplemente nur wenn Nahrungskalziumzufuhr zu gering
- Die individuelle Kalziumaufnahme durch Nahrungsmittel kann mit einem Kalziumrechner des IQWiG ermittelt werden.
- Angaben zum Kalziumgehalt von Nahrungsmitteln finden sich ebenfalls über eine Website des IQWiG.
- keine isolierte Zufuhr von Vitamin D3 ohne tägliche Aufnahme von 1.000 mg Kalzium27-28
- bei einem hohen Sturz- und/oder Frakturrisiko und/oder einer geringen Sonnenlichtexposition 800 IE Vitamin D3 täglich oral substituieren.
- Rezeptierung von Vitamin-D-Supplementen zulasten der GKV nur möglich bei folgenden Indikationen: manifeste Osteoporose mit Fraktur ohne adäquates Trauma, spezifische Osteoporose-Therapie (z. B. Bisphosphonat bei gleichzeitig ausreichender Kalziumzufuhr, Einnahme von mehr als 7,5 mg Prednisolonäquivalent länger als 6 Monate
- Cave: Ausnahmen für die Empfehlungen zu Kalzium und Vitamin D3 gelten u. a. für den primären Hyperparathyreoidismus, Nierensteine, eine Hyperkalziurie und aktive granulomatöse Erkrankungen.
- Cave: zu hohe Kalzium- oder Vitamin-D-Zufuhr (Gefahr der Nephrokalzinose, Hyperkalzämie) durch gleichzeitige Einnahme von Nahrungsergänzungsmitteln und/oder verschiedener angereicherter Präparate!29
- Bolusgaben bringen keinen Vorteil und sind potenziell sturzfördernd.30
- Kalzium-Supplemente nur wenn Nahrungskalziumzufuhr zu gering
- Für Vitamin B, Folsäure und auch die Einnahme von grünem Tee gibt es keine eindeutigen Nachweise der Wirksamkeit.2
Überprüfung des Nutzen-Risiko-Verhältnisses frakturbegünstigender Medikamente
- Regelmäßige Überprüfung des Verhältnisses von Nutzen und Risiken bei folgenden Substanzen:17
- orale und inhalative Glukokortikoide
- Glitazone
- Antiepileptika
- Antidepressiva
- Neuroleptika
- Orthostase auslösende Medikamente
- Protonenpumpeninhibitoren (vor allem bei Langzeiteinnahme)
- Opioide
- sedierende Medikamente
- bei L-Thyroxin-Einnahme: TSH > 0,3 mU/l (Ausnahmen beim differenzierten Schilddrüsen-Ca).
DVO-Empfehlungen zur Basistherapie2
- Die Umsetzung der generellen Maßnahmen zur Prophylaxe von Frakturen soll bei allen Risikogruppen erfolgen.
- Beeinflussbare Risikofaktoren sollen nach Möglichkeit minimiert werden.
- Weitere begleitende Maßnahmen zur Krankheitsbewältigung sollten empfohlen werden (z. B. Selbsthilfegruppen).
- Die Versorgung mit einer ausreichenden Menge an Kalzium und Vitamin D soll sichergestellt werden.
- Bei Patient*innen ohne eine spezifische medikamentöse Therapie soll
die Ernährung 1.000 mg Kalzium enthalten.- Supplemente sollten eingenommen werden, wenn diese Menge nicht sicher erreicht werden kann.
Indikationsstellung zur spezifischen medikamentösen Therapie
Generelle Indikation
- Eine generelle Indikation besteht bei:
- osteoporotischen Wirbelkörper- oder Femurfrakturen
- längerdauernder hochdosierter Kortikoidtherapie (≥ 7,5 mg Prednisolonäquivalent) in Kombination mit erniedrigtem T-Score oder niedrigtraumatischen Frakturen
- Bei typischen klinischen und radiologischen Aspekten einer osteoporotischen Wirbelkörper-Fraktur oder Femurfraktur kann eine Therapie auch ohne vorgängige DXA eingeleitet werden.2,17
Indikation nach Risikoprofil
- Ansonsten ergibt sich die Indikation aus der individuellen Risikostratifizierung mit einem resultierenden 10-Jahres-Frakturrisiko > 30 %.
- Zur Risikostratifizierung gemäß DVO-Leitlinien kann folgende Tabelle verwendet werden:2,17
- Primär erfolgt die Einschätzung des Risikos dabei mit den Parametern Alter, Geschlecht und T-Wert aus DXA-Messung (T-Werte aus anderen Bildgebungsverfahren können nicht verwendet werden).
- Modifiziert wird die sich ergebende Empfehlung für oder gegen medikamentöse Therapie durch das evtl. Vorliegen weiterer Risikofaktoren.
DVO-Empfehlungen zur Indikationsstellung für eine spezifische medikamentöse Therapie2,17
Generelle Indikation
- Niedrigtraumatische singuläre WK-Fraktur 2. oder 3. Grades oder multiple WK-Frakturen 1.–3. Grades
- Niedrigtraumatische proximale Femurfraktur
- Glukokortikoidtherapie > 3 Monate mit Prednisolonäquivalent ≥ 7,5 mg, wenn
- T-Score ≤ –1,5 an der LWS oder Femur oder
- Vorliegen von niedrigtraumatischen WK-Frakturen oder ≥ 3 peripheren Frakturen
Indikation nach Risikoprofil
- Eine spezifische medikamentöse Therapie soll ab einem 10-Jahres-Frakturrisiko größer 30 % für Schenkelhalsfraktur und Wirbelkörperfraktur empfohlen werden.
- Siehe Tabelle Indikation zur spezifischen medikamentösen Osteoporosetherapie.
Spezifische medikamentöse Therapie
Behandlungsprinzipien
- Als spezifische medikamentöse Therapieoptionen sind verfügbar:
- antiresorptive Substanzen
- osteoanabole Substanzen.
- Antiresorptive Behandlung in der Regel bei Erstdiagnose19
- Vermeidung eines weiteren Knochensubstanzverlusts, Stabilisierung des noch vorhandenen Knochengewebes
- am häufigsten mit Bisphosphonaten oder dem monoklonalen Antikörper Denosumab
- Kiefernekrosen und atypische Femurfrakturen sind bei diesen Substanzen seltene, aber schwerwiegende Nebenwirkungen.31-33
- Osteoanabole Behandlung bei bereits fortgeschrittenem Strukturverlust, multiplen Frakturen oder Folgefrakturen unter antiresorptiver Therapie19
- Wiederaufbau der Mikroarchitektur, Besserung der Knochenfestigkeit19
- Vorwiegend osteoanabol wirksam ist Teriparatid (rekombinantes humanes, biologisch aktives Fragment des humanen Parathormons).34
- Teriparatid wird s. c. verabreicht, zugelassene Therapiedauer max. 24 Monate mit antiresorptiver Nachbehandlung19
- Eine neuere, dual wirksame Substanz ist Romosozumab34-35 (monoklonaler Sklerostinantikörper).
- laut AkdÄ geringer Zusatznutzen gegenüber Alendronsäure36
Wirkstoffauswahl
- Gemäß DMP Osteoporose sollen für die individuelle Wahl berücksichtigt werden: mögliche Nebenwirkungen, Komorbiditäten, Wirkungsdauer auch nach Absetzen des Präparates, Einnahmemodalität, Patientenpräferenzen und Zulassungsstatus.20
- Bei geschlechterspezifischen Anforderungen an die Therapie entscheiden die Ärzt*innen bei Menschen mit unbestimmtem/diversem Geschlecht individuell nach pflichtgemäßem Ermessen.20
- Die DVO empfiehlt zur spezifischen Therapie die Verwendung eines Wirkstoffs mit hoher Empfehlungsstärke gemäß Leitlinien.2
- Belegte Wirksamkeit für Frauen haben:
- Alendronat,37 Risedronat, Zoledronat,38-39 Ibandronat (Biphosphonate)
- Denosumab40-41 (monoklonaler Antikörper)
- Teriparatid42 (Parathormonfragment)
- Bazedoxifen, Raloxifen (Selektive Östrogenrezeptor-Modulatoren SERM)
- Östrogene (zur reinen Osteoporosetherapie nur indiziert, wenn andere Präparate nicht vertagen wurden)
- Romosozumab
- Für Männer sind zugelassen (Evidenz zur Wirksamkeit geringer als bei Frauen):2
- Alendronat, Risedronat, Zoledronat
- Denosumab
- Teriparatid.
- Zu Details der Wirkung auf 1. WK-Frakturen, 2. proximale Femurfrakturen, 3. periphere Frakturen mit DVO-Empfehlungsgraden:
Gleichzeitige Glukokortikoid-Therapie
- Bei postmenopausalen Frauen, die mit Glukokortikoiden behandelt werden, sind Alendronat, Risedronat, Teriparatid und Zoledronat zugelassen.17
- Bei Männern, die mit Glukokortikoiden behandelt werden, sind Alendronat, Teriparatid und Zoledronat zugelassen.17
Behandlung bei Prostatakarzinom
- Denosumab ist zugelassen zur Behandlung von Knochenschwund im Zusammenhang mit einer Hormonablation bei Männern mit einem Prostatakarzinom mit erhöhtem Frakturrisiko.17
Kombinationstherapie im Klimakterium
- Eine niedrig dosierte Hormontherapie mit einem spezifischen Osteoporose-Präparat kann bei Frauen mit klimakterischen Beschwerden und dem gleichzeitigen Vorliegen einer Osteoporose kombiniert werden.
- Ansonsten ist bei systemischer Hormonersatztherapie keine zusätzliche Gabe anderer spezifischer Osteoporose-Therapeutika erforderlich.17
Einschätzung für den hausärztlichen Bereich
- Das günstigste Nutzen-Risiko-Kosten-Verhältnis weist Alendronat (70 mg 1 x/Woche) auf: breiter Effektivitätsnachweis, vorliegende Langzeitstudien, geringe Kosten, nachhalte Wirkung auch nach Absetzen.
- Für Männer ist formal nur die 10-mg-Dosierung (tägliche Gabe erforderlich) zugelassen, aber teurer und schwieriger umzusetzen als die einmal wöchentliche Gabe.
Kontraindikationen
- Folgende Kontraindikationen sind bei den verschiedenen Substanzgruppen zu berücksichtigen:19
- Biphosphonate: Hypokalzämie, Niereninsuffizienz. Orale Präparate: Erkrankungen des Ösophagus, gastrointestinale Erkrankungen (Ulzera)
- Denusomab: Hypokalzämie
- Teriparatid (Parathormonfragment): Hyperkalzämie, Niereninsuffizienz, metabolische Knochenerkrankungen, AP-Erhöhung, eingeschränkte Leberfunktion, Strahlentherapie in der Anamnese, Urolithiasis, Knochentumoren
- Bazedoxifen, Raloxifen (Selektive Estrogenrezeptor-Modulatoren SERM): gebärfähiges Alter, thromboembolische Ereignisse, eingeschränkte Leberfunktion, Niereninsuffizienz, ungeklärte vaginale Blutungen
- Östrogene: V. a. Uterus-/Mammakarzinom, Lebererkrankungen, Thrombosen/thromboembolische Ereignisse, Ikterus, ungeklärte vaginale Blutungen, Sichelzellanämie, Otosklerose, Angina pectoris, Myokardinfarkt
- Romosozumab: Hypokalzämie, vorausgegangener Myokardinfarkt oder Schlaganfall43-44
Wirkstoffe und ihre Dosierung
- Die Angaben beziehen sich auf die im DMP Osteoporose angegebenen Wirkstoffe20 (entnommen entsprechenden Fachinformationen, bei Verordnung eines spezifischen Präparates sollte die jeweilige spezifische Fachinfo für Detailinformationen beachtet werden).
Biphosphonate
- Alendronat (postmenopausale Frauen und Männer)
- Dosierung: 70 mg p. o./1 x wöchentlich (Männer 10 mg p. o./1 x tgl.)
- Besonderheiten
- Einnahme morgens nach dem ersten Aufstehen mit einem ganzen Glas Wasser (mindestens 200 ml)
- kein Zerkauen/Zerdrücken der Tablette, kein Auflösenlassen im Mund (Gefahr von Ulzerationen)
- Mindestens 30 min lang nach Einnahme nicht hinlegen.
- Nahrungsaufnahme frühestens 30 min nach Einnahme
- Risedronat (postmenopausale Frauen und Männer)
- Dosierung: 35 mg p. o./1 x wöchentlich
- Besonderheiten
- Einnahme am Morgen sofort nach dem Frühstück (bei Einnahme auf nüchternen Magen erhöhtes Risiko von Schmerzen im Oberbauch)
- kein Lutschen oder Zerkauen der Tablette
- Einnahme in aufrechter Körperhaltung mit einem Glas gewöhnlichem Trinkwasser
- Mindestens 30 min lang nach der Einnahme nicht hinlegen.
- Zoledronat (postmenopausale Frauen und Männer)
- Dosierung 5 mg i. v./1 x jährlich
- Besonderheiten
- gute Hydrierung vor Gabe von Zoledronat
- Ibandronat (postmenopausale Frauen)
- Dosierung: 150 mg p. o./1 x monatlich (alternativ 3 mg i. v. alle 3 Monate)
- Besonderheiten
- p. o. Einnahme nach einer nächtlichen Nüchternperiode (von mindestens 6 Stunden) und 1 Stunde vor der ersten Nahrungs- oder Flüssigkeitsaufnahme (außer Wasser) des Tages sowie vor der oralen Anwendung irgendeines anderen Arzneimittels oder einer Ergänzungstherapie (einschließlich Kalzium)
Denosumab (postmenopausale Frauen und Männer)
- Dosierung: 60 mg s. c. alle 6 Monate
- Besonderheiten: Patient*innen sollten die Packungsbeilage und die Erinnerungskarte ausgehändigt bekommen.
Raloxifen (postmenopausale Frauen)
- Dosierung: 60 mg p. o./1 x tgl.
- Besonderheiten: Die Tablette kann zu jeder Tageszeit unabhängig von den Mahlzeiten eingenommen werden.
Teriparatid (postmenopausale Frauen und Männer)
- Dosierung: 20 Mikrogramm s. c./1 x tgl.
- Besonderheiten: maximale Therapiedauer 24 Monate (keine Wiederholung im Lauf des Lebens)
Romosozumab
- 210 mg, verabreicht als 2 s. c. Injektionen 1-mal monatlich für 12 Monate43-44
Therapiedauer und -wirkung
- Eine spezifische Therapie soll in der Regel mindestens 3 Jahre andauern.20
- Kann abhängig vom individuellen Frakturrisiko lebenslang notwendig sein.20
- Als allgemeiner Grundsatz gilt, eine spezifische Therapie nach 3–5 Jahren auf Nutzen-Risiko neu zu evaluieren.17
- Biphosphonate weisen eine über das Therapieende hinaus noch länger anhaltender Wirkung auf (akkumulieren im Knochen), dies gilt insbesondere für Alendronat und Zolendronat.2
- Bei anderen Therapeutika kann der Behandlungserfolg nach Therapieende rasch wieder verloren gehen.2
- Bei länger als 1 Jahr dauernder Behandlung mit Denosumab kommt es zu einem Reboundeffekt mit Wiederabfall der Knochenmasse.34
- Eine Denosumab-Therapie sollte daher mit einer mindestens 6-monatigen Biphosphonatgabe abgeschlossen werden.2
- Nach einer (auf max. 24 Monate begrenzten) Behandlung mit Teriparatid sollte eine antiresorptive Behandlung angeschlossen werden, um den Knochenmassezuwachs zu erhalten.2
- Bei länger als 1 Jahr dauernder Behandlung mit Denosumab kommt es zu einem Reboundeffekt mit Wiederabfall der Knochenmasse.34
Adhärenz
- Probleme mit der Therapieadhärenz sind insbesondere bei oral durchgeführter Behandlung bekannt.34
- Bereits nach 1 Jahr nehmen nur noch ca. 60 % der Patient*innen die Therapie wie verordnet ein.5
- Eine gute Aufklärung ist daher wichtig, da erfahrungsgemäß viele Patient*innen die Erkrankung Osteoporose zunächst nicht richtig verstehen.5
- Auch akute (z. B. gastrointestinale) Nebenwirkungen können zum Therapieabbruch führen.34
- Eine Verbesserung der Adhärenz kann auch durch die i. v. Gabe von Biphosphonaten oder die s. c. Gabe von Denosumab erzielt werden.5
DVO-Empfehlungen zur spezifischen medikamentösen Therapie
Substanzwahl
- Für die spezifische Therapie soll ein Präparat mit hoher Empfehlungsstärke verwendet werden.
- Für die individuelle Auswahl der Medikamente sollen die möglichen Neben- und Zusatzwirkungen, Kontraindikationen, die Kosten und die Einnahmemodalitäten berücksichtigt werden.
- Vor allem bei einer Anwendung von parenteralen Antiresorptiva soll vor einer Anwendung eine tägliche Gesamtzufuhr von mindestens 1.000 mg Kalzium und eine ausreichende Versorgung mit Vitamin D3 (800–1.000 IE), ggf. durch eine adäquate Vortherapie mit Kalzium und Vitamin D, sichergestellt werden.
- Östrogene/Gestagene sollen nur bei Unverträglichkeit oder Kontraindikationen gegenüber den anderen o. g. Osteoporose-Therapeutika unter sorgfältiger individueller Abwägung von Nutzen und Risiken gemeinsam mit der Patientin im Rahmen der Sekundärprävention eingesetzt werden.
- Eine niedrig dosierte Hormontherapie mit einem spezifischen Osteoporose-Präparat kann bei Frauen mit klimakterischen Beschwerden und dem gleichzeitigen Vorliegen einer Osteoporose kombiniert werden.
- Effektivere Frakturreduktion durch Teriparatid gegenüber oralen Bisphosphonaten in Bezug auf WK-Frakturen auch bei einer Vortherapie mit Bisphosphonaten
- Vor Beginn einer Therapie mit Bisphosphonaten und Denosumab sollte bei Patient*innen mit begleitenden Risikofaktoren eine zahnärztliche Untersuchung mit präventiver Zahnbehandlung durchgeführt werden. Der Therapiebeginn muss dabei nicht aufgeschoben werden. Unter der Therapie sind regelmäßige zahnärztliche Kontrollen empfohlen.
Therapiedauer
- Eine spezifische Osteoporose-Therapie soll nach jeweils 3–5 Jahren Therapiedauer hinsichtlich Nutzen und Risiko reevaluiert werden.
- Die Therapie mit Bisphosphonaten hat einen nachgewiesenen Nutzen für 3–5 Jahre.
- Denosumab hat einen nachgewiesenen Nutzen bis zu 3 Jahren. Nach dem Absetzen müssen aber andere Maßnahmen zum Erhalt der Knochendichte eingesetzt werden.
- Für eine Therapie mit Raloxifen besteht ein nachgewiesener Nutzen bis zu 8 Jahren.
- Die Therapie mit Teriparatid ist auf 24 Monate begrenzt.
- Romosozumab ist für eine 12-monatige Behandlung zugelassen. In der Regel sollte dann eine Weiterbehandlung mit resorptionshemmenden Präparaten erfolgen.44
Ergänzende Therapien
Physiotherapie
- Physiotherapeutische Behandlung dient sowohl der Vorbeugung als auch der Behandlung von Frakturen bei Osteoporose.46-49
- Neben Frakturnachbehandlung und Schmerzmanagement soll Physiotherapie heutzutage bereits präventiv die Hauptursachen von Frakturen verhindern: Sturz und Abbau der neuromuskulären Kapazität.50
- Physiotherapeutische Maßnahmen setzen in der Prävention an 3 Schlüsselpunkten an:50
- Erhalt bzw. Aufbau von Knochenmasse und -festigkeit
- Sturzprävention
- Verminderung von Sturzangst und damit Erhalt der physischen Aktivitäten.
- Gute Kommunikation und Zusammenarbeit zwischen Physiotherapeut*innen und Ärzt*innen ist Voraussetzung für den Behandlungserfolg.51-52
Medikamentöse Schmerztherapie
- Grundsätzlich kann die analgetische Therapie an das Stufenschema der WHO angelehnt werden.53
- Allerdings erfordern Kontraindikationen und Nebenwirkungen nicht selten ein Abweichen vom WHO-Schema.2
DVO-Empfehlungen zur Physiotherapie und Schmerztherapie2
- Um eine schmerzarme Mobilisation zu ermöglichen, sollte insbesondere bei akuten Frakturen die Versorgung mit einer wirbelsäulenaufrichtenden Orthese erwogen werden.
- Die Orthesen sollten mit physiotherapeutischen Übungsprogrammen und Haltungsschulungen zur Anwendung kommen.
- Elektrische Feldtherapie und Elektrotherapie, wie Interferenzstrom und horizontale Therapie mit und ohne Übungsprogramm, sind möglicherweise geeignet, Schmerz bei multiplen Wirbelkörperfrakturen zu reduzieren und eine Funktionsverbesserung zu ermöglichen.
- Durch Physiotherapeut*innen supervidierte Übungsprogramme mit und ohne Informationsangebot sind in der Lage, Schmerzen zu reduzieren und Lebensqualität zu verbessern.
- Sind trotz der Anwendung von ambulanten mono- oder bereits multimodalen konservativen Behandlungsmöglichkeiten Schmerzen und Funktionsbeeinträchtigungen nicht beherrschbar, kann eine stationäre Behandlung, die dann multimodalen Charakter aufweist, auch unter der Berücksichtigung z. B.von Sturzangst erforderlich werden.
- NSAR, Paracetamol, Metamizol und Opiate sind zur Behandlung von Frakturschmerzen wirksam.
- Vom WHO-Stufenschema muss in vielen Fällen wegen Kontraindikationen oder nicht tolerabler Nebenwirkungen abgewichen werden. Da meist ältere Menschen behandelt werden, sind die Regeln der „Schmerztherapie beim älteren Menschen“ anzuwenden mit Berücksichtigung von Komorbiditäten, Nebenwirkungen und Komedikationen.
DMP (Disease Management Programm)
- 2020 wurde ein neues DMP Osteoporose aufgelegt.20,54
- Eingeschrieben werden können Patientinnen ab dem vollendeten 50. Lebensjahr und Patienten ab dem vollendeten 60. Lebensjahr (Menschen mit unbestimmtem oder diversem Geschlecht ab dem vollendeten 50. LJ) mit gesicherter Diagnose einer medikamentös behandlungsbedürftigen Osteoporose.
- Inhalte des DMP sind u. a.:54
- spezifische medikamentöse Therapie für Frauen und Männer
- Schulungen für Patient*innen
- Ermittlung des Sturzrisikos
- Angebot von Funktionstraining oder Rehasport.
- Das DMP Osteoporose ist bislang noch nicht in der Regelversorgung der Bundesländer implementiert (Stand Dezember 2022).
Verlauf, Komplikationen und Prognose
Komplikationen
- Frakturen
- Beeinträchtigung der Lebensqualität
- Immobilisierung
- Invalidisierung
- Nebenwirkungen der spezifischen medikamentösen Therapie
Verlauf und Prognose
- Bei der Mehrzahl der Patient*innen mit Osteoporose besteht eine chronische Erkrankung mit einem dauerhaft erhöhten Frakturrisiko.2
- Im Einzelfall kann ein erhöhtes Frakturrisiko nach dem Wegfall des Risikofaktors innerhalb von 1–2 Jahren reversibel sein.2
- z. B. Beendigung des Rauchens, Beendigung einer Therapie mit Antiepileptika, Beendigung einer oralen Glukokortikoid-Therapie, Beendigung einer Aromatasehemmer-Therapie, u. a.
- Eine Basistherapie sollte so lange erfolgen, wie ein erhöhtes Frakturrisiko besteht.14
- Spezifische Medikamente können das osteoporosespezifische Frakturrisiko im Mittel um ca. 50 %, bei schwerer Osteoporose auch bis zu 80 % senken. Das Risiko für alle klinischen Frakturen wird um mindestens 1/3 gesenkt.14
Verlaufskontrolle
- Ohne medikamentöse Therapie: Intervalle in Abhängigkeit bestehender bzw. neu aufgetretener Beschwerden, vorhandener Risiken, Komorbiditäten sowie dem Ergebnis der früheren Untersuchung/en17
- Unter medikamentöser Therapie: 3- bis 6-monatliche Überprüfung von Verträglichkeit und Adhärenz, regelmäßige Überprüfung von Kontraindikationen, regelmäßige zahnärztliche Kontrollen unter Bisphosphonaten und Denosumab17
- Im Rahmen des DMP Osteoporose sollten die Verlaufskontrollen folgendes beinhalten (Checkliste Verlaufskontrolle):20
- Sturzanamnese
- Erfassung von Frakturen oder klinischen Hinweisen auf Frakturen
- Abschätzung, ob die Kalzium- und Vitamin D-Zufuhr ausreichend ist.
- Motivation zu adäquatem, regelmäßigem körperlichem Training und dessen Verstetigung sowie zur Fortführung der erlernten Lebensstilinterventionen
- bei postmenopausalen Frauen: Frage nach einer Hormonersatztherapie
- Berücksichtigung weiterer eingenommener Medikamente, die das Frakturrisiko erhöhen und, falls erforderlich, die Einleitung der Überprüfung der Indikation.
- Prüfung der osteoporosespezifischen Medikation
- Überprüfung von Kontraindikationen (z. B. neu aufgetretene Niereninsuffizienz)
- Überprüfung der Adhärenz
- Einhaltung der empfohlenen Einnahmemodalitäten (insbesondere bei Bisphosphonaten)
- Erfassung von Nebenwirkungen
- Abwägung der Fortführung der osteoporosespezifischen Therapie in Abhängigkeit von Nutzen, Nebenwirkungen und Risiken
- DXA-Verlaufskontrolle zum Zweck der Optimierung der Therapieentscheidung frühestens nach 5 Jahren, wenn nicht aufgrund besonderer therapierelevanter anamnestischer und klinischer Befunde früher geboten20
DVO-Empfehlungen zu Verlaufskontrollen2
Klinische Kontrollen
- Klinische Kontrollen sollten nach Einleitung einer spezifischen Therapie zunächst alle 3–6 Monate erfolgen.
- Sie sollten auf die Verträglichkeit und zwischenzeitlich eingetretene Ereignisse, auch Frakturen fokussiert sein.
- Bei Änderung äußerer Umstände oder bei Hinweisen auf neue Frakturen sollten zusätzliche Kontrolluntersuchungen durchgeführt werden.
- Hat sich eine Änderung der Therapie ergeben (z. B. Therapieabbruch wegen äußerer Umstände (z. B. tatsächliche oder vermeintliche Nebenwirkungen) soll eine Reevaluation des Frakturrisikos durchgeführt werden.
- Für die individuelle Entscheidung bezüglich einer Langzeittherapie der Osteoporose sollen Nutzen und Risiko der eingesetzten Substanz, die Höhe des Frakturrisikos, der Therapieverlauf sowie die eingesetzte Substanz in die Überlegungen einbezogen werden.
- Eine spezifische Osteoporose-Therapie soll nach jeweils 3–5 Jahren Therapiedauer hinsichtlich Nutzen und Risiko reevaluiert werden.
Wiederholung Knochendichtemessung
- Die Häufigkeit der Wiederholung von Knochendichtemessungen sollte sich ohne spezifische Therapie an der Ausgangsknochendichte orientieren, insbesondere an der Wahrscheinlichkeit, innerhalb des Messintervalls die Interventionsschwelle bezüglich einer spezifischen Therapie zu überschreiten.
- Bei einer laufenden spezifischen Therapie ist der Nutzen von Kontrollmessungen der Knochendichte nicht belegt und kann allenfalls als Instrument zur Verbesserung der Compliance und Adhärenz hilfreich sein.
Patienteninformationen
Patienteninformationen in Deximed
Weitere Informationen
- Gesundheitsinformation.de: Osteoporose
Patientenorganisationen
Illustrationen

Osteoporose der LWS: verminderte Knochendichte und Deckplatteneinbrüche der Wirbelkörper

Prädilektionsstellen osteoporotischer Frakturen
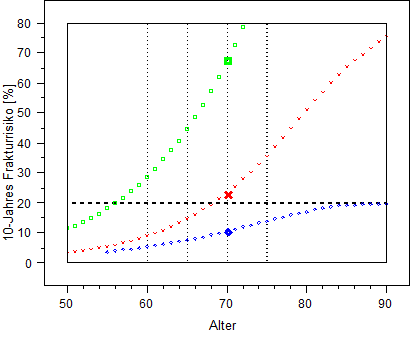
Risiko osteoporosetypischer Frakturen in den nächsten 10 Jahren bei Männern (blau) und Frauen (rot) im Bevölkerungsdurchschnitt sowie bei Frauen mit bereits eingetretener Wirbelkörperfraktur (grün). Raten über 50 % stellen Extrapolationen dar und überschätzen wahrscheinlich das Risiko (Quelle: Dachverband der deutschsprachigen wissenschaftlichen Gesellschaften Osteologie (DVO). Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern).
Quellen
Leitlinien
- Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (DVO). Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern. Stand 2017. www.dv-osteologie.org
- Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (DVO). Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern. Stand 2017. Kitteltaschenversion
- Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (DVO). Physiotherapie und Bewegungstherapie bei Osteoporose. Stand 2008. www-dvo-osteologie.org
Literatur
- Lohnstein M, Eras J, Hammerbacher C. Der Prüfungsguide Allgemeinmedizin - Aktualisierte und erweiterte 3. Auflage. Augsburg: Wißner-Verlag, 2018.
- Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (DVO). Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern. DVO-Leitlinie Osteoporose 2017. www.dv-osteologie.org
- Kanis J. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report. WHO Study Group. Osteoporos Int 1994; 4: 368-381. doi:10.1007/BF01622200 DOI
- Kanis JA on behalf of the World Health Organization Scientific Group (2007) Assessment of osteoporosis at the primary health-care level. Technical Report. World Health Organization Collaborating Centre for Metabolic Bone Diseases, University of Sheffield, UK. www.sheffield.ac.uk
- Deuß U. Diagnostik und Therapie der Osteoporose unter Berücksichtigung der aktuellen DVO-Leitlinie. CME 2020. www.springermedizin.de
- Heppner H, Gosch M. Prophylaxe, Diagnostik und Therapie der Osteoporose. Orthopädie&Rheuma 2018; 21: 29-32. doi:10.1007/s15002-018-1275-y DOI
- Fuchs J, Scheidt-Nave C, Kuhnert R. 12-Monats-Prävalenz von Osteoporose in Deutschland. Journal of Health Monitoring 2017; 2: 61-65. doi:10.17886/RKI-GBE-2017-055 DOI
- European Prospective Osteoporosis Study (EPOS) Group. Incidence of vertebral fracture in europe: results from the European Prospective Osteoporosis Study (EPOS). J Bone Miner Res. 2002 Apr;17(4):716-24. www.ncbi.nlm.nih.gov
- Robert Koch-Institut (Hrsg) (2015) Gesundheit in Deutschland. Gesundheitsberichterstattung des Bundes. Gemeinsam getragen von RKI und Destatis. RKI, Berlin. www.rki.de
- Lippuner K1, Johansson H, Kanis JA, Rizzoli R. Remaining lifetime and absolute 10- year probabilities of osteoporotic fracture in Swiss men and women. Osteoporos Int. 2009 Jul;20(7):1131-40. doi: 10.1007/s00198-008-0779-8. Epub 2008 Oct 31. www.ncbi.nlm.nih.gov
- Baum E, Peters K. Primäre Osteoporose – leitliniengerechte Diagnostik und Therapie. Dtsch Arztebl 2008; 105: 573–82 DOI: 10.3238/arztebl.2008.0573 www.aerzteblatt.de
- Gosch M, Kammerlander C, Neuerburg C. Osteoporose – Epidemiologie und Versorgungsqualität. Z Gerontol Geriat 2019; 52: 408-413. doi:10.1007/s00391-019-01559-7 DOI
- Thomasius F, Hadji P. Osteoporose – Was muss der Gynäkologe beachten?. Gynäkologische Endokrinologie 2020; 18: 231-239. doi:10.1007/s10304-020-00342-x DOI
- Siggelkow H, Deutsche Gesellschaft für Innere Medizin (DGIM). Osteoporose. eMedpedia, Zugriff 10.05.21 www.springermedizin.de
- Jakob F. Primäre und sekundäre Osteoporose. Internist 2005; 46: S24–S30. doi:10.1007/s00108-005-1417-6 DOI
- Thomasius F, Bühring B. Risikoassessment bei Osteoporose. Internist 2021; 62: 463-473. doi:10.1007/s00108-021-00994-2 DOI
- Dachverband der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften (DVO). Prophylaxe, Diagnostik und Therapie der Osteoporose bei postmenopausalen Frauen und bei Männern. DVO-Leitlinie Osteoporose 2017, Kitteltaschenversion. dv-osteologie.org
- Kanis JA, et al. FRAX™ and the assessment of fracture probability in men and women from the UK. Osteoporos Int. 2008 Apr; 19(4): 385–397. Published online 2008 Feb 22. doi: 10.1007/s00198-007-0543-5. www.ncbi.nlm.nih.gov
- Schilling S, Waizenhöfer A, Lehmann W. Diagnostik und Therapie der Osteoporose in der Orthopädie. Orthopädie&Rheuma 2016; 19: 27-31. doi:10.1007/s15002-016-0909-1 DOI
- Beschluss des Gemeinsamen Bundesausschusses über die 20. Änderung der DMP-Anforderungen-Richtlinie (DMP-A-RL): Änderung der Anlage 2, Ergänzung der Anlage 19 (DMP Osteoporose) und der Anlage 20 (Osteoporose - Dokumentation). Bundesanzeiger 16.01.20. Zugriff 07.05.21. www.bundesanzeiger.de
- Buehring B, Thomas J, Wittkämper T, et al. Evaluation des Trabecular Bone Score (TBS) in der täglichen Praxis bei Patienten mit entzündlich rheumatischen und nichtentzündlichen Erkrankungen. Z Rheumatol 2020; 79: 1067–1074. doi:10.1007/s00393-020-00764-9 DOI
- Teutsch B. DMP Osteoporose: Hausärzte sollen Unterversorgung abbauen. Der Hausarzt digital, 20.02.2020. Zugriff 07.05.2021. www.hausarzt.digital
- Santesso N, Carrasco-Labra A, Brignardello-Petersen R. Hip protectors for preventing hip fractures in older people. Cochrane Database Syst Rev 2014; 3: CD001255. doi:10.1002/14651858.CD001255.pub5 DOI
- Koike T, Orito Y, Toyoda H, et al. External hip protectors are effective for the elderly with higher-than-average risk factors for hip fractures. Osteoporosis Int 2009; 20: 1613.20. pmid:19137351 PubMed
- Kiel DP, et al. Efficacy of a hip protector to prevent hip fracture in nursing home residents: the HIP PRO randomized controlled trial. JAMA 2007; 198: 413–22. www.ncbi.nlm.nih.gov
- Baum E. Verdacht auf Osteoporose. Wann Diagnostik ausweiten, wann behandeln? Der Allgemeinarzt-online. 16.01.2017 www.allgemeinarzt-online.de
- Avenell A, Mak J, O'Connell D.Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men. Cochrane Database Syst Rev. 2014 Apr 14;4:CD000227. pubmed.ncbi.nlm.nih.gov
- Reid I, Bolland M, et al. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. Lancet 2013. doi:10.1016/S0140-6736(13)61647-5.
- Zieschang M. Risiko einer Hyperkalzämie bei unkontrollierter Einnahme von Vitamin D. www.akdae.de
- Bischoff-Ferrari HA, et al. The Effects of Four Doses of Vitamin D Supplements on Falls in Older Adults. JAMA Intern Med 2016; 176: 175-83. www.acpjournals.org
- Sawatari Y, Marx RE. Bisphosphonates and bisphosphonate induced osteonecrosis. Oral Maxillofacial Surg Clin N Am 2007; 19: 487-98. www.ncbi.nlm.nih.gov
- Park-Wyllie LY, Mamdani MM, Juurlink DN, et al. Bisphosphonate use and the risk of subtrochanteric or femoral shaft fractures in older women. JAMA 2011; 305: 783-9. jama.jamanetwork.com
- Schilcher J, Michaëlsson K, Aspenberg P. Bisphosphonate use and atypical fractures of the femoral shaft . N Engl J Med 2011; 364: 1728-37. DOI: 10.1056/NEJMoa1010650 DOI
- Obermayer-Pietsch B, Fössl I, Dimai H. Langfristige Therapiekonzepte bei Osteoporose. Internist 2021; 62: 474-485. doi:10.1007/s00108-021-00993-3 DOI
- McClung MR, Grauer A, Boonen S, et al. Romosozumab in postmenopausal women with low bone mineral density. N Engl J Med 2014. doi:10.1056/NEJMoa1305224 DOI
- Stellungnahme der Arzneimittelkommission der deutschen Ärzteschaft zur frühen Nutzenbewertung gemäß § 35a SGB V Romosozumab (Osteoporose, postmenopausale Frauen) Berlin, den 6. Juli 2020. www.akdae.de
- Wells GA, Cranney A, Peterson J, Boucher M, Shea B, Welch V, Coyle D, Tugwell P. Alendronate for the primary and secondary prevention of osteoporotic fractures in postmenopausal women. Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No.: CD001155. pubmed.ncbi.nlm.nih.gov
- Serrano AJ, Begona L, Anitua E, Cobos R, Orive G. Systematic review and meta-analysis of the efficacy and safety of alendronate and zoledronate for the treatment of postmenopausal osteoporosis. Gynecol Endocrinol. 2013 Dec;29(12):1005-14. PMID: 24063695 PubMed
- Reid DM, Devogelaer J-P, Saag K, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet 2009; 373: 1253-63. PubMed
- Austin M, Yang YC, Vittinghoff E, et al. Relationship between bone mineral density changes with denosumab treatment and risk reduction for vertebral and nonvertebral fractures. J Bone Miner Res. 2012 Mar;27(3):687-93. PMID: 22095631 PubMed
- Brown JP, Roux C, Ho PR, et al. Denosumab significantly increases bone mineral density and reduces bone turnover compared with monthly oral ibandronate and risedronate in postmenopausal women who remained at higher risk for fracture despite previous suboptimal treatment with an oral bisphosphonate.. Osteoporos Int. 2014 Mar 28. pmid:24676847 PubMed
- Tsai JN, Uihlein AV, Lee H, et al. Teriparatide and denosumab, alone or combined, in women with postmenopausal osteoporosis: the DATA study randomised trial. Lancet 2013. doi:doi:10.1016/S0140-6736(13)60856-9 DOI
- Addendum der DVO-Leitlinie Osteoporose 2017. dv-osteologie.org
- AKDAE. Update - neue Arzneimittel. Romosozumab. www.akdae.de
- Black DM, et al. Effects of Continuing or Stopping Alendronate After 5 Years of Treatment. JAMA. 2006;296(24):2927-2938. doi:10.1001/jama.296.24.2927. jamanetwork.com
- Swanenburg J, Mulder T, de Bruin E, et al. Physiotherapeutische Interventionen bei Osteoporose. Z Rheumatol ; 62: 522-526. www.springermedizin.de
- De Kam D, Smulders E, Weerdesteyn V, Smits-Engelsman BC. Exercise interventions to reduce fall-related fractures and their risk factors in individuals with low bone density: a systematic review of randomized controlled trials. Osteoporos Int. 2009 Dec;20(12):2111-25. PMID: 19421702 PubMed
- Sherrington C, Whitney JC, Lord SR, et al. Effective exercise for the prevention of falls: a systematic review and meta-analysis. J Am Geriatr Soc. 2008 Dec;56(12):2234-43. PMID: 19093923. PubMed
- Newman M, Minns Lowe C, Barker K. Spinal Orthoses for Vertebral Osteoporosis and Osteoporotic Vertebral Fracture: A Systematic Review. Arch Phys Med Rehabil 2016; 97: 1013-25. pmid:26615791 PubMed
- Dachverband der deutschsprachigen wissenschaftlichen Gesellschaften Osteologie (DVO). Leitlinie Physiotherapie und Bewegungstherapie bei Osteoporose. dv-osteologie.org
- Preisinger E. Bewegungs- und Physiotherapie bei Osteoporose. rheuma plus 2018; 17: 23-27. doi:10.1007/s12688-017-0149-8 DOI
- Lange U, Müller-Ladner U, Teichmann J. Ambulante Physiotherapie bei Osteoporose. Z Rheumatol 2012; 71: 319-325. doi:10.1007/s00393-012-0964-1 DOI
- Heuchemer L, Emmert D, Bender T, et al. Schmerztherapie bei Osteoporose. Schmerz 2020; 34: 91-104. doi:10.1007/s00482-020-00445-1 DOI
- Kassenärztliche Bundesvereinigung (KBV). Praxisnachrichten: DMP für Osteoporose-Patienten auf den Weg gebracht. Zugriff 14.05.21 www.kbv.de
Autor*innen
- Michael Handke, Prof. Dr. med., Facharzt für Innere Medizin, Kardiologie und Intensivmedizin, Freiburg i. Br.
- Erika Baum, Prof. Dr. med., Professorin für Allgemeinmedizin, Biebertal (Review)
- Die ursprüngliche Version dieses Artikels basiert auf einem entsprechenden Artikel im norwegischen hausärztlichen Online-Handbuch Norsk Elektronisk Legehåndbok (NEL, https://legehandboka.no/).